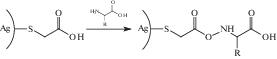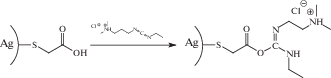Журнал аналитической химии, 2019, T. 74, № 4, стр. 254-278
Химически модифицированные наночастицы золота и серебра в спектрометрическом анализе
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
2 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: olan@petrol.chem.msu.ru
Поступила в редакцию 19.02.2018
После доработки 16.10.2018
Принята к публикации 16.10.2018
Аннотация
Обзор посвящен анализу литературы в области получения, химического модифицирования поверхности наночастиц золота и серебра и их использования в спектрометрических методах химического и биохимического анализа. Путем формирования и последующего изменения химического состава поверхностного слоя наночастиц возможно решение задач группового и индивидуального определения аналитов – ионов металлов, органических и биоорганических соединений. Наличие доступной развитой поверхности, содержащей функциональные группы различной природы, в сочетании с эффектами поверхностного плазмонного резонанса, усиленного и гигантского комбинационного рассеяния открывает широкие перспективы для практического использования наночастиц в химическом и биохимическом анализе.
Металлы в наноразмерном состоянии, в том числе и благородные, обладают ценным, а иногда и уникальным набором свойств, определяющих области их практического использования. Эффекты поверхностного плазмонного резонанса (ППР), приповерхностного усиления флуоресценции, комбинационного рассеяния в сочетании комплексообразованием, специфической сорбцией аналита способствуют созданию новых материалов, сочетающих в себе несколько источников аналитического сигнала различной природы. Материалы такого рода в настоящее время являются одними из наиболее перспективных в химическом анализе, биоаналитической, медицинской химии, клинической диагностике [1–10].
Для реализации анализа с использованием металлических наночастиц применяют многомерные зависимости, получаемые от одного объекта методами оптической спектрометрии, комбинационного рассеяния, флуоресценции, различными электрохимическими и др. Многие характеристики указанных методов, такие как наличие, положение и форма полос в спектрах поглощения, рамановский сдвиг линий комбинационного рассеяния, электрохимические вольт-амперные характеристики и т.п. существенным, а иногда и определяющим образом зависят от химического состава и структуры поверхностного слоя наночастиц. В основе эффектов формирования устойчивых агрегатов наночастиц благородных металлов, сказывающихся на их свойствах (прежде всего, спектральных), могут лежать взаимодействия различной природы: водородные связи [11–13], координация цвиттер-ионных пар [14], комлексообразование [15–17], формирование супрамолекулярных структур с участием функциональных групп химического модификатора поверхности [18–21].
Благодаря стабильности свойств и относительно невысокой стоимости наиболее часто в практике анализа используют коллоиды золота и серебра. Опубликованы единичные работы по использованию платины и палладия, но они не играют значимой роли в данной области. В методиках определения неорганических аналитов чаще используют золи серебра, при анализе органических, а особенно биоорганических объектов – золота.
Специфичность взаимодействия поверхности металлических наночастиц с компонентами окружающей среды, детерминирующая селективность определения аналита, во многом зависит от химического состава сорбционного слоя, а иногда и от конформации молекул, составляющих его. В конденсированной среде не существует “«голой»” поверхности наночастиц, в той или иной степени она уже химически модифицирована непосредственно после формирования. За счет процессов конкурентной сорбции (хемосорбции) могут происходить изменения в этом слое, сказывающиеся на специфике взаимодействий.
Основная цель данного обзора – описание и критический анализ методов химического модифицирования поверхности наночастиц золота и серебра, трансформации поверхностного слоя, а также практического использования модифицированных наночастиц для качественного и количественного определения неорганических, органических и биоорганических соединений.
МЕТОДЫ ХИМИЧЕСКОГО МОДИФИЦИРОВАНИЯ ПОВЕРХНОСТИ НАНОЧАСТИЦ ЗОЛОТА И СЕРЕБРА
Процесс формирования новой фазы описывает теория критического зародыша [22]. При движении системы к устойчивому состоянию свободная энергия проходит через максимум, соответствующий размеру критического зародыша. В докритической области размеров зародыши неустойчивы и распадаются. По оценкам, приведенным в работе [23], размер критических зародышей серебра составляет ~0.6 нм, что соответствует металлическому кластеру, состоящему из 6–10 атомов. В ходе химического восстановления исходных соединений золота и серебра этот размер достигается довольно быстро. Все наночастицы золей, описываемых авторами, имеют размер больше критического.
С термодинамической точки зрения из-за наличия нескомпенсированных связей поверхностных атомов коллоидная система в области нанометровых размеров обладает избыточной энергией и неустойчива. Для устранения влияния этого фактора в состав системы вводят специальный компонент – стабилизатор. Его роль сводится к взаимодействию с поверхностными атомами, за счет энтальпии которого происходит общее снижение энергии. Такого рода процесс называют по разному – стабилизация, химическое модифицирование, функционализация поверхности. По существу, это одно и то же явление. Тем не менее, при получении наночастиц этот компонент реакционной смеси чаще всего называют стабилизатором, а при дальнейших манипуляциях с ранее синтезированным коллоидом – химическим модификатором поверхности. Одно и то же соединение в разных работах может выполнять роль как стабилизатора, так и химического модификатора поверхности наночастиц и иметь соответствующее название.
В большинстве аналитических методик коллоид, содержащий наночастицы золота или серебра, предварительно получают, а затем либо используют без модифицирования, либо химически модифицируют поверхность наночастиц. Иногда операцию модифицирования (функционализации) поверхности необходимо проводить непосредственно в момент получения коллоида, в ряде случаев ее осуществление возможно через последовательные превращения.
Как правило, источником наночастиц золота и серебра являются их соединения, ионы металлов которых вступают в окислительно-восстановительные реакции в ходе получения золей [24]. Наиболее распространенной в настоящее время является жидкофазная реакция в водной среде. В качестве восстановителей, как правило, используют боргидрид [25–32] или цитрат натрия [18, 33–41]. Для получения коллоидов серебра чаще применяют боргидрид, а золота – цитрат натрия. Средний размер частиц в сопоставимых условиях в случае боргидридного восстановления обычно ниже по сравнению с применением цитрата независимо от природы металла.
Даже формально химически не модифицированные частицы содержат в сорбционном слое компоненты окружающей среды: восстановитель или продукты его окисления, ионы электролитов, вводимые в состав исходной реакционной смеси стабилизаторы, такие как поверхностно активные вещества или полимеры (в том числе и биополимеры). Ниже для упрощения схем модифицирования поверхности исходные наночастицы благородных металлов будем изображать без стабилизатора, если его природа в момент синтеза непринципиальна.
Рассматривая химически модифицированные наночастицы золота и серебра как систему ядро–оболочка, отдельной группой следует признать индивидуальные соединения размером порядка 1–2 нм, содержащие десятки атомов металла и почти эквивалентное им количество достаточно сильных комплексообразователей, таких как фосфины или тиолы [42–50]. Так, описаны стехиометрические кластерные металлорганические соединения, такие как [Ag8(DPPE)4(SC6H3F2)14]6–, Ag16(DPPE)4(SC6H3F2)14, [Ag32(DPPE)5(SC6H4CF3)24] (где DPPE = Ph2P(CH2)2PPh2) [45], Au11(PPh3)7Cl3 [46], Au11(PPh3)7(SCN)3 [47], Au38(SC2Ph)24 [48], Au55(PPh3)12Cl6 [49], Au101(PPh3)21Cl5 [50]. В них отсутствуют некомпенсированные связи поверхностных атомов металла, да и металлической поверхности как таковой не существует. Попытка разрушения лигандной оболочки в большинстве случаев приводит к необратимому распаду металлического кластера. Тем не менее, если под действием того или иного аналита такие соединения способны изменять свои свойства, например спектральные, то они могут быть с успехом использованы для целей химического анализа. Пока в литературе такие примеры отсутствуют.
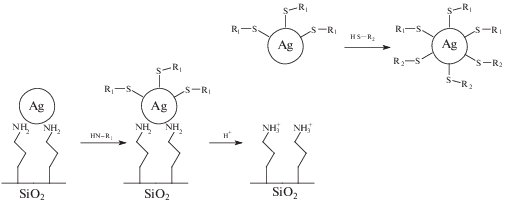
Методы химического модифицирования поверхности неорганических соединений [51] можно применять для золей наночастиц золота и серебра, но с учетом специфики реакционных центров. Молекула модификатора должна содержать три фрагмента: “якорь”, “линкер” (ножку) и “целевую функциональную группу”. Роль первого сводится к прочному фиксированию на поверхности, второго – к обеспечению подвижности и лишь только третьего – к приданию специфических свойств, используемых в том числе и для решения задач химического анализа. В качестве якорных используют функциональные группы, имеющие высокое сродство к металлам, такие как –SH, –S–S, –NH2, –C(O)SH, –C(S)SH и т.п. В качестве линкера в большинстве случаев выступает углеводородная цепочка как без заместителей, так и содержащая промежуточные функциональные группы и/или гетероатомные фрагменты. В качестве целевой может выступать практически любая функциональная группа, обеспечивающая необходимые свойства коллоида. Именно эти группы способны формировать новые системы, такие как комплексы с аналитами, супрамолекулярные структуры наночастиц, используемых в том числе и в аналитической химии.
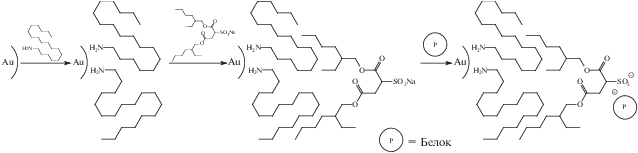
Авторы работы [52] рассматривают получение химически модифицированных наночастиц золота как конкуренцию процессов формирования металлического ядра и взаимодействия поверхностных атомов с сероорганическим веществом, имеющим к ним высокое сродство. Первый процесс сопровождается ростом размера частиц, второй, который авторы называют “пассивацией поверхности”, – прекращением роста (схема 1 ).
Схема 1 .
В случае снижения энергии системы за счет формирования связей Au–Au доминирует первый тип реакций, при бóльшем выигрыше в энергии за счет хемосорбции модификатора – второй. При малых степенях заполнения поверхности бóльшая часть поверхностных атомов обладает нескомпенсированной избыточной энергией и способна к химическому взаимодействию. В случае высоких значений плотности прививки модификатора возможно его вытеснение с поверхности соединениями, имеющими бóльшее сродство к ней. Это приводит к пассивации поверхности, повышению устойчивости коллоида. Такого рода механизм достаточно универсален. Так, в работе [53] описаны золи золота, поверхностно модифицированные меркаптоянтарной кислотой. По отношению к исходным (немодифицированным) золям они обладают повышенной устойчивостью к коагуляции под действием соляной кислоты и к деструкции металлического ядра в присутствии ионов цианида и молекулярного кислорода.
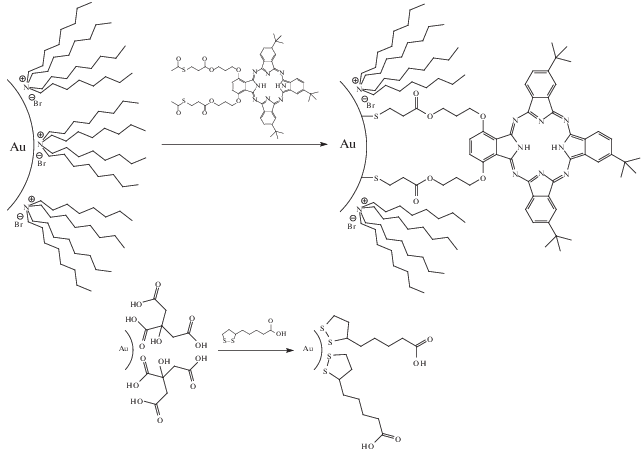
Довольно часто при получении золей благородных металлов в качестве стабилизаторов применяют поверхностно-активные вещества. Они стабилизируют коллоид в момент синтеза, а в дальнейшем могут быть вытеснены молекулами модификатора. Типичными продуктами химического модифицирования являются золи наночастиц золота, содержащие хемосорбированные порфириновые фрагменты [54] или карбоксильные группы [36], которые затем могут быть использованы для целей химического анализа (схема 2 ).
Схема 2 .
В ряде случаев (схема 3 ) поверхность наночастиц может быть модифицирована повторно за счет введения в систему соединений, более реакционноспособных соединений по отношению к металлической поверхности [36].
Схема 3 .
Иногда (схема 4 ) для практического использования химически модифицированных наночастиц благородных металлов в химическом анализе объектов окружающей среды, например, для определения инсектицидов, возникает необходимость в одновременном использовании двух модификаторов [13].
Схема 4 .
Наличие аналита (триазофоса) в исследуемом образце способствует формированию супрамолекулярных структур с участием функциональных групп меркаптоуксусной и гуанидинуксусной кислот, хемосорбированных на поверхности серебра.
При использовании двух модификаторов (схема 5 ) за счет их упорядочивания на поверхности наночастиц могут быть получены наночастицы-янусы [55].
Схема 5 .
Подобные объекты перспективны для практического использования за счет пространственно обусловленного взаимодействия с аналитом.
Реакционная способность внешних (целевых) функциональных групп молекул стабилизатора может быть использована для дальнейшего химического модифицирования поверхности наночастиц благородных металлов. Например, наночастицы золота или серебра, поверхностно модифицированные меркаптоуксусной кислотой,
в дальнейшем могут быть введены в химические реакции с аминокислотами, белками [56]:
практически важными гликопептидами, такими как ванкомицин (NVan) [57]:
с карбодиимидами [58]:
а также с карбодиимидами в сочетании с аминами [59]
Химические трансформации функциональных групп люминола в сочетании с его способностью к хемилюминесценции лежат в основе определения ионов Cu2+ и Co2+ с использованием химически модифицированных наночастиц золота [60]. Гидразидные фрагменты люминола, содержащиеся в приповерхностном слое наночастиц золота (1), способны к гидролизу, а получаемые при этом карбоксилы – к координации ионов металлов. Последующая обработка золей, содержащих поверхностные металлокомплексы (2), пероксидом водорода вызывает хемилюминесценцию остаточного люминола (сxема 6), причем медьсодержащий продукт имеет две полосы излучения.
Схема 6 .
Совместная обработка золя (1) цистеином и соединениями кобальта приводит к частичному вытеснению люминола цистеином с последующим формированием поверхностных комплексов Co2+. Добавление к золю (3) пероксида водорода также вызывает хемилюминесценцию люминола, содержащегося на поверхности наночастиц.
Для решения практических задач, связанных с хемилюминесценцией живых объектов, получены биосовместимые золотые наночастицы, содержащие комплекс рутения с бипиридилом. Для этого исходный золь золота обрабатывали тиолированными олигомерами этиленгликоля, а затем предварительно синтезированным тиолсодержащим комплексом рутения в соответствии со схемой 7 [61].
Схема 7 .
В качестве модификаторов поверхности использовали глутатион [62], фосфолипиды [31], хитозан [26, 63, 64], NADH [65], олигопептиды [66], олигонуклеотиды и аптамеры [67–69], ДНК [70]. Во многих случаях методы химического модифицирования поверхности наночастиц высокомолекулярными веществами, в том числе и природными, принципиально не отличаются: молекулы вещества хемосорбируются за счет функциональных групп, имеющих высокое сродство к металлу. Особенность полимеров – взаимодействие по нескольким центрам одновременно. Кроме того, для биополимеров в ряде случаев критическим является значение рН реакционной среды.
ВТОРИЧНЫЕ ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В СОРБЦИОННОМ СЛОЕ ХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ НАНОЧАСТИЦ ЗОЛОТА И СЕРЕБРА
Химический состав сорбционного слоя наночастиц может изменяться за счет происходящих в нем вторичных процессов. Параметры внешней среды, например рН, в которой диспергированы химически модифицированные наночастицы, могут оказывать влияние на химическое состояние молекул в самоорганизованном сорбционном слое. В работе [71] с использованием методов краевых углов смачивания и рентгеновской фотоэлектронной спектроскопии исследовано состояние цистеина, хемосорбированного на поверхности золота. Химическое модифицирование золота цистеином авторы проводили в буферных растворах при фиксированном значении рН в интервале от 6 до 14. Установлено, что хемосорбированные на золотой подложке молекулы цистеина могут находиться в двух формах: нейтральной и цвиттер-ионной. При использовании химически модифицированных наночастиц благородных металлов для сорбции катионов и анионов из водных объектов форму нахождения функциональных групп модификатора необходимо учитывать.
При химическом модифицировании поверхности наночастиц золота производными меркаптопропионовой кислоты (схема 8 ) между внешними функциональными группами образуются водородные связи [12].
Схема 8 .
В ряде случаев (например, в случае цистеина) кроме водородных связей возможны обратимые реакции конденсации (схема 9 ), приводящие к образованию оснований Шиффа [12].
Схема 9 .
Под действием факторов внешней среды возможно окисление спиртовой группы цитрата, сопряженное с последовательным декарбоксилированием, приведенное на схеме 10 [72].
Схема 10 .
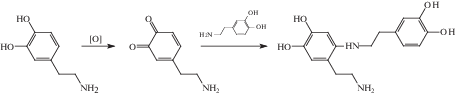
При использовании в качестве стабилизаторов ароматических аминофенолов, таких как допамин, 2-(3,4-дигидроксифенил)этиламин, при наличии в системе окислителя, которыми являются соединения Ag(I) или Au(III), возможно формирование хинонов с последующей конденсацией и восстановлением ароматической структуры фенола (схема 11 ).
Схема 11 .
В результате на поверхности наночастицы образуется трехмерная структура полимера, аналогичная той, что зафиксирована в работе [73].
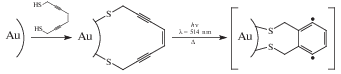
Строение молекулы хемосорбированного соединения может изменяться под воздействием внешнего лазерного излучения в видимой области спектра. Описана [74] трансформация углеводородного скелета молекул дитиола, хемосорбированных на поверхности наночастиц золота (схема 12 ).
Схема 12 .
В работе [75] приведен пример реакции димеризации хемосорбированных на поверхности наночастиц серебра молекул п-аминотиофенола, происходящей под воздействием лазерного излучения (схема 13 ).
Схема 13 .
Важную роль в этом процессе играет молекулярный кислород, активация которого облегчается в сорбционном слое частиц, обладающих эффектом ППР [76]. Резонансное поглощение, характерное для металлических наночастиц, может быть источником возникновения электрон-дырочных пар. Возбужденные электроны поверхностных атомов металла способны перемещаться на несвязывающую 2π орбиталь адсорбированного атома кислорода, что облегчает его диссоциацию, предшествующую реакции дегидратации с участием двух аминогрупп модификатора.
ПРИМЕНЕНИЕ ХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ НАНОЧАСТИЦ ЗОЛОТА И СЕРЕБРА ПРИ ОПРЕДЕЛЕНИИ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Золи наночастиц благородных металлов, как “голые”, так и химически модифицированные, находят применение при определении неорганических соединений [3, 4, 18, 77]. При взаимодействии химически модифицированных наночастиц с аналитом возникает новая субстанция, свойства которой отличны от исходных компонентов. В зависимости от природы взаимодействия такие аналитические реагенты могут быть использованы в качестве групповых для суммарного определения однотипных аналитов либо индивидуальных для селективного определения того или иного катиона или аниона. При выборе модификатора может иметь значение метод регистрации аналитического сигнала. Например, функциональная группа, образующая комплекс с аналитом, может тушить флуоресценцию или иметь сильное поглощение в той или иной области спектра.
В основе методик определения катионов и/или анионов лежит взаимодействие наночастиц с аналитом, приводящее к формированию аналитического сигнала, фиксируемого инструментально. Чаще всего для целей неорганического анализа используют абсорбционную молекулярную спектрометрию, реже – электрохимические и люминесцентные методы. Обзор методик определения неорганических аналитов с использованием золей наночастиц благородных металлов приведен в табл. 1.
Таблица 1.
Примеры определения неорганических аналитов с использованием золей химически модифицированных наночастиц золота и серебра методами молекулярной спектрометрии
| Золь металла | Модификатор | Добавочный реагент | Аналит | cн, М | Область линейности, М | Литература |
|---|---|---|---|---|---|---|
| Ag | Цистеин | – | Ca2+ | 10–7 | 1 × 10–7–1 × 10–3 | [78] |
| Ag | Цистеин | – | Cr3+ | Нет данных | Нет данных | [79] |
| Au | Тиолсодержащий триазол | – | Cr3+ | Нет данных | 6 × 10–7–7 × 10–6 | [33] |
| Au | ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{7}^{{4 - }}$ | – | Fe3+, | 5.6 × 10–6 | 1 × 10–5–6 × 10–5 | [80] |
| Ag | Дитиокарбамат допамина | – | Co2+ | 1.4 × 10–5 | 1 × 10–3–1.5 × 10–2 | [81] |
| Au | Люминол, цистеин | Н2О2 | Cu2+, | 5 × 10–6 | 2 × 10–5–8 × 10–4 | [60] |
| Co2+ | Нет данных | Нет данных | ||||
| Au | Тиолсодержащие иминодиуксусные кислоты | Миоглобин | Cu2+ | Нет данных | Нет данных | [82] |
| Au | Хитозан | – | Zn2+ | Нет данных | 1 × 10–4–2 × 10–2 | [83] |
| Cu2+ | 1 × 10–4–5 × 10–3 | |||||
| Au | Дитиолансодержащий циклотривератрилен | – | Cu2+, Zn2+, Pb2+, Hg2+, Eu3+, Cd2+ | Нет данных | Нет данных | [84] |
| Ag | Тиолсодержащий триазин | – | Pb2+ | 10–7 | 5 × 10–7–3 × 10–6 | [85] |
| Au | ω-Меркаптоундекановая кислота | – | Pb2+ | 10–5 | Нет данных | [86] |
| Au | Меркаптопропионовая кислота, меркаптоянтарная кислота | Дипиколи-новая кислота | Cu2+, Hg2+, Pb2+ | Нет данных | Нет данных | [18, 19] |
| Ag | Валин, изолейцин | ЭДТА | Hg2+, Pb2+, Cd2+ | Нет данных | Нет данных | [87] |
| Ag | NADH | – | Hg2+ | 2 × 10–11 | 3 × 10–11–1×10–9 | [65] |
| Ag | Хитозан | – | Hg2+ | 1 × 10–7 | 2.5 × 10–7–5.5 × 10–6 | [26] |
| Ag (нп)* | Цистеин | – | Hg2+ | 1.1 × 10–7 | 1 × 10–6–5 × 10–6 | [88] |
| Ag | Цистеин | – | Hg2+ | Нет данных | Нет данных | [89] |
| Au | Пептид | ЭДТА | Hg2+ | 1 × 10–6 | 1 × 10–6–5 × 10–5 | [66] |
| Au | Тиолсодержащий тимин | – | Hg2+ | 2.8 × 10–9 | 5 × 10–9–1 × 10–6 | [90] |
| Au | Меламин | – | Hg2+ | 5 × 10–8 | 5 × 10–8–1 × 10–6 | [91] |
| Au | Тиолсодержащие катионные ПАВ | – | Hg2+ | 3 × 10–8 | 3 × 10–8–6 × 10–7 | [92] |
| Au | Глутатион | – | Cd2+ | 1 × 10–5 | 1 × 10–6–5 × 10–5** | [93] |
| Au | Тиоацетат пирозиния | – | Pd2+ | 1 × 10–8 | 1 × 10–8–1 × 10–4** | [94] |
| Ag (нп)* | Цистеин | – | I– | Нет данных | Нет данных | [95] |
В большинстве случаев наличие функциональных групп в молекуле модификатора является необходимым и достаточным условием для образования комплекса с аналитом. Иногда для этого необходимо введение в состав системы добавочного реагента.
Наличие карбоксильных групп в цитрат-стабилизированных наночастицах серебра способствует координации ионов редкоземельных металлов, имеющих собственную флуоресценцию. В работе [96] описана методика определения ионов тербия(III) с участием цитрат-стабилизированных коллоидов серебра. Ион тербия координируется с карбоксильными группами модификатора, образуя поверхностный комплекс. В качестве дополнительного компонента в систему вводят дипиколиновую кислоту (схема 14 ).
Схема 14 .
Ее присутствие способствует устранению сразу нескольких проблем, осложняющих флуоресцентное определение аналита. Во-первых, дипиколиновая кислота способна к вытеснению из координационной сферы иона тербия молекул воды, тушащих флуоресценцию. Во-вторых, формирование такого рода разнолигандного поверхностного комплекса препятствует взаимодействиям наночастиц между собой, устраняя их агрегацию.
Устойчивость подобных поверхностных фрагментов, включающих аналит, определяется конкурентными реакциями комплексообразования с участием зафиксированных на поверхности внешних лигандов. Константы устойчивости комплексов на поверхности и в объеме с участием внешнего реагента должны быть сопоставимы между собой. В случае высоких значений констант устойчивости поверхностных комплексов при введении аналита в концентрациях выше критического (порогового) значения может происходить необратимая агрегация наночастиц. На этом принципе основано определение малых концентраций ионов Hg2+ с использованием золей наночастиц серебра, поверхностно стабилизированных цистеином [97]. Кроме того, возможно разрушение двойного электрического слоя наночастиц, возникновение эффекта приобретенной гидрофобности, что также способствует потере устойчивости коллоидной системой. При образовании более устойчивого комплекса с внешним лигандом использование химически модифицированных наночастиц для определения аналита теряет смысл.
Образование комплексов с участием функциональных групп нескольких наночастиц и ионов металлов может быть использовано для определения последних. Основная задача химического анализа, связанная с такими объектами, – получение специфического аналитического сигнала, ассоциированного с супрамолекулярными структурами, возникающими в ходе взаимодействия металл–лиганд. В большинстве случаев аналитическим сигналом является интенсивность поглощения в видимой и ближней ИК областях спектра при бóльших длинах волн по сравнению с максимумом полосы ППР. Формы полос, соотношение интенсивностей в максимуме и при фиксированных значениях длин волн для индивидуальных наночастиц и их ассоциатов отличаются. Данным методом может быть определен широкий круг соединений щелочноземельных, редкоземельных, переходных металлов [15–17, 78, 97–105]. Использование несферических наночастиц благородных металлов, содержащих в спектре ППР несколько полос, в данном случае – скорее мешающий фактор. Видимо, этим обусловлено наличие буквально единичных работ с использованием золей несферических наночастиц [88, 95].
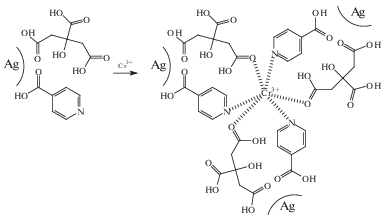
При химическом модифицировании за счет вытеснения другим реагентом (модификатором) молекул стабилизатора с поверхности наночастиц необходимо добиваться его относительно высокого содержания в конечном продукте. Это условие не всегда является обязательным. В ряде случаев формирование поверхностного комплекса возможно с участием двух типов молекул – стабилизатора, вводимого при синтезе наночастиц, и модификатора, используемого для связывания аналита. В работе [15] синтезирован золь серебра, содержащий одновременно на поверхности ионы цитрата и изоникотиновую кислоту. Последующая обработка этого золя соединениями хрома(III) приводит к образованию разнолигандных поверхностных комплексов с участием нескольких наночастиц (схема 15 ), фиксируемых спектрофотометрически по наличию дополнительной полосы поглощения с максимумом в области 550 нм.
Схема 15 .
Модифицирование поверхности наночастиц серебра меркаптобензойной кислотой (схема 16 ) использовано для определения переходных металлов, например меди [16].
Схема 16 .
Соединения, образующие с металлами хелаты, такие как иминодиуксусная кислота, использованы в качестве модификаторов поверхности наночастиц серебра для определения катионов с координационным числом 4 (схема 17 ), например свинца(II) [102]. При связывании свинца наночастицы серебра образуют дополнительную полосу поглощения ППР в области 650 нм. Аналогичный эффект не наблюдается для соединений Mn(II), Cd(II), Cu(II), Hg(II), Ba, Ca, Zn(II), Co(II), Li, Ag(I), Fe(III), Mg, K, Al при соотношении концентраций металл–аналит в диапазоне 2 : 1–20 : 1.
Схема 17 .
Многоцентровое взаимодействие аналита с молекулами модификатора, содержащимися на одной наночастице, с образованием ассоциатов (схема 18 ) лежит в основе определения ионов хрома(III) [106]. В присутствии хрома(III) в спектре поглощения возникает дополнительная полоса при 630 нм, не проявляющаяся для соединений Zn(II), Ni(II), Co(II), Cu(II), Mn(II), Pb(II), Hg(II), Fe(III), Pt(IV), Mo(V), W(VI), Cr(VI).
Схема 18 .
Дополнительные полосы с максимумом при 640–680 нм зафиксированы в работе [107], целью которых было определение ионов тяжелых металлов, в частности кадмия, на химически модифицированных производными 1,2,4-триазола золотых наночастицах (схема 19 ).
Схема 19 .
В случае недостаточной устойчивости комплексов, включающих ион металла и лиганд, химически закрепленный на поверхности наночастиц, в систему дополнительно вводят соединение-линкер, обеспечивающее формирование супрамолекулярных структур.
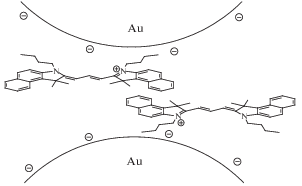
В работах [18, 19] описано получение наночастиц золота, химически модифицированных меркаптопропионовой кислотой. При введении в них дипиколиновой кислоты (2,6-дикарбоксипиридина) и ионов ртути(II) формируются упорядоченные ансамбли наночастиц (схема 20 ). Это явление можно использовать в высокоселективном и чувствительном методе определения ртути(II).
Схема 20 .
Эффекты формирования комплексов с участием функциональных групп химически модифицированных наночастиц благородных металлов обычно проявляются в интервале концентраций аналита 0.1–10 мкМ. Перспективным направлением исследований в данной области является поиск пар химически модифицированная наночастица–аналит, позволяющих проводить химический анализ на уровне концентраций 1 нМ и ниже.
ПРИМЕНЕНИЕ ХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ НАНОЧАСТИЦ ЗОЛОТА И СЕРЕБРА ПРИ ОПРЕДЕЛЕНИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методы определения неорганических и органических веществ с использованием наночастиц золота и серебра близки между собой, однако в каждом случае имеются свои особенности. Наличие той или иной функциональной группы, участвующей в образовании комплексов, как правило, позволяет идентифицировать не индивидуальное соединение, а целый класс аналогичных веществ. Для неизвестного объекта в большинстве случаев можно говорить о групповом анализе. Множество органических соединений не выдерживают длительного контакта с сильными неорганическими кислотами, окислителями. Экстракция или сорбция органических соединений как методы пробоподготовки не всегда применимы. При определении органических соединений с участием химически модифицированных наночастиц золота и серебра следует учитывать перечисленные выше ограничения.
Основной метод исследования органических веществ (как и неорганических) – спектрофотометрия; достаточно широко используют также флуоресценцию, неупругое рассеяние. Возможно образование агрегатов наночастиц с участием органических веществ, имеющих собственные полосы поглощения, отличные от ППР исходных наночастиц. Доля методов определения органических соединений, основанных на эффектах приповерхностного усиления флуоресценции, комбинационного рассеяния, растет.
В ряде случаев трудно отнести анализируемый объект к традиционным органическим соединениям. Некоторые органические аналиты представляют собой биоорганические соединения, биологически активные вещества, методы определения которых рассмотрены ниже. Если и модификатор поверхности наночастиц, и аналит представляют собой низкомолекулярные соединения, то такие объекты анализа можно отнести к органическим, а если хотя бы один из них биополимер – биоорганическим (биохимическим). Характеристика методов определения органических соединений с использованием химически модифицированных наночастиц золота и серебра дана в табл. 2.
Таблица 2.
Спектрометрическое и электрохимическое определение органических аналитов с использованием золей химически модифицированных наночастиц золота и серебра
| Золь металла | Модификатор | Аналит | Метод регистрации* | cн, М | Область линейности, М | Литера-тура |
|---|---|---|---|---|---|---|
| Ag | Цистеин, гомоцистеин, глутатион | Цистеин | СФ, МС | 7 × 10–9 | 1 × 10–7–5 × 10–5 | [11] |
| Гомоцистеин | 2.2 × 10–8 | 1 × 10–7– 5 × 10–5 | ||||
| Ag(нп)** | Цистеин | Цистеин | СФ | Нет данных | 2 × 10–7–2 × 10–5 | [108] |
| Ag(нп)** | Цистеин | Цистеин + + 5 × 10–6 M I– |
СФ | 5 × 10–8 | 5 × 10–8–1 × 10–5 | [95] |
| Ag | Диглицин | Диглицин | ГКР | Нет данных | Нет данных | [29] |
| Ag | 4.4'-Бипиридин | Триптофан | СФ | 2 × 10–5 | 8 × 10–5–5 × 10–4 | [109] |
| Ag | Поливиниловый спирт | Глюкоза | СФ | Нет данных | 1 × 10–5– 3 × 10–4*** |
[110] |
| Ag | Соли бипиридиния | ПАУ | ГКР | 5 × 10–10 | 1 × 10–9–5 × 10–6 | [111] |
| 1 × 10–7 | 1 × 10–7–5 × 10–4 | [112] | ||||
| Ag | Тиолсодержащие циклодекстрины | ПАУ | ГКР | 1 × 10–6 | 1 × 10–5– 4 × 10–4*** |
[113] |
| Ag | Гидроксибензойные кислоты | Гидрокси бензойные кислоты | ГКР | Нет данных | Нет данных | [114] |
| Au | Глицин-цистеамин | Нингидрин | СФ | Нет данных | Нет данных | [115] |
| Ag | Меламин | Циануровая кислота | СФ | Нет данных | 8 × 10–6–
5 × 10–5**** Градуировочная зависимость линейна от lg c |
[116] |
| Au | Меламин | Кленбутерол | ЭХ | 1 × 10–11 | 1 × 10–11–1 × 10–7 | [117] |
| Ag | β-Циклодекстрин-содержащий цитрат | Рибофлавин | СФ | 1.7 × 10–7 | 2 × 10–7–5 × 10–6 | [118] |
| Ag | Аскорбиновая кислота | Каптоприл | СФ | 7 × 10–7 | 2 × 10–7–3 × 10–6 | [119] |
| Ag | Допамин | Меламин | ОС | 8 × 10–8 | 8 × 10–8–1 × 10–5 | [120] |
| Ag | Сульфаниловая кислота | Меламин | СФ | 1 × 10–8 | 9 × 10–7–3 × 10–6 | [121] |
| Ag | Хромотроповая кислота | Меламин | СФ | 3.6 × 10–8 | 1 × 10–7–2 × 10–6 | [122] |
| Au | Фолиевая кислота | Метотрексат | СФ | 2.8 × 10–8 | 3 × 10–8–5 × 10–7 | [123] |
| Au | 4-Меркаптофенил-борная кислота | Сиаловая кислота | СФ | 6.8 × 10–5 | 8 × 10–5–2 × 10–3 | [20] |
| Ag | 4-Аминотиофенол | 6-Бензиламинопурин | СФ | 1 × 10–6 | 1 × 10–6–2 × 10–5 | [124] |
| Ag | Дитиокарбамат 5-сульфоантранило-вой кислоты | Трициклазол | СФ | 1.8 × 10–7 | 1 × 10–6–1 × 10–4 | [125] |
| Ag | Дитиокарбаматы | Пестициды: | СФ | [126] | ||
| Тирам | 2.8 × 10–6 | 3 × 10–6–2 × 10–5 | ||||
| Паракват | 7.2 × 10–6 | 5 × 10–5–5 × 10–4 | ||||
| Ag | 3-Меркапто-пропионовая кислота, гуанидин-уксусная кислота | Триазофоры | СФ | 8 × 10–8 | 5 × 10–7–5 × 10–4 | [13] |
Органические модификаторы с высоким сродством к нульвалентным благородным металлам, существенно влияющие на характеристики ППР даже в области низких концентраций, можно определять методами спектрофотометрии. Спектры ППР немодифицированных и модифицированных наночастиц различаются. Чем выше сродство в системе наночастица–молекула модификатора, тем больше сдвинут максимум полосы поглощения в длинноволновую область и тем она шире [55]. Наиболее вероятной причиной возникновения такого эффекта является делокализация электронной плотности поверхностных атомов наночастицы. Чем выше вклад химических взаимодействий в сорбцию аналита на поверхности металла, тем значительнее изменение спектров поглощения.
Восстановление соединений серебра в присутствии цистеина [127] или триптофана [128] сопровождается дополнительным изменением спектров поглощения по отношению к наночастицам, образующимся в их отсутствие. На основе этого эффекта могут быть реализованы как методы контроля химической трансформации поверхности наночастиц благородных металлов, так и способы количественного определения модификаторов. Исследована [127] зависимость спектров поглощения золей серебра, полученных цитратным восстановлением, от концентрации цистеина. По мере увеличения его содержания снижается интенсивность поглощения в максимуме при 420 нм и одновременно формируется новая широкая полоса в области 700 нм. Подобное поведение зафиксировано и для триптофана [128]. Видимо, причиной является агрегация наночастиц, связанная со взаимодействием функциональных групп молекул модификатора и аналита.
Золи наночастиц благородных металлов, содержащие на поверхности оптически активные молекулы, такие как аминокислоты (например, цистеин или его производные), по-разному взаимодействуют с веществами, также содержащими асимметричный атом углерода. При обработке цитрат-стабилизированных золей наночастиц серебра растворами триптофана, содержащими чистые оптические изомеры, а не их рацемическую смесь, наблюдается различие в агрегативной устойчивости коллоидов. Введение D-триптофана вызывает агрегацию, в то время как аналогичное количество L-изомера – нет [129]. При комплементарности функциональных групп модификатора и аналита формируется более плотная упаковка наночастиц, что влияет на спектральные характеристики. Этот эффект представляет собой достаточно общее явление и зафиксирован для пар модификатор–аналит цистеин–допамин [130], ацетилцистеин–тирозин [131], цитрат–аланин [132], винная кислота–α-аминокислоты [133]. В работе [131] приведено возможное пространственное расположение молекулы тирозина между наночастицами золота, модифицированными N-ацетилцистеином (схема 21 ).
Схема 21 .
Некоторые органические соединения даже в области малых концентраций способны к вытеснению компонентов сорбционного слоя, сопровождающемуся агрегацией наночастиц. В области малых степеней замещения (возможно фиксирование) происходят спектральные изменения, коррелирующие с концентрацией аналитов. На этом принципе основано определение меламина [120–122], антибиотиков, содержащих замещенные фторхинолоны [134]. В то же время нахождение в поверхностном слое наночастиц серебра небольшого количества меламина способствует определению органических аналитов, таких как циануровая кислота [116] или кленбутерол [117].
Образование супрамолекулярных структур с участием металлических наночастиц и органических аналитов, выражающееся в изменении положения максимума, формы линий ППР, может быть с успехом использовано для целей химического анализа. В работе [20] описан спектрофотометрический метод определения сиаловой кислоты. Исходный цитрат-стабилизированный золь золота обрабатывают меркаптофенилборной кислотой, способной образовывать циклические пятичленные аддукты с гликолевыми фрагментами аналита (схема 22 ).
Схема 22 .
Исходный и химически модифицированный золи имеют красную окраску, а конечный продукт после введения сиаловой кислоты – синюю. Изменение интенсивностей поглощения при 520 и 710 нм положено в основу методики анализа. Подобные химически модифицированные золи могут быть использованы для определения полиолов, имеющих два α,β-диольных фрагмента, например сахаров или полиолов.
Образование трехмерных супрамолекулярных структур золей серебра, химически модифицированных 3-меркаптопропионовой и гуанидинуксусной кислотами, с триазофосом (фосфорорганическим инстектицидом), выражающееся в появлении новой широкой полосы поглощения агрегатов наночастиц при 550 нм, лежит в основе метода его количественного спектрофотометрического определения [13]. При нахождении триазофоса в анaлизируемом объекте происходит межчастичное связывание за счет образования водородных связей атомов кислорода тиофосфата с карбоксильными группами химического модификатора, а также π−π-связывания бензольных колец и триазольных пятичленных гетероциклов, входящих в его состав.
Обратный процесс разрушения комплексов меди и функциональных групп молекул гомоцистеина, хемосорбированных на поверхности наночастиц серебра, под действием лидокаина (схема 23 ) служит основой методики его обнаружения в крови и моче [104].
Схема 23 .
Геометрическое соответствие размера и конформации молекулы аналита полости β-циклодекстрина в сочетании с его комплексообразующими свойствами делает такого рода материалы весьма перспективными для анализа. В работе [118] использованы наночастицы серебра, содержащие хемосорбированные β-циклодекстрины, для спектрофотометрического определения рибофлавина. Аналогичные золи способны селективно извлекать из жидких сред полициклические ароматические углеводороды (ПАУ), такие как антрацен и пирен. Данные о содержании ПАУ в образцах в дальнейшем можно получить с использованием спектроскопии комбинационного рассеяния [135].
Примерно 40 лет назад было зафиксировано значительное увеличение сигнала комбинационного рассеяния пиридина вблизи металлической поверхности [136]. Этот эффект позже получил название гигантского комбинационного рассеяния (ГКР) [137, 138]. Коэффициент усиления сигнала ГКР может достигать 109–1010 раз [139, 140].
В основе механизма усиления сигнала комбинационного рассеяния лежит эффект локализованного поверхностного плазмонного резонанса. При нахождении двух наночастиц, обладающих этим эффектом, на расстоянии, сопоставимом с толщиной сорбционного слоя, в межчастичном пространстве возникают особые зоны, называемые “горячими точками” (hot spots), в которых интенсивность неупругого рассеяния энергии электромагнитного поля возрастает в 105–1010 раз [140]. С использованием данного метода возможно определение сверхмалых количеств вещества вплоть до единичных молекул. Для достижения желаемого эффекта необходимо выполнение по крайней мере двух условий: селективной сорбции определяемого вещества и достаточно близкого вплоть до прямого контакта расположения двух металлических наночастиц. Большинство работ в области химического и биохимического анализа с использованием эффекта ГКР нацелено на решение этих двух проблем. Химическое модифицирование поверхности наночастиц благородных металлов в немалой степени способствует этому.
Простейшим способом, обеспечивающим селективность сорбции аналита, является использование электростатического взаимодействия между ним и двойным заряженным слоем наночастицы. Ограничением является условие, что аналит должен содержать заряженную функциональную группу.
В работе [141] приведены методики определения цианиновых красителей, вводенных в золь наночастиц золота (схема 24 ).
Схема 24 .
Цианиновые красители представляют собой соли четвертичного аммония с положительно заряженным атомом азота. Кроме того, они способны непосредственно в сорбционном слое наночастиц за счет π−π-взаимодействий полициклических ароматических фрагментов образовывать димеры (J-агрегаты), интенсивность сигнала которых коррелирует с концентрацией.
Число работ в области использования эффекта ГКР для решения задач аналитической, а особенно биоаналитической химии постоянно увеличивается.
ПРИМЕНЕНИЕ ХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ НАНОЧАСТИЦ ЗОЛОТА И СЕРЕБРА ПРИ ОПРЕДЕЛЕНИИ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Выше отмечено, что провести четкую границу между органическим и биоорганическим химическим анализом затруднительно. В данном разделе рассмотрены биоорганические соединения, которые используют в качестве модификаторов поверхности наночастиц благородных металлов и/или аналитов.
Низко- и высокомолекулярные биоорганические соединения используют в качестве модификаторов поверхности для определения таких аналитов, как триэтиламин [142], лектин [143], кофейная [64] и аскорбиновая [144] кислоты. Эти методики можно отнести и к предыдущему разделу. В трехкомпонентной системе наночастица–модификатор–аналит возможно получение многомерных градуировочных зависимостей, связанных с содержанием каждого из компонентов. При фиксированных концентрациях двух компонентов возможно количественное определение третьего. Так, точно зная содержание наночастиц и модификатора, возможно определение аналита. Этот же подход можно использовать для установления определения содержаний наночастиц или модификатора.
Предельным случаем хемосорбции низкомолекулярных биоорганических соединений является формирование монослоя модификатора. При этом пространственное расположение функциональных групп в молекуле в большинстве случаев существенным образом не изменяется. Для высокомолекулярных биоорганических соединений, например белков, возможна ситуация, когда необходимо сохранить конформацию макромолекулы, определяющую ее специфические свойства. Уже при молекулярной массе биополимера порядка 10 кДа размеры макромолекулы и наночастицы сопоставимы. Наличие нативных вторичной, третичной структур биополимера может способствовать селективности, но одновременно может затруднять сорбцию аналита, который тоже может представлять собой высокомолекулярное соединение. Характеристика методов определения биоорганических соединений и/или наночастиц золота и серебра, модифицированных ими, дана в табл. 3.
Таблица 3.
Определение биоорганических соединений с использованием золей химически модифицированных наночастиц золота и серебра
| Золь металла | Модификатор | Аналит | Метод реги-страции* | cн | Область линейности | Литера-тура |
|---|---|---|---|---|---|---|
| Ag | 4-Меркаптопиридин | Трипсин | ГКР | 1 × 10–7 г/л | 10–7–10–1 г/л** | [145] |
| Au | Манноза | Лектин | СФ | 1 × 10–7 М | 2 × 10–7–4 × 10–7 М | [143] |
| Au | Тиолированная иминодиуксусная кислота | Миоглобин в присутствии ионов Cu2+ | СФ | Нет данных | 9 × 10–4–2 × 10–2 г/л** | [83] |
| Au | Хитозан | Кофейная кислота | ЭХ | 2.5 × 10–8 М | 5 × 10–8–2 × 10–3 М | [64] |
| Au | Меламин | Бычий сывороточный альбумин | СФ | 1.4 × 10–9 М | 2 × 10–8–1 × 10–7 М | [146] |
| Au | ω-Меркаптогексаде-кановая кислота, глюкоксидаза | Глюкоза | СФ | 5 × 10–3 г/л | 1 × 10–2–9 × 10–2 г/л | [40] |
| Ag | Аптамеры нуклеиновых кислот | Аденозинмонофосфат | СФ | 9 × 10–7 М | 1 × 10–6–4 × 10–6 М | [147] |
| Кокаин | 9 × 10–7 М | 1 × 10–6–5 × 10–6 М | ||||
| Au | Аптамеры | Абсцизовая кислота | СФ | 3.3 × 10–7 М | 5 × 10–7–5 × 10–5 М** | [148] |
| Au | Производные ω- меркаптоундекановой кислоты, биотин | Тестостерон | СФ | 5 × 10–8 г/л | 1 × 10–7–1 × 10–5 г/л** | [149] |
| Au | Глутаминовая кислота | Полипептиды | СФ | Нет данных | Нет данных | [150] |
| Ag | 4-Меркаптопиридин | Гепарин | ГКР | 5 × 10–7 г/л | 5 × 10–7–2 × 10–4 г/л | [151] |
| Ag | ω-Меркапто-карбоновые кислоты | Гем, гемоглобин | СФ, ГКР | Нет данных | Нет данных | [152] |
| Ag | Аскорбиновая кислота | Бычий сывороточный альбумин | СФ | 1.6 × 10–7 М | 2 × 10–6–5 × 10–5 М | [144] |
| Au | Порфириновые комплексы европия с дисульфидными группами | Бычий сывороточный альбумин | Ф | Нет данных | Нет данных | [153] |
| Ag | Тиолсодержащие аптамеры | Полипептиды | Ф | 5 × 10–7 г/л | 5 × 10–7–2 × 10–5 г/л | [154] |
| Au | Тиолсодержащие аптамеры | Тромбин | ЛР | Нет данных | 1 × 10–9–5 × 10–8 М | [155] |
| Au | Тиолированные производные адамантана, олигонуклеотиды | ДНК | СФ | Нет данных | Нет данных | [156] |
В качестве модификаторов поверхности наиболее часто используют три класса биополимеров – полипептиды (белки), полисахариды, полинуклеотиды. В отличие от индивидуальных аминокислот и их димеров, специально синтезированные олиго- и полипептиды не так часто применяют для этой цели. В большинстве работ, описывающих химическое модифицирование металлических наночастиц полипептидами, используют белки, выделенные из живых объектов [157–159]. Природные высокомолекулярные полисахариды, такие как циклодекстрин [118, 135] или хитозан [143], можно успешно применять для химического модифицирования поверхности металлических наночастиц. Использование олиго- и полинуклеотидов в качестве биооорганических модификаторов наночастиц основано на способности функциональных групп к взаимодействию с поверхностными атомами [67, 70, 147, 148, 154, 156, 160].
Прямое химическое модифицирование поверхности наночастиц биоорганическими соединениями не нашло широкого применения. Чаще используют материалы, состоящие из металлического ядра и многослойной оболочки. При этом вещество промежуточного слоя должно иметь высокое сродство как к металлу, так и к целевому слою (схема 25 ).
Схема 25 .
В этом качестве используют алифатические тиолы [161], аминокислоты [162, 163], полимеры [164], анионные ПАВ [165] и т.п.
Наночастицы благородных металлов с химически привитыми к их поверхности олигонуклеотидами (аптамерами) представляют собой высокоселективные сорбенты. Их широко используют для определения различных биоорганических соединений, например аденозинмонофосфата [147], абсцизовой кислоты [148], кокаина [147], тромбина [155], специфических белков [154] и др. Основная проблема в данном случае – найти и синтезировать аптамер, взаимодействующий с аналитом с высокой селективностью.
Другим направлением развития селективного биохимического анализа является использование взаимодействий типа биотин–стрептавидин. На этом основано, например, определение тестостерона [149]. Подобные методики могут найти широкое применение в клиническом анализе.
* * *
Анализ литературы показывает, что химически модифицированные наночастицы золота и серебра благодаря эффекту поверхностного плазмонного резонанса, способности усиливать флуоресценцию, комбинационное рассеяние аналитов, находящихся в их сорбционном слое, представляют собой перспективные материалы, в том числе и для использования в аналитической химии. Основное направление развития работ в данной области – целевое формирование поверхностного слоя, обладающего селективностью по отношению к аналиту, которая достигается за счет формирования поверхностных комплексов, супрамолекулярных структур с участием аналита. На практике эти материалы применяют для высокоспецифичного определения небольших, зачастую следовых количеств аналитов [166], существенным образом влияющих на процессы агрегации наночастиц, что приводит к изменению их оптических свойств, проявлению эффектов усиления неупругих видов рассеяния, флуоресценции [167]. Благодаря высоким значения удельной поверхности и малым объемам золя наночастиц золота и серебра перспективно их использование в микрофлюидных методах анализа [168, 169], в том числе реализуемых в виде чипов [170].
Список литературы
de Dios A.S., Díaz-García M.E. Multifunctional nanoparticles: Analytical prospects // Anal. Chim. Acta. 2010. V. 666. № 1–2. P. 1.
Dykman L., Khlebtsov N. Gold nanoparticles in biomedical applications: recent advances and perspectives // Chem. Soc. Rev. 2012. V. 41. № 6. P. 2256.
Терентьева E.A., Апяри В.В., Кочук Е.В., Дмитриенко С.Г., Золотов Ю.А. Применение наночастиц серебра в спектрофотометрии // Журн. аналит. химии. 2017 . Т. 72 . № 11 С. 978. (Terenteva E.A., Apyari V.V., Kochuk E.V., Dmitrienko S.G., Zolotov Yu.A. Use of silver nanoparticles in spectrophotometry // J. Analyt. Chem. 2017. V. 72. № 11 P. 1138.)
Priyadarshini E., Pradhan N. Gold nanoparticles as efficient sensors in colorimetric detection of toxic metal ions: A review // Sens. Actuators. B. 2017. V. 238. P. 888.
Mannelli I., Marco M.-P. Recent advances in analytical and bioanalysis applications of noble metal nanorods // Anal. Bioanal. Chem. 2010. V. 398. № 6. P. 2451.
Csáki A., Thiele M., Jatschka J., Dathe A., Zopf D., Stranik O., Fritzsche W. Plasmonic nanoparticle synthesis and bioconjugation for bioanalytical sensing // Eng. Life Sci. 2015. V. 15. № 3. P. 266.
Chen Y., Xianyu Y., Jiang X. Surface modification of gold nanoparticles with small molecules for biochemical analysis // Acc. Chem. Res. 2017. V. 50. № 2. P. 310.
Fukumori Y., Ichikawa H. Nanoparticles for cancer therapy and diagnosis // Adv. Powder Technol. 2006. V. 17. № 1. P. 1.
Kumar A., Boruah B.M., Liang X.-J. Gold nanoparticles: Promising nanomaterials for the diagnosis of cancer and HIV/AIDS // J. Nanomater. 2011. V. 2011. Art. ID 202187.
Сотников Д.В., Жердев А.В., Дзантиев Б.Б. Детекция межмолекулярных взаимодействий, основанная на регистрации поверхностного плазмонного резонанса // Успехи биол. химии. 2015. Т. 55. С. 391. (Sotnikov D.V., Zherdev, A.V., Dzantiev B.B. Detection of intermolecular interactions based on surface plasmon resonance registration // Biochemistry (Moscow). 2015. V. 80. № 13. P. 1820.)
Shrivas K., Wu H.-F. Applications of silver nanoparticles capped with different functional groups as the matrix and affinity probes in surface-assisted laser desorption/ionization time-of-flight and atmospheric pressure matrix-assisted laser desorption/ionization ion trap mass spectrometry for rapid analysis of sulfur drugs and biothiols in human urine // Rap. Commun. Mass Spectrom. 2008. V. 22. № 18. P. 2863.
Paulini R., Frankamp B.L., Rotello V.M. Effects of branched ligands on the structure and stability of monolayers on gold nanoparticles // Langmuir. 2002. V. 18. № 6. P. 2368.
Bhamore J.R., Ganguly P., Kailasa S.K. Molecular assembly of 3-mercaptopropinonic acid and guanidineacetic acid on silver nanoparticles for selective colorimetric detection of triazophos in water and food samples // Sens. Actuators B. 2016. V. 233. P. 486.
Acres R.G., Feyer V., Tsud N., Carlino E., Prince K.C. Mechanisms of aggregation of cysteine functionalized gold nanoparticles // J. Phys. Chem. C. 2014. V. 118. № 19. P. 10481.
Sharif T., Niaz A., Najeeb M., Zaman M.I., Ihsan M., Sirajuddin. Isonicotinic acid hydrazide-based silver nanoparticles as simple colorimetric sensor for the detection of Cr3+ // Sens. Actuators B. 2015. V. 216. P. 402.
Zhou Y., Zhao H., He Y., Ding N., Cao Q. Colorimetric detection of Cu2+ using 4-mercaptobenzoic acid modified silver nanoparticles // Coll. Surf. A. 2011. V. 391. P. 179.
Wang X., Guillet Y., Selvakannan P.R., Remita H., Broadband B.P. Spectral signature of the ultrafast transient optical response of gold nanorods // J. Phys. Chem. C. 2015. V. 119. № 13. P. 7416.
Lin Y.-W., Huang C.-C., Chang H.-T. Gold nanoparticle probes for the detection of mercury, lead and copper ions // Analyst. 2011. V. 136. № 5. P. 863.
Huang C.-C., Chang H.-T. Parameters for selective colorimetric sensing of mercury(II) in aqueous solutions using mercaptopropionic acid-modified gold nanoparticles // Chem. Commun. 2007. № 12. P. 1215.
Sankoh S., Thammakhet C., Numnuam A., Limbut W., Kanatharana P., Thavarungkul P. 4-Mercaptophenylboronic acid functionalized gold nanoparticles for colorimetric sialic acid detection // Biosens. Bioelectron. 2016. V. 85. P. 743.
Safenkova I.V., Zherdev A.V., Dzantiev, B.B. Correlation between the composition of multivalent antibody conjugates with colloidal gold nanoparticles and their affinity // J. Immunol. Methods. 2010. V. 357. № 1–2. P. 17.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 445 с.
Anderson R., Buscall R., Eldridge R., Mulvaney P., Scales P. Concentrated synthesis of metal nanoparticles in water // RSC Adv. 2014. V. 4. № 60. P. 31914.
Оленин А.Ю., Лисичкин Г.В. Получение, динамика структуры объема и поверхности металлических наночастиц в конденсированных средах // Успехи химии. 2011. Т. 80. № 7. С. 635. (Olenin A.Yu., Lisichkin G.V. Metal nanoparticles in condensed media: preparation and the bulk and surface structural dynamics // Russ. Chem. Rev. 2011. V. 80. № 7. P. 605.)
Ravindran A., Dhas S.P., Chandrasekaran N., Mukherjee A. Differential interaction of silver nanoparticles with cysteine // J. Exp. Nanosci. 2013. V. 8. № 4. P. 589.
Mi F.-L., Wu S.-J., Zhong W.-Q., Huang C.-Y. Preparation of a silver nanoparticle-based dual-functional sensor using a complexation–reduction method // Phys. Chem. Chem. Phys. 2015. V. 17. № 33. P. 21243.
Porter L.A., Ji D. Jr., Westcott S.L., Graupe M., Czernuszewicz R.S., Halas N.J., Lee T.R. Gold and silver nanoparticles functionalized by the adsorption of dialkyl disulfides // Langmuir. 1998. V. 14. № 26. P. 7378.
Huang T., Nallathamby P.D., Gillet D., Xu X.-H.N. Design and synthesis of single-nanoparticle optical biosensors for imaging and characterization of single receptor molecules on single living cells // Anal. Chem. 2007. V. 79. № 20. P. 7708.
Xiaojuan Y., Huaimin G., Jiwei W. Surface-enhanced Raman spectrum of Gly-Gly adsorbed on the silver colloidal surface // J. Mol. Struct. 2010. V. 977. P. 56.
Nishida N., Yao H., Kimura K. Chiral functionalization of optically inactive monolayer-protected silver nanoclusters by chiral ligand-exchange reactions // Langmuir. 2008. V. 24. № 6. P. 2759.
He P., Zhu X. Synthesis and characterization of phospholipid-functionalized silver nanoparticles // Mater. Res. Bull. 2008. V. 43. № 3. P. 625.
Patil V., Mayya K.S., Pradhan S.D., Sastry M. Evidence for novel interdigitated bilayer formation of fatty acids during three-dimensional self-assembly on silver colloidal particles // J. Am. Chem. Soc. 1997. V. 119. № 39. P. 9281.
Shahrivari S., Faridbod F., Ganjali M.R. Highly selective and sensitive colorimetric determination of Cr3+ ion by 4-amino-5-methyl-4H-1,2,4-triazole-3-thiol functionalized Au nanoparticles // Spectrochim. Acta A. 2018. V. 191. P. 189.
Mangeney C., Ferrage F., Aujard I., Marchi-Artzner V., Jullien L., Ouari O., Rekaı E.D., Laschewsky A., Vikholm I., Sadowski J.W. Synthesis and properties of water-soluble gold colloids covalently derivatized with neutral polymer monolayers // J. Am. Chem. Soc. 2002. V. 124. № 20. P. 5811.
Wang W., Xiong T., Cui H. Fluorescence and electrochemiluminescence of luminol-reduced gold nanoparticles: photostability and platform effect // Langmuir. 2008. V. 24. № 6. P. 2826.
Ivanov M.R., Bednar H.R., Haes A.J. Investigations of the mechanism of gold nanoparticle stability and surface functionalization in capillary electrophoresis // ACS Nano. 2009. V. 3. № 2. P. 386.
Newman J.D.S., MacCrehan W.A. The effect of aniline concentration in the ligand exchange reaction with citrate-stabilized gold nanoparticles // Langmuir. 2009. V. 25. № 16. P. 8993.
Péron O., Rinnert E., Lehaitre M., Crassous P., Compère C. Detection of polycyclic aromatic hydrocarbon (PAH) compounds in artificial sea-water using surface-enhanced Raman scattering (SERS) // Talanta. 2009. V. 79. P. 199.
Zhang Z., Ross R.D., Roeder R.K. Preparation of functionalized gold nanoparticles as a targeted X-ray contrast agent for damaged bone tissue // Nanoscale. 2010. V. 2. № 4. P. 582.
Radhakumary C., Sreenivasan K. Naked eye detection of glucose in urine using glucose oxidase immobilized gold nanoparticles // Anal. Chem. 2011. V. 83. № 7. P. 2829.
Wrzesien J., Graham D. Synthesis of SERS active nanoparticles for detection of biomolecules // Tetrahedron. 2012. V. 68. № 4. P. 1230.
Chen Z., Gao L. A facile and novel way for the synthesis of nearly monodisperse silver nanoparticles // Mater. Res. Bull. 2007. V. 42. № 9. P. 1657.
Andrieux-Ledier A., Tremblay B., Courty A. Synthesis of silver nanoparticles using different silver phosphine precursors: formation mechanism and size control // J. Phys. Chem. C. 2013. V. 117. № 28. P. 14850.
Balasubramanian R., Guo R., Mills A.J., Murray R.W. Reaction of Au55(PPh3)12Cl6 with thiols yields thiolate monolayer protected Au75 clusters // J. Am. Chem. Soc. 2005. V. 127. № 22. P. 8126.
Yang H., Wang Y., Zheng N. Stabilizing subnanometer Ag(0) nanoclusters by thiolate and diphosphine ligands and their crystal structures // Nanoscale. 2013. V. 5. № 7. P. 2674.
Yang Y., Chen S. Surface manipulation of the electronic energy of subnanometer-sized gold clusters: An electrochemical and spectroscopic investigation // Nano Lett. 2003. V. 3. № 1. P. 75.
Vollenbroek F.A., Van den Berg J.P., Van der Velden J.W.A., Bour J.J. 31P[1H] Nuclear magnetic resonance investigation of gold cluster compounds // Inorg. Chem. 1980. V. 19. № 9. P. 2685.
Wang W., Murray R.W. Reaction of triphenylphosphine with phenylethanethiolate-protected Au38 nanoparticles // Langmuir. 2005. V. 21. № 15. P. 7015.
Woehrle G.H., Brown L.O., Hutchison J.E. Thiol-functionalized, 1.5-nm gold nanoparticles through ligand exchange reactions: Scope and mechanism of ligand exchange // J. Am. Chem. Soc. 2005. V. 127. № 7. P. 2172.
Petroski J., Chou M.H., Creutz C. Rapid phosphine exchange on 1.5-nm gold nanoparticles // Inorg. Chem. 2004. V. 43. № 5. P. 1597.
Химия привитых поверхностных соединении / Под ред. Лисичкина Г.В. М.: ФИЗМАТЛИТ, 2003. 592 с.
Oh E., Susumu K., Goswami R., Mattoussi H. One-phase synthesis of water-soluble gold nanoparticles with control over size and surface functionalities // Langmuir. 2010. V. 26. № 10. P. 7604.
Zhu T., Vasilev K., Kreiter M., Mittler S., Knoll W. Surface modification of citrate-reduced colloidal gold nanoparticles with 2-mercaptosuccinic acid // Langmuir. 2003. V. 19. № 22. P. 9518.
Kotiaho A., Lahtinen R., Efimov A., Metsberg H.-K., Sariola E., Lehtivuori H., Tkachenko N.V., Lemmetyinen H. Photoinduced Charge and energy transfer in phthalocyanine-functionalized gold nanoparticles // J. Phys. Chem. C. 2010. V. 114. № 1. P. 162.
Оленин А.Ю., Низамов Т.Р., Лисичкин Г.В. Химическое модифицирование поверхности наночастиц серебра. Получение частиц-янусов // Рос. нанотехнол. 2014. Т. 9. № 9–10. С. 19. (Olenin A.Yu., Nizamov T.R., Lisichkin G.V. Chemical modification of the surfaces of silver nanoparticles: synthesis of Janus particles // Nanotechnol. Russ. 2014. V. 9. № 9–10. P. 467.)
Kisukuri C.M., Macedo A., Oliveira C.C.S., Camargo P.H.C., Andrade L.H. Investigating the influence of the interface in thiol-functionalized silver−gold nanoshells over lipase activity // Langmuir. 2013. V. 29. № 12. P. 15 974.
QingShan W., Jian J., JinHong F., JiaCong S. Norvancomycin-capped silver nanoparticles: Synthesis and antibacterial activities against E. coli // Sci. Chin. Ser. B. 2007. V. 50. № 3. P. 418.
Hassan M.M. Antibacterial and antifungal thioglycolic acid-capped silver nanoparticles and their application on wool fabric as a durable antimicrobial treatment // ChemistrySelect. 2017. V. 2. № 1. P. 504.
McMahon J.M., Emory S.R. Phase transfer of large gold nanoparticles to organic solvents with increased stability // Langmuir. 2007. V. 23. № 3. P. 1414.
Li F., Wu Y., Liu J., Zhu C., He J. Catalyst metal ions and luminol bifunctionalized gold nanoparticles: Unique chemiluminescence property for Cu(II) monitoring // J. Photochem. Photobiol. A. 2018. V. 352. P. 19.
Pramod P., Sudeep P.K., Thomas K.G., Kamat P.V. Photochemistry of ruthenium trisbipyridine functionalized on gold nanoparticles // J. Phys. Chem. B. 2006. V. 110. № 42. P. 20737.
García-Marín A., Abad J.M., Ruiz E., Lorenzo E., Piqueras J., Pau J.L. Glutathione immunosensing platform based on total internal reflection ellipsometry enhanced by functionalized gold nanoparticles // Anal. Chem. 2014. V. 86. № 10. P. 4969.
Prikhozhdenko E.S., Lengert E.V., Parakhonskiy B.V., Gorin D.A., Sukhorukov G.B., Yashchenok A.M. Biocompatible chitosan nanofibers functionalized with silver nanoparticles for SERS based detection // Acta Phys. Polon. A. 2016. V. 129. № 2. P. 247.
Hone D.C., Haines A.H., Russell D.A. Rapid, quantitative colorimetric detection of a lectin using mannose-stabilized gold nanoparticles // Langmuir. 2003. V. 19. № 17. P. 7141.
Maduraiveeran G., Ramaraj R. Enhanced sensing of mercuric ions based on dinucleotide-functionalized silver nanoparticles // Anal. Methods. 2011. V. 8. № 44. P. 7966.
Si S., Kotal A., Mandal T.K. One-dimensional assembly of peptide-functionalized gold nanoparticles: an approach toward mercury ion sensing // J. Phys. Chem. C. 2007. V. 111. № 3. P. 1248.
Lee J.-S., Lytton-Jean A.K.R., Hurst S.J., Mirkin C.A. Silver nanoparticle-oligonucleotide conjugates based on dna with triple cyclic disulfide moieties // Nano Lett. 2007. V. 7. № 7. P. 2112.
Kreuzer M.P., Quidant R., Salvador J.-P., Marco M.-P., Badenes G. Colloidal-based localized surface plasmon resonance (LSPR) biosensor for the quantitative determination of stanozolol // Anal. Bioanal. Chem. 2008. V. 391. № 5. P. 1813.
Su D., Yang X., Xia Q., Zhang Q., Chai F., Wang C., Qu F. Folic acid functionalized silver nanoparticles with sensitivity and selectivity colorimetric and fluorescent detection for Hg2+ and efficient catalysis // Nanotechnology. 2014. V. 25. № 35. Art. 355702.
Liu B., Liu J. Methods for preparing DNA-functionalized gold nanoparticles, a key reagent of bioanalytical chemistry // Anal. Methods. 2017. V. 9. № 18. P. 2633.
Filimon A.-D., Jacob P., Hergenröder R., Jürgensen A. Study on the reversible changes of the surface properties of an L-Cysteine self-assembled monolayer on gold as a function of pH // Langmuir. 2012. V. 28. № 23. P. 8692.
Park J.-W., Shumaker-Parry J.S. Strong resistance of citrate anions on metal nanoparticles to desorption under thiol functionalization // ACS Nano. 2015. V. 9. № 2. P. 1665.
Wang W., Zhang A., Liu L., Tian M., Zhang L. Dopamine-induced surface functionalization for the preparation of Al–Ag bimetallic microspheres // J. Electrochem. Soc. 2011. V. 158. № 4. P. D228.
Walker J.M., Gou L., Bhattacharyya S., Lindahl S.E., Zaleski J.M. Photothermal plasmonic triggering of au nanoparticle surface radical polymerization // Chem. Mater. 2011. V. 23. № 23. P. 5275.
Kang L., Xu P., Chen D., Zhang B., Du Y., Han X., Li Q., Wang H.-L. Amino acid-assisted synthesis of hierarchical silver microspheres for single particle surface-enhanced Raman spectroscopy // J. Phys. Chem. C. 2013. V. 117. № 19. P. 10007.
Zhao L.-B., Liu X.-X., Zhang M., Liu Z.-F., Wu D.-Y., Tian Z.-Q. Surface plasmon catalytic aerobic oxidation of aromatic amines in metal/molecule/metal junctions // J. Phys. Chem. C. 2016. V. 120. № 2. P. 944.
Oliveira E., Núñez C., Santos H. M., Fernández-Lodeiro J., Fernández-Lodeiro A., Capelo J.L., Lodeiro C. Revisiting the use of gold and silver functionalised nanoparticles as colorimetric and fluorometric chemosensors for metal ions // Sens. Actuators B. 2015. V. 212. P. 297.
Han C., Xub K., Liu Q., Liu X., Li J. Colorimetric sensing of cysteine using label-free silver nanoparticles // Sens. Actuators B. 2014. V. 202. P. 574.
Ravindran A., Mani V., Chandrasekaran N., Mukherjee A. Selective colorimetric sensing of cysteine in aqueous solutions using silver nanoparticles in the presence of Cr3+ // Talanta. 2011. V. 85. № 1. P. 533.
Wu S.-P., Chen Y.-P., Sung Y.-M. Colorimetric detection of Fe3+ ions using pyrophosphate functionalized gold nanoparticles // Analyst. 2011. V. 136. № 9. P. 1887.
Mehta V.N., Mungara A.K., Kailasa S.K. Dopamine dithiocarbamate functionalized silver nanoparticles as colorimetric sensors for the detection of cobalt ion // Anal. Methods. 2013. V. 5. № 7. P. 1818.
Zhang X., Kong X., Fan W., Du X. Iminodiacetic acid-functionalized gold nanoparticles for optical sensing of myoglobin via Cu2+ coordination // Langmuir. 2011. V. 27. № 10. P. 6504.
Sugunan A., Thanachayanont C., Dutta J., Hilborn J.G. Heavy-metal ion sensors using chitosan-capped gold nanoparticles // Sci. Technol. Adv. Mater. 2005. V. 6. № 3–4. P. 335.
Osner Z.R., Holz R.C., Becker D.P. An analytical method for detecting toxic metal cations using cyclotriveratrylene derivative capped gold nanoparticles // Tetrahedron Lett. 2015. V. 56. P. 5419.
Noh K.-C., Nam Y.-S., Lee H.-J., Lee K.-B. A colorimetric probe to determine Pb2+ using functionalized silver nanoparticles // Analyst. 2015. V. 140. № 24. P. 8209.
Fan C., He S., Liu G., Wang L., Song S. A portable and power-free microfluidic device for rapid and sensitive lead (Pb2+) detection // Sensors. 2012. V. 12. № 7. P. 9467.
Kumar V.V., Anthony S.P. Silver nanoparticles based selective colorimetric sensor for Cd2+, Hg2+ and Pb2+ ions: Tuning sensitivity and selectivity using co-stabilizing agents // Sens. Actuators B. 2014. V. 191. P. 31.
Фурлетов А.А., Апяри В.В., Гаршев А.В., Дмитриенко С.Г., Золотов Ю.А. Треугольные нанопластинки серебра в качестве спектрофотометрического реагента для определения ртути(II) // Журн. аналит. химии. 2017. Т. 72. № 12. С. 1059. (Furletov A.A., Apyari V.V., Garshev A.V., Dmitrienko S.G., Zolotov Yu.A. Triangular silver nanoplates as a spectrophotometric reagent for the determination of mercury(II) // J. Analyt. Chem. 2017. V. 72. № 12. P. 1203.)
Nidy M., Umadevi M., Rajkumar B.J.M. Structural, morphological and optical studies of L-cysteine modified silver nanoparticles and its application as a probe for the selective colorimetric detection of Hg2+ // Spectrochim. Acta A. 2014. V. 133. P. 265.
Chen L., Lou T., Yu C., Kang Q., Chen L. N-1-(2-Mercaptoethyl)thymine modification of gold nanoparticles: A highly selective and sensitive colorimetric chemosensor for Hg2+ // Analyst. 2011. V. 136. № 22. P. 4770.
Liu G., Ren H., Guan Y., Dai R., Chai C. Development of a mercury detection kit based on melamine-functionalized gold nanoparticles // Anal. Sci. 2015. V. 31. № 2. P. 113.
Liu D., Qu W., Chen W., Zhang W., Wang Z., Jiang X. Highly sensitive, colorimetric detection of mercury(ii) in aqueous media by quaternary ammonium group-capped gold nanoparticles at room temperature // Anal. Chem. 2010. V. 82. № 23. P. 9606.
Guo Y., Zhang Y., Shao H., Wang Z., Wang X., Jiang X. Label-free colorimetric detection of cadmium ions in rice samples using gold nanoparticles // Anal. Chem. 2014. V. 86. № 17. P. 8530.
Anwar A., Minhaz A., Khan N.A., Kalantari K., Afifi A.B.M., Shah M.R. Synthesis of gold nanoparticles stabilized by a pyrazinium thioacetate ligand: A new colorimetric nanosensor for detection of heavy metal Pd(II) // Sens. Actuators B. 2018. V. 257. P. 875.
Li Y., Li Z., Gao Y., Gong A., Zhang Y., Hosmane N.S., Shen Z., Wu A. “Red-to-blue” colorimetric detection of cysteine via anti-etching of silver nanoprisms // Nanoscale. 2014. V. 6. № 18. P. 10631.
Tan H., Li Q., Ma C., Song Y., Xu F., Chen S., Wang L. Lanthanide-functionalized silver nanoparticles for detection of an anthrax biomarker and test paper fabrication // J. Nanopart. Res. 2014. V. 16. № 1. Art. 2151.
Bamdad F., Khorram F., Samet M., Bamdad K., Sangi M.R., Allahbakhshi F. Spectrophotometric determination of L-cysteine by using polyvinylpyrrolidone-stabilized silver nanoparticles in the presence of barium ions // Spectrochim. Acta A. 2016. V. 161. P. 52.
Modi R.P., Mehta V.N., Kailasa S.K. Bifunctionalization of silver nanoparticles with 6-mercaptonicotinic acid and melamine for simultaneous colorimetric sensing of Cr3+ and Ba2+ ions // Sens. Actuators B. 2014. V. 195. P. 562.
Wu X., Tang W., Hou C., Zhang C., Zhu N. Colorimetric and bare-eye detection of alkaline earth metal ions based on the aggregation of silver nanoparticles functionalized with thioglycolic acid // Microchim. Acta. 2014. V. 181. № 9–10. P. 991.
Mohammadi S., Khayatian G. Colorimetric detection of Bi (III) in water and drug samples using pyridine-2,6-dicarboxylic acid modified silver nanoparticles // Spectrochim. Acta A. 2015. V. 148. 405.
Shang Y., Wu F., Qi L. Highly selective colorimetric assay for nickel ion using N-acetyl-L-cysteine-functionalized silver nanoparticles // J. Nanopart. Res. 2012. V. 14. № 10. Art. 1169.
Qi L., Shang Y., Wu F. Colorimetric detection of lead (II) based on silver nanoparticles capped with iminodiacetic acid // Microchim. Acta. 2012. V. 178. № 1–2. P. 221.
Jeevika A., Shankaran D. R. Visual colorimetric sensing of copper ions based on reproducible gelatin functionalized silver nanoparticles and gelatin hydrogels // Coll. Surf. A. 2014. V. 461. P. 240.
Dou Y., Yang X., Liu Z., Zhu S. Homocysteine-functionalized silver nanoparticles for selective sensing of Cu2+ ions and lidocaine hydrochloride // Coll. Surf. A. 2013. V. 423. P. 20.
Jeevika A., Shankaran D.R. Functionalized silver nanoparticles probe for visual colorimetric sensing of mercury // Mater. Res. Bull. 2016. V. 83. P. 48.
Zhao L., Jin Y., Yan Z., Liu Y., Zhu H. Novel, highly selective detection of Cr(III) in aqueous solution based on a gold nanoparticles colorimetric assay and its application for determining Cr(VI) // Anal. Chim. Acta. 2012. V. 731. P. 75.
Wang A.-J., Guo H., Zhang M., Zhou D.-L., Wang R.-Z., Feng J.-J. Sensitive and selective colorimetric detection of cadmium(II) using gold nanoparticles modified with 4-amino-3-hydrazino-5-mercapto-1,2,4-triazole // Microchim. Acta. 2013. V. 180. № 11–12. P. 1051.
Wu T., Li Y.F., Huang C.Z. Selectively colorimetric detection of cysteine with triangular silver nanoprisms // Chin. Chem. Lett. 2009. V. 20. № 5. P. 611.
Li H., Li F., Han C., Cui Z., Xie G., Zhang A. Highly sensitive and selective tryptophan colorimetric sensor based on 4,4-bipyridine-functionalized silver nanoparticles // Sens. Actuators B. 2010. V. 145. № 1. P. 194.
Serra A., Filippo E., Re M., Palmisano M., Vittori-Antisari M., Buccolieri A., Manno D. Non-functionalized silver nanoparticles for a localized surface plasmon resonance-based glucose sensor // Nanotechnology. 2009. V. 20. № 16. Art. 165501.
Guerrini L., Garcia-Ramos J.V., Domingo C., Sanchez-Cortes S. Nanosensors based on viologen functionalized silver nanoparticles: few molecules surface-enhanced Raman spectroscopy detection of polycyclic aromatic hydrocarbons in interparticle hot spots // Anal. Chem. 2009. V. 81. № 4. P. 1418.
Lopez-Tocon I., Otero J.C., Arenas J.F., Garcia-Ramos J.V., Sanchez-Cortes S. Multicomponent direct detection of polycyclic aromatic hydrocarbons by surface-enhanced Raman spectroscopy using silver nanoparticles functionalized with the viologen host lucigenin // Anal. Chem. 2011. V. 83. № 7. P. 2518.
Xie Y., Wang X., Han X., Xue X., Ji W., Qi Z., Liu J., Zhao B., Ozaki Y. Sensing of polycyclic aromatic hydrocarbons with cyclodextrin inclusion complexes on silver nanoparticles by surface-enhanced Raman scattering // Analyst. 2010. V. 135. № 6. P. 1389.
Fleger Y., Mastai Y., Rosenbluh M., Dressler D.H. SERS as a probe for adsorbate orientation on silver nanoclusters // J. Raman Spectrosc. 2009. V. 40. № 11. P. 1572.
Leontowich A.F.G., Calver C.F., Dasog M., Scott R.W.J. Surface properties of water-soluble glycine-cysteamine-protected gold clusters // Langmuir. 2010. V. 26. № 2. P. 1285.
Kappi F.A., Tsogas G.Z., Giokas D.L., Christodouleas D.C., Vlessidis A.G. Colorimetric and visual read-out determination of cyanuric acid exploiting the interaction between melamine and silver nanoparticles // Microchim. Acta. 2014. V. 181. № 5–6. P. 623.
Miao P., Han K., Sun H., Yin J., Zhao J., Wang B., Tang Y. Melamine functionalized silver nanoparticles as the probe for electrochemical sensing of clenbuterol // ACS Appl. Mater. Interfaces. 2014. V. 6. № 11. P. 8667.
Ma Q., Song J., Zhang S., Wang M., Guo Y., Dong C. Colorimetric detection of riboflavin by silver nanoparticles capped with β-cyclodextrin-grafted citrate // Coll. Surf. B. 2016. V. 148. P. 66.
Rastegarzadeh S., Hashemi F. A surface plasmon resonance sensing method for determining captopril based on in situ formation of silver nanoparticles using ascorbic acid // Spectrochim. Acta A. 2014. V. 122. P. 536.
Ma Y., Niu H., Zhang X., Cai Y. One-step synthesis of silver/dopamine nanoparticles and visual detection of melamine in raw milk // Analyst. 2011. V. 136. № 20. P. 4192.
Song J., Wu F., Wan Y., Ma L. Colorimetric detection of melamine in pretreated milk using silver nanoparticles functionalized with sulfanilic acid // Food Control. 2015. V. 50. P. 356.
Song J., Wu F., Wan Y., Ma L.-H. Visual test for melamine using silver nanoparticles modified with chromotropic acid // Microchim. Acta. 2014. V. 181. № 11–12. P. 1267.
Zhao S.S., Bukar N., Toulouse J.L., Pelechacz D., Robitaille R., Pelletier J.N., François J. Masson miniature multi-channel SPR instrument for methotrexate monitoring in clinical samples // Biosens. Bioelectron. 2015. V. 64. P. 664.
Ma S., He J., Guo M., Sun X., Zheng M. Facile colorimetric detection of 6-benzylaminopurine based on p-aminobenzenethiol functionalized silver nanoparticles // RSC Adv. 2016. V. 6. № 108. P. 106608.
Rohit J.V., Kailasa S.K. 5-Sulfo anthranilic acid dithiocarbamate functionalized silver nanoparticles as a colorimetric probe for the simple and selective detection of tricyclazole fungicide in rice samples // Anal. Methods. 2014. V. 6. № 15. P. 5934.
Rohit J.V., Kailasa S.K. Cyclen dithiocarbamate-functionalized silver nanoparticles as a probe for colorimetric sensing of thiram and paraquat pesticides via host–guest chemistry // J. Nanopart. Res. 2014. V. 16. № 11. Art. 2585.
Řezanka P., Koktan J., Řezanková H., Mat$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{e} $jka P., Král V. Spectrometric determination of L-cysteine and its enantiomeric purityusing silver nanoparticles // Coll. Surf. A. 2013. V. 436. P. 961.
Liu C., Li B., Xu C. Colorimetric chiral discrimination and determination of enantiometric excess of D/L-tryptophan using silver nanoparticles // Microchim. Acta. 2014. V. 181. № 11–12. P. 1407.
Zhang L., Xu C., Liu C., Li B. Visual chiral recognition of tryptophan enantiomers using unmodified gold nanoparticles as colorimetric probes // Anal. Chim. Acta. 2014. V. 809. P. 123.
Zhang L., Xu C., Song G., Li B. Self-assembly of L-cysteine–gold nanoparticles as chiral probes for visual recognition of 3,4-dihydroxyphenylalanine enantiomers // RSC Adv. 2015. V. 5. № 34. P. 27003.
Su H., Zheng Q., Li H. Colorimetric detection and separation of chiral tyrosine based on N-acetyl-Lcysteine modified gold nanoparticles // J. Mater. Chem. 2012. V. 22. № 14. P. 6546.
Zor E., Bekar N. Lab-in-a-syringe using gold nanoparticles for rapid colorimetric chiral discrimination of enantiomers // Biosens. Bioelectron. 2017. V. 91. P. 211.
Song G., Zhou F., Xu C., Li B. A universal strategy for visual chiral recognition of α-amino acids with L-tartaric acid-capped gold nanoparticles as colorimetric probes // Analyst. 2016. V. 141. № 4. P. 1257.
Derayea S.M., Omar M.A., Hammad M.A., Hassan Y.F. Application of surface plasmon resonance of citrate capped silver nanoparticles for the selective determination of some fluoroquinolone drugs // J. Appl. Pharm. Sci. 2017. V. 7. № 2. P. 16.
Xie Y., Wang X., Han X., Xue X., Ji W., Qi Z., Liu J., Zhao B., Ozaki Y. Sensing of polycyclic aromatic hydrocarbons with cyclodextrin inclusion complexes on silver nanoparticles by surface-enhanced Raman scattering // Analyst. 2010. V. 135. № 6. P. 1389.
Albrecht M.G., Creighton J.A. Anomalously intense Raman spectra of pyridine at a silver electrode // J. Am. Chem. Soc. V. 99. № 15. P. 5215.
Moskovits M. Surface-enhanced spectroscopy // Rev. Mod. Phys. 1985. V. 57. № 3. P. 783.
Kneipp K., Kneipp H., Itzkan I., Dasari R.R., Feld M.S. Ultrasensitive chemical analysis by raman spectroscopy // Chem. Rev. 1999. V. 99. № 10. P. 2957.
Li J.-F., Zhang Y.-J., Ding S.-Y., Panneerselvam R., Tian Z.-Q. Core–shell nanoparticle-enhanced Raman spectroscopy // Chem. Rev. 2017. V. 117. № 7. P. 5002.
Zrimsek A.B., Chiang N., Mattei M., Zaleski S., McAnally M.O., Chapman C.T., Henry A.-I., Schatz G.C., Van Duyne R.P. Single-molecule chemistry with surface- and tip-enhanced Raman spectroscopy // Chem. Rev. 2017. V. 117. № 11. P. 7583.
Lim I-I. S., Goroleski F., Mott D., Kariuki N., Ip W., Luo J., Zhong C.-J. Adsorption of cyanine dyes on gold nanoparticles and formation of J-aggregates in the nanoparticle assembly // J. Phys. Chem. B. 2006. V. 110. № 13. P. 6673.
Filippo E., Manno D., Buccolieri A., Serra A. Green synthesis of sucralose-capped silver nanoparticles for fast colorimetric triethylamine detection // Sens. Actuators B. 2013. V. 178. № 1. P. 1.
Di Carlo G., Curulli A., Toro R.G., Bianchini C., De Caro T., Padeletti G., Zane D., Ingo G.M. Green synthesis of gold−chitosan nanocomposites for caffeic acid sensing // Langmuir. 2012. V. 28. № 12. P. 5471.
Yang X.-H., Ling J., Peng J., Cao Q.-E., Wang L., Ding Z.-T., Xiong J. Catalytic formation of silver nanoparticles by bovine serum albumin protected-silver nanoclusters and its application for colorimetric detection of ascorbic acid // Spectrochim. Acta A. 2013. V. 106. P. 224.
Chen L., Fu X., Li J. Ultrasensitive surface-enhanced Raman scattering detection of trypsin based on anti-aggregation of 4-mercaptopyridine-functionalized silver nanoparticles: An optical sensing platform toward proteases // Nanoscale. 2013. V. 5. № 13. P. 5905.
Huang Z., Wang H., Yang W. Gold nanoparticle-based facile detection of human serum albumin and its application as an INHIBIT logic gate // ACS Appl. Mater. Interfaces. 2015. V. 7. № 17. P. 8990.
Sharon E., Enkin N., Albada H.B., Willner I. Aptasensors based on supramolecular structures of nucleic acid-stabilized Ag nanoclusters // Chem. Commun. 2015. V. 51. № 6. P. 1100.
Wang S., Li W., Chang K., Liu J., Guo Q., Sun H., Jiang M., Zhang H., Chen J., Hu J. Localized surface plasmon resonance-based abscisic acid biosensor using aptamer-functionalized gold nanoparticles // PLoS ONE. 2017. V. 12. № 9. Art. e0185530.
Yockell-Lelièvre H., Bukar N., McKeating K.S., Arnaud M., Cosin P., Guo Y., Dupret-Carruel J., Mougin B., Masson J.-F. Plasmonic sensors for the competitive detection of testosterone // Analyst. 2015. V. 140. № 15. P. 5105.
Wangoo N., Bhasin K.K., Mehta S.K., Suri C.R. Synthesis and capping of water-dispersed gold nanoparticles by an amino acid: Bioconjugation and binding studies // J. Coll. Interface Sci. 2008. V. 323. № 2. P. 247.
Wang X., Chen L., Fu X., Chen L., Ding Y. Highly sensitive surface-enhanced raman scattering sensing of heparin based on antiaggregation of functionalized silver nanoparticles // ACS Appl. Mater. Interfaces. 2013. V. 5. № 21. P. 11059.
Kalaivani G., Sivanesan A., Kannan A., Narayanan N.S.V., Kaminska A., Sevvel R. Plasmon-tuned silver colloids for SERRS analysis of methemoglobin with preserved nativity // Langmuir. 2012. V. 28. № 40. P. 14357.
Comby S., Gunnlaugsson T. Luminescent lanthanide-functionalized gold nanoparticles: exploiting the interaction with bovine serum albumin for potential sensing applications // ACS Nano. 2011. V. 5. № 9. P. 7184.
Li H., Chen C.-Y., Wei X., Qiang W., Li Z., Cheng Q., Xu D. Highly sensitive detection of proteins based on metal-enhanced fluorescence with novel silver nanostructures // Anal. Chem. 2012. V. 84. № 20. P. 8656.
Liao Y.-J., Shiang Y.-C., Huang C.-C., Chang H.-T. Molecularly imprinted aptamers of gold nanoparticles for the enzymatic inhibition and detection of thrombin // Langmuir. 2012. V. 28. № 24. P. 8944.
Yin H., Deodhar T.J., Chen M., Lu Y., Hu J.J., Xiong D. Tridentate tripodal sulfur ligand as a stable molecular surface anchor for the fabrication of oligonucleotide-gold based label-free biosensors // Anal. Methods. 2017. V. 9. № 4. P. 600.
Joshi D., Soni R.K. Synthesis of gold and silver nanoparticle S-ovalbumin protein conjugates by in situ conjugation process // J. Nanopart. Res. 2015. V. 17. № 5. Art. 210.
Gulsuner H.U., Ceylan H., Guler M.O., Tekinay A.B. Multi-domain short peptide molecules for in situ synthesis and biofunctionalization of gold nanoparticles for integrin-targeted cell uptake // ACS Appl. Mater. Interfaces. 2015. V. 7. № 20. P. 10677.
Niide T., Shimojo K., Wakabayashi R., Goto M., Kamiya N. Enzymatic fabrication of protein-decorated gold nanoparticles by the aid of artificial peptides with gold-binding affinity // Langmuir. 2013. V. 29. № 50. P. 15596.
Abe S., Maity B., Ueno T. Functionalization of protein crystals with metal ions, complexes and nanoparticles // Curr. Opin. Chem. Biol. 2018. V. 43. P. 68.
Skeete Z., Cheng H., Crew E., Lin L., Zhao W., Joseph P., Shan S., Cronk H., Luo J., Li Y., Zhang Q., Zhong C.-J. Design of functional nanoparticles and assemblies for theranostic applications // ACS Appl. Mater. Interfaces. 2014. V. 6. № 24. P. 21752.
Sajjanar B., Kakodia B., Bisht D., Saxena S., Singh A.K., Joshi V., Tiwari A.K., Kumar S. Peptide-activated gold nanoparticles for selective visual sensing of virus // J. Nanopart. Res. 2015. V. 17. № 5. Art. 234.
Yang H., Fung S.-Y., Xu S., Sutherland D.P., Kollmann T.R., Liu M., Turvey S.E. Amino acid-dependent attenuation of Toll-like receptor signaling by peptide-gold nanoparticle hybrids // ACS Nano. 2015. V. 9. № 7. P. 6774.
Khoury L.R., Goldbart R., Traitel T., Enden G., Kost J. Harvesting Low molecular weight biomarkers using gold nanoparticles // ACS Nano. 2015. V. 9. № 6. P. 5750.
Wangoo N., Bhasin K.K., Boro R., Suri C.R. Facile synthesis and functionalization of water-soluble gold nanoparticles for a bioprobe // Anal. Chim. Acta. 2008. V. 610. № 1. P. 142.
Bendicho C., Bendicho-Lavilla C., Lavilla I. Nanoparticle-assisted chemical speciation of trace elements // Trends Anal. Chem. 2016. V. 77. P. 109.
Achyuthan K.E., Achyuthan A.M., Brozik S.M., Dirk S.M., Lujan T.R., Romero J.M., Harper J.C. Plasmonic fluorescent nanocomposites of cyanines self-assembled upon gold nanoparticle scaffolds // Anal. Sci. 2012. V. 28. № 5. P. 433.
Boken J., Soni S.K., Kumar D. Microfluidic synthesis of nanoparticles and their biosensing applications // Crit. Rev. Anal. Chem. 2016. V. 46. № 6. P. 538.
Taranova N.A., Urusov A.E., Sadykhov E.G., Zherdev A.V., Dzantiev B.B. Bifunctional gold nanoparticles as an agglomeration-enhancing tool for highly sensitive lateral flow tests: a case study with procalcitonin // Microchim. Acta. 2017. V. 184. № 10. P. 4189.
Wang J., Jin M., Gong Y., Li H., Wu S., Zhang Z., Zhou G., Shui L., Eijkel J.C.T., van den Berg A. Continuous fabrication of microcapsules with controllable metal covered nanoparticle arrays using droplet microfluidics for localized surface plasmon resonance // Lab Chip. 2017. V. 17. № 11. P. 1970.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии