Журнал аналитической химии, 2019, T. 74, № 5, стр. 323-334
Гидрофильная хроматография
Л. А. Карцова 1, *, Е. А. Бессонова 1, В. Д. Сомова 1
1 Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Старый Петергоф, Университетский просп., 26, Россия
* E-mail: kartsova@gmail.com
Поступила в редакцию 02.02.2018
После доработки 17.03.2018
Принята к публикации 26.10.2018
Аннотация
Метод гидрофильной хроматографии (HILIC), включающий распределение, адсорбцию, ионный обмен и эксклюзию аналитов, получил в последнее время активное развитие. Рассматриваются принципы метода, типы стационарных и подвижных фаз, механизмы удерживания высокополярных соединений в условиях HILIC, реализация режима двумерной хроматографии, а также области применения метода.
В последние годы отмечается повышенный интерес к методу гидрофильной хроматографии (hydrophilic interaction liquid chromatography, HILIC) как альтернативе обращенно-фазовой ВЭЖХ (ОФ ВЭЖХ) при разделении высокополярных и ионных гидрофильных аналитов [1–4]. Для метода HILIC встречаются и другие обозначения: RRP (reverse reversed-phase) и ANP (aqueous normal-phase сhromatography), т.е. обращенная ОФ ВЭЖХ и водная нормально-фазовая (НФ) ВЭЖХ. Сам термин “гидрофильная жидкостная хроматография” предложен еще в 1990 г. Альпертом [5], полагавшим, что механизм удерживания аналитов обусловлен их распределением между полярным водно-органическим элюентом и слоем подвижной фазы, обогащенным водой и иммобилизованным на поверхности стационарной фазы. Позднее появились работы [6] по разделению сахаров на гидрофильных стационарных фазах, содержащих на поверхности сорбента слой воды. Высказано предположение, что адсорбированный слой воды может быть вовлечен в механизм удерживания аналитов [7].
Появление на рынке новых лекарств, среди которых встречаются и контрафактные биотехнологические препараты, например, такие как лиофилизированные пептиды с молекулярной массой менее 5 кДа, потребовало развития новых подходов к разделению аналитов.
Широкое распространение метод HILIC получил в начале 2000-х гг. [8–11] (рис. 1), что обусловлено, в первую очередь, выпуском специально разработанных стационарных фаз, способных обеспечить более сильное удерживание полярных соединений. В книге [1] рассмотрены основы HILIC, типы стационарных фаз, различные аспекты механизма разделения и области применения метода. Детальная информация представлена и в обзорах [9–16].
Рис. 1.
Количество публикаций по методу HILIC за период 1990–2017 гг. по данным Scopus (поиск по словосочетаниям “hydrophilic liquid chromatography”, “HILIC”).

Механизм разделения аналитов в HILIC сложнее, чем в ОФ ВЭЖХ, поскольку гидрофильная хроматография сочетает в себе характерные черты нормально-фазовой (полярная стационарная фаза), обращенно-фазовой (полярная подвижная фаза) и ионообменной (возможность ионообменных взаимодействий) хроматографии [17]. Подвижная фаза в HILIC содержит значительную долю органического растворителя (>60%) и небольшую часть воды или буферного раствора. На полярной поверхности неподвижной фазы формируется обогащенный водой слой. Адсорбированная водная фаза образуется при использовании элюентов, содержащих в органическом растворителе (обычно ацетонитрил) 2–40 об. % воды. При этом количество адсорбированной воды сильно зависит и от типа полярного сорбента. В подвижных фазах, обогащенных ацетонитрилом, удерживание аналитов определяют, в первую очередь, полярные взаимодействия (режим HILIC), тогда как при использовании элюентов с большим содержанием воды реализуется режим ОФ ВЭЖХ с доминирующими гидрофобными взаимодействиями. Наибольшая избыточная концентрация органического растворителя в стационарной фазе характерна для подвижных фаз, содержащих ~20 об. % ацетонитрила. Наименьшая адсорбция ацетонитрила отмечена при его концентрации в элюенте ~80 об. %. Это, в свою очередь, соответствует максимальной адсорбции воды на силикагеле. Построение линейной и логарифмической зависимостей фактора удерживания от содержания воды в составе подвижной фазы в условиях HILIC позволяет выяснить, какой механизм удерживания, распределение или адсорбция, преобладает [18–21].
Таким образом, удерживание аналитов в гидрофильной хроматографии – это сочетание распределительного механизма между подвижной фазой и слоем воды, адсорбированным у поверхности полярного сорбента, и адсорбционного, где важную роль могут играть электростатические взаимодействия и образование водородных связей. Вклад каждого из механизмов зависит от типа неподвижной фазы, от органического растворителя (природы и концентрации) и водного компонента (рН и концентрации) в подвижной фазе, а также от физико-химических свойств аналитов [22, 23].
Несмотря на сложность механизма разделения аналитов метод HILIC имеет ряд преимуществ по сравнению с НФ и ОФ режимами ВЭЖХ. Он предпочтителен при разделении высокополярных водорастворимых веществ, которые в условиях ОФ и НФ ВЭЖХ либо элюируются с мертвым объемом, либо плохо растворимы в неполярных органических растворителях. Благодаря высокому содержанию органических растворителей в подвижной фазе, отмечено увеличение эффективности при определении основных аналитов и чувствительности масс-спектрометрического детектирования [24].
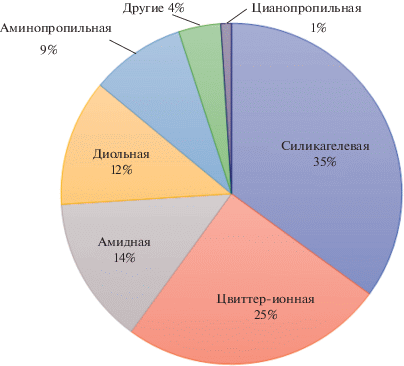
Стационарные фазы. В гидрофильной хроматографии, в принципе, можно использовать любые полярные стационарные фазы, которые подразделяют на три группы: нейтральные (отсутствие электростатических взаимодействий с аналитами), заряженные (сильные электростатические взаимодействия) и цвиттер-ионные (слабые электростатические взаимодействия) [3, 5, 9]. Природа неподвижной фазы существенно влияет на удерживание аналитов, так как формирование адсорбированного водного слоя у поверхности сорбента, необходимого для реализации режима гидрофильной хроматографии, зависит от конкретных функциональных групп стационарной фазы. Силикагель и модифицированный силикагель с амино-, диольными, амидными или цвиттер-ионными группами являются традиционными стационарными фазами для HILIC. При этом немодифицированный силикагель по-прежнему наиболее востребован: около 35% исследований выполнено с его использованием (рис. 2). Оснóвные аналиты сильно удерживаются на силикагеле за счет образования водородных связей и ионообменных взаимодействий с силанольными группами. Кислотные аналиты имеют большее сродство к фазам, содержащим аминогруппы, при этом сильные электростатические взаимодействия иногда могут привести и к их необратимой адсорбции аналитов.
Вторым наиболее часто используемым типом сорбентов в гидрофильной хроматографии являются цвиттер-ионные фазы. Активный слой, прививаемый на широкопористый силикагель или полимерный носитель, содержит сильнокислотные (сульфо-) и сильноосновные (четвертичные аммониевые) группы. Примером таких сорбентов является сульфобетаиновая фаза –(СH2)3–N+(СН3)2–(СH2)3–${\text{SO}}_{3}^{ - },$ которую первоначально применяли для анализа смесей неорганических соединений и белков [16]. Фазы со связанным сульфоалкилбетаином сильно адсорбируют воду за счет образования водородных связей и формируют объемный слой воды на поверхности сорбента, в значительной степени контролирующий процесс разделения полярных аналитов в HILIC [25]. В работе [26] предложен новый тип цвиттер-ионной фазы с фосфорилхолиновыми группами на полимерном сорбенте. Коммерчески доступные цвиттер-ионные колонки выпускаются под торговыми названиями ZIC-HILIC (на основе силикагеля) и ZIC-pHILIC (на полимерной основе). Колонка ZIC-HILIC оказалась лучшей по параметрам разрешения и коэффициентам асимметрии для выбранного набора пептидов. Описаны [27–30] монолитные колонки с цвиттер-ионными группами, внедренными в полиметакрилатные полимерные структуры, для катионообменного разделения белков в HILIC.
Следующими по востребованности в HILIC являются амидные фазы, характеризующиеся хорошими воспроизводимостью и стабильностью. Амидная группа не заряжена в диапазоне рН элюентов, используемых в HILIC. Ионообменные взаимодействия с полярными аналитами на таких фазах практически отсутствуют, что уменьшает риск их необратимой адсорбции. Пептидные стационарные фазы, иммобилизованные на поверхности диоксида кремния, являются гидрофильными из-за присутствия множественных амидных связей. Их традиционно применяют в системах HILIC для хиральных разделений, фракционирования ДНК, выделения пептидов, белков и т.д.
Среди других применяемых в HILIC стационарных фаз следует также упомянуть:
• диольные, обладающие значительной гидрофильностью и используемые в основном для разделения белков;
• аминопропильные, для которых существует проблема возможной необратимой адсорбции аналитов из-за реакционной способности аминогрупп;
• цианопропильные, имеющие ограниченное применение в HILIC, так как большинство полярных соединений обычно слабо удерживаются на таких фазах.
Неуклонно растет популярность стационарных полисахаридных фаз (циклофруктан-6) в HILIC для разделения нуклеиновых оснований, нуклеозидов, нуклеотидов, ксантинов, β-блокаторов, фенольных кислот, углеводов [31, 32]. В работе [33] сообщается о стационарной фазе Click Maltose (рис. 3), которая прекрасно зарекомендовала себя при разделении полярных соединений: сахаров, пептидов, нуклеозидов. Предложены стационарные фазы, модифицированные циклодекстринами, для хиральных разделений в HILIC. Неомицин − гидрофильный аминогликозид − подошел для разделения нуклеозидов, цитокининов и сульфонамидов в сочетании с подвижными фазами с большим содержанием воды, а иммобилизация на силикагеле дендритного полимера обеспечила смешанный механизм удерживания, сочетающий гидрофобные, анионобменные и гидрофильные взаимодействия в зависимости от природы аналита и элюента [34, 35].
Рис. 3.
Схема иммобилизации 1-пропаргил-O-мальтозы на поверхности силикагеля методом клик-химии и разделение сахаров, пептидов и нуклеозидов на полученной фазе [33]. Сахара: 1 − сорбоза, 2 − глюкоза, 3 − тураноза, 4 − целлобиоза, 5 – трегалоза, 6 − мелицитоза, 7 – раффиноза. Пептиды: 1 − FGGF, 2 − LGG, 3 − Angiotensin III, 4 − EE, 5 – GGH. Нуклеозиды: 1 – 5-метилуридин, 2 – уридин, 3 – аденозин, 4 – инозин, 5 – ксантозин, 6 – цитидин, 7 – гуанозин, 8 – 1-метиладенозин.

Полярность стационарных фаз в HILIC возрастает в ряду: цианопропильные, диольные, аминопропильные, силикагель [36]. При сопоставлении разделения ионогенных полярных соединений на немодифицированном силикагеле, силикагеле с привитыми амидными, диольными, цвиттер-ионными группами и силикагеле, модифицированном длинноцепочечными алкильными радикалами с полярными группами, наиболее высокие факторы удерживания полярных аналитов наблюдали для немодифицированного силикагеля (рис. 4) [37]. При этом сильные электростатические взаимодействия, характерные для таких фаз, часто приводят к снижению эффективности и размыванию хроматографических зон [12, 38].
Рис. 4.
Разделение полярных соединений на различных стационарных фазах в условиях HILIC. Стационарные фазы: (а) – цвиттер-ионная, (б) – диольная, (в) – силикагелевая, (г) – амидная, (д) – фаза смешанного типа. Подвижная фаза ацетонитрил–формиат аммония (85 : 15, по объему) 5 мМ, pH 3.0 [37]: 1 – фенол, 2 – нафталинсульфокислота, 3 – п-ксиленсульфокислота, 4 – кофеин, 5 – нортриптилин, 6 – дифенилгидрамин, 7 – бензиламин, 8 – прокаинамид.

Полимерные стационарные фазы используют в HILIС редко, так как они не обеспечивают требуемую селективность разделения полярных соединений [39–41]. Однако их применение может оказаться целесообразным при проведении хроматографического анализа в сильнокислых и сильноосновных средах.
В последние годы большой интерес вызывает использование в методах разделения ионных жидкостей (ИЖ) [42–49]. Опубликованы сообщения [50] о применении ИЖ в качестве стационарных фаз и в HILIC. Приготовлено несколько дикатионных ИЖ на основе 1,4-бис(3-аллилимидазолия)бутана и 1,8-бис(3-аллилимидазолия)октана в комбинации с различными анионами. Следует понимать, что поскольку только один компонент ИЖ (обычно катионный) иммобилизуется на поверхности сорбента, сформированная неподвижная фаза уже не является, строго говоря, ионной жидкостью.
Описано [51] применение оксидов металлов в качестве стационарных фаз для HILIС. Силикагель, покрытый диоксидами металлов или оксидом графена, демонстрирует повышенную стабильность по сравнению с обычными материалами на основе диоксида кремния для ВЭЖХ [51–54]. В работе [55] сообщается о новой стационарной фазе для HILIC, полученной нанесением пористого графитированного углерода на поливиниловый спирт.
Подвижные фазы. Выбор органического растворителя в HILIC существенно влияет на селективность разделения аналитов. Среди различных параметров подвижной фазы на селективность разделения в наибольшей степени влияет величина рН. Подвижные фазы содержат органический растворитель (70–98 об. %) и воду. Высокая концентрация органических растворителей в составе элюента способствует повышению эффективности в процессах электрораспыления и усилению интенсивности обнаруженных сигналов при масс-спектрометрическом детектировании при переходе от режима ОФ ВЭЖХ к системе HILIC. Элюирующая сила органических растворителей увеличивается в порядке возрастания их полярности и тенденции к протонодонорным/протоноакцепторным взаимодействиям. Наиболее широко используемый в HILIC растворитель – ацетонитрил. Ацетон по сравнению с ним является более слабым апротонным растворителем и используется при варьировании селективности разделения [56]. Если определяемый аналит плохо растворим в ацетонитриле, то применяют спирты, образующие водородные связи с функциональными группами сорбента и способные конкурировать с молекулами воды за активные центры на поверхности силикагеля. В работе [57] исследовано влияние низкомолекулярных спиртов (метанол, этанол, изопропанол) в качестве органических модификаторов на удерживание гидразинов на цвиттер-ионной колонке и показано, что с увеличением длины углеродной цепи в молекуле спирта времена удерживания аналитов возрастают. Изучено [58] влияние природы органического растворителя на разделение гидрофильных витаминов на диольной колонке. Наименьшая селективность наблюдается при использовании в качестве подвижных фаз изопропанола и метанола, лучшее разделение достигается в случае ацетонитрила.
На селективность разделения в HILIC влияет также природа и концентрация буферного раствора, что позволяет регулировать степень ионизации функциональных групп на поверхности сорбента и факторы разделения аналитов [17, 59]. Изменение концентрации буферного раствора влияет на разделение полярных аналитов в HILIC в существенно большей степени, чем в ОФ ВЭЖХ, так как одним из механизмов удерживания аналитов является ионный обмен. Буферные растворы для HILIC готовят обычно на основе солей (формиат или ацетат аммония), благодаря их высокой растворимости в подвижных фазах с высоким содержанием ацетонитрила. Кроме того, они совместимы с масс-спектрометрическим детектированием. Повышение концентрации соли (или буферного раствора) в подвижной фазе способствует увеличению водно-органического слоя на поверхности сорбента, что в свою очередь приводит к возрастанию времен удерживания полярных веществ [60–66].
Гидрофильная хроматография с электростатическим отталкиванием. Предложена интересная модификация обсуждаемого метода – гидрофильная хроматография с электростатическим отталкиванием (electrostatic repulsion hydrophilic interaction chromatography, ERLIC) [67, 68]. Показано, что если ионообменную колонку промывать подвижной фазой с большим содержанием органического растворителя, аналиты могут удерживаться за счет гидрофильных взаимодействий, даже если они имеют одинаковый заряд с неподвижной фазой. В этом случае важную роль играет буферный раствор в составе элюента, ослабляющий силы электростатического отталкивания между заряженными группами аналита и неподвижной фазой. Рис. 5 иллюстрирует совместное разделение основных и кислотных пептидов методом HILIC на нейтральной колонке (Polyhydroxyethyl A) и на слабом анионообменнике PolyWAX LP. Оснóвные пептиды (пики 15 и 17) в первом случае (HILIC) удерживаются сильнее, чем кислотные. Однако их параметры значительно уменьшаются на анионообменной колонке за счет электростатических отталкиваний с положительно заряженными группами на поверхности сорбента (ERLIC). Таким образом, при разделении веществ, сильно различающихся по заряду, можно использовать так называемые “эффекты отталкивания”, чтобы селективно уменьшить параметры удерживания сильно сорбирующихся веществ. Это позволило разделить в изократическом режиме смеси веществ, которые обычно требуют градиентного элюирования: пептиды, аминокислоты и нуклеотиды. Метод ERLIC нашел широкое применение в протеомике [69–71].
Рис. 5.
Разделение основных и кислотных пептидов методами HILIC (а) и ERLIC (б) [67]; (а): колонка Polyhydroxyethyl A, подвижная фаза: 20 мM CH3PO3Na, pH 2.0, 63% CH3CN; (б): колонка PolyWAX LP, подвижная фаза: 20 мM CH3PO3Na, pH 2.0, 70% CH3CN.

HILIC в условиях двумерной хроматографии. Порядок элюирования аналитов в HILIC, как правило, противоположен элюированию этих же компонентов в ОФ ВЭЖХ. Такое различие в селективности разделения одних и тех же соединений может оказаться полезным при анализе смесей со сложной матрицей в условиях двумерной хроматографии (2D) с целью увеличения пиковой емкости [72–75]. Ортогональность и комплементарность методов HILIC и ОФ ВЭЖХ [13, 36, 76–78] обеспечивают возможность их сочетания в режиме 2D, что показано, например, при разделении природных антиоксидантов, фенольных кислот и флавонов. Системы HILIC × ОФ ВЭЖХ характеризуются большей селективностью, чем системы ОФ × ОФ ВЭЖХ. Установлено, что при использовании HILIC в первом измерении в сочетании с условиями ОФ ВЭЖХ на монолитных или колонках типа “ядро–оболочка” во втором измерении, обеспечивается значительно лучшая ортогональность для двумерного разделения фенольных и флавоноидных соединений по сравнению с силикагелевыми, диольными, полиэтиленгликолевыми или цвиттер-ионными колонками (рис. 6) [75].
Рис. 6.
Двумерное HILIC × ОФ ВЭЖХ разделение фенольных кислот и флавонов на монолитной капиллярной колонке DioEDMA в первом измерении и колонке Kinetex XB-C18 (50 × 3 мм, 2.6 мкм) с градиентом ацетонитрила 3–50% за 1 мин, расход 3 мл/мин во втором измерении [74].

Сочетание HILIC × ОФ ВЭЖХ обеспечивает требуемую ортогональность для разделения пептидов [76], флавоноидных гликозидов [77], фармацевтических препаратов и продуктов их разложения, а также повышает метаболическое профилирование физиологических жидкостей [78]. При этом лучшая ортогональность достигается при использовании HILIC в первом измерении [67]. Показано [22, 72] эффективное применение HILIC × ОФ ВЭЖХ с масс-спектрометрическим детектированием для анализа триптического гидролизата противоопухолевого белкового препарата трастузумаба.
Еще одним примером ортогональности с HILIC в 2D-режиме является ионообменная хроматография, которую применяли для разделения гликопротеинов [79, 80] и белков гистонов [81–84]. Сочетание HILIC с анионообменной хроматографией позволяет получать профили гликопротеинов благодаря различию механизмов разделения.
При сочетании HILIC и ОФ ВЭЖХ в режиме реального времени могут возникать проблемы, поскольку элюенты с большим содержанием органического растворителя, используемые в HIL-IC, являются слишком сильными элюентами для ОФ ВЭЖХ, тогда как элюенты с большим содержанием воды, используемые в ОФ ВЭЖХ, обладают высокой элюирующей способностью в HILIC. Это может привести к низкому разрешению аналитов, несимметричным и даже раздвоенным пикам на хроматограмме [67, 68]. Для решения этой проблемы используют либо автономные установки в системах HILIC × ОФ ВЭЖХ с улавливающими колонками, либо регулирование и разбавление потока после первой колонки для изменения элюирующей силы подвижной фазы [82]. В последние годы разработан модулирующий кран с двумя петлями, которые поочередно наполняются и опустошаются, позволяя изменять состав подвижных фаз. В то время как одна петля наполняется элюатом из колонки первого измерения, содержимое второй петли анализируется на колонке второго измерения. Другая возможность ортогонального разделения HILIC × ОФ ВЭЖХ на одной полярной колонке заключается в использовании многократного ввода пробы на одной колонке с чередующимся градиентным режимом увеличения (ОФ ВЭЖХ) и уменьшения (HILIC) концентрации органического растворителя в подвижной фазе.
Предложен прием предварительного разбавления элюента водой перед поступлением в колонку с обращенной фазой. Подобный 2D режим (HILIC и ОФ ВЭЖХ) прекрасно зарекомендовал себя, например, при определении полифенолов в зеленом чае. Обратное сочетание хроматографических режимов разделения использовали при анализе различных фармацевтических препаратов. Капиллярная колонка HILIC в первом измерении в сочетании с колонкой ОФ ультра ВЭЖХ во втором и масс-спектрометрическое детектирование обеспечили высокую разрешающую способность при разделении антоцианов в ягодах и образцах красных вин [85, 86].
Области применения метода гидрофильной хроматографии. Метод HILIC имеет ряд ограничений по сравнению с ОФ ВЭЖХ:
• механизм разделения изучен недостаточно, и прогноз влияния условий на разделение аналитов часто бывает затруднителен;
• круг определяемых аналитов ограничен: нейтральные и гидрофобные соединения в условиях HILIC удерживаются слабо, кислотные (например, отрицательно заряженные ионы) могут иметь низкие значения параметров удерживания из-за возможного электростатического отталкивания между ионами аналита и отрицательно заряженными силанольными группами неподвижной фазы;
• требуются длительное время уравновешивания хроматографической системы и существенно бóльшие объемы органических растворителей по сравнению с ОФ ВЭЖХ.
Несмотря на эти ограничения, существует немало примеров применения HILIC для анализа смесей небольших полярных молекул, включая биомаркеры, нуклеозиды, нуклеотиды/олигонуклеотиды, аминокислоты, сахариды, гликозиды, олигосахариды, гидрофильные лекарственные средства, алкалоиды, углеводы и другие полярные или ионизируемые соединения, которые играют большую роль в фармацевтической и в биомедицинской химии, протеомике, метаболомике [79, 87–89], сельскохозяйственной и пищевой химии. Режим HILIC широко используют для разделения пептидов и белков, а также некоторых неорганических веществ. В последнее десятилетие количество подобных исследований резко возросло из-за хорошей совместимости подвижных фаз, используемых в HILIC с методом ионизации в жидкостной хромато-масс-спектрометрии.
Подвижные фазы с высоким содержанием органического растворителя удачно сочетаются с масс-спектрометрическим детектированием; их широко применяют для определения низко- и высокомолекулярных веществ [90–106]. В обзоре [90], посвященном применению масс-спектрометрического детектирования с ионизацией электрораспылением в сочетании с HILIC, рассмотрены различные этапы процесса ионизации и влияние на него состава подвижной фазы по сравнению с ОФ ВЭЖХ. Применение в HILIC подвижных фаз с большим содержанием высокополярных органических растворителей, более летучих и с меньшим значением поверхностного натяжения по сравнению с водной фазой, увеличивает эффективность процесса образования капель и десольватации при ионизации электрораспылением по сравнению с ОФ ВЭЖХ, что приводит к повышенной чувствительности детектирования [90–93]. Однако необходимо оптимизировать концентрацию буферного раствора, поскольку высокая концентрация солей может подавлять интенсивность сигнала.
Таким образом, метод HILIC, в первую очередь, применим для разделения незаряженных высокополярных и амфифильных соединений, которые невозможно разделить методом ОФ ВЭ-ЖХ и/или ионообменной хроматографией: углеводов [107, 108], пептидов [109–112] и полярных фармацевтических препаратов [113, 114]. Обсуждаются перспективы HILIC в метаболическом профилировании [114].
Работа выполнена при финансовой поддержке проекта РФФИ 17-03-01282 а.
Список литературы
Olsen B.A., Pack B.W. Hydrophilic Interaction Chromatography: a Guide for Practitioners, Hoboken, NJ: Wiley, 2013. 336 p.
Ikegami T., Tomomatsu K., Takubo H., Horie K., Tanaka N. Separation efficiencies in hydrophilic interaction chromatography // J. Chromatogr. A. 2008. V. 1184. P. 474.
Jandera P., Janás P. Recent advances in stationary phases and understanding of retention in hydrophilic interaction chromatography. A review // Anal. Chim. Acta. 2017. V. 967. P. 12.
McCalley D.V. Understanding and manipulating the separation in hydrophilic interaction liquid chromatography-a review // J. Chromatogr. A. 2017. V. 1523. P. 49.
Alpert A.J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds // J. Chromatogr. 1990. V. 499. P. 177.
Linden J.C., Lawhead C.L. Liquid chromatography of saccharides // J. Chromatogr. 1975. V. 105. P. 125.
Petrus H., Irgum K. Hydrophilic interaction chromatography // J. Sep. Sci. 2006. V. 29. P. 1784.
Hsieh Y. Potential of HILIC-MS in quantitative bioanalysis of drugs and drug metabolites // J. Sep. Sci. 2008. V. 31. № 9. P. 1481.
Guo Y., Gaiki S. Retention and selectivity of stationary phases for hydrophilic interaction chromatography // J. Chromatogr. A. 2011. V. 1218. № 35. P. 5920.
Jian W., Edom R.W., Xu Y., Weng N. Recent advances in application of hydrophilic interaction chromatography for quantitative bioanalysis // J. Sep. Sci. 2010. V. 33. № 6–7. P. 681.
Dejaegher B., Heyden Y.V. HILIC methods in pharmaceutical analysis // J. Sep. Sci. 2010. V. 33. № 6–7. P. 698.
Jandera P. Stationary and mobile phases in hydrophilic interaction chromatography: A review // Anal. Chim. Acta. 2011. V. 692. P. 1.
Buszewski B., Noga S. Hydrophilic interaction liquid chromatography (HILIC) – a powerful separation technique // Anal. Bioanal. Chem. 2012. V. 402. № 1. P. 231.
Greco G., Letzel T. Main interactions and influences of the chromatographic parameters in HILIC separations // J. Chromatogr. Sci. 2013. V. 51. P. 684.
Zhang Q., Yang F.Q., Hu Y.J., Xia Z.N. Recent applications of hydrophilic interaction chromatography in pharmaceutical analysis // J. Sep. Sci. 2017. V. 40. P. 49.
Hemstrom P., Irgum K. Hydrophilic interaction chromatography // J. Sep. Sci. 2006. V. 29. № 12. P. 1784.
McCalley D.V. Is hydrophilic interaction chromatography with silica columns a viable alternative to reversed-phase liquid chromatography for the analysis of ionisable compounds? // J. Chromatogr. A. 2007. V. 1171. P. 46.
Snyder L.R., Poppe H. Mechanism of solute retention in liquid–solid chromatography and the role of the mobile phase in affecting separation: Competition versus “sorption” // J. Chromatogr. 1980. V. 184. № 4. P. 363.
Scott R.P.W., Kucera P. Solute-solvent interactions on the surface of silica gel. II // J. Chromatogr. 1979. V. 171. P. 37.
Nikitas P., Pappa-Louisi A., Agrafiotou P. Effect of the organic modifier concentration on the retention in reversed-phase liquid chromatography: I. General semi-thermodynamic treatment for adsorption and partition mechanisms // J. Chromatogr. A. 2002. V. 946. № 1–2. P. 33.
Valette J.C., Demesmay C., Rocca J.L., Verdon E. Separation of tetracycline antibiotics by hydrophilic interaction chromatography using an amino-propyl stationary phase // Chromatographia. 2004. V. 59. № 1–2. P. 55.
McCalley D.V. Understanding and manipulating the separation in hydrophilic interaction liquid chromatography // J. Chromatogr. A. 2017. V. 1523. № 10. P. 49.
McCalley D.V. Effect of mobile phase additives on solute retention at low aqueous pH in hydrophilic interaction liquid chromatography // J. Chromatogr. A. 2017. V. 1483. P. 71.
Nguyen H.P., Schug K.A. The advantages of ESI-MS detection in conjunction with HILIC mode separations: Fundamentals and applications // J. Sep. Sci. 2008. V. 31. № 9. P. 1465.
Viklund C., Sjorgen A., Irgum K., Nes I. Chromatographic interactions between proteins and sulfoalkylbetaine-based zwitterionic copolymers in fully aqueous low-salt buffers // Anal. Chem. 2001. V. 73. № 3. P. 444.
Jiang W., Fischer G., Girmay Y., Irgum K. Zwitterionic stationary phase with covalently bonded phosphorylcholine type polymer grafts and its applicability to separation of peptides in the hydrophilic interaction liquid chromatography mode // J. Chromatogr. A. 2006. V. 1127. № 1–2. P. 82.
Liu C., Chen W., Yuan G., Xiao Y., Crommen J., Xu S., Jiang Z. Influence of the cross-linker type on the chromatographic properties of hydrophilic sulfoalkylbetaine-type monolithic columns // J. Chromatogr. A. 2014. V. 1373. P. 73.
Stankova M., Jandera P., Urban J., Skeríkova V. Cross-linker effects on the separation efficiency on (poly)methacrylate capillary monolithic columns. Part II. Aqueous normal-phase liquid chromatography // J. Chromatogr. A. 2013. V. 1289. P. 47.
Jandera P., Stankova M. The effects of the column length on the efficiency of capillary zwitterionic organic polymer monolithic columns in HILIC chromatography // Chromatographia. 2015. V. 79. № 13–14. P. 853.
Skeríkova V., Urban J. Highly stable surface modification of hypercrosslinked monolithic capillary columns and their application in hydrophilic interaction chromatography // J. Sep. Sci. 2013. V. 36. № 17. P. 2806.
Qiu H.X., Loukotkova L., Sun P., Tesarova E., Bosakova Z., Armstrong D.W. Cyclofructan 6 based stationary phases for hydrophilic interaction liquid chromatography // J. Chromatogr. A. 2011. V. 1218. № 2. P. 270.
Padivitage N.L.T., Dissanayake M.K., Armstrong D.W. Separation of nucleotides by hydrophilic interaction chromatography using the FRULIC-N column // Anal. Bioanal. Chem. 2013. V. 405. № 27. P. 8837.
Fu Q., Guo Z., Liang T., Zhang X., Xu Q., Liang X. Chemically bonded maltose via click chemistry as stationary phase for HILIC // Anal. Methods. 2010. V. 2. P. 217.
Oertel R., Renner U., Kirch W. Determination of neomycin by LC-tandem mass spectrometry using hydrophilic interaction chromatography // J. Pharm. Biomed. Anal. 2004. V. 35. № 3. P. 633.
Peng X., Feng Y., Hu X. Preparation and characterization of the neomycinbonded silica stationary phase for hydrophilic-interaction chromatography // Chromatographia. 2013. V. 76. № 9–10. P. 459.
Jandera P. Stationary phases for hydrophilic interaction chromatography, their characterization and implementation into multidimensional chromatography concepts // J. Sep. Sci. 2008. V. 31. № 9. P. 1421.
McCalley D.V. Study of the selectivity, retention mechanisms and performance of alternative silica-based stationary phases for separation of ionised solutes in hydrophilic interaction chromatography // J. Chromatogr. A. 2010. V. 1217. № 20. P. 3408.
Kawachi Y., Ikegami T., Takubo H., Ikegami Y., Miyamoto M., Tanaka N. Chromatographic characterization of hydrophilic interaction liquid chromatography stationary phases: Hydrophilicity, charge effects, structural selectivity, and separation efficiency // J. Chromatogr. A. 2011. V. 1218. № 35. P. 5903.
Li Y., Lee M.L. Biocompatible polymeric monoliths for protein and peptide separations // J. Sep. Sci. 2009. V. 32. № 20. P. 3369.
Lin J., Lin J., Lin X., Xie Z. Preparation of a mixed-mode hydrophilic interaction/anion-exchange polymeric monolithic stationary phase for capillary liquid chromatography of polar analytes // J. Chromatogr. A. 2009. V. 1216. № 5. P. 801.
Persson J., Hemstrom P., Irgum K. Preparation of a sorbitol methacrylate grafted silica as stationary phase for hydrophilic interaction chromatography // J. Sep. Sci. 2008. V. 31. № 9. P. 1504.
Berthod A., Ruiz-Angel M.J., Carda-Broch S. Ionic liquids in separation techniques // J. Chromatogr. A. 2008. V. 1184. № 1–2. P. 6.
Jungnickel C., Łuczak J., Ranke J., Fernandez J., Muller A., Thoming J. Micelle formation of imidazolium ionic liquids in aqueous solution // Coll. Surf. A: Physicochem. Eng. Aspects. 2008. V. 316. P. 278.
Shashkov M.V., Sidel’nikov V.N. Properties of columns with several pyridinium and imidazolium ionic liquid stationary phases // J. Chromatogr. A. 2013. V. 1309. № 27. P. 56.
Shashkov M.V., Sidel’nikov V.N. Single cation ionic liquids as high polarity thermostable stationary liquid phases for capillary chromatography // Russ. J. Phys. Chem. A. 2012. V. 86. № 1. P. 138.
Колобова Е.А., Карцова Л.А., Бессонова Е.А., Кравченко А.В. On-line концентрирование биогенных аминов методом капиллярного электрофореза с иcпользованием синтезированных ковалентных покрытий на основе ионных жидкостей // Аналитика и контроль. 2017. Т. 21. № 1. С. 57. (Kolobova E.A., Kartsova L.A., Bessonova E.A., Kravchenko A.V. On-line concentration of biogenic amines by capillary electrophoresis method using the synthesized covalent coating based on the imidazolium ionic liquids // Analytics and Control. 2017. V. 21. № 1. P. 57.)
Сомова В.Д., Бессонова Е.А., Карцова Л.А. Новый вариант гидрофильной хроматографии с участием ионных жидкостей на основе имидазола для определения высокополярных лекарственных препаратов в биологических жидкостях // Аналитика и контроль. 2017. Т. 21. № 3 С. 241. (Somova V.D., Bessonova E.A., Kartsova L.A. A new version of hydrophilic interaction liquid chromatography with the use of ionic liquids based on imidazole for the determination of highly polar drugs in body fluids // Analytics and Control. 2017. V. 21. № 3. P. 241.)
Bessonova E., Kartsova L., Gallyamova V. Ionic liquids based on imidazole for online concentration of catecholamines in capillary electrophoresis // J. Sep. Sci. 2017. V. 40. № 10. P. 2304.
Карцова Л.А., Бессонова Е.А., Колобова Е.А. Ионные жидкости – модификаторы хроматографических и электрофоретических систем // Журн. аналит. химии. 2016. Т. 71. № 2. С. 147. (Kartsova L.A., Bessonova E.A., Kolobova E.A. Ionic Liquids as Modifiers of Chromatographic and Electrophoretic Systems // J. Analyt. Chem. 2016. V. 71. № 2. P. 147.)
Qiao L.Z., Li H., Shan Y.H., Wang S.Y., Shi X.Z., Lu X., Xu G.W. Study of surface-bonded dicationic ionic liquids as stationary phases for hydrophilic interaction chromatography // J. Chromatogr. A. 2014. V. 1330. № 21. P. 40.
Janeckova L., Kalíkova K., Bosakova Z., Tesarova E. Study of interaction mechanisms on zirconia-based polystyrene HPLC column // J. Sep. Sci. 2010. V. 33. № 19. P. 3043.
Nawrocki J., Dunlap C., McCormick A., Carr P.W. Part I. Chromatography using ultra-stable metal oxide-based stationary phases for HPLC // J. Chromatogr. A. 2004. V. 1028. № 1. P. 1.
Jandera P., Novotna K., Beldean-Galea M.S., Jísa K. Retention and selectivity tests of silica-based and metal-oxide bonded stationary phases for RP-HPLC // J. Sep. Sci. 2006. V. 29. № 6. P. 856.
Randon J., Huguet S., Piram A., Puy G., Demesmay C., Rocca J.L. Synthesis of zirconia monoliths for chromatographic separations // J. Chromatogr. A. 2006. V. 1109. № 1. P. 19.
Hou Y., Zhang F., Liang X., Yang B., Liu X., Dasgupta P.K. Poly (vinyl alcohol) modified porous graphitic carbon stationary phase for hydrophilic interaction chromatography // Anal. Chem. 2016. V. 88. № 9. P. 4676.
Fountain K.J., Xu J., Diehl D.M., Morrison D. Influence of stationary phase chemistry and mobile-phase composition on retention, selectivity, and MS response in hydrophilic interaction chromatography // J. Sep. Sci. 2010. V. 33. № 6–7. P. 740.
Liu M., Ostovic J., Chen E.X., Cauchon N. Hydrophilic interaction liquid chromatography with alcohol as a weak eluent // J. Chromatogr. A. 2009. V. 1216. № 12. P. 2362.
Karatapanis A.E., Fiamegos Y.C., Stalikas C.D. A revisit to the retention mechanism of hydrophilic interaction liquid chromatography using model organic compounds // J. Chromatogr. A. 2011. V. 1218. № 20. P. 2871.
Yong Guo. Recent progress in the fundamental understanding of hydrophilic interaction chromatography (HILIC) // Analyst. 2015. V. 140. P. 6452.
Hong Bui N.T., Verhage J.J., Irgum K. Tris(hydroxymethyl)aminomethane-functionalized silica particles and their application for hydrophilic interaction chromatography // J. Sep Sci. 2010. V. 33. № 19. P. 2965.
Jandera P. Column selectivity for two-dimensional liquid chromatography // J. Sep. Sci. 2006. V. 29. № 12. P. 1763.
Heaton J.C., Russell J.J., Underwood T., Boughtflower R., McCalley D.V. Comparison of peak shape in hydrophilic interaction chromatography using acidic salt buffers and simple acid solutions // J. Chromatogr. A. 2014. V.1347. P. 39.
Heaton J.C., McCalley D.V. Some factors that can lead to poor peak shape in hydrophilic interaction chromatography, and possibilities for their remediation // J. Chromatogr. A. 2016. V. 1427. P. 37.
Pesek J., Matyska M.T., Fischer S.M. Improvement of peak shape in aqueous normal phase analysis of anionic metabolites // J. Sep. Sci. 2011. V. 34. P. 3509.
McCalley D.V. Study of retention and peak shape in hydrophilic interaction chromatography over a wide pH range // J. Chromatogr. A. 2015. V. 1411. P. 41.
Kumar A., Heaton J.C., McCalley D.V. Practical investigation of the factors that affect the selectivity in hydrophilic interaction chromatography // J. Chromatogr. A. 2013. V. 1276. P. 33.
Alpert A.J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides // Anal. Chem. 2008. V. 80. № 1. P. 62.
Gama M.R., Silva R.G. da C., Collins C.H., Bottoli C.B.G. Hydrophilic interaction chromatography // Trends Anal. Chem. 2012. V. 37. P. 48.
Serra A., Gallart-Palau X., Wei J., Sze S.K. Characterization of glutamine deamidation by long-length electrostatic repulsion-hydrophilic interaction chromatography-tandem mass spectrometry (LERLIC-MS/MS) in Shotgun Proteomics // Anal. Chem. 2016. V. 88. № 21. P. 10 573.
Zacharias L.G., Hartmann A.K., Song E.H., Zhao J.F., Zhu R., Mirzaei P., Mechref Y. HILIC and ERLIC Enrichment of glycopeptides derived from breast and brain cancer cells // J. Proteome Res. 2016. V. 15. № 10. P. 3624.
Adav S.S., Hwa H.H., de Kleijn D., Sze S.K. Improving blood plasma glycoproteome coverage by coupling ultracentrifugation fractionation to electrostatic repulsion–hydrophilic interaction chromatography enrichment // J. Proteome Res. 2015. V. 14. № 10. P. 2828.
Jandera P., Hájek T., Škeřiková V., Soukop J. Dual hydrophilic interaction-RP retention mechanism on polar columns: Structural correlations and implementation for 2-D separations on a single column // J. Sep. Sci. 2010. V. 33. P. 841.
François I., Sandra K., Sandra P. Comprehensive liquid chromatography: fundamental aspects and practical considerations–a review // Anal. Chim. Acta. 2009. V. 641. № 1–2. P. 14.
Jandera P., Hájek T., Staňkova M., Vyňuchalova K., Česla P. Optimization of comprehensive two-dimensional gradient chromatography coupling in-line hydrophilic interaction and reversed phase liquid chromatography // J. Chromatogr. A. 2012. V. 1268. P. 91.
Gilar M., Olivova P., Daly A.E., Gebler J.C. Orthogonality of separation in two-dimensional liquid chromatography // Anal. Chem. 2005. V. 77. № 19. P. 6426.
Feng J., Guo Z., Shi H., Gu J., Jin Y., Liang X. Orthogonal separation on one beta-cyclodextrin column by switching reversed-phase liquid chromatography and hydrophilic interaction chromatography // Talanta. 2010. V. 81. № 4–5. P. 1870.
Wang X., Li W., Rasmussen H.T. Orthogonal method development using hydrophilic interaction chromatography and reversed-phase high-performance liquid chromatography for the determination of pharmaceuticals and impurities // J. Chromatogr. A. 2005. V. 1083. P. 58.
Sandra K., Moshir M., D’hondt F., Tuytten R., Verleysen K., Kas K., François I., Sandra P. Highly efficient peptide separations in proteomics: Part 2: Bi- and multidimensional liquid-based separation techniques // J. Chromatogr. B. 2009. V. 877. № 11–12. P. 1019.
Di Palma S., Mohammed Sh., Heck Albert J.R. ZIC-cHILIC as a fractionation method for sensitive and powerful shotgun proteomics // Nature Protocols. 2012. V. 7. № 11. P. 2041.
Lindner H., Sarg B., Meraner C., Helliger W. Separation of acetylated core histones by hydrophilic-interaction liquid chromatography // J. Chromatogr. A. 1996. V. 743. № 1. P. 137.
Lindner H., Sarg B., Helliger W. Application of hydrophilic-interaction liquid chromatography to the separation of phosphorylated H1 histones // J. Chromatogr. A. 1997. V. 782. № 1. P. 55.
Sarg B., Koutzamani E., Helliger W., Rundquist I., Lindner H.H. Postsynthetic trimethylation of histone H4 at Lysine 20 in mammalian tissues is Associated with aging // J. Biol. Chem. 2002. V. 277. P. 39195.
Sarg B., Helliger W., Talasz H., Koutzamani E., Lindner H.H. Histone H4 Hyperacetylation Precludes Histone H4 Lysine 20 Trimethylation // J. Biol. Chem. 2004. V. 279. P. 53458.
Willemse C.M., Stander M.A., Vestner J., Tredoux A.G.J., Villiers A. Comprehensive two-dimensional liquid chromatographic analysis of anthocyanins // J. Chromatogr. A. 2014. V. 1359. P. 189.
Willemse C.M., Stander M.A., Vestner J., Tredoux A.G.J., Villiers A. Comprehensive two-dimensional hydrophilic interaction chromatography (HILIC) x reversed-phase liquid chromatography coupled to high-resolution mass spectrometry (RP-LC-UV-MS) analysis of anthocyanins and derived pigments in red wine // Anal. Chem. 2015. V. 87. № 24. P. 12006.
Wilson S.R., Jankowski M., Pepaj M., Mihailova A., Boix F., Truyols G.V., Lundanes E., Greibrokk T. 2D LC separation and determination of bradykinin in rat muscle tissue dialysate with on-line SPE-HILIC-SPE-RP-MS // Chromatographia. 2007. V. 66. № 7–8. P. 469.
Spagou K., Tsoukali H., Raikos N., Gika H., Wilson I.D., Theodoridis G. Hydrophilic interaction chromatography coupled to MS for metabonomic/metabolomic studies // J. Sep. Sci. 2010. V. 33. P. 716.
Boersema P.J., Mohammed S., Heck A.J.R. Hydrophilic interaction liquid chromatography (HILIC) in proteomics // Anal. Bioanal. Chem. 2008. V. 391. P. 151.
Alpert A.J., Shukla M., Shukla A.K., Zieske L.R., Yuen S.W., Ferguson M.A.J., Mehlert A., Pauly M., Orlando R. Hydrophilic-interaction chromatography of complex carbohydrates // J. Chromatogr. A. 1994. V. 676. № 1. P. 191.
Nguyen H.P., Schug K.A. The advantages of ESI-MS detection in conjunction with HILIC mode separations: Fundamentals and applications // J. Sep. Sci. 2008. V. 31. P. 1465.
Naidong W. Bioanalytical liquid chromatography tandem mass spectrometry methods on underivatized silica columns with aqueous/organic mobile phases // J. Chromatogr. B. 2003. V. 796. P. 209.
Rodriguez-Aller M., Gurny R., Veuthey J.L., Guillarme D. Coupling ultrahigh-pressure liquid chromatography with mass spectrometry: constraints and possible applications // J. Chromatogr. A. 2013. V. 1292. P. 2.
Periat A., Boccard J., Veuthey J.L., Rudaz S., Guillarme D. Systematic comparison of sensitivity between hydrophilic interaction liquid chromatography and reversed phase liquid chromatography coupled with mass spectrometry // J. Chromatogr. A. 2013. V. 1312. P. 49.
Cheng F., Wang Z., Huang Y., Duan Y., Wang X. Investigation of salivary free amino acid profile for early diagnosis of breast cancer with ultra performance liquid chromatography-mass spectrometry // Clin. Chim. Acta. 2015. V. 447. P. 23.
Zhong L., Cheng F., Lu X., Duan Y., Wang X. Untargeted saliva metabonomics study of breast cancer based on ultra performance liquid chromatography coupled to mass spectrometry with HILIC and RPLC separations // Talanta. 2016. V. 158. P. 351.
Wu X., Huang Y., Sun J., Wen Y., Qin F., Zhao L., Xiong Zh. A HILIC-UHPLC–MS/MS untargeted urinary metabonomics combined with quantitative analysis of five polar biomarkers on osteoporosis rats after oral administration of Gushudan // J. Chromatogr. B. 2018. V. 1072. P. 40.
Cai X., Zou L., Dong J., Zhao L., Wang Y., Xu Q., Xue X., Zhang X., Liang X. Analysis of highly polar metabolites in human plasma by ultra-performance hydrophilic interaction liquid chromatography coupled with quadrupole-time of flight mass spectrometry // Anal. Chim. Acta. 2009. V. 650. P. 10.
Vilhena R.O., Pontes F.L., Marson B.M., Ribeiro R.P., de Carvalho K.A., Cardoso M.A., Pontarolo R. A new HILIC-MS/MS method for the simultaneous analysis of carbidopa, levodopa, and its metabolites in human plasma // J. Chromatogr. B. 2014. V. 967. P. 41.
Sangaraju D., Shahidi-Latham Sh.K., Burgess B.L., Dean B., Ding X. A multi-matrix HILIC-MS/MS method for the quantitation ofendogenous small molecule neurological biomarker N-acetyl asparticacid (NAA) // J. Pharm. Biomed. Anal. 2017. V. 140. P. 11.
Fauvelle V., Mazzella N., Morin S., Moreira S., Delest B., Budzinski H. Hydrophilic interaction liquid chromatography coupled with tandem mass spectrometry for acidic herbicides and metabolites analysis in fresh water // Environ. Sci. Pollut. Res. Int. 2015. V. 22. № 6. P. 3988.
Periat A., Fekete S., Cusumano A., Veuthey J.-L., Beck A., Lauber M., Guillarme D. Potential of hydrophilic interaction chromatography for the analytical characterization of protein biopharmaceuticals // J. Chromatogr. A. 2016. V. 1448. P. 81.
d’Atri V., Fekete S., Beck A., Lauber M., Guillarme D. Hydrophilic interaction chromatography hyphenated with mass spectrometry: a powerful analytical tool for the comparison of originator and biosimilar therapeutic monoclonal antibodies at the middle-up level of analysis // Anal. Chem. 2017. V. 89. P. 2086.
Peritat A., Krull I.S., Guillarme D. Applications of hydrophilic interaction chromatography to amino acids, peptides and proteins // J. Sep. Sci. 2015. V. 38. P. 357.
Murakami H., Horiba R., Iwata T., Miki Y., Uno B., Sakai T., Kaneko K., Ishihama Y., Teshima N., Esaka Y. Progress in a selective method for the determination of the acetaldehydederived DNA adducts by using HI-LIC-ESI-MS/MS // Talanta. 2018. V. 177. P. 12.
Chirita R.-I., West C., Finaru A.-L., Elfakir C. Approach to hydrophilic interaction chromatography column selection: Application to neurotransmitters analysis // J. Chromatogr. A. 2010. V. 1217. P. 3091.
Salas D., Borrull F., Fontanals N., Marc R.M. Hydrophilic interaction liquid chromatography coupled to high-resolution mass spectrometry to determine artificial sweeteners in environmental waters // Anal. Bioanal. Chem. 2015. V. 407. P. 4277.
Churms S.C. Recent progress in carbohydrate separation by high-performance liquid chromatography based on hydrophilic interaction // J. Chromatogr. A. 1996. V. 720. № 1–2. P. 151.
Yoshida T. Peptide separation by hydrophilic-interaction chromatography: A review // J. Biochem. Biophys. Methods. 2004. V. 60. № 3. P. 265.
Hao Z.G., Lu C., Xiao B.M., Wenig N.D., Parker B., Knapp M., Ho C. Separation of amino acids, peptides and corresponding Amadori compounds on a silica column at elevated temperature // J. Chromatogr. A. 2007. V. 1147. № 2. P. 165.
Periat A., Krull I.S., Guillarme D. Applications of hydrophilic interaction chromatography to amino acids, peptides, and proteins // J. Sep. Sci. 2015. V. 38. P. 357.
Wujcik C.E., Tweed J., Kadar E.P. Application of hydrophilic interaction chromatography retention coefficients for predicting peptide elution with TFA and methanesulfonic acid ion-pairing reagents // J. Sep. Sci. 2010. V. 33. P. 826.
Strege M.A., Stevenson S., Lawrence S.M. Mixed-mode anion-cation exchange/hydrophilic interaction liquid chromatography-electrospray mass spectrometry as an alternative to reversed phase for small molecule drug discovery // Anal. Chem. 2000. V. 72. № 19. P. 4629.
Janvier S., De Sutter E., Wynendaele E., De Spiegeleer B., Vanhee C., Deconinck E. Analysis of illegal peptide drugs via HILIC-DAD-MS // Talanata. 2017. V. 174. P. 562.
Berkecza R., Tömösia F., Körmöczia T., Szegedib V., Horváthb J., Janáky T. Comprehensive phospholipid and sphingomyelin profiling of different brain regions in mouse model of anxiety disorder using online two-dimensional (HILIC/RP)-LC/MS method // J. Pharm. Biomed. Anal. 2018. V. 149. P. 308.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии