Журнал аналитической химии, 2019, T. 74, № 5, стр. 335-349
Основные методы и подходы к определению маркеров окислительного стресса – органических пероксидных соединений и пероксида водорода
М. Е. Барсукова 1, И. А. Веселова 1, *, Т. Н. Шеховцова 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: irina.veselova@mail.ru
Поступила в редакцию 24.01.2018
После доработки 04.07.2018
Принята к публикации 04.07.2018
Аннотация
Обзор публикаций в основном за последние 15 лет, характеризующих достоинства, ограничения и перспективы развития современных методов и подходов к определению органических гидропероксидов и пероксида водорода – важнейших маркеров-показателей уровня окислительного стресса у живых организмов.
В настоящее время вопросам диагностики окислительного стресса (ОС) уделяют пристальное внимание как отечественные, так и зарубежные ученые: только за последнее десятилетие опубликовано около 40 тыс. обзорных статей, посвященных окислительному или оксидативному стрессу. Эти публикации можно разделить на исследовательские, посвященные установлению и изучению биохимических механизмов ОС [1–4], а также влиянию ОС на развитие нейродегенеративных, сердечно-сосудистых и эндокринных заболеваний [1, 2, 5, 6], и аналитические, представляющие основные методы определения показателей и маркеров ОС: методы регистрации активных форм кислорода (АФК), окислительного повреждения биомолекул, содержания и активности антиоксидантов [7–10].
Окислительным стрессом называют нарушение баланса между процессами образования активных форм кислорода и антиоксидантной защитой организма в пользу образования свободных радикалов [11]. Основным “инструментом” или движущей силой окислительного стресса служат активные формы кислорода. Важнейшими АФК считают супероксидный радикал (${\text{O}}_{2}^{{\centerdot - }}$), синглетный кислород (1О2), гидроксильный (•OH) и пероксидный (•HO2) радикалы, пероксид водорода (H2O2), пероксидный ион (${\text{HO}}_{2}^{ - }$), гипохлорит-ион (OCl–) [12]. Активные формы кислорода и другие свободные радикалы образуются в живых организмах в результате нормального аэробного клеточного метаболизма, а также под влиянием факторов окружающей среды, в результате ультрафиолетового излучения, ионизирующей радиации или сигаретного дыма [13, 14]. Избыточное образование свободных радикалов усиливает пероксидное окисление липидов (ПОЛ), вызывающее мультиклеточные и мультитканевые повреждения из-за накопления в клетках и тканях недоокисленных продуктов (оснований Шиффа, диеновых конъюгатов, малонового диальдегида и др.) [15]. Процесс пероксидного окисления липидов глубоко и всесторонне исследуется с точки зрения механизмов, динамики, определения продуктов окисления, их участия в заболеваниях. Пероксидация липидов играет важную роль в патогенезе многих заболеваний, включая рак, болезни Паркинсона и Альцгеймера, атеросклероз, гипертонию, ишемию, сахарный диабет, идиопатический легочный фиброз [16–18]. Вследствие этого чрезвычайно важна разработка методов определения окислительного стресса на ранних стадиях развития, пока он не привел к серьезным изменениям в организме. Диагностика окислительного стресса в клиническом исполнении при анализе биологических жидкостей должна быть экспрессной (продолжительность анализа не должна превышать 15–30 мин), точной и простой.
В настоящем обзоре рассмотрены известные на сегодняшний день методы определения в живых системах в условиях развития окислительного стресса как основных первичных продуктов пероксидного окисления – органических гидропероксидов, так и пероксида водорода – центральной окислительно-восстановительной сигнальной молекулы в физиологическом окислительном стрессе [19]; обсуждены их достоинства и ограничения, а также перспективы развития современных методов и подходов к определению органических гидропероксидов и пероксида водорода в матрицах сложного состава, таких как биологические жидкости, ткани и др.
РОЛЬ ОРГАНИЧЕСКИХ ПЕРОКСИДОВ И ПЕРОКСИДА ВОДОРОДА В ЖИВЫХ ОРГАНИЗМАХ
Гидропероксиды относятся к важным продуктам окисления органических веществ молекулярным кислородом или пероксидом водорода. Они образуются практически во всех продуктах питания и живых организмах по свободнорадикальной цепной реакции при окислении органических веществ молекулярным кислородом. Метаболические продукты пероксидного окисления липидов могут накапливаться в тканях и жидкостях организма, если антиоксидантная система не успевает утилизировать их с необходимой скоростью. Вследствие этого нарушается транспорт ионов через мембрану клетки, что может влиять на ионный состав жидкой части крови, скорость поляризации и деполяризации мембран мышечных клеток: нарушать проводимость нервных импульсов, их сократимость, увеличивать рефрактерный период (период времени после возникновения на возбудимой мембране потенциала действия, в ходе которого возбудимость мембраны снижается, а затем постепенно восстанавливается до исходного уровня); приводить к попаданию жидкости во внеклеточное пространство, вызывая отеки, сгущение крови, нарушение электролитного баланса в клетках и тканях.
Изменение структуры тканей в результате пероксидного окисления липидов можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней (тыльной поверхности кисти). Этот пигмент, называемый липофусцином, представляет собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Он не гидролизуется ферментами лизосом и поэтому накапливается в клетках, нарушая их функции [20].
Ранее отмечено, что в живых организмах гидропероксиды липидов играют важную роль в процессах развития различных сердечно-сосудистых заболеваний и патологий центральной нервной системы (болезни Альцгеймера, Паркинсона, инсульт и др.). Четкое понимание механизмов, связанных с метаболизмом липидов и гибелью/пролиферацией клеток, важно для патогенеза и профилактики рака. Исследования бразильских ученых [21] показали, что употребление в пищу слишком большого количества мяса и продуктов с высоким содержанием жиров вызывает повышение уровня гидропероксида линолевой кислоты и гемоглобина в толстой кишке. В свою очередь взаимодействие гема гемоглобина с гидропероксидами липидов способствует геномной нестабильности и вызывает развитие канцерогенного процесса, что может привести к развитию рака толстой кишки.
Окисление липидов в биологических системах осуществляется в результате цепной реакции, состоящей из трех стадий: инициации цепной реакции, ее продолжения и обрыва (или завершения). Органические гидропероксиды (первичные продукты ПОЛ) образуются на стадии распространения (развития цепи) пероксидного окисления липидов. Гидропероксидная группа может присоединяться к различным липидным структурам, например к жирным кислотам, триацилглицеринам, фосфолипидам или стеринам. На стадии инициации процесса пероксидного окисления липидов происходят следующие превращения.
1. Свободный кислородный радикал (инициатор, преимущественно в форме •ОН) во время стадии инициации взаимодействует с полиненасыщенными жирными кислотами (LH).
2. При атаке инициирующим радикалом диаллильного атома углерода, на котором формируется радикальный центр, активно протекает свободнорадикальное окисление. Кислота (LH) изомеризуются с образованием более термодинамически стабильного сопряженного диена перед взаимодействием с молекулярным кислородом. Таким образом, из жирной кислоты образуется алкильный радикал (L•).
На стадии продолжения цепного процесса протекают следующие реакции.
3. К алкильному радикалу (L •) присоединяется О2, в результате чего образуется пероксидный радикал (LОО•).
4. Пероксидные радикалы (LОО•) отщепляют атом водорода от близлежащих молекул; это могут быть другие полиненасыщенные жирные кислоты, белки или нуклеиновые кислоты, в результате чего образуются липидные гидропероксиды (LООH) (рис. 1).
Рис. 1.
Общий механизм пероксидного окисления ненасыщенных жирных кислот на примере арахидоновой кислоты [22].
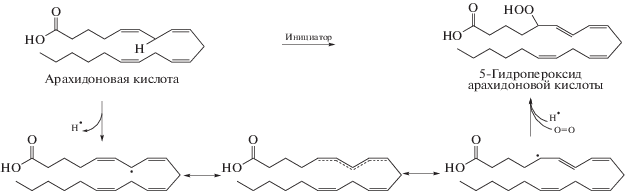
Антиоксиданты, такие как α-токоферол, витамин E, служат донорами атомов водорода. Их взаимодействие с пероксидными радикалами LОО• также ведет к образованию липидных гидропероксидов (LООH) и сравнительно инертных α‑токоферолфеноксильных радикалов. В отсутствие антиоксидантов пероксидные радикалы LОО• могут отщеплять атом водорода от другой молекулы липида (LH), продуцируя высоко активный алкильный радикал (L•), который затем продолжает другую цепную реакцию.
5. Липидный гидропероксид (LООH) способен к внутримолекулярной перегруппировке и спонтанному разложению на алкоксильный (LO•) и гидроксильный (•ОH) радикалы. Если переоксидное окисление липидов катализируют металлы с переменной валентностью (железо или медь), то декомпозиция липидных гидропероксидов (LООH) сопровождается образованием алкоксильных (LО•) и пероксидных (LОО•) радикалов, а также ионов гидроксила и водорода. Все эти радикалы при взаимодействии с другими жирными кислотами (LH) способны инициировать новые радикальные цепные реакции. Кроме того, LOOН вновь реагирует с О2, что приводит к образованию многочисленных вторичных производных, таких как циклические пероксиды, простагландиноподобные бициклоэндопероксиды, мультигидроксилпроизводные и т.д.
6. Алкоксильный радикал (LO•) при продолжении свободнорадикальной атаки может распадаться с образованием альдегидов и алкильных радикальных фрагментов. Процесс пероксидного окисления липидов завершается в результате образования кислородных мостиков или С–С связи между алкильными (L•), алкоксильными (LO•) и пероксидными (LОО•) радикалами [1, 9, 23, 24].
Степень окислительного стресса можно оценить по концентрации участников или продуктов реакции пероксидного окисления липидов – маркеров ОС. Из всех продуктов окисления наибольший интерес представляют гидропероксиды липидов, так как они, с одной стороны, образуются в результате окисления липидов и могут служить маркерами окислительного липидного стресса, а с другой, сами активно участвуют в пероксидном окислении в реакции разветвления цепи [25].
Следует отметить, что пероксид водорода относится к активным формам кислорода, как и химически активные молекулы, которые образуются при неполном восстановлении молекулярного кислорода и традиционно рассматриваются как нежелательные побочные продукты аэробного дыхания, вызывающие окислительный стресс. Пероксид водорода участвует в регуляции сигнальных ферментов и транскрипционных факторов. Совокупность накопленных к настоящему времени данных свидетельствует о том, что пероксид водорода удовлетворяет большинству критериев вторичных посредников. Он играет важную роль в клеточной пролиферации, дифференцировке, миграции и апоптозе [26].
В отличие от свободных радикалов (высоко реакционноспособных и химически нестабильных), при умеренных реакционных условиях, таких как низкая температура и отсутствие ионов металлов, гидропероксиды липидов и пероксид водорода относительно стабильны и являются информативными маркерами, по содержанию которых можно количественно оценивать степень окислительного стресса [27], проводить раннюю диагностику различных социально значимых заболеваний для установления степени тяжести патологического процесса, косвенно выявлять сопутствующие заболевания, а также контролировать эффективность комплекса лечебных, реабилитационных, профилактических и оздоровительных мероприятий.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ОРГАНИЧЕСКИХ ГИДРОПЕРОКСИДОВ И ПЕРОКСИДА ВОДОРОДА
Методам определения органических пероксидов посвящено значительно меньше публикаций [28, 29], чем методам определения пероксида водорода (рис. 2), а сведения о содержании органических гидропероксидов в одних и тех же биологических объектах сильно различаются. Например, в плазме здорового человека уровень концентраций органических гидропероксидов может варьироваться от n пкМ до 4.5 мкМ. Такое отличие можно объяснить различиями в методах подготовки или хранения проб, в методологии анализа [30, 31]. Кроме того, в настоящее время нет единой универсальной количественной характеристики окислительного стресса, и для его оценки чаще всего общее содержание пероксидов пересчитывают на содержание пероксида кумола или трет-бутилгидропероксида. Особенностью методов определения гидропероксидов является плохая растворимость многих органических пероксидов в воде и, следовательно, необходимость определять их в органических или водно-органических средах.
Рис. 2.
Сравнительная диаграмма публикаций, посвященных методам определения органических пероксидов и пероксида водорода.

Оценка пероксидного числа иодометрическим титрованием – классический метод определения гидропероксидов [32, 33]. Этот метод малочувствителен и неспецифичен. Основные погрешности в иодометрии возникают в результате потери иода из-за его летучести, окисления иодид-ионов кислородом воздуха, мешающего влияния веществ, индуцирующих окисление иодида (Cu2+, NO3–, NO и др.) в щелочной среде, адсорбции молекул иода, порядка смешивания растворов, а также под влиянием других условий протекания реакций. Основным недостатком иодометрического титрования при определении гидропероксидов липидов в биологических объектах является относительно высокий предел обнаружения и, как следствие, большая масса анализируемого образца. Преимущество титрования — возможность использования неводных растворителей.
Спектрофотометрию с образованием цветных металлокомплексов используют для определения белковых гидропероксидов и гидропероксидов липидов [34–37]. Подобные методики основаны на окислении ионов железа(II) гидропероксидами в присутствии, например, ксиленолового оранжевого, с образованием комплекса железо(III)–хромофор, сильно поглощающего в диапазоне длин волн 540–600 нм:
По этой методике определяют общее содержание гидропероксидов в плазме крови здоровых людей и больных сахарным диабетом 2-го типа, почечной недостаточностью и гиперхолестеринемией [38].
Несмотря на простоту и экспрессность этого метода, его недостатком является мешающее влияние на определение гидропероксидов различных соединений. Например, добавление 0.3–5 мМ аскорбиновой кислоты в реакционную смесь уменьшает поглощение образующегося индикаторного комплексного соединения. Мешают определению гидропероксидов ЭДТА и другие хелатообразующие реагенты, используемые в качестве антикоагулянтов при подготовке проб крови [39]. Кроме того, метод неспецифичен по отношению к пероксидным соединениям липидов – сигнал дают многие другие соединения, способные окислять ионы железа(II).
Флуориметрическое определение гидропероксидов. Более специфичным и чувствительным для определения липидных гидропероксидов в биологических жидкостях является флуоресцентный метод, позволяющий при правильном выборе флуорофора создавать аналитические методики с низкими пределами обнаружения или же проводить достаточно тонкие исследования биохимических взаимодействий.
Для определения общего содержания липидных гидропероксидов в модельных системах липосом или плазме крови чаще всего используют такие флуоресцентные реагенты, как дифенил-1-пиренилфосфин (ДПФ) и 3-перилендифенилфосфин (3-ПДФФ) [40, 41]. Метод основан на специфической реакции окисления гидропероксидами ДПФ и 3-ПДФФ. Интенсивность флуоресценции образующихся в результате реакции оксидов возрастает пропорционально содержанию гидропероксидов. Схема реакции окисления 3-ПДФФ представлена на рис. 3. Этот подход позволяет определять гидропероксиды липидов на уровне наномолярных концентраций. Например, при использовании ДПФ пределы обнаружения и нижняя граница определяемых концентраций гидропероксида кумола составили 0.08 и 0.25 нмоль эквивалентов в 40 мкл плазмы соответственно. Для уменьшения влияния матрицы в ходе анализа использовали ЭДТА и 2,6-ди-трет-бутил-4-метилфенол. Переходные металлы способны разлагать гидропероксиды плазмы на радикалы, а ЭДТА за счет связывания металлов в комплекс защищает гидропероксиды от разложения.
Этот подход является одним из самых распространенных; его применяют не только для мониторинга пероксидного окисления липидов в клеточных мембранах в присутствии ДПФ или 3-ПДФФ в качестве флуоресцентного реагента [42–44], но и для постколоночного детектирования в методе ВЭЖХ [45–47]. Недостатком этих индикаторных систем является то, что длины волн возбуждения и испускания лежат в коротковолновой области (λeх = 353 нм, λem = 380 нм в случае ДПФ) или различаются лишь незначительно (λex = 440, λem = = 470 нм в случае 3-ПДФФ), поэтому при определении гидропероксидов мешающее влияние оказывает собственная флуоресценция биоматриц.
Предложен [48] флуоресцентный метод определения не только органических пероксидов (бензоилпероксида и пероксида ацетона), но и пероксида водорода. Флуорофор получали реакцией окислительного деборирования: к раствору прохелатора добавляли раствор ацетата цинка в метаноле. Схема реакции представлена на рис. 4. При добавлении к смеси пероксида водорода значительно увеличивается интенсивность флуоресценции при λem = 440 нм. Пределы обнаружения пероксида водорода и органических пероксидов ниже 10 нМ.
При определении гидропероксидов в биологических материалах широко используют реакцию с тиобарбитуровой кислотой (ТБК) [49–51]. ТБК-тест основан на способности ТБК реагировать с малоновым диальдегидом (МДА), промежуточным продуктом ферментативного окисления арахидоновой кислоты и конечным продуктом окислительной деградации липидов. В работе [52] МДА определяли в плазме крови по флуориметрической реакции с ТБК, которая при высокой температуре и низком значении pH протекает с образованием триметинового комплекса (λex/em = = 535/550 нм), содержащего одну молекулу МДА и две молекулы ТБК (рис. 5). Предел обнаружения свободного и связанного с белком малонового диальдегида составил 300 нМ.
Недостаток этого метода состоит, прежде всего, в его неспецифичности. Результаты определения первичных продуктов ПОЛ могут содержать погрешности, поскольку источником МДА могут служить продукты разложения ДНК при ее окислительном повреждении, а возможно, и других нелипидных молекул. Кроме того, ТБК при высокой температуре и низком рН может реагировать и с некоторыми альдегидами, дезоксисахарами, сиаловыми кислотами, гликозилированными белками. Тест с ТБК дает информацию только о наличии веществ, реагирующих с ТБК, но не об их составе и природе [53].
Флуориметрическое определение пероксида водорода. Известно, что пероксид водорода играет важную роль в организме человека. Он участвует в метаболизме белков, углеводов, жиров, витаминов, минеральных солей, иммунной защите, способствует транспортировке сахара из плазмы крови в клетки организма. Однако ряд вопросов об участии пероксида водорода в различных процессах не имеет ответа: почему и в какой момент функционирования клетки происходит переход от нормального синтеза сигнального Н2О2 к окислительному стрессу; какую роль играет Н2О2 во внутриклеточной передаче сигнала. До сих пор неясно, какое количество пероксида водорода, накопленного в клетке, вызывает негативные изменения, а какое его количество необходимо для нормального функционирования организма. Для ответа на эти вопросы необходимы чувствительные, селективные и экспрессные методики определения пероксида водорода в биологических жидкостях. Данные о содержании пероксида водорода в плазме крови неоднозначны. Так, например, в обзоре [54] нормальными концентрациями H2O2 считают 1–5 мкМ. В других работах [55, 56] сообщается о содержаниях пероксида водорода на уровне нМ и мМ.
Флуориметрическая методика определения пероксида водорода и других активных форм кислорода предложена в работе [57]. Она основана на реакции между Н2О2, кобальтом(II) и гидразидом флуоресцеина в мицеллярной среде. Диапазон определяемых концентраций и предел обнаружения пероксида водорода составили 2.1–460 и 0.7 нг/мл соответственно при длине волны испускания 527 нм (λex = 460 нм). Реакцию проводили при нагревании в течение 10–60 мин при 80°С. Методика была успешно апробирована в анализе мочи человека. В работе [58] использовали аналогичную флуоресцентную реакцию между пероксидом водорода и флуоресцеином в присутствии кобальта(II). Флуоресценцию регистрировали при λem = 525 нм (длина волны возбуждения λeх = = 500 нм). Пероксид водорода определяли способом введено–найдено в ряде биологических и экологических объектов, а именно в сыворотке крови теленка, слюне человека, дождевой воде. Достоинством метода является отсутствие влияния неорганических ионов, таких как Cu(II), Mg, Zn, Ca, Fe(II), Mo(VI), Na, K, хлорид, фторид, бромид, цианид, фосфат, аммоний, нитрат, сульфат и аммиак, присутствующих в больших количествах в анализируемых образцах, на определение H2O2.
Для флуориметрического определения H2O2 в мышечных тканях краба использовали реакцию пероксидазного окисления гомованилиновой кислоты [59]. Образующийся в ходе реакции димер гомованилиновой кислоты флуоресцирует при 425 нм (λex = 315 нм), продукт реакции стабилен в течение 12 ч (рис. 6). При анализе биологических образцов для осаждения белковой фракции использовали ледяную трихлоруксусную кислоту с последующей нейтрализацией ее избытком раствора K2HPO4. Этим методом можно эффективно определять пероксид водорода в тканях без использования внутреннего стандарта и дорогостоящих реагентов.
Рис. 6.
Механизм образования флуоресцентного димера гомованилиновой кислоты после окисления H2O2, катализируемого пероксидазой из корней хрена [59].

Анализ в нейтральной среде имеет особое значение для образцов, содержащих белки, ферменты или другой биологический материал. В работе [60] предложена флуориметрическая индикаторная система для определения пероксида водорода и антибиотика тетрациклина, основанная на образовании смешанолигандного комплекса Eu(III)–тетрациклин–пероксид водорода. Применение этой индикаторной системы наиболее эффективно в диапазоне рН 6.9–7.4 в 13 мМ MOPS буферном растворе. Описанную методику использовали для определения пероксида водорода и пероксида мочевины в крови человека [61]. На определение пероксида водорода не влияют ионы щелочных и щелочноземельных металлов в концентрации менее 100 мМ, однако многие переходные металлы (Co2+, Fe3+, Zn2+) тушат люминесценцию при концентрации 0.1–1 мМ, а Cu2+ – даже при концентрации <0.1 мкМ. Присутствие фосфат ионов (>1 мкМ) повышает люминесцентный сигнал, поэтому фосфатные буферные растворы нельзя использовать для анализа, а образцы, содержащие неизвестные количества фосфата, нельзя анализировать напрямую [62].
Хемилюминесцентное определение гидропероксидов и пероксида водорода. Пероксидное окисление липидов сопровождается хемилюминесценцией. Хемилюминесцентные методики определения гидропероксидов, характеризующиеся высокой чувствительностью, весьма перспективны [63–65]. Так, для оценки окислительного стресса в клинических условиях разработана хемилюминесцентная методика определения суммарного содержания гидропероксидов липидов, основанная на реакции их окисления в присутствии микропероксидазы и активатора хемилюминесценции изолюминола в боратном буферном растворе с рН 10.0. Предел обнаружения по гидропероксиду линолевой кислоты составляет 16 нМ. Методика использована для определения гидропероксидов липидов в липопротеинах фолликулярной жидкости и плазмы крови пациенток, проходящих процедуру экстрaкорпорального оплодотворения [66].
Разработана хемилюминесцентная методика определения гидропероксидов липидов в системе липидный субстрат–железо(II)–кумарин С-525 (активатор хемилюминесценции) [67]. Гидропероксиды липидов определяли методом добавок с помощью стандартного соединения трет-бутилгидропероксида. Предел обнаружения по трет-бутилгидропероксиду составил 164 нМ. Несмотря высокие чувствительность и селективность, метод не может быть применен для определения общего содержания гидропероксидов, поскольку эндогенные соединения, такие как убихинол и токоферолы, влияют на интенсивность хемилюминесценции [68].
В работе [29] предложена методика определения бензоилпероксида и трет-бутилпероксида по реакции каталитического окисления люминола в карбонатном буферном растворе с рН 9.9, содержащем ТРИС, миметиком пероксидазы – железо(III)–TAMЛ (комплекс железа(III) с тетраамидомакроциклическим лигандом) в различных органических средах. Изучено влияние на интенсивность хемилюминесценции и каталитическую активность комплекса железо(III)–TAMЛ четырех растворителей: ацетонитрила, диметилсульфоксида, этанола и изопропанола. Установлено, что наиболее низкие пределы обнаружения бензоилпероксида (70–100 нМ) и трет-бутилпероксида (3–90 мкМ) достигаются в присутствии этанола.
Хроматографические методы определения пероксидов с люминесцентным детектированием. Выше отмечено, что гидропероксид индивидуального липида можно определить хроматографическими методами. В работе [69], посвященной определению гидропероксида фосфатидилхолина (продукт первичного окисления фосфолипида, содержащегося в биомембранах) в плазме, используют ВЭЖХ с хемилюминесцентным детектированием. В качестве хемилюминесцентного реагента для постколоночной реакции использовали люминол, в качестве подвижной фазы – смесь метанол–изопропанол. Линейный диапазон определяемых содержаний гидропероксида составил 10–100 пмоль. Авторы работы [70] для определения гидропероксидов в сыворотке крови использовали способ, основанный на регистрации хемилюминесценции, возникающей при их взаимодействии с ферментативной системой микропероксидаза–изолюминол. Указанная индикаторная система в сочетании с ВЭЖХ позволяет не только отделить антиоксиданты сыворотки крови (мочевую кислоту, аскорбиновую кислоту, альбумин, билирубин и др.) от гидропероксидов и тем самым устранить их ингибирующее влияние на хемилюминесценцию изолюминола, но и идентифицировать природу гидропероксидов липидов. Однако, отвечая критериям высокой чувствительности и специфичности, этот способ весьма трудоемок, требует предварительной экстракции липидов из сыворотки крови, а также наличия сложной аппаратуры. Объектом исследования служили апо-В ЛП сыворотки крови больных сахарным диабетом 2-го типа. Обнаружено, что у обследованной группы больных значения уровней гидропероксидов находились в диапазоне 0.55–1.47 нмоль/мг белка.
Разработан [71] метод определения органических пероксидов и пероксида водорода с помощью ВЭЖХ с УФ-облучением и последующим пероксиоксалатным хемилюминесцентным детектированием. Органические пероксиды (бензоилпероксид, трет-бутилгидропероксид, трет-бутилпербензоат, гидропероксид кумола) подвергали УФ-облучению (254 нм, 15 Вт) для получения детектируемого пероксида водорода.-Хроматографическое разделение четырех органических пероксидов и пероксида водорода выполняли на колонке с обращенной фазой в изократическом режиме элюирования в течение 30 мин. Пределы обнаружения пероксида водорода, бензоилпероксида, трет-бутилгидропероксида, трет-бутилпербензоата и гидропероксида кумола составили 1.1, 6.8, 31.3, 7.5 и 1.3 мкМ соответственно. Эта методика апробирована в анализе пшеничной муки. Индивидуальные гидропероксиды холестерина и триацилглицерина в плазме крови определяли методом ВЭЖХ с последующим детектированием с помощью дифенил-1-пирилфосфина с пределами обнаружения 1 пмоль [72]. Для определения суммы липидных гидропероксидов в тканях мышей разного возраста (20, 30, 40, 60 и 85 нед.) флуоресцентную реакцию окисления 1-нафтилдифенилфосфина до его оксида проводили до хроматографического разделения и определения. [73, 74]. Уровень липидных гидропероксидов в органах и тканях взрослых мышей почти в два раза превышает уровень гидропероксидов в органах незрелой мыши (в возрасте 5 нед.). Также установлено, что этанол усиливает пероксидное окисление липидов и повышает концентрацию гидропероксидов холестерина в печени и мышцах крыс [75].
Методы ВЖЭХ с хемилюминесцентным, флуоресцентным способами детектирования [76–79] используют для разделения и индивидуального определения гидропероксидов в объектах со сложной матрицей. Эти методы обладают высокими чувствительностью и селективностью, однако недостаточно экспрессны и не обеспечивают полную картину окислительного стресса in vivo, требуют квалифицированного персонала и дорогостоящего оборудования.
Электрохимические методы. Все пероксиды способны электровосстанавливаться и могут быть определены электрохимически. Для электрохимического определения гидропероксидов липидов и пероксида водорода используют электроды, модифицированные берлинской лазурью [80, 81], оксидом графена с наночастицами Ag и Au, нанотрубками, наностержнями [82–84], различными полимерами [85–87], а также электроды с иммобилизованными ферментами [88–90]. Большинство оригинальных работ и обзоров посвящено электрохимическому определению пероксида водорода в различных объектах: продуктах питания, косметической продукции, дезинфицирующих чистящих средствах [91–94]. Целый ряд исследований в последнее время посвящен разработке электрохимических сенсоров для определения пероксида водорода в биологических жидкостях и клетках [95–99]. Так, например, разработан [95] биосенсор, модифицированный коферментом А и золотом(III), для определение H2O2 в сыворотке крови и моче человека, а также пероксида водорода, высвобождаемого из раковых клеток шейки матки человека. В работе [98] пероксид водорода в моче человека определяли с использованием неферментативного амперометрического сенсора с иммобилизованными наночастицами CuS на поверхности стеклоуглеродного электрода.
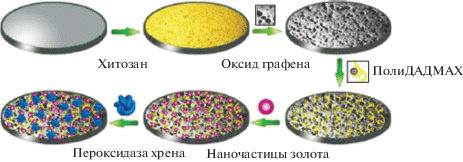
Наиболее широко используемыми модификаторами поверхности электродов, предназначенных для определения пероксида водорода, являются пероксидаза хрена и гемоглобин [100–103]. Например, для амперометрического определения H2O2. в эритролейкемических клетках человека (К526) изготовлена пленка на поверхности электрода из оксида графена, покрытая наночастицами золота и иммобилизованной пероксидазой хрена (HRP) (рис. 7). Определение клеточного пероксида водорода является важным аспектом исследования его функций в физиологии клетки [90]. Диапазон определяемых концентраций пероксида водорода составил от 0.02 до 1 мкМ, предел обнаружения 7.5 нМ. Разработанный сенсор позволяет селективно определять пероксид водорода в присутствии глюкозы, ${\text{NO}}_{3}^{ - },$ аскорбиновой кислоты и допамина. Биосенсор характеризуется высокой скоростью формирования отклика (4 с) и стабильностью (90% исходной величины аналитического сигнала сохраняется в течение 2 нед.). Ферментный электрод перед использованием хранили при пониженных температурах (4°С) в буферном растворе.
Работ по электрохимическому определению органических пероксидов значительно меньше, чем по определению пероксида водорода. Существующие электрохимические сенсоры позволяют определять пероксиды различного строения на уровне наномолярных–миллимолярных концентраций. Практически во всех случаях аналитический сигнал стабилен в течение месяца (табл. 1).
Таблица 1.
Электрохимические сенсоры для определения пероксида водорода и органических пероксидов (РЭ – рабочий электрод, мод. – модификатор)
| Определяемое соединение | Условия реакции | Электроды | Диапазон линейности, мкМ | cmin, мкМ | Литература |
|---|---|---|---|---|---|
| Пероксид водорода | 0.1 М фосфатный буферный раствор, рН 7.0, U = –0.4 В, амперометрическое детектирование | РЭ – золотой, мод. – пероксидаза и серебряные нанотрубки; стабилен 1 мес при 4°С | 0.0048–0.31 | 0.0012 | [104] |
| 0.1 М фосфатный буферный раствор, рН 7.4 (циклическая вольтамперометрия) | РЭ – стеклоуглеродный, мод. – оксид графена и берлинская лазурь | – | – | [105] | |
| 0.1 М фосфатный буферный раствор, рН 7.4, циклическая вольтамперометрия, или U = –0.4 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод. – наночастицы или пленка палладия, стабильность низкая (на 10 день хранения сигнал падает на 71%) | 10–1400, 1–1400 |
6.8, 0.3 |
[106] | |
| 50 мМ фосфатный буферный раствор, рН 7.0, U = –0.45 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод. – пленка сополимера полиметиленового голубого и флавинадениндинуклеотида, стабилен 1 мес в фосфатном буферном растворе | 0.1–960 | 0.1 | [107] | |
| U = 0.05 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод. – берлинская лазурь | 0.01–10000 | 0.01 | [108] | |
| 0.1 М фосфатный буферный раствор, рН 6.0 (4.5) U = –0.05 В, амперометрическое детектирование | РЭ – графитовый, мод. – пероксидаза хрена / пальмового дерева / сладкого картофеля | 1–700 (1–1000)/ 10–400 (10–200)/ 10–200 (10–200) |
– | [109] | |
| трет-Бутил- гидропероксид | 0.1 М фосфатный буферный раствор, рН 8.0, U = –0.45 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод – фталоцианин кобальта, стабилен 1 мес при 4°С | 26–4800 | 5 | [110] |
| Пероксид кумола, 2-бутанонпероксид, трет-бутилгидропероксид |
0.05 М фосфатный буферный раствор, рН 8.5, U = –0.70 В, амперометрическое детектирование | РЭ – платиновый, мод. – пероксидаза и поли-(винилферроцен), стабилен 5 д. при 20°С | 100–600, 25–400, 100–600 |
[111] | |
| 2-Бутанонпероксид, трет-бутил-гидропероксид | Циклическая вольтамперометрия или при U = –0.25 V хроноамперометрия | РЭ – стеклоуглеродный, мод. – пленка
на основе полимера Eastman-AQ 55D, содержащей иммобилизованную
пероксидазу и органические красители: 1) метиленовый голубой, 2) метиленовый зеленый, 3) новый метиленовый голубой N, 4) мелдолову синь, 5) N-метилфеназинметасульфат |
1) 2.5–520, 6.0–620, 2) 1.7–570, 4.7–560, 3) 3.0–467, 6.5–573, 4) 1.0–615, 4.0–675, 5) 0.4–584, 2.4–723 |
1) 1.0 3.0 2) 0.7, 2.5 3) 1.5, 3.4, 4) 0.5, 2.0, 5) 0.2, 1.0 |
[112] |
| Пероксид водорода, пероксид кумола, трет-бутилгидропероксид | 0.1 М фосфатно-цитратный буферный раствор, рН 4.0, U = –0.05 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод. –пероксидаза и поли(анилинометилферроцен) | 4–90, 10–80 (160–240), 40–240 |
– | [113] |
| 2-Бутанонпероксид, трет-бутил-гидропероксид | U = –0.05 В, амперометрическое детектирование в органических растворителях | РЭ – графитовый, мод. – пероксидаза, иммобилизованная в органогеле на основе диметилформамида и полигидроксилцеллюлозы | 8–500, 50–100 (растворитель хлороформ) |
5, 20 |
[114] |
| Лаурил пероксид, бензоил пероксид | 50 мМ фосфатный буферный раствор, циклическая вольтамперометрия, U = 0.1 В, амперометрическое детектирование | РЭ – стеклоуглеродный, мод. – пероксидаза, иммобилизованная в осмиевом редокс-полимере на основе полиаллиламина | 20–160, 0.3–4.1 (растворитель этанол (90%)) |
– | [115] |
| Бензоилпероксид | 0.1 М фосфатный буферный раствор, pH 5.2, U = 0.0 В, амперометрическое детектирование | РЭ – биосенсор, состоящий из смеси угольного порошка и кокосовых волокон, содержащих пероксидазу и фенольные соединения, стабилен 3 мес при комнатной температуре | 5–55 | – | [116] |
| Пероксид кумола | U = –0.4 В, амперометрическое детектирование в ацетонитриле | РЭ – графитовый, мод. – пероксидаза хрена, иммобилизованная в нафионе, стабильность низкая | n–700 | 100 | [117] |
| Линолеиновый пероксид | 50 мМ фосфатный буферный раствор, рН 7.0, циклическая вольтамперометрия | Одноразовый печатный электрод, РЭ – углеродный, мод. – пероксидаза с ковалентно пришитыми ферроценовыми группами, стабилен 24 ч | 5–100 | – | [118] |
Большинство разработанных электрохимических датчиков и биосенсоров апробированo в анализе водонерастворимых лосьонов для кожи и средств для окраски волос [106, 110, 113, 115], лекарственных препаратов [119] и пищевых продуктов [81]. В последние 15 лет работы, посвященные электрохимическому определению гидропероксидов в биологических жидкостях, отсутствуют. Разработанные индикаторные системы и сенсоры апробировали, вероятно, в модельных растворах. В настоящее время актуальной аналитической задачей является создание таких биосенсоров, которые могли бы стабильно и воспроизводимо работать в органических растворителях, способных растворять анализируемую липосомную биоматрицу, обладали бы высокой чувствительностью и селективностью по отношению к определяемым маркерам окислительного стресса.
* * *
Таким образом, разработка методов определения пероксидов различного строения является динамически развивающимся направлением химического анализа, клинической диагностики. Предложены разнообразные методы и подходы к определению общего содержания липидных гидропероксидов и пероксида водорода в различных биообъектах, поскольку их роль в развитии повреждений клеток определяется активностью именно пероксидной группы и мало зависит от радикала. Однако большинство разработанных методик не лишено недостатков, к которым относятся мешающее влияние матрицы, недостаточная чувствительность и воспроизводимость, ограниченный круг анализируемых объектов или недостаточная экспрессность анализа для получения достоверных результатов. Поиск новых индикаторных систем, расширение возможностей уже известных методов и методик, которые могли бы успешно применяться в средах различной полярности при минимальном мешающем влиянии компонентов биологической матрицы, остается актуальной проблемой аналитической химии.
Список литературы
Reed T.T. Lipid peroxidation and neurodegenerative disease // Free Radical Biol. Med. 2011. V. 51. № 7. P. 1302.
Gaschler M.M., Stockwell B.R. Lipid peroxidation in cell death // Biochem. Biophys. Res. Commun. 2017. V. 482. № 3. P. 419.
Niki E., Yoshida Y., Saito Y., Noguchi N. Lipid peroxidation: mechanisms, inhibition, and biological effects // Biochem. Biophys. Res. Commun. 2005. V. 338. № 1. P. 668.
Waraho T., McClements D.J., Decker E.A. Mechanisms of lipid oxidation in food dispersions // Trends Food Sci. Technol. 2011. V. 22. № 1. P. 3.
Tramutola A., Lanzillotta C., Perluigi M., Butterfield D.A. Oxidative stress, protein modification and Alzheimer disease // Brain Res. Bull. 2017. V. 133. P. 88.
Yan M.H., Wang X., Zhu X. Mitochondrial defects and oxidative stress in Alzheimer disease and Parkinson disease // Free Radical Biol. Med. 2013.V. 62. P. 90.
Catala A. An overview of lipid peroxidation with emphasis in outer segments of photoreceptors and the chemiluminescence assay // Int. J. Biochem. Cell Biol. 2006. V. 38. № 9. P. 1482.
Kinter M. Analytical technologies for lipid oxidation products analysis // J. Chromatogr. B. 1995. V. 671 P. 223.
Abuja P.M., Albertini R. Methods for monitoring oxidative stress, lipid peroxidation and oxidation resistance of lipoproteins // Clin. Chim. Acta. 2001. V. 306. № 1–2. P. 1.
Niki E. Biomarkers of lipid peroxidation in clinical material // Biochim. Biophys. Acta. 2014. V. 1840. № 2. P. 809.
Sies H. Oxidative Stress. London: Academic Press, 1985. 507 p.
Ghosh N., Das A., Chaffee S., Roy S., Sen C.K. Immunity Inflammation Health Disease. Elsevier Inc., 2018. P. 45.
Sharma P., Jha A.B., Dubey R.S., Pessarakli M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions // J. Bot. 2012. V. 2012. P. 1.
Burke K.E., Wei H. Synergistic damage by UVA radiation and pollutants // Toxicol. Ind. Health. 2009. V. 25. № 4–5. P. 219.
Тюзиков И.А. Окислительный стресс как ключевой механизм старения: патофизиологические механизмы и SMART-диагностика // Вопросы диетологии. 2017. Т. 7. № 1. С. 47.
Klaunig J.E., Wang Z. Oxidative stress in carcinogenesis // Curr. Opin. Toxicol. 2018. V. 7. P. 116.
Rogers L.K., Cismowski M.J. Oxidative stress in the lung – The essential paradox // Curr. Opin. Toxicol. 2018. V. 7. P. 37.
Crotty G.F., Ascherio A., Schwarzschild M.A. Targeting urate to reduce oxidative stress in Parkinson disease // Exp. Neurol. Part B. 2017. V. 298. P. 210.
Sies H. Hydrogen peroxide as a central redox signaling molecule in physiological oxidative stress: Oxidative eustress // Redox Biolog. 2017. V. 11. P. 613.
Ефимов А.А., Маслякова Г.Н. О роли липофусцина в инволютивных и патологических процессах // Саратовский научно-медицинский журн. 2009. Т. 5. № 1. С. 111.
Angeli J.P.F., Garcia C.C.M., Sena F., Freitas F.P., Miyamoto S., Medeiros M.H.G., Mascio P.D. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer // Free Radical Biol. Med. 2011. V. 51. № 2. P. 503.
Rahman T., Hosen I., Islam M.M.T., Shekhar H.U. Oxidative stress and human health // Adv. Biosci. Biotech. 2012. V. 3. № 7A. P. 997.
Узбеков М.Г. Перекисное окисление липидов и антиоксидантные системы при психических заболеваниях // Социальная и клиническая психиатрия. Т. 2015. № 4. С. 97.
Min B., Ahn D.U. Mechanism of lipid peroxidation in meat and meat products – A review // Food Sci. Biotechnol. 2005. V. 14. № 1. P. 152.
Джатдоева А.А., Полимова А.М., Проскурнина Е.В., Проскурнин М.А., Владимиров Ю.А. Определение липидов и продуктов их окисления методом ИК-спектроскопии // Журн. аналит. химии. 2016. Т. 71. № 6. С. 570.
Ткачук В.А., Тюрин-Кузьмин П.А., Белоусов В.В., Воротников А.В. Пероксид водорода как новый вторичный посредник // Биологические мембраны. 2012. Т. 29. № 1–2. С. 21.
Ayala A., Munoz M.F., Arguelles S. Lipid peroxidation: production, metabolism, and signaling mechanism of malondialdehyle and 4-hydroxy-2-nonenal // Oxid. Med. Cell. Long. 2014. V. 2014. P. 31.
Родионов П.В., Алиева Е.А., Сергеева Е.А., Павлова М.Е., Веселова И.А., Шеховцова Т.Н. Определение пероксида водорода и органических пероксидов в мицеллярных и водно-органических средах с использованием спектрофотометрического биосенсора на основе пероксидазы из корней хрена // Журн. аналит. химии. Т. 71. № 9. С. 971. (Rodionov P.V., Alieva E.A., Sergeeva E.A., Veselova I.A., Shekhovtsova T.N. Determination of hydrogen peroxide and organic peroxides in micellar and aqueous–organic media using a spectrophotometric biosensor based on horseradish peroxidase // J. Analyt. Chem. 2016. V. 71. № 9. P. 932.)
Demiyanova A.S., Sakharov I.Yu. High chemiluminescent activity of Fe III-TAML activator in aqueous-organic media and its use in determination of organic peroxides // Analyst. 2015. V. 140. P. 2964.
Cramer G.L., Miller J.F., Pendleton R.B., Lands W.E.M. Iodometric measurement of lipid hydroperoxides in human plasma // Anal. Biochem. 1991. V. 193. № 2. P. 204.
Pastorino A.M., Zamburlini A., Zennaro L., Maiorino M., Ursini F. Measurement of lipid hydroperoxides in human plasma and lipoproteins by kinetic analysis of proton emission // Methods Enzymol. 1991. V. 300. P. 33.
Asakawa T.M. Colorimetric determination of peroxide value with potassium iodide-silica gel reagent // J. Am. Oil Chem. Soc. 1978. V. 55. P. 619.
Hara S., Totani Y. A highly sensitive method for the micro-determination of lipid hydroperoxides by potentiometry // J. Am. Oil Chem. Soc. 1988. V. 65. P. 1948.
Gay C.A., Gebicki J.M. Measurement of protein and lipid hydroperoxides in biological systems by the ferric–xylenol orange method // Anal. Biochem. 2003. V. 315. № 1. P. 29.
Banerjee D., Madhusoodanan U.K., Sharanabasappa M., Ghosh S., Jacob J. Measurement of plasma hydroperoxide concentration by FOX-1 assay in conjunction with triphenylphosphine // Clin. Chim. Acta. 2003. V. 337. № 1–2. P. 147.
Bou R., Codony R., Tres A., Decker E.A., Guardiola F. Determination of hydroperoxides in foods and biological samples by the ferrous oxidation–xylenol orange method: a review of the factors that influence the method’s performance // Anal. Biochem. 2008. V. 377. № 1. P. 1.
Jiang Z.Y., Hunt J.V., Wolff S.P. Ferrous ion oxidation in the presence of xylenol orange for detection of lipid hydroperoxide in low density lipoprotein // Anal. Biochem. 1992. V. 202. № 2. P. 384.
Nourooz-Zadeh J. Ferrous ion oxidation in presence of xylenol orange for detection of lipid hydroperoxides in plasma // Methods Enzymol. 1991. V. 300. P. 58.
Arab K., Steghens J.P. Plasma lipid hydroperoxides measurement by an automated xylenol orange method // Anal. Biochem. 2004. V. 325. № 1. P. 158.
Santas J., Guardiola F., Rafecas M., Bou R. Determination of total plasma hydroperoxides using a diphenyl-1-pyrenylphosphine fluorescent probe // Anal. Biochem. 2013. V. 434. № 1. P. 172.
Chotimarkorn C., Nagasaka R., Ushio H., Ohshima T., Matsunaga S. Development of novel fluorescent probe 3-perylene diphenylphosphine for determination of lipid hydroperoxide with fluorescent image analysis // Biochem. Biophys. Res. Commun. 2005. V. 338. № 2. P. 1222.
Okimoto Y., Watanabe A., Niki E., Yamashita T., Noguchi N. A novel fluorescent probe diphenyl-1-pyrenylphosphine to follow lipid peroxidation in cell membranes // FEBS Lett. 2000. V. 474. P. 137.
Takahashi M., Shibata M., Niki E. Estimation of lipid peroxidation of live cells using a fluorescent probe, diphenyl-1-pyrenylphosphine // Free Radical Biol. Med. 2001. V. 31 P. 164.
Bou R., Chen B., Guardiola F., Codony R., Decker E.A. Determination of lipid and protein hydroperoxides using the fluorescent probe diphenyl-1-pyrenylphosphine // Food Chem. 2010. V. 123. № 3. P. 892.
Akasaka K., Ohrui H. Development of phosphine reagents for the high-performance liquid chromatographic–fluorometric determination of lipid hydroperoxides // J. Chromatogr. A. 2000. V. 881. № 1–2. P. 159.
Ohshima T., Hopia A., German J.B., Frankel E.N. Determination of hydroperoxides and structures by high-performance liquid chromatography with post-column detection with diphenyl-l-pyrenylphosphin // Lipids. 1996. V. 31. № 10. P. 1091.
Matot I., Manevich Y., Al-Mehdi A.-B., Song C., Fisher A.B. Fluorescence imaging of lipid peroxidation in isolated rat lungs during nonhypoxic lung ischemia // Free Radical Biol. Med. 2003. V. 34. № 6. P. 785.
Germain M.E., Knapp M.J. Turn-on fluorescence detection of H2O2 and TATP // Inorg. Chem. 2008. V. 47. № 21. P. 9748.
Coudray C., Richard M.J., Favier A.E. Determination of primary and secondary lipid peroxidation products: Plasma lipid hydroperoxides and thiobarbituric acid reactive substances // Anal. Free Radicals Biol. Syst. 1995. P. 185.
Tsai M.-C., Huang T.-L. Thiobarbituric acid reactive substances (TBARS) is a state biomarker of oxidative stress in bipolar patients in a manic phase // J. Affective Disorders. 2015. V. 173. P. 22.
Kosugi H., Kikugawa K. Potential thiobarbituric acid-reactive substances in peroxidized lipids // Free Radical Biol. Med.1989. V. 7. № 2. P. 205.
Grintzalis K., Zisimopoulos D., Grune T., Weber D., Georgiou C.D. Method for the simultaneous determination of free/protein malondialdehyde and lipid/protein hydroperoxides // Free Radical Biol. Med. 2013. V. 59. P. 27.
Маханова Р.С. К вопросу изучения перекисного окисления липидов // Известия Оренбургского государственного аграрного университета. 2011. Т. 29. № 1. С. 231.
Forman H.J., Bernardo A., Davies K.J.A. What is the concentration of hydrogen peroxide in blood and plasma? // Arch. Bioch. Biophys. 2016. V. 603. № 1. P. 48.
Lacy F., Kailasam M.T., O’Connor D.T., Schmid-Schonbein G.W., Parmer R.J. Plasma hydrogen peroxide production in human essential hypertension: Role of heredity, gender, and ethnicity // Hypertension. 2000. V. 36. P. 878.
Aune S.E., Yeh S.T., Zelinski D.P., Angelos M.G. Measurement of hydrogen peroxide and oxidant stress in a recirculating whole blood-perfused rat heart model // Resuscitation. 2011. V. 82. P. 222.
Nakahara R., Fujlmoto T., Doi M., Morita K., Yamaguchi T., Fujita Y. Fluorophotometric determination of hydrogen peroxide and other reactive oxygen species with fluorescein hydrazide (FH) and its crystal structure // Chem. Pharm. Bull. 2008. V. 56. № 7. P. 977.
Nakahara R., Kashitani S., Hayakawa K., Kitani Y., Yamaguchi T., Fujita Y. Fluorophotometric determination of hydrogen peroxide with fluorescin in the presence of cobalt(II) and reaction against other reactive oxygen species // J. Fluoresc. 2009. V. 19. № 5. P. 769.
Biswaranjan P. A modified fluorimetric method for determination of hydrogen peroxide using homovanillic acid oxidation principle // Bio. Med. Res. Int. 2014. V. 2014. P. 1
Beltyukova S.V., Vityukova E.O., Egorova A.V. Spectral luminescence properties of Eu(III) complexes with tetracycline antibiotics and hydrogen peroxide // J. Appl. Spectrosc. 2007. V. 74. № 3. P. 344.
Courrol L., Bellini M.H., Tarelho L.V.G., Silva F.R.O., Mansano R.D., Gomes L., Vieira N.D., Sho N. Urea hydrogen peroxide determination in whole blood using europium tetracycline probe // Anal. Biochem. 2006. V. 355. P. 140.
Wolfbeis O.S., Durkop A., Wu M., Lin Z. Europium ion-based luminescent sensing probe for hydrogen peroxide // Angew. Chem. Int. Ed. 2002. V. 41. P. 4495.
Jimenez A.M., Navas M.J. Chemiluminescence methods (present and future) // Grasas y Aceites. 2002. V. 53. № 1. P. 64.
Navas M.J., Jimenez A.M. Review of chemiluminescent methods in food analysis // Food Chem. 1996. V. 55. P. 7.
Rolewski P., Siger A., Nogala-Kałucka M., Polewski K. Chemiluminescent assay of lipid hydroperoxides quantification in emulsions of fatty acids and oils // Food Res. Int. 2009. V. 42. P. 165.
Проскурнина Е.В., Джатдоева А.А., Лобиченко Е.Н., Шалина Р.И., Владимиров Ю.А. Хемилюминесцентное определение гидропероксидов липидов в биологических жидкостях // Журн. аналит. химии. 2017. Т. 72. № 7. С. 639.
Волкова П.О., Алексеев А.В., Джатдоева А.А., Проскурнина Е.В., Владимиров Ю.А. Определение гидропероксидов липидов методом активированной хемилюминесценции // Вестн. Моск. ун-та. 2016. Т. 57. № 1. С. 34.
Yamamoto Y., Frei B., Ames B.N. Assay of lipid hydroperoxides using high-performance liquid chromatography with isoluminal chemiluminescence detection // Methods Enzymol. 1990. V. 186. P. 371.
Hui S., Chiba H., Sakurai T., Asakawa C., Nagasaka H., Murai T., Ide H., Kurosawa T. An improved HPLC assay for phosphatidylcholine hydroperoxides (PCOOH) in human plasma with synthetic PCOOH as internal standard // J. Chromatogr. B. 2007. V. 857. № 1. P. 158.
Теселкин Ю.О., Бабенкова И.В. Определение содержания липогидропероксидов в липопротеинах сыворотки крови с использованием системы микропероксидаза–люминол // Вестн. РГМУ. 2011. № 5. С. 54.
Wada M., Inoue K., Ihara A., Kishikawa N., Nakashima K., Kurodab N. Determination of organic peroxides by liquid chromatography with on-line post-column ultraviolet irradiation and peroxyoxalate chemiluminescence detection // J. Chromatogr. A. 2003. V. 987. P. 189.
Etsuo N. Biomarkers of lipid peroxidation in clinical material // Biochim. Biophys. Acta. 2014. V. 1840. № 2. P. 809.
Tokumaru S., Iguchi H., Kojo S. Mechanisms of ageing and development // Mech. Ageing Dev. 1996. V. 86. P. 67.
Tokumaru S., Tsukamoto I., Iguchi H., Kojo S. Specific and sensitive determination of lipid hydroperoxides with chemical derivatization into 1-naphthyldiphenylphosphine oxide and high-performance liquid chromatography // Anal. Chim. Acta. 1995. V. 307. P. 97.
Asano M., Nushid H., Adachi J., Nagasaki Y., Nakagawa K., Kuse A., Ueno Y. Lipid hydroperoxides in human plasma after ethanol consumption // Legal Med. 2009. V. 11. P. S223.
Miyazawa T., Fujimoto K., Suzuki T., Yasuda K. Determination of phospholipid hydroperoxides using luminol chemiluminescence-high-performance liquid chromatography // Methods Enzymol. 1994. V. 233. P. 324.
Yamamoto Y. Chemiluminescence-based high-performance liquid chromatography assay of lipid hydroperoxides // Methods Enzymol. 1994. V. 233. P. 319.
Meguro H., Akasaka K., Ohru H. Determination of hydroperoxides with fluorometric reagent diphenyl-1-pyrenylphosphine // Methods Enzymol. 1990. V. 186 P. 157.
.Angeli J.P.F, Garcia C.C.M., Sena F., Freitas P., Miyamoto S., Medeiros M.H.G., Mascio P.D. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells // Free Radical Biol. Med. 2011. V. 51. P. 503.
Mokrushina A.V., Heim M., Karyakina E.E., Kuhn A., Karyakin A.A. Enhanced hydrogen peroxide sensing based on Prussian Blue modified macroporous microelectrodes // Electrochem. Commun. 2013. V. 29. P. 78.
Adhoum N., Monser L. Electrochemical sensor for hydroperoxides determination based on Prussian blue film modified electrode // Sens. Actuators B. 2008. V. 133. № 2. P. 588.
Chang H., Wang X., Shiu K.K., Zhu Y., Wang J., Li Q., Chen B., Jiang H. Layer-by-layer assembly of graphene, Au and poly(toluidine blue O) films sensor for evaluation of oxidative stress of tumor cells elicited by hydrogen peroxide // Biosens. Bioelectron. 2013. V. 41. P. 789.
Xiang C., Zou Y., Sun L. X., Xu F. Direct electrochemistry and electrocatalysis of cytochrome c immobilized on gold nanoparticles-chitosan-carbon nanotubes-modified electrode // Talanta. 2007. V. 74. № 2. P. 206.
Moozarm N.P., Lorestani F., Meng W.P., Alias Y. A novel non-enzymatic H2O2 sensor based on polypyrrole nanofibers–silver nanoparticles decorated reduced graphene oxide nano composites // Appl. Surf. Sci. 2015. V. 332. P. 648.
Koodlur L.S. Layer-by-layer self assembly of a water-soluble phthalocyanine on gold. Application to the electrochemical determination of hydrogen peroxide // Bioelectrochemistry. 2013. V. 91. P. 21.
Pillay J., Ozoemena K.I. Layer-by-layer self-assembled nanostructured phthalocyaninatoiron(II)/SWCNT-poly(m-aminobenzenesulfonic acid) hybrid system on gold surface: Electron transfer dynamics and amplification of H2O2 response // Electrochim. Acta. 2009. V. 54. № 22. P. 5053.
Dontsova E.A., Zeifman Y.S., Budashov I.A., Eremenko A.V., Kalnov S.L., Kurochkin I.N. Screen-printed carbon electrode for choline based on MnO2 nanoparticles and choline oxidase/polyelectrolyte layers // Sens. Actuators B. 2011. V. 159. № 1. P. 261.
Campanella L., Giancola D., Gregori E., Tomassetti M. Determination of hydroperoxides in nonaqueous solvents or mixed solvents, using a biosensor with two antagonist enzymes operating in parallel // Sens. Actuators B. 2003. V. 95. P. 321.
Lin X.Q., Chen J., Chen Z.H. Amperometric biosensor for hydrogen peroxide based on immobilization of horseradish peroxidase on methylene blue modified graphite electrode // Electroanalysis. 2000. V. 12. № 4. P. 306.
Chunmei Y., Wanga L., Lia W., Zhub C., Baoa N., Gua H. Detection of cellular H2O2 in living cells based on horseradish peroxidase at the interface of Au nanoparticles decorated graphene oxide // Sens. Actuators B. 2015. V. 211. P. 17.
Ahammad S. Hydrogen peroxide biosensors based on horseradish peroxidase and hemoglobin // J. Biosens. Bioelectron. 2013. P. S9.
Kogularasu S., Govindasamy M., Chen S.-M., Mani V. 3D graphene oxide-cobalt oxide polyhedrons for highly sensitive non-enzymatic electrochemical determination of hydrogen peroxide // Sens. Actuators B. 2017. V. 253. P. 773.
Ensafi A.A., Rezaloo F., Rezaei B. Electrochemical sensor based on porous silicon/silver nanocomposite for the determination of hydrogen peroxide // Sens. Actuators B. 2016. V. 231. P. 239.
Zhang R., Chen W. Recent advances in graphene-based nanomaterials for fabricating electrochemical hydrogen peroxide sensors // Biosens. Bioelectron. 2017. V. 89. P. 249.
Hu Y., Zhang Q., Guo Z., Wang S. CoA-dependent coordination polymer as a novel electrochemical sensing platform for sensitive detection of hydrogen peroxide in biological environments // J. Electroanal. Chem. 2017. V. 801. P. 306.
Wang T., Zhu H., Zhuoj J., Zhu Z., Papakonstantinou P., Lubarsky G., Lin J., Li M. Biosensor based on ultrasmall MoS2 nanoparticles for electrochemical detection of H2O2 released by cells at the nanomolar level // Anal. Chem. 2013. V. 85. № 21. P. 10289.
Ben-Amor S., Vanhovec E., Belaidi F.S., Charlot S., Colin D., Rigoulet M., Devin A., Sojic N., Launay J., Temple-Boyer P., Arbault S. Enhanced detection of hydrogen peroxide with platinized microelectrode arrays for analyses of mitochondria activities // Electrochim. Acta. 2014. V. 126. P. 171.
Dutta A.K., Das S., Samanta P.K., Roy S., Adhikary B., Biswas P. Non–enzymatic amperometric sensing of hydrogen peroxide at a CuS modified electrode for the determination of urine // Electrochim. Acta. 2014. V. 144. P. 282.
Chatterjee S., Chen A. Functionalization of carbon buckypaper for the sensitive determination of hydrogen peroxide in human urine // Biosens. Bioelectron. 2012. V. 35. № 1. P. 302.
Deng K.Q., Zhou J.H., Li X.F. Noncovalent nanohybrid of ferrocene with chemically reduced graphene oxide and its application to dual biosensor for hydrogen peroxide and choline // Electrochim. Acta. 2013. V. 95. P. 18.
Liu X., Luo L., Ding Y., Xu Y., Li F. Hydrogen peroxide biosensor based on the immobilization of horseradish peroxidase on Al2O3 nanoparticles/chitosan film-modified electrode // J. Solid State Electrochem. 2011. V. 15. P. 447.
Lu L.M., Qiu X.L., Zhang X.B., Shen G.L., Tan W.H., Yu R.Q. Supramolecular assembly of enzyme on functionalized graphene for electrochemical biosensing // Biosens. Bioelectron. 2013. V. 45. P. 102.
Wang Y., Hasebe Y. Carbon felt-based bioelectrocatalytic flow-through detectors: highly sensitive amperometric determination of H2O2 based on a direct electrochemistry of covalently modified horseradish peroxidase using cyanuric chloride as a linking agent // Sens. Actuators B. 2011. V. 155. P. 722.
Song M.-J., Hwang S.W., Whang D. Amperometric hydrogen peroxide biosensor based on a modified gold electrode with silver nanowires // J Appl. Electrochem. 2010. V. 40. P. 2099.
Farah A.M., Thema F.T., Dikio E.D. Electrochemical detection of hydrogen peroxide based on graphene oxide Prussian Blue modified glassy carbon electrode // Int. J. Electrochem. Sci. 2012. V. 7. P. 5069.
Kitte S.A., Assresahegn B.D., Soreta T.R. Electrochemical determination of hydrogen peroxide at a glassy carbon electrode modified with palladium nanoparticles // J. Serb. Chem. Soc. 2013. V. 78. № 5. P. 701.
Lin K.-C., Yin C.-Y., Chen S.-M. An electrochemical biosensor for determination of hydrogen peroxide using nanocomposite of poly(methylene blue) and FAD hybrid film // Sens. Actuators B. 2011. V. 157. P. 202.
Puganova E.A., Karyakin A.A. New materials based on nanostructured Prussian blue for development of hydrogen peroxide sensors // Sens. Actuators B. 2005. V. 109. P. 167.
Alpeeva I.S., Niculescu-Nistor M., Leon J.C., Csoregi E., Sakharov I.Y. Palm tree peroxidase-based biosensor with unique characteristics for hydrogen peroxide monitoring // Biosens. Bioelectron. 2005. V. 21. P. 742.
Cui L., Chen L., Xu M., Su H., Ai S. Nonenzymatic amperometric organic peroxide sensor based on nano-cobalt phthalocyanine loaded functionalized graphene film // Anal. Chim. Acta. 2012. V. 712. P. 64.
Gundogan-Paul M., Celebi S.S., Ozyoruk H., Yıldız A. Amperometric enzyme electrode for organic peroxides determination prepared from horseradish peroxidase immobilized in poly(vinylferrocenium) film // Biosens. Bioelectron. 2002. V. 17. P. 875.
Haiying L., Shaohua Y., Yiqin Q., Zhaojin W. Amperometric biosensors sensitive to organic peroxides based on immobilization of redox organic dyes and horseradish peroxidase in polyester ionomer film // J. Shanghai University. 1998. V. 2. № 4. P. 320.
Mulchandani A., Wang C.L., Weetall H.H. Amperometric detection of peroxides with poly(anilinomethylferrocene)-modified enzyme electrodes // Anal. Chem. 1995. V. 67. P. 94.
Guo Y., Dong S. Organic phase enzyme electrodes based on organohydrogel // Anal. Chem. 1997. V. 69. P. 1904.
Baldini E., Dall O.V.C., Danilowicz C., Rezzano I., Calvo E.J. Amperometric detection of peroxides using peroxidase and porphyrin biomimetic modified electrodes // Electroanalysis. 2002. V. 14. P. 1157.
Kozan J.V.B., Silva R.P., Serrano S.H.P., Lima A.W.O., Angnes L. Amperometric detection of benzoyl peroxide in pharmaceutical preparationsusing carbon paste electrodes with peroxidases naturally immobilized on coconut fibers // Biosens. Bioelectron. 2010. V. 25. P. 1143.
Dimcheva N., Horozova E. Horseradish peroxidase-based organic-phase enzyme electrode // Anal. Bioanal. Chem. 2005. V. 382. P. 1374.
Tsai W.-C., Cass A.E.G. Ferrocene-modified horseradish peroxidase enzyme electrodes. A kinetic study on reactions with hydrogen peroxide and linoleic hydroperoxide // Analyst. 1995. V. 120. P. 2249.
Wang J., Lin Y., Chen L. Organic-phase biosensors for monitoring phenol and hydrogen peroxide in pharmaceutical antibacterial products // Analyst. 1993. V. 118. P. 277.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии