Журнал аналитической химии, 2019, T. 74, № 6, стр. 421-425
Характеристические профили биологически активных веществ образцов плазмы крови больных туберкулезом, полученные методом ВЭЖХ
С. А. Соловьёва 1, Е. А. Бессонова 1, Л. А. Карцова 1, *
1 Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Старый Петергоф, Университетский просп., 26, Россия
* E-mail: kartsova@gmail.com
Поступила в редакцию 15.02.2018
После доработки 24.10.2018
Принята к публикации 24.10.2018
Аннотация
Методами жидкостной хромато-масс-спектрометрии идентифицированы токсичные метаболиты (N-ацетилизониазид, пиразиноевая кислота, дезацетилрифампицин) противотуберкулезных препаратов основного ряда (этамбутола, пиразинамида, рифампицина, изониазида), что важно при подборе требуемых дозировок этих лекарств для максимального терапевтического воздействия и снижения побочных эффектов. Получены и обработаны методами главных компонент и k-ближайших соседей характеристические хроматографические профили образцов плазмы крови доноров с туберкулезом легких (“патология”) и клинически здоровой группы (“норма”). Показана перспективность такого подхода для получения дополнительного диагностического критерия туберкулеза легких.
Туберкулез (ТБ) и в XXI веке остается одной из актуальных проблем здравоохранения во всем мире. С целью выявления специфических биомаркеров туберкулеза проводятся исследования по метаболомным профилированиям биологических образцов, позволяющие диагностировать это заболевание на ранней стадии и получать информацию о патогенезе ТБ [1–4]. Подобная тенденция использования характеристических хроматографических и/или электрофоретических профилей биологически активных веществ в биомедицине обусловлена возможностью получения диагностически важной информации: выявление конкретных патологий и поиск доминирующих биомаркеров, исследование индивидуальной восприимчивости заболевания и специфика его протекания [5, 6]. Работы в данной области относятся к направлению “метаболомика”, целью которой является изучение изменений в составе эндогенных метаболитов [7]. Эксперимент включает пробоподготовку биологических образцов, анализ методами хроматографии или капиллярного электрофореза [8] и последующую хемометрическую обработку полученных профилей, позволяющих классифицировать образцы по принципу норма/патология. Метаболомные исследования принципиальны и для оптимизации лекарственной терапии: метаболизм лекарственных средств у конкретного пациента может протекать по-разному, при этом некоторые метаболиты проявляют токсичность. Существуют и проблемы развития лекарственной устойчивости Mycobacterium tuberculosis к противотуберкулезным препаратам (ПТП), токсичности самих ПТП и их метаболитов [9, 10], что требует получения дополнительной информации о содержании этих веществ в биологических объектах.
Ранее нами разработана методика [11] одновременного определения ПТП основного ряда в образцах плазмы крови для оптимизации лекарственной терапии туберкулеза легких. Найдены условия определения пиразинамида, рифампицина и изониазида методом ион-парной ВЭЖХ с УФ-детектированием (ВЭЖХ‒УФ) и этамбутола, не содержащего хромофорных групп, методом ВЭЖХ с масс-спектрометрическим детектированием (ВЭЖХ‒МС).
Цель данного исследования − методами жидкостной хромато-масс-спектрометрии идентифицировать метаболиты ПТП основного ряда и выявить возможности хемометрической обработки получаемых хроматографических профилей для классификации образцов плазмы крови доноров с туберкулезом легких (“патология”) и клинически здоровой группы (“норма”).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и материалы. Для пробоподготовки образцов биологических жидкостей и приготовления подвижных фаз использовали ацетонитрил (для ВЭЖХ, Acros organics, Бельгия), муравьиную кислоту (х. ч., Неохим, Россия), воду деионированную (система Milli Q Synthesis). Анализируемые биологические объекты представлены образцами плазмы крови контрольной группы (12 образцов), пациентов с выявленным ТБ легких без начала лекарственной терапии (13 образцов) и на стадии лечения ПТП основного ряда (этамбутолом, пиразинамидом, рифампицином, изониазидом). Образцы плазмы крови пациентов с выявленным ТБ легких предоставлены НИИ фтизиопульмонологии (Санкт-Петербург).
Аппаратура и программное обеспечение. Жидкостный хроматограф Shumadzu LC-20 (Япония) с диодно-матричным детектором (SPD-M20A); жидкостный хроматограф с тройным квадрупольным масс-анализатором с ионизацией электрораспылением Shumadzu LCMS 8030 (Япония); колонка (150 × 2 мм, диаметр частиц 5 мкм) Luna C18(2) (Phenomenex, США); центрифуга Thermo Scientifiс SL16 (Thermo, США) с системой охлаждения.
Для хемометрической обработки хроматографических профилей использовали программный пакет R version 3.4.3 (The R Foundation for Statistical Computing, Австрия).
Подготовка образцов плазмы крови. Процедура подготовки образцов плазмы крови для анализа основана на ранее описанной методике определения ПТП [11] и включает осаждение белков путем добавления к образцу ацетонитрила в соотношении 1 : 3 (по объему), встряхивание в течение 2 мин, центрифугирование для отделения образовавшегося осадка в течение 10 мин (10 000 об./мин) при 4°С. Надосадочную жидкость отбирали в хроматографические виалы. Образцы плазмы крови до и после хроматографического анализа хранили при –20°С.
Условия анализа методами ВЭЖХ‒УФ и ВЭ‒ЖХ−МС/МС. Разделение выполняли в градиентном режиме элюирования с подвижной фазой 0.1%-ный водный раствор муравьиной кислоты (раствор А)–ацетонитрил (раствор Б). Программа градиентного элюирования: 5 мин – 3 об. % Б; 15 мин – 70 об. % Б; 20 мин – 70 об. % Б; 21 мин – 95 об. % Б; 25 мин – 95 об. % Б. Длина волны диодно-матричного детектора 254 нм.
Условия масс-спектрометрического детектирования метаболитов ПТП: ионизация электрораспылением (положительная полярность, напряжение на капилляре –4500 В, расход газа 15 л/мин, температура осушающего газа 250°С), режим мониторинга заданных реакций m/z 763.4 для 25-О-дезацетилрифампицина, m/z 136.1 для ацетилизониазида, m/z 107.0 для пиразиноевой кислоты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
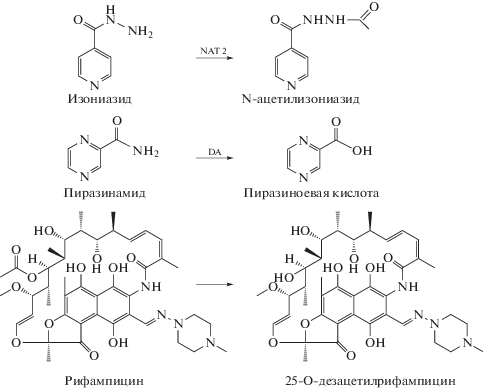
Один из режимов химиотерапии ТБ включает одновременный прием изониазида, рифампицина, пиразинамида, этамбутола. Известно, что изониазид метаболизируется в печени до токсичного N-ацетилизониазида с помощью фермента N-ацетилтрансферазы (схема 1). Активность данного фермента обусловлена генетически. У медленных инактиваторов концентрация изониазида в крови всегда значительно выше, чем у быстрых, причем в последнем случае гораздо чаще наблюдаются различные побочные реакции [12]. Токсичный метаболит пиразинамида — пиразиноевая кислота, образующаяся в печени при участии фермента деамидазы, — ингибирует почечную экскрецию мочевой кислоты.
Рифампицин метаболизируется в печени путем деацетилирования с образованием метаболита дезацетилрифампицина, который является причиной таких побочных процессов, как гепатотоксичность, проявление аллергических реакций и т.д. [13, 14] Данную информацию необходимо учитывать в практике клинической медицины.
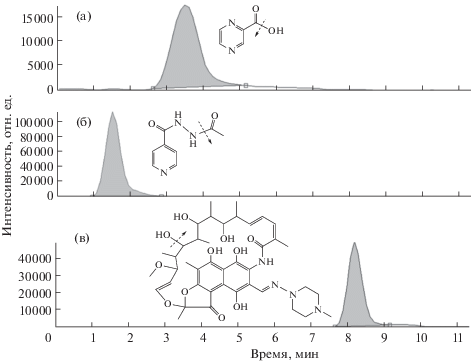
Нами проведен поиск возможных метаболитов ПТП методом обращенно-фазовой (ОФ) ВЭЖХ с МС-детектированием в режиме сканирования (m/z 100–900) в образцах плазмы крови доноров, находящихся на стадии лечения. Условия пробоподготовки и анализа образцов плазмы крови совпадают с условиями определения ПТП и их метаболитов [11], что дает возможность дальнейшего одновременного исследования метаболических профилей и детектирования остаточных количеств ПТП. По выделенным молекулярным ионам обнаружены следующие метаболиты: N-ацетилизониазид, пиразиноевая кислота, 25-O-дезацетилрифампицин. Наличие указанных соединений подтверждают результаты хромато-масс-спектрометрического анализа экстрактов плазмы крови по характерным осколочным ионам метаболитов (рис. 1) и соответствующие масс-спе-ктры.
Схема 1. Схемы образования метаболитов противотуберкулезных препаратов в организме (NAT 2 − N-ацетилтрансфераза 2 типа, DA – деамидаза).
Рис. 1.
Хроматограмма метаболитов противотуберкулезных препаратов с масс-спектрометрическим детектированием осколочных ионов и схемы их фрагментации: (а) – пиразиноевая кислота, (б) – N-ацетилизониазид, (в) – 25-О-дезацетилрифампицин. Условия разделения и детектирования указаны в “Экспериментальной части”.
Методом ОФ ВЭЖХ в градиентном режиме элюирования со спектрофотометрическим детектированием (254 нм) получены и хемометрически обработаны характеристические профили образцов плазмы крови контрольной группы (“норма”) и доноров с выявленным ТБ легких. Такой подход может оказаться полезным при поиске независимого диагностического критерия ТБ, а также при экспресс-скрининге эффективности проводимой лекарственной терапии.
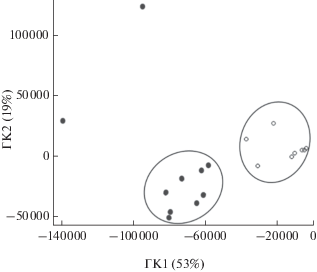
Полученные профили обрабатывали методом главных компонент (МГК), который позволяет выявить скрытую взаимосвязь между образцами и достаточно легко интерпретировать результаты. Для этой цели хроматограммы представляли в виде матрицы, где каждый ее элемент − значение интенсивности поглощения при конкретном времени удерживания с шагом 0.01 с. В матрице данных учитывали времена удерживания аналитов, начиная с пятой минуты. Данный шаг позволил не принимать во внимание неразделяемые компоненты биологического образца, слабо удерживаемые на обращенно-фазовом сорбенте и элюируемые с мертвым временем хроматографической колонки. На двумерном графике счетов МГК в координатах главных компонент ГК1 и ГК2 можно выделить кластеры “норма” и “патология” (рис. 2), причем 2 образца, принадлежащие классу “патология”, значительно отличаются от других объектов того же класса. Этот факт говорит лишь о каких-либо особенностях данных объектов (например, сопутствующее заболевание и т.п.), так как МГК не является способом классификации. Выделение четких групп образцов дает большую вероятность их отнесения к истинному классу. Значения объясненной дисперсии составили 53 и 19%.
Рис. 2.
График счетов для образцов плазмы крови здоровых (⚪) и больных туберкулезом легких (⚫) доноров.
Для задачи классификации образцов плазмы крови как “норма” и “патология” применили метод k-ближайших соседей (k-Nearest Neighbors, kNN). Суть метода заключается в вычислении расстояния от образца до его k-ближайших соседей: объекту присваивается тот класс, к которому принадлежит большинство. Обучающий набор состоял из 18 образцов (по 9 образцов каждого класса), тестовый – из 7. Метод kNN является параметрическим методом классификации, поэтому необходимо было выбрать оптимальное число соседей. После предварительного обучения, в ходе которого каждому образцу из набора присваивалась группа норма/патология, лучшие результаты классификации достигнуты для числа соседей, равного 3. Точность для изученной независимой тестовой выборки, рассчитанная как отношение числа правильно классифицируемых образцов к их общему количеству, составила 86% (1 образец патологии неверно классифицирован как “норма”).
Список литературы
Preez I.D., Luies L., Loots D.T. Metabolomics biomarkers for tuberculosis diagnostics: current status and future objectives // Biomark. Med. 2017. V. 11. № 2. P. 179.
Eoh H. Metabolomics: A window into the adaptive physiology of Mycobacterium tuberculosis // Tuberculosis. 2014. V. 94. № 6. P. 538.
Zhong L., Zhou J., Chen X., Yin Y. Serum metabolomic study for the detection of candidate biomarkers of tuberculosis // Int. J. Clin. Exp. Pathol. 2016. V. 9. № 3. P. 3256.
Frediani J.K., Jones D.P., Tukvadze N., Uppal K., Sanikidze E., Kipiani M., Tran V.T., Hebbar G., Walker D.I., Kempker R.R., Kurani S.S., Colas R.A., Dalli J., Tangpricha V., Serhan C.N., Blumberg H.M., Ziegler T.R. Plasma metabolomics in human pulmonary tuberculosis disease: A pilot study // PLoS One. 2014. V. 9. № 10.
Gowda G.N., Zhang S., Gu H., Asiago V., Shanaiah N., Raftery D. Metabolomics-based methods for early disease diagnostics // Expert Rev. Mol. Diagn. 2008. V. 8. № 5. P. 617.
Wishart D.S. Emerging applications of metabolomics in drug discovery and precision medicine // Nat. Rev. Drug Discov. 2016. V. 15. № 7. P. 473.
Johnson C.H., Ivanisevic J., Siuzdak G. Metabolomics: beyond biomarkers and towards mechanisms // Nat. Rev. Mol. Cell Biol. 2016. V. 17. № 7. P. 451.
Карцова Л.А., Объедкова Е.В. Хроматографические и электрофоретические профили биологически активных соединений для диагностики различных заболеваний // Журн. аналит. химии. 2013. Т. 68. № 4. С. 316. (Kartsova L.A., Obedkova E.V. Chromatographic and electrophoretic profiles of biologically active compounds for the diagnosis of various diseases // J. Analyt. Chem. 2013. V. 68. № 4. P. 291.)
Palomino J.C., Martin A. Drug resistance mechanisms in Mycobacterium tuberculosis // Antibiotics. 2014. V. 3. № 3. P. 317.
Schaberg T., Rebhan K., Lode H. Risk factors for side-effects of isoniazid, rifampin and pyrazinamide in patients hospitalized for pulmonary tuberculosis // Eur. Respir. J. 1996. V. 9. P. 2026.
Бессонова Е.А., Карцова Л.А., Соловьёва С.А. Хроматографическое и хромато-масс-спектрометрическое определение противотуберкулезных препаратов основного ряда в плазме крови // Аналитика и контроль. 2016. Т. 20. № 2. С. 161.
Zhou Z., Chen L., Liu P., Shen M., Zou F. Simultaneous determination of isoniazid, pyrazinamide, rifampicin and acetylisoniazid in human plasma by high-performance liquid chromatography // Anal. Sci. 2010. V. 26. № 11. P. 1133.
Vu D.H., Koster R.A., Bolhuis M.S., Greijdanus B., Altena R.V., Nguyen D.H., Brouwers J.R., Uges D.R., Alffenaar J.W. Simultaneous determination of rifampicin, clarithromycin and their metabolites in dried blood spots using LC-MS/MS // Talanta. 2014. V. 121. P. 9.
Arbex M.A., Varella Mde C., Siqueira H.R., Mello F.A. Antituberculosis drugs: drug interactions, adverse effects, and use in special situations. Part 1: First-line drugs // J. Bras. Pneumol. 2010. V. 36. № 5. P. 626.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии