Журнал аналитической химии, 2019, T. 74, № 6, стр. 415-420
Разделение энантиомеров 2-бромбутана, 2-хлорбутана, 2-хлорпентана и бутанола-2 на неподвижной фазе на основе супрамолекулярной структуры урацила
А. Р. Нафикова 1, Д. А. Аллаярова 1, В. Ю. Гуськов 1, *
1 Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: guscov@mail.ru
Поступила в редакцию 01.01.2018
После доработки 27.03.2018
Принята к публикации 20.11.2018
Аннотация
Предложена новая хиральная неподвижная фаза на основе супрамолекулярной структуры урацила с индуцированной хиральностью. В соответствии с эффектом Кондепуди механическое размешивание приводит к формированию на поверхности сорбента слоя супрамолекулярной структуры с преобладанием одного из видов хиральных супрамолекулярных кластеров. Полученная неподвижная фаза применена для газохроматографического разделения энантиомеров 2-бромбутана, 2-хлорбутана, 2-хлорпентана и бутанола-2. Эффективность насадочной колонки длиной 1 м, заполненной модифицированным урацилом инертным носителем, составляет 200–400 теоретических тарелок. На предложенной неподвижной фазе достигнуто полное разделение при 45°С энантиомеров 2-бромбутана за 210 с, 2-хлорбутана за 180 с. Энантиомеры 2-хлорпентана удалось разделить при 60 и 65°С за 170 и 160 с соответственно. Энантиомеры бутанола-2 частично разделены при 100°С. Вероятно, энантиоселективность предложенной неподвижной фазы связана с адсорбцией одного энантиомера вне полости супрамолекулярной структуры, а другого – внутри нее.
Хиральная хроматография – один из наиболее востребованных методов аналитического и препаративного разделения энантиомеров [1, 2]. Развитие хиральной газовой хроматографии в последние десять лет связано с совершенствованием хиральных фаз на основе производных циклодекстрина, а также с использованием разнообразных хиральных наноматериалов, таких как органические полимерные материалы с молекулярными ловушками, металлорганические структуры и т.д. Хиральные фазы на основе наноматериалов могут превосходить циклодекстрины в энантиоселективности и стабильности [3–6]. В связи с этим разработка новых хиральных неподвижных фаз на основе наноматериалов представляется актуальной.
Среди структурированных на наноуровне материалов выделяются двумерные супрамолекулярные структуры гетероциклических соединений. Такие структуры легко самособираются практически на любых поверхностях [7, 8] и могут образовывать упорядоченные поверхности дальнего порядка [9, 10]. Обнаружено [11–20], что даже в случае отсутствия в исходных мономерах источника хиральности при формировании супраструктуры возможно индуцирование хиральности под воздействием различных внеших факторов: поляризованного света, оптически чистого растворителя, температуры или даже размешивания. Наиболее перспективно использование формирования энантиочистых кристаллов ахиральных соединений под воздействием интенсивного размешивания (эффект Кондепуди) [21–25]. Ранее показано, что данный эффект может быть применен и к двумерным супрамолекулярным структурам. Полученные адсорбенты показали высокую энантиоселективность как по отношению к успешно разделенным ранее рацематам ментола, лимонена, камфена и камфоры [26], так и по отношению к рацематам 2-хлорбутана и 2-бромбутана [27]. Последние рацематы являются одними из наиболее сложных для разделения. Полученные на неподвижной фазе на основе циануровой кислоты [27] коэффициенты селективности многократно превосходят таковые как на традиционных [28], так и на новых [29] хиральных неподвижных фазах.
Урацил, так же как и циануровая кислота, способен образовывать супрамолекулярные структуры. В зависимости от природы модифицируемой поверхности и количества наносимого вещества урацил образует на поверхности супраструктуры ленточного или сетчатого типа с полостью размером около 7 Å [30–34]. Ранее получены данные [26] о способности поверхностей, модифицированных урацилом, к хиральному распознаванию оптических изомеров камфена, камфоры, лимонена и ментола.
В настоящей работе изучена возможность разделения энантиомеров 2-замещенных галогеналканов на адсорбенте, модифицированном в режиме индуцирования хиральности супрамолекулярной структурой урацила.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходным адсорбентом являлся Inerton N с удельной поверхностью 0.4–0.65 м2/г и размером частиц 0.200–0.250 мм (Chemapol, Чехия). В качестве модификатора поверхности использовали урацил (Авилон-Компанихим, Россия, CAS № 66-22-8), дополнительно очищенный двукратной перекристаллизацией из водного раствора. В качестве растворителя использовали водно-спиртовой раствор в соотношении вода–этанол 3 : 1 (по объему). Использовали дистиллированную воду, дополнительно очищенную в деионизаторе ДВ-10UV (ЦветХром, Россия), этанол х. ч., наличие примесей в котором контролировали хроматографически. Модифицировали поверхность инертного носителя по следующей методике: в 50 мл термостатируемого при 60°С растворителя вносили навеску инертного носителя Inerton N массой 6 г и перемешивали раствор со скоростью 500 об./мин. В размешиваемую суспензию медленно вводили 20 мл нагретого до 60°С раствора урацила с массой растворенного вещества 60 мг и упаривали при 60°С до момента, когда размешивание становилось невозможным. Полученный порошок модифицированного адсорбента сушили при комнатной температуре и доводили до постоянной массы в сушильном шкафу при 100–110°С. Данная методика модифицирования способствует формированию на поверхности сорбента слоя супрамолекулярной структуры с преобладанием одного вида хиральных супрамолекулярных кластеров.
Исследование проводили на газовом хроматографе Цвет-500М (Цвет, Россия) с пламенно-ионизационным детектором при расходе газа-носителя гелия (марки А, Реторта, Россия, CAS№ 7440-59-7) 4–6 мл/мин в диапазоне температур от 45 до 100°С. Использовали стальную колонку длиной 1 м и внутренним диаметром 3 мм. Колонку предварительно кондиционировали в течение 10 ч при 100°С. В качестве аналитов изучали 2-хлорбутан, 2-бромбутан, 2-хлорпентан и бутанол-2 (CAS № 78-86-4, 78-76-2, 625-29-6 и 78-92-2 соответственно; все Sigma-Aldrich, США, чистота >98%, чистоту аналитов дополнительно проверяли газохроматографически на насадочной колонке SE-30 длиной 3 м). Пробы вводили в виде разбавленных паровоздушных смесей так, чтобы количество аналита лишь немного превышало предел чувствительности детектора.
Удельные удерживаемые объемы аналитов рассчитывали по формуле:
где j – коэффициент Джеймса-Мартина, t – время удерживания, с; tm – время удерживания несорбирующегося компонента метана, с; ω – расход газа-носителя, мл/с; m – масса сорбента в колонке, г.Критерий разделения двух оптических изомеров рассчитывали по формуле:
В случае неполного разделения пиков использовали критерий разделения K2:
где h1 и h2 – высоты первого и второго пиков соответственно, hmin – минимум на кривой элюирования между пиками. В этом случае критерий разделения R рассчитывали по формуле:РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
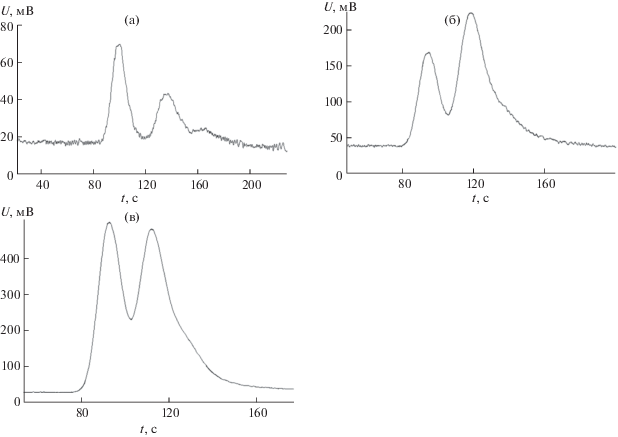
На инертном носителе InertonN, модифицированном урацилом, достигнуто разделение пар энантиомеров 2-бромбутана, 2-хлорбутана, 2‑хлорпентана и бутанола-2 в диапазоне температур 45–75 и при 100°C (рис. 1–3).
Рис. 1.
Разделение рацемата 2-бромбутана при 55°С, ω = 5.7 мл/мин (а); при 60°С, ω = 5.7 мл/мин (б).
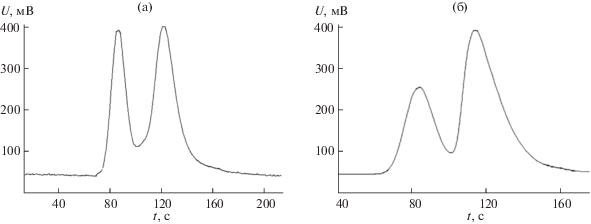
Рис. 2.
Разделение рацемата 2-хлорбутана при 45°С, ω = 4.6 мл/мин (а); при 55°С, ω = 5.0 мл/мин (б); при 60°С, ω = 5.5 мл/мин (в).

Рис. 3.
Разделение рацемата 2-хлорпентана при 60°С, ω = 5.4 мл/мин (а); при 70°С, ω = 5.2 мл/мин (б); при 75°С, ω = 5.4 мл/мин (в).
Удельные удерживаемые объемы, соответствующие им относительные стандартные отклонения, а также критерии разделения R аналитов представлены в табл. 1. Поскольку время выхода первого энантиомера равно времени выхода несорбирующегося компонента в пределах понрешности измерений и, следовательно, Vg(T) = 0, в табл. 1 представлены удельные удерживаемые объемы для второго по времени элюирования энантиомера. На исходном немодифицированном инертном носителе Inerton N удерживаемые объемы изученных аналитов равны в пределах погрешности измерений мертвому удерживаемому объему; адсорбция отсутствовала. Нулевое удерживание первого энантиомера на инертном носителе, модифицированном урацилом, также свидетельствует об отсутствии его адсорбции. Отличное от нуля удерживание второго энантиомера может наблюдаться только в случае его адсорбции в полости структуры урацила. Описанные явления подтверждают выдвинутое нами ранее [27] предположение о причинах энантиоселективности поверхности двумерных супрамолекулярных структур ахиральных соединений: один энантиомер адсорбируется в полости супрамолекулярной структуры, а другой – вне ее.
Таблица 1.
Удельные удерживаемые объемы энантиомеров Vg(T) при различных температурах, соответствующие значения sr, критерии разделения R для пар энантиомеров
| T, °C | Vg(T), мг/л | sr | R |
|---|---|---|---|
| 2-Бромбутан | |||
| 65 | 0.74 | 0.08 | 0.61 |
| 60 | 0.78 | 0.06 | 0.76 |
| 55 | 0.92 | 0.04 | 0.78 |
| 45 | 1.37 | 0.02 | 1.33 |
| 2-Хлорбутан | |||
| 65 | 0.39 | 0.06 | 0.50 |
| 60 | 0.58 | 0.07 | 0.52 |
| 55 | 0.55 | 0.06 | 0.65 |
| 45 | 0.85 | 0.04 | 1.01 |
| 2-Хлорпентан | |||
| 75 | 0.67 | 0.04 | 0.61 |
| 70 | 0.69 | 0.05 | 0.69 |
| 65 | 0.82 | 0.07 | 1.05 |
| 60 | 1.00 | 0.06 | 1.09 |
| Бутанол-2 | |||
| 100 | 4.11 | 0.12 | 0.52 |
| 17.36 | 0.28 | ||
Из табл. 1 видно, что удельные удерживаемые объемы второго энантиомера и степень разделения энантиомеров закономерно уменьшаются с увеличением температуры для всех пар энантиомеров. Для 2-бромбутана в исследованном диапазоне температур 45–65°С разделение энантиомеров максимально при 45°С. Значение R > 1 для 2‑хлорбутана также достигнуто только при 45°С. Максимальную степень разделения энантиомеров 2-хлорпентана наблюдали при 60°С. При 70°С и выше для энантиомеров 2-хлорбутана и 2‑бромбутана, и при 80°С и выше для энантиомеров 2-хлорпентана разделение энантиомеров отсутствует.
При разделении энантиомеров бутанола-2 наблюдали сильное размывание пиков вследствие образования водородных связей с урацилом. Из-за этого при 40–70°С низкая эффективность колонки не позволила достичь адекватного разделения. При повышении температуры колонки до 100°С достигнуто разделение энантиомеров бутанола-2 с R = 0.52. При более высоких температурах разделения не наблюдали. Таким образом, для соединения, имеющего гидроксильную группу в своем составе, температурный диапазон, в котором проявляется энантиоселективность, на 25 градусов выше по сравнению с 2-замещенными галогеналканами.
Воспроизводимость удерживаемых объемов близка к таковой на изученном ранее образце графитированной термической сажи, модифицированной циануровой кислотой. В исследуемом диапазоне температур эффективность метровой насадочной хроматографической колонки составила 200–400 теоретических тарелок. Полное разделение энантиомеров 2-бромбутана и 2-хлорбутана достигнуто при 45°С за 210 и 180 с соответственно, а разделение энантиомеров 2-хлорпентана за 160 с при 60°С.
* * *
Таким образом, новая хиральная неподвижная фаза на основе супрамолекулярной структуры урацила, хиральность которой индуцирована в соответствии с эффектом Кондепуди, может быть рекомендована для экспрессного разделения рацематов низкомолекулярных органических соединений.
Работа выполнена за счет гранта Российского научного фонда (проект № 17-73-10181).
Список литературы
Schurig V. Separation of enantiomers by gas chromatography // J. Chromatogr. A. 2001. V. 906. P. 275.
Гуськов В.Ю., Майстренко В.Н. Новые хиральные неподвижные фазы: получение, свойства, применение в газовой хроматографии // Журн. аналит. химии. 2018. Т. 73. № 10. С. 727.
Adly F.G., Antwi N.Y., Ghanem A. Cyclodextrin-functionalized monolithic capillary columns: Preparation and chiral applications // Chirality. 2016. V. 28. № 2. P. 97.
Zhang X., Zhang C., Sun G., Xu X., Tan Y., Wu H., Cao R., Liu J., Wu J. Cyclodextrins and their derivatives in the resolution of chiral natural products: A review // Instrum. Sci. Technol. 2012. V. 40. P. 194.
Peluso P., Mamane V., Cossu S. Homochiral metal–organic frameworks and their application in chromatography enantioseparations // J. Chromatogr. A. 2014. V. 1363. P. 11.
Cetina M., Benci K., Wittine K., Mintas M. Weak C−H⋅⋅⋅π and C−H⋅⋅⋅F interactions form higher-order supramolecular structures in cytosine and uracil (Z)-4'-benzamido-2'-butenyl derivatives // Cryst. Growth Des. 2012. V. 12. P. 5262.
ZhangH.-M., Xie Z.-X., Long L.-Sh., Zhong H.-P., Zhao W., Mao B.-W., Xu X., Zheng L.-S. One-step preparation of large-scale self assembled monolayers of cyanuric acid and melamine supramolecular species on Au(III) surfaces // J. Phys. Chem. C. 2008. V. 112. P. 4209.
Gus’kov V.Y., Gainullina Yu.Yu., Ivanov S.P., Kudasheva F.Kh. Thermodynamics of organic molecules adsorption on modified by 5-hydroxy-6-methyluracil sorbents by inverse gas chromatography // J. Chromatogr. A. 2014. V. 1356. P. 230.
Lackinger M., Heckl W.M. Carboxylic acids: Versatile building blocks and mediators for two-dimensional supramolecular self-assembly // Langmuir. 2009. V. 25. № 19. P. 11307.
Reck G., Kretschmer R.-G., Kutschabsky L., Pritzkow W. POSIT – a method for structure determination of small partially known molecules from powder diffraction data. Structureof 6- methyl-1,2,3,4-tetrahydropyrimidine-2,4-dion (6-methyluracil) // Acta Crystallogr. A. 1988. V. 44. № 4. P. 417.
Tejedor R.M., Oriol L., Serrano J.L., Ureña F.P., González J.J.L. Photoinduced chiral nematic organization in an achiral glassy nematic azopolymer // Adv. Funct. Mater. 2007. V. 17. P. 3486.
Shen Z., Wang T., Liu M. Macroscopic chirality of supramolecular gels formed from achiral tris(ethyl cinnamate) benzene-1,3,5-tricarboxamides // Angew. Chem. Int. Ed. 2014. V. 53. P. 13424.
Fujiki M. Supramolecular chirality: Solvent chirality transfer in molecular chemistry and polymer chemistry // Symmetry 2014. V. 6. P. 677.
Mineo P., Villari V., Scamporrinoa E., Micalib N. Supramolecular chirality induced by a weak thermal force // Soft Matter. 2014. V. 10. P. 44.
Vera F., Serrano J.L., Santo M.P.D., Barberi R., Rosa M.B., Sierra T. Insight into the supramolecular organization of columnar assemblies with phototunable chirality // J. Mater. Chem. 2012. V. 22. P. 18025.
Bruin A.G.D., BarbourM.E., Briscoe W.H. Macromolecular and supramolecular chirality: a twist in the polymer tales // Polym. Int. 2014. V. 63. P. 165.
Ruiz U., Pagliusi P., Provenzano C., Shibaev V.P., Cipparrone G. Supramolecular chiral structures: smart polymer organization guided by 2D polarization light patterns // Adv. Funct. Mater. 2012. V. 22. P. 2964.
Zhang L., Qin L., Wang X., Cao H., Liu M. Supramolecular chirality in self-assembled soft materials: regulation of chiral nanostructures and chiral functions // Adv. Mater. 2014. V. 26. P. 6959.
Katsonis N., Xu H., Haak R.M., Kudernac T., Tomovic Z., George S., Auweraer M.V.d., Schenning A.P.H.J., Meijer E.W., Feringa B.L., Feyter S.D. Emerging solvent-induced homochirality by the confinement of achiral molecules against a solid surface // Angew. Chem. Int. Ed. 2008. V. 47. P. 4997.
Ohta E., Sato H., Ando S., Kosaka A., Fukushima T., Hashizume D., Yamasaki M., Hasegawa K., Muraoka A., Ushiyama H., Yamashita K., Aida T. Redox-responsive molecular helices with highly condensed π-clouds // Nat. Chem. 2010. V. 3. P. 68.
Kondepudi D.K., Digits J., Bullock K. Studies in chiral symmetry breaking crystallization I: The effects of stirring and evaporation rates // Chirality. 1995. V. 7. P. 62.
Kondepudi D.K., Asakura K. Chiral autocatalysis, spontaneous symmetry breaking, and stochastic behavior // Acc. Chem. Res. 2001. V. 34. P. 946.
Kondepudi D.K. Spontaneous generation and propagation of chiral asymmetry // Int. J. Quantum Chem. 2004. V. 98. P. 222.
Kawasaki T., Suzuki K., Hakoda Y., Soai K. Achiral nucleobase cytosine acts as an origin of homochirality of biomolecules in conjunction with asymmetric autocatalysis // Angew. Chem. Int. Ed. 2008. V. 47. P. 496.
Saito Y., Hyuga H. Chirality selection in crystallization // J. Phys. Soc. Jpn. 2005. V. 74. № 2. P. 535.
Gus’kov V.Yu., Gainullina Yu.Yu., Sukhareva D.A., Sidelnikov A.V., Kudasheva F.Kh. Chiral surfaces formed by uracil, 5-hydroxy-6-methiluracil and melamin supramolecular structures // Int. J. Appl. Chem. 2016. V. 12. № 3. P. 359.
Гуськов В.Ю., Сухарева Д.А., Арсланова И.В., Мусабиров Д.Э. Газохроматографическое разделение энантиомеров 2-хлорбутана и 2-бромбутана на адсорбенте CarboblackC, модифицированном циануровой кислотой // Журн. аналит. химии. 2017. Т. 72. № 10. С. 917.
Venema A., Henderiks H., Geest R.V. The enantioselectivity of modified cyclodextrins: Studies on interaction mechanisms // J. High Resolut. Chromatogr. 1991. V. 14. P. 676.
Zhang J.-H., Xie S.-M., Chen L., Wang B.-J., He P.-G., Yuan L.-M. Homochiral porous organic cage with high selectivity for the separation of racemates in gas chromatography // Anal. Chem. 2015. V. 15. № 15. P. 7817.
Масунов А.Э., Грищенко С.И., Зоркий П.М. Влияние специфических межмолекулярных взаимодействий на кристаллическую структуру, производные и аналоги урацила // Журн. физ. химии. 1993. Т. 63. № 2. С. 221.
Stewart R.F., Jensen L.H. Redetermination of the crystal structure of uracil // Acta Crystallogr. 1967. V. 23. № 6. P. 1102.
Cavallini M., Aloisi G., Bracali M., Guidelli R. An in situ STM investigation of uracil on Ag(111) // J. Electroanal. Chem. 1998. T. 444. C. 75.
Li W.-H., Haiss W., Floate S., Nichols R.J. In-situ infrared spectroscopic and scanning tunneling microscopy investigations of the chemisorption phases of uracil, thymine, and 3-methyl uracil on Au (111) electrodes // Langmuir. 1999. T. 15. C. 4875.
Papageorgiou A.C., Fischer S., Reichert J., Diller K., Blobner F., Klappenberger F., Allegretti F., Seitsonen A.P., Barth J.V. Chemical transformations drive complex self-assembly of uracil on close-packed coinage metal surfaces // ACS Nano. 2012. V. 6. № 3. C. 2477.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



