Журнал аналитической химии, 2019, T. 74, № 6, стр. 437-444
Амперометрическое детектирование триптофана и пиридоксина на двойном планарном электроде, модифицированном наночастицами золота, в проточно-инжекционной системе
Л. Г. Шайдарова 1, И. А. Челнокова 1, М. А. Ильина 1, *, Ю. А. Лексина 1, Г. К. Будников 1
1 Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Marina_Ilina16@mail.ru
Поступила в редакцию 23.01.2018
После доработки 28.03.2018
Принята к публикации 03.12.2018
Аннотация
Разработан способ проточно-инжекционного амперометрического определения триптофана и пиридоксина на планарном электроде с электроосажденными наночастицами золота. Зависимость аналитического сигнала от концентрации триптофана и пиридоксина в логарифмических координатах линейна в интервале от 5 × 10–7 до 5 × 10–3 и от 5 × 10–8 до 5 × 10–3 М соответственно. Показана возможность одновременного амперометрического определения триптофана и пиридоксина с помощью двойного планарного электрода, модифицированного наночастицами золота, в проточно-инжекционной системе. Разработанный способ апробирован при определении триптофана и пиридоксина в лекарственных средствах.
В последние десятилетия большое внимание в фармацевтической промышленности уделяется разработке лекарственных средств, в рецептуре которых использованы биологически активные вещества, участвующие в процессах жизнедеятельности человека. Так, например, большой популярностью пользуются биологически активные добавки с высоким содержанием незаменимой аминокислоты L-триптофана (Трп) – естественного антидепрессанта [1, 2]. Нарушение метаболизма Трп может привести к образованию продуктов, способствующих развитию болезней Альцгеймера и Паркинсона. Прием Трп позволяет устранить депрессивное состояние и нарушения сна, снизить частоту перепадов настроения, раздражительности и напряжения. Кроме того, эта аминокислота используется при лечении алкогольной и никотиновой зависимостей, купирует проявления абстинентного синдрома.
В некоторых лекарственных препаратах на основе Трп присутствует пиридоксин (витамин В6), который участвует в метаболизме Трп, липидов и нуклеиновых кислот, регулирует процессы торможения и возбуждения в центральной нервной системе [3, 4]. В связи с этим разработка чувствительных и экспрессных способов определения Трп и пиридоксина как раздельно, так и при совместном присутствии является актуальной задачей.
Для определения Трп и пиридоксина наиболее часто используют хроматографию [5–7], капиллярный электрофорез и спектральные методы [8, 9]. Эти методы имеют ряд недостатков: высокую стоимость оборудования, длительность подготовки пробы, необходимость высокой квалификации специалистов, а также недостаточные селективность и чувствительность определения. В последнее время в качестве альтернативного метода определения биологически активных веществ применяют вольтамперометрию с химически модифицированными электродами (ХМЭ), дающими каталитический отклик [10–16]. Этот способ выгодно отличается от хроматографических и спектральных методов анализа высокой чувствительностью, экспрессностью, невысокой стоимостью оборудования, простотой.
Актуальное направление современной электроаналитической химии – сочетание амперометрического детектирования с анализом в потоке жидкости. Это позволяет повысить чувствительность и селективность определений, а также производительность анализа [12, 17–19]. Описаны различные способы определения Трп и пиридоксина в проточно-инжекционной системе. Для определения Трп в основном используют хемилюминесцентные детекторы [20, 21], а для определения пиридоксина – амперометрические [22, 23]. Например, электрод, модифицированный комплексом гексацианоферрата(II) железа(III), позволяет определять пиридоксин в диапазоне 1–80 мкМ [22], а электрод, модифицированный комплексом гексацианорутената(II) рутения(III), – в диапазоне 0.2–50 мкМ [23]. Примеры совместного амперометрического детектирования Трп и пиридоксина в проточно-инжекционной системе в литературе не описаны.
С целью миниатюризации электрохимической ячейки, состоящей из трех объемных электродов, в проточном анализе используют ячейки с планарными электродами, содержащими на одной поверхности рабочий, вспомогательный электроды и электрод сравнения. Для одновременного определения нескольких соединений применяют многоэлектродные системы, например планарные электроды с двумя рабочими электродами [24–26]. Использование двойных планарных электродов (ДПЭ) в качестве электрохимических детекторов для многокомпонентного анализа в условиях потока представляет несомненный интерес.
С целью разработки высокочувствительного и селективного способа определения Трп и пиридоксина изучена каталитическая активность наночастиц золота, электроосажденных на планарных электродах, при окислении Трп и пиридоксина и возможность использования каталитического отклика ХМЭ для амперометрического детектирования этих органических соединений в условиях проточно-инжекционного анализа (ПИА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклические вольтамперограммы (ЦВА) регистрировали с помощью бипотенциостата DropSens μSTAT400 (Испания) на планарном электроде (ПЭ) фирмы “DropSens” (Испания), содержащем один или два рабочих электрода площадью 0.1 и 0.06 см2 соответственно (рис. 1). Рабочие и вспомогательный электроды изготовлены из углеродной пасты, электрод сравнения – из серебряной пасты. В качестве модификатора использовали наночастицы золота, осаждение которых на поверхности ПЭ проводили методом потенциостатического электролиза по способу, описанному в работе [27]. Циклические вольтамперограммы регистрировали при скорости развертки потенциала 20 мВ/с.
Рис. 1.
Схематическое изображение проточной тонкослойной ячейки типа отражающей стенки с планарными электродами, содержащими один или два рабочих электрода: 1 – вспомогательный электрод, 2 – рабочий электрод, 3 – электрод сравнения.
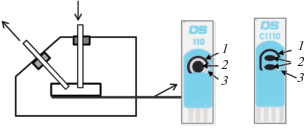
Для проточно-инжекционного анализа использовали установку, описанную в работе [28], включающую перистальтический насос PERIMAX 12 (Германия), инжектор, смеситель, электрохимическую ячейку и регистрирующее устройство – бипотенциостат DropSens μSTAT400, совмещенный с персональным компьютером. Аналит детектировали в электрохимической проточной ячейке типа “отражающей стенки” с ПЭ с одним или двумя рабочими электродами. Схема проточной тонкослойной ячейки с ПЭ представлена на рис. 1.
В качестве аналитов использовали Трп и пиридоксин (витамин B6) х. ч. фирмы “Aldrich”. Растворы этих соединений готовили растворением их точных навесок в водном растворе фонового электролита. Серии растворов меньших концентраций готовили разбавлением исходных растворов непосредственно перед измерениями. Растворы лекарственных средств готовили также растворением их точных навесок или аликвот раствора из ампул в растворе фонового электролита. В качестве фонового электролита использовали 0.1 М H2SO4.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
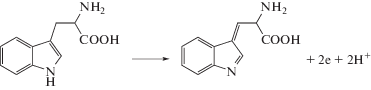
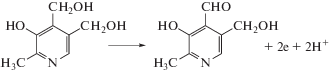
Триптофан и пиридоксин окисляются на ПЭ в кислой среде необратимо и в одной и той же области потенциалов – при Е ~ 1.0 В. Электроокисление Трп и пиридоксина обычно представляют следующими схемами [29, 30]:
Схема 1 . Окисление триптофана.
Схема 2 . Окисление пиридоксина.
С целью повышения чувствительности и селективности вольтамперометрического определения Трп и пиридоксина изучена электрокаталитическая активность наночастиц золота, электроосажденных на ПЭ (Au–ПЭ), при электроокислении этих органических соединений.
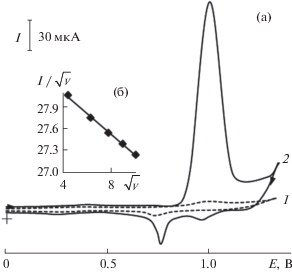
На ЦВА, полученной на электроде Au–ПЭ на фоне 0.1 М H2SO4, регистрируется одна четко выраженная пара анодно-катодных пиков (рис. 2а, кривая 1). Анодный пик наблюдается при потенциале (Еп) 0.95 В, который, вероятно, связан с образованием оксо- и гидроксоформ Au(III) [31, 32]. Восстановление этих форм наблюдается на катодной ветви ЦВА при Еп 0.72 В.
Рис. 2.
Циклические вольтамперограммы на электроде Au–ПЭ в отсутствие (1) и в присутствии (2) 5 × 10–3 М пиридоксина на фоне 0.1 М H2SO4, скорость изменения потенциала 20 мВ/с (а). Зависимость величины I/$\sqrt v $ от $\sqrt v $ при окислении пиридоксина на электроде Au–ПЭ (б).
Ранее методом атомно-силовой микроскопии показано [27], что при электроосаждении наночастиц золота в описываемых условиях формируются равномерно расположенные по всей поверхности подложки наночастиц металла одинакового размера. Большинство частиц имеет диаметр 50 нм и высоту 25 нм.
При окислении пиридоксина на Au–ПЭ на анодной ветви ЦВА наблюдается один пик при Еп 1.0 В (рис. 2а, кривая 2). Высота пика во много раз превышает пик окисления собственно модификатора и увеличивается с ростом концентрации аналита. Зависимость тока пика от скорости изменения потенциала указывает на кинетический характер окисления органического соединения (рис. 2б), т.е. свидетельствует об электродном процессе, осложненном химической реакцией. В связи с этим окисление пиридоксина на данном ХМЭ можно объяснить с позиции электрокатализа, который проявляется в уменьшении перенапряжения и увеличении тока окисления субстрата. При этом каталитический отклик электрода Au–ПЭ характеризуется высокими стабильностью и воспроизводимостью.
Установлено, что иммобилизованные наночастицы золота проявляют каталитическую активность и при окислении Трп. На анодной ветви ЦВА наблюдается пик при Еп 0.70 В, высота которого зависит от концентрации субстрата. Электроокисление Трп происходит в области потенциалов, характерных для окисления модификатора, и сопровождается многократным увеличением тока по сравнению с током окисления модификатора (рис. 2а). При этом наблюдается уменьшение перенапряжения окисления этого органического соединения на ХМЭ (Екат) по сравнению с потенциалом окисления субстрата на немодифицированном электроде (ES) (табл. 1).
Таблица 1.
Вольт-амперные характеристики электроокисления триптофана и пиридоксина (c = 5 × 10–3 М) на электроде Au–ПЭ на фоне 0.1 М H2SO4
| Органическое соединение | ES, В | Екат, В | Iкат, мкА | Iкат/Iмод |
|---|---|---|---|---|
| Триптофан | 1.10 | 0.70 | 176 | 16.0 |
| Пиридоксин | 1.15 | 1.00 | 190 | 14.1 |
Вольт-амперные характеристики электроокисления Трп и пиридоксина представлены в табл. 1. Различие в значениях потенциала электроокисления Трп и пиридоксина, видимо, связано с тем, что в роли катализатора выступают различные химические формы иммобилизованного катализатора. Каталитический эффект рассчитывали по отношению каталитического тока окисления органического соединения на ХМЭ (Iкат) к току окисления модификатора (Iмод): Iкат/Iмод.
Изучена возможность определения Трп и пиридоксина на электроде Au–ПЭ в условиях ПИА. Измерения проводили в потенциостатическом режиме. В этом случае на чувствительность аналитического сигнала влияет величина налагаемого потенциала, объем и скорость инжекции раствора. Для каждого соединения определяли электрохимические и гидродинамические условия регистрации ПИА-сигнала. На рис. 3 представлены зависимости электрокаталитического отклика электрода Au–ПЭ от налагаемого потенциала (Е) и скорости потока (u) при проточно-инжекционном амперометрическом определении Трп и пиридоксина.
Рис. 3.
Зависимость тока окисления триптофана (⚪) и пиридоксина (◆) (с = 5 × 10–3 М) на электроде Au–ПЭ от накладываемого потенциала (а) и скорости потока (б) в условиях ПИА на фоне 0.1 М H2SO4

На основании полученных экспериментальных результатов выбраны рабочие условия определения Трп и пиридоксина в ПИА: Е 0.70 и 1.10 В для Трп и пиридоксина соответственно, u = = 2.8 мл/мин. В подобранных условиях регистрировали зависимость сигнала от концентрации определяемых соединений в режиме ПИА.
Характеристики определения органических соединений представлены в табл. 2. Зависимость ПИА-сигнала от концентрации аналитов в логарифмических координатах линейна в широком интервале 5 × 10–7–5 × 10–3 и 5 × 10–8–5 × 10–3 М для Трп и пиридоксина соответственно.
Таблица 2.
Аналитические характеристики определения триптофана и пиридоксина на электроде Au–ПЭ на фоне 0.1 М H2SO4
| Аналит | Диапазон концентраций, М |
Уравнение регрессии lg I = a + blg с (I, мкА; с, М) |
R | |
|---|---|---|---|---|
| а ± Δa | b ± Δb | |||
| Триптофан | 5 × 10–7–5 × 10–3 | 3.34 ± 0.02 | 0.64 ± 0.04 | 0.996 |
| Пиридоксин | 5 × 10–8–5 × 10–3 | 4.21 ± 0.08 | 0.72 ± 0.01 | 0.990 |
При непрерывном использовании ХМЭ в условиях ПИА электрокаталитический отклик хорошо воспроизводим. Рассчитанные значения sr для отклика ХМЭ не превышают 2.0% (n = 10, P = 0.95).
Использование каталитического отклика модифицированного электрода в условиях ПИА позволяет обеспечить теоретическую производительность до 180 проб./ч (при времени отклика ХМЭ 20 с).
Разработанный способ определения Трп и пиридоксина использовали в анализе некоторых лекарственных средств. Для приготовления анализируемого раствора таблетки препарата измельчали и растирали, навеску порошка растертых таблеток растворяли в 0.1 М H2SO4 (фоновый электролит) и переносили в мерную колбу емк. 50 мл, встряхивали и разбавляли до метки этим же фоновым электролитом. Раствор тщательно перемешивали и фильтровали. При анализе раствора для инъекций аликвоту препарата помещали в мерную колбу емк. 100 мл и разбавляли до метки фоновым электролитом. Исследуемые растворы инжектировали в проточно-инжекционную систему, затем регистрировали аналитический сигнал и измеряли его высоту. Концентрацию аналита в образце определяли по градуировочному графику. Результаты определения Трп и пиридоксина в лекарственных средствах по амперометрическому отклику электрода Au–ПЭ в условиях ПИА представлены в табл. 3. Присутствие матричных компонентов (метилцеллюлоза, стеарат кальция) не мешает определению.
Таблица 3.
Результаты проточно-инжекционного амперометрического определения триптофана и пиридоксина в лекарственных препаратах на модифицированном планарном электроде с одним или двумя рабочими электродами (n = 6, P = 0.95, tтабл = 2.57)
| Лекарственное средство | Аналит | Электрод | Содержание в препарате, г (мг/мл) | Найдено, г (мг/мл) | sr |
|---|---|---|---|---|---|
| Триптофан (в таблетках), РУП “Белмедпрепараты” | Триптофан | Au–ПЭ | 0.2 | 0.200 ± 0.005 | 0.03 |
| Пиридоксин (в ампулах), ОАО “Биосинтез” | Пиридоксин | Au–ПЭ | (10) | (9.8 ± 0.4) | 0.04 |
| Пиридоксин (в ампулах), ОАО “Дальхимфарм” | Пиридоксин | Au–ПЭ | (10) | (9.7 ± 0.2) | 0.04 |
| Пиридоксин буфус (в ампулах), ПФК ЗАО “ОБНОВЛЕНИЕ” | Пиридоксин | Au–ПЭ | (50) | (47 ± 1) | 0.03 |
| Формула спокойствия Триптофан (в таблетках), ЗАО “Эвалар” | Триптофан | Au–ДПЭ | 0.50 | 0.54 ± 0.02 | 0.03 |
| Пиридоксин | Au–ДПЭ | 0.002 | 0.0021 ± 0.0001 | 0.05 |
В некоторых лекарственных средствах могут присутствовать оба исследуемых соединения, Трп и пиридоксин, поэтому представляло интерес выяснить возможность их совместного определения в условиях ПИА. Установлено, что при совместном присутствии Трп и пиридоксина на графике зависимости величины тока от потенциала регистрируются два сигнала при Еп 0.70 и 1.10 В (рис. 4а), соответствующие окислению Трп и пиридоксина на ХМЭ. Разность потенциалов пиков окисления этих соединений составляет 400 мВ, поэтому с помощью данного ХМЭ возможно одновременное определение Трп и пиридоксина в лекарственных средствах. В качестве электрохимического детектора использовали ДПЭ, который позволяет осуществлять двухкомпонентный анализ в условиях одноканального проточно-инжекционного анализа. При этом повышается селективность и экспрессность определения. Для одновременного определения Трп и пиридоксина в лекарственных средствах использовали модифицированный ДПЭ с двумя рабочими электродами, на поверхности которых иммобилизованы наночастицы золота (Au–ДПЭ). Измерения осуществляли также в потенциостатических условиях, причем сигнал Трп регистрировали на одном рабочем электроде при Е1 0.70 В, а сигнал пиридоксина – на другом рабочем электроде при Е2 1.10 В. Как видно из рис. 4б, при наложении двух различных потенциалов на электроде Au–ДПЭ параллельно регистрируются два независимых сигнала.
Рис. 4.
Зависимость тока окисления триптофана и пиридоксина (с = 5 × 10–3 М) при совместном присутствии на электроде Au–ПЭ от накладываемого потенциала (а) и на Au–ДПЭ при Е1 0.70 В и Е2 1.10 В от времени (б) в условиях ПИА на фоне 0.1 М H2SO4.
Рассмотрено взаимное влияние этих аналитов на измеряемый сигнал, регистрируемый на ХМЭ в интервалах концентраций, характерных для лекарственных препаратов (табл. 4). Для этого варьировали содержание мешающего компонента при постоянной концентрации определяемого соединения. Установлено, что как при равных, так и при разных концентрациях Трп и пиридоксина, относительное стандартное отклонение определения не превышает 5.0%.
Таблица 4.
Взаимное влияние триптофана и пиридоксина на результаты проточно-инжекционного амперометрического определения на электроде Au–ДПЭ (n = 6, P = 0.95, tтабл = 2.57)
| Аналит | Cоотношение триптофан : пиридоксин |
Введено, мМ | Найдено, мМ | Показатель правильности, % | sr |
|---|---|---|---|---|---|
| Триптофан | 1 : 1 | 5.0 | 4.9 ± 0.2 | 98 | 0.04 |
| 1 : 0.1 | 5.0 | 5.1 ± 0.1 | 102 | 0.02 | |
| Пиридоксин | 1 : 1 | 0.5 | 0.48 ± 0.02 | 96 | 0.05 |
| 10 : 1 | 0.5 | 0.50 ± 0.01 | 100 | 0.02 |
Разработанную методику использовали для одновременного амперометрического детектирования Трп и пиридоксина на ДПЭ в условиях ПИА в биологически активной добавке “Формула спокойствия Триптофан”. Результаты анализа приведены в табл. 3.
* * *
Таким образом, применение модифицированного электрода с электрокаталитическим откликом в качестве амперометрического детектора в ПИА приводит к повышению чувствительности и понижению нижней границы определяемых содержаний аналитов, а также к уменьшению перенапряжения окисления рассматриваемых соединений. Использование ДПЭ позволяет проводить многокомпонентный анализ и сократить продолжительность анализа, поскольку сигналы определяемых веществ регистрируются на двух рабочих электродах одновременно в момент попадания пробы на поверхность электрода. Предложенный способ проточно-инжекционного амперометрического определения Трп и пиридоксина на ХМЭ отличается от описанных в литературе аналогов, прежде всего, тем, что позволяет одновременно селективно определять два соединения – Трп и пиридоксин – на модифицированном ДПЭ в широком диапазоне концентраций. Достигнутые значения нижней границы определяемых концентраций (5 × 10–7 и 5 × 10–8 мкМ для Трп и пиридоксина соответственно) близки или на порядок меньше приведенных в литературе для определения этих соединений на ХМЭ [10, 11], в том числе с иммобилизованными частицами золота [15, 16]. Разработанный способ отличается простотой, высокой воспроизводимостью и экспрессностью анализа и может быть использован для раздельного и совместного определения пиридоксина и Трп в фармацевтической продукции с высокими чувствительностью и селективностью.
Работа выполнена при финансовой поддержке Казанского (Приволжского) федерального университета.
Список литературы
Грибакин С.Г., Давыдовская А.А. Триптофан, серотонин, мелатонин: нутрициология сна // Вопросы детской диетологии. 2014. Т. 12. № 4. С. 21.
Кольман Я., Рём К.-Г. Наглядная биохимия. М.: Мир, 2000. С. 469.
Быковченко И.Р. Витаминная проблема и ее решение // Журн. о российском рынке лекарств и медицинской технике. 2013. №. 10. С. 42.
Компанцева Е.В., Халата А.В., Овчаренко Л.П., Дуккардт Л.Н., Благоразумная Н.В. Анализ лекарственного препарата, содержащего изониазид и пиридоксина гидрохлорид в виде гранул // Хим.-фарм. журн. 2005. Т. 39. № 8. С. 45.
Lebiedzinska A., Marszall M.L., Kuta J., Szefer P. Reversed-phase high-performance liquid chromatography method with coulometric electrochemical and ultraviolet detection for the quantification of vitamins B1 (thiamine), B6 (pyridoxamine, pyridoxal and pyridoxine) and B12 in animal and plant foods // J. Chromatogr. A. 2007. V. 1173. № 1–2. P. 71.
Marszall M.L., Lebiedziniska A., Czarnowski W., Makarowski R., Klos M., Szefer P. Application of the high-performance liquid chromatography method with coulometric detection for determination of vitamin B6 in human plasma and serum // J. Chromatogr. B. 2009. V. 877. № 27. P. 3151.
Marszall M.L., Lebiedzinska A., Czarnowski W., Szefer P. High-performance liquid chromatography method for the simultaneous determination of thiamine hydrochloride, pyridoxine hydrochloride and cyanocobalamin in pharmaceutical formulations using coulometric electrochemical and ultraviolet detection // J. Chromatogr. A. 2005. V. 1094. № 1–2. P. 91.
Chen G., Ding X., Cao Z., Ye J. Determination of melatonin and pyridoxine in pharmaceutical preparations for health-caring purposes by capillary electrophoresis with electrochemical detection // Anal. Chim. Acta. 2000. V. 408. № 1–2. P. 249.
Sorouraddin M.-H., Rashidi M.-R., Ghorbani-Kalhor E., Asadpour-Zeynali K. Simultaneous spectrofluorimetric and spectrophotometric determination of melatonin and pyridoxine in pharmaceutical preparations by multivariate calibration methods // Il Farmaco. 2005. V. 60. № 5. P. 451.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: БИНОМ. Лаборатория знаний. 2010. С. 416.
Шайдарова Л.Г., Будников Г.К. Проблемы аналитической химии. Т. 14. Химические сенсоры. М.: Наука, 2011. С. 203.
Шайдарова Л.Г., Будников Г.К. Фармацевтический анализ. Сер. “Проблемы аналитической химии”. М.: АНРАМАК-МЕДИА, 2013. С. 580.
Zhu Ch., Yang G., Du D., Lin Y. Electrochemical sensors and biosensors based on nanomaterials and nanostructures // Anal. Chem. 2015. P. 87. № 1. P. 230.
Шайдарова Л.Г., Будников Г.К. Химически модифицированные электроды на основе благородных металлов, полимерных пленок или их композитов в органической вольтамперометрии // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1014.
Wang C., Yuan R., Chai Y., Chen S., Hu F., Zhang M. Simultaneous determination of ascorbic acid, dopamine, uric acid and tryptophan on gold nanoparticles/overoxidized-polyimidazole composite modified glassy carbon electrode // Anal. Chim. Acta. 2012. V. 741. P. 15.
Kooshki M., Abdollahi H., Bozorgzadeh S., Haghighi B. Second-order data obtained from differential pulse voltammetry: Determination of tryptophan at a gold nanoparticles decorated multiwalled carbon nanotube modified glassy carbon electrode // Electrochim. Acta. 2011. V. 56. № 24. P. 8618.
Шайдарова Л.Г., Челнокова И.А., Махмутова Г.Ф., Гедмина А.В., Дегтева М.А., Будников Г.К. Электрохимическое и проточно-инжекционное детектирование инсулина на электроде, модифицированном углеродными нанотрубками с иммобилизованными гексацианометаллатами // Аналитика и контроль. 2013. Т. 17. № 2. С. 236
Шайдарова Л.Г., Челнокова И.А., Махмутова Г.Ф., Дегтева М.А., Гедмина А.В., Будников Г.К. Проточно-инжекционное и порционно-инжекционное определение гидроксипуринов на электроде, модифицированном смешанновалентными оксидами рутения и иридия // Журн. аналит. химии. 2014. Т. 69. № 9. С. 946.
Шайдарова Л.Г., Челнокова И.А., Дегтева М.А., Махмутова Г.Ф., Лексина Ю.А., Гедмина А.В., Будников Г.К. Амперометрическое детектирование кофеина на электроде, модифицированном композитом на основе смешановалентных оксидов иридия и рутения в условиях порционно-инжекционного анализа // Хим.-фарм. журн. 2015. Т. 49. № 10. С. 49.
Chen H., Li L., Zhou M., Ma Y.J. Flow-injection chemiluminescence determination of tryptophan using galangin-potassium permanganate–polyphosphoric acid system // Chin. Chem. Lett. 2008. V. 19. № 2. P. 203.
Liang Y.D., Song J.F. Flow-injection chemiluminescence determination of tryptophan through its peroxidation and epoxidation by peroxynitrous acid // J. Pharm. Biomed. Anal. 2005. V. 38. № 1. P. 100.
Razmi H., Mohammad-Rezaei R. Flow injection amperometric determination of pyridoxine at a Prussian blue nanoparticle-modified carbon ceramic electrode // Electrochim. Acta. 2010. V. 55. № 5. P. 1814.
Шайдарова Л.Г., Давлетшина Л.Н., Будников Г.К. Проточно-инжекционное определение водорастворимых витаминов В1 В2 и В6 по электрокаталитическому отклику графитового электрода, модифицированного пленкой из гексацианорутената(II) рутения(III) // Журн. аналит. химии. 2006. Т. 61. № 5. С. 544.
Paixao T.R.L.C., Matos R.C., Bertotti M. Development of a Dual-Band Amperometric Detector for Determination of Ascorbic Acid and Glucose // Talanta. 2003. V. 61. № 5. P. 725.
Zhang H., Galal A., Rubinson J.F., Marawi I., Ridgway T.H., Lunsford S.K., Zimmer H., Mark H.B. Flow-injection amperometric detection of catechol using dual-band poly(3-methylthiophene) electrodes // Electrochim. Acta. 1998. V. 43. № 23. P. 3511.
Paixao T.R.L.C., Matos R.C., Bertotti M. Development of a dual-band amperometric detector for determination of ascorbic acid and glucose // Electroanalysis. 2003. V. 15. № 23. P. 1884.
Шайдарова Л.Г., Челнокова И.А., Дегтева М.А., Лексина Ю.А., Гедмина А.В., Будников Г.К. Порционно-инжекционное определение креатинина на электроде, модифицированном наночастицами золота // Учен. зап. Казан. ун-та. Сер. Естеств. Науки. 2014. Т. 156. № 4. С. 40.
Шайдарова Л.Г., Челнокова И.А., Лексина Ю.А., Ильина М.А., Гедмина А.В., Будников Г.К. Проточно-инжекционное амперометрическое определение дофы и тирозина на двойном электроде, модифицированном бинарной системой золото–кобальт // Журн. аналит. химии. 2018. Т. 73. № 2. С. 129.
Xia X., Zheng X.Z., Zhang Y., Zhao X., Wang C. Synthesis of Ag-MoS2/chitosan nanocomposite and its application for catalytic oxidation of tryptophan // Sens. Actuators B: Chem. 2014. V. 192. P. 42.
Солдатенков А.Т., Колядина Н.М., Шендрик И.В. Основы органической химии лекарственных веществ. М.: Химия. 2001. С. 123.
Burke L.D. The scope for new application for gold arising from the electrocatalytic behaviour of its metastable surface states // Gold Bull. 2004. V. 37. № 1–2. P. 125.
Burke L.D., Nugent P.F. The electrochemistry of gold: I The redox behaviour of the metal in aqueous media // Gold Bull. 1997. V. 30 № 2. P. 43.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии