Журнал аналитической химии, 2019, T. 74, № 7, стр. 483-526
Новые направления применения ионных жидкостей в аналитической химии. 1. жидкостная экстракция
И. В. Плетнев 1, *, С. В. Смирнова 1, Н. В. Шведене 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинский горы, 1, стр. 3, Россия
* E-mail: pletnev@analyt.chem.msu.ru
Поступила в редакцию 27.02.2018
После доработки 10.04.2018
Принята к публикации 23.12.2018
Аннотация
В первой части обзора приводятся общие сведения об ионных жидкостях (ИЖ) и короткая историческая справка, разбираются различные варианты микроэкстракционного концентрирования с применением ИЖ: экстракция в каплю, мембранная экстракция, экстракция с диспергированием растворителя, экстракция в возникающую in situ ИЖ и др. Дан обзор работ по экстракции ионов металлов и органических соединений в ИЖ для целей химического анализа. Описаны двухфазные водные системы на основе смешивающихся с водой ИЖ и высаливателей; рассмотрены примеры таких систем, их преимущества и факторы, влияющие на разделение фаз.
CОКРАЩЕНИЯ И ОБОЗНАЧЕНИЯ
Экстракционные методы:
КМЭ капельная микроэкстракция,
МЭДР микроэкстракция с диспергированием растворителя или дисперсионная жидкость‒жидкостная микроэкстракция,
МЭДР‑Т микроэкстракция с диспергированием растворителя под действием температуры,
МЭДР‑УЗ микроэкстракция с диспергированием растворителя под воздействием ультразвука,
МЭДР‑МВ микроэкстракция с диспергированием растворителя при содействии микроволнового поля,
in situ-МЭДР микроэкстракция в возникающий растворитель (в образующуюся in situ ионную жидкость)
МЭОПК микроэкстракция с отверждением плавающей капли,
ММЭ мембранная микроэкстракция,
ТФМЭ твердофазная микроэкстракция,
ДФВС двухфазные водные системы.
Методы определения:
ГХ газовая хроматография,
ГХ‒МС газовая хроматография с масс-спектрометрическим детектированием,
УВЭЖХ ультравысокоэффективная жидкостная хроматография,
КЭ капиллярный электрофорез,
ДМД диодно-матричный детектор,
УФ ультрафиолетовый детектор,
ФД флуоресцентный детектор,
МС масс-спектрометрический детектор,
ПИД пламенно-ионизационный детектор,
МС-ИСП масс-спектрометрия с индуктивно связанной плазмой,
ААС атомно-абсорбционная спектроскопия,
ПААС пламенная атомно-абсорбционная спектроскопия,
ЭТААС электротермическая атомно-абсорбционная спектроскопия,
АЭС-ИСП атомно-эмиссионная спектроскопия с индуктивно связанной плазмой,
МС/МС тандемная масс-спектрометрия,
СФ спектрофотометрия,
ХЛ хемилюминесцентная спектроскопия,
ФЛ флуоресцентная спектроскопия.
Ионные жидкости:
С1C2ImPF6 гексафторфосфат 1-этил-3-метилимидазолия,
C1С2ImBF4 тетрафторборат 1-этил-3-метилимидазолия,
C1С2ImC2SO4 этилсульфат 1-этил-3-метилимидазолия,
C1С4ImC1CO2 ацетат 1-бутил-3-метилимидазолия,
C1С4ImBr бромид 1-бутил-3-метилимидазолия,
C1C4ImPF6 гексафторфосфат 1-бутил-3-метилимидазолия,
C1С4ImN(CN)2 дицианамид 1-бутил-3-метилимидазолия,
C1С4ImCF3SO3 трифлат 1-бутил-3-метилимидазолия,
C1С4ImBF4 тетрафторборат 1-бутил-3-метилимидазолия,
C1C4ImCl хлорид 1-бутил-3-метилимидазолия,
C1C1С4ImBF4 тетрафторборат 1-бутил-2,3-диметилимидазолия,
C1C1C4ImTf2N бис(трифторметилсульфонил) имид 1-бутил-2,3-диметилимидазолия,
C1C6ImPF6 гексафторфосфат 1-гексил-3-метилимидазолия,
C1С6ImBF4 тетрафторборат 1-гексил-3-метилимидазолия,
C1С6ImTf2N бис(трифторметилсульфонил) имид 1-гексил-3-метилимидазолия,
C1C6ImFAP трис(пентафторэтил)трифторфосфат 1-гексил-3-метилимидазолия,
C1C8ImPF6 гексафторфосфат 1-октил-3-метилимидазолия,
C1С8ImCl хлорид 1-октил-3-метилимидазолия,
C1C8ImTf2N бис(трифторметилсульфонил) имид 1-октил-3-метилимидазолия,
С1C16ImTf2N бис(трифторметилсульфонил) имид 1-гексадецил-3-метилимидазолия,
C1C16ImBr бромид 1-гексадецил-3-метилимидазолия,
С4C16ImTf2N бис(трифторметилсульфонил) имид 1-гексадецил-3-бутилимидазолия,
C4C16ImBr бромид 1-гексадецил-3-бутилимидазолия,
C5C5ImPF6 гексафторфосфат 1,3-дипентилимидазолия,
C1C4PipCl хлорид 1-бутил-3-метилпиперидиния,
C1C4PyrCl хлорид 1-бутил-3-метилпирролидиния,
С4PyCl хлорид бутилпиридиния,
aC1ImBr бромид 1-аллил-3-метилимидазолия,
aC1ImСl хлорид 1-аллил-3-метилимидазолия,
N4444Cl хлорид тетрабутиламмония,
P4444Cl хлорид тетрабутилфосфония,
P4444С1SO4 метилсульфат тетрабутилфосфония,
CYPHOS® IL-101 хлорид тригексил(тетрадецил) фосфония,
TOALS N-лауроилсаркозинат тетраоктиламмония,
TOMAS салицилат триоктилметиламмония,
TOMATS тиосалицилат триоктилметиламмония.
ИОННЫЕ ЖИДКОСТИ – ОБЩАЯ ХАРАКТЕРИСТИКА
Ионные жидкости – соли, жидкие при комнатной или вообще не очень высокой температуре. Под “не очень высокой” температурой обычно понимают 100°С [1]. Эта очевидно условная граница отделяет “ионные жидкости” от “расплавов солей”. Последний термин, чаще употребляемый физико-химиками и электрохимиками, относят по большей части к жидкому состоянию привычных неорганических солей (классический пример ‒ криолит Na3AlF6 c т. пл. около 1000°С, тысячи тонн которого потребляет алюминиевая промышленность). Ионные жидкости же обычно содержат катион и/или анион органической природы11. Среди них особо выделяют ИЖ, жидкие при комнатной температуре (ИЖКТ; room-temperature ionic liquids, RTIL).
Поскольку определения ссылаются на точку плавления, следует сразу же отметить, что процессы перехода в жидкое состояние/затвердевания ИЖ отличаются сложностью и многообразием [5], а граница между твердым и жидким состоянием нередко расплывчата. Так, температуры перехода в жидкое состояние и затвердевания могут не совпадать друг с другом. Ионные жидкости часто дают переохлажденные расплавы, т.е. остаются жидкими ниже точки плавления. Такие расплавы могут затвердевать, образуя аморфные твердые вещества – стекла. Дополнительное осложнение состоит в том, что одна и та же ИЖ может иметь разные точки плавления вследствие полиморфизма кристаллических фаз. Так, популярная ИЖ С1С4ImCl кристаллизуется (как минимум) в двух формах, плавящихся при 41 и 66°C. Рентгеноструктурный анализ показал, что в кристаллах первого типа две ближние к имидазольному кольцу связи C‒C бутильного радикала находятся в транс-конформации, а в кристаллах второго типа одна из них принимает гош-конформацию [6–9].
Как указывает название, ИЖ состоят из ионов. Здесь, правда, присутствует неоднозначность: положительные и отрицательные ионы почти всегда в какой-то степени ассоциированы и вряд ли можно указать граничную степень дис(асс)оциации, разделяющую жидкости, всецело составленные из отдельных ионов и те, что содержат значительную часть ионных пар, тройников или более крупных агрегатов и кластеров. Можно было бы говорить, что ионные жидкости состоят из эквимолярных количеств положительных и отрицательных ионов и/или из их агрегатов, причем ионные формы доминируют22.
Еще одна неоднозначность терминологии связана с индивидуальностью и чистотой ИЖ. Многие ИЖ могут содержать значительное количество растворенной воды, некоторые – очень значительное. Например, полученная нами не смешивающаяся с водой ИЖ N-лауроилсаркозинат тетраоктиламмония (TOALS) содержит в равновесном состоянии 13.2 мас. % воды, что соответствует 86 мол. % [14]. Считать ли это вещество ИЖ с примесью воды или концентрированным водным раствором соли? Оба варианта ответа законны, и оба имеют недостатки. Первый выглядит странно, поскольку на каждую пару ионов “основного вещества” приходится около шести молекул “примеси” (воды). Второй вариант в этом смысле лучше; лучше он еще и потому, что физико-химические свойства раствора не зависят от того, была ли исходная соль жидкой или твердой, а представление о растворе соли правильно охватывает оба этих случая. С другой стороны, то, что водный раствор соли может не смешиваться с чистой водой, как в случае TOALS, кажется удивительным (подобные двухфазные водные системы описаны ниже). На практике выбор термина во многом диктуется обстоятельствами, контекстом; в рамках настоящего обзора мы чаще будем говорить об “ионных жидкостях”.
Кстати, присутствие примеси воды может быть критически важно для самого существования ИЖ как жидкости. Так, салицилат триоктилметиламмония (TOMAS) в отсутствие воды – твердое вещество с т. пл. 32.8°C [15]. При насыщении же водой он “разжижается”, превращается в ИЖ, не замерзающую как минимум до ‒18°C (как и TOALS, это ‒ гидрофильно-гидрофобная ионная жидкость, так как она не смешивается с водой, но равновесное содержание воды в ней велико, 59 мол. % [15, 16]).33
Данное короткое введение дает некоторое представление о тех неожиданностях и парадоксах, которые связаны с ИЖ. Это поистине необычные соединения, химия и физико-химия которых отличаются богатством и своеобразием.
Интересно и важно то, что, комбинируя разнобразные катионы и анионы, можно получать вещества с очень разными свойствами, в том числе специально ориентированными на конкретные приложения. Учитывая, как много известно органических катионов и анионов, потенциальное число ИЖ огромно. Часто приводят оценку 1018, восходящую, вероятно, к работе [18] и, конечно, имеющую мало отношения к практике. Сколько же ионных жидкостей уже известно? Нижней оценкой можно считать число ИЖ, представленных в базе данных NIST IL Thermo [19]: на середину 2017 г. их было 1707. Поскольку эта база данных основана на физико-химических работах, общую оценку числа известных ИЖ разумно увеличить в 5‒10 раз, что дает величину ~104. Это более чем на порядок больше, чем число молекулярных растворителей (260), упоминаемых в книге Маркуса [20], или число распространенных в промышленности растворителей (600, [21]).
Несмотря на всю многочисленность и разнообразие ИЖ, можно попытаться выделить их важнейшие особенности. Прежде всего, это сравнительно высокая энергия когезии, за которую ответственны электростатические силы, действующие между катионами и анионами (в ряде случаев существен и вклад ван-дер-ваальсовых взаимодействий) [22, 23]. Частицы ИЖ “удерживаются вместе” относительно сильнее, чем частицы обычных молекулярных растворителей. Высокой энергией когезии объясняется нелетучесть ИЖ44, которая, в свою очередь, приводит к типичному для ИЖ отсутствию запаха и несклонности к воспламенению (отсутствующих) паров. Этим же объясняется и обычная для ИЖ высокая вязкость; с точки зрения химика-аналитика она может быть и достоинством, и недостатком, в зависимости от приложения.
Еще одной родовой особенностью ИЖ является электропроводность, прямо следующая из ионной природы этих веществ [27] (с очевидными оговорками насчет возможной ассоциации ионов и высокой вязкости, мешающей переносу носителей заряда). Разумеется, это свойство чрезвычайно важно для электрохимии, в том числе аналитической.
Наконец, по-видимому, еще одной важной особенностью ИЖ, общей для многих представителей класса, является склонность к некоторой организации и даже наносегрегации и наногетерогенности [12] в бóльших масштабах, чем присуще обычным жидкостям, характеризующимся наличием только ближнего порядка.
В заключение дадим короткую историческую справку. По-видимому, первая ИЖ/ИЖКТ была описана российским академиком П.И. Вальденом в 1914 г. (нитрат этиламмония, т. пл. 13‒14°С) [28]. К его работе долго не проявляли интерес. Лишь через несколько десятилетий стали появляться – поначалу эпизодические – сообщения о новых ИЖ, перспективных, прежде всего, для электрохимических приложений. Краткую историю развития области вплоть до начала XXI века можно найти в работах [21, 29]. Ос-новные вехи связаны с появлением ИЖ на основе N-алкилпиридиния и анионных галогенидных комплексов алюминия [30, 31], солей N,N'-диалкилдимидазолия с анионами хлоралюмината и хлорида [32, 33], а затем – с более гидролитически стабильными анионами, в частности, тетрафторборатом [34]. На рубеже столетий началось интенсивное развитие направления. На рис. 1 показано, как по данным Web of Science (Core collection) с годами менялось число публикаций по ИЖ вообще и их применению в аналитической химии в частности 55.
Ионным жидкостям посвящено уже много книг. На наш взгляд, особенного внимания заслуживают монографии [35–41]. Работы по аналитической химии составляют существенную часть публикаций, касающихся ИЖ, так что дать общий обзор их применения в аналитической химии в журнальной статье трудно (есть уже две книги [37, 38]).
Мы остановимся на самых, на наш взгляд, новых и интересных направлениях, связанных с экстракционным выделением и разделением, а также с электрохимическими методами анализа.
Конечно, этот выбор в значительной мере предопределен собственными исследовательскими интересами авторов, однако анализ литературы его, в общем, подтверждает. Так, по данным Web of Science из 50 наиболее цитируемых работ по ИЖ в категории “аналитическая химия”, вышедших в 2014‒2015 гг. (всего их около тысячи), половину составляют публикации, посвященные экстракции (включая применение ИЖ, иммобилизованных на твердом носителе) и электрохимическому анализу (11 и 14 соответственно). Еще более выразительная картина наблюдалась в 2016 г., где их суммарная доля равна двум третям (15 и 19 из 50 соответственно).
Этим областям в целом посвящены и наши ранее опубликованные обзоры [42–45]. Здесь же мы остановимся на наиболее важных “узких” направлениях последнего времени.
В работах по экстракции рассмотрим все, что связано с микроэкстракцией и с двухфазными водными системами. Внедрение ИЖ дало мощный толчок развитию этих исследований и, пожалуй, вывело их на новый уровень. Совсем недавно появился чрезвычайно интересный и тесно связанный с обеими областями подход – микроэкстракция в возникающий растворитель. В области же электроаналитической химии самые “горячие” работы по ИЖ связаны с электрохимическими сенсорами, особенно использующими новые перспективные материалы: разнообразные наночастицы, графен и т.п.
НОВЫЕ ПОДХОДЫ В ЭКСТРАКЦИИ С ИСПОЛЬЗОВАНИЕМ ИОННЫХ ЖИДКОСТЕЙ
Микроэкстракция. Одна из основных тенденций развития аналитической химии ‒ миниатюризация: уменьшение анализируемых проб, используемых объемов и размеров приборов и устройств. Дополнительный плюс миниатюризации ‒ снижение расхода реагентов, позволяющее более свободно использовать сравнительно недешевые (а иногда и не самые “экологически дружественные”) вещества. В связи с этим в последние 10‒15 лет широкое развитие получили варианты микроэкстракции – капельная, мембранная и особенно микроэкстракция с диспергированием растворителя [46].
Общими требованиями к растворителям в микроэкстракции являются низкие растворимость в воде и летучесть [47]. Эти свойства определяют стабильность результатов и влияют на эффективность концентрирования в целом. Многие ионные жидкости как раз обладают указанными свойствами, что и определило бурный рост числа соответствующих работ. Сегодня можно уверенно сказать, что с внедрением ИЖ начался новый этап развития микроэкстракционного концентрирования [48, 49]. Полезными оказались такие свойства ИЖ, как низкое давление паров, хорошая термическая стабильность, высокая (и варьируемая) вязкость. Широкий выбор катионной/анионной составляющей ИЖ позволяет регулировать смешиваемость с водой и органическими растворителями. Вязкость ИЖ позволяет получать стабильные капли объемом до 10 мкл [50]. Важным достоинством является меньшая токсичность ИЖ по сравнению с большинством органических растворителей.
В микроэкстракции нашли применение разнообразные ИЖ с температурами плавления ниже комнатной. Чаще всего это соединения, образованные катионами 1,3-диалкилимидазолия, N-алкилпиридиния, тетраалкиламмония, тетраалкилфосфония и анионами – гексафторфосфатом, тетрафторборатом, бис(трифторметилсульфонил)имидом, перфторалкилсульфонатами, хлоридом и др.
Многообразие физико-химических свойств позволило использовать ИЖ для развития аналитических методов и специальных приложений. Особенности физико-химических свойств ИЖ способствовали развитию и совершенствованию методов жидкостной и парофазной микроэкстракции. В первую очередь это экстракция в каплю, мембранная экстракция и экстракция с диспергированием растворителя. Рассмотрим их подробнее (и дополнительно адресуем читателя к более ранним обзорам [51–54]).
Капельная микроэкстракция (КМЭ) (single drop microextraction, SDME) – один из наиболее популярных вариантов микроэкстракции, в котором объем используемого растворителя уменьшен до объема капли (от нескольких нанолитров до нескольких микролитров) [50, 51]. Экстрагирующая фаза представляет собой каплю растворителя, удерживаемую на конце иглы микрошприца. Предварительно в микрошприц отбирают определенный объем экстрагента, прокалывают прокладку виала66, помещая иглу в исследуемый раствор (вариант прямого погружения в перемешиваемый раствор, directly immersed in stirred solution, DI-SDME) либо в свободное пространство над анализируемым раствором (парофазная капельная экстракция, headspace single drop microextraction, HS-SDME). Затем поршнем аккуратно выдавливают каплю экстрагента на конце иглы. После экстракции микрокаплю втягивают обратно в шприц и переносят/вводят в прибор для определения экстрагированных соединений (чаще всего применяют методы ГХ, ГХ‒МС, ВЭЖХ, ЭТААС, КЭ).
Существует еще несколько разновидностей КМЭ. Это экстракция из капли в каплю (удобна при объемах анализируемой пробы в несколько микролитров); трехфазная жидкость‒жидкость‒жидкостная КМЭ (экстракция аналита из водной фазы в малый объем органической фазы, затем реэкстракция в каплю водной фазы, находящейся на конце иглы микрошприца, погруженной в органическую фазу) и динамический вариант экстракции [47].
Процедура КМЭ характеризуется простотой, низкой стоимостью, не требует использования сложного оборудования. Важное достоинство метода – объединение стадий концентрирования и дозирования в одном устройстве и органичное сочетание с хроматографическим анализом [47].
Применение ИЖ, обладающих высокими вязкостью и поверхностным натяжением, позволяет получить стабильные капли бóльшего объема по сравнению с традиционными растворителями [53], что способствует увеличению чувствительности последующего определения. Поскольку ИЖ обладают низким давлением паров, снижаются потери экстрагента за счет испарения в процессе экстракции. Это позволяет эффективно извлекать легколетучие соединения непосредственно из паровой фазы (парофазная капельная микроэкстракция).
Первое сообщение о применении ИЖ в КМЭ появилось в 2003 г. [55]. Авторы этой работы экстрагировали полициклические ароматические углеводороды (ПАУ) из водного раствора в каплю ИЖ с последующим определением методом ВЭЖХ. Использовали три ИЖ с анионом гексафторфосфата; эффективность экстракции ПАУ увеличивалась в ряду: C1C4ImPF6 < C1C6ImPF6 < < C1C8ImPF6. Такой порядок авторы связали с уменьшением растворимости ИЖ в воде в этом ряду. (Интересно, что увеличение расчетных коэффициентов распределения ПАУ для обычной “макроэкстракционной” системы ИЖ–вода [56] происходит в обратном порядке.) ПАУ эффективно экстрагировались в каплю ИЖ объемом 3 мкл. Стоит отметить, что объем стабильной капли традиционного для капельной экстракции растворителя – октанола-1 – составил 1 мкл. Поскольку капля ИЖ более стабильна при бóльшем объеме, оказалось возможным увеличить продолжительность концентрирования и достичь высоких коэффициентов концентрирования. Для низколетучих ПАУ вариант КМЭ с прямым погружением в перемешиваемый раствор обеспечил более высокие коэффициенты концентрирования, чем парофазная КМЭ.
Позже объем капли экстрагента удалось дополнительно увеличить (до 10 мкл) за счет увеличения диаметра используемого капилляра, что позволило достичь высоких степеней извлечения алкилфенолов (>90%) [50], хлорированных анилинов (>80%) [57] из природных и сточных вод. Низкие пределы обнаружения производных анилина получены за счет эффективного микроконцентрирования в 10 мкл C1C4ImPF6 в варианте парофазной КМЭ при 90°С, благодаря стабильности капли экстрагента и высокому сродству ИЖ к извлекаемым соединениям.
Ионные жидкости в качестве экстрагентов использовали в КМЭ для извлечения хлорсодержащих и ароматических углеводородов [58], ПАУ, бензола, толуола, этилбензола [59], фталатов, ароматических аминов [60, 61], фенолов [62, 63], пестицидов [64] и гербицидов [65]. Найдено, что из ряда исследованных в работе ИЖ с анионом гексафторфосфата [59] C1C8ImPF6 обладает наилучшей экстрагирующей способностью по отношению к бензолу, толуолу, этилбензолу и ксилолам. Оптимальная температура экстракции равна 30°С; дальнейшее повышение температуры до 80°С приводит к снижению степени извлечения. Аналогичная тенденция отмечена и в ряде других работ. Авторы связывают ее с возможным уменьшением коэффициентов распределения с ростом температуры, а также с увеличением давления и концентрации молекул воды в паровой фазе, мешающих переносу в нее определяемых соединений [59, 64].
Для хроматографического определения веществ в концентрате важно, чтобы экстрагент был совместим с подвижной фазой. Использование в качестве экстрагента ИЖ в ряде случаев требует доработки системы ввода пробы с целью переноса экстрагируемых соединений из фазы ИЖ (за счет термической десорбции) в газовый хроматограф и предотвращения поступления самой ИЖ в разделительную колонку и загрязнения колонки [58, 59, 66].
При определении методом ВЭЖХ микрокаплю со сконцентрированными примесями после КМЭ вводят непосредственно в колонку хроматографа. Скрининг важных экотоксикантов ‒ ароматических углеводородов, ПАУ, фталатов, ароматических аминов, фенолов и гербицидов – проводили [65], анализируя полученный в ходе микроконцентрирования экстракт. Коэффициенты концентрирования изученных соединений находились в диапазонах 5–168 при экстракции в C1C4ImPF6 (5 мкл, время экстракции 15 мин) и 4–178 при экстракции в C1C8ImPF6 (5 мкл, 30 мин). Увеличение продолжительности экстракции при использовании C1C8ImPF6 авторы связывают с более высокой вязкостью этой ИЖ. Достигнуто количественное извлечение ряда фосфорорганических пестицидов [64]. Степени извлечения увеличивались с ростом ионной силы (до 35% хлорида натрия) и с повышением температуры до 70°С. Стабильность капли C1C4ImPF6 резко снижалась при объеме капли выше 10 мкл. В оптимальных условиях получены низкие пределы обнаружения определяемых соединений (табл. 1).
Таблица 1.
Применение ионных жидкостей в капельной микроэкстракции
| Определяемые соединения | Объект исследования | Ионная жидкость | Объем экстрагента, мкл | Метод определения | Предел обнаружения, мкг/л | Коэффициент концентри-рования | Литература |
|---|---|---|---|---|---|---|---|
| ПАУ | Вода | C1C8ImPF6 | 3 | ВЭЖХ-УФ | – | 42–168 | [55] |
| 4-Нонилфенол, 4-трет-октилфенол |
Вода | C1C6ImPF6 | 10 | ВЭЖХ-ФД | 0.3–0.7 | 130–163 | [50] |
| Хлоранилин | Вода | C1C4ImPF6 | 10 | ВЭЖХ-УФ | 0.5–1.0 | – | [57] |
| Дихлорметан, п-ксилол, н-ундекан |
Вода | C1C4ImPF6 | 2 | ГХ‒МС | 2.6–15.6 | – | [58] |
| Ароматические амины | Вода | C1C6ImPF6 | 15 | ГХ‒МС | 12.5 | 132–186 | [60] |
| Ароматические амины | Вода | C1C4ImPF6 | 10 | ВЭЖХ-УФ | 0.09–0.38 | 13.7–116.3 | [61] |
| Бензол, толуол, этилбензол, ксилолы | Природная, питьевая вода | C1C8ImPF6 | 2 | ГХ‒МС | 0.022–0.091 | [59] | |
| Фенолы | Вода | C1C4ImPF6 | – | ВЭЖХ-УФ | 0.3–0.5 | 17.2–160.7 | [62] |
| Фенолы | Вода | C1C4ImPF6 | 2.4 нл | КЭ-УФ | 0.05 нг/л | – | [63] |
| Пестициды | C1C4ImPF6 | 10 | ВЭЖХ-УФ | 0.05–0.08 | [64] | ||
| Ароматические углеводороды, ароматические амины, гербициды, фенолы, фталаты, ртутьорганические соединения |
Вода | C1C4ImPF6 | 5 | ВЭЖХ-УФ | – | 5–168 | [65] |
| C1C8ImPF6 | 4–178 | ||||||
| 2,4,6-Трихлоранизол | Вода Вино |
C1C6ImTf2N | 2 | ВЭЖХ‒МС | 0.2 нг/л | – | [67] |
| Индометацин, напроксен |
Моча | C1C4ImPF6 | 50 | ВЭЖХ-УФ | 38 70 |
– | [68] |
| Тиоридазин, левомепромазин |
Моча | C1C4ImPF6 | 50 | ВЭЖХ-УФ | 21 60 |
– | [69] |
| Hg2+, ртутьорганические соединения | Вода | C1C6ImPF6 | 4 | ВЭЖХ-ДМД | 1.0–22.8 | 3–31 | [70] |
| Cd2+ | Вода (речная, водопроводная) | C1C4ImPF6 | 20 | ЭТААС | 0.015 | 42 | [71] |
| Pb2+ | Вода, пищевые продукты | C1C4ImPF6 | 7 | ЭТААС | 0.015 | 76 | [72] |
В большинстве работ по КМЭ используют гексафторфосфатные ИЖ. Ионная жидкость с анионом бистрифлилимида впервые использована в работе [67]. Помимо высокой экстрагирующей способности, она удовлетворяла требованиям последующего детектирования – не давала матричных эффектов при определении методом спектроскопии ионной подвижности. 2,4,6-Трихлоранизол экстрагировали в варианте парофазной КМЭ. Оптимальная температура экстракции 50°С, продолжительность экстракции не превышала 30 мин. Степень извлечения увеличивалась с увеличением ионной силы (экстракцию проводили при концентрации хлорида натрия 350 г/л).
Нестабильность капли – один из главных недостатков, ограничивающих применение КМЭ в сочетании с ВЭЖХ. Малый размер капли (на уровне микролитров) не всегда обеспечивает высокую чувствительность при хроматографическом определении. Динамический вариант КМЭ предложен для эффективной экстракции нестероидных противовоспалительных препаратов и фенотиазиновых производных из биологических жидкостей [68, 69]. Для контроля объема капли и скорости потока аналитов предложено специально изготовленное устройство, благодаря которому удалось увеличить объем капли до 50 мкл и повысить чувствительность определения.
Высокая чувствительность определения фенолов (4-хлорфенола, 2-нитрофенола и 3-нитрофенола) достигнута при сочетании в режиме реального времени КМЭ с капиллярным электрофорезом [63]. Количественная экстракция фенолов в каплю C1C4ImPF6 малого объема (2.4 нл), находящуюся непосредственно на конце погруженного в анализируемый раствор капилляра, достигалась за 10 мин с высокими коэффициентами концентрирования (107–156).
Экстракция ионов металлов в варианте КМЭ описана в работах по определению ртути в водных растворах [70], свинца в пищевых продуктах [72], кадмия в пищевых продуктах и в воде [71]. Свинец и кадмий в присутствии пирролидиндитиокарбамата аммония количественно экстрагировали из образцов природной воды в каплю ИЖ C1C4ImPF6 [71, 72]. Экстракт, содержащий комплекс свинца, вводили непосредственно в графитовую печь для определения методом ЭТААС. В оптимальных условиях предел обнаружения и коэффициент концентрирования свинца составили 0.015 мкг/л и 76 соответственно. После экстракции кадмия в каплю объемом 20 мкл экстракт разбавляли тетрагидрофураном до 100 мкл для снижения матричных помех при последующем определении. Аликвоту 10 мкл вводили в электротермический атомизатор (вольфрамовая нить). В оптимальных условиях предел обнаружения и коэффициент концентрирования кадмия составили 0.015 мкг/л и 42 соответственно [71].
Ртуть(II) и ртутьорганические соединения определяли в виде дитизонатных комплексов методом ВЭЖХ после КМЭ в каплю ИЖ объемом 4 мкл. Показано, что из трех изученных ИЖ (C1C4ImPF6, C1C6ImPF6, C1C8ImPF6) только C1C6ImPF6 извлекает неорганическую ртуть в виде дитизонатного комплекса. Время экстракции при рН 11 составило 20 мин. Пределы обнаружения для исследованных соединений находились в диапазоне между 1.0 и 22.8 мкг/л [70].
Микроэкстракция с отверждением плавающей капли (МЭОПК) (solidification of a floating organic drop, SFOD-ME). Здесь примененяют ИЖ с плотностью меньше, чем у воды, не смешивающиеся с водой и имеющие температуру плавления, близкую к комнатной. Каплю экстрагента наносят на поверхность анализируемого раствора, который перемешивают магнитной мешалкой при постоянной температуре. После окончания концентрирования анализируемый раствор охлаждают и затвердевшую каплю экстракта переносят в отдельную емкость, где она расплавляется, а затем анализируют. В работе [73] ИЖ C1C2ImPF6, твердую при комнатной температуре, использовали для экстракции сульфаниламидов. Под действием микроволнового поля (240 Вт, 90 с) ИЖ плавилась и диспергировалась. После охлаждения в ледяной бане в течение 5 мин капли ИЖ затвердевали. После центрифугирования и отделения водного раствора декантацией затвердевший экстракт растворяли в ацетоне и анализировали методом ВЭЖХ. Степени извлечения сульфониламидов 91.9–102.8%, значения относительных стандартных отклонений до 0.12, пределы обнаружения 0.33–0.85 мкг/л. Для определения пестицидов методом МЭОПК в качестве экстрагента использовали ИЖ гексафторфосфат тригексилтетрацедилфосфония и растворитель додеканол-1 в соотношении 1 : 5. Продолжительность экстракции составила 30 мин, степени извлечения 75.6–113.9% [74].
Высокие коэффициенты концентрирования, достигаемые за короткое время, разнообразие вариантов осуществления, возможность сочетания со многими методами определения – основные достоинства метода КМЭ с использованием ИЖ.
Мембранная микроэкстракция в полое волокно (ММЭ) (hollow fiber liquid phase microextraction, HFME) – подход, устраняющий такие недостатки КМЭ, как нестабильность и высокая вероятность отрыва капли, а также ограничение объема используемого экстрагента. Сосудом для экстракции служит гидрофобное полимерное полое волокно; обычно его надевают на иглу микрошприца, а свободный конец перед работой запечатывают. Существуют варианты двухфазной, трехфазной мембранной экстракции, мембранной экстракции из капли в каплю, парофазной мембранной экстракции и экстракция во вращающуюся мембрану [47]. В двухфазном варианте экстракция происходит в экстракционный растворитель, заключенный в волокно. В трехфазном варианте реализуются и экстракция, и реэкстракция. Определяемые вещества экстрагируются из исходного водного раствора в растворитель, находящийся в порах стенок волокна, а затем реэкстрагируются в заключенный внутрь волокна водный раствор-приемник (отличающийся по составу или pH от исходного [75, 76]). Конечно, эти варианты – современные микромасштабные разновидности давно известных способов экстракции “твердыми экстрагентами” и мембранной экстракции с импрегнированными мембранами (supported liquid membranes, SLM).
Выбор растворителя в ММЭ играет определяющую роль для достижения эффективного извлечения. Основными требованиями являются хорошее удерживание в порах мембраны при иммобилизации, несмешиваемость с водой, низкая летучесть, сродство к извлекаемым соединениям. Этим требованиям удовлетворяют многие ИЖ.
Авторы работы [75] погружали полипропиленовый капилляр (полое волокно) длиной 5 см в 10 мл ИЖ C1C8ImPF6 и выдерживали в течение 10 мин для заполнения пор. Далее промывали водой в течение 5 мин и закрепляли на конце иглы микрошприца; вводили в капилляр 10 мкл принимающей фазы (рН 13, фосфатный буферный раствор). Свободный конец капилляра запаивали и вводили (не снимая со шприца) в 15 мл анализируемого раствора фенолов (рН 1, перемешивание магнитной мешалкой). После экстракции срезали запечатанный конец капилляра, всасывали фазу-приемник в микрошприц и вводили в жидкостной хроматограф. Стабильность иммобилизованного экстрагента обеспечивала высокую воспроизводимость при определении хлорфенолов методом ВЭЖХ в реальных объектах. Высокая чувствительность определения бензола, толуола, этилбензола, ксилолов достигнута после экстракции в C1C8ImPF6 и определения методом ГХ [76]. Эффективность трехфазной мембранной экстракции сульфониламидов с C1C8ImPF6 в качестве экстрагента увеличивается при добавлении активного полярного растворителя три-н-октилфосфиноксида в ИЖ [77].
Ряд диалкилимидазолиевых и диалкилпиридиниевых ИЖ изучен в качестве экстрагента и акцепторной фазы в двухфазной мембранной микроэкстракции органических соединений, являющихся так называемыми “УФ-фильтрами” [78]. Только ИЖ C1C6ImFAP проявила высокое сродство к извлекаемым соединениям и обеспечила высокие степени извлечения, однако необходимое время экстракции довольно велико (50 мин). Ранее ИЖ с подобным анионом, обладающие высокой термической и гидролитической устойчивостью, низкой растворимостью в воде, зарекомендовали себя как эффективные экстрагенты для ПАУ [79].
В качестве жидкостной мембраны и принимающей фазы для экстракции красителя нейтрального красного использовали C1C8ImPF6 [80]. Экстракцию проводили при рН 7, при котором краситель существует в нейтральной форме. Для достижения количественной экстракции использовали электрическое поле (‒70 В). После экстракции в течение 20 мин краситель элюировали из экстракта этанолом под действием ультразвука и разбавляли в два раза фосфатным буферным раствором для дальнейшего спектрофотометрического/хемилюминесцентного определения. Предел обнаружения нейтрального красного составил 0.38 мкг/л.
Для концентрирования бисфенола А и диэтилстильбэстрола из водных растворов (20 мл) использовали C1C8ImPF6, акцепторной фазой служил раствор гидроксида натрия с рН 10 (5 мкл) [81]. Продолжительность экстракции 10 мин. Высокие коэффициенты концентрирования бисфенола А (850) и диэтилстильбэстрола (624) получены при сочетании ММЭ с определением методом ВЭЖХ-УФ.
Ионные жидкости в методе ММЭ использовали не только в качестве экстрагирующего растворителя, но и в качестве принимающей фазы. Пределы обнаружения для трех изученных ПАУ удалось снизить с 10 нг/мл при прямом хроматографическом определении без концентрирования до 0.25 нг/мл с концентрированием в варианте трехфазной ММЭ с C1C4ImCl (4.5 М раствор) в качестве принимающей фазы. При большей концентрации ИЖ степень извлечения снижалась, по-видимому, из-за высокой вязкости раствора, затрудняющей массоперенос и диффузию экстрагируемых соединений. Экстракцию проводили в течение 15 мин при 40°С из водных растворов с добавкой метанола (0.4 об. %) и высаливателя (5 мас. % NaCl). По окончании экстракции акцепторную фазу (ИЖ) вводили в жидкостной хроматограф [82].
Мембранную микроэкстракцию использовали для концентрирования ионов металлов в диалкилимидазолиевые ИЖ, заключенные в поры мембраны [83–85]. Двухфазная ММЭ никеля(II) и свинца(II) в виде пирролидиндитиокарбаматных комплексов изучена в работе [83]. Для количественного извлечения ионов металлов необходимо использовать ИЖ с длинными алкильными заместителями в имидазолиевом кольце. Экстракцию проводили при рН 3 и объеме принимающей фазы 8 мкл. Время достижения количественного извлечения 15 мин. Металлы определяли непосредственно в экстракте методом ЭТААС. В трехфазной мембранной экстракции кадмия в виде комплекса с 4-(2-пиридилазо)резорцином (ПАР) в качестве экстрагента использовали C1C4ImPF6, а акцепторной фазы – раствор ЭДТА [86]. В оптимальных условиях достигнута количественная экстракция кадмия с коэффициентом концентрирования 162.
Недостатками мембранной экстракции является эффект памяти при вторичном использовании (поэтому в большинстве случаев для каждого анализа готовят новую мембрану), необходимость предварительного заполнения пор мембраны экстрагентом и не очень высокая точность при ручном режиме работы. Мембранную микроэкстракцию может затруднять недостаточно высокая интенсивность массопереноса “через стенку” из исходной в принимающую фазу. Недавно описано применение ультразвуковой обработки для устранения таких помех при экстракции и ААС-определении хрома [87], кобальта и никеля [88]. В обоих случаях использовали ИЖ C1C6ImPF6 и комплексообразующий реагент 1-(2-пиридилазо)-2-нафтол (ПАН). Мембранную микроэкстракцию чаще реализуют в статическом варианте.
Примеры анализируемых объектов и некоторые метрологические характеристики предложенных методик анализа представлены в табл. 2.
Таблица 2.
Примеры использования ионных жидкостей в мембранной микроэкстракции
| Определяемые соединения | Объекты исследования | Экстрагент | Донорная фаза | Принимающая фаза | Метод определения | Предел обнаружения, мкг/л | Коэффициент концентри-рования | Литера-тура |
|---|---|---|---|---|---|---|---|---|
| Хлорфенолы | Вода | C1C8ImPF6 | рН 1 (0.1М HCl) | рН 13 (фосф. буфер) | ВЭЖХ-УФ | 0.5–1.0 | [75] | |
| Бензол, толуол, этилбензол, ксилолы | Вода | C1C4ImPF6 | Вода | – | ГХ-ПИД | 2.2–3.0 | [76] | |
| Сульфамиды | Вода | C1C8ImPF6 | рН 4.5 (KH2PO4) | рН 13 (NaOH) | ВЭЖХ-УФ | 0.1–0.4 | [77] | |
| УФ-фильтры | Вода | C1C6ImFAP | рН 3 (HCl) | – | ВЭЖХ-УФ | 0.2–0.5 | 22–216 | [78] |
| Нейтральный красный | Напитки | C1C8ImPF6 | рН 7 (фосфатный буферный раствор) | – | СФ, ХЛ | 0.38 | [80] | |
| Бисфенол А, диэтилстиль-бэстрол |
Вода | С1C8ImPF6 | Вода (5% NaCl) | рН 13 (NaOH) | ВЭЖХ-УФ | 0.20 0.05 |
850 624 |
[81] |
| ПАУ | Речная вода | н-октанол-1 | Вода (0.1 об. % СН3ОН) | С1C4ImCl | ВЭЖХ-УФ | 0.25 | 43–54 | [82] |
| Pb2+ Ni2+ |
Сточные воды | C1C6ImPF6 | рН 3 (HCl) | – | ЭТААС | 0.03 0.02 |
78 200 |
[83] |
| Cd2+ | Вода | C1C8ImPF6 | рН 3 (СН3СООН) | – | ЭТ | 0.009 | [84] | |
| Метилртуть Hg2+ | Вода (речная водопроводная) | C1C4ImPF6 | рН 6 | L-цистеин (1г/л) | ВЭЖХ‒МС-ИСП | 0.3 нг/л 0.9 нг/л |
1620 1540 |
[85] |
| Cd2+ | Вода, соевое молоко, рис | C1C4ImPF6 | рН 10 | ЭДТА | ЭТААС | 0.12 нг/л | 162 | [86] |
Микроэкстракция с диспергированием растворителя (МЭДР) или дисперсионная жидкость‒жидкостная микроэкстракция (в англоязычной литературе dispersive liquid−liquid microextraction, DLLME) предложена в 2006 г. иранскими исследователями [89]. В этом методе предварительно растворяют не смешивающийся с водой экстракционный растворитель в дополнительном (дисперсионном) растворителе, который полностью смешивается с водой. При введении смеси в анализируемый водный раствор экстрагирующий растворитель выделяется в виде тонкодисперсной эмульсии с размером частиц в десятые-сотые доли микрометра. Это приводит к увеличению общей поверхности массообмена по сравнению с обычной экстракцией не менее чем в 104–105 раз; как следствие, межфазное равновесие устанавливается не более чем за 1 мин [89]. Агрегирование частиц эмульсии в отдельную фазу-концентрат обычно достигается центрифугированием.
Использование ИЖ в ряде случаев не требует применения диспергирующего растворителя, который иногда может неблагоприятно влиять на коэффициенты распределения примесей и осложняет автоматизацию. Диспергирование при этом может осуществляться, например, регулированием температуры (охлаждение предварительно нагретого водного раствора аналита, содержащего гидрофобную ИЖ), воздействием ультразвука или микроволнового излучения.
Впервые ИЖ в МЭДР применили китайские [90] и иранские химики [91]. В работе [90] использовали C1С6ImPF6 в качестве экстрагента для извлечения группы фосфорорганических пестицидов из объектов окружающей среды. Водный раствор, содержащий аналиты и гидрофобную ИЖ, нагревали до 80°C (при этом существенно увеличивалась растворимость ИЖ в воде), затем охлаждали в течение 30 мин в ледяной бане. Этот прием позволил избежать введения диспергирующего растворителя. Микрокапли ИЖ с сконцентрированными аналитами осаждали центрифугированием.
Авторы работы [91] определяли ртуть в воде, используя C1С6ImPF6 и C1С6ImTf2N, которые предварительно растворяли в небольшом количестве ацетона. Для связывания ионов металла вводили комплексообразующий реагент – тиокетон Михлера. Образованию тонкодисперсной эмульсии способствовало нагревание до 35°C и последующее охлаждение. Этот вариант МЭДР с регулируемой температурой иногда называют “микроэкстракция с агрегированием при охлаждении” (cold-induced aggregation microextraction, CIAME).
В многочисленных публикациях по применению ИЖ в МЭДР можно выделить четыре основных подхода: 1) традиционная МЭДР (система включает водный раствор, содержащий аналит, ионную жидкость в качестве экстрагента, диспергирующий растворитель); 2) МЭДР с регулируемой температурой; 3) МЭДР с диспергированием под воздействием ультразвука, микроволнового излучения, интенсивного перемешивания и т.д.; 4) МЭДР с ИЖ, образующейся in situ.
В традиционном варианте МЭДР к анализируемому раствору добавляют в качестве экстрагента небольшое количество гидрофобной ионной жидкости (для связывания металлов обычно дополнительно вводят комплексообразующий реагент) и дисперсионный растворитель, чаще всего – метанол, ацетонитрил или ацетон. Смесь хорошо перемешивают, сконцентрированные в микрокаплях ИЖ определяемые соединения отделяют центрифугированием. Процедура достаточно проста и отличается от классического варианта МЭДР только заменой экстракционного органического растворителя на ионную жидкость. Так, изучена экстракция и разработана методика определения гетероциклических инсектицидов в воде [92] с использованием C1С6ImPF6 в качестве экстрагента и метанола как диспергирующего растворителя. Степень извлечения составила более 80%, а коэффициенты концентрирования – около 210 при экстракции из 5 мл водного раствора в 20 мкл органической фазы. Простота предложенного метода сочеталась с низкими пределами обнаружения (0.53 мкг/л).
В большинстве работ, касающихся традиционного варианта МЭДР, используют имидазолиевые ИЖ с анионами гексафторфосфата или бис(трифлил)имида. Примечательно, что практически во всех случаях требуется небольшое количество органического растворителя для разбавления сконцентрированного экстракта с целью уменьшения вязкости ИЖ и расширения возможности ее использования в анализе. Пестициды [93–95], ПАУ [96], фенолы [97], парабены [98], метамфетамин [99], α-токоферол [100], метаболит пирена [101], лекарственные препараты [102] определяли при сочетании МЭДР с ВЭЖХ [93, 94, 98, 99, 101–103], электрофорезом [97], спектрофотометрией [104]. При определении методом ВЭЖХ в качестве растворителя используют метанол, ацетонитрил или ацетон. Реже применяют реэкстракцию и соответственно определение в реэкстракте. Так, бисфенол-А, 1- и 2-нафтолы, 2,4-дихлорфенол в косметической продукции (лосьоны, тоники и т.п.) определяли с помощью КЭ после экстракции определяемых соединений в C1C8ImPF6 в присутствии диспергирующего растворителя ацетона и реэкстракции щелочными водными растворами [97]. Из-за высокой вязкости ИЖ и сильного поглощения в УФ-области ее прямое использование в КЭ невозможно. Кроме того, ввиду низкой растворимости в щелочном растворе некоторые из сопутствующих/мешающих веществ оставались в фазе ИЖ, т.е. реэкстракция щелочным раствором позволила в некоторой степени провести очистку от примесей. При использовании C1C8ImPF6 достигнуто высокое извлечение (82‒119%) определяемых соединений. Пределы обнаружения для бисфенола-А, 2-нафтола, 1-нафтола, 2,4-дихлорфенола составили 5, 5, 8, 100 нг/мл, коэффициенты концентрирования – 60.1, 52.7, 49.2, 18.0 соответственно.
Ионные жидкости на основе тригексилтетрадецилфосфония применяли для концентрирования гербицидов (анион бис(трифлил)имид) [105] и ПАУ (бромид ион) [106].
В качестве диспергирующего агента предложено использовать гидрофильную ионную жидкость, например C1С4ImBF4, вместо органического растворителя [107, 108]. В таком варианте органический растворитель (метанол) необходим только для разбавления концентрата перед определением методом ВЭЖХ.
Следует отметить, что в ряде работ для уменьшения адгезии ИЖ на стенках экстракционных пробирок дополнительно вводили ПАВ, чаще всего Тритон X-114 или додецилсульфат натрия [91, 109–112].
Для извлечения ионов металлов в качестве комплексообразующих реагентов используют традиционные для экстракции органические реагенты: диэтил- и пирролидин-дитиокарбаминаты, 1-нитрозо-2-нафтол [111], ПАР [112], 4,4'-бис(диметиламино)тиобензофенон и др. [109, 113–115]. В ряде случаев для ускорения комплексообразования требуется нагревание реакционной смеси. Так, реакцию комплексообразования кобальта(II) с 1-нитрозо-2-нафтолом при рН 4 проводили при 50°С в течение 15 мин, затем раствор охлаждали в течение 10 мин и добавляли C1С6ImPF6 в метаноле. Время экстракции составило 7 мин.
После экстракции элементы определяют, как правило, методом ААС с пламенной [96] или электротермической атомизацией [109, 111, 112, 114, 115], реже – с индуктивно связанной плазмой [116]. Ввиду высокой вязкости ИЖ иногда перед определением металлов экстракт разбавляют небольшим количеством органического растворителя [111] или отделяют ИЖ, пропуская через микроколонку с сорбентом. Металл элюируют подходящим растворителем, например ацетоном [112]. Отделив таким образом ИЖ, снижают матричные помехи при атомизации пробы. Так, кобальт в комплексе с ПАР экстрагировали из 2 мл анализируемого раствора в раствор хлорида тетрадецил(тригексил)фосфония (CYPHOS®IL101) в ацетоне со степенью извлечения 98–103%. После отделения ИЖ на колонке с флоресилом кобальт элюировали азотной кислотой. Предел обнаружения кобальта методом ЭТААС составил 8 нг/л [112].
Наиболее распространенные объекты анализа методом традиционной МЭДР – природные воды [109, 112–114], реже – биологические жидкости [111], растительные экстракты [114], пищевые продукты [109, 114].
Основной недостаток традиционной МЭДР заключается в необходимости введения в систему третьего компонента ‒ диспергирующего растворителя, в качестве которого обычно используют летучие органические растворители. Объем диспергирующего растворителя часто критически влияет на образование дисперсной системы, степень диспергирования ИЖ в водной фазе и, в конечном счете, на эффективность экстракции. Уменьшение объема диспергирующего растворителя не позволяет как следует диспергировать ИЖ, дисперсная система может иногда и вовсе не образоваться.
Для того чтобы избежать введения третьего компонента в экстракционную систему предложены другие способы диспергирования ИЖ. Эти подходы основаны на использовании нагревания, микроволнового поля, облучении ультразвуком. Соответствующие методы получили названия: микроэкстракция с диспергированием растворителя под действием температуры, МЭДР‑Т (temperature assisted IL-DLLME, TA-IL-DLLME или cold-induced aggregation ME, CIAME); дисперсионная микроэкстракция под воздействием ультразвука, МЭДР‑УЗ (IL-based ultrasound-assisted DLLME, IL-USA-DLLME) и при содействии микроволнового поля, МЭДР‑МВ (IL-based microwave-assisted DLLME, IL-MA-DLLME). Применение интенсивного перемешивания – один из альтернативных способов избежать необходимость введения третьего компонента (диспергатора) в систему, соответствующий вариант получил название IL-based vortex-assisted DLLME (IL-VA-DLLME).
Микроэкстракцию с диспергированием растворителя под действием температуры (МЭДР‑Т) осуществляют при нагревании водного раствора, содержащего определяемые соединения и гидрофобную ИЖ в качестве экстрагента. Поскольку растворимость ИЖ увеличивается с ростом температуры, нагревание способствует ее диспергированию в водном растворе. Последующее охлаждение смеси приводит к оседанию микрокапель ИЖ, содержащих экстрагированные соединения. В этом варианте микроэкстракции не исключено и использование диспергирующих растворителей, таких как метанол, ацетонитрил и т.д. Если диспергирующие агенты не использовать, то помутнение раствора, т.е. образование дисперсной системы, происходит на этапе охлаждения [90, 117, 118], а в присутствии таких агентов – непосредственно после их добавления [91, 119–123].
Впервые о возможности диспергирования ИЖ посредством температурного контроля в МЭДР сообщили авторы работ [90, 91] при определении органических соединений и ионов металлов. В работе [91] экстракцию проводили при более низкой температуре, использовали две гидрофобные ИЖ, содержащие одинаковые катионы, но разные анионы – C1С6ImPF6 и C1С6ImTf2N – для предотвращения солюбилизации ответственной за экстракцию ИЖ C1С6ImРF6 в водных растворах с высоким содержанием солей. В экстракционную систему также вводили Triton X-114 для предотвращения “налипания” ИЖ на стенки пробирки, как утверждают авторы.
Микроэкстракцию с температурным контролем обычно проводят при 50‒90°С, более высокие температуры нельзя использовать из-за испарения воды. Существенным недостатком метода является довольно высокая продолжительность анализа, вызванная дополнительными этапами нагревания/охлаждения [117, 123]. Продолжительность экстракции определяют как интервал времени от момента добавления ИЖ до центрифугирования. Она практически не влияет на степень извлечения, поскольку образование большой межфазной поверхности при диспергировании ИЖ, например, посредством увеличения ее растворимости при нагревании, приводит к быстрому переносу экстрагируемых соединений из водной фазы в фазу ИЖ, соответственно экстракционное равновесие устанавливается крайне быстро. Центрифугирование обычно проводят сразу после образования мутного раствора. Ограничением метода является возможность его использования только для термически устойчивых соединений.
Для определения пестицидов [90], фунгицидов [118], фенолов и фенольных соединений [120, 124], красителей [123], антибиотиков [117, 119] и ионов металлов чаще всего используют диалкилимидазолиевые ИЖ с анионом гексафторфосфатом. Например, малахитовый зеленый и кристаллический фиолетовый из речной воды и воды рыбоводных прудов экстрагировали в C1С8ImPF6, в качестве диспергирующего растворителя использовали метанол [123]. После смешивания всех реагентов пробирки нагревали при 70°С. Время экстракции при этом составило 50 мин.
Металлы экстрагируют в присутствии комплексообразующих реагентов. Так, свинец экстрагировали в ИЖ в присутствии дитизона [125], ванадий – 2-(5-бром-2-пиридилазо)-5-диэтиламинофенола [121], цинк – 8-гидроксихинолина [122], свинец – пирролидиндитиокарбамината аммония [126], серебро – в присутствии дисульфирама [127], хром – пирролидиндитиокарбамата аммония [128], железо – 2,2'-дипиридила [129].
При определении металлов часто необходимо дополнительное время и/или нагревание для получения соответствующих комплексных соединений, в виде которых их экстрагируют. Так, антибиотики тетрациклинового ряда экстрагировали в ионную жидкость в виде соответствующих комплексных соединений с La(III), для получения которых требовалось перемешивание и выдерживание реагентов в течение 40 мин. Только после этого к водной фазе добавляли C1C4BImPF6, нагревали реакционную смесь и выдерживали в течение 30 мин при 60°С (установленная оптимальная температура) до полного растворения ИЖ. Далее охлаждали в ледяной бане в течение 30 мин и центрифугировали в течение 10 мин при 4°С. Определение проводили методом ВЭЖХ в фазе ИЖ после разбавления метанолом [117]. Тем не менее, в большинстве случаев продолжительность экстракции в системах с ИЖ меньше, чем в системах, в которых в качестве диспергирующего растворителя используют смешивающиеся с водой органические растворители.
Высокие степени извлечения и значения коэффициентов концентрирования достигнуты при определении и органических соединений, и ионов металлов. Условия экстракции и примеры анализируемых объектов представлены в табл. 3 ([130‒150]).
Таблица 3.
Применение ионных жидкостей в микроэкстракции с диспергированием растворителя
| Определяемые соединения | Объект анализа (объем, мл) | ИЖ (количество) | Диспер-гирующий растворитель, V, мкл |
VИЖ, мкл/
разбавитель, V, мкл |
Комментарии | Метод определения | Предел обнаружения, мкг/л |
Коэффициент концентрирования/ степень извлечения | Литера-тура |
|---|---|---|---|---|---|---|---|---|---|
| Традиционная микроэкстракция с диспергированием растворителя | |||||||||
| Инсектициды | Вода (5) | C1С6ImPF6 (52 мг) | Метанол (500) | 19/метанол (50) | – | ВЭЖХ-ДМД | 0.53–1.28 | 209–276/82–106 | [92] |
| Пестициды | Вода (5) | C1С8ImPF6 (436 мг) | Метанол (1000) | –/– | – | ВЭЖХ-УФ | 0.1–5.0 | 200–250/71–81 | [93] |
| ПАУ | Вода (10) | C1С8ImPF6 (5 мкл) | Ацетон (1000) | 27/метанол (500) | Охлаждение в лед. бане 2 мин | ВЭЖХ-ФД | 0.03–2.0 нг/л | 316‑346/81.3–93.4 | [96] |
| Фенолы | Водная косметика (10) | C1С8ImPF6 (80 мкл) | Ацетон (900) | –/реэкстракция 0.1 М NaOH (150 мкл) | Предварительная экстракция ацетонитрилом | КЭ-УФ | 5–100 | 18.0–60.1/– | [97] |
| Парабены | Пищевые продукты (10) | C1С8ImPF6 (100 мкл) | Ацетонитрил (100) | 60/Метанол (20) | Предварительная экстракция метанолом | ВЭЖХ-УФ | 1.0–1.5 нг/г | 68.2–90.4 / 60.1–79.5 |
[98] |
| Метамфетамин | Моча (10) | C1С8ImPF6 (50 мкл) | Метанол (500) | 20/‒ | – | ВЭЖХ-УФ | 1.7 | 224‒227/81 | [99] |
| α-Токоферол | Зерно | C1С8ImPF6 (180 мкл) | Этанол (4000) | – | Предварительная экстракция смесью метанол‒KOH | ВЭЖХ‒МС | 0.7 нг/г | ‒/87‒106 | [100] |
| 3-Гидроксибенз(а)пирен | Моча (10) | C1С8ImPF6 (60 мкл) | Ацетон (1000) | ‒/метанол (50), | Предварительный ферментативный гидролиз мочи и дериватизация дансилхлоридом | ВЭЖХ‒МС | 0.2 пг/мл | ‒/88‒96 | [101] |
| Индометацин, кетопрофен, напроксен |
Биологические жидкости (10) | C1С4ImPF6 (280 мкл) | Метанол (720) | – | Разбавление метанолом 1 : 1 | ВЭЖХ-УФ | 8.3–3.2 | 74–85/36–42 | [103] |
| Формальдегид | Сточные воды, детергенты (10) | C1С6ImPF6 (75 мкл) | Этанол (1000) | –/этанол (100) | Дериватизация ацетоуксусным эфиром | СФ | 0.02 | 158.5/– | [104] |
| Гербициды | Соевые продукты | (C6)3C14PTf2N (60 мкл) | Пропанол-2 (240) | 20/– | Предварительная экстракция из соевого соуса/молока смесью ацетон‒ ацетонитрил (1 : 5) | ВЭЖХ-ДМД | 0.12‒0.34 мг/л | 18‒43/25‒67 | [105] |
| ПАУ | Вода (4.1) | N(C6)3C14Br (30 мкл) | Метанол (60) | 23.6/‒ | ВЭЖХ-УФ | 0.02‒0.49 | 109‒228/60‒108 | [106] | |
| Триклозан, триклокарбан | Вода (5) | C1С8ImPF6 (50 мкл) | C1C4ImBF4 (300) | –/метанол (50) | ВЭЖХ–МС/МС | 0.23–0.35 | –/– | [107] | |
| Пестициды | Вода (5) | C1С8ImPF6 (50 мкл) | C1C4ImBF4 (300) | –/метанол (90) | ВЭЖХ-УФ | 0.28–0.83 | –/– | [108] | |
| Hg2+, ртуть-органические соединения | Водная косметика (5) | C1С6ImPF6 (52 мг) |
Метанол (500) | 8/метанол (60) | ПДТК (2 г/л, 30 мкл) | ВЭЖХ‒МС-ИСП | 1.3–7.2 нг /л | 115–760/‒ | [59] |
| As(III) | Вино (4) | C1С8ImPF6 (40 мг) | Метанол (100) | –/метанол, 10% HNO3 (100) | ДЭДТК (2 М, 50 мкл), Тритон Х-114 (5%, 40 мкл), Na-ClO4 (24%, 250 мкл) | ЭТААС | 5 нг/л | 46/100 | [109] |
| Dy(III), Sm(III), Eu(III), Gd(III) | Вода (80) | C1С6ImPF6 (600 мкл) | Метанол (8) | 500/1 M HNO3 (500) | 1-Гидрокси-2-нафталинкарбо-новая кислота, додецилсульфат натрия (0.001 М, 1 мл) | АЭС-ИСП | 0.34–1.29 | 19–86/– | [110] |
| Со(II) | Вода, биологические жидкости (6) | C1С6ImPF6 (60 мг) | Метанол (500) | –/метанол (50) | 1-Нитрозо-2-нафтол (4 × 10–3 М, 200 мкл) | ЭТААС | 3.8 нг/л | 120/99.9 | [111] |
| Сr(VI), Co(II), Cu(II), Ni(II) | Вода (10) | C1C6ImFAP (80 мкл) | Метанол (500) | –/ацетонитрил (105) | ПДТК (4%, 500 мкл) | УВЭЖХ-УФ | 0.3–2 | 68–75/80–95 | [113] |
| Se(IV) | Вода, экстракт чеснока (4) | CYPHOS®IL101 (50 мг) | Метанол (100) | –/метанол, 10% HNO3 (200) | ПДКА (7.9 × 10-5 М) | ЭТААС | 14 нг/л | 20/– | [114] |
| Cr(VI, III) | Биологические жидкости (1) | C1С6ImPF6 (80 мг) | Ацетон (100) | –/– | Рэкстракция из ИЖ 0.5 М HNO3 (0.1 мл) | ЭТААС | 0.005 | 10/96 | [115] |
| Co2+, Cu2+, Mn2+ Ni2+, Zn2+ |
Питьевая, речная, сточная воды (30) |
C1С6ImTf2N (210 мкл) | Этанол (4000) | 100/пропанол-1 (100) | ТТФА (0.5 М) | АЭС-ИСП | 0.1‒0.2 | 79–102/53–68 | [116] |
| Микроэкстракция с диспергированием растворителя под контролем температуры | |||||||||
| Тетрациклиновые антибиотики | Вода (5) | C1С4ImPF6 (0.15 г) | – | –/метанол | La(III) (4 × 10-4 М, 50 мкл), Тритон Х-111 (1 мас. %, 0.5 мл); 30°С | УВЭЖХ | 0.031–0.26 | –/62.6–96.3 | [117] |
| Фунгициды | Вода (10) | C1С8ImPF6 (55 мкл) |
Метанол | –/75 об.% метанол, вода (200) | 90°С, охлаждение 10 мин | ВЭЖХ-УФ | 0.32–0.79 | –/– | [118] |
| Фенолы | Вода (10) | C1С8ImPF6 (50 мкл) |
Метанол (700) | –/метанол (200) | 60°С, охлаждение 20 мин | ВЭЖХ-ДМД | 0.27–0.68 | 334–371/ – | [120] |
| Малахитовый зеленый, кристаллический фиолетовый |
C1С8ImPF6 (80 мкл) | Метанол (80 мкл) | –/ацетонитрил | 70°С, охлаждение 10 мин | ВЭЖХ-УФ | 0.086 0.030 |
254/91.7 276/97.2 |
[123] | |
| Фенолы | Вода (5) | C1С8ImPF6 (35 мкл) | Ацетон (1000) | 20/метанол (200) | 60°С, охлаждение 3 мин | ВЭЖХ | 0.58–0.86 | 112–168/45–67 | [124] |
| V(IV), V(V) | Вода (2) | C1С4ImPF6 (45 мкл) | Этанол (100) | –/метанол (50) | 5-Br-ПАДЭФА (0.001 М в этаноле, 200 мкл), 60°С, охлаждение 10 мин | ЭТААС | 4.9 нг/л | 40/75 | [121] |
| Zn(II) | Вода (30) | C1С6ImPF6 (95 мг) | Этанол (650) | –/этанол (500) | 8-оксихинолин
(8.5 × 10–5 М), 50°С, охлаждение 10 мин |
ПААС | 0.18 | 60/– | [122] |
| Pb(II) | Вода (10) | C1С6ImPF6 (50 мкл) | – | –/метанол (150), 1.5 М HNO3 (650) | Дитизон (200 мкг/л в этаноле, 50 мкл), 80°С, охлаждение 15 мин | ПААС | 9.5 | –/– | [125] |
| Pb(II) | Биологические жидкости | C1С4ImPF6 (45 мкл) | – | – | ПДТК (0.2 мас.%, 1 мл), 75°С, охлаждение 10 мин | ПААС | 0.13 | 93 | [126] |
| Ag (наночастицы) | Вода (6) | C1С8ImPF6 (50 мкл) | – | 43/– | Дисульфирам (3 × 10–5 М в этаноле, 50 мкл), 77°С, охлаждение 20 мин | ЭТААС | 5.2 нг/л | 120/– | [127] |
| Сr(III) Cr(VI) |
Вода (5) | C1С8ImPF6 (25 мкл) | C1C8ImBr (25 мкл) | 7/этанол (100) | ПДТК (0.1 мас.%); 45°С, охлаждение 10 мин | ЭТААС | 5.4 нг/л 2.45 нг/л |
42/– 43/– |
[128] |
| Микроэкстракция c диспергированием растворителя с ультразвуковым или микроволновым воздействием | |||||||||
| Ароматические амины | Вода (10) | C1С6ImPF6 (60 мкл) | Ацетонитрил (700) | –/метанол‒вода (50 : 50, по объему) (200) | УЗ (5 мин), охлаждение 30 мин | ВЭЖХ-УФ | 0.17–0.49 | –/– | [130] |
| Нестероидные противовоспалительные препараты | Вода (10) | C1С8ImPF6 (85 мг) |
Ацетонитрил (500) | 30/ацетонит-рил‒вода (10 : 90, по объему) (470) | УЗ (4 мин), охлаждение 3 мин | ВЭЖХ-МС | 1–142 нг/л | 99–111/– | [131] |
| УФ-фильтры: Бензофенон, бензофенон-3 |
Вода (10) | C1C6ImFAP (250 мкл) | Метанол (100) | 17/– | УЗ (3 мин) | ВЭЖХ‒УФ | 0.2 0.5 |
464/– 412/– |
[132] |
| Сульфаниламиды | Молочные смеси (4) | C1С6ImPF6 (70 мкл) |
C1С4ImВF4 (100) | –/ацетонитрил, 0.1% муравьиной кислоты (200) | УЗ (10 мин, 30°С), добавление NaPF6 (0.08 г), УЗ (2 мин) | ВЭЖХ-УФ | 2.94– –16.7 мг/кг | – /– | [133] |
| 2-Нафтол, 4-нитрофенол |
C1С6ImPF6 (65 мкл) | C1С2ImBF4 (120 мкл) и BSO3HMImOTf(30) | –/метанол (60) | УЗ (5 мин), охлаждение 20 мин | ВЭЖХ-ДМД | 5.5 10 |
–/– | [134] | |
| Формальдегид | Напитки (5) | C1С6ImPF6 (70 мкл) | Ацетонитрил (400) | –/ацетонитрил (100) | МВ (120 Вт, 1.5 мин); дериватизация | ВЭЖХ-УФ | 0.12 | –/– | [135] |
| Сульфониламиды | Вода, мед, молоко, биологические жидкости (10) | C1С6ImPF6 (100 мкл) | Метанол (750 мкл) | –/ацетонитрил (100) | МВ (240 Вт, 1.5 мин) | ВЭЖХ-ФД | 11–33 нг/г | 24–44/– | [136] |
| Аминогликозиды | Молоко (5) | C1С6ImPF6 (60 мкл) |
1 × 10З3 М Тритон Х-100 (100) | –/ацетонитрил (100) | МВ (180 Вт, 1 мин) | ВЭЖХ-ФД | 0.11–0.50 | 22–34/ – | [137] |
| Пестициды | Вытяжки из почв (10) | C1С6ImPF6 (117.5 мг) | Метанол (418) | 80/ацетонит-рил‒0.01 М фосфатный буферный раствор с рН 8.70 (59 : 41, по объему) (1120) | Вибрационное перемешивание (1 мин) | ВЭЖХ-ФД | 0.02–90.2 нг/г | –/– | [138] |
| Пестициды | Вода (10) | РРImPF6 (117.5 мг) | Метанол (418) | 80/0.001 М ацетонитрил и фосфатный буферный раствор с рН 8.70 (72 : 28, по объему) (1120 мкл) | Вибрационное перемешивание (1 мин) | ВЭЖХ-ФД | 0.01–9.30 | 35/– | [139] |
| Фосфорорганические пестициды | Вода (5) | C1С8ImPF6 (50 мкл) | Метанол (1000) |
–/– | Вортекс (1 мин) | ВЭЖХ-УФ | 0.061–0.73 | –/– | [140] |
| Инсектициды | Вода (10) | C1С6ImPF6 (70 мкл) | Ацетонитрил (300) | –/ацетонитрил (50) | УЗ (1 мин) | ВЭЖХ-УФ | 0.05–0.15 | 261–302/ 80–91 | [141] |
| Трициклические антидепрессанты | Вода (5) | C1С6ImFAP (20 мкл) | Метанол (200 мкл) |
–/метанол (70) | УЗ (1 мин) | ВЭЖХ-УФ | 0.3–1.0 | 17–43/ – | [142] |
| Cd(II) | Вода (10) | C1С6ImPF6 (73 мкл) | – | 15/95%-ный этанол (105), (1 : 1) HNO3 (30) | ДЭДТК (0.05 мас. %), УЗ (1 мин), охлаждение 2 мин | ЭТААС | 7.4 нг/л | 63/94 | [143] |
| Rh(III) | Вода, растительные экстракты (10) | C1С8ImNTf2 (30 мг) | – | ‒/96%-ный этанол (300) | 5-Br-ПАДЭАФ (1.7 × 10–5М), Тритон-Х-100 (0.03 мас. %), 95°С, 40 мин, УЗ (10 мин) | ПААС | 0.37 | 29.3/– | [144] |
| Cd(II) | Вода (10), овощи | C1С4ImPF6 (150 мкл) | – | –/конц. HNO3 (500) | УЗ (3 мин), 180 мг Fe3O4, УЗ (1.5 мин) | ПААС | 0.4 | 100/– | [145] |
| Hg2+ Hg${\text{CH}}_{3}^{ + }$ |
Вода (10) | TOMATS (30 мкл) | – | 50/99.5%-ный этанол (200) | УЗ (2 мин), охлаждение 5 мин. | ААС | 0.03 0.4 |
310/– 200 – |
[146] |
| Cd(II), Co(II), Pb(II) | Чай (10) | TOMATS | – | 10/метанол (50) | УЗ (45 Вт, 120 с) | ВЭЖХ-УФ | 0.002, 0.009, 0.013 мг/кг | 200/90‒102 | [147] |
| Pb(II) | Вода (10) | C1С4ImPF6 (200 мкл) | 0.01 об. % Тритон Х-100 (100) | –/метанол (500) | Вибрационное перемешивание (15 с) | ПААС | 0.307 | 54.2/– | [148] |
| Cd(II) | Вода (7) | C1С8ImPF6 (500 мкл) | – | –/этанол (500) | 8-Оксихинолин (1.35 × 10–4 М), вибрационное перемешивание (6 мин) | ПААС | 2.9 | 35/– | [149] |
| Cd(II) | Вода (10) | C1С6ImPF6 (60 мкл) | – | –/этанол (500) | ПДТК (0.44 мас. %), Вортекс (5 мин) |
ПААС | 1.1 | 35/– | [150] |
Микроэкстракция с интенсивным перемешиванием достигается ультразвуковым или микроволновым воздействием или применением высокоскоростных вибрационных перемешивающих устройств. Это является альтернативой нагреванию при получении тонкодисперсных эмульсий ИЖ в водном растворе. Поскольку применение дополнительных источников энергии сопровождается повышением температуры, использование ультразвука или микроволнового излучения часто требует дополнительного этапа охлаждения. В ряде случаев для улучшения диспергирования гидрофобных ИЖ используют органический растворитель, поверхностно-активное вещество (ПАВ) или гидрофильную ИЖ. Главными преимуществами МЭДР‑Т, МЭДР‑УЗ и МЭДР‑МВ являются экспрессность и обычно высокая степень извлечения экстрагируемых соединений.
Микроэкстракция под воздействием ультразвука [130–134, 141‒147] была исторически первой альтернативой традиционной дисперсионной микроэкстракции и микроэкстракции с контролируемой температурой. Применение ультразвука в сочетании с МЭДР впервые описано для определения ароматических аминов [130] и кадмия в воде [143].
Отмечено [131], что использование ультразвукового излучения позволяет не только сократить продолжительность экстракции, но и уменьшить объем диспергирующего растворителя. Кроме того, при извлечении аналитов из фармацевтических препаратов зафиксировано увеличение степеней извлечения парацетамола, кетопрофена, напроксена и др. более чем на 10% [131], если после экстракции под воздействием ультразвука экстракционную смесь охладить (достаточно 3 мин) в ледяной бане.
Ультразвук оказывает мощное содействие образованию эмульсий, гомогенизации реакционных смесей, способствует массопереносу аналитов между несмешивающимися фазами. Однако для уменьшения износа оборудования и потери растворителей и аналитов в некоторых случаях требуется уменьшить мощность ультразвукового излучения. Показано, что добавление небольших количеств диспергирующего растворителя позволяет снизить продолжительность ультразвукового облучения без снижения степеней извлечения [132]. При определении ртути и метилртути в природных водах найдено, что продолжительность ультразвукового воздействия на экстракцию должна быть небольшой из-за возможного перегрева с потерей летучих соединений; рекомендовано выдерживать экстракционную смесь в ледяной бане [134]. Авторы в качестве экстрагента, диспергирующего растворителя и комплексообразующего реагента использовали тиосалицилат триоктилметиламмония (TOMATS). Степени извлечения Hg2+ и СH3Hg+ из 10 мл анализируемых водных растворов (рН 4) в присутствии 30 мкл TOMATS при ультразвуковом облучении (45 Вт в течение 2 мин, охлаждение в ледяной воде 5 мин, центрифугирование 10 мин, 4500 об./мин) составили 95‒103%. Соединения ртути определяли непосредственно в фазе ИЖ, предварительно разбавленной этанолом, методом ААС.
Впоследствии ту же ИЖ TOMATS применили для определения в зеленом чае кадмия, кобальта и свинца методом ВЭЖХ с фотометрическим детектированием [147]. Пределы обнаружения составили (мг/кг) 0.002 для Cd(II), 0.009 для Co(II) и 0.013 для Pb(II).
В качестве дисперсгирующего растворителя можно применять гидрофильные ИЖ. Так, гидрофильную ИЖ С1С4ImBF4 использовали в качестве диспергирующего растворителя в варианте МЭДР с ультразвуковым воздействием для определения сульфаниламидов в детском сухом молоке [133], вторую (гидрофобную) ИЖ С1С6ImPF6 применяли как экстрагент. Для определения фенольных соединений в природной воде использовали в качестве экстрагента C1С6ImPF6, а в качестве диспергирующих растворителей – две гидрофильные ИЖ С1С2ImBF4 и BSO3HMImOTf (трифторметилсульфат 1-сульфобутил-3-метилимидазолия). Последняя ИЖ с сульфогруппой, ковалентно связанной с алкильной цепочкой катионной части ИЖ, служила в качестве рН-модификатора: добавлением определенного объема этой ИЖ устанавливали необходимое значение рН. 4-Нитрофенол и 2-нафтол экстрагировали со степенью извлечения выше 87 и 98% соответственно при рН 2 и ультразвуковом воздействии в течение 5 мин (200 Вт, 25°С) [134]. Пределы обнаружения составили 5.5 и 10.0 мкг/л для 4-нитрофенола и 2-нафтола соответственно.
Микроэкстракцию с диспергированием растворителя с ультразвуковым воздействием применяли также для концентрирования при определении методом ВЭЖХ антидепрессантов циталопрама и нортриптилина [151], фосфорорганических пестицидов [152], а также определении парабенов методом КЭ [153].
Благодаря ионной природе, способность ИЖ поглощать энергию микроволнового излучения чрезвычайно высока. Это обеспечивает быстрый разогрев реакционной смеси и возможность проведения процессов при высоких температурах практически в отсутствие паров растворителя [154]. Одним из важных преимуществ использования микроволнового или ультразвукового излучения в вариантах МЭДР является возможность одновременно проводить экстракцию и реакцию дериватизации экстрагируемого соединения в одной экстракционной пробирке под воздействием этих видов излучения. Впервые такое сочетание было описано в работе [135] при определении формальдегида в напитках. В последующих работах проводили экстракцию и дериватизацию сульфаниламидов с флуорескамином [136], аминоглюкозидов, присутствующих в молоке [137], под воздействием микроволнового излучения в сочетании с МЭДР, используя ПАВ (Тритон Х-114) в качестве диспергирующего растворителя, с последующим определением методом ВЭЖХ. Китайские исследователи применили микроволновой вариант МЭДР для определения антрахинонов в растительных образцах [155]. В целом микроволновое излучение применяют для содействия микроэкстракции реже, чем ультразвук.
Сравнительно недавно для улучшения диспергирования ИЖ в МЭДР начали применять интенсивное перемешивание (высокоскоростные орбитальные перемешивающие устройства) [138, 139, 156‒159]. Этот способ диспергирования уже стал одним из наиболее распространенных. Показано, что кратковременное (2‒5 мин) интенсивное перемешивание не только уменьшает расход ИЖ и дисперсионного растворителя (метанола), но также улучшает диспергирование С1С8ImPF6 и способствует увеличению степеней извлечения фосфорорганических пестицидов [140]. Для улучшения диспергирования ИЖ и уменьшения продолжительности экстракции интенсивное перемешивание использовали и для извлечения свинца в виде комплекса с ПАР [148], кадмия в виде комплекса с 8-гидроксихинолином [149] и пирролидиндитиокарбаминатом [150].
Для отделения микрокапель ИЖ от водной фазы и избежании потерь органической фазы на стадии отделения предложен новый метод, являющийся комбинацией дисперсионной жидкостной и дисперсионной твердофазной микроэкстракции (ТФМЭ) с магнитными наночастицами [145, 157, 141 ]. При определении инсектицидов магнитные наночастицы Fe3O4 добавляют после МЭДР для облегчения удаления микрокапель ИЖ из водного раствора с использованием магнита [141]. Инсектициды десорбировали ацетонитрилом и определяли хроматографически. Кроме того, показано, что добавление магнитных наночастиц на стадии экстракции в систему, содержащую С1С4ImPF6, позволяет существенно повысить степень извлечения свинца в виде его пирролидиндитиокарбаминатного комплекса и кадмия в виде комплекса с 4-(2-тиазолилазо)резорцином с 45% до количественной экстракции. Рост извлечения авторы объясняют адсорбцией комплекса металла на поверхности наночастиц. При этом для диспергирования ИЖ использовали интенсивное перемешивание; продолжительность экстракции не превышала 3‑5 мин [145, 160]. Ионные жидкости и металлы десорбировали с наночастиц азотной кислотой. Для концентрирования негативно влияющих на эндокринную систему веществ описано применение магнитных наночастиц Fe3O4, покрытых слоем SiO2, к которому ковалентно привита “ионная жидкость” – хлорид метилимидазолия [161] (кавычки здесь употребили авторы данного обзора, а не цитируемой работы).
С той же целью – облегчить отделение концентрата от водного раствора – наряду с магнитными частицами в последнее время используют магнитные ионные жидкости (МИЖ). Отметим три недавних обзора о таких ИЖ – один общего характера [162], а два других специально по аналитическим приложениям [163, 164]. Конечно, самый очевидный и распространенный тип МИЖ ‒ это соли с анионом ${\text{FeCl}}_{4}^{ - }.$ Так, ИЖ тетрахлороферрат триоктилметиламмония применяли для определения ряда лекарственных препаратов [165]. Среди других анионов можно упомянуть ${\text{FeBrCl}}_{3}^{ - }$ для определения ПАУ [166]. Авторы работы [167] использовали для концентрирования ряда органических соединений, включая инсектициды и ПАУ, МИЖ на основе аниона тетрахлороманганата(II), который устойчивее к гидролизу, чем ${\text{FeCl}}_{4}^{ - }.$
Удачное сочетание МЭДР и ТФМЭ предложено для определения антидепрессантов в воде [142]. Сначала аналиты экстрагировали под воздействием ультразвука в течение 1 мин, далее эмульсия попадала в микроустройство для ТФЭ, содержащее цеолитный каркас с привитыми группами имидазолиями. Время вибрационного воздействия для ТФЭ не превышало 1 мин, десорбция занимала 5 мин.
Иранские авторы [168] определяли ртуть в водных растворах и пробах крови после экстракции/сорбции в сложной системе ИЖ‒ацетон‒карбокси-функционализированный нанопористый графен с содержанием компонентов 100 мг/250 мкл/10 мг соответственно. Эту смесь вводили в пробу (10 мл) и обрабатывали ультразвуком. После отстаивания ртуть извлекали азотной кислотой из системы сорбент/ИЖ и определяли методом ААС холодного пара в варианте проточно-инжекционного анализа.
Другая иранская группа предложила [169] вариант МЭДР с диспергированием ИЖ посредством нанесения ИЖ на твердый носитель – таблетку из смеси твердых неорганических солей (используется для приготовления изотонических растворов) – с последующим растворением таблетки; высвобождающаяся при этом ИЖ эффективно диспергируется в водном растворе. Подход применен для определения инсектицидов в соках и овощах методом ВЭЖХ с фотометрическим детектированием.
Микроэкстракция в возникающий растворитель (в образующуюся in situ ИЖ, in situ-МЭДР) является одним из наиболее интересных и перспективных вариантов микроэкстракции. В этом варианте обычно используют гидрофильную ИЖ, из которой в ходе реакции обмена при добавлении соответствующей соли – анионообменного агента in situ образуется гидрофобная ИЖ, отделяющаяся от водного раствора. Гидрофильную ИЖ растворяют в водном растворе, содержащем определяемые соединения; при добавлении ионообменного реагента происходит образование мутного раствора тонкодисперсной эмульсии образующейся гидрофобной ИЖ. В результате значительно увеличивается общая площадь поверхности фазы экстрагента – гидрофобной ИЖ. Существенно, что реакция обмена и экстракция происходят одновременно, и перенос аналитов в экстрагирующую гидрофобную ИЖ является быстрым и эффективным. В результате достигаются высокие степени извлечения и коэффициенты концентрирования аналитов. На сегодняшний день имеется около трех десятков работ по применению образующейся in situ ИЖ для экстракции ионов металлов и органических соединений (табл. 4 [170‒199]). Во всех случаях использовали ИЖ на основе катиона диалкилимидазолия и фторированных анионов.
Таблица 4.
Применение микроэкстракции с диспергированием растворителя в образующуюся in situ ионную жидкость
| Определяемые соединения | Объекты анализа, V, мл | Ионная жидкость | Гидрофильная ионная жидкость (количество)/
анионообменный реагент (с, V, мкл) |
VИЖ, мкл/ разбавитель, V, мкл | Комментарии | Метод опреде-ления | Предел обнару-жения, мкг/л | Коэффициент концентрирования/ степень извлечения | Литера-тура |
|---|---|---|---|---|---|---|---|---|---|
| Hg2+ | Вода (5) | C1С6ImPF6 | C1С6ImBF4 (30 мг)/NaPF6 (120 мг/мл, 600) | –/85%-ный этанол (150) | ТМ (2 × 10–6 М, пропанол) | СФ | 0.7 | 37/5 | [170] |
| Pd2+ | Вода с высоким содержанием солей (10) | C1С6ImPF6 | C1С6ImBF4 (3.6 г)/NaPF6 (120 мг/мл, 600) | –/85%-ный этанол (100) | ТМ (5.2 × 10–6 М, пропанол) | СФ | 0.2 | 97/– | [171] |
| Сd2+ | Вода с высоким содержанием солей (5) | C1С6ImPF6 | C1С6ImBF4 (30 мг)/NaPF6 (120 мг/мл, 1000) | 8/этанол (50) | О,О-Диэтилтио- фосфат (0.03 М, этанол) | ПААС | 0.07 | 78/13 | [172] |
| Ag+ | Вода (10) | C1С6ImPF6 | C1С6ImBF4 (36 мг)/NaPF6 (120 мг/мл, 800) | –/85%-ный этанол (100) | ТМ (7.5 × 10–6 М, пропанол), 50°С, охлаждение 10 мин | СФ | 0.4 | 95.5/– | [173] |
| Ni2+ | Вода (8) | C1С6ImPF6 | C1С6ImBF4 (30 мг)/NaPF6 (120 мг/мл, 2000) | 13/этанол (50) | 1-(2-пиридилазо)-2-нафтол (10 мг/л) | ПААС | 0.6 | 153/– | [174] |
| Cu2+ | Вода (5) | C1С6ImPF6 | C1С6ImBF4 (35 мг)/NaPF6 (120 мг/мл, 500) | –/этанол (200) | Гидрохлорид тиамина (150 мг/л) | ФЛ | 0.024 | 25/90–102 | [175] |
| Zn2+ | Вода (5) | C1С6ImPF6 | C1С6ImBF4 (30 мг)/NaPF6 (100мг) | –/этанол (50) | 1-(2-Гидрокси-нафталин-1-ил)этилоксим (2 × 10–2 М, 5 мл) | ПААС | 0.5 | 81/96–101 | [176] |
| Au3+ | Вода (45) | C1С10ImPF6 | C1С10ImCl (100 мг/мл, 1.2 мл)/NH4PF6 (40 г/л, 4000) | 420/метанол (1580) | – | ПААС | 0.3 нг /мл | 24/– | [177] |
| V(V) | Вода (30) | C1С6ImPF6 | C1С6ImBF4 (120 мг)/NaPF6 (220 мг/мл, 1000) | 15/HNO3 (35, 50 об. %), этанол (100) | N-Бензоил-N-фенилгидроксиламин | ПААС | 0.047 | 176/92‒102 | [178] |
| Сr(III) Cr(IV) |
Вода (10) | C1С8ImNTf2 | C1С8ImCl (1 М, 100 мкл)/LiNTf2 (1 М, 100) | 33/– | ПДТК (0.5 М, 180 мкл, метанол), Тритон Х-114 (0.2 М, 100 мкл) | ЭТААС | 0.02 | 300/95–100 | [179] |
| Pb2+ Cd2+ |
Вода (10) | C1С8ImNTf2 | C1С8ImCl (0.1 М, 100 мкл)/LiNTf2 (0.1 М, 100) | 33/– | ПДТК (0.5 М, 200 мкл, метанол), Тритон Х-114 (0.2 М, 100 мкл) | ЭТААС | 0.003 0.0002 |
280/98–102 | [180] |
| Cu2+ | Вода (10) | C1С6ImNTf2 | C1С6ImCl (0.45 г/мл, 45 мкл)/LiNTf2 (0.2 г/мл, 100) | 8/этанол (32) | ДЭДТК (0.11 г/мл, 100 мкл) | ЭТААС | 0.004 | 200/101–104 | [181] |
| Cu2+ | Вода (10), почвы | C16ImNTf2 | C1С6ImCl (0.45 г/л, 45 мкл)/ LiNTf2 (0.2 г/л, 100) | 8/этанол (42) | ДЭДТК (0.11 г/л, 100 мкл) | ЭТААС | 1.8 | –/– | [182] |
| Pd2+ | Вода (10) | C1С6ImPF6 | C1С6ImCl (0.339 М, 1 мл)/ КPF6(0.339 М, 1000) | –/этанол (15) | Гидрохлорид тиамина (150 мг/л) | ЭТААС СФ |
0.003 0.3 |
–/93.5–104.4 | [183] |
| Co2+ | Вода (10) | C1С6ImPF6 | C1С6ImBF4 (30 мг)/NaPF6 (120 мг/мл, 1000) | –/метанол (100) | 1-Нитрозо-2- нафтол (1.5 × 10–4 М) | ПААС | 0.8 | –/95–108 | [184] |
| Антрахиноны | Растения (ревень) | C1С8ImPF6 | C1С8ImBF4 (140 мкл)/NН4PF6 (4%, 1000) | –/ацетонитрил (200) | МВ (180 Вт, 60 с) | ВЭЖХ-ДМД | 0.015–0.026 | –/82–93 | [155] |
| Ароматические соединения | Вода (10) | C1С4ImNTf2 | C1С4ImCl (38 мкл)/LiNTf2 (0.2 г/мл, 471) | 12/– | – | ВЭЖХ-УФ | 0.02–34.5 | 184–935/22–112 | [185] |
| Фенолы | Вода (морская) (10) | C1С4ImNTf2 | C1С4ImCl (38 мкл)/LiNTf2 (0.2 г/мл, 340) | 10/ацетнитрил | ВЭЖХ-ДМД | 0.8–4.8 | 130–1037/12–96 | [186] | |
| Таншиноны | Водные экстракты растений (1) | C1С8Im PF6 | C1С8ImCl (0.5 М)/НPF6 (20) | –/– | ВЭЖХ-УФ | 80–97 | 25–29/84–96 | [187] | |
| Гербициды | Вода (5) | C1С4ImNTf2 | C1С4ImBF4 (40 мкл)/ LiNTf2 (0.2 г/мл, 500) | –/– | МВ (30 Вт, 50°С, 90 с)] | ВЭЖХ-УФ | 0.52-1.3 | 103–132/88–114 | [188] |
| Инсектициды (пиретроиды) | Вода (10) | C1С8ImNTf2 | C1С8ImCl (0.02 г)/LiNTf2 (0.03 г/мл, 830) | 25/– | Охлаждение 1 мин | ВЭЖХ-ДМД | 0.02–0.18 | –/89.7–95.6 | [189] |
| ПАУ | Водые экстракты зерновых (1.5) | С4С16ImNTf2 | C4С16ImBr (6 × 10–5 М)/ LiNTf2 (0.5 г/мл, 34) | 65/ацетонитрил (30) | Охлаждение 1 ч | ВЭЖХ-УФ | 0.03– –83 мкг/кг | 5.6–14/68.4–119 | [190] |
| Инсектициды | Вода (10) | C1С8ImNTf2 | C1С8ImCl (0.0388 г)/ LiNTf2 (10.03 г/мл, 1500) | –/ацетонитрил (200мкл) | – | ВЭЖХ-УФ | 0.16–0.45 | –/80–89 | [191] |
| ПАУ, фенолы, парабены | Водные экстракты почв (4) | С4С16ImNTf2 | С4С16ImBr (1.6 × 10–4 М)/ LiNTf2 (0.5 г/мл, 92) | 90/ацетонитрил (110) | Вибрационное перемешивание (1 мин), нагревание (65°С, 5 мин) | ВЭЖХ-УФ | 0.04– –81 мг/кг | 5.4–24/27.1–106 | [192] |
| Метилтретбутиловый эфир | Вода (10) | C1С8Im PF6 | C1С8ImCl (50 мг)/ KPF6 (50 мг) | 29 мг/– | Вибрационное перемешивание (1 мин) | ГХ-ПИД | 0.09 | –/99.6–107 | [193] |
| Фосфорорганические пестициды | Вода (10) | C1С4ImNTf2 | C1С4ImCl (1 М 200 мкл)/LiNTf2 (1 М 240) | 20/– | 0.5 М NaCl, термодесорбция | ГХ‒МС | 10–19 нг/л | –/85–118 | [194] |
| Хлорфенолы | Вода (5) | C1С4ImNTf2 | C1С4ImCl (100 мкл)/LiNTf2 (0.51 г/мл, 300) | 150/– | Реэкстракция 40 мл 0.14 М NaOH | ВЭЖХ-ДМД | 0.8 – 3.2 | 34–65/95–114 | [195] |
| Атенолол | Плазма (5) | C1С4ImPF6 | C1С4ImBF4 (50 мг)/LiNTf2 (180 мг/мл, 500) | 12/ацетонитрил (50) | УЗ 4.5 мин (50 Вт) | ВЭЖХ-УФ | 0.5 нг/мл | 18–19.3/90–97 | [196] |
| Фенольные соединения растительного происхождения | Растения (лимонник) | C1С4ImPF6 | C1С4ImBF4 (150 мкл)/NН4PF6 (0.8 г) | – | 80°С, 15 мин | ВЭЖХ‒МС/МС | 0.02– –0.05 нг/мл | –/78–119 | [197] |
| Полихлорирован-ные бифенилы, акриламид | Молоко, кофе | C1С4ImNTf2 [BeEOHIm][NTf2] |
C1С4ImCl (120 мг)/LiNTf2 (0.2 г/мл) | 20/– | – | ГХ | 3.9–-13.8 | –/– | [198] |
| Бифенил, бисфенол, напроксен, кофеин и др. | Вода (10) | C1С4ImNTf2 | C1C14ImCl (40 мкл)/LiNTf2 (0.2 г/мл, 471) | 9/– | – | ВЭЖХ-УФ | 0.50–55.8 | –/91–107 | [199] |
В варианте in situ-МЭДР для ускорения реакции обмена часто используют интенсивное перемешивание, микроволновое или ультразвуковое излучение. Анионообменный реагент обычно добавляют к гидрофильной ИЖ в соотношении 1 : 1. Иногда используют и диспергирующий растворитель.
Этот вариант микроэкстракции был впервые описан иранскими [170] и американскими [185] исследователями. Авторы работы [170] для определения ртути(II) в присутствии 4,4'-бис(диметиламино)тиобензофенона использовали гидрофильную ИЖ С1С6ImBF4 и поставщик гидрофобного аниона ‒ гексафторфосфат натрия. Из-за ее высокой вязкости С1С6ImBF4 растворяли в небольшом количестве ацетона. Для понижения растворимости образующейся ИЖ вводили NaPF6 в трехкратном избытке по отношению к С1С6ImBF4. Это позволило количественно извлекать ртуть(II) из растворов с высоким содержанием солей.
При выборе ИЖ и анионообменного реагента важно, чтобы гидрофильная ИЖ легко растворялась в водном растворе, а образующаяся гидрофобная ИЖ имела низкую растворимость в воде и плотность выше, чем у воды. Это особенно важно при определении аналитов в растворах с высоким содержанием солей, например в морской воде. Так, в работах [170–175] по экстракции ионов металлов в in situ образующуюся ИЖ С1С6ImPF6 со сравнительно высокой растворимостью в воде для снижения ее растворимости при проведении реакции обмена использовали достаточно большой избыток NaPF6.
Изучение влияния температуры и продолжительности экстракции показало, что варьирование температуры в интервале от 0 до 60°С не влияет на степень извлечения кадмия в комплексе с O,O-диэтилдитиофосфатом [172]. При повышенной температуре мутный раствор не может образоваться немедленно, необходима стадия охлаждения. Поскольку гидрофильная ИЖ С1С6ImBF4 лучше растворяется в воде при повышенной температуре, в работах [171, 173] водный раствор, содержащий С1С6ImBF4, ион металла и комплексообразующий реагент выдерживали в термостате при 50°С в течение 4 мин. Затем добавляли анионообменный реагент, встряхивали и помещали в ледяную баню (0°С) на 10 мин для снижения растворимости образовавшейся С1С6ImPF6 и скорейшего образования мутного раствора. При отсутствие стадий термостатирования и охлаждения образующиеся дисперсные растворы после добавления анионообменного реагента сразу же центрифугировали. Показано, что увеличение времени экстракции (от момента ввода NaPF6 до центрифугирования) в интервале от 0 до 20 мин не влияет на степень извлечения [172].
Хром(III, VI), свинец(II) и кадмий(II) экстрагировали в образующуюся in situ С1C8ImTf2N в присутствии пирролидиндитиокарбамината аммония и Тритона Х-114, уменьшающего потери ИЖ за счет налипания на стенки экстракционной пробирки [176, 177]. Медь(II) экстрагировали в присутствии диэтилдитиокарбамината натрия в С1C6ImTf2N, образующуюся in situ [178, 179]. Анионообменный реагент LiTf2N добавляли к хлориду диалкилимидазолия в соотношении 1 : 1. Количественная экстракция достигнута в отсутствие диспергирующего растворителя, этапов нагревания/охлаждения и ультразвукового/микроволнового воздействия.
Объем экстракта, полученного в ходе in situ-МЭДР, составлял от 7 до 33 мкл. Металлы после экстракции определяли непосредственно в фазе ИЖ либо спектрофотометрически, либо флуориметрически, либо методом ААС (в том числе с электротермической атомизацией [179–183], где малый объем пробы не помеха). Ввиду высокой вязкости экстракта перед введением в атомизатор экстракт в ряде случаев разбавляли этанолом; для уменьшения матричных эффектов (влияния ионной жидкости) особое внимание уделяли программированию температуры атомизатора.
Описано определение кобальта методом атомной абсорбции после in situ-МЭДР в ИЖ С1С6ImPF6 с 1-(2-пиридилазо)-2-нафтолом с агрегированием при охлаждении [184].
Авторы настоящего обзора показали, что при совместном растворении в воде бромида тетраоктиламмония и N-лауроилсаркозината натрия образуется in situ не смешивающаяся с водой ионная жидкость TOALS. В возникающую таким образом новую фазу из водного раствора можно экстрагировать в присутствии ПАР ионы кадмия, кобальта, меди, никеля, свинца и цинка, а ионы кадмия – и в отсутствие ПАР [200]. Заметим, что, в отличие от других примеров in situ-МЭДР, здесь стартовым материалом не служила гидрофильная ионная жидкость: оба исходных вещества – твердые соли. Таким образом, показано, что получать in situ можно самые разные не смешивающиеся с водой ИЖ. Вовсе не обязательно исходить из жидкой соли; агрегатное состояние исходных солей – поставщиков ионов – совершенно не важно. Учет этого очевидного соображения существенно расширяет возможности получения растворителей для экстракции in situ.
Использовать in situ-МЭДР для экстракции и определения органических соединений впервые предложили американские авторы [185]. В этом случае предпочтительными оказались анионообменный реагент LiTf2N и гидрофильная ИЖ С1C4ImCl. Примечательно, что практически во всех работах по экстракции в in situ образующуюся ИЖ с бистрифлилимидом в качестве аниона наиболее удовлетворительные результаты получали при добавлении к гидрофильной ИЖ бистрифлилимида лития в молярном соотношении 1 : 1, в отличие от NaPF6, который всегда вводили в значительном избытке. Это, очевидно, связано с более высокой растворимостью гексафторфосфатных ИЖ.
Сравнение результатов экстракции более десяти органических соединений (бифенил, нафталин, фенантрен, пирен, нитробензол и т.д.), полученных традиционной МЭДР в отсутствие и в присутствии диспергирующего растворителя, с in situ-МЭДР показало, что коэффициенты концентрирования для последнего варианта существенно выше [185]. Авторы объясняют этот факт тем, что, поскольку гидрофильная ИЖ полностью растворяется в водном растворе, содержащем определяемые соединения, образующаяся из нее в ходе реакции обмена гидрофобная ИЖ полностью диспергирована в растворе. Это обеспечивает несравненно бóльшую площадь контакта между экстракционным растворителем и водным раствором аналита.
Как известно, добавление высаливателей часто используют в микроэкстракционных методах для увеличения извлечения. Влияние солевого эффекта на степень извлечения органических соединений изучено достаточно широко. В работе [185] установлено, что введение хлорида натрия вплоть до концентрации 30 мас. % практически не влияет на степень извлечения в in situ образующуюся С1C4ImTf2N соединений с небольшой молекулярной массой (например, этилбензоат, α,α,α,6-тетрафтор-м-толуидин, нитробензол, 3-трет-бутилфенол). Экстракция фенолов из водных растворов в С1C8ImTf2N не ухудшалась при увеличении содержания хлорида натрия до 3.5 мас. % [186]. Однако степень извлечения уменьшается для всех изученных ПАУ. Ухудшение экстракции авторы связывают с влиянием увеличивающейся ионной силы на процесс ионного обмена и соответственно на количество образующейся in situ фазы ИЖ. При высокой концентрации солей также увеличивается вязкость раствора, что может осложнить диффузию больших по размеру молекул в органическую фазу [185, 187]. Кроме того, при содержании хлорида натрия более 15 мас. % снижалась растворимость в воде исходной гидрофильной ИЖ С1С8ImCl [187]. Увеличение ионной силы раствора (добавляли хлорид натрия от 5 до 20 мас. %) приводило к снижению степеней извлечения инсектицидов и гербицидов [188, 201].
Исследование влияния продолжительности экстракции (от момента добавления ионообменного реагента до центрифугирования) показало, что она не влияет на эффективность извлечения, поэтому, как правило, центрифугирование проводят сразу после образования мутного раствора. В некоторых работах после добавления ионообменного реагента выдерживают реакционную смесь в течение 1 мин в ледяной бане, а затем центрифугируют [189, 201].
Влияние температуры на экстракцию в in situ образующуюся ИЖ рассматривали в литературе неоднократно. Тем не менее, единого мнения об оптимальной температуре для in situ-МЭДР нет. Показано [172], что увеличение температуры с 0 до 60°С практически не влияет на степень извлечения кадмия в виде комплекса с O,O-диэтилдитиофосфатом, поэтому экстракцию проводили при комнатной температуре. Экстракция некоторых органических соединений, например триазиновых гербицидов, в С1С4ImTf2N возрастает при увеличении температуры до 50°С, а дальнейшее увеличение температуры приводит к небольшому снижению степени извлечения. Подобную тенденцию изменения степени извлечения наблюдали и при увеличении времени воздействия микроволнового излучения на экстракцию таншинонов в С1C8ImTf2N [187]. Полученные результаты авторы связывают с тем, что в зависимости от природы извлекаемых соединений одни эффективно экстрагируются в ИЖ непосредственно в процессе ее образования, для других же требуется дополнительная энергия, например нагрев или время. Однако с ростом температуры, а также при длительном микроволновом воздействии, сопровождаемом разогревом экстракционной смеси, возможно как уменьшение объема ИЖ вследствие повышения растворимости, так и обратный переход извлекаемых соединений из ИЖ в водную фазу; эти процессы могут приводить к снижению экстракции [187, 188].
На условия проведения экстракции и условия получения in situ ИЖ влияет природа образующейся ИЖ и анализируемого объекта [190, 192]. Недавно описаны ИЖ, содержащие длинные алкильные цепочки в составе катиона имидазолия. Эти ИЖ представляют собой, по сути, ПАВ. Так, С4C16ImBr и С1C16ImBr использовали для извлечения ПАУ под действием микроволнового излучения из твердых матриц (злаки, морские отложения) в качестве альтернативы органическим растворителям и традиционным ПАВ. Поскольку С4C16ImBr и С1C16ImBr растворимы в воде, их применили для in situ-МЭДР. В ходе реакции обмена с LiTf2N получены не смешивающиеся с водой С4C16ImTf2N и С1C16ImTf2N. Однако условия in situ образования ИЖ отличались и существенным образом зависели от матрицы анализируемого объекта. При экстракции ПАУ из злаковых необходимым условием образования тонкодисперсной эмульсии и возможности последующего отделения С4C16ImTf2N являлось выдерживание реакционной смеси при ‒8°С в течение 1 ч [190]. Однако экстракт легко отделялся после центрифугирования при определении ПАУ в морских отложениях [192]. Для получения же экстракта с in situ образующейся С1C16ImTf2N необходимо было добавление ацетонитрила (16.5 об. %) до введения LiTf2N, а также нагревание экстракционной смеси в течение 5 мин при 65°С. Во всех случаях перед центрифугированием реакционную смесь подвергали непродолжительному интенсивному перемешиванию (3–4 мин) [192]. Сравнение результатов хроматографического определения ПАУ после микроэкстракции ИЖ на основе ПАВ под воздействием микроволнового поля в сочетании с in situ-МЭДР и без нее показало, что применение in situ-МЭДР позволяет снизить предел обнаружения по крайней мере на порядок, например, для бензпирена с 40 до 4 нг/л [190].
Описано определение метил-трет-бутилового эфира в водах после микроэкстракции в in situ образующуюся С1C16ImTf2N [193], инсектицидов – в С1C8ImTf2N [191], бисфенолов – в С1C6ImTf2N [194], хлорфенолов – в С1C4ImTf2N [199], алкалоидов [202] и стероидов [203] – в С1C6ImPF6. После микроэкстракции в С1C4ImPF6 с диспергированием ультразвуком определяли атенолол в плазме крови методом ВЭЖХ [196] и лигнаны в растительном сырье методом УВЭЖХ‒МС/МС [197]. Авторы работы [198] определяли полихлорированные бифенилы в молоке и акрилонитрил в кофе методом ГХ после концентрирования в ИЖ (исследовали пять ИЖ ‒ бистрифлилимидов катионных производных имидазола). Недавно описано сочетание in situ-МЭДР с применением магнитных наночастиц для сбора концентрата (определяли инсектидициды методом ВЭЖХ) [204].
In situ-МЭДР использовали для экстракции дезоксирибонуклеиновой кислоты из растворов, содержащих белки (альбумины) и ионы щелочных и щелочноземельных металлов [205]. К водному раствору ДНК добавляли смешивающуюся с водой ИЖ, а затем к полученному раствору LiTf2N. В качестве гидрофильных ИЖ изучены шесть диалкилимидазолиевых ИЖ. Выбор ИЖ определялся, прежде всего, способностью к взаимодействию с нуклеиновой кислотой, например, за счет образования водородных связей с фосфатными эфирными группами. Степень извлечения достигала 97% при использовании бромида 1-(1,2-дигидроксипропил)-3-гексадецилимидазолия (0.5 мг ИЖ на экстракцию из 2 мл водного раствора). Для уменьшения конкурирующей экстракции альбумина работали в области рН ниже изоэлектрической точки белка.
В работе [199] экстракцию различных по природе органических соединений (кoфеин, напроксен, ибупрофен, бисфенол и др.) в in situ образующуюся С1С4ImTf2N сравнивали с обычной МЭДР в функциализованные ИЖ с метанолом в качестве диспергирующего растворителя. Среди функциализованных ИЖ с анионом FAP наилучшие степени извлечения получены при использовании ИЖ с катионом 1-(6-аминогексил)-1-метилпирролидиния (HNH2MPL). Для соединений, содержащих четвертичный атом азота, коэффициент концентрирования в HNH2MP-FAP в 2‒50 раз больше, чем в другие ИЖ. Для полярных соединений, а также соединений, содержащих кислотные группы, наилучшие результаты получены при экстракции в С1С4ImTf2N.
Использование двухфазных водных систем на основе ионных жидкостей. Одной из важнейших областей применения ИЖ в современных экстракционных процессах являются двухфазные водные системы на основе ионных жидкостей (ИЖ–ДФВС) (в англоязычной литературе – IL-ABS, ionic liquid-based aqueous biphasic systems, или IL-ATPS, ionic liquid-based aqueous two phase systems) [206].
Давно известны и используются, в том числе в анализе, двухфазные водные системы (ДФВС) на основе полимеров. Водные растворы некоторых высокомолекулярных соединений (полиэтиленгликоль, декстран, поливиниловый спирт и др.) обладают свойством не смешиваться с концентрированными водными растворами электролитов. Хотя сами по себе все компоненты таких систем водорастворимы, при определенных соотношениях их концентраций образуются две несмешивающиеся, насыщенные водой фазы. Поскольку ДФВС состоят преимущественно из воды, они являются удобной биосовместимой средой для клеток, клеточных органелл, биологически активных соединений; их активно использовали для экстракции, извлечения и очистки биомолекул, таких как белки и нуклеиновые кислоты [206–209]. Двухфазные водные системы на основе солей четвертичного аммония и их применение для целей экстракции обсуждаются в работе [210].
Применение ДФВС дает возможность преодолеть принципиальное ограничение традиционных экстракционных систем – низкую способность извлекать из водных растворов сильно гидратированные соединения. В работах [211, 212] впервые показана возможность экстракции соединений ионов металлов с гидрофильными аналитическими реагентами в ДФВС. Фазовые и экстракционные равновесия в водных расслаивающихся системах с протолитическим взаимодействием представлены в работе [213].
В 2003 г. Роджерс с сотр. показали [214], что ДФВС могут образовывать не только полимеры, подобные полиэтиленгликолю (ПЭГ) или декстрану, но и ИЖ в сочетании с космотропными неорганическими солями-высаливателями. Смешав гидрофильную ИЖ С1C4ImCl и концентрированный раствор соли K3PO4, авторы получили ДФВС, состоящую из верхней, насыщенной ИЖ, фазы и нижней фазы, насыщенной неорганической солью. В последующее десятилетие основные усилия были направлены на использование ИЖ в качестве аналога полимер-обогащенной фазы, а совсем недавно – и “водной” фазы, насыщенной солью.
Двухфазные водные системы на основе ИЖ имеют ряд преимуществ. Во-первых, выбор гидрофильных ИЖ достаточно широк, а варьируя катион и анион ИЖ, можно получить фазу требуемой полярности. В системах на основе полимеров имеются две гидрофобные фазы, а различие в полярности фаз главным образом зависит от содержания воды; более гидрофобная фаза образована полимером, а более гидрофильная (и более ионная) – обычно солью с высокой плотностью заряда. Ограниченное различие в полярности фаз сдерживает применение таких систем в экстракции. Широкий же выбор доступных ИЖ потенциально позволяет покрыть весьма широкий диапазон гидрофильности/гидрофобности. Кроме того, замена полимера на ИЖ в двухфазной системе может улучшить важные для экстракции физические свойства. Cистемы на основе полимеров отличаются высокой вязкостью и медленным расслоением/разделением фаз. Системы на основе фосфониевых ИЖ и неорганических солей менее вязки (4‒11 сПз), чем традиционные полимер-насыщенные фазы (~40 сПз) при том же фракционном составе [215]. Двухфазные водные системы на основе имидазолиевых ИЖ еще менее вязки [216]; ДФВС на основе ИЖ и углеводов проявляют вязкость, схожую с системами на основе ИЖ и неорганической соли [217]. Низкая вязкость ИЖ–ДФВС благоприятствует быстрому массопереносу и обеспечивает легкость работы с такими системами.
Только ИЖ, смешивающиеся с водой при комнатной температуре, могут образовывать двухфазные водные системы. В системе с гидрофобной ИЖ две фазы уже существуют до добавления любой соли, и одна из фаз содержит сравнительно мало воды. Ассортимент гидрофобных ИЖ сравнительно невелик; часто такие ИЖ содержат фторированные анионы, которые могут быть гидролитически неустойчивы и в целом не очень “экологически дружественны”. Выбор же гидрофильных ИЖ обширен, к тому же гидрофильные ИЖ обычно менее токсичны, чем гидрофобные [218, 219]. В связи с этим в последнее время все большее внимание уделяют применению сравнительно гидрофильных ИЖ на основе солей холина, а также замене неорганических солей с высокой плотностью заряда (высаливающих агентов) на другие промоторы образования ДФВС ‒ биоразлагаемые органические соли, углеводы, полимеры или аминокислоты [220–230].
Наиболее распространены и изучены среди ИЖ‒ДФВС тройные системы типа ионная жидкость‒неорганическая соль‒вода. Добавление солей с высокой плотностью заряда катиона/аниона к водному раствору ИЖ из-за предпочтительной гидратации этих солей приводит к образованию фазы, обогащенной ИЖ (высаливание). Ионные жидкости обычно состоят из низкосимметричных ионов с делокализованным зарядом, способных только к слабому внутримолекулярному взаимодействию и, следовательно, слабо гидратируемых по сравнению с солями, обычно используемыми в качестве высаливателей. В такой системе все фазообразующие компоненты являются ионными, поэтому, в отличие от традиционных водных двухфазных систем, где ионный обмен невозможен, в ИЖ–ДФВС ионы могут распределяться между фазами, причем электронейтральность системы и каждой фазы сохраняется [231].
Cреди ИЖ для создания ДФВС подавляющее большинство – гидрофильные имидазолиевые [231–236]. Значительно реже используют ИЖ на основе катионов фосфония, аммония, пиридиния, пиперидиния, пироллидиния [215, 231, 233, 237]. Среди ИЖ на основе диалкилимидазолия наиболее популярны С1C4ImCl, С1C4ImBr, С1C4ImBF4 (несмотря на низкую гидролитическую устойчивость последней). Показано, что способность к образованию ДФВС уменьшается в следующем ряду: [P4444Cl] > [N4444Cl] > [C4PyCl] > > [С1C4ImCl] [230]. Независимо от природы высаливателя и рН фосфониевые ИЖ всегда более эффективны для создания ДФВС [215, 231]. Такую тенденцию связывают с тем, что в четвертичных солях фосфония и аммония заряд катиона, локализованный главным образом на гетероатоме, экранирован объемными алкильными заместителями, что увеличивает тенденцию к высаливанию ИЖ. Катион же имидазолиевых ИЖ имеет заряд, более равномерно распределенный по гетероциклу и способный к взаимодействию через образование водородных связей. Для алкилимидазолиевых ИЖ при увеличении числа атомов углерода в боковой цепи вплоть до шести способность к образованию двухфазных систем возрастает. Однако для ИЖ с более длинными боковыми цепями такая закономерность нарушается, что связывают с присущей им способностью к самоассоциации [222]. Такие функциональные группы в боковой алкильной цепи имидазолиевых ИЖ, как ОН-группа, двойные связи и т.д. усиливают гидрофильный характер ИЖ, они легче гидратируются и соответственно хуже выделяются в виде отдельной фазы даже при высоких концентрациях высаливателя [206].
Природа аниона ИЖ влияет на способность к образованию двухфазных систем. Анионы, обладающие меньшей способностью к образованию водородных связей, усиливают склонность ИЖ к образованию ДФВС [238]. Так, ИЖ с бромид-анионом обладает более ярко выраженной способностью к образованию двухфазной системы, чем с хлорид-ионом.
В качестве высаливающих агентов обычно используют неорганические соли, такие как K3PO4, K2HPO4, K2CO3, (NH4)2SO4, а также органические соли ‒ ацетат, цитрат, тартрат и т.д. Показано, что для солей натрия высаливающее действие уменьшается в следующем ряду анионов: ${\text{PO}}_{4}^{{3 - }}$ > > ${{{\text{C}}}_{6}}{{{\text{H}}}_{5}}{\text{O}}_{7}^{{3 - }}$ > ${\text{HPO}}_{4}^{{2 - }}$ ≈ ${\text{CO}}_{3}^{{2 - }}$ > ${\text{SO}}_{4}^{{2 - }}$ ≈ ${\text{SO}}_{3}^{{2 - }}$ > > ${{{\text{C}}}_{4}}{{{\text{H}}}_{4}}{\text{O}}_{6}^{{2 - }}$ $ \gg $ ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$ > OH– > ${\text{C}}{{{\text{H}}}_{3}}{\text{CO}}_{2}^{ - }$ ≈ ${\text{HSO}}_{4}^{ - }$ ≈ ≈ HCO3 > Cl– [239]. Влияние катиона изучено на примере хлоридов и ацетатов. В обоих случаях получен один и тот же ряд: Mg2+ ≈ Ni2+ ≈ Sr2+ > > Ca2+$ \gg $ Na+ > K+ > Cs+ [239]. Обнаруженные эффекты согласуются с хорошо известным рядом Гофмейстера [206, 231, 235, 240].
Помимо неорганических и органических солей, в качестве веществ, способствующих фазовому разделению в двухфазных водных системах с гидрофильными ИЖ, используют более мягкие агенты – аминокислоты, углеводы, водорастворимые полимеры. В работах [217, 223, 225, 226, 228–230] исследованы системы ИЖ–аминокислота–вода, ИЖ–углевод–вода, ИЖ–полимер–вода. Поскольку и аминокислоты, и углеводы обладают слабым высаливающим действием, выбор ИЖ для создания ИЖ–ДФВС на их основе существенно ограничен. Образование таких систем отмечено в литературе только для имидазолиевых ИЖ. Интересно, что наилучшую способность к образованию двухфазной водной системы и в случае с аминокислотами, и с углеводами показала ИЖ С1С4ImBF4 [223, 225, 226]. Например, в присутствии L-лизина способность к образованию ИЖ–ДФВС уменьшается в следующем ряду С1С4ImBF4 > С1С4ImCF3SO3 > С1С4ImN(CN)2. Влияние природы аниона ИЖ проявляется в способности образовывать водородные связи с водой: чем слабее основные свойства аниона ИЖ, тем выше у него тенденция к отделению от водной фазы. Отмечено, что способность к расслоению систем ИЖ–аминокислота–вода связана и с гидрофобностью и соответственно с растворимостью в воде аминокислоты: чем она выше, тем легче происходит расслаивание [223].
В системах ИЖ–углевод–вода расслоение происходит при высоких концентрациях углевода (1 моль/кг); установлен следующий ряд ИЖ по способности к образованию ИЖ–ДФВС: С1С4ImBF4 > aС1ImBr > aС1ImCl > С1С4ImCF3SO3 [217, 225, 226]. Наиболее подробно влияние природы углеводов на образование двухфазных водных систем изучено в работе [217]: определяющую роль играет число гидроксильных групп углевода и его стереохимия, влияющие на образование водородных связей с водой и, следовательно, на высаливающее действие.
Система ИЖ–полимер–вода аналогична системе полимер–неорганическая соль–вода, в которой вместо традиционного высаливателя – неорганической соли спользовали ИЖ. Ребело и сотр. [228] изучили влияние природы аниона и длины боковой цепи катиона ИЖ С1С2ImC2SO4 и С1СnImCl, где n = 2, 4, 6, 8. Оказалось, что ИЖ с длинной боковой алифатической цепью улучшают растворимость ПЭГ 35000, тогда как с короткими радикалами – вызывают высаливание. По данным [229, 230] для систем с полипропиленгликолем (ППГ) количество ИЖ, требуемое для разделения фаз, увеличивается в ряду: aImCl ≈ ≈ С1С4ImCl < С1С4ImC1CO2 < С1С2ImBr < < С1С4ImBr. Следовательно, образованию ДФВС способствует применение ИЖ с короткими боковыми цепями у катиона имидазолия. Подобные результаты получены в работе [227] для системы с ПЭГ. Если для систем ИЖ–неорганическая соль–вода увеличение длины боковой цепи увеличивает гидрофобность ИЖ и это благоприятно сказывается на способности к расслаиванию, то для системы ИЖ–полимер–вода имеет место противоположная тенденция, так как в этом случае ИЖ действует как высаливающий агент. ИЖ с короткой боковой цепью обладает большим сродством к воде и таким образом легче гидратируется, что способствует образованию второй фазы. Для хлоридных ИЖ с разными катионами отмечена следующая последовательность, составленная в соответствии со способностью образовывать ИЖ–ДФВС: P444Cl > C1C4РipCl > C1C4РyrCl > > C1C4РyCl > С1C4ImCl, которая коррелирует с относительной гидрофобностью ИЖ.
Описано применение двухфазных систем на основе ИЖ для разделения широкого круга органических веществ, в первую очередь, биомолекул от простых спиртов до сложных ферментов [215‒217, 220‒223, 232, 236, 237], а также ионов металлов (интересны системы, позволяющие отделять важные для медицины изотопы 203Pb и 195(m,g),197mHg от “родительских” элементов-мишеней Tl и Au соответственно [241, 242]). Двухфазные водные системы на основе ионных жидкостей могут использоваться для разделения, выделения и очистки разного вида веществ, препаративных целей.
Большое число экспериментальных исследований посвящено проблеме распределения белков в системах с ИЖ [232, 237, 243–250]. Сделаны попытки выявить главные факторы, определяющие взаимодействие между белком и ИЖ. Поскольку белки легко денатурируются и теряют свою биологическую активность при контакте с большинством органических растворителей, использование ИЖ может привести к созданию новых, более совершенных, экстракционных систем получения и очистки биотехнологических продуктов.
Бычий сывороточный альбумин (БСА) исследовали чаще других. Опубликованы работы по распределению БСА в двухфазных системах вода–имидазолиевые ИЖ, отличающиеся длиной боковой цепи (этил-, бутил-, гексил-) и анионами (Br–, Cl–, [N(CN)2]–) [244–246]. В работе [247] исследована экстракционная система с ИЖ Ammoeng110TM на основе катиона аммония с поли-этиленоксидными группами и с K2HPO4–KH2PO4 в качестве высаливающих агентов. Показано, что может быть достигнуто практически количественное извлечение в результате одностадийной экстракции. Методами УФ- и ИК-спектроскопии подтверждено, что ионная жидкость не изменяет структуру белка [245]. Однако движущая сила экстракции белков до конца не выяснена. Авторы работ [244, 247] полагают, что электростатические взаимодействия между отрицательно заряженными аминокислотными остатками на поверхности белка и катионом ИЖ являются основной причиной экстракции. Однако в работе [245] высказано мнение, что при распределении белка определяющий фактор – гидрофобные взаимодействия, тогда как электростатические взаимодействия и высаливающий эффект только содействуют экстракции.
Изучение распределения лизоцима, трипсина и миоглобина в водной двухфазной системе на основе AmmoengTM 110 и буферной системы K2HPO4–KH2PO4 показало, что поверхностный заряд и молекулярная масса являются важнейшими факторами, влияющими на распределение биомолекул [243, 247]. Белки большого размера, подобные альбумину, достаточно эффективно экстрагируются в фазу ИЖ, тогда как белки малого размера (например, миоглобин) остаются в водной фазе. Предложенная модель, описывающая распределение белковых молекул в ИЖ–ДФВС, предполагает, что электростатическое взаимодействие между отрицательно заряженным аминокислотным остатком на поверхности белка и катионом ИЖ является движущей силой экстракции. Авторы адаптировали экстракционную систему для извлечения специфических белков-мишеней, при этом оказалось возможным не только экстрагировать алкогольдегидрогеназу из клеточных экстрактов, но и использовать фазу, содержащую ИЖ и фермент, для проведения каталитической реакции с высоким выходом и высокой стабильностью фермента.
Влияние неорганических солей и углеводов на экстракцию БСА изучено в работах [244, 246]. Предложенная методология может быть весьма полезной в очистке белков от сложных матриц, так как катионы щелочных и щелочноземельных металлов, большинство переходных металлов, так же как и сахариды, имеют тенденцию оставаться в нижней насыщенной солью фазе.
Коэффициенты распределения цитохрома С, миоглобина, овальбумина, гемоглобина в ИЖ–ДФВС на основе С1C4ImCl и K2HPO4 оказались на 2‒3 порядка выше, чем полученные в двухфазной системе на основе ПЭГ [248].
Гидрофильные ИЖ и их водные растворы обеспечивают сбалансированное взаимодействие ИЖ–фермент. Они обладают способностью хорошо растворять ферменты, но при этом не сильно разрушают структуру фермента и взаимодействуют с его активными центрами. Так, липазы, широко используемые в органическом синтезе, эффективно экстрагируются с использованием ИЖ–ДФВС; наиболее эффективны оказались ИЖ на основе катионов имидазолия (С1С8Im+) и анионов Cl– и $[{\text{N}}({\text{C}}{{{\text{H}}}_{2}})_{2}^{ - }]$ [237, 249].
Серия функционализованных ИЖ на основе катиона гуанидиния изучена для создания ИЖ–ДФВС и экстракции белковых молекул. В присутствии высаливателя K2HPO4 степень извлечения из нейтральных водных растворов уменьшается в ряду лизоцим > трипсин > овальбумин > > БСА, соответствующем порядку уменьшения размера молекул. Степень извлечения белка находится в интервале 70–97% [250].
Распространенным объектом исследования в двухфазных системах на основе гидрофильных ИЖ и разных высаливающих веществ, таких как неорганические, органические соли, углеводы, ПЭГ, являются аминокислоты [215, 217, 235, 251]. Лучше всего обычно экстрагируются ароматические аминокислоты. Механизм распределения аминокислот сложен и до конца не выяснен; очевидна роль гидрофобных взаимодействий, образования водородных связей, электростатических взаимодействий и высаливания.
Экстракцию аминокислот в двухфазных системах на основе имидазолиевых ИЖ и неорганической соли K3PO4 систематически исследовали в работах [235, 252]. Коэффициент распределения L-триптофана в системе aC1ImCl–K3PO4–Н2О составляет более 120 [252], что значительно превышает значения, полученные для традиционной системы на основе ПЭГ (К ≈ 1–7 [253, 254]). Влияние катионной составляющей ИЖ более существенно, чем анионной. Так, присутствие бензильной группы, двойных связей в боковых цепях имидазолиевого катиона, а также образование водородных связей способствует увеличению коэффициентов распределения [252].
Экстракция триптофана в ИЖ–ДФВС на основе фосфониевой ИЖ P1444С1SO4 и K3PO4 (25 мас. % ИЖ и 15 мас. % K3PO4, 298 K) изучена в работе [215]. Коэффициент распределения триптофана (К ≈ 9.00) оказался выше, чем для имидазолиевой ИЖ с подобным анионом (К ≈ ≈ 4.47 [255]). Фосфониевые ИЖ имеют плотность ниже, чем у воды (в отличие от имидазолиевых), обладают более высокой термической стабильностью, а отсутствие “кислого” протона делает их более стабильными в присутствии нуклеофилов и оснований.
Изучена экстракционная способность ИЖ–ДФВС на основе имидазолиевых ИЖ и солей лимонной кислоты. Цитрат-ионы считаются биоразлагаемыми, соответственно системы на их основе более экологичны. Изучено влияние заряда, структуры, физико-химических свойств аминокислот на их распределение в системе С4МImBr–цитрат калия [251]. Отмечена хорошая корреляция между величиной коэффициента распределения аминокислоты и ее гидрофобностью. Коэффициенты распределения аминокислот уменьшаются в ряду триптофан > тирозин > фенилаланин > лейцин > валин, согласующемся с рядом уменьшения гидрофобности. Ароматические аминокислоты и аминокислоты с длинной боковой цепью экстрагируются эффективнее. Ухудшение экстракции при снижении рН с 7 до 5 связывают с уменьшением высаливающего действия цитрата при подкислении раствора, а также с переходом от нейтральной к катионной форме аминокислоты.
Для экстракции аминокислот перспективными оказались водные двухфазные системы ИЖ–углевод–вода и ИЖ–ПЭГ–вода. Углеводы интересны тем, что не заряжены, биоразлагаемы, нетоксичны, обладают умеренным сродством к воде и высаливающим действием. Изучение распределения веществ разной гидрофобности в системе ИЖ–углевод (моносахариды, дисахариды, и полиолы: D-глюкоза, D-фруктоза, D-манноза, D-ксилоза, D-малтитол, ксилитол, D-сорбитол) показало, что для гидрофильных соединений, таких как аминокислоты (например, триптофан), экстракция зависит от типа ИЖ и специфических взаимодействий между ИЖ и аминокислотой и практически не зависит от используемого для создания двухфазной системы углевода. Степень извлечения не превышает 50%. Для умеренно полярных веществ, например кофеина, извлечение слабо зависит от способности углевода к гидратации. Для гидрофобных соединений экстракция может быть улучшена правильным выбором углевода, т.е. обладающим высокой способностью к гидратации и высаливающим действием. Так, коэффициенты распределения β-каротина в системе С1C4ImCF3SO3 (40 мас. %)–углевод (25 мас. %) составили от 5.5 до 24, степень извлечения до 95% [217].
Экстракция триптофана и тирозина в двухфазной системе на основе ИЖ и ППГ 400 изучена в работе [230]. Обе аминокислоты обладают ароматической π-системой, что предполагает возможность взаимодействия с имидазолиевым катионом. Предпочтительное распределение триптофана в фазу, обогащенную С1C2ImBr, авторы связывают с усиленным π–π взаимодействием за счет пиррольного кольца в молекуле триптофана. Распределение же тирозина обусловлено образованием водородной связи между OH-группой боковой цепи аминокислоты и атомом ПЭГ.
Распределение аминокислот изучено в ДФВС на основе функционализованных ИЖ. Коэффициент распределения триптофана в системе хлорид 3-метил-1-(N,N-диэтилкарбонилметил)имидазолия–К2НРО4 при рН 13 составил 180. При использовании ИЖ с двумя амидными группами (хлорид 1,3-бис(N,N-диэтилкарбонилметил)имидазолия) значение коэффициента распределения возросло до 570, что согласуется с предположением об образовании водородной связи между амидной группой ИЖ и водородом аминогруппы триптофана [256].
Экстракция антибиотиков в ИЖ–ДФВС с гидрофильной ИЖ С1C4ImBF4 и различными неорганическими солями представлена в работах [220, 221, 223, 257, 258]. В присутствии таких высаливателей, как Na2SO4, Na2HPO4, NaH2PO4, степень извлечения пенициллина превысила 90%, причем коэффициент распределения пенициллина увеличивался с увеличением гидрофобности ИЖ в следующем ряду: С1C4ImBr < < С1C4ImBF4 < С1С1C4ImBF4 < С1C8ImBr. Двухфазная водная система на основе ионной жидкости обеспечивает более высокие коэффициенты распределения, чем традиционная система на основе водорастворимых полимеров. В отличие от стандартной экстракции пенициллина бутилацетатом, которую проводят при рН 2, в ИЖ–ДФВС экстракция эффективна при рН 4–5. Это важно, поскольку пенициллин недостаточно стабилен в кислой среде, а предложенный метод позволяет проводить экстракцию в более мягких условиях. Извлечение пенициллина из культуральной жидкости составило 93% для системы С1C4ImСl (20 мас. %)–NaH2PO4 (40 мас. %) [258].
Степень извлечения хлороамфеникола из пищевых продуктов с использованием системы С1C4ImCl–K2HPO4 составила 98.5%, что несколько превосходит результаты, полученные для традиционной ДФВС [259]. При использовании аминокислоты в качестве промотора фазового разделения вместо неорганической соли (система С1C4ImCF3SO3–лизин) коэффициент распределения ципрофлаксина составил 2.7. Это значение ниже, чем полученное в системах с неорганическими солями, что вполне объяснимо высоким высаливающим действием последних [223].
Рис. 1.
Динамика числа публикаций по ионным жидкостям: (◼) – все; (⚫) ‒ публикации по аналитической химии.
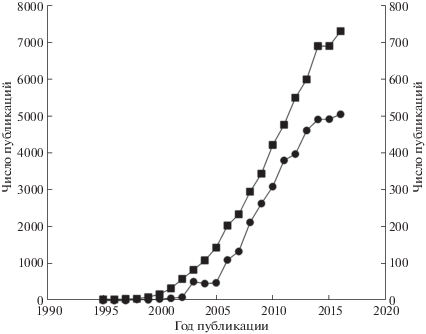
Двухфазные водные системы на основе солей холина, ПЭГ и различных высаливателей изучены в работах [220, 221]. Интересно, что распределение тетрациклина в таких системах определяется в первую очередь природой ее компонентов Так, в системе ПЭГ–хлорид холина тетрациклин распределяется в фазу, насыщенную полимером, со степенью извлечения 81.6% при рН 4–5, а в системе хлорид холина–К3РО4 в фазу, насыщенную холином, причем степень извлечения составила 92.4% при рН > 13. Исследованные системы успешно применены для извлечения антибиотика из раствора микробиологического производства.
Экстракция алкалоидов в двухфазной системе на основе С1C4ImСl–K2HPO4 впервые продемонстрирована в работе [260]. Позже авторы работы [261] подробно изучили влияние катионной и анионной составляющих имидазолевых ИЖ на эффективность экстракции в системах из гидрофильной ИЖ и неорганической соли K3PO4. Для кофеина и никотина удалось подобрать условия однократной количественной экстракции, коэффициенты распределения около 120. Изучение распределения кофеина, никотина, теофиллина и теобромина в двухфазных системах на основе имидазолиевых ИЖ С1СnImCl и цитрата калия показало, что коэффициенты распределения увеличиваются с увеличением длины алкильного заместителя в боковой цепи имидазолия до n = 6. Для системы С1С6ImCl–цитрат калия (рН 7) значения коэффициента распределения составили 13.00, 8.43, 12.33 и 8.62 для кофеина, никотина, теофиллина и теобромина соответственно. Ухудшение экстракции в ИЖ с n > 6 связывают с самоагрегацией и мицеллообразованием ИЖ [222]. В двухфазных системах ИЖ–полимер–вода эффективность извлечения алкалоидов определяется в первую очередь гидрофобностью последнего. Показано, что эффективность экстракции убывает в ряду никотин > ксантин > кофеин, соответствующем ряду уменьшения гидрофобности. Никотин и ксантин распределяются предпочтительно в фазу ИЖ, кофеин – в фазу ПЭГ [262].
Китайские исследователи [263] описали двухступенчатую схему извлечения природных полифенолов – кукруминоидов – из растений. Сначала из твердого образца выщелачивли целевые соединения в ДФВС на основе С2С2ImI–K2HPO4 при интенсивном перемешивании. После центрифугирования отделяли обогащенный ИЖ концентрат, добавляли LiTf2N и экстрагировали куркуминоиды в образующуюся in situ гидрофобную ИЖ С2С2ImTf2N; далее целевые соединения реэкстрагировали щелочным водным раствором. Авторы указывают на то, что двухступенчатая схема обеспечивает возобновление ИЖ, правда, в изменнном виде бис(трифлил)имидной соли. Не очень ясно, является ли это существенным достоинством метода. Аналогичным образом экстрагировали аконитиновые алкалоиды из растительного сырья с использованием ДФВС на основе С1С6ImBr [264]. При этом данную гидрофильную ИЖ применяли для выщелачивания аналитов из порошкообразного образца при обработке ультразвуком. Затем добавляли K2HPO4, отделяли обогащенный ИЖ слой образующейся ДФВС; который либо анализировали методом ВЭЖХ, либо проводили вторую стадию экстракции в образующуюся in situ гидрофобную ИЖ С1С6ImPF6 c последующей реэкстракцией целевых соединений водным раствором HCl.
Описано определение витамина В12 в биологических жидкостях: экстракцию проводили в ДФВС на основе С1C6ImCl–K2HPO4, определение – методом ВЭЖХ. Степень извлечения составила 97%, предел обнаружения 0.09 мкг/мл [265].
Список литературы
Johnson K.E. What’s an ionic liquid? // Electrochem. Soc. Interface. 2007. V. 16. № 1. P. 38.
Raade J.W., Padowitz D. Development of molten salt heat transfer fluid with low melting point and high thermal stability // J. Sol. Energy Eng. 2011. V. 133. № 3. P. 031013.
Angell C.A. A new class of molten salt mixtures. The hydrated dipositive ion as an independent cation species // J. Electrochem. Soc. 1965. V. 112. № 12. P. 1224.
Wilcox R.J., Losey B.P., Folmer J.C.W., Martin J.D., Zeller M., Sommer R. Crystalline and liquid structure of zinc chloride trihydrate: A unique ionic liquid // Inorg. Chem. 2015. V. 54. № 3. P. 1109.
Ngo H.L., LeCompte K., Hargens L., McEwen A.B. Thermal properties of imidazolium ionic liquids // Thermochim. Acta. 2000. V. 357–358. P. 97.
Holbrey J.D., Reichert W.M., Nieuwenhuyzen M., Johnson S., Seddon K.R., Rogers R.D. Crystal polymorphism in 1-butyl-3-methylimidazolium halides: supporting ionic liquid formation by inhibition of crystallization // Chem. Commun. 2003. № 14. P. 1636.
Hayashi S., Ozawa R., Hamaguchi H. Raman spectra, crystal polymorphism, and structure of a prototype ionic-liquid [bmim]Cl // Chem. Lett. 2003. V. 32. № 6. P. 498.
Saha S., Hayashi S., Kobayashi A., Hamaguchi H. Crystal structure of 1-butyl-3-methylimidazolium chloride. A clue to the elucidation of the ionic liquid structure // Chem. Lett. 2003. V. 32. № 8. P. 740.
Ozawa R., Hayashi S., Saha S., Kobayashi A., Hamaguchi H. Rotational isomerism and structure of the 1-butyl-3-methylimidazolium cation in the ionic liquid state // Chem. Lett. 2003. V. 32. № 10. P. 948.
Tokuda H., Hayamizu K., Ishii K., Susan M.A.B.H., Watanabe M. Physicochemical properties and structures of room temperature ionic liquids. 2. Variation of alkyl chain length in imidazolium cation // J. Phys. Chem. B. 2005. V. 109. № 13. P. 6103.
Gebbie M.A., Valtiner M., Banquy X., Fox E.T., Henderson W.A., Israelachvili J.N. Ionic liquids behave as dilute electrolyte solutions // PNAS. 2013. V. 110. № 24. P. 9674.
Hayes R., Warr G.G., Atkin R. Structure and nanostructure in ionic liquids // Chem. Rev. 2015. V. 115. № 13. P. 6357.
Gebbie M.A., Smith A.M., Dobbs H.A., Lee A.A., Warr G.G., Banquy X., Valtiner M., Rutland M.W., Israelachvili J.N., Perkin S., Atkin R. Long range electrostatic forces in ionic liquids // Chem. Commun. 2017. V. 53. № 7. P. 1214.
Смирнова С.В., Самарина Т.О., Ильин Д.В., Плетнев И.В. Солюбилизация 4-(2-пиридилазо)резорцина в гидрофильно-гидрофобных ионных жидкостях и экстракция ионов тяжелых металлов из водных растворов // Вестн. Моск. ун-та. Сер. 2: Химия. 2015. Т. 56. № 5. С. 32. (Smirnova S.V., Samarina T.O., Il’in D.V., PletnevI.V. Solubilization of 4-(2-pyridylazo)-resorcinol in hydrophobic– hydrophilic ionic liquids and extraction of heavy metal ions from aqueous solutions // Mosc. Univ. Chem. Bull. 2015. V. 70. № 5. P. 229.)
Egorov V.M., Djigailo D.I., Momotenko D.S., Chernyshov D.V., Torocheshnikova I.I., Smirnova S.V., Pletnev I.V. Task-specific ionic liquid trioctylmethylammonium salicylate as extraction solvent for transition metal ions // Talanta. 2010. V. 80. № 3. P. 1177.
Smirnova S.V., Samarina T.O., Pletnev I.V. Hydrophobic–hydrophilic ionic liquids for the extraction and determination of metal ions with water-soluble reagents // Anal. Methods. 2015. V. 7. № 22. P. 9629.
Smith E.L., Abbott A.P., Ryder K.S. Deep eutectic solvents (DESs) and their applications // Chem. Rev. 2014. V. 114. № 21. P. 11060.
Holbrey J.D., Seddon K.R. Ionic liquids // Clean Products and Processes. 1999. V. 1. № 4. P. 223.
Ionic Liquids Database – ILThermo [Electronic resource]. http://ilthermo.boulder.nist.gov/ (03.01.2018).
Marcus Y. The Properties of Solvents. Chichester, New York: Wiley, 1998.
Plechkova N.V., Seddon K. R. Applications of ionic liquids in the chemical industry // Chem. Soc. Rev. 2008. V. 37. P. 123.
Shi R., Wang Y. Dual ionic and organic nature of ionic liquids // Scientific Reports. 2016. V. 6. P. 19644.
Shimizu K., Tariq M., Gomes M.F.C., Rebelo L.P.N., Lopes J.N.C. Assessing the dispersive and electrostatic components of the cohesive energy of ionic liquids using molecular dynamics simulations and molar refraction data // J. Phys. Chem. B. 2010. V. 114. № 17. P. 5831.
Earle M.J., Esperança J.M.S.S., Gilea M.A., Canongia Lopes J.N., Rebelo L.P.N., Magee J.W., Seddon K.R., Widegren J.A. The distillation and vitality of ionic liquids // Nature. 2006. V. 439. № 7078. P. 831.
Leal J., Esperanca J., da Piedade M., Lopes J., Rebelo L., Seddon K. The nature of ionic liquids in the gas phase // J. Phys. Chem. A. 2007. V. 111. № 28. P. 6176.
Emel’yanenko V.N., Boeck G., Verevkin S.P., Ludwig R. Volatile times for the very first ionic liquid: Understanding the vapor pressures and enthalpies of vaporization of ethylammonium nitrate // Chem. Eur. J. 2014. V. 20. № 37. P. 11640.
Galinski M., Lewandowski A., Stepniak I. Ionic liquids as electrolytes // Electrochim. Acta. 2006. V. 51. № 26. P. 5567.
P. Walden. Ueber die Molekulargrösse und elektrische Leitfähigkeit einiger geschmolzenen Salze // Извѣстія Императорской Академіи Наукъ. VI серiя. 1914. V. 8. № 6. P. 405.
Wilkes J. A short history of ionic liquids – from molten salts to neoteric solvents // Green Chem. 2002. V. 4. № 2. P. 73.
Hurley F. H. Electrodeposition of aluminum: pat. US2446331 A USA. 1948.
Gale R., Gilbert B., Osteryoung R. Raman spectra of molten aluminum chloride: 1-butylpyridinium chloride systems at ambient temperatures // Inorg. Chem. 1978. V. 17. № 10. P. 2728.
Wilkes J.S., Levisky J.A., Landers J.S., Vaugh R.L., Hussey C.L. A New Class of Room Temperature Molten Salts for Battery Application. Technical Report FJSRL-TR-81-0011 (DTIC ADA148490), Defense Technical Information Center, USA, 1981. 3 p. https://ia800102.us.archive.org/19/items/DTIC_ADA148490/DTIC_ADA148490.pdf (26.06.2018)
Wilkes J.S., Levisky J.A. Dialkylimidazolium Chlorides. Technical Report No. FJSRL-TR81-0001 (DTIC ADA094772), Defense Technical Information Center, USA, 1981. 17 p. https://ia800104.us.archive.org/14/items/DTIC_ADA094772/DTIC_ADA094772.pdf (26.06.2018)
Wilkes J.S., Zaworotko M.J. Air and water stable 1-ethyl-3-methylimidazolium based ionic liquids // J. Chem. Soc. Chem. Commun. 1992. № 13. P. 965.
Ionic Liquids in Synthesis / Eds. Wasserscheid P., Welton T. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2002. 364 p.
Асланов Л.А., Захаров М.А., Абрамычева Н.Л. Ионные жидкости в ряду растворителей. М.: Изд-во Моск. ун-та, 2005. 272 с.
Koel M. Ionic Liquids in Chemical Analysis. Boca Raton: CRC Press, 2008. 456 p.
Koel M. Analytical Applications of Ionic Liquids. London: World Scientific. (Europe), 2016. 436 p.
Seddon K.R., Plechkova N.V. Ionic Liquids UnCOILed: Critical Expert Overviews. Hoboken, N.J.: John Wiley & Sons, 2012. 528 p.
Ionic Liquids Further UnCOILed: Critical Expert Overviews / Eds. Plechkova N.V., Seddon K.R., Hoboken N.J. USA: John Wiley & Sons, Inc., 2014. 438 p.
Plechkova N.V., Seddon K.R. Ionic Liquids Completely UnCOILed: Critical Expert Overviews. Hoboken, N.J.: John Wiley & Sons, 2015. 583 p.
Плетнев И.В., Смирнова С.В., Хачатрян К.С., Зернов В.В. Применение ионных жидкостей в экстракции // Рос. хим. журн. 2004. Т. 48. С. 51.
Pletnev I.V., Smirnova S.V., Egorov V. M. Liquid-liquid extraction of organic compounds / Ionic Liquids in Chemical Analysis / Ed. Mihkel Koel. Boca Raton:CRC Press, 2008. P. 243.
Smirnova S.V., Samarina T.O., Pletnev I.V. Novel ionic liquids for liquid-liquid extraction // Analytical Applications of Ionic Liquids / Ed. Mihkel Koel. World Scientific, 2016. P. 139.
Шведене Н.В., Чернышёв Д.В., Плетнев И.В. Ионные жидкости в электрохимических сенсорах // Рос. хим. журн. 2008. Т. 52. № 2. С. 80.
Campillo N., Vinas P., Sandrejova J., Andruch V. Ten years of dispersive liquid-liquid microextraction and derived techniques // Appl. Spectrosc. Rev. 2017. V. 52. № 4. P. 267.
Крылов В.А., Крылов А.В., Мосягин П.В., Маткивская Ю.О. Жидкофазное микроэкстракционное концентрирование примесей // Журн. аналит. химии. 2011. Т. 66. № 4. С. 341. (Krylov V.A., Krylov A.V., Mosyagin P.V., Matkivskaya Yu.O. Liquid-phase microextraction preconcentration of impurities // J. Analyt. Chem. 2011. V. 66. № 4. P. 331.)
Kokosa J.M., Przyjazny A., Jeannot M. Solvent Microextraction: Theory and Practice. Hoboken, N.J.: John Wiley & Sons, 2009. 340 p.
Kokosa J.M. Recent trends in using single-drop microextraction and related techniques in green analytical methods // Trends Anal. Chem. 2015. V. 71. P. 194.
Liu J.F., Chi Y.G., Jiang G.B., Tai C., Peng J.F., Hu J.T. Ionic liquid-based liquid-phase microextraction, a new sample enrichment procedure for liquid chromatography // J. Chromatogr. A. 2004. V. 1026. № 1–2. P. 143.
Spietelun A., Marcinkowski L., de la Guardia M., Namiesnik J. Green aspects, developments and perspectives of liquid phase microextraction techniques // Talanta. 2014. V. 119. P. 34.
Trujillo-Rodríguez M.J., Rocío-Bautista P., Pino V., Afonso A.M. Ionic liquids in dispersive liquid−liquid microextraction // Trends Anal. Chem. 2013. V. 51. P. 87.
Han D., Tang B., Lee Y.R., Row K.H. Application of ionic liquid in liquid phase microextraction technology // J. Sep. Sci. 2012. V. 35. № 21. P. 2949.
Martinis E.M., Berton P., Wuilloud R.G. Ionic liquid-based microextraction techniques for trace-element analysis // Trends Anal. Chem. 2014. V. 60. P. 54.
Liu J., Jiang G.B., Chi Y.G., Cai Y.Q., Zhou Q.X., Hu J.T. Use of ionic liquids for liquid-phase microextraction of polycyclic aromatic hydrocarbons // Anal. Chem. 2003. V. 75. № 21. P. 5870.
Abraham M.H., Zissimos A.M., Huddleston J.G., Willauer H.D., Rogers R.D., Acree W.E. Some novel liquid partitioning systems: Water-ionic liquids and aqueous biphasic systems // Ind. Eng. Chem. Res. 2003. V. 42. № 3. P. 413.
Peng J.F., Liu J.F., Jiang G.B., Tai C., Huang M.J. Ionic liquid for high temperature headspace liquid-phase microextraction of chlorinated anilines in environmental water samples // J. Chromatogr. A. 2005. V. 1072. № 1. P. 3.
Aguilera-Herrador E., Lucena R., Cardenas S., Valcarcel M. Direct coupling of ionic liquid based single-drop microextraction and GC/MS // Anal. Chem. 2008. V. 80. № 3. P. 793.
Aguilera-Herrador E., Lucena R., Cárdenas S., Valcárcel M. Ionic liquid-based single-drop microextraction/gas chromatographic/mass spectrometric determination of benzene, toluene, ethylbenzene and xylene isomers in waters // J. Chromatogr. A. 2008. V. 1201. № 1. P. 106.
Sarafraz-Yazdi A., Mofazzeli F. Ionic liquid-based submerged single drop microextraction: a new method for the determination of aromatic amines in Eenvironmental water samples // Chromatographia. 2010. V. 72. № 9–10. P. 867.
Zhou Q., Ye C. Ionic liquid for improved single-drop microextraction of aromatic amines in water samples // Microchim. Acta. 2008. V. 162. № 1–2. P. 153.
Ye C., Zhou Q., Wang X., Xiao J. Determination of phenols in environmental water samples by ionic liquid-based headspace liquid-phase microextraction coupled with high-performance liquid chromatography // J. Sep. Sci. 2007. V. 30. № 1. P. 42.
Wang Q., Qiu H., Li J., Liu X., Jiang S. On-line coupling of ionic liquid-based single-drop microextraction with capillary electrophoresis for sensitive detection of phenols // J. Chromatogr. A. 2010. V. 1217. № 33. P. 5434.
Ye C.-L., Zhou Q.-X., Wang X.-M. Headspace liquid-phase microextraction using ionic liquid as extractant for the preconcentration of dichlorodiphenyltrichloroethane and its metabolites at trace levels in water samples // Anal. Chim. Acta. 2006. V. 572. № 2. P. 165.
Liu J., Chi Y., Jiang G. Screening the extractability of some typical environmental pollutants by ionic liquids in liquid-phase microextraction // J. Sep. Sci. 2005. V. 28. № 1. P. 87.
Márquez-Sillero I., Cárdenas S., Valcárcel M. Direct determination of 2,4,6-tricholoroanisole in wines by single-drop ionic liquid microextraction coupled with multicapillary column separation and ion mobility spectrometry detection // J. Chromatogr. A. 2011. V. 1218. № 42. P. 7574.
Márquez-Sillero I., Aguilera-Herrador E., Cárdenas S., Valcárcel M. Determination of 2,4,6-tricholoroanisole in water and wine samples by ionic liquid-based single-drop microextraction and ion mobility spectrometry // Anal. Chim. Acta. 2011. V. 702. № 2. P. 199.
Cruz-Vera M., Lucena R., Cárdenas S., Valcárcel M. Ionic liquid-based dynamic liquid-phase microextraction: Application to the determination of anti-inflammatory drugs in urine samples // J. Chromatogr. A. 2008. V. 1202. № 1. P. 1.
Cruz-Vera M., Lucena R., Cárdenas S., Valcárcel M. Determination of phenothiazine derivatives in human urine by using ionic liquid-based dynamic liquid-phase microextraction coupled with liquid chromatography // J. Chromatogr. B. 2009. V. 877. № 1–2. P. 37.
Pena-Pereira F., Lavilla I., Bendicho C., Vidal L., Canals A. Speciation of mercury by ionic liquid-based single-drop microextraction combined with high-performance liquid chromatography-photodiode array detection // Talanta. 2009. V. 78. № 2. P. 537.
Wen X., Deng Q., Wang J., Yang S., Zhao X. A new coupling of ionic liquid based-single drop microextraction with tungsten coil electrothermal atomic absorption spectrometry // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2013. V. 105. P. 320.
Manzoori J.L., Amjadi M., Abulhassani J. Ultra-trace determination of lead in water and food samples by using ionic liquid-based single drop microextraction-electrothermal atomic absorption spectrometry // Anal. Chim. Acta. 2009. V. 644. № 1–2. P. 48.
Song Y., Wu L., Lu C., Li N., Hu M., Wang Z. Microwave-assisted liquid-liquid microextraction based on solidification of ionic liquid for the determination of sulfonamides in environmental water samples // J. Sep. Sci. 2014. V. 37. P. 3533.
Yang M., Zhang P., Hu L., Lu R., Zhou W., Zhang S., Gao H. Ionic liquid-assisted liquid-phase microextraction based on the solidification of floating organic droplets combined with high performance liquid chromatography for the determination of benzoylurea insecticide in fruit juice // J. Chromatogr. A. 2014. V. 1360. P. 47.
Peng J.-F., Liu J.-F., Hu X.-L., Jiang G.-B. Direct determination of chlorophenols in environmental water samples by hollow fiber supported ionic liquid membrane extraction coupled with high-performance liquid chromatography // J. Chromatogr. A. 2007. V. 1139. № 2. P. 165.
Ma X., Huang M., Li Z., Wu J. Hollow fiber supported liquid-phase microextraction using ionic liquid as extractant for preconcentration of benzene, toluene, ethylbenzene and xylenes from water sample with gas chromatography-hydrogen flame ionization detection // J. Hazard. Mater. 2011. V. 194. P. 24.
Tao Y., Liu J.-F., Hu X.-L., Li H.-C., Wang T., Jiang G.-B. Hollow fiber supported ionic liquid membrane microextraction for determination of sulfonamides in environmental water samples by high-performance liquid chromatography // J. Chromatogr. A. 2009. V. 1216. № 35. P. 6259.
Ge D., Lee H.K. Ionic liquid based hollow fiber supported liquid phase microextraction of ultraviolet filters // J. Chromatogr. A. 2012. V. 1229. P. 1.
Yao C., Pitner W.R., Anderson J.L. Ionic liquids containing the tris(pentafluoroethyl)trifluorophosphate anion: A new class of highly selective and ultra hydrophobic solvents for the extraction of polycyclic aromatic hydrocarbons using single drop microextraction // Anal. Chem. 2009. V. 81. № 12. P. 5054.
Wang S.-R., Wang S. Ionic liquid-based hollow fiber-supported liquid-phase microextraction enhanced electrically for the determination of neutral red // J. Food Drug Anal. 2014. V. 22. № 4. P. 418.
Zou Y.M., Zhang Z., Shao X.L., Chen Y., Wu X.Y., Yang L.Q., Zhu J.J., Zhang D.M. Application of three phase hollow fiber LPME using an ionic liquid as supported phase for preconcentration of bisphenol A and diethylstilbestrol from water sample with HPLC detection // J. Liq. Chromatogr. Relat. Technol. 2015. V. 38. P. 8.
Liu W., Wei Z., Zhang Q., Wu F., Lin Z., Lu Q., Lin F., Chen G., Zhang L. Novel multifunctional acceptor phase additive of water-miscible ionic liquid in hollow-fiber protected liquid phase microextraction // Talanta. 2012. V. 88. P. 43.
Abulhassani J., Manzoori J.L., Amjadi M. Hollow fiber based-liquid phase microextraction using ionic liquid solvent for preconcentration of lead and nickel from environmental and biological samples prior to determination by electrothermal atomic absorption spectrometry // J. Hazard. Mater. 2010. V. 176. № 1–3. P. 481.
Zeng C., Hu Y., Luo J. Ionic liquid-based hollow fiber supported liquid membrane extraction combined with thermospray flame furnace AAS for the determination of cadmium // Microchim Acta. 2012. V. 177. № 1–2. P. 53.
Wang Z., Xu Q., Li S., Luan L., Li J., Zhang S., Dong H. Hollow fiber supported ionic liquid membrane microextraction for speciation of mercury by high-performance liquid chromatography-inductively coupled plasma mass spectrometry // Anal. Methods. 2015. V. 7. № 3. P. 1140.
Chen H., Han J., Wang Y., Hu Y., Ni L., Liu Y., Kang W., Liu Y. Hollow fiber liquid-phase microextraction of cadmium(II) using an ionic liquid as the extractant // Microchim. Acta. 2014. V. 181. № 11–12. P. 1455.
Pimparu R., Nitiyanontakit S., Miro M., Varanusupakul P. Dynamic single-interface hollow fiber liquid phase microextraction of Cr (VI) using ionic liquid containing supported liquid membrane // Talanta. 2016. V. 161. P. 730.
Hsu K.-C., Lee C.-F., Chao Y.-Y., Hung C.-C., Chen P.-C., Chiang C.-H., Huang Y.-L. Ultrasound-assisted hollow fiber/ionic liquid-based liquid phase microextraction using an ionic liquid solvent for preconcentration of cobalt and nickel ions in urine samples prior to FAAS determination // J. Anal. At. Spectrom. 2016. V. 31. № 11. P. 2338.
Rezaee M., Assadi Y., Hosseinia M., Aghaee E., Ahmadi F., Berijani S. Determination of organic compounds in water using dispersive liquid−liquid microextraction // J. Chromatogr. A. 2006. V. 1116. № 1–2. P. 1.
Zhou Q., Bai H., Xie G., Xiao J. Trace determination of organophosphorus pesticides in environmental samples by temperature-controlled ionic liquid dispersive liquid-phase microextraction // J. Chromatogr. A. 2008. V. 1188. № 2. P. 148.
Baghdadi M., Shemirani F. Cold-induced aggregation microextraction: A novel sample preparation technique based on ionic liquids // Anal. Chim. Acta. 2008. V. 613. № 1. P. 56.
Liu Y., Zhao E., Zhu W., Gao H., Zhou Z. Determination of four heterocyclic insecticides by ionic liquid dispersive liquid–liquid microextraction in water samples // J. Chromatogr. A. 2009. V. 1216. № 6. P. 885.
He L., Luo X., Xie H., Wang C., Jiang X., Lu K. Ionic liquid-based dispersive liquid–liquid microextraction followed high-performance liquid chromatography for the determination of organophosphorus pesticides in water sample // Anal. Chim. Acta. 2009. V. 655. № 1–2. P. 52.
Ravelo-Pérez L.M., Hernández-Borges J., Asensio-Ramos M., Rodríguez-Delgado M.Á. Ionic liquid based dispersive liquid–liquid microextraction for the extraction of pesticides from bananas // J. Chromatogr. A. 2009. V. 1216. № 43. P. 7336.
Wang Y.L., You L.Q., Mei Y.W., Liu J.P., He L.J. Benzyl functionalized ionic liquid as new extraction solvent of dispersive liquid−liquid microextraction for enrichment of organophosphorus pesticides and aromatic compounds // Chin. J. Anal. Chem. 2016. V. 44. P. 942.
Pena M.T., Casais M.C., Mejuto M.C., Cela R. Development of an ionic liquid based dispersive liquid–liquid microextraction method for the analysis of polycyclic aromatic hydrocarbons in water samples // J. Chromatogr. A. 2009. V. 1216. № 36. P. 6356.
Zhou C., Tong S., Chang Y., Jia Q., Zhou W. Ionic liquid-based dispersive liquid–liquid microextraction with back-extraction coupled with capillary electrophoresis to determine phenolic compounds // Electrophoresis. 2012. V. 33. № 8. P. 1331.
Yang P., Ren H., Qiu H., Liu X., Jiang S. Determination of four trace preservatives in street food by ionic liquid-based dispersive liquid−liquid microextraction // Chem. Pap. 2011. V. 65. № 6. P. 747.
Wang R., Qi X., Zhao L., Liu S., Gao S., Ma X., Deng Y. Ionic-liquid-based dispersive liquid−liquid microextraction coupled with high-performance liquid chromatography for the forensic determination of methamphetamine in human urine // J. Sep. Sci. 2016. V. 39. № 13. P. 2444.
Xie Q., Sun D., Cao J., Jia L., Hou B., Li D. Determination of alpha-tocopherol in cereal grains by use of saponification coupled with ionic-liquid-based dispersive liquid−liquid microextraction before high-performance liquid chromatography-mass spectrometry // Anal. Methods. 2016. V. 8. № 26. P. 5283.
Hu H., Liu B., Yang J., Lin Z., Gan W. Sensitive determination of trace urinary 3-hydroxybenzo[a]pyrene using ionic liquids-based dispersive liquid−liquid microextraction followed by chemical derivatization and high performance liquid chromatography-high resolution tandem mass spectrometry // J. Chromatogr. B. 2016. V. 1027. P. 200.
Li Z., Chen F., Wang X., Wang C. Ionic liquids dispersive liquid–liquid microextraction and high-performance liquid chromatographic determination of irbesartan and valsartan in human urine // Biomed. Chromatogr. 2013. V. 27. № 2. P. 254.
Cruz-Vera M., Lucena R., Cárdenas S., Valcárcel M. One-step in-syringe ionic liquid-based dispersive liquid–liquid microextraction // J. Chromatogr. A. 2009. V. 1216. № 37. P. 6459.
Arvand M., Bozorgzadeh E., Shariati S., Zanjanchi M.A. Ionic liquid-based dispersive liquid–liquid microextraction for the determination of formaldehyde in wastewaters and detergents // Environ. Monit. Assess. 2012. V. 184. № 12. P. 7597.
Lubomirsky E., Padro J.M., Reta M.R. Development of a dispersive liquid−liquid microextraction technique for the analysis of aryloxyphenoxy-propionate herbicides in soy-based foods // Microchem. J. 2016. V. 129. P. 63.
Medina G.S., Reta M. Development of a dispersive liquid−liquid microextraction method using a lighter-than-water ionic liquid for the analysis of polycyclic aromatic hydrocarbons in water // J. Sep. Sci. 2016. V. 39. № 21. P. 4209.
Zhao R.-S., Wang X., Sun J., Hu C., Wang X.-K. Determination of triclosan and triclocarban in environmental water samples with ionic liquid/ionic liquid dispersive liquid−liquid microextraction prior to HPLC-ESI-MS/ MS // Microchim. Acta. 2011. V. 174. № 1–2. P. 145.
Zhao R.-S., Wang X., Zhang L.-L., Wang S.-S., Yuan J.-P. Ionic liquid/ionic liquid dispersive liquid–liquid microextraction, a new sample enrichment procedure for the determination of hexabromocyclododecane diastereomers in environmental water samples // Anal. Methods. 2011. V. 3. P. 831.
Escudero L.B., Martinis E.M., Olsina R.A., Wuilloud R.G. Arsenic speciation analysis in mono-varietal wines by on-line ionic liquid-based dispersive liquid–liquid microextraction // Food Chem. 2013. V. 138. № 1. P. 484.
Mallah M.H., Shemirani F., Maragheh M.G. Ionic liquids for simultaneous preconcentration of some lanthanoids using dispersive liquid−liquid microextraction technique in uranium dioxide powder // Environ. Sci. Technol. 2009. V. 43. № 6. P. 1947.
Berton P., Wuilloud R.G. Highly selective ionic liquid-based microextraction method for sensitive trace cobalt determination in environmental and biological samples // Anal. Chim. Acta. 2010. V. 662. № 2. P. 155.
Berton P., Wuilloud G.R. An online ionic liquid−based microextraction system coupled to electrothermal atomic absorption spectrometry for cobalt determination in environmental samples and pharmaceutical formulations // Anal. Methods. 2011. V. 3. № 3. P. 664.
Razmislevičienė I., Olšauskaitė V., Padarauskas A. Ionic liquid-based dispersive liquid−liquid microextraction combined with ultra performance liquid chromatography for the determination of metal ions // Chemija. 2011. V. 22. № 4. P. 197.
Martinis E.M., Escudero L.B., Berton P., Monasterio R.P., Filippini M.F., Wuilloud R.G. Determination of inorganic selenium species in water and garlic samples with on-line ionic liquid dispersive microextraction and electrothermal atomic absorption spectrometry // Talanta. 2011. V. 85. № 4. P. 2182.
Shirkhanloo H., Ghazaghi M., Mousavi H.Z. Chromium speciation in human blood samples based on acetyl cysteine by dispersive liquid−liquid biomicroextraction and in vitro evaluation of acetyl cysteine/cysteine for decreasing of hexavalent chromium concentration // J. Pharm. Biomed. Anal. 2016. V. 118. P. 1.
Ranjbar L., Yamini Y., Saleh A., Seidi S., Faraji M. Ionic liquid based dispersive liquid−liquid microextraction combined with ICP-OES for the determination of trace quantities of cobalt, copper, manganese, nickel and zinc in environmental water samples // Microchim. Acta. 2012. V. 177. № 1–2. P. 119.
Hou D., Guan Y., Di X. Temperature-induced ionic liquids dispersive liquid–liquid microextraction of tetracycline antibiotics in environmental water samples assisted by complexation // Chromatographia. 2011. V. 73. № 11–12. P. 1057.
Gao Y., Zhou Q., Xie G., Yao Z. Temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with HPLC with ultraviolet detector for the determination of fungicides // J. Sep. Sci. 2012. V. 35. № 24. P. 3569.
Zeeb M., Ganjali M.R., Norouzi P. Modified ionic liquid cold-induced aggregation dispersive liquid−liquid microextraction combined with spectrofluorimetry for trace determination of ofloxacin in pharmaceutical and biological samples // DARU. 2011. V. 19. № 6. P. 446.
Zhou Q., Gao Y., Xiao J., Xie G. Sensitive determination of phenols from water samples by temperature-controlled ionic liquid dispersive liquid-phase microextraction // Anal. Methods. 2011. V. 3. № 3. P. 653.
Berton P., Martinis E., Martinezc L., Wuilloud R. Room temperature ionic liquid-based microextraction for vanadium species separation and determination in water samples by electrothermal atomic absorption spectrometry // Anal. Chim. Acta. 2009. V. 640. № 1–2. P. 40.
Zeeb M., Sadeghi M. Modified ionic liquid cold-induced aggregation dispersive liquid−liquid microextraction followed by atomic absorption spectrometry for trace determination of zinc in water and food samples // Microchim. Acta. 2011. V. 175. № 1–2. P. 159.
Zhang Z., Zhou K., Bu Y., Shan Z., Liu J., Wu X., Yang L., Chen Z. Determination of malachite green and crystal violet in environmental water using temperature-controlled ionic liquid dispersive liquid–liquid microextraction coupled with high performance liquid chromatography // Anal. Methods. 2012. V. 4. № 2. P. 429.
Jiang X., Zhang H., Chen X. Determination of phenolic compounds in water samples by HPLC following ionic liquid dispersive liquid−liquid microextraction and cold-induced aggregation // Microchim. Acta. 2011. V. 175. № 3–4. P. 341.
Bai H., Zhou Q., Xie G., Xiao J. Temperature-controlled ionic liquid–liquid-phase microextraction for the pre-concentration of lead from environmental samples prior to flame atomic absorption spectrometry // Talanta. 2010. V. 80. № 5. P. 1638.
Shah F., Kazi T.G., Naeemullah, Afridi H.I., Soylak M. Temperature controlled ionic liquid-dispersive liquid phase microextraction for determination of trace lead level in blood samples prior to analysis by flame atomic absorption spectrometry with multivariate optimization // Microchem. J. 2012. V. 101. P. 5.
Absalan G., Akhond M., Sheikhian L., Goltz D.M. Temperature-controlled ionic liquid-based dispersive liquid-phase microextraction, preconcentration and quantification of nano-amounts of silver ion by using disulfiram as complexing agent // Anal. Methods. 2011. V. 3. № 10. P. 2354.
Sadeghi S., Zeraatkar Moghaddam A. Preconcentration and speciation of trace amounts of chromium in saline samples using temperature-controlled microextraction based on ionic liquid as extraction solvent and determination by electrothermal atomic absorption spectrometry // Talanta. 2012. V. 99. P. 758.
Akhond M., Absalan G., Khoshnoodi-Ghasroddashti Y., Ershadifar H. Reflection scanometry as a new detection technique in temperature-controlled ionic liquid-based dispersive liquid phase microextraction // Anal. Methods. 2016. V. 8. № 1. P. 111.
Zhou Q., Zhang X., Xiao J. Ultrasound-assisted ionic liquid dispersive liquid-phase micro-extraction: A novel approach for the sensitive determination of aromatic amines in water samples // J. Chromatogr. A. 2009. V. 1216. № 20. P. 4361.
Parrilla Vazquez M.M., Parrilla Vazquez P., Martinez Galera M., Gil Garcia M.D., Ucles A. Ultrasound-assisted ionic liquid dispersive liquid−liquid microextraction coupled with liquid chromatography-quadrupole-linear ion trap-mass spectrometry for simultaneous analysis of pharmaceuticals in wastewaters // J. Chromatogr. A. 2013. V. 1291. P. 19.
Zhang Y., Lee H.K. Ionic liquid-based ultrasound-assisted dispersive liquid–liquid microextraction followed high-performance liquid chromatography for the determination of ultraviolet filters in environmental water samples // Anal. Chim. Acta. 2012. V. 750. P. 120.
Gao S., Yang X., Yu W., Liu Z., Zhang H. Ultrasound-assisted ionic liquid/ionic liquid-dispersive liquid–liquid microextraction for the determination of sulfonamides in infant formula milk powder using high-performance liquid chromatography // Talanta. 2012. V. 99. P. 875.
Sun J.-N., Chen J., Shi Y.-P. Multiple functional ionic liquids based dispersive liquid–liquid microextraction combined with high performance chromatography for the determination of phenolic compounds in water samples // Talanta. 2014. V. 125. P. 329.
Xu X., Su R., Zhao X., Liu Z., Li D., Li X., Zhang H., Wang Z. Determination of formaldehyde in beverages using microwave-assisted derivatization and ionic liquid-based dispersive liquid–liquid microextraction followed by high-performance liquid chromatography // Talanta. 2011. V. 85. № 5. P. 2632.
Xu X., Su R., Zhao X., Liu Z., Zhang Y., Li D., Li X., Zhang H., Wang Z. Ionic liquid-based microwave-assisted dispersive liquid–liquid microextraction and derivatization of sulfonamides in river water, honey, milk, and animal plasma // Anal. Chim. Acta. 2011. V. 707. № 1–2. P. 92.
Xu X., Liu Z., Zhao X., Su R., Zhang Y., Shi J., Zhao Y., Wu L., Ma Q., Zhou X., Zhang H., Wang Z. Ionic liquid-based microwave-assisted surfactant-improved dispersive liquid–liquid microextraction and derivatization of aminoglycosides in milk samples // J. Sep. Sci. 2013. V. 36. № 3. P. 585.
Asensio-Ramos M., Hernández-Borges J., Borges-Miquel T.M., Rodríguez-Delgado M.Á. Ionic liquid-dispersive liquid–liquid microextraction for the simultaneous determination of pesticides and metabolites in soils using high-performance liquid chromatography and fluorescence detection // J. Chromatogr. A. 2011. V. 1218. № 30. P. 4808.
Asensio-Ramos M., Hernández-Borges J., Ravelo-Pérez L.M., Afonso M.M., Palenzuela J.A., Rodríguez-Delgado M.Á. Dispersive liquid–liquid microextraction of pesticides and metabolites from soils using 1,3-dipentylimidazolium hexafluorophosphate ionic liquid as an alternative extraction solvent // Electophoresis. 2012. V. 33. № 9–10. P. 1449.
Zhang L., Chen F., Liu S., Chen B., Pan C. Ionic liquid-based vortex-assisted dispersive liquid–liquid microextraction of organophosphorus pesticides in apple and pear // J. Sep. Sci. 2012. V. 35. № 18. P. 2514.
Zhang J., Li M., Yang M., Peng B., Li Y., Zhou W., Gao H., Lu R. Magnetic retrieval of ionic liquids: Fast dispersive liquid–liquid microextraction for the determination of benzoylurea insecticides in environmental water samples // J. Chromatogr. A. 2012. V. 1254. P. 23.
Ge D., Lee H.K. Ionic liquid based dispersive liquid–liquid microextraction coupled with micro-solid phase extraction of antidepressant drugs from environmental water samples // J. Chromatogr. A. 2013. V. 1317. P. 217.
Li S., Cai S., Hu W., Chen H., Liu H. Ionic liquid-based ultrasound-assisted dispersive liquid–liquid microextraction combined with electrothermal atomic absorption spectrometry for a sensitive determination of cadmium in water samples // Spectrochim. Acta B. 2009. V. 64. № 7. P. 666.
Molaakbari E., Mostafavi A., Afzali D. Ionic liquid ultrasound assisted dispersive liquid–liquid microextraction method for preconcentration of trace amounts of rhodium prior to flame atomic absorption spectrometry determination // J. Hazard. Mater. 2011. V. 185. № 2–3. P. 647.
Khan S., Kazi T.G., Soylak M. Rapid ionic liquid-based ultrasound assisted dual magnetic microextraction to preconcentrate and separate cadmium-4-(2-thiazolylazo)-resorcinol complex from environmental and biological samples // Spectrochim. Acta A. 2014. V. 123. P. 194.
Stanisz E., Werner J., Matusiewicz H. Mercury species determination by task specific ionic liquid-based ultrasound-assisted dispersive liquid−liquid microextraction combined with cold vapour generation atomic absorption spectrometry // Microchem. J. 2013. V. 110. P. 28.
Werner J. Determination of metal ions in tea samples using task-specific ionic liquid-based ultrasound-assisted dispersive liquid−liquid microextraction coupled to liquid chromatography with ultraviolet detection // J. Sep. Sci. 2016. V. 39. № 8. P. 1411.
Shah F., Yilmaz E., Kazi T.G., Afridi H.I., Soylak M. Vortex-assisted liquid–liquid microextraction coupled to flame atomic absorption spectrometry for lead determination: ionic liquid based microextraction using Triton X-100 as dispersant // Anal. Methods. 2012. V. 4. № 12. P. 4091.
Chamsaz M., Atarodi A., Eftekhari M., Asadpour S., Adibi M. Vortex-assisted ionic liquid microextraction coupled to flame atomic absorption spectrometry for determination of trace levels of cadmium in real samples // J. Adv. Res. 2013. V. 4. № 1. P. 35.
Chamsaz M., Eftekhari M., Atarodi A., Asadpour S., Ariani M. Preconcentration procedure using vortex agitator system for determination of trace levels of cadmium by flame atomic absorption spectrometry // J. Brazil. Chem. Soc. 2012. V. 23. № 9. P. 1630.
Vaghar-Lahijani G., Aberoomand-Azar P., Saber-Tehrani M., Soleimani M. Application of ionic liquid-based ultrasonic-assisted microextraction coupled with HPLC for determination of citalopram and nortriptyline in human plasma // J. Liq. Chromatogr. Relat. Technol. 2017. V. 40. № 1. P. 1.
Albishri H.M., Aldawsari N.A.M., Abd El-Hady D. Ultrasound-assisted temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with reversed-phase liquid chromatography for determination of organophosphorus pesticides in water samples // Electrophoresis. 2016. V. 37. № 19. P. 2462.
Ma T., Li Z., Jia Q., Zhou W. Ultrasound-assisted temperature-controlled ionic liquid emulsification microextraction coupled with capillary electrophoresis for the determination of parabens in personal care products // Electrophoresis. 2016. V. 37. № 12. P. 1624.
Кубракова И.В., Мясоедова Г.В., Еремин С.А., Плетнев И.В., Моходоева О.Д., Морозова В.А., Хачатрян К.С. Подготовка проб в условиях микроволнового нагрева // Методы и объекты хим. анализа. 2006. Т. 1. № 1. С. 27.
Wang Z., Hu J., Du H., He S., Li Q., Zhang H. Microwave-assisted ionic liquid homogeneous liquid−liquid microextraction coupled with high performance liquid chromatography for the determination of anthraquinones in Rheum palmatum L. // J. Pharm. Biomed. Anal. 2016. V. 125. P. 178.
Ye L., Liu J., Yang X., Peng Y., Xu L. Orthogonal array design for the optimization of ionic liquid-based dispersive liquid–liquid microextraction of benzophenone-type UV filters // J. Sep. Sci. 2011. V. 34. № 6. P. 700.
Zhang C., Wan X.Y., Zhou C.Z., Li Y. Ionic liquid-based ultrasound-assisted dispersive liquid-liquid microextraction followed by high-performance liquid chromatography for the determination of bisphenol-A in sediment samples // Asian J. Chem. 2013. V. 25. № 16. P. 9023.
Li J.M., Shi Q.W., Jiang Y., Gao J.L., Li M.J., Ma H.Y. Microwave-assisted extraction and ionic liquid-based dispersive liquid-liquid microextraction followed by HPLC for the determination of trace components in a Langdu preparation // Anal. Methods. 2016. V. 8. P. 5218.
Chen X., Zhang X., Liu F., Hou F. Binary-solvent-based ionic-liquid-assisted surfactant-enhanced emulsification microextraction for the determination of four fungicides in apple juice and apple vinegar // J. Sep. Sci. 2017. V. 40. № 4. P. 901.
Soylak M., Yilmaz E. Determination of cadmium in fruit and vegetables by ionic liquid magnetic microextraction and flame atomic absorption spectrometry // Anal. Lett. 2015. V. 48. № 3. P. 464.
Antonio Casado-Carmona F., del Carmen Alcudia-Leon M., Lucena R., Cardenas S., Valcarcel M. Magnetic nanoparticles coated with ionic liquid for the extraction of endocrine disrupting compounds from waters // Microchem. J. 2016. V. 128. P. 347.
Joseph A., Żyła G., Thomas V.I., Nair P.R., Padmanabhan A.S., Mathew S. Paramagnetic ionic liquids for advanced applications: A review // J. Mol. Liq. 2016. V. 218. P. 319.
Clark K.D., Nacham O., Purslow J.A., Pierson S.A., Anderson J.L. Magnetic ionic liquids in analytical chemistry: A review // Anal. Chim. Acta 2016. V. 934. P. 9.
An J., Trujillo-Rodríguez M.J., Pino V., Anderson J.L. Non-conventional solvents in liquid phase microextraction and aqueous biphasic systems // J. Chromatogr. A. 2017. V. 1500. № Supplement C. P. 1.
Chatzimitakos T., Binellas C., Maidatsi K., Stalikas C. Magnetic ionic liquid in stirring-assisted drop-breakup microextraction: Proof-of-concept extraction of phenolic endocrine disrupters and acidic pharmaceuticals // Anal. Chim. Acta. 2016. V. 910. P. 53.
Trujillo-Rodriguez M.J., Nacham O., Clark K.D., Pino V., Anderson J.L., Ayala J.H., Afonso A.M. Magnetic ionic liquids as non-conventional extraction solvents for the determination of polycyclic aromatic hydrocarbons // Anal. Chim. Acta. 2016. V. 934. P. 106.
Yu H., Merib J., Anderson J.L. Faster dispersive liquid-liquid microextraction methods using magnetic ionic liquids as solvents // J. Chromatogr. A. 2016. V. 1463. P. 11.
Shirkhanloo H., Khaligh A., Mousavi H.Z., Rashidi A. Ultrasound assisted-dispersive-ionic liquid-micro-solid phase extraction based on carboxyl-functionalized nanoporous graphene for speciation and determination of trace inorganic and organic mercury species in water and caprine blood samples // Microchem. J. 2017. V. 130. P. 245.
Farajzadeh M.A., Bamorowat M., Mogaddam M.R.A. Ringer tablet-based ionic liquid phase microextraction: Application in extraction and preconcentration of neonicotinoid insecticides from fruit juice and vegetable samples // Talanta. 2016. V. 160. P. 211.
Baghdadi M., Shemirani F. In situ solvent formation microextraction based on ionic liquids: A novel sample preparation technique for determination of inorganic species in saline solutions // Anal. Chim. Acta. 2009. V. 634. № 2. P. 186.
Vaezzadeh M., Shemirani F., Majidi B. Microextraction technique based on ionic liquid for preconcentration and determination of palladium in food additive, sea water, tea and biological samples // Food Chem. Toxicol. 2010. V. 48. № 6. P. 1455.
Mahpishanian S., Shemirani F. Preconcentration procedure using in situ solvent formation microextraction in the presence of ionic liquid for cadmium determination in saline samples by flame atomic absorption spectrometry // Talanta. 2010. V. 82. № 2. P. 471.
Vaezzadeh M., Shemirani F., Majidi B. Determination of silver in real samples using homogeneous liquid-liquid microextraction based on ionic liquid // J. Analyt. Chem. 2012. V. 67. № 1. P. 28.
Zarei Z., Shemirani F. Determination of nickel in food samples by flame atomic absorption spectroscopy after preconcentration and microextraction based ionic liquids using full factorial and central composite design // J. Food Sci. 2012. V. 77. № 12. P. C1242.
Zeeb M., Ganjali M.R., Norouzi P., Kalaee M.R. Separation and preconcentration system based on microextraction with ionic liquid for determination of copper in water and food samples by stopped-flow injection spectrofluorimetry // Food Chem. Toxicol. 2011. V. 49. № 5. P. 1086.
Hosseini M., Dalali N., Nejad S.M., Jamali R. In situ solvent formation microextraction based on ionic liquids and 1-(2-hydroxynaphtalene-1-yl) ethane oxime for determination of zinc // J. Braz. Chem. Soc. 2012. V. 23. № 1. P. 78.
Sha O., Chen J., Chen L., Li S. In situ ionic liquid dispersive liquid–liquid microextraction and determination of Au (III) by flame atomic absorption spectrometry // J. Iran. Chem. Soc. 2015. V. 12. № 8. P. 1391.
Zeeb M., Mirza B., Zare-Dorabei R., Farahani H. Ionic liquid-based ultrasound-assisted in situ solvent formation microextraction combined with electrothermal atomic absorption spectrometry as a practical method for preconcentration and trace determination of vanadium in water and food samples // Food Anal. Methods. 2014. V. 7. № 9. P. 1783.
López-García I., Vicente-Martínez Y., Hernández-Córdoba M. Determination of very low amounts of chromium (III) and (VI) using dispersive liquid–liquid microextraction by in situ formation of an ionic liquid followed by electrothermal atomic absorption spectrometry // J. Anal. At. Spectrom. 2012. V. 27. № 5. P. 874.
López-García I., Vicente-Martínez Y., Hernández-Córdoba M. Determination of lead and cadmium using an ionic liquid and dispersive liquid–liquid microextraction followed by electrothermal atomic absorption spectrometry // Talanta. 2013. V. 110. P. 46.
Stanisz E., Zgoła-Grześkowiak A. In situ metathesis ionic liquid formation dispersive liquid–liquid microextraction for copper determination in water samples by electrothermal atomic absorption spectrometry // Talanta. 2013. V. 115. P. 178.
Stanisz E., Zgoła-Grześkowiak A., Matusiewicz H. Generation of Vatile copper species after in situ ionic liquid formation dispersive liquid–liquid microextraction prior to atomic absorption spectrometric detection // Talanta. 2014. V. 129. P. 254.
Eskandari H. In situ formed 1-hexyl-3-methylimidazolium hexafluorophosphate for dispersive liquid−liquid microextraction of Pd(II) prior to electrothermal AAS and spectrophotometry // Turk. J. Chem. 2012. V. 36. № 4. P. 631.
Baghdadi M., Shemirani F., Zhad H.R.L.Z. Determination of cobalt in high-salinity reverse osmosis concentrates using flame atomic absorption spectrometry after cold-induced aggregation microextraction // Anal. Methods. 2016. V. 8. № 8. P. 1908.
Yao C., Anderson J.L. Dispersive liquid–liquid microextraction using an in situ metathesis reaction to form an ionic liquid extraction phase for the preconcentration of aromatic compounds from water // Anal. Bioanal. Chem. 2009. V. 395. № 5. P. 1491.
López-Darias J., Pino V., Ayala J.H., Afonso A.M. In-situ ionic liquid-dispersive liquid−liquid microextraction method to determine endocrine disrupting phenols in seawaters and industrial effluents // Microchim. Acta. 2011. V. 174. № 3–4. P. 213.
Bi W., Tian M., Row K.H. Ultrasonication-assisted extraction and preconcentration of medicinal products from herb by ionic liquids // Talanta. 2011. V. 85. № 1. P. 701.
Zhong Q., Su P., Zhang Y., Wang R., Yang Y. In-situ ionic liquid-based microwave-assisted dispersive liquid–liquid microextraction of triazine herbicides // Microchim. Acta. 2012. V. 178. № 3–4. P. 341.
Yu C., Zhang S., Zhang J., Li S., Zhou W., Gao H., Lu R. An in situ ionic liquid dispersive liquid−liquid microextraction method for the detection of pyrethroids by LC-UV in environmental water samples // J. Braz. Chem. Soc. 2013. V. 24. № 6. P. 1034.
Germán-Hernández M., Pino V., Anderson J.L., Afonso A.M. A novel in situ preconcentration method with ionic liquid-based surfactants resulting in enhanced sensitivity for the extraction of polycyclic aromatic hydrocarbons from toasted cereals // J. Chromatogr. A. 2012. V. 1227. P. 29.
Li S., Hu L., Chen K., Gao H. Extensible automated dispersive liquid–liquid microextraction // Anal. Chim. Acta. 2015. V. 872. P. 46.
Delgado B., Pino V., Anderson J.L., Ayala J.H., Afonso A.M., González V. An in situ extraction–preconcentration method using ionic liquid-based surfactants for the determination of organic contaminants contained in marine sediments // Talanta. 2012. V. 99. P. 972.
Hosseini M., Dalali N. Use of Ionic Liquids for Trace Analysis of Methyl Tert-Butyl Ether in Water Samples using in situ Solvent Formation Microextraction Technique and Determination by GC/FID // Sep. Sci. Technol. 2014. V. 49. № 12. P. 1889.
Cacho J.I., Campillo N., Vinas P., Hernandez-Cordoba M. In situ ionic liquid dispersive liquid−liquid microextraction and direct microvial insert thermal desorption for gas chromatographic determination of bisphenol compounds // Anal. Bioanal. Chem. 2016. V. 408. P. 243.
Fan C., Li N., Cao X. Determination of chlorophenols in honey samples using in situ ionic liquid-dispersive liquid–liquid microextraction as a pretreatment method followed by high-performance liquid chromatography // Food Chem. 2015. V. 174. P. 446.
Zeeb M., Farahani H., Papan M.K. Determination of atenolol in human plasma using ionic-liquid-based ultrasound-assisted in situ solvent formation microextraction followed by high-performance liquid chromatography // J. Sep. Sci. 2016. V. 39. № 11. P. 2138.
W., Yu S., Deng Y., Pan T. Screening of lignan patterns in Schisandra species using ultrasonic assisted temperature switch ionic liquid microextraction followed by UPLC-MS/MS analysis // J. Chromatogr. B. 2016. V. 1008. P. 45.
Zhang C., Cagliero C., Pierson S.A., Anderson J.L. Rapid and sensitive analysis of polychlorinated biphenyls and acrylamide in food samples using ionic liquid-based in situ dispersive liquid−liquid microextraction coupled to headspace gas chromatography // J. Chromatogr. A. 2017. V. 1481. P. 1.
Yao C., Li T., Twu P., Pitner W.R., Anderson J.L. Selective extraction of emerging contaminants from water samples by dispersive liquid–liquid microextraction using functionalized ionic liquids // J. Chromatogr. A. 2011. V. 1218. № 12. P. 1556.
Смирнова С.В., Самарина Т.О., Ильин Д.В., Плетнев И.В., Золотов Ю.А. Метод возникающего растворителя: экстракция ионов металлов из водных растворов в образующуюся in situ ионную жидкость // Докл. Акад. наук. 2016. Т. 469. № 6. С. 691. (Smirnova S.V., Samarina T.O., Ilin D.V., Pletnev I.V., Zolotov Yu A. The method of appearing solvent: Extraction of metal ions from aqueous solutions into in situ forming ionic liquid // Dokl. Chemi. 2016. V. 469. № 2. P. 238.).
Li S., Gao H., Zhang J., Li Y., Peng B., Zhou Z. Determination of insecticides in water using in situ halide exchange reaction-assisted ionic liquid dispersive liquid–liquid microextraction followed by high-performance liquid chromatography // J. Sep. Sci. 2011. V. 34. № 22. P. 3178.
Li L., Huang M., Shao J., Lin B., Shen Q. Rapid determination of alkaloids in Macleaya cordata using ionic liquid extraction followed by multiple reaction monitoring UPLC-MS/MS analysis // J. Pharm. Biomed. Anal. 2017. V. 135. P. 61.
Zhang R., Cheng X., Guo J., Zhang H., Hao X. Comparison of two ionic liquid-based pretreatment methods for three steroids’ separation and determination in water samples by HPLC // Chromatographia. 2017. V. 80. № 2. P. 237.
Zhang Y., Yang X., Wang J., Zhou W., Lu R., Gao H., Zhang S. In situ solvent formation microextraction combined with magnetic dispersive micro-solid-phase extraction for the determination of benzoylurea insecticides in water samples // J. Sep. Sci. 2017. V. 40. № 2. P. 442.
Li T., Joshi M.D., Ronning D.R., Anderson J.L. Ionic liquids as solvents for in situ dispersive liquid–liquid microextraction of DNA // J. Chromatogr. A. 2013. V. 1272. P. 8.
Freire M.G., Cláudio A.F.M., Araújo J.M.M., Coutinho J.A.P., Marrucho I.M., Lopes J.N.C., Rebelo L.P.N. Aqueous biphasic systems: a boost brought about by using ionic liquids // Chem. Soc. Rev. 2012. V. 41. № 14. P. 4966.
Albertsson P.-A. Partition of Cell Particles and Macromolecules. 3d ed. New York: Wiley-Interscience, 1986. 346 p.
Zaslavsky B.Y. Aqueous Two-phase Partitioning: Physical Chemistry and Bioanalytical applications. Boca Raton: CRC Press, 1994. 656 p.
Oppermann S., Stein F., Kragl U. Ionic liquids for two-phase systems and their application for purification, extraction and biocatalysis // Appl. Microbiol. Biotechnol. 2011. V. 89. № 3. P. 493.
Леснов А.Е., Денисова С.А., Кудряшова О.С., Чепкасова А.В., Катаева Е.Ю., Мохнаткина Н.Н. Применение расслаивающихся систем вода−поверхностно-активное вещество−высаливатель для целей экстракции // Журн. прикл. химии. 2010. Т. 83. № 8. С. 1379.
Зварова Т.И., Шкинев В.М., Спиваков Б.Я., Золотое Ю.А. Жидкостная экстракция в системах водный раствор соли‒водный раствор полиэтиленгликоля // Докл. АН СССР. 1983. Т. 273. № 1. С. 107. (Zvarova T., Shkinev V., Spivakov B., Zolotov I. Liquid extraction in the system of aqueous salt solution− aqueous polyethylene−glycol solution // Doklady Akademii Nauk USSR. 1983. V. 273. № 1. P. 107.)
3варова Т.И., Шкинев B.M., Воробьева Г.А., Спиваков Б.Я., Золотов Ю.А. Экстракция комплексов металлов с водорастворимыми реагентами в двухфазных водных системах полиэтиленгликоль–соль–вода–органический реагент // Журн. аналит. химии. 1988. Т. 43. № 1. С. 37. (Zvarova T., Shkinev V., Vorobeva G., Spivakov B., Zolotov Y. Extraction of metal-complexes with water-soluble reagents in 2-phase aqueous polyethyleneglycol−salt−water−organic reagent systems // J. Analyt. Chem. 1988. V. 43. № 1. P. 29.)
Петров Б.И., Леснов А.Е., Денисова С.А. Фазовые и экстракционные равновесия в водных расслаивающихся системах с протолитическим взаимодействием // Журн. аналит. химии. 2015. Т. 70. № 6. С. 563. (Petrov B.I., Lesnov A.E., Denisova S.A. Phase and extraction equilibriums in aqueous segregable systems with protolytic interaction // J. Analyt. Chem. 2015. V. 70. № 6. Р. 647.)
Gutowski K.E., Broker G.A., Willauer H.D., Huddleston J.G., Swatloski R.P., Holbrey J.D., Rogers R.D. Controlling the aqueous miscibility of ionic liquids: Aqueous biphasic systems of water-miscible ionic liquids and water-structuring salts for recycle, metathesis, and separations // J. Am. Chem. Soc. 2003. V. 125. № 22. P. 6632.
Louros C.L., Cláudio A.F.M., Neves C.M., Freire M.G., Marrucho I.M., Pauly J., Coutinho J.A. Extraction of biomolecules using phosphonium-based ionic liquids + K3PO4 aqueous biphasic systems // Int. J. Mol. Sci. 2010. V. 11. № 4. P. 1777.
Cláudio A.F.M., Freire M.G., Freire C.S., Silvestre A.J., Coutinho J.A. Extraction of vanillin using ionic-liquid-based aqueous two-phase systems // Sep. Purif. Technol. 2010. V. 75. № 1. P. 39.
Freire M.G., Louros C.L., Rebelo L.P.N., Coutinho J.A. Aqueous biphasic systems composed of a water-stable ionic liquid+ carbohydrates and their applications // Green Chem. 2011. V. 13. № 6. P. 1536.
Docherty K.M., Kulpa Jr C.F. Toxicity and antimicrobial activity of imidazolium and pyridinium ionic liquids // Green Chem. 2005. V. 7. № 4. P. 185.
Ranke J., Müller A., Bottin-Weber U., Stock F., Stolte S., Arning J., Störmann R., Jastorff B. Lipophilicity parameters for ionic liquid cations and their correlation to in vitro cytotoxicity // Ecotoxicol. Environ. Saf. 2007. V. 67. № 3. P. 430.
Pereira J.F., Vicente F., Santos-Ebinuma V.C., Araújo J.M., Pessoa A., Freire M.G., Coutinho J.A. Extraction of tetracycline from fermentation broth using aqueous two-phase systems composed of polyethylene glycol and cholinium-based salts // Process Biochem. 2013. V. 48. № 4. P. 716.
Shahriari S., Tomé C.L., Araújo M.J.M., Rebelo N.L.P., Coutinho P.J.A., Marrucho M.I., Freire G.M. Aqueous biphasic systems: a benign route using cholinium-based ionic liquids // RSC Advances. 2013. V. 3. № 6. P. 1835.
Passos H., Trindade M.P., Vaz T.S.M., da Costa L.P., Freire M.G., Coutinho J.A.P. The impact of self-aggregation on the extraction of biomolecules in ionic-liquid-based aqueous two-phase systems // Sep. Purif. Technol. 2013. V. 108. P. 174.
Dominguez-Perez M., Tome L., Freire M., Marrucho I., Cabeza O., Coutinho J. (Extraction of biomolecules using) aqueous biphasic systems formed by ionic liquids and aminoacids // Sep. Purif. Techn. 2010. V. 72. № 1. P. 85.
Zhang J., Zhang Y., Chen Y., Zhang S. Mutual coexistence curve measurement of aqueous biphasic systems composed of [bmim][BF4] and glycine, l-serine, and l-proline, respectively // J. Chem. Eng. Data. 2007. V. 52. № 6. P. 2488.
Chen Y., Wang Y., Cheng Q., Liu X., Zhang S. Carbohydrates-tailored phase tunable systems composed of ionic liquids and water // J. Chem. Thermodyn. 2009. V. 41. № 9. P. 1056.
Wu B., Zhang Y., Wang H. Phase behavior for ternary systems composed of ionic liquid+ saccharides + water // J. Phys. Chem. B. 2008. V. 112. № 20. P. 6426.
Freire M.G., Pereira J.F.B., Francisco M., Rodríguez H., Rebelo L.P.N., Rogers R.D., Coutinho J.A.P. Insight into the interactions that control the phase behaviour of new aqueous biphasic systems composed of polyethylene glycol polymers and ionic liquids // Chem. Eur. J. 2012. V. 18. № 6. P. 1831.
Visak Z.P., Lopes J.N.C., Rebelo L.P.N. Ionic liquids in polyethylene glycol aqueous solutions: Salting-in and salting-out effects // Monatsh. Chem. 2007. V. 138. № 11. P. 1153.
Wu C., Wang J., Pei Y., Wang H., Li Z. Salting-Out Effect of Ionic Liquids on Poly(propylene glycol) (PPG): Formation of PPG + ionic liquid aqueous two-phase systems // J. Chem. Eng. Data. 2010. V. 55. № 11. P. 5004.
Zafarani-Moattar M.T., Hamzehzadeh S., Nasiri S. A new aqueous biphasic system containing polypropylene glycol and a water-miscible ionic liquid // Biotechnol. Prog. 2012. V. 28. № 1. P. 146.
Bridges J.N., Gutowski E.K., Rogers D.R. Investigation of aqueous biphasic systems formed from solutions of chaotropic salts with kosmotropic salts (salt–salt ABS) // Green Chem. 2007. V. 9. № 2. P. 177.
Cao Q., Quan L., He C., Li N., Li K., Liu F. Partition of horseradish peroxidase with maintained activity in aqueous biphasic system based on ionic liquid // Talanta. 2008. V. 77. № 1. P. 160.
Cláudio A.F.M., Ferreira A.M., Shahriari S., Freire M.G., Coutinho J.A. Critical assessment of the formation of ionic-liquid-based aqueous two-phase systems in acidic media // J. Phys. Chem. B. 2011. V. 115. № 38. P. 11145.
Deng Y., Chen J., Zhang D. Phase diagram data for several salt + salt aqueous biphasic systems at 298.15 K // J. Chem. Eng. Data. 2007. V. 52. № 4. P. 1332.
Li Z., Pei Y., Liu L., Wang J. (Liquid + liquid) equilibria for (acetate-based ionic liquids + inorganic salts) aqueous two-phase systems // J. Chem. Thermodyn. 2010. V. 42. № 7. P. 932.
Lu Y., Lu W., Wang W., Guo Q., Yang Y. Thermodynamic studies of partitioning behavior of cytochrome c in ionic liquid-based aqueous two-phase system // Talanta. 2011. V. 85. № 3. P. 1621.
Ventura S.P.M., Sousa S.G., Freire M.G., Serafim L.S., Lima Á.S., Coutinho J.A.P. Design of ionic liquids for lipase purification // J. Chromatogr. B. 2011. V. 879. № 26. P. 2679.
Pei Y., Wang J., Liu L., Wu K., Zhao Y. Liquid−Liquid equilibria of aqueous biphasic systems containing selected imidazoliumiIonic liquids and salts // J. Chem. Eng. Data. 2007. V. 52. № 5. P. 2026.
Shahriari S., Neves C.M., Freire M.G., Coutinho J.A. Role of the Hofmeister series in the formation of ionic-liquid-based aqueous biphasic systems // J. Phys. Chem. B. 2012. V. 116. № 24. P. 7252.
Ventura S.P., Sousa S.G., Serafim L.S., Lima Á.S., Freire M.G., Coutinho J.A. Ionic liquid based aqueous biphasic systems with controlled pH: the ionic liquid cation effect // J. Chem. Eng. Data. 2011. V. 56. № 11. P. 4253.
Ghosh K., Lahiri S., Sarkar K., Naskar N., Choudhury D. Ionic liquid-salt based aqueous biphasic system for rapid separation of no-carrier-added Pb-203 from proton irradiated (Tl2CO3)-Tl-nat target // J. Radioanal. Nucl. Chem. 2016. V. 310. № 3. P. 1311.
Ghosh K., Lahiri S., Maiti M. Separation of no-carrier-added 195(m,g), 197mHg from Au target by ionic liquid and salt based aqueous biphasic systems // J. Radioanal. Nucl. Chem. 2016. V. 310. № 3. P. 1345.
Dreyer S., Kragl U. Ionic liquids for aqueous two-phase extraction and stabilization of enzymes // Biotechnol. Bioeng. 2008. V. 99. № 6. P. 1416.
Du Z., Yu Y., Wang J. Extraction of proteins from biological fluids by use of an ionic liquid/aqueous two-phase system // Chem. Eur. J. 2007. V. 13. № 7. P. 2130.
Pei Y., Wang J., Wu K., Xuan X., Lu X. Ionic liquid-based aqueous two-phase extraction of selected proteins // Sep. Purif. Technol. 2009. V. 64. № 3. P. 288.
Pei Y., Li Z., Liu L., Wang J., Wang H. Selective separation of protein and saccharides by ionic liquids aqueous two-phase systems // Sci. China Chem. 2010. V. 53. № 7. P. 1554.
Dreyer S., Salim P., Kragl U. Driving forces of protein partitioning in an ionic liquid-based aqueous two-phase system // Biochem. Eng. J. 2009. V. 46. № 2. P. 176.
Ruiz-Angel M.J., Pino V., Carda-Broch S., Berthod A. Solvent systems for countercurrent chromatography: an aqueous two phase liquid system based on a room temperature ionic liquid // J. Chromatogr. A. 2007. V. 1151. № 1. P. 65.
Marques Ventura S.P., Barros R.L.F. de, Barbosa J.M. de P., Faria Soares C.M., Silva Lima Á., Pereira Coutinho J.A. Production and purification of an extracellular lipolytic enzyme using ionic liquid -based aqueous two-phase systems // Green Chem. 2012. V. 14. № 3. P. 734.
Ding X., Wang Y., Zeng Q., Chen J., Huang Y., Xu K. Design of functional guanidinium ionic liquid aqueous two-phase systems for the efficient purification of protein // Anal. Chim. Acta. 2014. V. 815. P. 22.
Zafarani-Moattar M.T., Hamzehzadeh S. Partitioning of amino acids in the aqueous biphasic system containing the water-miscible ionic liquid 1-butyl-3-methylimidazolium bromide and the water-structuring salt potassium citrate // Biotechnol. Prog. 2011. V. 27. № 4. P. 986.
Neves C.M., Ventura S.P., Freire M.G., Marrucho I.M., Coutinho J.A. Evaluation of cation influence on the formation and extraction capability of ionic-liquid-based aqueous biphasic systems // J. Phys. Chem. B. 2009. V. 113. № 15. P. 5194.
Salabat A., Abnosi M.H., Motahari A. Investigation of amino acid partitioning in aqueous two-phase systems containing polyethylene glycol and inorganic salts // J. Chem. Eng. Data. 2008. V. 53. № 9. P. 2018.
Lu M., Tjerneld F. Interaction between tryptophan residues and hydrophobically modified dextran: Effect on partitioning of peptides and proteins in aqueous two-phase systems // J. Chromatogr. A. 1997. V. 766. № 1–2. P. 99.
Ventura S., Neves C., Freire M., Marrucho I., Oliveira J., Coutinho J. Evaluation of anion influence on the formation and extraction capacity of ionic-liquid-based aqueous Biphasic systems // J. Phys. Chem. B. 2009. V. 113. № 27. P. 9304.
Li C., Li Z., Wang A., Yin J., Wang J., Li H., Liu Q. Aqueous two phase extraction process of tryptophan based on functionalized ionic liquids // RSC Advances. 2013. V. 3. № 18. P. 6356.
Qingfen L., Xuesheng H., Yuhong W., Ping Y., Hansong X., Jiang Y., Huizhou L. Extraction of penicillin G by aqueous two-phase system of [Bmim]BF4/NaH2PO4 // Chin. Sci. Bull. 2005. V. 50. № 15. P. 1582.
Liu Q., Yu J., Li W., Hu X., Xia H., Liu H., Yang P. Partitioning behavior of penicillin G in aqueous two phase system formed by ionic liquids and phosphate // Sep. Sci. Technol. 2006. V. 41. № 12. P. 2849.
Han J., Wang Y., Yu C., Li C., Yan Y., Liu Y., Wang L. Separation, concentration and determination of chloramphenicol in environment and food using an ionic liquid/salt aqueous two-phase flotation system coupled with high-performance liquid chromatography // Anal. Chim. Acta. 2011. V. 685. № 2. P. 138.
Li S., He C., Liu H., Li K., Liu F. Ionic liquid-based aqueous two-phase system, a sample pretreatment procedure prior to high-performance liquid chromatography of opium alkaloids // J. Chromatogr. B. 2005. V. 826. № 1–2. P. 58.
Freire G.M., Neves S.C.M.S., Marrucho M.I., Lopes J.N.C., Rebelo N.L.P., Coutinho P.J.A. High-performance extraction of alkaloids using aqueous two-phase systems with ionic liquids // Green Chem. 2010. V. 12. № 10. P. 1715.
Pereira J.F.B., Ventura S.P.M., e Silva F.A., Shahriari S., Freire M.G., Coutinho J.A.P. Aqueous biphasic systems composed of ionic liquids and polymers: A platform for the purification of biomolecules // Sep. Purif. Technol. 2013. V. 113. P. 83.
Shu Y., Gao M., Wang X., Song R., Lu J., Chen X. Separation of curcuminoids using ionic liquid based aqueous two-phase system coupled with in situ dispersive liquid-liquid microextraction // Talanta. 2016. V. 149. P. 6.
Wang X., Li X., Li L., Li M., Wu Q., Liu Y., Yang J., Jin Y. Green determination of aconitum alkaloids in Aconitum carmichaeli (Fuzi) by an ionic liquid aqueous two-phase system and recovery of the ionic liquid coupled with in situ liquid-liquid microextraction // Anal. Methods. 2016. V. 8. № 35. P. 6566.
Berton P., Monasterio R.P., Wuilloud R.G. Selective extraction and determination of vitamin B12 in urine by ionic liquid-based aqueous two-phase system prior to high-performance liquid chromatography // Talanta. 2012. V. 97. P. 521.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


