Журнал аналитической химии, 2019, T. 74, № 7-app, стр. 71-80
Амперометрические тирозиназные биосенсоры на основе модифицированных наноматериалами электродов для определения афлатоксина М1
Р. М. Варламова 1, Э. П. Медянцева 1, *, Р. Р. Хамидуллина 1, Г. К. Будников 1
1 Казанский (Приволжский) федеральный университет, Химический институт им. А.М. Бутлерова
42008 Казань, ул. Кремлевская, 18, Россия
* E-mail: emedyant@gmail.com
Поступила в редакцию 07.03.2018
После доработки 30.05.2018
Принята к публикации 30.01.2019
Аннотация
Предложены амперометрические биосенсоры для определения афлатоксина М1 на основе планарных платиновых электродов, модифицированных углеродными нанотрубками (УНТ), оксидом графена (ГО) и наночастицами золота (НЧ Au) в хитозане, и иммобилизованного фермента тирозиназы. Оптимизированы условия получения НЧ Au. Установлено, что афлатоксин М1 проявляет свойства обратимого ингибитора тирозиназы, что позволяет определять его с помощью биосенсоров, модифицированных наноматериалами в диапазоне концентраций 1 × 10–11–1 × 10–6 М с сmin 5 × 10–12 М. Согласно результатам кинетических исследований реакции ферментативного превращения фенола в присутствии афлатоксина М1 и тирозиназного биосенсора наблюдается двухпараметрически рассогласованное (модификация композитом УНТ/НЧ Аu), а также двухпараметрически согласованное (модификации ГО/НЧ Аu) ингибирование. С помощью предлагаемых ферментных сенсоров на основе тирозиназы апробированы методики определения афлатоксина М1 в молочных продуктах.
Афлатоксин М1 является гидролизированным метаболитом афлатоксина В1, продукта жизнедеятельности микроскопических грибков Aspergillus, который в естественных условиях загрязняет зерновые, бобовые и другие пищевые продукты и способен в организме животных превращаться в афлатоксин М1 (схема).
Структурная формула афлатоксина М1.
Этот токсин обнаружен в молоке коров, получавших корм, загрязненный афлатоксином В1, и поэтому получил название “молочный токсин” с буквенным обозначением М1. Афлатоксины не имеют ни вкуса, ни запаха, но обладают сильной токсичностью. Доза всего в 2 мкг на килограмм массы тела может вызвать системное заболевание – афлатоксикоз [1, 2]. Как и его предшественник, токсин М1 уже при низких концентрациях представляет серьезную угрозу для здоровья животных и человека.
В настоящее время весьма разрабатываются перспективные, простые и экономичные способы определения микотоксинов на основе сочетания принципов биокаталитических взаимодействий и вольтамперометрической регистрации аналитического сигнала [3]. Такие методы представляют собой достойную альтернативу существующим хроматографическим и оптическим методам [4–6]) и даже зачастую значительно превосходят их в селективности определений.
Анализ литературы показал, что примеры биосенсоров для определения микотоксинов на сегодняшний день немногочисленны. В основном это холинэстеразные биосенсоры и биосенсоры на основе афлатоксиноксидазы [7].
Современный подход к совершенствованию и разработке новых амперометрических биосенсоров связан с различными способами модификации поверхности первичных преобразователей с целью придания им заданных свойств. Наноматериалы, в частности, УНТ, благодаря своим уникальным электронным свойствам перспективны для использования в качестве основы для создания миниатюрных биосенсорных устройств [8]. Оксид графена обладает гидрофильными свойствами в связи с наличием кислородсодержащих функциональных групп, хорошо диспергируется в водной среде. Это обеспечивает возможность сшивания и/или захватывания (удерживания) фермента поверхностью используемого модификатора. Большое количество кислородсодержащих групп в сочетании с большой площадью поверхности делает ГО идеальной платформой для ковалентной иммобилизации белка [9].
Применение НЧ Au сопровождается появлением новых физических, электрохимических свойств электродов и их хорошей проводимости [10]. Использование УНТ и наночастиц металлов дает возможность создать необходимую плотность заряда, что позволяет напрямую влиять на чувствительноcть сенсора и поддерживать его высокую электроактивность. Композиты на основе ГО могут быть использованы в качестве материала электрода для улучшения электрохимических свойств сенсоров и биосенсоров [11]. Кроме того, ГО может осаждаться на любую подложку, а затем преобразовывать ее в проводник.
Такой подход весьма перспективен для совершенствования поверхности используемых первичных преобразователей, что открывает новые возможности при разработке биосенсоров для определения различных микотоксинов. Представляло интерес разработать амперометрические биосенсоры на основе иммобилизованной тирозиназы для определения микотоксинов.
Цель настоящей работы – разработка амперометрических биосенсоров на основе платиновых планарных электродов, модифицированных УНТ, ГО, НЧ Аu и иммобилизованным ферментом тирозиназой, для определения афлатоксина М1, оценка их аналитических возможностей, сопоставление результатов анализа, полученных на модифицированных и немодифицированных сенсорах, а также использование полученных результатов для контроля содержания афлатоксина М1 в пищевых продуктах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и аппаратура. Основой разрабатываемых биосенсоров служила планарная система, состоящая из рабочего, вспомогательного электродов и электрода сравнения (фирма BVT Technologies, Брно, Чехия).
Материал поверхности рабочего электрода, на который иммобилизовали фермент, – платиносодержащая паста. Из платины изготовлен и вспомогательный электрод. В качестве электрода сравнения использовали “псевдохлоридсеребряный электрод”, состоящий из серебра в 0.1 М растворе хлорида калия. Объем рабочей ячейки системы составлял 200 мкл. Все измерения с использованием этих электродов проводили с помощью многоцелевого электрохимического детектора “МЕВ” с компьютеризированным управлением [12]. Для приготовления суспензии УНТ, ГО, НЧ Au использовали ультразвуковую ванну (WiseClean модель WUC–A03H, DAIHAN ScientificCo.Ltd, Korea), частота 40 КГц.
В качестве субстрата использовали фенол х. ч., растворы которого готовили по точной навеске в рабочем буферном растворе и использовали в течение не более 3 ч. Применяли тирозиназу из ткани грибов (шампиньонов) с каталитической активностью (165 ± 8) U/мл.
Применяли 1%-ный раствор глутарового альдегида фирмы “ICN” и бычий сывороточный альбумин (БСА) (Reanal, Венгрия). Для получения НЧ Au использовали цитрат натрия х. ч., HCl х. ч., HAuCl4 · 4H2O х. ч., SnCl2 ч., полиэтиленгликоль (PEG-3000) (Sigma).
В работе использовали УНТ с геометрическими параметрами: длина 0.1–10 мкм, внутренний диаметр 2–6 нм, внешний диаметр 10–15 нм (Sigma-Aldrich, США) и ГО с преимущественным размером 75 нм (Sigma-Aldrich, США).
Использовали хроматографически чистый препарат афлатоксина М1 (раствор афлатоксина М1 в ацетонитриле) из государственного стандартного образца (изготовитель: ГНУВНИИВСГЭ, 7935-2001, Москва).
Для получения рабочих растворов из стандартного образца афлатоксина М1 органический растворитель (ацетонитрил) отгоняли под вакуумом при комнатной температуре. Полученный препарат афлатоксина М1 использовали для приготовления рабочих растворов растворением в бидистиллированной воде с добавлением метанола. Применяли фосфатный буферный раствор с рН 7.05 ± 0.05. Значения рН водных растворов определяли рН-метром рН-150 со стеклянным электродом, градуированным по стандартным буферным растворам.
Подготовка углеродных нанотрубок для модификации электродов. Для подготовки УНТ их обрабатывали растворами азотной и серной кислот [8]. Затем осаждали УНТ с помощью центрифуги и многократно (5–6 раз) обрабатывали водой до нейтральной реакции. Обработанные УНТ высушивали при 60°С до постоянной массы. После этого к навеске УНТ добавляли 0.5%-ный (по массе) раствор хитозана в 0.05 М уксусной кислоте, смесь солюбилизировали с помощью ультразвука (УЗ) при комнатной температуре до получения гомогенного раствора. Конечная концентрация УНТ составляла 1 мг/мл. Однородность используемых для модификации поверхности электрода растворов УНТ поддерживали периодической (не менее раза в месяц) обработкой УЗ.
Подготовка оксида графена для модификации поверхности электродов. Исходный ГО представлял собой водный раствор с концентрацией 2 мг/мл. Для лучшего закрепления ГО на поверхности электрода добавляли 0.5%-ный уксуснокислый раствор хитозана. Полученный раствор подвергали ультразвуковой обработке при 35°С для получения дисперсии с концентрацией 1.5 мг/мл [11]. Однородность используемого для модификации поверхности электрода раствора ГО поддерживали периодической (не менее раза в месяц) обработкой УЗ.
Дисперсию ГО в хитозане (1 мкл) наносили на электроды и сушили при 20°С в течение сут [12].
Получение гомогената из грибов. В качестве источников тирозиназы использовали гомогенат из грибов (шампиньоны – Agaricusbisporus). Для этого навеску плодового тела гриба мелко нарезали и растирали в вымороженной ступке до пастообразной текстуры. Далее к нему добавляли фосфатный буферный раствор с рН 7.05 и перемешивали магнитной мешалкой. После этого смесь фильтровали через двойной марлевый слой и использовали как непосредственный источник тирозиназы [13].
Получение биочувствительной части амперометрического тирозиназного биосенсора на основе печатного платинового электрода. Для получения биочувствительной части биосенсора на поверхность рабочего электрода наносили смесь, содержащую раствор фермента (тирозиназы), раствор БСА (50 мг/мл), фосфатный буферный раствор (50 мМ, pH 7.5), дистиллированную воду и 1%-ный раствор глутарового альдегида. Глутаровый альдегид вносили в последнюю очередь, и после энергичного перемешивания на поверхности электродов наносили по 1 мкл этой смеси. Полученные таким образом биосенсоры оставляли на ночь в закрытой чашке Петри при 4°С. На следующий день биосенсоры промывали водой, оставляли для высушивания на воздухе и в дальнейшем хранили в холодильнике при 4°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ литературы показал, что на сегодняшний день не существует амперометрических тирозиназных биосенсоров для определения афлатоксина М1 в пищевых продуктах. Однако фермент тирозиназа имеет большие потенциальные возможности для определения эффекторов этого фермента различной природы. Так, недостаточная активность тирозиназы или ее полное отсутствие в организме человека приводит к ряду заболеваний [14]. В то же время существуют простые и доступные способы получения ферментного препарата из плодового тела грибов Agaricusbisporus. В связи с этим для разработки новых амперометрических биосенсоров для определения афлатоксина М1 использовали иммобилизованную тирозиназу, полученную описанным выше способом.
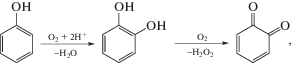
Известно, что под действием тирозиназы фенол подвергается биокаталитическому гидролизу с образованием в качестве продукта хинона по схеме:
ферментативная реакция [14]:
электрохимическая реакция:
На тирозиназном биосенсоре при потенциалах 0.65–0.70 В наблюдается дополнительный пик, который можно отнести к окислению пероксида водорода (рис. 1). По данным [15] электрохимическое окисление пероксида водорода протекает по схеме:
Рис. 1.
Циклическая вольтамперограмма продуктов реакции ферментативного превращения фенола в присутствии тирозиназного биосенсора. Концентрация фенола 1 × 10–3 М, фоновый электролит – фосфатный буферный раствор с рН 7.05.

Пик при потенциале 0.2 В относится, вероятнее всего, к электрохимическому окислению фенола до соответствующего хинона.
Наибольший каталитический эффект для этого фермента наблюдается в среде фосфатного буферного раствора с рН 7.0 ± 0.05 [16], поэтому его использовали в качестве фонового электролита для измерений тирозиназным биосенсором. Используемая концентрация субстрата тирозиназы – фенола – составляла 1 мМ.
Действие афлатоксина М1 на каталитическую активность иммобилизованной тирозиназы. Изучение действия афлатоксина М1 на иммобилизованную тирозиназу, входящую в состав биочувствительной части амперометрического биосенсора на основе печатных электродов, показало, что в его присутствии уменьшается аналитический сигнал в диапазоне концентраций 1 × 10–10–1 × 10–6 М, т.е. М1 ингибирует ферментативное превращение фенола. Это явление обнаружено впервые (рис. 2), ранее подобный эффект наблюдали лишь для зеараленона [17].
Рис. 2.
Вольтамперограммы окисления фенола на тирозиназном биосенсоре в отсутствие (1) и в присутствии 1 мкМ афлатоксина М1 (2); фосфатный буферный раствор с рН 7.05 (3).

Максимальная степень (процент) ингибирования токсином М1 фермент-субстратной системы тирозиназа–фенол составляет 78 ± 1.0% в изученной области концентраций (табл. 1).
Таблица 1.
Аналитические характеристики тирозиназного биосенсора в отсутствие и в присутствии модификаторов при определении афлатоксина М1 (n = 5, P = 0.95)
| Модификатор | Диапазон определяемых концентраций, М |
Уравнение
градуировочной зависимости I* = (А ± δ) + (В ± δ)(–lg c) |
cmin, М | ||
| (А ± δ) | (В ± δ) | r | |||
| – | 1 × 10–10–1 × 10–6 | 92 ± 2 | 9.0 ± 0.3 | 0.9892 | 5 × 10–11 |
| УНТ | 2 × 10–10–1 × 10–6 | 48 ± 1 | 4.1 ± 0.2 | 0.9920 | 1 × 10–11 |
| ГО | 5 × 10–11–1 × 10–6 | 64 ± 2 | 5.6 ± 0.2 | 0.9901 | 1 × 10–11 |
| УНТ/НЧ Au | 5 × 10–12–1 × 10–6 | 62 ± 2 | 5.0 ± 0.2 | 0.9978 | 1 × 10–12 |
| ГО/НЧ Au | 1 × 10–11–1 × 10–6 | 60 ± 2 | 5.2 ± 0.1 | 0.9948 | 5 × 10–12 |
Правильность определения М1 токсина в указанных диапазонах концентраций биосенсором на основе иммобилизованной тирозиназы оценивали способом введено–найдено (табл. 2).
Таблица 2.
Результаты определения М1 токсина с помощью тирозиназных биосенсоров в отсутствие и в присутствии модификаторов (n = 5, P = 0.95)
| Модификатор | Введено, М | Найдено, М | sr | Процент открытия, % |
|---|---|---|---|---|
| – | 7 × 10–8 | (7.2 ± 0.4) × 10–8 | 0.06 | 92–103 |
| 5 × 10–9 | (4.8 ± 0.3) × 10–9 | 0.06 | 98–111 | |
| УНТ | 3 × 10–8 | (2.9 ± 0.1) × 10–8 | 0.03 | 100–107 |
| 6 × 10–10 | (6.3 ± 0.4) × 10–10 | 0.06 | 94–106 | |
| ГО | 4 × 10–8 | (4.1 ± 0.2) × 10–8 | 0.05 | 93–103 |
| 7 × 10–9 | (6.8 ± 0.4) × 10–9 | 0.06 | 97–109 | |
| УНТ/НЧ Au | 5 × 10–8 | (5.1 ± 0.2) × 10–8 | 0.04 | 94–102 |
| 8 × 10–10 | (7.8 ± 0.4) × 10–10 | 0.05 | 98–108 | |
| ГО/НЧ Au | 8 × 10–7 | (7.8 ± 0.3) × 10–7 | 0.04 | 99–107 |
| 4 × 10–10 | (4.1 ± 0.2) × 10–10 | 0.05 | 93–103 |
Влияние углеродных наноструктурированных материалов на аналитические характеристики разрабатываемых биосенсоров. Для модифицирования поверхности используемых планарных электродов на нее методом капельного испарения наносили полученные дисперсии УНТ или ГО в хитозане. Затем на полученную модифицированную поверхность иммобилизовали раствор тирозиназы.
Изучение действия афлатоксина М1 на тирозиназу, иммобилизованную в хитозане на модифицированные УНТ- или ГО-электроды, показало, что характер действия этого соединения существенно не изменяется: афлатоксин М1 по-прежнему ингибирует тирозиназу. В то же время электроды, модифицированные УНТ или ГО в хитозане, позволяют расширить диапазон определяемых концентраций микотоксина, улучшить коэффициент корреляции (табл. 1). Максимальная степень ингибирования М1 при действии на фермент-субстратную систему тирозиназа–фенол в этих условиях увеличилась и составила 85.6 ± 0.8% в случае УНТ и 82.0 ± 0.9% для ГО в изученном диапазоне концентраций микотоксина.
Правильность определения М1 токсина в указанных диапазонах концентраций с помощью тирозиназных биосенсоров оценивали способом введено–найдено (табл. 2).
Наночастицы золота как модификаторы поверхности печатных электродов. Получение наночастиц золота. Одним из современных приемов изменения свойств биосенсоров и их аналитических характеристик является модификация поверхности электродов, служащих основой биосенсоров, УНТ, ГО и нанокомпозитами на их основе, включающими НЧ металлов. Весьма удобным компонентом в этом плане оказались НЧ Аu: в частности, нанокомпозиты УНТ/НЧ металлов (УНТ/НЧ Аu), ГО/НЧ металлов (ГО/НЧ Au).
На сегодняшний день известно довольно много способов получения наночастиц золота. Мы использовали способ [18], поскольку он достаточно прост, позволяет синтезировать наночастицы золота из доступных реагентов в мягких условиях и не занимает много времени. Наилучшие условия получения наночастиц золота представлены в табл. 3. Наличие в растворах НЧ Au определенного размера подтверждено оптическими спектрами растворов наночастиц (рис. 3.): в них имеются плазмонные полосы поглощения НЧ Au с максимумами при λ = 580 нм (размер частиц около 45 нм) и 520 нм (размер частиц около 25 нм). Исходя из формы спектров поглощения, НЧ Au размером 45 нм более однородны по размеру, чем наночастицы размером 25 нм.
Таблица 3.
Условия получения наночастиц золота
| Тип наночастиц золота |
Компонент | Цвет полученного раствора | ||||
|---|---|---|---|---|---|---|
| раствор HAuCl4 · 4H2O, мг/л | раствор SnCl2, мг/л | цитратный буферный раствор, pH | раствор ПЭГ, мг/л | хитозан, % | ||
| 1 | 25 | 950 | 4.3 ± 0.1 | 10 | 0.5 | Розовый |
| 2 | 1 × 104 | 9500 | 4.3 ± 0.1 | 10 | 0.75 | Бордовый |
Рис. 3.
Спектры поглощения НЧ Au с размером частиц ~25 нм (1) и ~45 нм (2) в 0.5%-ном растворе хитозана.

Предварительные исследования показали, что модификация поверхности электродов суспензиями УНТ, ГО и НЧ Аu приводит к изменению аналитических возможностей биосенсоров. Представляло интерес рассмотреть морфологию поверхности электродов при модификации УНТ, ГO и НЧ Au. Удобным методом для получения информации является атомно-силовая микроскопия (АСМ): с помощью АСМ-изображений можно наблюдать поверхности электродов на разных стадиях получения биочувствительной части сенсоров в разных условиях (рис. 4). Судя по полученным нами АСМ-изображениям поверхности электрода, при нанесении НЧ Аu 2 типа (табл. 3) поверхность становится более развитой, наночастицы более однородными и, кроме того, они более равномерно распределены по поверхности электрода.
Рис. 4.
АСМ-изображения в режимах топографии в 2D (а), (б) и 3D (в), (г) проекциях поверхности платинового электрода, модифицированного НЧ Au в 0.5%-ном (а), (в) и в 0.75%-ном растворах хитозана (б), (г), размер 2.5 × 2.5 мкм.

На полученной модифицированной поверхности иммобилизовали тирозиназу. При модификации поверхности рабочего электрода варьировали количество раствора НЧ Au в хитозане, наносимого на поверхность печатного электрода. Установили, что использование 0.5 мкл раствора позволяет получить более воспроизводимую однородную поверхность, обеспечивающую достаточно интенсивный аналитический сигнал. В дальнейшем использовали 0.5 мкл раствора НЧ Au (рис. 5).
Рис. 5.
Зависимость аналитического сигнала (тока) от количества НЧ Au, наносимого на рабочую поверхность электрода.

Влияние модификации поверхности электродов нанокомпозитами УНТ/НЧ Аu, ГО/НЧ Аu на аналитические возможности тирозиназного биосенсора. Изучение действия афлатоксина М1 на модифицированные УНТ/НЧ Au и ГО/НЧ Au тирозиназные сенсоры показало, что микотоксин оказывают на них ингибирующее действие. Степень (процент) ингибирования при действии на фермент-субстратную систему тирозиназа–фенол составляет для афлатоксина М1 90 ± 2% для УНТ/НЧ Au, 89 ± 1% для ГО/НЧ Au (табл. 1).
Правильность определения М1 токсина в указанных диапазонах концентраций с помощью тирозиназных биосенсоров оценивали способом введено–найдено (табл. 2).
Использование модифицированных УНТ/НЧ Au и ГО/НЧ Au тирозиназных биосенсоров позволило снизить предел обнаружения определяемых концентраций М1 токсина (рис. 6).
Согласно результатам кинетических исследований с использованием модифицированных УНТ, ГО и НЧ Au биосенсоров, в присутствии разных концентраций афлатоксина М1 при концентрации субстрата 1 × 10–3 М наблюдаются двухпараметрически рассогласованное ингибирование (при одинаковом воздействии, ведущем к снижению сродства субстрата и фермента, эффектор в присутствии этой концентрации фенола уменьшает скорость его ферментативного превращения) в случае тирозиназного биосенсора, модифицированного УНТ/НЧ Аu. В случае же тирозиназного биосенсора, модифицированного ГО/НЧ Аu, наблюдается двухпараметрически согласованное ингибирование (при одинаковом воздействии, ведущем к повышению сродства субстрата и фермента, эффектор в присутствии этой концентрации фенола уменьшает скорость его ферментативного превращения) (табл. 4).
Таблица 4.
Кинетические параметры реакции тирозиназного превращения фенола в присутствии афлатоксина М1 (сфенола = 1 мМ, рН 7.0, n = 5, P = 0.95)
| сафлатоксина М1, М | Km × 105, М |
Vmax × 106, М с |
Соотношение параметров Km и Vmax |
Тип ингибирования | KI, М–1 |
|---|---|---|---|---|---|
| Тирозиназный биосенсор УНТ/НЧ Аu | |||||
| 0 | 3.5 ± 0.9 | 3.8 ± 0.8 | |||
| 1 × 10–6 | 2.5 ± 0.3 | 1.5 ± 0.7 | $K_{{\text{m}}}^{'}$ < Km $V_{{{\text{max}}}}^{'}$ < Vmax |
Двухпараметрически рассогласованное ингибирование | (7.2 ± 0.9) × 10–7 |
| Тирозиназный биосенсор ГО/НЧ Аu | |||||
| 0 | 2.9 ± 0.3 | 3.6 ± 0.3 | |||
| 1 × 10–8 | 5.2 ± 0.2 | 1.2 ± 0.1 | $K_{{\text{m}}}^{'}$ > Km $V_{{{\text{max}}}}^{'}$ < Vmax |
Двухпараметрически согласованное ингибирование |
(1.5 ± 0.2) × 10–9 |
Определение афлатоксина М1 в пищевых продуктах. Предлагаемые биосенсоры могут быть использованы для определения содержания М1 токсина в пищевых продуктах. Мы определяли М1 токсин в молоке, кефире, твороге. При пробоподготовке образцов использовали рекомендации [19].
Подготовка пробы к анализу. Образец суспендировали в смеси ацетонитрила и воды, затем добавляли 1.7 М раствор NaCl. По данным [19] в этом случае должно достигаться достаточно полное извлечение определяемых компонентов. Смесь перемешивали магнитной мешалкой не менее 30 мин, затем центрифугировали в течение 20 мин при скорости 7000 об/мин. Надосадочную жидкость использовали для приготовления рабочих водных растворов последовательным разбавлением для последующего определения М1 токсина с помощью тирозиназного биосенсора на основе модифицированных УНТ/НЧ Аu электродов. Этот тирозиназный биосенсор показал лучшие аналитические характеристики – более высокие чувствительность и коэффициент корреляции.
Предварительно установили, что для раствора после однократного экстрагирования микотоксина аналитический сигнал отсутствует, т.е. он не содержит компонентов, оказывающих ингибирующее действие на иммобилизованные ферменты. Таким образом, микотоксин полностью извлекается из образца в результате однократной экстракции.
Методика выполнения анализа. В электрохимическую ячейку вносили определенный объем раствора субстрата, буферный раствор, 0.1 М раствор КСl, раствор аналита и ферментный сенсор. Через 10 мин измеряли значение тока при потенциалах проявления аналитического сигнала. Содержание микотоксина определяли по соответствующему градуировочному графику. Результаты определения содержания афлатоксина М1 в образцах молочных продуктов представлены в табл. 5.
Таблица 5.
Результаты определения афлатоксина М1* в молочных продуктах тирозиназным биосенсором, модифицированным УНТ/НЧ Au (n = 5, P = 0.95)
| Объект анализа | Найдено афлатоксина M1 | |||
|---|---|---|---|---|
| М | sr | мг/кг | sr | |
| Молоко 1.5% | (7.0 ± 0.3) × 10–11 | 0.04 | (2.3 ± 0.1) × 10–5 | 0.04 |
| Молоко 0.5% | (4.4 ± 0.2) × 10–11 | 0.04 | (1.40 ± 0.06) × 10–5 | 0.04 |
| Творог мягкий 0.1% | (5.0 ± 0.3) × 10–10 | 0.06 | (1.80 ± 0.09) × 10–4 | 0.05 |
| Кефир обезжиренный | (6.0 ± 0.4) × 10–12 | 0.07 | (2.00 ± 0.12) × 10–7 | 0.06 |
Найденное количество афлатоксина М1 в анализируемых образцах пищевых продуктов во всех случаях ниже ПДК. Таким образом, разработанный тирозиназный биосенсор, модифицированный УНТ/НЧ Au, можно использовать для контроля качества продуктов питания. Сопоставление наших результатов с данными, полученными с помощью другого биосенсора, в частности, цистеиндесульфгидразного, функционирование которого основано на других принципах [3], показывает, что результаты сопоставимы (равноточны) и вклад систематической погрешности незначим (табл. 6).
Таблица 6.
Результаты определения афлатоксина М1 в молоке модифицированным УНТ/НЧ Au тирозиназным и цистеиндесульфгидразным биосенсорами (n = 5, P = 0.95, tтабл. = 2.78, Fтабл. = 6.39)
| Биосенсор | Введено × 107, М | Найдено, М | tрасч | Fрасч | |
|---|---|---|---|---|---|
| (х ± δ) × 10–7 | sr | ||||
| Тирозиназный | 3.0 | 2.9 ± 0.2 | 0.03 | 1.51 | 2.00 |
| Цистеиндесульф- гидразный | 3.0 | 3.1 ± 0.2 | 0.06 | ||
Список литературы
Тутельян В.А., Кравченко Л.В. Микотоксины. М.: Медицина, 1985. 321 с.
Alberts J.F., Engelbrecht Y., Steyn P.S., Holzapfel W.H., Van Zyl W.H. Biological degradation of aflatoxin B1 by Rhodococcus erythropolis cultures // Int. J. Food Microbiol. 2006. V. 109. № 1–2. P. 121.
Медянцева Э.П., Май Тхи Тхань Х., Варламова Р.М., Тарасова Е.Ю., Сахапова Г.Р., Будников Г.К. Амперометрические биосенсоры для определения охратоксина А // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2012. Т. 154. № 4. С. 92.
Kharandi N.A., Babri M., Azad J. A novel method for determination of patulin in apple juices by GC–MS // Food Chem. 2013. V. 141. № 3. P. 1619.
Bakar N.-B., Makahleh A., Saad B. Vortex-assisted liquid–liquid microextraction coupled with high performance liquid chromatography for the determination of furfurals and patulin in fruit juices // Talanta. 2014. V. 120. P. 47.
Khayoon W.S., Saad B., Salleh B., Manaf N.H.A., Latiff A.A. Micro-solid phase extraction with liquid chromatography–tandem mass spectrometry for the determination of aflatoxins in coffee and malt beverage // Food Chem. 2014. V. 147. P. 287.
Li S., Chen J., Cao H., Yao D., Liu D. Amperometric biosensor for aflatoxin B1 based on aflatoxin-oxidase immobilized on multiwalled carbon nanotubes // Food Control. 2011. V. 22. № 1. P.43.
Feng W., Ji P. Enzymes immobilized on carbon nanotubes // Biotechnol. Adv. 2011. V. 29. № 6. P. 889.
Bai X., Chen G., Shiu K. Electrochemical biosensor based on reduced graphene oxide modified electrode with Prussian blue and poly(toluidine blue O) coating // Electrochim. Acta. 2013. V. 89. P. 454.
Шаповалова Е.Н., Ананьева И.А., Елфимова Я.А., Гринева Л.А., Мажуга А.Г., Шпигун О.А. Разделение азотсодержащих соединений методом высокоэффективной жидкостной хроматографии на силикогеле, модифицированного наночастицами золота, стабилизированных хитозаном // Вестн. Моск. ун-та. Сер. 2. Химия. 2012. Т. 53. № 2. С. 108.
He L., Wang H., Xia G., Sund J., Song R. Chitosan/graphene oxide nanocomposite films with enhanced interfacial interaction and their electrochemical applications // Appl. Surf. Sci. 2014. V. 314. P. 510.
Медянцева Э.П., Варламова Р.М., Гималетдинова Д.А., Фаттахова А.Н., Будников Г.К. Условия функционирования амперометрического биосенсора на основе моноаминоксидазы // Учен. зап. Каз. гос. ун-та. Естеств. науки. 2006. Т. 148. № 2. С. 21.
Amjad A., Suhail A., Qayyum H. Simultaneous purification and immobilization of mushroom tyrosinase on an immunoaffinity support // Process Biochem. 2005. V. 40. № 7. P. 2379.
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М: Медицина, 1998. 704 с.
Евтюгин Г.А., Будников Г.К., Стойкова Е.Е. Основы биосенсорики: учебное пособие. Казань: Казан. гос. ун-т, 2007. 82 с.
Кулис Ю.Ю. Аналитические системы на основе иммобилизованных ферментов. Вильнюс: Мокслас, 1981. 200 с.
Zhao Q., Zhuang Q.K. Determination of phenolic compounds based on the tyrosinase-single walled carbon nanotubes sensor // Electroanalysis. 2005. V. 17. № 1. P. 85.
Май Тхи Тхань Х., Медянцева Э.П., Варламова Р.М., Сахапова Г.Р., Николаева О.В. Определение зеараленона амперометрическими биосенсорами на основе модифицированных углеродными нанотрубками электродов // Вестн. Казан. технол. ун-та. 2012. Т. 15. № 15. С. 149.
Шашканова О.Ю., Ермолаева Т.Н. Новый метод диагностики аутоиммунных заболеваний, основанный на аффинной реакции на поверхности пьезокварцевого сенсора // Сорбционные и хроматографические процессы. 2009. Т. 9. № 5. С. 677.
ГОСТ 30711-2001. Продукты пищевые. Методы выявления и определения содержания афлатоксинов В(1) и М(1). Введ. c 01.07.2002 г. М.: Изд-во стандартов, 2001. 14 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии