Журнал аналитической химии, 2019, T. 74, № 7-app, стр. 63-70
Твердоконтактные потенциометрические сенсоры для определения некоторых цефалоспориновых антибиотиков в лекарственных препаратах и ротовой жидкости
Е. Г. Кулапина 1, *, М. С. Тютликова 1, О. И. Кулапина 2, А. Е. Дубасова 1
1 Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
2 Саратовский государственный медицинский университет им. В.И. Разумовского
410012 Саратов, ул. Б. Казачья, 112, Россия
* E-mail: kulapinaeg@mail.ru
Поступила в редакцию 16.02.2018
После доработки 21.05.2018
Принята к публикации 24.01.2019
Аннотация
Разработаны немодифицированные и модифицированные полианилином твердоконтактные потенциометрические сенсоры на основе органических ионообменников – ассоциатов тетрадециламмония и комплексных соединений серебра(I) с цефазолином (цефотаксимом, цефуроксимом). Сенсоры обеспечивают широкий диапазон определяемых содержаний цефалоспориновых антибиотиков 1 × 10–4 (5 × 10–5)–0.1 М, пределы обнаружения антибиотиков составляют n × 10–5 М. Введение полианилина снижает время установления стационарного потенциала, дрейф потенциала, увеличивает срок службы сенсоров. Сенсоры применены для определения антибиотиков в ротовой жидкости и основного вещества (цефуроксим аксетила) в препарате “Зиннат”.
Одним из важных направлений развития электрохимических методов анализа является совершенствование конструкций электрохимических сенсоров, а также поиск новых материалов для них. Наиболее перспективными представляются сенсоры, в которых отсутствует внутренний раствор – твердоконтактные потенциометрические сенсоры. Преимущество твердоконтактных сенсоров – простота применения, транспортировки, хранения; их существенный недостаток – нестабильность электродного потенциала во времени, в связи с чем необходимо калибровать такие сенсоры перед каждым определением [1].
Для стабилизации потенциала твердоконтактных сенсоров используют различные модификаторы [2–6], в том числе токопроводящие полимеры [7–11]. Такие полимеры вводят в состав слоя, промежуточного между мембраной и токоотводом. Электронная проводимость токопроводящих полимеров обусловлена подвижностью делокализованных π-электронов в сопряженной структуре полимера: они становятся ионоэлектронными трансдьюсерами в результате процессов допирования. Электронопроводящие полимеры – полианилин, поли(N-фенилглицин), поли(о-фенилендиамин), поли(о-аминофенол) и др. – применены [7–11] для стабилизации потенциала твердоконтактных электродов, чувствительных к некоторым лекарственным средствам (дофамину, анаприлину, доксициклину и др.).
В настоящее время антибиотики используют при лечении различных инфекционно-воспалительных заболеваний [12, 13]. Цефалоспориновые антибиотики относятся к классу β-лактамов, их молекулы состоят из соединенных β-лактамного (β-lac) и дигидротиазиного циклов, имеют две боковые цепи радикалов различной химической природы. От их структуры в значительной степени зависят антимикробная активность, химическая устойчивость, растворимость и кислотно-основные свойства [12, 14]. В зависимости от спектра антимикробной активности выделяют 4 поколения цефалоспоринов [12].
Объектами настоящего исследования являются цефалоспориновые антибиотики различных поколений – цефазолин (I поколение), цефуроксим и цефуроксим аксетил (II поколение), цефотаксим (III поколение). Они обладают бактерицидным эффектом, широким спектром антибактериального действия при лечении инфекций, вызванных чувствительными микроорганизмами: инфекций дыхательных путей, лор-органов, кожи, мягких тканей, костей, суставов, мочевыводящих путей и др. [12, 15].
Для определения цефалоспориновых антибиотиков в различных объектах применяются спектроскопические, хроматографические, электрохимические, иммуноферментные и другие методы, которые требуют дорогостоящей аппаратуры и применения органических растворителей. Потенциометрические сенсоры позволяют экспрессно определять цефалоспориновые антибиотики в малых объемах проб без предварительной пробоподготовки [15–18].
Известны жидкостные потенциометрические сенсоры на основе ионных ассоциатов тетраалкиламмония с катионами β-лактамов или комплексными соединениями серебро(I)–β-lac, чувствительные к цефалоспориновым антибиотикам [19]. Указанные сенсоры неудобны в эксплуатации, так как применимы для анализа только в вертикальном положении.
Настоящая работа посвящена созданию немодифицированных и модифицированных полианилином (ПАНи) твердоконтактных потенциометрических сенсоров на основе ассоциатов тетрадециламмония (ТДА) и комплексных соединений серебра(I) c цефотаксимом, цефазолином и цефуроксимом и сравнению их электроаналитических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. Исследовали цефалоспориновые антибиотики цефазолин, цефуроксим, цефуроксим аксетил, цефотаксим, цефтриаксон фармакопейной чистоты (табл. 1). Исходные 0.1 М водные растворы антибиотиков готовили по точным навескам препаратов в дистиллированной воде; рабочие (свежеприготовленные) 1 × 10–2–1 × 10–6 М растворы получали последовательным разбавлением. Кислотность свежеприготовленных водных растворов цефотаксима, цефазолина, цефуроксима с изменением их концентрации не меняется (рН 6.0).
Таблица 1.
Исследуемые вещества
| Название, производитель | Сокра-щение | Формула |
|---|---|---|
| Цефотаксим (ОАО “Биохимик”, Саранск) | Сeftx |  |
| Цефазолин (ОАО “Красфарма”, Красноярск) | Cef |  |
| Цефуроксим (цефурус) (ОАО “Синтез”, Курган) | Cefur1 |  |
| Цефуроксим аксетил (Glaxo Operation UKLimited, UK) | Cefur2 |  |
| Цефтриаксон порошок для инъекций (ОАО “Синтез”, Курган) | Ceftr |  |
| Тетрадециламмония бромид (Sigma-Aldrich) | ТДА |  |
| Полианилин | ПАНи |  |
Объектом исследования выбрали жидкость ротовой полости (ЖРП). Ротовая жидкость или смешанная слюна – биологическая жидкость человека, легкодоступная для определения самых разнообразных соединений. Ее удобно использовать для изучения фармакокинетики антибиотиков в связи с простотой и неинвазивностью отбора проб.
Жидкость ротовой полости содержит 98–99% воды, около 0.5% неорганических солей (Mn2+, Cu2+, Fe2+, Mg2+, Ca2+, Na+, K+, F–, Cl–, ${\text{HCO}}_{{\text{3}}}^{ - },$ ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ и др.) и до 1% органических веществ (белки, мочевина, аммиак, креатин, остатки пищи и др.) [20]. Коэффициенты потенциометрической селективности антибиотиков по отношению к неорганическим ионам, входящим в состав ЖРП, позволяют определять цефалоспориновые антибиотики в ротовой жидкости [19].
Жидкость ротовой полости отбирали через полчаса после еды. Перед сбором смешанной слюны ротовую полость ополаскивали водой. В чистые полиэтиленовые пробирки собирали смешанную слюну, центрифугировали ее в течение 10 мин при 3500 об./мин для осаждения белков и твердых остатков пищи. Отбирали по 0.3 мл водных 1 × 10–4–0.1 М растворов антибиотиков, разбавляли ЖРП до 3 мл, помещали в ячейку и измеряли ЭДС при постоянном перемешивании. Предварительно сенсоры кондиционировали в ЖРП без антибиотика в течение 20 мин.
Получение материалов сенсоров. Электродноактивные компоненты (ЭАК) получали в два этапа:
• 5 мл 2 × 10–2 М водного раствора цефотаксима (цефазолина, цефуроксима) помещали в химический стакан, добавляли к нему 5 мл 1 × 10–2 М раствора нитрата серебра и несколько капель раствора NaOH для создания щелочной среды рН ≈ 8. Смесь тщательно перемешивали.
• В делительную воронку помещали 5 мл. водного раствора комплексного соединения серебро(І)–антибиотик и 5 мл 1 × 10–2 М раствора ТДА в хлороформе. Полученную смесь интенсивно встряхивали в течение двух часов. Затем хлороформный слой отделяли от водной фазы в предварительно взвешенный бюкс и оставляли под тягой до полного испарения хлороформа.
Для приготовления пластифицированных мембран в бюкс помещали навески ЭАК и растворителя-пластификатора дибутилфталата (ДБФ). Затем при непрерывном перемешивании добавляли циклогексанон и постепенно навеску поливинилхлорида (ПВХ). Смесь тщательно перемешивали до полной гомогенизации, выливали в чашку Петри и оставляли на воздухе до полного удаления циклогексанона. Получали эластичные прозрачные пленки толщиной порядка 0.5 мм. Соотношение ПВХ : ДБФ по массе составило 1 : 3; концентрацию ЭАК варьировали в интервале 1–5%.
Изучали твердоконтактные сенсоры с пластифицированными мембранами собственного изготовления. К тщательно отшлифованному графитовому стрежню приклеивали мембранные диски диаметром 5–7 мм. Перед работой сенсоры кондиционировали в течение суток в 1 × 10–3 М растворе соответствующего антибиотика. Клей получали растворением 0.5 г ПВХ и 0.25 г ДБФ в 5 мл циклогексанона.
Модифицированные полианилином мембраны изготавливали по описанной выше методике с добавлением ПАНи. Соотношение масс навесок полианилина и ЭАК составляло 1 : 1 (способ 1). Использовали мембраны, изготовленные на основе полианилина (трансдьюсер), которые приклеивали между графитовым стержнем (токоотвод) и мембраной, содержащей ЭАК (способ 2). Пленку также наносили на поверхность электрода методом полива.
Методы исследования. Электрохимические характеристики сенсоров изучали, измеряя ЭДС элементов с переносом:
ЭДС цепи измеряли на иономере универсальном И-160 М (погрешность измерения ± 1мВ), электрод сравнения – хлоридсеребряный ЭВЛ-‑1МЗ. Ионную силу (μ = 0.1) поддерживали постоянной добавлением 1 М раствора NaCl.
Для контроля рН растворов антибиотиков использовали рН-метр рХ 150 мП с использованием стеклянного (ЭСЛ-63-07) и хлоридсеребряного (ЭВМ-1МЗ) электродов; для отделения белковых компонентов из смешанной слюны использовали центрифугу ЦЛМН-Р-10-0.1 Элекон.
Коэффициенты потенциометрического селективности (Ki/j) оценивали методом бионных потенциалов и смешанных растворов [21].
Объемные свойства мембран исследовали при постоянном токе (методом приложенного потенциала) с использованием четырехэлектродной схемы, состоящей из пары платиновых (токопроводящих) и пары хлоридсеребряных (регистрирующих) электродов. Напряжение на мембране при прохождении тока регистрировали с помощью двух электродов сравнения, подключенных к мультиметру ДТ9202А и последовательно подключенному микроамперметру М-244. Источником поляризации служил гальваностат.
Ячейка представляла собой цилиндр, состоящий из двух равных отсеков (l = 2 см), между которыми наклеивали мембрану диаметром 1 см. Отсеки ячейки заполняли растворами антибиотиков различных концентраций.
Пробоподготовка ротовой жидкости. Пробы ЖРП центрифугировали 10–20 мин при 3500 об./мин. В подготовленные пробы ЖРП вносили различные добавки антибиотиков. Концентрацию антибиотиков в ЖРП находили по градуировочному графику. Статистическую обработку проводили согласно рекомендациям [22]. Сенсоры использовали для определения основного вещества цефуроксим аксетила в препарате “Зиннат”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Цефазолин и цефуроксим – антибиотики кислотного типа, полностью диссоциируют при рН 5; цефотаксим – амфотерный антибиотик, молекула которого содержит карбоксильную и аминотиазольную группы. Этот антибиотик существует в виде катиона (сильнокислая среда), цвиттер-иона (слабокислая среда) и аниона (нейтральная и слабощелочная среда). Цефалоспорины подвержены гидролизу: при раскрытии β-лактамного кольца образуется 7-аминоцефалоспорановая кислота [14]. Цефуроксим аксетил – эфир цефуроксима – гидролизуется до цефуроксима (в водной среде и кишечнике) [12].
Существенной особенностью строения цефалоспориновых антибиотиков является наличие большого числа гетероатомов (–ОН, –NH2, –S–-группы и др), т.е. потенциально это комплексообразующие реагенты. Известно [23], что только ион серебра(I) образует отрицательно заряженные комплексные соединения с β-лактамами. Состав и константы образования этих соединений определены методами спектрофотометрии и потенциометрии [24]. В слабокислой среде цефазолин, цефотаксим образуют комплексы стехиометрического состава 1 : 1, в щелочной среде эти же антибиотики взаимодействуют с серебром(I) с образованием билигандных заряженных комплексных соединений $\left( {{\text{AgL}}_{{\text{2}}}^{ - }} \right).$ Константы устойчивости соединений ${\text{Ag}}(\beta {\text{ - lac}})_{{\text{2}}}^{ - }$ равны: lg β = 7.56 (цефазолин), lg β = 7.35 (цефотаксим) [24]. Заряженные комплекы серебра(I) с цефалоспоринами использовали в качестве ЭАК мембран потенциометрических сенсоров, противоины – катионы тетрадециламмония. Произведения растворимости ${\text{Ag}}(\beta {\text{ - lac}})_{{\text{2}}}^{ - }$ ⋅ TDA+ составили соответственно 1.9 × 10–8 и 2.1 × 10–8 для цефазолина и цефотаксима [24].
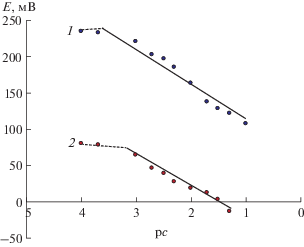
Рассмотрим основные электрохимические характеристики исследуемых сенсоров. Зависимости ЭДС от концентрации антибиотиков идентичны и линейны в интервале концентраций 1 × 10–4 (5 × 10–5)–1 × 10–2 (0.1) М; наклоны электродных функций составляют 52–58 мВ/рс (цефуроксим, цефуроксим аксетил, цефотаксим, цефазолин). Оптимальная концентрация ЭАК в мембранах составляет 2–5%; дрейф потенциала сенсоров 5–10 (2–4) мВ/сут. По зависимости Е = = f(–lg cβ-lac) определены пределы обнаружения антибиотиков (рис. 1, табл. 2).
Рис. 1.
Электродные функции в растворах цефазолина для немодифицированных (1), модифицированных полианилином (2, 3) сенсоров: 2 – способ 2, 3 – способ 1 (ЭАК – Ag(Cef)2·TДА).

Таблица 2.
Электроаналитические характеристики немодифицированных и модифицированных полианилином твердоконтактных сенсоров на основе различных электродноактивных компонентов в растворах соответствующих антибиотиков (n = 3, P = 0.95)
| ЭАК | Е = f(c), M | S ± ∆S, мB/pc | τ, с (10–4– 10–3 М) | сmin, М | ΔЕ, мВ/сут |
|---|---|---|---|---|---|
| Ag(Cef)2 · ТДА | 5 × 10–5–0.1 | 52 ± 5 | 10–20 | 5 × 10–5 | 5–10 |
| Ag(Cef)2 · ТДА–ПАНи (способ 1) | 5 × 10–5–0.1 | 56 ± 4 | 5–10 | 2 × 10–5 | 4–6 |
| Ag(Cef)2 · ТДА–ПАНи (способ 2) | 5 × 10–5–0.1 | 57 ± 4 | 5–10 | 2 × 10–5 | 4–6 |
| Ag(Cef)2 · ТДА ЖК-сенсор | 1 × 10–5–0.1 | 57 ± 2 | 20–25 | 3 × 10–6 | 2–4 |
| Ag(Ceftx)2 · ТДА | 5 × 10–5–0.1 | 55 ± 5 | 10–20 | 3 × 10–5 | 4–6 |
| Ag(Ceftx)2 · ТДА–ПАНи | 5 × 10–5–0.1 | 58 ± 5 | 10–20 | 2 × 10–5 | 2–4 |
Потенциалопределяющей является реакция ионного обмена на границе мембрана/раствор (предварительно происходит диссоциация ионообменника в фазе мембраны):
Исследовали электроаналитические свойства сенсоров, модифицированных полианилином. Из рис. 1 видно, что исследуемые модифицированные сенсоры на основе Ag(Cef)2–TDA обладает чувствительностью к цефазолину в широком интервале концентраций. Угловые коэффициенты электродных функций соответствуют теоретическим для однозарядных ионов. Сенсоры обладают более продолжительным сроком службы (2 мес.), при этом уменьшается дрейф потенциала. Улучшение электрохимических характеристик связано с тем, что полианилин обладает высокими электропроводящими свойствами, снижает сопротивление мембран в 2 раза, обеспечивает бóльшую удельную поверхность мембран сенсоров. Способы модифицирования поверхности твердоконтактных сенсоров не влияют на их электроаналитические свойства. Жидкостные сенсоры имеют более широкий интервал линейности электродных функций; предел обнаружения снижается на порядок, срок службы 3–4 мес. [19].
Сенсоры на основе различных ЭАК чувствительны к цефотаксиму, цефазолину, цефуроксиму, цефуроксим аксетилу, цефтриаксону в широком концентрационном интервале (рис. 2, 3). Природа активных компонентов мембран не влияет на электроаналитические свойства сенсоров, так как константы устойчивости комплексных соединений серебра(I) с цефазолином и цефотаксимом практически одинаковы, а их ионные ассоциаты с тетрадециламмонием имеют близкие значения произведений растворимости.
Рис. 2.
Электродные функции для немодифицированных (1) и модифицированных полианилином (2) сенсоров в растворах цефотаксима (ЭАК – Ag(Cef)2 · ТДА).

Рис. 3.
Электродные функции немодифицированных сенсоров в растворах некоторых цефалоспориновых антибиотиков: 1 – цефотаксим, 2 – цефазолин, 3 – цефуроксим, 4 – цефтриаксон (ЭАК – Ag(Ceftx)2 · ТДА).

Сравнение электроаналитических свойств сенсоров показывает, что модифицирование поверхности мембран приближает крутизну электродных функций к нернстовским значениям для однозарядных (цефотаксим, цефуроксим) и двузарядных (цефтриаксон) ионов; сокращается время отклика, что связано с влиянием полианилина на стабилизацию потенциалов твердоконтактных сенсоров. Пределы обнаружения антибиотиков и интервалы линейности электродных функций одинаковы для немодифицированных и модифицированных сенсоров (табл. 3).
Таблица 3.
Электрохимические характеристики твердоконтактных немодифицированных цефотаксимселективных сенсоров в растворах некоторых цефалоспориновых антибиотиков (электродноактивный компенент – Ag(Ceftx)2 · TDA, n = 3, P = 0.95)
| Антибиотик | Е = f(c), M | S ± ∆S, мB/pc | τ, с (10–3–10–2 М) | сmin, М | ΔЕ, мВ/сут |
|---|---|---|---|---|---|
| Цефотаксим | 1 × 10–4–0.1 | 55 ± 3 | 20–25 | 6.3 × 10–5 | 10–12 |
| Цефазолин | 1 × 10–4–0.1 | 58 ± 5 | 20–25 | 3.2 × 10–5 | 7–9 |
| Цефуроксим | 1 × 10–4–0.1 | 50 ± 4 | 20–30 | 3.2 × 10–5 | 10–12 |
| Цефтриаксон | 1 × 10–4–0.1 | 31 ± 3 | 20–30 | 3.2 × 10–5 | 10–12 |
Оценены коэффициенты потенциометрической селективности (Ki/j) цефотаксимселективных сенсоров по отношению к цефтриаксону, цефуроксиму, цефазолину (рис. 4). Сенсоры на основе Ag(Ceftx)2 · TDA не обладают специфичностью по отношению к основному иону, они проявляют чувствительность и к другим цефалоспоринам (Ki/j = 1). Аналогичные данные по Ki/j получены и для цефазолинселективных сенсоров по отношению к цефотаксиму, цефуроксиму, цефтриаксону.
Рис. 4.
Коэффициенты потенциометрической селективности цефотаксима к цефтриаксону, цефуроксиму, цефазолину. ЭАК – Ag(Ceftx)2 · ТДА, сЭАК = 2%.

Таким образом, сенсоры на основе тетрадециламмония с комплексными соединениями серебро(I)–цефотаксим (цефазолин) можно рекомендовать в качестве универсальных для определения цефазолина, цефотаксима, цефуроксима, цефуроксим аксетила, цефтриаксона. Важно, что нет необходимости синтеза различных ЭАК, получения мембран и изготовления отдельных сенсоров. Сенсоры на основе различных ЭАК можно применять в мультисенсорных системах типа “электронный язык” для раздельного определения цефалоспориновых антибиотиков в водных и биологических средах.
Исследование транспортных свойств мембран показало, что введение полианилина уменьшает их сопротивление (Rнемод = 1.3 ± 0.1 МОм, Rмод = = 0.75 ± 0.03 МОм); что связано с увеличением проводимости мембран в присутствии полианилина.
Электроаналитические характеристики цефотаксимселективных сенсоров в ротовой жидкости. На рис. 5 в качестве примера представлены электродные функции твердоконтактных сенсоров в растворах цефотаксима на фоне ЖРП. Наблюдается отклонение значений электродных потенциалов в сторону отрицательных значений на фоне ротовой жидкости. Это может быть связано с сильным фоновым влиянием неорганических и органических ионов, входящих в состав смешанной слюны. Сенсоры имеют достаточно большую область линейности (1 × 10–4–0.1 М), угол наклона электродных функций 50 ± 2 мВ/рс, время отклика 40–60 с. Все это делает возможным их применение при определении антибиотиков в биологических жидкостях без предварительного осаждения белков.
Рис. 5.
Электродные функции твердоконтактных сенсоров в водном растворе (1) и на фоне жидкости ротовой полости (2). ЭАК – Ag(Ceftx)2 · ТДА, сЭАК = 2%.
Мы выполнили определение цефотаксима, цефазолина, цефуроксима в модельных водных растворах (sr ≤ 0.08) и в смешанной слюне (sr ≤ 0.1) с внесенными добавками антибиотиков (табл. 4).
Таблица 4.
Результаты определения цефотаксима в модельных водных растворах и в ротовой жидкости (n = 3, P = = 0.95)
| Водный раствор | ЖРП | ||||
|---|---|---|---|---|---|
| введено, мг | найдено, мг | sr | введено, мг | найдено, мг | sr |
| 2.3 | 1.9 ± 0.4 | 0.08 | 1.0 | 1.3 ± 0.3 | 0.09 |
| 5.7 | 6 ± 1 | 0.07 | 2.3 | 2.5 ± 0.4 | 0.06 |
| 22 | 26 ± 5 | 0.08 | 10 | 10 ± 2 | 0.07 |
| 57 | 64 ± 7 | 0.04 | 22 | 23 ± 6 | 0.10 |
Методика ионометрического определения антибиотиков в ЖРП аналогична способу [19]. Таким образом, разработанные немодифицированные и модифицированные твердоконтактные потенциометрические сенсоры на основе соединений тетрадециламмония с комплексными соединениями серебро(І)–β-lac, позволяют определять цефалоспориновые антибиотики в водных средах и ротовой жидкости. Их можно использовать для исследования фармакокинетики антибиотиков, контроля их содержания в процессе лечения, определения основного вещества в лекарственных препаратах
Методика определения цефуроксим аксетила в препарате “Зиннат”. Каждая таблетка лекарственного препарата “Зиннат” содержит в качестве активного компонента цефуроксим аксетил (250 мг в пересчете на цефуроксим) и вспомогательные вещества: МКЦ, кроскармеллозу натрия, лаурилсульфат натрия, коллоидный диоксид кремния, растительное гидрогенизированное масло, пропиленгликоль, метилпарагидроксибензоат.
Навеску цефуроксима (цефурабола, цефуруса) растворяли в колбе емк. 25 мл (концентрация антибиотика 1 × 10–2 М). Растворы с концентрациями 1 × 10–3–1 × 10–5 М готовили из 1 × 10–2 М раствора последовательным разбавлением в колбах емк. 25 мл и измеряли ЭДС.
Измельчали таблетку препарата “Зиннат”, точную навеску помещали в колбу емк. 25 мл, разбавляли до метки дистиллированной водой, измеряли ЭДС модифицированным полианилином и хлоридсеребряным электродами. По зависимости ЭДС от отрицательного логарифма концентрации стандартного свежеприготовленного раствора цефуроксима находили концентрацию цефуроксим аксетила в таблетке. Рассчитывали содержание основного вещества в препарате “Зиннат”. Показано, что найденные содержания цефуроксим аксетила соответствуют декларированным.
Список литературы
Кулапин А.И., Матерова Е.А., Кулапина Е.Г. Твердоконтактные потенциометрические сенсоры с пластифицированными мембранами // Заводск. лаборатория. Диагностика материалов. 2002. Т. 68. № 12. С. 3.
Шведене Н.В., Откидач К.Н., Гумеров М.Р., Тараканов П.А., Томилова Л.Г. Новые металлопорфиразины как активные компоненты мембран анионселективных электродов // Журн. аналит. химии. 2015. Т. 70. № 1. С. 63. (Shvedene N.V., Otkidach K.N., Gumerov M.R., Tarakanov P.A., Tomilova L.G. New metalloporphyrazines as active components of membranes of anion-selective electrodes // J. Analyt. Chem. 2015. V. 70. № 1. Р. 72.)
Adhikari B.-R., Govindhan M., Chen A. Carbon nanomaterials based electrochemical biosensors for the sensitive detection of pharmaceutical and biological compounds // Sensors. 2015. V. 15. № 9. P. 22490.
Wang Huai-Sheng, Li Tian-Hua, Jia Wen-Li, Xu Hong-Yan. Highly selective and sensitive determination of dopamine using a Nafion/carbon nanotubes coated poly-(3-methylthiophene) modified electrode // Biosens. Bioelectron. 2006. V. 22. P. 664.
Verrelli G., Lvova L., Paolesse R., Di Natale C., D’Amico A. Metalloporphyrin-based electronic tongue: An application for the analysis of Italian white wines // Sensors. 2007. V. 7. P. 2750.
Хади М., Хонарманд Э. Применение электрода из анодированного пирографита с торцевой поверхностью для анализа клиндамицина в фармацевтических препаратах и образцах человеческой мочи // Электрохимия. 2017. Т. 53. № 4. С. 431.
Абаляева В.В., Дремова Н.Н. Электрохимическое допирование полианилина анионом тетрацианохинодиметана // Электрохимия. 2016. Т. 52. № 8. С. 834.
Холошенко Н.М., Рясенский С.С., Горелов И.П. Твердотельные ионоселективные электроды с ионно-электронными трансдьюсерами для определения дофамина // Хим.-фарм. журн. 2006. Т. 40. № 6. С. 44.
Горелов И.П., Рясенский С.С., Картамышев С.В., Федорова М.В. Твердотельный ионоселективный электрод с ионо-электронным трансдьюсером для определения хлордиазепоксида // Журн. аналит. химии. 2005. Т. 60. № 1. С. 74. (Gorelov I.P., Ryasensky S.S., Kartamyshev S.V., Fedorova M.V. Solid-state ion-selective electrode with ion-electron transducer for determination of chlordiazepoxide // J. Analyt. Chem. 2005. V. 60. № 1. Р. 65.)
Рясенский С.С., Феофанова М.А., Васильева Д.В., Мантров Г.И. Твердотельный ионоселективный электрод с ионо-электронным трансдьюссером для количественного определения доксициклина // Хим.-фарм. журн. 2016. Т. 50. № 3. С. 52.
Картамышев С.В., Кузнецова М.В. Рясенский С.С., Горелов И.П. Твердотельные ионоселективные электроды, обратимые к анаприлину // Хим.-фарм. журн. 2005. Т. 39. № 1.С. 42.
Яковлев В.П., Яковлев С.В. Рациональная антимикробная фармакотерапия. М.: Литтерра, 2007. 784 с.
Суворова М.П, Белобородов В.Б., Яковлев С.В., Гаврилов М.М. Нозокомиальные инфекции в педиатрических стационарах // Вопросы практической педиатрии. 2016. Т. 6. С. 7.
Алексеев В.Г. Металлокомплексы пенициллинов и цефалоспоринов // Хим.-фарм. журн. 2011. Т. 45. № 11. С. 31.
Кулапина О.И., Кулапина Е.Г. Антибактериальная терапия. Современные методы определения антибиотиков в биологических и лекарственных средах. Саратов: Изд.-во “Саратовский источник”, 2015. 91 с.
Dehdashtian S., Behbahani M., Noghrehabadi A. Fabrication of a novel, sensitive and selective electrochemical sensor for antibiotic cefotaxime based on sodium montmorillonitenonoclay/electroreducedgraphene oxide composite modified carbon paste electrode // J. Electroanal. Chem. 2017. V. 801. P. 450.
Merola G., Martini E., Tomassetti M., Campanella L. New immunosensor for β-lactam antibiotics determination in river waste waters // Sens. Actuators B. 2014. V. 199. P. 301.
Merola G., Martini E., Tomassetti M., Campanell L. Simple and suitable immunosensor for β-lactam antibiotics analysis in real matrixes: milk, serum, urine // J. Pharm. Biomed. Anal. 2015. V. 106. P. 186.
Кулапина О.И., Макарова Н.М., Кулапина Е.Г. Потенциометрические сенсоры для определения некоторых цефалоспориновых антибиотиков в биологических и лекарственных средах // Журн. аналит. химии. 2015 .Т. 70 № 4. С. 399. (Kulapina O.I., Makarova N.M., Kulapina Е.G. Potentiometric sensors for the determination of some cephalosporin antibiotics in biological fluids and medicinal preparations // J. Analyt. Chem. 2015. V. 70. № 4. Р. 477.)
Вавилова Т.П., Янушевич О.О., Островская И.Г. Слюна. Аналитические возможности и перспективы. М.: Бином, 2014. 312 с.
Белюстин А.А. Потенциометрия. Физико-химические основы применения. М.: Лань, 2015. 336 с.
Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета программа Statistica. М.: МедиаСфера, 2002. 312 с.
Алексеев В.Г., Демская Л.В. Комплексообразование серебра(I) с ампициллином, амоксициллином и цефалексином // Коорд. химия. 2007. Т. 33. № 3. С. 211.
Кулапина Е.Г., Снесарев С.В. Потенциометрические сенсоры на основе органических ионообменников тетраалкиламмония и комплексов серебра(I) с ампициллином, оксациллином, цефазолином // Журн. аналит. химии. 2012. Т. 67. № 2. С. 198. (Kulapina Е.G., Snesarev S.V. Potentiometric sensors based on organic ion exchangers of tetraalkylammonium and silver complexes with ampicillin, oxacillin, and cefazolin // J. Analyt. Chem. 2012. V. 67. № 2. Р. 163.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


