Журнал аналитической химии, 2019, T. 74, № 8, стр. 563-573
Ковалентные покрытия кварцевых капилляров для электрофоретического определения биологически активных аналитов
Л. А. Карцова a, А. В. Кравченко a, *, Е. А. Колобова a, b
Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Петродворец, Университетский просп., 26, Россия
b Всероссийский центр экстренной и радиационной медицины имени А.М. Никифорова МЧС России
197082 Санкт-Петербург, ул. Оптиков, 54, Россия
* E-mail: kravchenko161216@gmail.com
Поступила в редакцию 03.05.2018
После доработки 26.01.2019
Принята к публикации 26.01.2019
Аннотация
Одно из главных ограничений метода капиллярного электрофореза (КЭ) – сорбция оснóвных соединений на стенках кварцевого капилляра. Для предотвращения этого явления в КЭ обычно используют фоновые электролиты с различными добавками, препятствующими сорбции аналитов благодаря формированию динамических покрытий. В качестве альтернативы применяют ковалентные покрытия, обладающие рядом достоинств и расширяющие аналитические возможности метода КЭ. Рассмотрены основные способы формирования покрытий, ковалентно связанных со стенками кварцевого капилляра.
Капиллярный электрофорез – активно развивающийся метод разделения и концентрирования ионных и нейтральных соединений [1]. Главные его достоинства – экспрессность, высокая эффективность и простота использования. Однако имеются и ограничения, затрудняющие использование КЭ при решении различных медико-биологических задач: сорбция ионогенных аналитов на стенках кварцевого капилляра и низкая чувствительность в УФ-области. Использование различных вариантов внутрикапиллярного концентрирования и формирование динамических или ковалентных покрытий на стенках капилляра позволяют преодолеть эти ограничения [2–4].
Опубликовано немало оригинальных статей и обзоров, посвященных динамическим модификаторам в КЭ [5–21], добавление которых в фоновый электролит способствует формированию покрытия внутренних стенок кварцевого капилляра. Однако воспроизводимость миграционных характеристик аналитов на таких покрытиях бывает недостаточна. Образование ковалентной связи между модификатором и силанольными группами капилляра позволяет генерировать стабильный электроосмотический поток (ЭОП), что существенно повышает воспроизводимость результатов электрофоретического анализа. Подобные эксперименты описаны еще в конце XX в. [22]: ковалентная пришивка γ-метакрилоксипропилтриметоксисилана с последующей физической адсорбцией акриламида способствовала селективному разделению смеси ароматических карбоновых кислот. Это послужило основой дальнейшего развития идеи формирования и использования в электрофоретическом анализе ковалентных покрытий.
РАЗЛИЧНЫЕ ПОДХОДЫ К ФОРМИРОВАНИЮ КОВАЛЕНТНЫХ ПОКРЫТИЙ
Применение разных техник для создания слоя-линкера и использование широкого круга соединений различной природы позволяет получать покрытия, характеризующиеся высокой стабильностью. В качестве исходных соединений традиционно применяют мономеры и силилирующие агенты, полимеризующиеся внутри капилляра с образованием силоксановых связей [23–40]. В работах [41–43] использовали реактивы Гриньяра, обеспечивающие формирование более стабильной по сравнению с Si–О связи Si–С. Рассмотрим некоторые примеры.
Одним из подходов при модификации стенок кварцевого капилляра является полимеризация мономеров in situ с образованием монолитных колонок [23], которые получили широкое распространение благодаря простоте синтеза и успешному применению в обращенно-фазовом режиме капиллярной электрохроматографии (КЭХ) при разделении пептидов [24, 25], ароматических углеводородов [26], аминов [27], полиароматических соединений [28, 29]. В работе [30] методом КЭХ на монолитной колонке, полученной радикальной сополимеризацией лаурилметакрилата и этилендиметакрилата, успешно разделены диастереоизомеры пептидов, чего не удавалось достичь в условиях ВЭЖХ и капиллярного зонного электрофореза.
Изучено [31] влияние структуры полимеров, используемых для ковалентной модификации стенок капилляра, на скорость ЭОП и время миграции аналитов. В результате модификации получили незаряженные покрытия для разделения поликатионных аналитов. Наиболее удачным оказалось покрытие на основе поли(N,N-диметилакриламида). Незначительное количество остаточных силанольных групп после модификации обеспечило лучшие аналитические характеристики: высокую воспроизводимость скорости ЭОП и эффективность. На подготовленном покрытии исследовали комплексообразование между аналитами и циклодекстринами [31]. Наряду с полимеризацией при модификации внутренних стенок кварцевого капилляра часто используют и процессы сополимеризации [30, 32, 33]. Так, в работе [33] синтезирована монолитная колонка с октадецилакрилатом – функциональным мономером и пентаэритритом триакрилата – сшивающим агентом. Подобные капилляры успешно применены при разделении смеси белков с эффективностью до 200 тыс. теоретических тарелок (т.т.) (рис. 1).
Рис. 1.
Электрофореграмма смеси пептидов, полученная на капилляре, модифицированном путем сополимеризации октадецилакрилата и пентаэритрит триакрилата [33]. Условия разделения: система КЭ P/ACE 5010; фоновый электролит: 50 об. % ацетонитрила, 10 мМ NaH2PO4 (pH 7); 12 кВ; 214 нм; 1 – лизозим, 2 – цитохром С, 3 –карбоангидраза, 4 – β-лактоглобулин В, 5 – β-лактоглобулин А, 6 – α-лактальбумин.

Полиэдральные олигомерные силсесквиоксаны – надмолекулярные структуры блок-сополимеров, содержащие метакрилатную группу, – в работе [34] взяты в качестве функциональных мономеров при сополимеризации с диметакрилатом бисфенола A и этилендиметакрилатом в присутствии порогенных растворителей. На данном покрытии удалось с высокой селективностью разделить полициклические ароматические углеводороды за счет дополнительных π–π-взаимодействий между аналитами и ароматической системой стационарной фазы. В рамках данной статьи отдельные виды монолитных колонок не будут рассмотрены, поскольку их синтезу и сфере применения посвящены обстоятельные обзоры [23, 24].
В работе [35] предложена трехстадийная модификация стенок кварцевого капилляра, включающая аминирование, винилирование с аллилглицидиловым эфиром и покрытие политиольной пленкой (рис. 2а). Авторы предположили, что такие новые полиметакрилатно-полисилоксановые композиционные материалы с повышенным содержанием тиолов эффективны в качестве основы для последующей фунционализации с помощью клик-реакции сульфанильных групп, что продемонстрировано на примере трет-бутилкарбамоилхинина (рис. 2б). Полученное покрытие обеспечило высокую энантиоселективность при разделении рацемической смеси (R,S)-N-3,5-динитробензол-лейцина. В работе [36] аналогичным образом синтезировано стабильное покрытие, на котором с высокой эффективностью разделены смеси ароматических соединений, содержащие как гомологи бензола, так и полициклические ароматические углеводороды в модельной смеси ЕРА 610 (рис. 3).
Рис. 2.
Схема синтеза полиметакрилатно-полисилоксанового покрытия с модификацией тиолами (а) и функционализацией трет-бутилкарбамоилхинином (б) [35].

Рис. 3.
Электрофореграмма смеси полициклических ароматических углеводородов (ЕРА 610) на покрытии, полученном путем клик-реакции метакрилат-полиэдрического олигомерного силсесквиоксана и тетракис(3-меркаптопропионат)пентаэритрита [36]. Условия разделения: Agilent 1100; фоновый электролит: ацетонитрил–вода; градиентный режим (пунктир): от 40% воды к 95% ацетонитрила, время градиента 25 мин; 300 нл/мин; УФ-детектор, 254 нм; 1 – нафталин, 2 – аценафтилен, 3 – аценафтен, 4 – флуорен, 5 – фенантрен, 6 – антрацен, 7 – флуорантен, 8 – пирен, 9 – бензо(а)антрацен, 10 – хризон, 11 – бензо(b)флуорантен, 12 – бензо(k)флуорантен, 13 – бензо(a)пирен, 14 – дибензо(a,h)антрацен, 15 – бензо(g,h,i)перилен, 16 – индено(1,2,3-cd)пирен.

При формировании ковалентных покрытий широко используют силилирующие агенты благодаря отсутствию токсичности и легкости образования связи Si–O, что, в свою очередь, позволяет снизить продолжительность реакции. В работе [37] описано создание ковалентного покрытия путем пришивки мономеров акриламида к стенкам кварцевого капилляра с помощью 7-октен-1-илтриметоксисилана. Последующая функционализация полиакриламидом позволила существенно снизить адсорбцию белков на стенках капилляра и повысить эффективность до 800 тыс. т.т. Силилирующие агенты использовали в работах [38–40].
Ковалентные покрытия можно формировать с использованием золь–гель технологии. Преимуществом такого подхода являются независимость структуры слоя от свойств поверхности капилляра и стабильность получаемого покрытия в широком диапазоне значений рН в течение длительного времени [42]. Золь–гель процедура включает несколько этапов: гидролиз; конденсацию и поликонденсацию, старение и сушку. Первый этап – гидролиз алкоксида металла с образованием соответствующего гидроксида, который далее подвергается поликонденсации с образованием частиц золя, сшиваемых с образованием геля. Образующийся гель выдерживают при комнатной температуре и атмосферном давлении (старение). Сформированная таким способом фторсодержащая неподвижная фаза обеспечила разделение позиционных изомеров дифторбензола [44]. Функционализация субслоя с применением ионных жидкостей (ИЖ) эффективна при разделении ароматических углеводородов и неорганических анионов [45]. В работе [46] с использованием золь–гель технологии подготовлена фторсодержащая стационарная фаза для КЭХ, полученная гидролизом смеси тетраэтоксисилана и тридекафтор-1,1,2,2-тетрагидрооктил-1-триэтоксисилана. На такой фазе полностью разделены фторированные аналиты, чего не удавалось достичь на колонке с сорбентом С8, полученной аналогичным способом. Достигнуты высокие значения эффективности (100–300 тыс. т.т./м).
Использование для модификации порфиринов, ковалентно связанных с бруцином через фенильный линкер, привело к селективному разделению нуклеиновых оснований (аденин, гуанин, тимин, урацил, цитозин), нуклеотидов, нуклеозидов (аденозин, гуанозин, уридин, цитидин, инозин) и олигопептидов за счет нековалентных взаимодействий: ионных, π–π-стэкинга, водородных связей. Отмечается стабильность покрытия как в щелочной (рН 9), так и в кислой средах (рН 2.5) [47].
Предложен [48–53] интересный путь создания ковалентного покрытия методом самосборки путем последовательной промывки кварцевого капилляра растворами модификаторов, которая сопровождается сшиванием образовавшихся слоев между собой. Полученное покрытие стабильно в широком диапазоне рН и не меняет своих характеристик после воздействия органических растворителей. Увеличение числа циклов промывки приводит к повышению толщины покрытия. На рис. 4а приведена схема синтеза покрытия AlaZnCl: капилляр после силилирования последовательно промывали в течение 30 мин растворами ацетата цинка в метаноле и раствором предварительно синтезированного лиганда N-(4-пиридилметил)-1-аланина. Эффективность покрытия AlaZnCl оценивали с использованием тестовой смеси, содержащей энантиомеры адреналина, изопротеренелола, норадреналина, синефрина, тербуталина и карведиола. Достигнуты высокие значения эффективности и факторов энантиоселективности (рис. 4б) [53].
Рис. 4.
Основные этапы синтеза покрытия AlaZnCl по схеме самосборки (а) и электрофореграммы энантиомеров нейромедиаторов и лекарственных средств на модифицированном AlaZnCl капилляре (б) [53]. Условия разделения: система КЭ PA 800 plus; фоновый электролит: 25 об. % метанола, 10 мМ боратный буферный раствор (рН 9–10); 15 кВ, УФ-детектор, 214 нм.

МОДИФИКАТОРЫ ДЛЯ ФУНКЦИОНАЛИЗАЦИИ КВАРЦЕВЫХ КАПИЛЛЯРОВ
При функционализации используют реагенты различной природы: от мономеров до высокомолекулярных соединений и даже живых организмов, например, бактерий E. coli. Так, при разделении моноклональных антител в качестве модификатора стационарной фазы использовали белок [54]. Субслой представлял собой полидиаллидиметиламмония хлорид, модифицированный бычьим сывороточным альбумином с участием электростатических взаимодействий. В работе [55] модификацию проводили бактериями E. coli (рис. 5а), и полученный капилляр использовали для разделения энантиомеров антибактериального средства офлоксацина (рис. 5б). В работе [38] кварцевый капилляр модифицировали в два этапа: 1) силилирование 3-аминопропилтриэтоксисиланом и 2) ковалентная пришивка δ-глюконолактона. Сформированное покрытие генерировало катодный ЭОП при рН > 4.3, что обеспечило разделение смеси белков в широком диапазоне рН с эффективностью до 450 тыс. т.т. Степень модификации оценивали, контролируя ЭОП.
Рис. 5.
Схема синтеза покрытия капилляра с применением бактерий E. coli (а) и электрофореграмма энантиомеров офлоксацина на покрытом капилляре (б) [55]. Условия разделения: система КЭ Аgilent 7100 3D; фоновый электролит: 50 мМ фосфатный буферный раствор (рН 6.0); 15 кВ; УФ-детектор, 280 нм.

Дендримеры. Возможность применения дендритных полимеров в качестве стационарных фаз для КЭХ обсуждается в работах [56–61]. Наличие полости у таких соединений способствует образованию комплексов включения с аналитами, что повышает селективность электрофоретического разделения. Использование карбосилановых дендримеров при модификации капилляра обеспечило получение покрытия, стабильного в кислой и щелочной средах, а также при низких и высоких температурах. Так, получена новая хиральная колонка для КЭХ, в которой стационарная фаза состояла из карбосилановых полимеров с привитыми терминальными фрагментами β-циклодекстрина (β-ЦД) [57]. Получены высокие значения эффективности и факторов энантиоселективности при разделении энантиомеров хлортриметона, прометазина и бензедрина. Использование карбосилановых дендримеров при модификации капилляра обеспечило устойчивость получаемого покрытия в кислой и щелочной средах, а также стабильность при низких и высоких температурах. Синтезированы PLOT-колонки на основе сверхразветвленных поли(этилениминовых) полимеров, модифицированных мальтозой, которые использовали для электрофоретического определения нанограммовых количеств альбумина в моче [58]. Лучшие характеристики разделения на полимерных покрытиях достигаются для оснóвных аналитов. Однако процесс их получения многостадиен, что ухудшает воспроизводимость рабочих характеристик колонок и увеличивает трудоемкость их изготовления. Интересный подход, лишенный указанных выше недостатков, предложен в работе [62], где фотосшивание дендримеров используют как один из вариантов формирования ковалентных покрытий. Методом послойной сборки дендритные полимеры прививали к поверхности капилляра за счет связующего фоточувствительного полимера, содержащего диазогруппы. Капилляр последовательно промывали водным раствором фоточувствительного полимера, водой и водным раствором дендритного полимера, модифицированного ЦД. На этом этапе формировалось многослойное физически адсорбированное покрытие за счет электростатического взаимодействия положительно заряженной диазониевой группы $( - {\text{N}}_{2}^{ + })$ фоточувствительного полимера и отрицательно заряженной карбоксильной группы дендримера. Разложение диазониевой группы под действием УФ-излучения (365 нм, 15 мин) обеспечило фотосшивание последовательных монослоев дендримера между собой, т.е. образование ковалентных связей (рис. 6). Покрытие не теряло своих характеристик в широком диапазоне рН и после воздействия органических растворителей. Возможности таких покрытий изучены на примере смеси белков, разделение которых достигнуто за 18 мин. Они прекрасно зарекомендовали себя и при разделении фенольных соединений, основных лекарственных препаратов, водорастворимых витаминов [63].
Рис. 6.
Схема формирования ковалентных покрытий на основе дендримеров методом послойной сборки [60].

Имидазолиевые ионные жидкости. Описана [64] модификация стенок кварцевого капилляра путем последовательного силилирования 3-хлорпропилтриметоксисиланом и постфункционализации имидазолом. Свойства полученных покрытий оценивались при электрофоретическом разделении тестовой смеси ароматических кислот. В найденных условиях достигнута высокая эффективность (300 тыс. т.т.) и снижена продолжительность анализа. Ковалентные покрытия с участием имидазолиевой ИЖ апробированы и при разделении ионов металлов [65]. Эффективность возросла в 1.5 раза за счет электростатического отталкивания ионов металлов от положительно заряженных стенок модифицированного ИЖ капилляра. Это позволило разделить ионы марганца и свинца, что не удавалось осуществить на немодифицированном капилляре (рис. 7). Пределы обнаружения составили 0.27–7.3 нг/мл. Ковалентное покрытие кварцевого капилляра с применением N-бутилзамещенного имидазола обеспечило снижение коэффициентов асимметрии пиков за счет предотвращения сорбции аналитов на стенках капилляра и заметный рост эффективности при электрофоретическом разделении аминокислот и катехоламинов, а сочетание с внутрикапиллярным концентрированием привело к снижению пределов обнаружения катехоламинов до 1–2 нг/мл [66].
Рис. 7.
Электрофореграммы ионов металлов на немодифицированном (а) и модифицированном ионной жидкостью (б) капиллярах [65]. Условия разделения: система КЭ IA-P1; фоновый электролит: 7.5 мМ молочная кислота, 0.6 мМ 18-краун-6, 12 мМ α-циклодекстрин, 100 мМ 1-гексил-3-метилимидазолий хлорид (рН 4); кондуктометрический детектор; 1 – Cs+, 2 – ${\text{NH}}_{4}^{ + }$, 3 – K+, 4 – Ca2+, 5 – Sr2+, 6 – Na+, 7 – Pb2+, 8 – Mg2+, 9 – Ba2+, 10 – Ni2+, 11 – Li+.
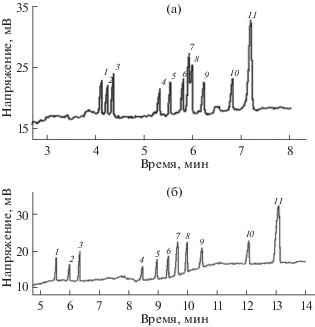
Металлоорганические каркасы (МОК) также нашли применение при функционализации. Это – координационные полимеры, представляющие собой микропористые кристаллические материалы, состоящие из кластеров или цепей ионов металлов, соединенных органическими лигандами, и обладающие большой площадью поверхности, разнообразной структурой и внутримолекулярными полостями [67–76]. Увеличение площади поверхности из-за пористости МОК сопровождается ростом эффективности и снижением продолжительности анализа, что показано на примере разделения смеси ароматических кислот и нестероидных противовоспалительных средств [69]. Синтез МОК in situ описан в работе [70]. Авторам удалось успешно применить полученные покрытия при разделении основных (замещенные анилины), кислотных (нитрофенолы) и нейтральных (углеводороды) аналитов. В работе [53] подобный подход применен для разделения энантиомеров.
Ковалентные органические каркасы, отличающиеся по сравнению с МОК бóльшей жесткостью и термостойкостью, низкой плотностью и постоянной пористостью, также могут быть иммобилизованы на внутренних стенках кварцевого капилляра. Предложена [49] методика создания полислоя с помощью послойной технологии, которая состояла в последовательной пришивке слоев дофамина и COF-5, представляющего собой продукт межмолекулярной дегидратации бензол-1,4-диборной кислоты и 2,3,6,7,10,11-гексагидрокситрифенилена. На примере модельной смеси алкилбензолов изучено влияние толщины привитого слоя на эффективность и селективность разделения. Сравнение результатов, полученных на трех капиллярах: со слоем полидофамина, со смешанным слоем полидофамин + + COF-5 и с тремя смешанными слоями полидофамин + COF-5 – показало, что полное разделение алкилбензолов достигнуто только в последнем случае, эффективность составила 140 тыс. т.т.
Наночастицы как модификаторы кварцевых капилляров представляют большой интерес. Их уникальные характеристики (высокая удельная поверхность и структурные свойства) открывают перспективы применения в КЭ для создания покрытий стенок капилляра при разделении заряженных аналитов [77]. Наноразмерные частицы диоксида кремния были первыми твердыми частицами, использованными для создания стационарных фаз в КЭХ. Легкость модификации частиц с силанольными и силоксановыми группами привела к появлению различных модифицированных частиц. Так, наночастицы с привитыми аминогруппами использовали в качестве покрытий стенок кварцевого капилляра, что привело к обращению ЭОП [78]. Преимущество таких покрытий – высокая воспроизводимость скорости ЭОП и миграции аналитов. Приготовлены монолитные колонки для КЭХ на основе модифицированного диоксида циркония для хиральных разделений [79]. Широко применяют в КЭХ и металлические наночастицы. Так, в работе [80] приготовлены колонки на основе наночастиц золота, привитых к поверхности капилляра посредством тиольных групп, что обеспечило предотвращение сорбции ДНК на стенках капилляра, высокую эффективность и воспроизводимость параметров миграции аналитов. В работе [81] получены наночастицы полихлорметилстирола, аминированные триметиламином, для применения в качестве покрытия стенок кварцевого капилляра. На таком капилляре в сочетании со стэкингом определяли бромат-ионы в водопроводной воде. При этом генерировался устойчивый обращенный ЭОП, а пределы обнаружения бромат-ионов были снижены с 80 до 8 нг/мл.
Полученные с использованием модифицированных ЦД частиц покрытия, стабильные в диапазоне рН 4.6–9.7, позволили успешно разделить энантиомеры лекарственных средств: зопиклона, хлорфенамина и тропикамида [82]. В работе [83] магнитные наночастицы сначала функционализировали аминогруппами (Fe3O4@SiO2–NH2) и C18-группами (Fe3O4@SiO2–C18), а затем с помощью магнитов закрепляли на поверхности кварцевого капилляра, обеспечивая легкость регулирования селективности разделения за счет изменения соотношения количества наночастиц в структуре покрытия. В работе [84] наночастицы на основе железа использовали для изготовления молекулярно-импринтированных полимеров путем самополимеризации дофамина на поверхности Fe3O4 в присутствии специально введенных целевых молекул-шаблонов – L-триптофана, L‑ти-розина, глицил-L-фенилаланина или S-флоксацина. После полимеризации и удаления шаблонов пористые частицы Fe3O4@PDA (PDA – полидофамин) упаковывали в микроканалы полидиметилсилоксана с помощью магнита и использовалали для энантиоселективного разделения аминокислот. Описано [52] формирование покрытия путем самосборки слоев катионного полиэлектролита полидиаллидиметиламмоний хлорида и оксида графена и использование его при разделении смеси конденсированных ароматических углеводородов. В работе [85] технология послойного нанесения применена для наночастиц диоксида кремния. Описано [86] аналогичное использование графена в качестве модификатора.
* * *
Таким образом, рассмотрены основные способы формирования покрытий стенок кварцевого капилляра путем образования ковалентной связи с модификатором, а также соединения различной природы, используемые для функционализации: от полимеров до наночастиц и МОК. Каждый из вариантов модификации имеет свои преимущества и ограничения. Стратегия выбора в существенной степени определяется природой модификатора и разделяемых соединений, конкретно решаемой аналитической задачей, условиями электрофоретического анализа, обеспечивающими лучшие характеристики эффективности и селективности разделения аналитов.
Авторы благодарят Российский фонд фундаментальных исследований за финансовую поддержку (грант 17-03-01282-a).
Список литературы
Капиллярный электрофорез / Под ред. Карцовой Л.А. / Проблемы аналитической химии. Т. 18. М.: Наука, 2014. 444 с.
Chen H., Wu Y.-H., Song D.-Y., Zhang W., Dong X.-Y., Li P.-W., Lu C.-M. On-line pre-concentration and UV determination of DNA fragments by dynamic coating capillary electrophoresis and its application to detection of genetically modified oilseed rape based on PCR // Microchem. J. 2007. V. 86. P. 17.
Chun M.S., Chung D.S. Large volume sample stacking in capillary electrophoresis of weakly acidic compounds using coated capillaries at high pH // Anal. Chim. Acta. 2003. V. 491. P. 173.
Kitagawaa F., Otsuka K. Recent applications of on-line sample preconcentration techniques in capillary electrophoresis. A review // J. Chromatogr. A. 2014. V. 1335. P. 43.
Znaleziona J., Petr J., Knob R., Maier V., Sevcık J. Dynamic coating agents in CE // Chromatographia. 2008. V. 67. P. 5.
Righetti P.G., Gelfi C., Verzola B., Castelletti L. The state of the art of dynamic coatings // Electrophoresis. 2001. V. 22. P. 603.
Liu C., Kang J. Improved capillary electrophoresis frontal analysis by dynamically coating the capillary with polyelectrolyte multilayers // J. Chromatogr. A. 2012. V. 1238. P. 146.
Tiana Y., Li Y., Mei J., Cai B., Dong J., Shi Z., Xiao Y. Simultaneous separation of acidic and basic proteins using gemini pyrrolidinium surfactants and hexafluoroisopropanol as dynamic coating additives in capillary electrophoresis // J. Chromatogr. A. 2015. V. 1412. P. 151.
Sedlakova P., Svobodova J., Miksık I., Tomas H. Separation of poly(amidoamine) (PAMAM) dendrimer generations by dynamic coating capillary electrophoresis // J. Chromatogr. B. 2006. V. 841. P. 135.
Liu H., Han N., Zhang L., Du Y., Zhang W. Design and evaluation of capillary electrophoresis in dynamically coated capillaries coupled with chemiluminescence detection // Anal. Chim. Acta. 2010. V. 680. P. 48.
Li J., Hana H., Wanga Q., Liua X., Jianga S. Polymeric ionic liquid as a dynamic coating additive for separation of basic proteins by capillary electrophoresis // Anal. Chim. Acta. 2010. V. 674. P. 243.
Gulcev M.D., Lucy C.A. Effect of coating electrolytes on two-tailed surfactant bilayer coatings in capillary electrophoresis // Anal. Chim. Acta. 2011. V. 690. P. 116.
Pei L., Lucy C.A. Insight into the stability of poly(diallydimethylammoniumchloride) and polybrene poly cationic coatings in capillary electrophoresis // J. Chromatogr. A. 2014. V. 1365. P. 226.
Sakai-Kato K., Kato M., Nakajima T., Toyo’oka T., Imai K., Utsunomiya-Tate N. Cationic starch derivatives as dynamic coating additives for protein analysis in capillary electrophoresis // J. Chromatogr. A. 2006. V. 1111. P. 127.
Melanson J.E., Baryla N.E., Lucy C.A. Dynamic capillary coatings for electroosmotic flow control in capillary electrophoresis // Trends Anal. Chem. 2001. V. 20. № 6. P. 365.
Acunha T., Simó C., Ibánez C., Gallardo A., Cifuentes A. Anionic metabolite profiling by capillary electrophoresis–mass spectrometry using a noncovalent polymeric coating. Orange juice and wine as case studies // J. Chromatogr. A. 2016. V. 1428. P. 326.
Bekri S., Leclercq L., Cottet H. Polyelectrolyte multilayer coatings for the separation of proteins by capillary electrophoresis: influence of polyelectrolyte nature and multilayer crosslinking // J. Chromatogr. A. 2015. V. 1399. P. 80.
Карцова Л.А., Бессонова Е.А., Колобова Е.А. Ионные жидкости – модификаторы хроматографических и электрофоретических систем // Журн. aналит. химии. 2016. Т. 71. № 2. С. 147. (Kartsova L.A., Bessonova E.A., Kolobova E.A. Ionic liquids as modifiers of chromatographic and electrophoretic systems // J. Analyt. Chem. 2016. V. 71. № 2. P. 141.)
Карцова Л.А., Бессонова Е.А. Биомедицинские приложения метода капиллярного электрофореза // Успехи химии. 2015. Т. 84. № 8. С. 860. (Kartsova L.A., Bessonova E.A. Biomedical applications of capillary electrophoresis // Russ. Chem. Rev. 2015. V. 84. № 8. Р. 860.)
Dzema D.V., Kartsova L.A., Emelianov G.A., Sukhomlinova E.A. New highly fluorinated polymers: modifiers of chromatographic and electrophoretic systems // Prot. Met. Phys. Chem.+ 2015. V. 51. № 6. P.1100.
Rageh A.H., Pyell U. Imidazolium-based ionic liquid-type surfactant as pseudostationary phase in micellar electrokinetic chromatography of highly hydrophilic urinary nucleosides // J. Chromatogr. A. 2013. V. 1316. P. 135.
Hjerten S. High-performance electrophoresis elimination of electroendosmosis and solute adsorption // J. Chromatogr. 1985. V. 347. P. 191.
Karenga S., El Rassi Z. Review trends in nonpolar polymer-based monolithic columns for reversed-phase capillary electrochromatography // Electrophoresis. 2011. V. 32. P. 90.
Karenga S., El Rassi Z. Naphthyl methacrylate-phenylenediacrylate-based monolithic column for reversed-phase capillary electrochromatography via hydrophobicand π interactions // Electrophoresis. 2010. V. 31. P. 3200.
Zhu G., Sun L., Dovichi N.J. Thermally-initiated free radical polymerization for reproducible production of stable linear polyacrylamide coated capillaries, and their application to proteomic analysis using capillary zone electrophoresis – mass spectrometry // Talanta. 2016. V. 146. P. 839.
Karenga S., El Rassi Z. Naphthyl methacrylate-based monolithic column for RP-CEC via hydrophobic and π interactions // Electrophoresis. 2010. V. 31. P. 991.
Pei L., Lucy C.A. Polymerized phospholipid bilayers as permanent coatings for small amine separations using mixed aqueous/organic capillary zone electrophoresis // J. Chromatogr. A. 2012. V. 1267. P. 80.
Connolly D., Twamley B., Paull B. High-capacity gold nanoparticle functionalised polymer monoliths // Chem. Commun. 2010. V. 46. P. 2109.
Proczek G., Augustin V., Descroix S., Hennion M.-C. Integrated microdevice for preconcentration and separation of a wide variety of compounds by electrochromatography // Electrophoresis. 2009. V. 30. P. 515.
Ludewig R., Dong J., Zou H., Scriba G.K.E. Separation of peptide diastereomers using cec and a hydrophobic monolithic column // J. Sep. Sci. 2010. V. 33. P. 1085.
Danel C., Melnyk P., Azaroual N., Larchanché P.-E., Goossens J.-F., Vaccher C. Evaluation of three neutral capillary coatings for the determination of analyte-cyclodextrin binding constants by affinity capillary electrophoresis. Application to N,N-disubstituted piperazine derivatives // J. Chromatogr. A. 2016. V. 1455. P. 163.
Zhang Q., Guo J., Wang F., Crommen J., Jiang Z. Preparation of a β-cyclodextrin functionalized monolith via a novel and simple one-pot approach and application to enantioseparations // J. Chromatogr. A. 2014. V. 1325. P. 147.
Karenga S., El Rassi Z. A novel, neutral hydroxylated octadecyl acrylate monolith with fast electroosmotic flow velocity and its application to the separation of various solutes including peptides and proteins in the absence of electrostatic interactions // Electrophoresis. 2010. V. 31. P. 3192.
Ou J., Zhang Z., Lin H., Dong J., Zou H. Polyhedral oligomeric silsesquioxanes as functional monomer to prepare hybrid monolithic columns for capillary electrochromatography and capillary liquid chromatography // Anal. Chim. Acta. 2013. V. 761. P. 209.
Carrasco-Correa E.J., Ramis-Ramos G., Herrero-Martínez J.M., Lämmerhofer M. Polymethacrylate monoliths with immobilized poly-3- mercaptopropyl methylsiloxane film for high-coverage surface functionalization by thiol-ene click reaction // J. Chromatogr. A. 2014. V. 1367. P. 123.
Lin H., Ou J., Liu Z., Wang H., Dong J., Zou H. Facile construction of macroporous hybrid monoliths via thiol- methacrylate michael addition click reaction for capillary liquid chromatography // J. Chromatogr. A. 2015. V. 1379. P. 34.
Cifuentes A., Canalejas P., Diez-Masa J.C. Preparation of linear polyacrylamide-coated capillaries. Study of the polymerization process and its effect on capillary electrophoresis performance // J. Chromatogr. A. 1999. V. 830. P. 423.
Shan L.G., Yu X., Wei Y.M., Zheng X.H., Zheng J.B. A covalent modified hydrophilic capillary for enhanced capillary electrophoresis of biopolymers // Chin. Chem. Lett. 2009. V. 20. P. 1123.
Xu L., Sun Y. Protein separation by open tubular capillary electrochromatography employing a capillary coated with phenylalanine functionalized tentacle-type polymer under both cathodic and anodic electroosmotic flows // J. Chromatogr. A. 2008. V. 1183. P. 129.
Sepehrifar R., Boysen R.I., Danylec B., Yang Y., Saito K., Hearn M.T. Application of pH-responsive poly(2-dimethyl-aminoethylmethacrylate)-block-poly(acrylic acid) coatings for the open-tubular capillary electrochromatographic analysis of acidic and basic compounds // Anal. Chim. Acta. 2016. V. 917. P. 117.
Moritani T., Yoon K., Rafailovich M., Chu B. DNA capillary electrophoresis using poly(vinyl alcohol). I. Inner capillary coating // Electrophoresis. 2003. V. 24. P. 2764.
Engelhard H., Cuñat-walter M.A. Preparation and stability tests for polyacrylamide-coated capillaries for capillary electrophoresis // J. Chromatogr. A. 1995. V. 716. P. 27.
Cobb K.A., Dolnik V., Novotny M. Electrophoretic separations of proteins in capillaries with hydrolytically stable surface structures // Anal. Chem. 1990. V. 62. P. 2478.
Narang P., Colón L.A. Sol–gel-derived fluorinated stationary phase for open tubular electrochromatography // J. Chromatogr. A. 1997. V. 773. P. 65.
Han H., Li J., Wang X., Liu X., Jiang S. Synthesis of ionic liquid-bonded organicsilica hybrid monolithic column for capillary electrochromatography // J. Sep. Sci. 2011. V. 34. P. 2323.
Purnima N., Colon L.A.. Sol–gel-derived fluorinated stationary phase for open tubular electrochromatography // J. Chromatogr. A. 1997. V. 773. P. 65.
Svobodová J., Kofronová O., Benada O., Král V., Mikšík I. Separation of oligopeptides, nucleobases, nucleosides and nucleotides using capillary electrophoresis/electrochromatography with sol–gel modified inner capillary wall // J. Chromatogr. A. 2017. V. 1517. P. 185.
Yu B., Chi M., Han Y., Cong H., Tang J., Peng Q. Self-assembled and covalently linked capillary coating of diazoresin and cyclodextrin-derived dendrimer for analysis of proteins by capillary electrophoresis // Talanta. 2016. V. 152. P. 76.
Bao T., Tang P., Kong D., Mao Z., Chen Z. Polydopamine-supported immobilization of covalent-organicframework-5 in capillary as stationary phase for electrochromatographic separation // J. Chromatogr. A. 2016. V. 1445. P. 140.
Qu Q., Liu Y., Shi W., Yan C., Tang X. Tunable thick porous silica coating fabricated by multilayer-by-multilayer bonding of silica nanoparticles for open-tubular capillary chromatographic separation // J. Chromatogr. A. 2015. V. 1399. P. 25.
Qu Q., Gu C., Gu Z., Shen Y., Wang C., Hu X. Layer-by-layer assembly of polyelectrolyte and grapheme oxide for open-tubular capillary electrochromatography // J. Chromatogr. A. 2013. V. 1282. P. 95.
Qu Q., Gu C., Gu Z., Shen Y., Wang C., Hu X. Layer-by-layer assembly of polyelectrolyte and grapheme oxide for open-tubular capillary electrochromatography // J. Chromatogr. A. 2013. V. 1282. P. 95.
Pan C., Wang W., Zhang H., Xu L., Chen X. In situ synthesis of homochiral metal–organic framework in capillary column for capillary electrochromatography enantioseparation // J. Chromatogr. A. 2015. V. 1388. P. 207.
Zhang Y., Wang W., Xiao X., Jia L. Separation of monoclonal antibody charge state variants by open tubular capillary electrochromatography with immobilized protein as stationary phase // J. Chromatogr. A. 2016. V. 1466. P. 180.
Fu Q., Zhang K., Gao D., Wang L., Yang F., Liu Y., Xia Z. Escherichia coli adhesive coating as a chiral stationary phase for open tubular capillary electrochromatography enantioseparation // Anal. Chim. Acta. 2017. V. 969. P. 63.
Abbasi E., Aval S.F., Akbarzadeh A., Milani M., Nasrabadi H.T., Joo S.W., Hanifehpour Y., Nejati-Koshki K., Pashaei-Asl R. Dendrimers: synthesis, applications, and properties // Nanoscale Res. Lett. 2014. V. 9. P. 247.
Chong-Qi S., Jie-Fen K., Nan-Jing S. Preparation and evaluation of capillary electrophoresis column bonded with carbosilane dendrimers // Chin. J. Anal. Chem. 2008. V. 36. P. 297.
Polikarpov N., Potolytsyna V., Bessonova E., Tripp S., Appelhans D., Voit B., Kartsova L. Dendritic glycopolymers as dynamic and covalent coating in capillary electrophoresis: View on protein separation processes and detection of nanogram-scaled albumin in biological samples // J. Chromatogr. A. 2015. V. 1378. P. 65.
Zhang X., Yang J., Liu S., Lin X., Xie Z. Branched polyethyleneimine-bonded tentacle-type polymer stationary phase for peptides and proteins separations by open-tubular capillary electrochromatography // J. Sep. Sci. 2011. V. 34. P. 3383.
Yu B., Chi M., Han Y., Cong H., Tang J., Peng Q. Self-assembled and covalently linked capillary coating of diazoresin and cyclodextrin-derived dendrimer for analysis of proteins by capillary electrophoresis // Talanta. 2016. V. 152. P. 76.
Бессонова Е.А., Королева В.Ю., Карцова Л.А., Потолицына В.Е. On-line концентрирование белков в условиях капиллярной электрохроматографии с использованием plot-колонок на основе сверхразветвленных полимеров // Cорбционные и хроматографические процессы. 2014. Т. 14. № 2. С. 275.
Yu B., Chi M., Han Y., Cong H., Tang J., Peng Q. Self-assembled and covalently linked capillary coating of diazoresin and cyclodextrin-derived dendrimer for analysis of proteins by capillary electrophoresis // Talanta. 2016. V. 152. P. 76.
Boonyakong C., Tucker S.A. Capillary electrophoresis using core-based hyperbranched polyethyleneimine (chpei) static-coated capillaries // J. Sep. Sci. 2009. V. 32. P. 3489.
Liu C.-Y., Ho Y.-W., Pai Y.-F. Preparation and evaluation of an imidazole-coated capillary column for the electrophoretic separation of aromatic acids // J. Chromatogr. A. 2000. V. 897. P. 383.
Qin W., Fong S., Li Y. Determination of ammonium and metal ions by capillary electrophoresis–potential gradient detection using ionic liquid as background electrolyte and covalent coating reagent // J. Chromatogr. A. 2004. V. 1048. P. 253.
Колобова Е.А., Карцова Л.А., Бессонова Е.А., Крав-ченко А.В. On-line концентрирование биогенных аминов методом капиллярного электрофореза с использованием синтезированных ковалентных покрытий на основе ионных жидкостей // Аналитика и контроль. 2017. Т. 21. № 1. С. 57.
Li H., Eddaoudi M., O’keeffe M., Yaghi O.M., Design and synthesis of an exceptionally stable and highly porous metal-organic framework // Nature. 1999. V. 402. P. 276.
Ferey G., Mellot-Draznieks C., Serre C., Millange F. Crystallized frameworks with giant pores: are there limits to the possible? // Acc. Chem. Res. 2005. V. 38. P. 217.
Li L.M., Yang F., Wang H.F., Yan X.P. Metal-organic framework polymethylmethacrylate composites for open-tubular capillary electrochromatography // J. Chromatogr. A. 2013. V. 1316. P. 97.
Xu Y., Xu L., Qi S, Dong Y., Rahman Z.U., Chen H., Chen X. In situ synthesis of MIL-100(Fe) in the capillary column for capillary electrochromatographic separation of small organic molecules // Anal. Chem. 2013. V. 85. P. 11369.
Pan C., Wang W., Zhang H., Xu L., Chen X. Simultaneous separation of neutral and cationic analytes by one dimensional open tubular capillary electrochromatography using zeolitic imidazolate framework-8 as stationary phase // J. Chromatogr. A. 2017. V. 1484. P. 98.
Bao T., Tang P., Mao Z., Chen Z. An immobilized carboxyl containing metal-organic framework-5 stationary phase for open-tubular capillary electrochromatography // Talanta. 2016. V. 154. P. 360.
Bao T., Zhang J., Zhang W., Chen Z. Growth of metal–organic framework HKUST-1 in capillary using liquid-phase epitaxy for open-tubular capillary electrochromatography and capillary liquid chromatography // J. Chromatogr. A. 2015. V. 1381. P. 239.
Huang H.-Y., Lin C.-L., Wu C.-Y., Cheng Y.-J., Lin C.-H. Metal organic framework–organic polymer monolith stationary phases for capillary electrochromatography and nano-liquid chromatography // Anal. Chim. Acta. 2013. V. 779. P. 96.
Fei Z.-X., Zhang M., Zhang J.-H., Yuan L.-M. Chiral metal – organic framework used as stationary phases for capillary electrochromatography // Anal. Chim. Acta. 2014. V. 830. P. 49.
Yu L.-Q., Yang C.-X., Yan X.-P. Room temperature fabrication of post-modified zeolitic imidazolate framework-90 as stationary phase for open-tubular capillary electrochromatography // J. Chromatogr. A. 2014. V. 1343. P. 188.
Дзема Д.В., Карцова Л.А., Поликарпова Д.А. Применение высокоосновного наноионита в капиллярном электрофорезе для разделения и концентрирования неорганических анионов // Аналитика и контроль. 2017. Т. 21. № 1. С. 41.
Takeda Y., Hayashi Y., Utamura N., Takamoto C., Kinoshita M., Yamamoto S., Hayakawa T., Suzuki S. Capillary electrochromatography using monoamine- and triamine-bonded silica nanoparticles as pseudostationary phases // J. Chromatogr. A. 2016. V. 1427. P. 170.
Tran L.N., Dixit S., Park J.H. Enantioseparation of basic chiral compounds on a clindamycin phosphate-silica/zirconia hybrid monolith by capillary electrochromatography // J. Chromatogr. A. 2014. V. 1356. P. 289.
Guihen E., Glennon J.D. Nanoparticles in Separation Science—Recent Developments // Anal. Lett. 2003. V. 36. P. 3309.
Guo Y., Xu F., Meng L., Tang W., Xia Y., Wu Y., Zhang S. Preparation and application of trimethylamine amination polychloromethyl styrene nanolatex coated capillary column for the determination of bromate by field-amplified sample stacking open-tubular capillary electrochromatography // Electrophoresis. 2013. V. 34. P. 1312.
Li M., Tarawally M., Liu X., Liu X., Guo L., Yang L., Wang G. Application of cyclodextrin-modified gold nanoparticles in enantioselective monolith capillary electrochromatography // Talanta. 2013. V. 109. P. 1.
Zhu Y., Zhang L., Qian J., Zhang W. The characteristics of open-tubular capillary electrochromatography columns with series/mixed stationary phases constructed with magnetic nanoparticle coating // Talanta. 2013. V. 104. P. 173.
Wang X.-N., Liang R.-P., Meng X.-Y., Qiu J.-D. One-step synthesis of mussel-inspired molecularly imprinted magneticpolymer as stationary phase for chip-based open tubular capillary electrochromatography enantioseparation // J. Chromatogr. A. 2014. V. 1362. P. 301.
Qu Q., Liub Y., Shi W., Yan C., Tang X. Tunable thick porous silica coating fabricatedby multilayer-by-multilayer bonding of silica nanoparticles for open-tubular capillary chromatographic separation // J. Chromatogr. A. 2015. V. 1399. P. 25.
Liu X., Liu X., Li M., Guo L., Yang L. Application of graphene as the stationary phase for open-tubular capillary electrochromatography // J. Chromatogr. A. 2013. V. 1277. P. 93.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


