Журнал аналитической химии, 2019, T. 74, № 8, стр. 574-579
Применение кремнезема с иммобилизованной 2-нитрозо-1-нафтол-4-сульфокислотой для сорбционно-фотометрического определения палладия
С. Л. Дидух-Шадрина a, *, В. Н. Лосев a, Н. В. Мазняк a, А. К. Трофимчук b
a Научно-исследовательский инженерный центр “Кристалл” Сибирского федерального университета
660041 Красноярск, просп. Свободный, 79, Россия
b Киевский национальный университет им. Тараса Шевченко, химический факультет
01033 Киев, ул. Владимирская, 64, Украина
* E-mail: semdid@mail.ru
Поступила в редакцию 03.04.2018
После доработки 07.06.2018
Принята к публикации 21.02.2019
Аннотация
Для концентрирования и фотометрического определения палладия(II) в фазе сорбента предложен кремнезем, модифицированный 2-нитрозо-1-нафтол-4-сульфокислотой (ННС), количественно извлекающий палладий(II) из растворов в диапазоне рН 1–8. При сорбции палладия(II) из растворов с рН 1–3 на поверхности сорбента образуются комплексные соединения стехиометрии Pd : ННС = 1 : 2, имеющие интенсивную сиреневую окраску и максимум в спектре диффузного отражения при 550 нм. Разработана методика сорбционно-фотометрического определения палладия в варианте спектроскопии диффузного отражения с пределом обнаружения 0.03 мкг на 0.1 г сорбента. Диапазон определяемых концентраций составляет 0.1–10 мкг/0.1 г. Методика опробована при определении палладия в сточных водах и водной вытяжке из почвы.
Благодаря своим химическим и физическим характеристикам (каталитические функции, электропроводность, химическая стойкость к коррозии) палладий(II) является одним из наиболее широко применяемых металлов платиновой группы в различных областях промышленности: нефтяной, стоматологической, фармацевтической, автомобильной, ювелирной и др. [1]. В результате активного использования палладий(II) попадает в окружающую среду вместе со сточными водами предприятий, с выхлопными газами автомобилей из-за износа автомобильных катализаторов. В окружающей среде палладий(II) взаимодействует с органическими веществами, например, гуминовыми кислотами, с образованием устойчивых комплексов [2]. С одной стороны, степень загрязнения окружающей среды палладием(II) значительно ниже по сравнению, например, с Cd, Hg, As и Pb. С другой стороны, в связи с накоплением в окружающей среде палладий(II) и его соединения в перспективе могут повлиять на здоровье человека, млекопитающих, рыб и развитие растений [3], что обусловливает необходимость разработки простых и высокочувствительных методик его определения.
Для определения палладия(II) в техногенных и природных объектах используют различные методы анализа [4, 5], однако сложность состава образцов ограничивает чувствительность используемых методов за счет матричных влияний. Для их устранения и повышения чувствительности определения палладия(II) применяют его предварительное экстракционное [6–9] или сорбционное концентрирование [10–15]. Комбинирование сорбционного концентрирования с последующим спектрофотометрическим определением палладия(II) непосредственно в фазе сорбента характеризуется простотой и экспрессностью [16]. В ряде работ [17–20] для фотометрического определения палладия(II) предложено использование его окрашенных комплексов с нитрозонафтолами и их сульфопроизводными. Сульфопроизводные нитрозонафтолов хорошо растворимы в воде и позволяют определять палладий(II) в водных растворах без предварительного экстрагирования [18, 19].
Нами предложено использование для сорбционно-фотометрического определения палладия(II) кремнезема с иммобилизованной 2-нитрозо-1-нафтол-4-сульфокислотой (нитрозо-Н-соль). Данный реагент прочно и эффективно закрепляется на поверхности аминированного кремнезема и достаточно устойчив к воздействию солевых сред [21], что позволит использовать его для определения палладия(II) в сточных водах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Раствор палладия(II) с концентрацией 1 г/л готовили растворением навески препарата H2[PdCl4] в 1 М HCl. Растворы палладия(II) с меньшей концентрацией готовили разбавлением исходного раствора дистиллированной водой в день проведения эксперимента. Исходный 5 × × 10–4 М раствор натриевой соли 2-нитрозо-1-нафтол-4-сульфокислоты готовили растворением навески препарата фирмы “Aldrich”. Для создания необходимого значения рН использовали НСl, раствор NaOH и ацетатный буферный раствор с рН 4.0–6.5. В качестве основы для синтеза сорбента использовали кремнезем марки Силохром С-120 (фракция 0.1–0.2 мм, удельная поверхность 120 м2/г, средний диаметр пор ~45 нм). Раствор (5%-ный) полигексаметиленгуанидина гидрохлорида (ПГМГ) готовили растворением навески препарата БИОПАГ-Д (Институт эколого-технологических проблем, Москва) в деионированной воде.
Аппаратура. Спектры диффузного отражения (СДО) в области 380–720 нм регистрировали на спектрофотоколориметре Пульсар (Химавтоматика, Россия). Спектры диффузного отражения приведены в координатах: функция Гуревича–Кубелки–Мунка F(R) = (1 – R)2/2R – длина волны, нм (здесь R – коэффициент диффузного отражения). Содержание палладия в растворах до и после сорбции определяли методом атомно-абсорбционной спектрометрии (ААС) на спектрометре Analyst-800 (Perkin-Elmer, США) с пламенным атомизатором (ацетилен–воздух) при длине волны 340.4 нм, ширине щели 0.2 нм. Для контроля рН растворов использовали иономер SevenЕasy S20 (Mettler-Toledo, Испания) с комбинированным электродом InLabExpertPro.
Методика эксперимента. Сорбент SiO2–ПГМГ–ННС синтезировали последовательной обработкой поверхности кремнезема ПГМГ и ННС по методике [21]. Данный способ синтеза позволяет получать сорбент SiO2–ПГМГ–ННС с любой контролируемой поверхностной концентрацией ННС вплоть до максимальной – 88 мкмоль на 1 г сорбента. В процессе синтеза сорбент приобретает желтую окраску, характерную для реагента.
При изучении сорбции палладия(II) в статическом режиме в градуированную пробирку с притертой пробкой емк. 20 мл вводили 1 мл раствора палладия(II) с концентрацией 5 мкг/мл, добавляли раствор NaOH и/или ацетатный буферный раствор для создания необходимого значения рН, дистиллированную воду до 10 мл. Вносили 0.1 г сорбента SiO2–ПГМГ–ННС с поверхностной концентрацией ННС 60 мкмоль/г и перемешивали в течение 1–20 мин. Сорбент отделяли от раствора декантацией, переносили во фторопластовую кювету, убирали излишки воды фильтровальной бумагой и регистрировали коэффициент диффузного отражения (R) в диапазоне 380–720 нм. Концентрацию палладия в растворе до и после сорбции определяли методом ААС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Степень извлечения палладия(II) сорбентом SiO2–ПГМГ–ННС в диапазоне рН 1–8 составляет 96–99% (рис. 1). Время установления сорбционного равновесия при сорбции металла сорбентом SiO2–ПГМГ–ННС при рН 1 не превышает 5 мин, при рН 5 – 3 мин.
Рис. 1.
Зависимость степени извлечения Pd(II) на SiO2–ПГМГ–ННС от рН: mсорб = 0.1 г, сPd(II) = = 0.5 мкг/мл, Vр-ра = 10 мл.

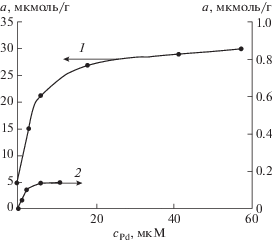
Палладий(II) в растворах хлороводородной кислоты при рН 1 присутствует в виде отрицательно заряженных хлоридных и аквахлоридных комплексов: [PdCl4]2– и [Pd(H2O)Cl3]– [22], которые способны извлекаться на сорбенте SiO2–ПГМГ по анионообменному механизму. Сорбционные емкости сорбентов SiO2–ПГМГ и SiO2–ПГМГ–ННС по палладию(II), определенные по горизонтальным участкам изотерм сорбции при рН 1, составили 0.14 и 30 мкмоль/г соответственно (рис. 2). Большая сорбционная емкость сорбента SiO2–ПГМГ–ННС по палладию(II) свидетельствует о его преимущественном извлечении за счет взаимодействия с ННС, закрепленной на поверхности кремнезема. При максимальной степени заполнения поверхности сорбента SiO2–ПГМГ реагентом не остается свободных аминогрупп ПГМГ, способных к взаимодействию с хлоридными и аквахлоридными комплексами палладия(II).
При определении состава комплекса палладия(II) и константы устойчивости поверхностного комплекса Pd(II) с ННС применен метод сдвига равновесия в варианте спектроскопии диффузного отражения. Концентрация палладия(II) в растворе остается постоянной, а переменной является поверхностная концентрация реагента – ННС. Соотношение Pd(II) : ННС и логарифм константы устойчивости (lg β) определяли по графику зависимости lg (∆F(R)i/(∆F(R)max – ∆F(R)i))–lg [ННС]s (рис. 3), где ∆F(R)max – разность функций F(R) максимального значения и контрольного опыта, ∆F(R)i – разность между значениями F(R) i-го и контрольного опытов, а [ННС]s – равновесная поверхностная концентрация реагента. Исходя из уравнения lg (∆F(R)i/(∆F(R)max – ∆F(R)i)) = lg βm/V + + lg[ННС]s, значение lg βm/V численно равно отрезку, отсекаемому прямой на оси ординат. Поскольку отношение m/V равно 10–2, константа устойчивости поверхностного комплекса палладия(II) с ННС lg β = 22.55 при рН 1 и lg β = 24.57 при рН 5. Стехиометрия поверхностного комплекса Pd(II) : ННС = 1 : 2 и не зависит от рН раствора.
Рис. 3.
Метод сдвига равновесия для Pd(II) на поверхности SiO2–ПГМГ–ННС: pH 1 (а), 5 (б); mсорб = 0.1 г; сPd(II) = = 0.2 мкг/мл; Vр-ра = 10 мл.

Спектроскопические характеристики комплексов палладия(II), образующихся на поверхности сорбента SiO2–ПГМГ–ННС, исследовали при поверхностной концентрации ННС 2 мкмоль/г, поскольку при большей поверхностной концентрации реагента сорбенты имеют интенсивную желтую окраску.
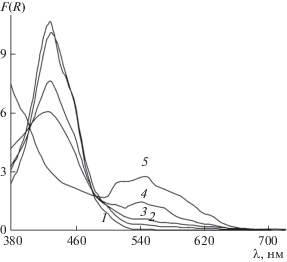
При сорбции палладия(II) при рН 1 поверхность сорбента SiO2–ПГМГ–ННС, первоначально окрашенная в желтый цвет, обесцвечивается, а затем постепенно окрашивается в фиолетовый цвет. Данный эффект связан с десорбцией ННС с поверхности сорбента, образованием в растворе комплекса [Pd(ННС)2]2–, который сорбируется на положительно заряженной поверхности SiO2–ПГМГ. При увеличении рН растворов палладия(II) до рН 2–3 наблюдается снижение интенсивности фиолетовой окраски. При рН ≥ 4 сорбент в процессе сорбции окрашивается в коричневый цвет. Максимальная интенсивность коричневой окраски сохраняется в диапазоне рН 4–7, совпадающей с областью количественного извлечения ННС сорбентом SiO2–ПГМГ [21]. Спектры диффузного отражения поверхностных комплексов палладия(II) с ННС при различных значениях рН приведены на рис. 4. При экстракции комплекса палладия(II) с 2-нитрозо-1-нафтолом в толуоле наблюдали аналогичные цвета экстрактов от фиолетового до красно-коричневого при различных значениях рН растворов [20].
Рис. 4.
Спектры диффузного отражения поверхностного комплекса Pd(II) на SiO2–ПГМГ–ННС: mсорб = 0.1 г; сPd(II) = 0.2 мкг/мл; Vр-ра = 10 мл; рН 1 (1), 2 (2), 3 (3), 4 (4), 5 (5), 6 (6), 7 (7), 8 (8).

Спектры диффузного отражения поверхностных комплексов палладия(II), полученных при рН 1, представляют собой широкую полосу с максимумом при 550 нм (рис. 4). С увеличением содержания палладия(II) при рН 1 на поверхности SiO2–ПГМГ–ННС пропорционально возрастает интенсивность окраски сорбента без изменения положения максимума СДО (рис. 5).
Рис. 5.
Спектры диффузного отражения поверхностного комплекса Pd(II) на SiO2–ПГМГ–ННС при рН 1: mсорб = 0.1 г; сPd(II), мкг/0.1 г сорбента: 0 (1), 1 (2), 2 (3), 5 (4), 10 (5).

При значениях рН ≥ 4 в CДО сорбентов наблюдается широкая полоса с интенсивным максимумом при 440 нм, соответствующая адсорбированной ННС, и малоинтенсивная полоса с максимумом при 540 нм, соответствующая поглощению поверхностного комплекса палладия(II) с ННС. При увеличении содержания палладия на поверхности сорбента в СДО снижается интенсивность максимума при 440 нм, что связано с координацией ННС в комплекс с палладием, увеличивается интенсивность полосы с максимумом при 540 нм (рис. 6). При содержании палладия(II) 10 мкг на 0.1 г сорбента исчезает максимум, соответстующий свободной ННС, что связано с ее полной координацией палладием и образованием поверхностного комплекса [Pd(ННС)2]2–.
Рис. 6.
Спектры диффузного отражения поверхностного комплекса Pd(II) на SiO2–ПГМГ–ННС при рН 5: mсорб = 0.1 г; сPd(II), мкг/0.1 г сорбента: 0 (1), 1 (2), 2 (3), 5 (4), 10 (5).
Время развития окраски поверхностных комплексов палладия соответствует времени установления сорбционного равновесия и составляет 3 мин при рН 5 и 5 мин при рН 1.
Сорбционно-фотометрическое определение палладия. Поскольку ННС при рН > 4 образует окрашенные комплексы с рядом цветных и тяжелых металлов [21, 23–25], для разработки методики сорбционно-фотометрического определения палладия использовали образование интенсивно окрашенных поверхностных комплексов при рН 1, при котором на поверхности сорбента отсутствует свободная ННС, а контрастность реакции комплексообразования палладия выше, чем при рН 5.
Построение градуировочной зависимости. В ряд градуированных пробирок с притертыми пробками емк. 20 мл вводят от 0.1 до 15 мкг палладия(II) в виде раствора в 1 М HCl и дистиллированную воду до общего объема 10 мл. Вносят 0.1 г сорбента SiO2–ПГМГ–ННС с концентрацией реагента 2 мкмоль/г сорбента, пробирки закрывают пробками и перемешивают 5 мин. Сорбенты отделяют от раствора декантацией, переносят во фторопластовую кювету, убирают излишки воды фильтровальной бумагой и измеряют коэффициент диффузного отражения при 550 нм. Предел обнаружения палладия, рассчитанный по 3s-критерию, равен 0.03 мкг на 0.1 г сорбента. Линейность градуировочной зависимости сохраняется в диапазоне концентраций 0.1–10 мкг палладия(II) на 0.1 г сорбента и описывается уравнением ∆F(R) = = (0.39 ± 0.02)с, где с – концентрация палладия на поверхности сорбента.
Избирательность сорбционно-фотометрического определения палладия изучали в бинарных системах, содержащих 0.05 мкг/мл палладия(II) и от 0.05 до 50 мкг/мл ионов других металлов. Определению 0.5 мкг палладия(II) на 0.1 г сорбента при рН 1 не мешают (в кратных количествах): Na(I), K(I), Ca(II), Mg(II), Sr(II), Al(III) (103), Pb(II), Cd(II), Mn(II), Zn(II), Cr(III) (102), Ni(II), Fe(III) (50), Fe(II), Cu(II) (25), Co(II) (10).
Разработанная методика использована при определении палладия в сточных водах палладирования печатных плат и в водном экстракте почвы.
Методика определения палладия в сточных водах участка палладирования печатных плат и в водном экстракте почвы. Водную вытяжку почвы получали по методике [26]. В градуированную пробирку с притертой пробкой вводят 5 мл сточной воды или водного экстракта почвы, добавляют 1 мл 1 М HCl, воду до общего объема 10 мл. Вносят 0.1 г сорбента и перемешивают 5 мин. Сорбент отделяют от раствора декантацией, переносят во фторопластовую кювету, убирают излишки воды фильтровальной бумагой и измеряют коэффициент диффузного отражения при 550 нм. Содержание палладия находят по градуировочному графику.
Результаты определения палладия(II) приведены в табл. 1. Правильность полученных результатов подтверждена методом введено–найдено.
Таблица 1.
Результаты сорбционно-фотометрического определения палладия(II) в сточных водах участка палладирования печатных плат и в водном экстракте почвы с использованием сорбента SiO2–ПГМГ–ННС (mсорб = 0.1 г, Vпробы = 5 мл, n = 5, Р = 0.95)
| Введено, мкг | Найдено, мкг | sr |
|---|---|---|
| Сточная вода | ||
| 0 | 0.62 ± 0.05 | 0.07 |
| 1 | 1.5 ± 0.1 | 0.06 |
| 2 | 2.6 ± 0.2 | 0.06 |
| Водный экстракт почвы | ||
| 0 | – | |
| 0.5 | 0.51 ± 0.04 | 0.07 |
| 1.0 | 1.02 ± 0.08 | 0.07 |
Работа выполнена при финансовой поддержке Министерства образования и науки Российской федерации в рамках гранта 4.6343.2017, выделенного Сибирскому федеральному университету.
Список литературы
Nordberg G.F., Flower B., Nordberg M., Friberg L. Handbook on the Toxicology of Metals, 3d ed. Academic Press, 2007. 975 p.
Moldovan M. Origin and fate of platinum group elements in the environment // Anal. Bioanal. Chem. 2007. V. 388. P. 537.
Gagnon Z., Newkirk C., Hicks S. Impact of platinum group metals on the environment: a toxicological, genotoxic and analytical chemistry // J. Environ. Sci. Health. Part A. 2006. V. 41. № 3. P. 397.
Rao C., Reddi G. Platinum group metals (PGM) occurrence, use and recent trends in their determination // Trends. Anal. Chem. 2000. V. 19. № 9. P. 565.
Machado R.C., Amaral C., Schiavo D., Nóbrega J.A., Nogueira A.R. Complex samples and spectral interferences in ICP-MS: Evaluation of tandem mass spectrometry for interference-free determination of cadmium, tin and platinum group elements // Microchem. J. 2017. V. 130. P. 271.
Mohammadi S.Z., Afzali D., Taher M.A., Baghelani Y. Determination of trace amounts of palladium by flame atomic absorption spectrometry after ligand less dispersive liquid–liquid microextraction // Microchim. Acta. 2010. V. 168. № 1. P. 123.
Ruhela R., Sharma J.N., Tomar B.S., Hubli R.C., Suri A.K. Extractive spectrophotometric determination of palladium with N,N,N,N-tetra(2-ethylhexyl)-thiodiglycolamide T(2EH)TDGA // Talanta. 2011. V. 85. P. 1217.
Amin A.S. Utility of cloud-point preconcentration and spectrophotometry for determination of trace amounts of palladium(II) and their analytical applications // Arabian J. Chem. 2016. V. 9. P. S326.
Mohammadi S., Afzali D., Pourtalebi D. Flame atomic absorption spectrometric determination of trace amounts of palladium, gold and nickel after cloud point extraction // J. Analyt. Chem. 2011. V. 66. № 7. P. 620.
Shuo Lin, Wei Wei, Xiaohui Wu, Tao Zhou, Juan Mao, Yeoung-Sang Yun. Selective recovery of Pd(II) from extremely acidic solution using ion-imprinted chitosan fiber: Adsorption performance and mechanisms // J. Hazard. Mater. 2015. V. 299. P. 10.
Awual Md.R., Khaleque Md.A., Ratna Y., Znad H. Simultaneous ultra-trace palladium(II) detection and recovery from waste water using new class meso-adsorbent // J.I.E.C. 2015. V. 21. P. 405.
Shaheen H.A., Marwani H.M., Soliman E.M. Selective solid phase extraction and determination of trace Pd(II) using multi-walled carbon nanotubes modified with 8-aminoquinoline // J. Mol. Liquids. 2017. V. 232. P. 139.
Mladenova E., Dakova I., Karadjova I., Karadjov M. Column solid phase extraction and determination of ultra-trace Au, Pd and Pt in environmental and geological samples // Microchem. J. 2012. V. 101. P. 59.
Woińska S., Godlewska-Żyłkiewicz B. Determination of platinum and palladium in road dust after their separation on immobilized fungus by electro thermal atomic absorption spectrometry // Spectrochim. Acta. Part B. 2011. V. 66. P. 522.
Bilba D., Paduraru C., Tofan L. Determination of trace amounts of palladium(II) by solid-phase spectrophotometry // Microchim. Acta. 2004. V. 144. № 1. P. 97.
Золотов Ю.А., Цизин Г.И., Дмитриенко С.Г., Моросанова Е.И. Сорбционное концентрирование микрокомпонентов из растворов. М.: Наука, 2007. 320 с.
Марченко З., Бальцежак М. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе: пер. с польского А.В. Гармаша. М.: БИНОМ, 2007. 711 с.
Siren H., Riekkola M.-L. Separation and determination of metals as complexes of 1-nitroso-2-naphthol-6-sulphonic and 2-nitroso-l-naphthol-6-sulphonic acids I: Ion-pair extraction and spectrophotometric method // Mikrochim. Acta [Wien]. 1986. V. III. P. 159.
Иванов В.М., Самарина Т.О., Фигуровская В.Н. Оптические и цветометрические характеристики комплекса палладия(II) с 1-нитрозо-2-нафтол-3,6-дисульфокислотой // Вестн. Моск. ун-та. Сер. 2. Химия. 2010. Т. 51. № 2. С. 110.
Cheng K.L. Spectrophotometric determination of palladium with 2-nitroso-1-naphthol // Anal. Chem. 1954. V. 26. P. 1894.
Дидух С.Л., Лосев В.Н., Мухина А.Н., Максимов Н.Г., Трофимчук А.К. Сорбционно-фотометрическое определение железа с использованием кремнзема с функциональными группами нитрозо-Р-соли и нитрозо-Н-соли // Журн. анал. хим. 2017. Т. 72. № 1. С. 50. (Didukh S.L., Losev V.N., Mukhina A.N., Maksimov N.G., Trofimchuk A.K. Adsorption-photometric determination of iron using silica with nitroso-R salt and nitroso-N salt functional groups // J. Analyt. Chem. 2017. V. 72. № 1. P. 49.)
Буслаева Т.М., Симанова С.А. Состояние платиновых металлов в солянокислых и хлоридных водных растворах. Палладий, платина, родий, иридий // Коорд. химия. 1999. Т. 25. № 3. С. 165. (Buslaeva T.M., Simanova S.A. Platinum metals in aqueous hydrochloric and chloride solutions: palladium, platinum, rhodium and iridium // Russ. J. Coord. Chem. 1999. V. 25. № 3. P. 151.)
Taher M.A., Puri B.K. Column preconcentration of cobalt with the ion pair of 2-nitroso-1-naphthol-4-sulfonic acid tetradecyldimethylbenzylammoniumchloride supported on naphthalene using second-derivative spectrophotometry // Analyst. 1995. V. 120. № 5. P. 95.
Taher M.A., Dehzoei A.M., Puri B.K., Puri S. Derivative UV-visible spectrophotometric determination of nickel in alloys and biological samples after preconcentration with the ion pair of 2-nitroso-1-naphthol-4-sulfonic acid and tetradecyldimethylbenzylammonium chloride onto microcrystalline naphthalene or by a column method //Anal. Chim. Acta. 1998. V. 367. № 1–3. P. 55.
Motomizu Sh., Kuwabara M., Oshima M. Separation and determination of metal ions with 2-nitroso-1-naphthol-4-sulfonic acid by high-performance capillary electrophoresis // Bunseki Kagaku. 1994. V. 43. № 8. P. 621.
РД 52.18.286-91. Методические указания. Методика выполнения измерений массовой доли водорастворимых форм металлов (меди, свинца, цинка, никеля, кадмия, кобальта, хрома, марганца) в пробах почвы атомно-абсорбционным анализом. М.: Государственный комитет СССР по гидрометеорологии, 1991. 31 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии