Журнал аналитической химии, 2019, T. 74, № 8, стр. 606-612
Обоснование выбора производных трифторацетофенона для изготовления мембран сульфат- и карбонатселективных электродов
Ю. В. Матвейчук *
Белорусский государственный университет, химический факультет
220030 Минск, ул. Ленинградская, 14, Беларусь
* E-mail: Yu_Matveychuk@mail.ru
Поступила в редакцию 07.03.2018
После доработки 19.04.2018
Принята к публикации 13.02.2019
Аннотация
Методами УФ-спектрофотометрии и хроматографии исследовано распределение трифторацетофенона (ТФАФ) и его производных – п-метилтрифторацетофенона п-МТФАФ), 2,4-диметилтрифторацетофенона (ДМТФАФ), 2,4,6-триметилтрифторацетофенона (ТМТФАФ), гептилового эфира п‑трифторацетилбензойной кислоты (ГЭ п-ТФАБК) – в системе гексан–вода, которая упрощенно моделирует поливинилхлоридную мембрану ионселективных электродов. Перечисленные вещества используют в качестве нейтральных переносчиков (НП) в мембранах ионселективных электродов, обратимых к двухзарядным карбонат- и сульфат-ионам. Систематически исследована гидратация ТФАФ и ряда его производных. Установлено, что ТФАФ обладает повышенной растворимостью в воде (коэффициент распределения D = 415) по сравнению с п-МТФАФ, ДМТФАФ, ТМТФАФ и ГЭ п-ТФАБК (D в пределах 1360–2700), что не позволяет рекомендовать его в качестве НП для изготовления мембран электродов. Наиболее сильно гидратируется ГЭ п-ТФАБК в щелочной среде. Установлено, что п-МТФАФ и ГЭ п-ТФАБК образуют кристаллогидраты. Определены коэффициенты селективности карбонат- и сульфатселективных электродов для всех изученных НП; селективность электродов увеличивается в ряду: ТФАФ < п-МТФАФ < ДМТФАФ < ТМТФАФ < п-БТФАФ (п-бутилтрифторацетофенон) < ГЭ п-ТФАФ.
Ранее нами изучено [1–3] влияние стерической доступности обменного центра высших четвертичных аммониевых солей (ЧАС) на аналитические характеристики ионселективных электродов (ИСЭ). Однако природа не только ЧАС, но и сольватирующей добавки (нейтрального переносчика) существенно влияет на характеристики электродов, обратимых к сульфат-, карбонат-, селенат- и другим гидрофильным ионам.
Для изготовления мембран ИСЭ, обратимых к гидрофильным неорганическим и органическим анионам, главным образом для карбонатселективного электрода, в качестве НП широко используют производные ТФАФ. Введение в состав мембран НП приводит к существенному улучшению, прежде всего, селективности. Для изготовления мембран ${\text{С О }}_{3}^{{2 - }}$–СЭ используют следующие производные ТФАФ: гептиловый (или гексиловый) эфир 4-трифторацетилбензойной кислоты (ГЭ п-ТФАБК), п-бутилацетофенон, 4'-N-пропил-2,2,2-трифторацетофенон, 3-бром-4-гексил-5-нитротрифторацетофенон, 1,7-бис(4′-трифторацетофенил)-4-додецил-1,7-диоксо-2,6-диоксигептан, 1,2-бис(4-трифторацетилбензоилоксиметил)бензол, 2,7-диаза-1,8-бис(4'-трифторацетофенил)-2,7-ди(1"-гексил)-1,8-диоксооктан, N,N'-диоктил-3α,12α-бис(4-трифторацетилоксибензил)-5β-холан-24-амид и др. [4–8].
В качестве НП в мембранах ${\text{SO}}_{4}^{{2 - }}$–СЭ используют только ГЭ п-ТФАБК [1–3, 9].
Несмотря на достаточно большое число работ по использованию ТФАФ и его производных, систематические исследования влияния природы заместителя в молекуле ТФАФ на аналитические характеристики ИСЭ, например сульфат- и карбонатселективных электродов, практически отсутствуют. Некоторые попытки предприняты в работе [10], где на примере ацетат- и карбонатселективных электродов апробировали широкий круг производных ТФАФ.
В настоящей работе систематически исследовано влияние природы заместителей в ТФАФ на селективность ${\text{SO}}_{4}^{{2 - }}$–СЭ и ${\text{С О }}_{3}^{{2 - }}$–СЭ, а также методами УФ-спектрометрии и хромато-масс-спектрометрии определены коэффициенты распределения ТФАФ и его производных в системе гексан–вода.
Система гексан–вода в упрощенном виде моделирует поведение поливинилхлоридных (ПВХ) мембран, содержащих НП, при контакте с водой.
Изучение распределения производных ТФАФ позволяет получить не только количественные характеристики экстракции (коэффициенты распределения D), но и теоретически обосновать выбор НП для изготовления электродов (на примере сульфат- и карбонатселективных электродов). Сульфат- и карбонат-ионы присутствуют во всех водных объектах, что обусловливает актуальность поставленной задачи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и аппаратура. Использовали NaHCO3 ч. д. а., K2SO4 ч., аммиак водный х. ч., KCl ч. д. а., KNO3 ч. д. а., Н3РО4 ч.
В качестве ионообменника для изготовления мембран ИСЭ согласно методике [11] использовали иодид тринонилоктадециламмония (ТНОДА, 5 мас. %); в качестве полимерной матрицы – 33 мас. % ПВХ, в качестве пластификаторов мембран (42 мас. %) – 1-бромнафталин (1-БН) ч. д. а., о-нитрофенилдециловый эфир (о-НФДЭ); в качестве сольватирующих добавок (20 мас. %) – ГЭ п-ТФАБК, п-бутилтрифторацетофенон (п-БТФАФ, Sigma-Aldrich Selectophore), ТФАФ (Sigma-Aldrich), п-МТФАФ, ДМТФАФ, ТМТФАФ. Растворитель мембранной композиции – тетрагидрофуран (Fluka AG).
Потенциал исследуемой электрохимической ячейки измеряли с помощью иономера И-160.1МП при 22 ± 1°С. В качестве электрода сравнения использовали хлоридсеребряный электрод ЭВЛ-1М3.1, для определения рН – стеклянный электрод ЭСЛ-43-07СР.
Подготовка ионселективных электродов. После изготовления мембран ${\text{SO}}_{4}^{{2 - }}$–СЭ вымачивали в течение 2 сут в 0.1 М растворе Na2SO4. В качестве внутреннего раствора использовали смесь 0.01 М раствора Na2SO4 и 0.001 М раствора KCl. Для повышения воспроизводимости результатов и устранения мешающего влияния карбонатов во всех растворах поддерживали рН на уровне 3.2 ± ± 0.1 добавлением ортофосфорной кислоты.
После изготовления мембран ${\text{С О }}_{3}^{{2 - }}$–СЭ вымачивали в течение 1−2 сут в 0.1 М растворе NaHCO3. В качестве внутреннего раствора для всех ИСЭ использовали смесь 0.01 М раствора NaНСО3 и 0.001 М раствора KCl. В растворах NaHCO3 поддерживали рН на уровне 8.0 ± 0.1 добавлением разбавленного раствора аммиака. Выбранные значения рН при работе с ${\text{С О }}_{3}^{{2 - }}$–СЭ соответствуют мольной доле ${\text{Н С О }}_{3}^{ - }$-ионов 100%. Значение рН, равное 8.0 ± 0.1, поддерживали также в растворах мешающих ионов при изучении селективности ${\text{С О }}_{3}^{{2 - }}$–СЭ.
Для исключения влияния ОН–-ионов градуировку проводили по растворам NaHCO3 с более низкими значениями рН, чем в растворах карбонатов, согласно методике [8, 12]. По данным [8] оптимальный диапазон рН при работе с ${\text{С О }}_{3}^{{2 - }}$–СЭ составляет 8.4−8.8; при увеличении рН становится заметным мешающее влияние ОН–-ионов в случае ИСЭ, в состав мембран которых входят производные трифторацетофенона. Активность ${\text{С О }}_{3}^{{2 - }}$-ионов в растворах NaHCO3 рассчитывали по формуле [8]:
Для градуировки ИСЭ использовали метод двукратного разбавления. Активность, коэффициенты активности в растворах K2SO4 рассчитывали согласно теории Дебая–Хюккеля [13]. Коэффициенты потенциометрической селективности (${\text{lg}}K_{{i,j}}^{{{\text{Pot}}}}$) определяли методом отдельных растворов в варианте равных потенциалов; все остальные характеристики – в соответствии с рекомендациями [14].
Изучение экстракции ГЭ п-ТФАБК в системе гексан–вода хроматографическим методом. Готовили 0.01 М раствор ($c_{{{\text{и с х }}}}^{{{\text{о р г }}.{\text{ф }}}}$) ГЭ п-ТФАБК в гексане. Отбирали 5 мл раствора в делительную воронку и добавляли 50 мл воды. Содержимое воронки встряхивали в течение 1 мин и оставляли до полного расслаивания. Затем отбирали по 40 мл водной фазы и добавляли по 4 мл гексана с целью концентрирования в 10 раз перешедшего в водную фазу ГЭ п-ТФАБК. Коэффициент распределения D рассчитывали по формуле:
Изучение экстракции ГЭ п-ТФАБК, ТФАФ, п-МТФАФ, 2,4-ДМТФАФ, 2,4,6-ТМТФАФ в системе гексан–вода методом УФ-спектрофотометрии. Готовили 0.01 М растворы ($c_{{{\text{и с х }}}}^{{{\text{о р г }}.\,\,{\text{ф }}}}$) ТФАФ и его производных в гексане. Отбирали по 10 мл растворов в делительные воронки и добавляли по 50 мл воды. Содержимое воронок встряхивали в течение 1 мин и оставляли до полного расслаивания. Затем отбирали по 40 мл водной фазы и добавляли по 8 мл гексана с целью концентрирования в 5 раз перешедшего в водную фазу ТФАФ и его производных. Коэффициент распределения D рассчитывали по формуле:
Перешедшие в водную фазу ТФАФ и его производные реэкстрагировали гексаном с целью соблюдения одинаковых условий эксперимента, т.е. использования одного и того же растворителя. Оптическую плотность водной фазы рассчитывали по формуле: Aвод. ф = $A_{{{\text{р е э к с т р }}}}^{{{\text{г е к с а н }}}}$/5. Умножение на 100 необходимо, так как $c_{{{\text{и с х }}}}^{{{\text{о р г }}.\,\,{\text{ф }}}}$ составляла 0.01 М, а УФ-спектр регистрировали при концентрации ТФАФ и его производных 1 × 10−4 М (значение оптической плотности не должно превышать 1.5). Экстракцию проводили из 0.01 М гексановых растворов с целью увеличения чувствительности определений.
Изучение гидратации ГЭ п-ТФАБК, ТФАФ, п-МТФАФ, 2,4-ДМТФАФ, 2,4,6-ТМТФАФ методом УФ-спектрофотометрии. Необходимость данного исследования обусловлена тем, что ТФАФ и его производные образуют диольные формы, тогда как разработанные нами ИСЭ функционируют как в кислой (${\text{SО }}_{4}^{{2 - }}$–СЭ), так и в щелочной средах (${\text{С О }}_{3}^{{2 - }}$–СЭ). Изученные системы представлены в виде табл. 1.
Таблица 1.
Системы, изученные методом УФ-спектрофотометрии
| Система | Состав |
|---|---|
| Нейтральная среда | |
| 1 | А* + 25 мл Н2О |
| Кислая среда | |
| 2 | А + 0.5 мл 1 М H2SO4 + 22 мл Н2О |
| 3 | А + 2.5 мл 1 М H2SO4 + 20 мл Н2О |
| 4 | А + 22.5 мл 1 М H2SO4 |
| Щелочная среда | |
| 5 | А + 1 мл 1 М раствора NaOH + 21.5 мл Н2О |
| 6 | А + 2.5 мл 1 М раствора NaOH + 20 мл Н2О |
| 7 | А + 22.5 мл 1 М раствора NaOH |
Гидратацию изучали в мерных пробирках с пришлифованными пробками, для чего смешивали компоненты систем 1–7 и встряхивали в течение 1 мин. После расслаивания измеряли оптическую плотность водной фазы. УФ-спектры записывали на UV-спектрофотометре Solar PB 2201 в диапазоне от 220 до 400 нм (кювета толщиной 1 см).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение гидратации ГЭ п-ТФАБК, ТФАФ, п-МТФАФ, 2,4-ДМТФАФ, 2,4,6-ТМТФАФ методом УФ-спектрофотометрии. Известно [15], что гидратная форма ТФАФ и его производных имеет в УФ-спектре полосу поглощения с максимумом при 231 нм, негидратная форма – полосу при 261 нм. На рис. 1а представлены УФ-спектры водных фаз, полученных после экстракции ТФАФ из его гексанового раствора (щелочная среда). Видно, что диольная (гидратная) форма ТФАФ образуется при экстракции из его гексанового раствора достаточно концентрированным (1 М) раствором NaOH (плечо в области 265 нм указывает, видимо, на равновесие гидратной и негидратной форм ТФАФ). В нейтральной и кислой средах гидратация ТФАФ не наблюдается (рис. 1б).
Рис. 1.
УФ-спектры водных фаз, полученных после экстракции трифторацетофенона (ТФАФ) из его гексанового раствора: (а) – щелочная среда, (б) – нейтральная и кислая среды. Номера спектров соответствуют номерам систем в табл. 1.
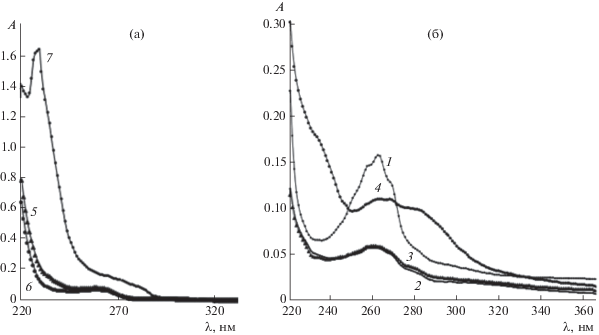
Гидратация п-МТФАФ, ДМТФАФ, ТМТФАФ протекает слабо, что, на наш взгляд, обусловлено стерическими препятствиями со стороны метильных групп сближению молекул воды и карбонильного атома углерода трифторацетильной группы, а также уменьшением кислотности карбонильного углерода. В спектрах ДМТФАФ не наблюдается полос ни при ~235 нм, ни при ~265 нм независимо от реакции среды; то же наблюдали для ТМТФАФ в нейтральной среде. В кислой и щелочной средах в спектрах ТМТФАФ имеются полосы поглощения при 260–270 нм, однако они очень широкие и значение оптической плотности не превышает 0.2 независимо от системы (табл. 1).
Гидратация заметно протекает для ГЭ п-ТФАБК, причем особенно сильно в щелочной среде (рис. 2, система 5). За время экстракции (30 мин) не обнаружено гидратной (диольной) формы, однако после длительного стояния МТФАФ (3–4 сут) и ГЭ п-ТФАБК (12–15 ч) под слоем воды можно заметить белые кристаллы (гидратные формы этих веществ).
На рис. 3, 4 представлены фрагменты ИК-спектров гидратной и для сравнения негидратной форм МТФАФ и ГЭ п-ТФАБК. В ИК-спектрах негидратных форм обоих веществ (рис. 3а и 4а) имеется интенсивная полоса около 1720 см–1, относящаяся к ν(С=О) карбонильной группы [16].
Рис. 4.
ИК-спектры гептилового эфира п-трифторацетилбензойной кислоты (ГЭ п-ТФАБК) (а) и его гидратной формы (б).

В ИК-спектрах гидратной формы ГЭ п-ТФАБК (рис. 4б) появляется высокоинтенсивная полоса около 1690 см–1 [16], относящаяся к сложноэфирной группе, и существенно уменьшается интенсивность полосы около 1720 см–1, что связано с превращением карбонильной группы в диольную группировку. Полосы при частоте более 3100 см–1 относятся к валентным колебаниям ν(ОН) [16]. В спектре гидратной формы п-МТФАФ (рис. 3б) также появляются полосы в области более 3100 см–1 и существенно уменьшается интенсивность полосы 1713 см–1.
Изучение экстракции в системе гексан–вода методом УФ-спектрофотометрии. Из табл. 2 видно, что ТФАФ обладает достаточно высокой растворимостью в воде, что затрудняет его применение в качестве НП в мембранах ИСЭ, обратимых к сульфат- и карбонат-ионам. Значения D для п-МТФАФ и ДМТФАФ близки. Значение D максимально для ТМТФАФ, видимо, из-за наличия в его молекуле трех метильных радикалов в бензольном кольце. Коэффициент распределения ГЭ п-ТФАБК, несмотря на наличие в нем в нем алкильного радикала С7, сопоставим с таковыми для п-МТФАФ и ДМТФАФ, что, видимо, обусловлено присутствием гидрофильной карбонильной группы и соответственно низкой степенью извлечения гексаном.
Таблица 2.
Коэффициенты распределения (D) трифторацетофенона и его производных в системе гексан–вода, полученные методом УФ-спектрофотометрии
| Вещество | Значение D (n = 4) |
|---|---|
| ТФАФ | 415 ± 25 |
| п-МТФАФ | 1490 ± 130 |
| ДМТФАФ | 1360 ± 90 |
| ТМТФАФ | 2700 ± 150 |
| ГЭ п-ТФАБК | 1420 ± 120 |
Ниже будет показано, что введение в состав мембран электродов ГЭ п-ТФАБК (по сравнению с остальными изученными НП) способствует значительному улучшению аналитических характеристик (селективности) карбонат- и сульфатселективных электродов. В связи с этим дополнительно изучили распределение ГЭ п-ТФАБК в системе гексан–вода хроматографическим методом. Получили D = 1760, что согласуется с данными УФ-спектрофотометрии.
Кроме того, получили хроматограммы всех изучаемых НП. Оказалось, что все используемые нейтральные переносчики характеризуются высоким содержанием основного вещества 90–99.5%. Так, ГЭ п-ТФАБК содержит 99.36% основного вещества.
Влияние природы производных ТФАФ на селективность карбонат- и сульфатселективных электродов. Установлено, что ЧАС со стерически доступным обменным центром, например хлорид 3,4,5-трисдодецилоксибензил(оксиэтил)4триметиламмония, обеспечивает существенное улучшение аналитических характеристик ИСЭ, обратимых к небольшим по размеру двухзарядным анионам, тогда как ЧАС со стерически затрудненным обменным центром (ТНОДА и др.), наоборот, можно использовать для изготовления ИСЭ, обратимых к большим по размеру комплексным анионам [1–3].
Введение в состав мембран НП в наибольшей степени влияет на селективность тех ИСЭ, в состав мембран которых входят стерически затрудненные ЧАС. В связи с этим в данной работе изготавливали ИСЭ на основе ТНОДА.
Выше указано, что основной предмет исследования в данной работе – влияние природы заместителя в ТФАФ на селективность карбонат- и сульфатселективных электродов. В табл. 3 представлены значения ${\text{lg}}K_{{i,j}}^{{{\text{Pot}}}}$ для карбонат- и сульфатселективных электродов (ЧАС – 5 мас. % ТНОДА, пластификатор – 42 мас. % 1-БН для ${\text{SO}}_{4}^{{2 - }}$–СЭ или о-НФДЭ для ${\text{С О }}_{3}^{{2 - }}$–СЭ, 20 мас. % НП, 33 мас. % ПВХ). Для сравнения приведены значения ${\text{lg}}K_{{i,j}}^{{{\text{Pot}}}}$ для карбонат- и сульфатселективных электродов, не содержащих в составе мембран НП (ЧАС – 5 мас. % ТНОДА, пластификатор – 62 мас. % 1-БН для ${\text{SO}}_{4}^{{2 - }}$–СЭ или о-НФДЭ для ${\text{С О }}_{3}^{{2 - }}$–СЭ, 33 мас. % ПВХ). Видно, что независимо от НП эффект от его введения в мембрану значителен. В ряду ТФАФ < п-МТФАФ < ДМТФАФ < < ТМТФАФ < п-БТФАФ < ГЭ п-ТФАБК увеличивается селективность карбонат- и сульфатселективных электродов, т.е. для ГЭ п-ТФАБК, который содержит сложноэфирную группу, эффект повышения селективности составляет 6.3 порядка в случае ${\text{С О }}_{3}^{{2 - }}$–СЭ. Сложноэфирная группа является акцептором электронной плотности, что дополнительно увеличивает положительный заряд на карбонильном атоме углерода трифторацетильной группы, что, в свою очередь, приводит к значительному усилению сольватирующих свойств данного НП.
Таблица 3.
Значения ${\text{lg}}K_{{i,j}}^{{{\text{Pot}}}}$ для карбонат- и сульфатселективных электродов*
| Нейтральный переносчик | $\lg K_{{{\text{SO}}_{4}^{{2 - }},j}}^{{{\text{Pot}}}}$ | $\lg K_{{{\text{CO}}_{3}^{{2 - }},j}}^{{{\text{Pot}}}}$ | ||
|---|---|---|---|---|
| Cl– | ${\text{NO}}_{3}^{ - }$ | Cl– | ${\text{NO}}_{3}^{ - }$ | |
| ТФАФ** | 1.1 | 3.7 | –0.6 | 3.3 |
| п-МТФАФ | 0.9 | 3.4 | –1.1 | 2.6 |
| ДМТФАФ | 0.8 | 3.2 | –1.3 | 2.4 |
| ТМТФАФ | 0.65 | 2.8 | –1.7 | 2.0 |
| п-БТФАФ | 0.3 | 2.5 | – | – |
| ГЭ п-ТФАБК | –1.1 | 1.6 | –3.2 | 1.0 |
| Без НП | 2.8 | 6.0 | 3.4 | 7.3 |
Кроме того, по данным [17] замещение в о- и п-положениях приводит к повышению электрофильности карбонильного атома углерода и эффективности добавки.
В работе [1] приведены результаты исследования, посвященного установлению механизма сольватации кислородсодержащих анионов ГЭ п-ТФАБК (как наиболее сильной сольватирующей добавки из изученных производных ТФАФ). Мы считаем, что анионы взаимодействуют с ГЭ п-ТФАБК по механизму ион-дипольного взаимодействия.
* * *
Таким образом, систематическое исследование гидратации ТФАФ и ряда его производных показало, что гидратация п-МТФАФ, ДМТФАФ, ТМТФАФ протекает слабо, что обусловлено стерическими препятствиями со стороны метильных радикалов. Гидратация протекает в заметной степени для ГЭ п-ТФАБК в щелочной среде Установлено, что п-МТФАФ и ГЭ п-ТФАБК образуют кристаллические гидраты при выдерживании под слоем воды. ТФАФ облает повышенной растворимостью в воде (D = 415) по сравнению с п-МТФАФ, ДМТФАФ, ТМТФАФ и ГЭ п-ТФАБК (D в пределах 1360–2700), что не позволяет рекомендовать его в качестве НП для изготовления мембран карбонат- и сульфатселективных электродов. Обоснован выбор НП из числа производных ТФАФ и получен ряд, соответствующий улучшению селективности карбонат- и сульфатселективных электродов: ТФАФ < п-МТФАФ < ДМТФАФ < < ТМТФАФ < п-БТФАФ < ГЭ п-ТФАБК.
Список литературы
Matveichuk Yu., Akayeu Ya., Rakhman’ko E. Hydration of p-trifluoroacetyl benzoic acid heptyl ester: how it affects analytical characteristics of sulphate selective electrodes based on higher quaternary ammonium salts // Chem. Papers. 2018. V. 72. № 2. P. 509.
Matveichuk Yu.V., Rakhman’ko E.M. Influence of the QAS nature and size of a doubly charged hydrophilic inorganic ions on the analytical characteristics of S4O$_{6}^{{2 - }}$, SO$_{4}^{{2 - }}$, SO$_{3}^{{2 - }}$, S2−, S2O$_{3}^{{2 - }}$ selective electrodes // Anal. Chem. Lett. 2017. V. 7. № 5. P. 647.
Matveichuk Yu., Rakhman’ko E., Akayeu Ya., Stanishevskii D. Ion-selective electrodes based on long-chain quaternary ammonium salts with enhanced steric accessibility, and their application for determination of hydrophilic double- charged inorganic anion // Chem. Papers. 2018. V. 72. № 3. P. 731.
Antonisse M.M.G., Reinhoudt D.N. Potentiometric anion selective sensors // Electroanalysis. 1999. V. 11. P. 1035.
Makarychev-Mikhailov S., Legin A., Mortensen J., Levitchev S., Vlasov Yu. Potentiometric and theoretical studies of the carbonate sensors based on 3-bromo-4-hexyl-5-nitrotrifluoroacetophenone // Analyst. 2004. V. 129. № 3. P. 213.
Shim J.H., Jeong I.S., Lee M.H., Hong H.P., On J.H., Kim K.S., Kim H.S., Kim B.H., Cha G.S., Nam H. Ion-selective electrodes based on molecular tweezer-type neutral carriers // Talanta. 2004. V. 63. № 1. P. 61.
Meyerhoff M.E., Pretsch E., Welti D.H., Simon W. Role of trifluoroacetophenone solvents and quaternary ammonium salts in carbonate-selective liquid membrane electrodes // Anal. Chem. 1987. V. 59. № 1. P. 144.
Shin J.H., Lee J.S., Lee Y.J., Cha G.S. Trifluoroacetophenone derivative-based carbonate ion-selective electrodes: effect of diluent pH on the anion selectivity // J. Electroanal. Chem. 1999. V. 468. № 1. P. 76.
Lomako S.V., Astapovich R.I., Nozdrin-Plotnitskaya O.V., Pavlova T.E., Lei S., Nazarov V.A., Okaev E.B., Rakhman’ko E.M., Egorov V.V. Sulfate-selective and its application for sulfate determinations in aqueous solutions // Anal. Chim. Acta. 2006. V. 562. № 2. P. 216.
Барт Т.Я., Караван В.С., Грекович А.Л., Ампилогова Н.А., Юринская В.Е., Никифоров В.А. Применение кислот Льюиса в мембранах пленочных ионоелективных электродов // Журн. аналит. химии. 1990. Т. 45. № 7. С. 1364.
Никольский Б.П., Матерова Е.А. Ионоселективные электроды. Л.: Химия, 1980. 240 с.
Смирнова А.Л., Грекович А.Л., Матерова Е.А. Влияние природы растворителя-пластификатора на электродные свойства пленочных карбонатселективных мембран // Электрохимия. 1988. Т. 24. № 9. С. 1187.
Dean J.A. Lange’s handbook of chemistry. McGRAW-HILL, INC., 1999.1291 p.
Камман К. Работа с ионоселективными электродами. М.: Мир, 1980. 288 с.
Wang K., Seiler K., Haug J.-P., Lehmann B., West S., Hartman K., Simon W. Hydration of trifluoroacetophenones as the basis for an optical humidity sensor // Anal. Chem. 1991. V. 63. № 10. P. 970.
Stuart B.H. Infrared Spectroscopy: Fundamentals and Applications. Wiley, 2004. 244 p.
Гулевич А.Л., Рахманько Е.М., Кийко Т.Н., Сенин П.В. Сольватирующие свойства трифторацетилпроизводных в анионообменных экстракционных системах // Химия и хим. технология. 2002. Т. 45. № 1. С. 48.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




