Журнал аналитической химии, 2020, T. 75, № 10, стр. 907-920
Определение свободных и этерифицированных жирных кислот в гидробионтах с различным содержанием полиненасыщенных кислот методом газожидкостной хроматографии
А. А. Никонова a, *, С. М. Шишлянников a, b, Т. А. Шишлянникова a, Т. Н. Авезова a, Т. А. Бабенко a, О. И. Белых a, О. Ю. Глызина a, В. А. Оболкин a, О. Н. Павлова a, А. Н. Смагунова c, Е. В. Суханова a, И. В. Тихонова a, Т. А. Ханаева a, В. А. Хуторянский c
a Лимнологический институт Сибирского отделения Российской академии наук
664033 Иркутск, ул. Улан-Баторская, 3, Россия
b Институт озероведения Российской академии наук
196105 Санкт-Петербург, ул. Севастьянова, 9, Россия
c Иркутский государственный университет
664033 Иркутск, ул. Лермонтова, 126, Россия
* E-mail: alenaxis@list.ru
Поступила в редакцию 27.01.2020
После доработки 25.03.2020
Принята к публикации 24.04.2020
Аннотация
Представлена методика определения жирных кислот (ЖК) в форме метиловых эфиров в гидробионтах (бактерии, цианобактерии, фитопланктон, зоопланктон, губки, жир рыб и тюленя) с разным содержанием полиненасыщенных жирных кислот (ПНЖК) методом газожидкостной хроматографии. Методику отличают: экономичность; эффективность экстракции липидов (извлечение ≥94%) с применением ультразвука в течение 10–15 мин без высушивания образца; высокий выход полиненасыщенных кислот (≥97%) за счет снижения степени их окисления до 40% при метилировании; исчерпывающая экстракция метиловых эфиров жирных кислот (МЭЖК), включая ПНЖК; новый подход к получению МЭ свободных ЖК без использования токсичных реагентов; надежность количественного определения МЭЖК (в том числе ω-3-, ω-6-, ω-9-ЖК), благодаря использованию в качестве стандарта дидецилового эфира и оценке правильности результатов с применением образца контроля “T14165QC Fish oil” (впервые). Методика опробована при определении ЖК гидробионтов Байкала в диапазоне их содержания от 20 до 2000 мкг в навеске и может быть применена для решения научных и прикладных задач. Внутрилабораторная прецизионность определения МЭЖК фитопланктона и бактерий составила ≤10%.
Жирные кислоты (ЖК) – алифатические одноосновные карбоновые кислоты, встречающиеся в природе в составе масел, жиров, восков растительного и животного происхождения в свободной (СЖК) и этерифицированной (ЭЖК) формах. Организмы водных экосистем содержат широкий спектр ЖК, включая насыщенные (НЖК), мононенасыщенные (МНЖК), полиненасыщенные (ПНЖК), незаменимые ЖК, разветвленные, циклические и др. В составе липидов простейших организмов – бактерий и дрожжей – чаще доминируют НЖК с линейной цепью (пальмитиновая С16:0 и стеариновая С18:0), разветвленные ЖК и мононенасыщенная олеиновая С18:1 кислота [1–5]. Некоторые виды цианобактерий (сине-зеленые водоросли) способны синтезировать МНЖК и ПНЖК, а некоторые синтезируют их в относительно больших количествах (>60%) [6–9]. Спектры жирных кислот различных видов бактерий являются характеристичными и сведены в специальные каталоги, используемые при таксономии. Роль свободных кислот в жизнедеятельности бактерий, а также механизм их синтеза и локализация в клетках до сих пор не изучены, в то время как липиды иных классов обнаруживают явную биологическую активность (например, антибиотическая активность гликолипидов). Изучение состава ЖК бактерий может помочь в понимании метаболизма ЖК высших организмов. Например, изучение состава липидов бактерий и микроводорослей, входящих в состав симбиотических сообществ пресноводных губок озера Байкал, может прояснить причины массовой гибели губок. Состав ЖК фитопланктона формируется за счет особенностей метаболизма и в результате влияния абиотических [1, 10–13] и биотических [14, 15] факторов. Фитопланктон и наземные растения являются первичными продуцентами незаменимых ЖК – эйкозатетраеновой С20:4 ω-6, эйкозапентаеновой С20:5 ω-3, докозагексаеновой С22:6 ω-3, – где ω характеризует положение двойных связей, начиная с хвоста алкильной цепи молекулы [16, 17]. Эти ЖК, передаваясь по трофическим сетям [18–23], влияют на функционирование и энергетический потенциал клеток [16, 24–26]. Специфичность состава ЖК гидробионтов морских и пресноводных экосистем дает информацию о переносе органического вещества по трофическим цепям от первичных продуцентов (например, фитопланктон) к консументам (например, рыбы), через промежуточные звенья цепи (например, зоопланктон). Состав ЖК, входящих в состав продуктов питания человека, отвечает за качество продукции. Состав ЖК первичных продуцентов, например эндемичных диатомей Байкала, как наиболее чувствительных к малейшим изменениям условий окружающей среды, может являться маркером таких изменений в условиях возрастающей антропогенной нагрузки. Жирные кислоты, продуцируемые микроводорослями, в известной мере усваиваются гетеротрофными бактериями. Поэтому изменение количественных и качественных характеристик фитопланктона влияет на численность и видовой состав бактерий озера Байкал.
Цель определения ЖК в тех или иных объектах, а также предполагаемый состав определяемых ЖК, диктуют выбор аналитического подхода [17].
Прямое определение олеиновой и линолевой ЖК в растительных маслах методом ВЭЖХ на обращенной фазе с рефрактометрическим детектированием используется как экспресс-метод анализа [27], а определение кислотного числа (ΣСЖК) алкали-, иодо- и pH-метрическим титрованием подходит и для анализа животных жиров [28–33]).
Экстракция ЖК из сложных матриц нефти и донных осадков может быть проведена способом Фолча [34], в том числе с модификациями [35, 36], например, вибромагнитной обработкой, улучшающей выход аналитов в мицеллярной форме. Последующее омыление ЖК спиртовым раствором щелочи [37–39], адсорбция примесей с помощью ионитов, силикагеля, модифицированного силикатом или гидроксидом калия, обеспечивают селективное выделение нефтяных кислот [34].
Для определения следовых количеств ЖК в воде применяют метод твердофазной экстракции на обращенной фазе [40], фракцию липидов омыляют щелочью, а затем метилируют [38].
Метод экстракционного алкилирования [41, 42] подходит для экстракции ЖК из биожидкостей (плазма крови, моча), когда в мягких условиях при комнатной температуре проводят щелочную переэтерификацию ЭЖК с последующим алкилированием СЖК иодметаном CH3I в присутствии катализатора гидроксида тетрабутиламмония N(C4H9)4OH. Методика, позволяющая определять свободные кислоты, пригодна для выявления патологий метаболизма ЖК. Недостатком методики являются токсичность иодметана и желательная очистка окрашенных экстрактов.
Для экстракции липидов из биомассы бактерий [2–8, 16, 43], фитопланктона [11–13, 17, 44, 45], зоопланктона [18, 19], рыбы [20, 22, 24], губок [46–48] используют смеси неполярного и полярного растворителей, например хлороформ–метанол (способ Фолча с модификациями [37, 49–51] и способ Блайта−Дайера [39, 49]), или пропан-2-ол–циклогексан–вода при облучении ультразвуком (УЗ) и нагревании [17]. Способ Фолча (хлороформ–метанол, 2 : 1, по объему) дает наилучшие результаты при жирности ≥ 2% [49]. Возможна замена хлороформа на менее токсичный дихлорметан [52, 17]. Сокращение длительности экстракции (4 ч, до 12 ч и более) из бактериомассы, в которой нет ПНЖК, возможно благодаря лиофильной сушке проб [53]. Экстракция в аппарате Сокслета также длительна (4–15 ч и более) и приводит к деструкции ПНЖК. Сверхкритическая флюидная экстракция диоксидом углерода при 40°С и 15 МПа нетоксична, недеструктивна, но малоэффективна (12 ч) [17, 54]. Экстракция при 45°С н-гексаном с УЗ (19 кГц, 65 Вт, 1 ч) и микроволновым (МВ) облучением (2.5 ГГц, 0.5–1 ч) [55] более эффективна (выход 12–25%) по сравнению в экстракцией в аппарате Сокслета (выход 2–5%). При этом увеличение частоты УЗ от 19 до 300 кГц снижает выход липидов вдвое.
Высокая полярность и низкая летучесть ЖК затрудняют их прямое определение методами газовой хроматографии (ГХ). Нагрев в инжекционной камере приводит к их термическому и термокаталитическому дегидрированию и декарбоксилированию. В наибольшей степени это касается ω-3 ПНЖК, бисаллильный атом углерода которых при двойной связи имеет низкую энергию активации для потери водородных атомов и образования свободных радикалов [56]. Замена полярной карбоксильной группы на менее полярную путем алкилирования или силилирования [40] позволяет избежать деструкции, повышает летучесть, информативность масс-спектров, и соответственно надежность идентификации пиков, улучшает чувствительность, селективность и хроматографические свойства при разделении на неполярных и слабополярных фазах. Газохроматографическое определение МЭЖК с пламенно-ионизационным детектированием (ПИД) [57, 58] известно еще с 1930-х гг. Силилирование позволяет определять гидроксикислоты и циклические кислоты.
Метилирующие агенты обычно добавляют к сухому экстракту [17, 59] либо к раствору липидов. Все эти агенты можно разделить на щелочные и кислотные. Этерификация липидов метанолом в присутствии сильных щелочей [50, 51, 53, 57, 60] (омыление) отличается экспрессностью (до 2 мин при н. у.), но приводит к деструкции ПНЖК и не позволяет получать эфиры свободных ЖК, а подходит для триацилглицеридов, гликолипидов, фосфолипидов и т.д.
Метилирование свободных ЖК возможно при изменении pH добавлением кислоты Льюиса (например, трифторида бора) [45, 50, 58, 61]. Жесткие условия реакции (нагрев до 60–100°С), распад ПНЖК, образование побочных продуктов, токсичность BF3 – серьезные недостатки метода. Кроме BF3, существуют реагенты R'CHN2, R'Cl, (CH3)4NOH, (CH3)3OBF4. Наиболее известен диазометан, CH2N2, легко получаемый в лабораторных условиях [62, 63]. Основными недостатками использования указанных реагентов являются токсичность, длительность и трудоемкость процесса, хотя нагрев или МВ-облучение снижают энергию активации, ускоряя процесс [58]. Для этерификации СЖК рыб применяют метилат натрия [59, 64]. Методика получения МЭЖК из жиров и масел с кислотным числом (КЧ) ≤2 с помощью метилата натрия включена в ГОСТ РФ [64]. Описано его применение и для получения МЭЖК из липидов фитопланктона [65], но в данном случае способ малоэффективен по причине взаимодействия метилата натрия с компонентами пробы.
Нагрев липидов до 50–170°С со спиртами С1–С5 в кислой среде обеспечивает протекание реакций как этерификации СЖК, так и трансэтерификации ЭЖК [50, 66], что является ключевым моментом при выборе этого метода. При этом применяют газообразный 5%-ный HCl [2, 50], 35%-ную HCl [60] и H2SO4 (1–5%) [50, 52, 66, 67]. К недостаткам стоит отнести длительность (до 12 ч), окисление ПНЖК при увеличении концентрации H2SO4 свыше 10% с целью ускорения реакции, замедление процесса при наличии воды в системе, токсичность HCl. МЭЖК экстрагируют н-гексаном (до 30 мл) [1, 53, 52] и определяют методами ГХ-ПИД и ГХ с масс-спектрометрическим детектированием (МС) [1, 38, 50, 52, 65, 68, 69].
Предлагаемая нами методика разработана для анализа биологических проб байкальских организмов сложного состава, содержание липидов в которых меняется в широком диапазоне – от 0.7% (фитопланктон) до ≥97% (тюлений жир), доля ЖК ~ от 20 до 2000 мкг в навеске, доля ПНЖК, в том числе незаменимых ω-3-, ω-6-, ω-9-ЖК, – от 0% (бактерии) до 60% (губки), доля СЖК – от 0.3% (губки) до 40% (фитопланктон). Методика универсальна для различных типов гидробионтов, обеспечивает минимальные потери ПНЖК при эстерификации, отличается простотой и экономичностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Отбор проб. Биомассу термофильного факультативно-анаэробного штамма PB15/Grf7geo Geobacillus sp., изолированного из низкотемпературного слоя донных осадков озера Байкал в районе выхода газосодержащих флюидных потоков метанового сипа Посольская Банка, получали приростом культуры (2016 г.) в модифицированной среде Видделя для пресноводных форм [70]. Биомассу гетеротрофных бактерий Bacillus sp. 9A, 2A, 2B, изолированных из биопленок твердых субстратов литоральной зоны озера Байкал (м. Березовый), получали приростом культур (2017 г.) в среде с глюкозой. Биомассу цианобактерий Synechoccus sp. Bf2 из биопленки, обрастающей дно Байкала в районе Ольхонских ворот, получали приростом культуры в минеральной среде Z-8. Биомассу центрифугировали при 3000 об/мин в течение 15 мин.
Байкальский фитопланктон отбирали в мае–сентябре 2014–2018 гг. в разных котловинах оз. Байкал сетью Джеди с глубины 5–50 м с размером ячеек 100 мкм. Пробы из-подо льда отбирали водолазы с помощью шприцевого пробоотборника. Пробы фильтровали (фильтр-аппарат с колбой емк. 1000 мл, Duran Group, Германия) на фильтрах из микроцеллюлозы (45 мкм, ВЛАДиСАРТ, Россия). Влажность оценивали гравиметрически. Пробы, содержащие нитчатые зеленые водоросли с целлюлозной клеточной мембраной, перетирали в ступке. Микроскопический анализ проводили на микроскопе Сarl Zeiss Axiover 200 (×400).
Байкальский зоопланктон (Epishura baicalensis, Macrohectopus branickii и Daphnia) отбирали в разных котловинах оз. Байкал с сентября по октябрь 2014, 2016 гг.
Жир тюленя (нерпа Phoca sibirica, 2018 г.) предоставлен на анализ д.х.н. Анненковым В.В (ЛИН СО РАН). Образцы препаратов “Рыбий жир” (жир лососевых рыб с содержанием ω-3-кислот ~300 мг/г согласно документации, Израиль), предоставлен к.х.н. Горшковым А.Г. (ЛИН СО РАН).
Байкальская губка Lubomirskia baicalensis отобрана водолазами в 2016, 2018 гг., а также взяты образцы байкальской губки, выращиваемой в экспериментальном пресноводном аквариумном комплексе байкальских гидробионтов ЛИН СО РАН.
Экстракция липидов. Для экстракции липидов из фитопланктона и бактерий биомассу размораживали и тщательно перемешивали. Биомассу зоопланктона перетирали в ступке. Клеточное содержимое губок отжимали. Жидкое содержимое губок, а также жидкий жир нерпы (растопленный при 25°С) и рыб отбирали механическим дозатором. Липиды экстрагировали из параллельных навесок смесью Фолча (хлороформ–метанол, 2 : 1, по объему) в пластиковых пробирках типа эппендорф емк. 2 мл, встряхивая и выдерживая их в ультразвуковой ванне (1.2 мл × 3 × 5 мин). Экстракты объединяли в стеклянных пробирках для центрифугирования, добавляли 1.2 мл воды, эмульгировали, центрифугировали при 3000 об/мин. Перед экстракцией липидов из губок к навескам (масса влажной навески ~0.02 г при влажности ~97%) добавляли 100 мкл 8%-ной H2SO4 в воде и после изменения окраски с зеленой на желтую через ~2 мин экстрагировали липиды. Экстракцию липидов из губок проводили 1 раз, к экстракту добавляли 350 мкл воды.
Кислотная этерификация жирных кислот и получение метиловых эфиров жирных кислот (общее содержание). Хлороформный слой экстракта (нижний) переносили в стеклянные пенициллиновые флаконы емк. 10 мл, упаривали в токе аргона досуха, сразу добавляли 4.5 мл 2%-ной H2SO4 в метаноле, плотно закрывали фольгой и помещали в термостат при 55°С на 1.5 ч. После метанолиза жирных кислот растворы охлаждали до комнатной температуры, добавляли 0.8 мл н-гексана. МЭЖК из полученных растворов экстрагировали н-гексаном (3 мл × 2 × ~2 мин). Перед второй экстракцией к растворам добавляли по 1 мл воды. Экстракты концентрировали до 1 мл в токе аргона, осушали безводным Na2SO4.
Раздельное получение метиловых эфиров этерифицированных и свободных жирных кислот с иодметаном. К навескам выделенных липидов фитопланктона (~0.02 г сырой массы) добавляли 2 мл 0.4 М NaOH в MeOH, помещали в УЗВ на 5 мин. Полученные метиловые эфиры этерефицированных кислот (МЭ ЭЖК) экстрагировали 3 мл н-гексана дважды. К оставшемуся раствору добавили фосфатный буфер (6 мл), помещали в УЗВ на 5 мин. Добавляли 400 мкл 0.2 М р-ра тетрабутиламмония бромида (ТБАБ), 200 мкл иодметана, 6 мл СH2Cl2, 10 мин встряхивали в закрытых колбах. Отбирали экстракт метиловых эфиров свободных ЖК. Экстракты МЭ ЭЖК и СЖК анализировали методами ГХ.
Раздельное получение метиловых эфиров этерифицированных и свободных жирных кислот в условиях изменения pH. К навескам выделенных липидов (~0.02 г сырой массы) добавляли 2 мл 0.4 М раствора NaOH в метаноле, помещали в УЗ-ванну на 5 мин. Полученные МЭ этерефицированных ЖК экстрагировали н-гексаном (3 мл × 2) промывали водой, сушили безводным Na2SO4, концентрировали в токе аргона до объема 1 мл. Экстракты МЭ ЭЖК анализировали методом ГХ. К оставшемуся щелочному раствору добавляли 3 мл воды, ~0.15 г перетертого в фарфоровой ступке сульфата меди(II), встряхивали в течение 5–10 мин до перехода голубой окраски Cu2SO4 в зеленую – Cu(OH)2 (до рH ~ 6), не передерживая раствор, чтобы избежать перехода Cu(OH)2 в CuO черного цвета, способного окислять ЖК. Свободные ЖК экстрагировали н-гексаном (3 мл × 2). Гексан выпаривали и проводили кислотную этерификацию СЖК (см. выше). Экстракты анализировали методом ГХ.
Газохроматографический с пламенно-ионизационным детектированием анализ экстрактов метиловых эфиров жирных кислот. Подготовленные экстракты анализировали на газовом хроматографе с пламенно-ионизационным детектором GC-2010 Plus (Shimadzu, Япония) с колонкой Optima-17MS (30 м × 0.25 мм, 0.25 мкм) фирмы “Macherey-Nagel” (Германия). Температура дозатора 310°С, объем вводимой в колонку пробы 2 мкл в режиме без деления потока, температура детектора 310°С, скорость потока водорода 40 мл/мин, скорость потока воздуха 400 мл/мин, скорость потока газа-носителя (гелий) 30 мл/мин, линейная скорость 28.5 см/с. В случае бактериальных экстрактов (наиболее простых по составу) хроматографию проводили при нагреве колонки от 120°С (удерживание 0.5 мин) до 260°С со скоростью 15 град/мин. В случае экстрактов фитопланктона, зоопланктона, рыбьего жира и жира нерпы – от 80 до 120°С со скоростью 10 град/мин, затем до 260°С (2.5 град/мин). В случае экстрактов губок, как наиболее сложных объектов, – от 80°С (0.5 мин) до 310°С со скоростью 2 град/мин (5 мин).
Оценка правильности методом добавок. Систематическую составляющую погрешности методики определения МЭЖК в фитопланктоне, жире рыб и байкальской нерпы характеризовали путем добавления в материал рабочих проб перед их подготовкой стандартные образцы, содержащие известное количество ЖК. В связи с отсутствием в коммерческой сети образцов сравнения в качестве добавки использовали образец рыбьего жира Fish Oil T14165QC (Supelco, Sigma-Aldrich Co. LLC, США) с установленными межлабораторно значениями содержаний ЖК, включая ω-3-, ω-6- и ω-9-ЖК (олеиновая С18:1 n–9, линолевая С18:2 n–6, α-линоленовая С18:3 n–3, γ-линоленовая С18:3 n–6, стеаридоновая С18:4 n–3, гондоновая С20:1 n–9, эйкозадиеновая С20:2 n–6, арахидоновая С20:4 n–6, эйкозатетраеновая С20:4 n–3, эйкозапентаеновая С20:5 n–3, цетолеиновая С22:1 n–11, докозапентаеновая С22:5 n–3, докозагексаеновая С22:6 n–3, нервоновая цис-С24:1 n–9), а также медицинский препарат рыбьего жира с содержанием ω-3-кислот ~ 300 мг/г. После гомогенизации лабораторных проб к двум параллельным навескам добавляли известное количество раствора добавки Fish Oil T14165QC и проводили экстракцию, метанолиз и ГХ-анализ, как описано выше.
Газохроматографический анализ с масс-спектрометрическим детектированием экстрактов метиловых эфиров жирных кислот (качественный). Экстракты анализировали на хромато-масс-спектрометре “6890В GC System, 7000С GC/MS Triple Quad” (Agilent, США) с колонкой Optima-17 (см. выше). Температура дозатора 290°С, температура квадруполя 150°С, температура ионного источника 230°С, энергия ионизации 70 эВ, объем пробы 2 мкл без деления потока. Хроматографию проводили в условиях, аналогичных ГХ-ПИД (см. выше). Пики детектировали в диапазоне значений m/z 40–500. Масс-спектры идентифицировали с использованием программного обеспечения NIST Mass Spectral Search Program for the NIST Mass Spectral Library (V. 2.2).
Количественное определение метиловых эфиров жирных кислот методом газовой хроматографии с пламенно-ионизационным детектированием. Количественное определение МЭЖК проводили методом внутреннего стандарта, для чего к экстрактам перед анализом добавляли 50 мкл стандартного раствора дидецилового эфира (C20H42O) в н-гексане (1 мг/мл). Детектор градуировали в диапазоне ΣМЭЖК от 40 до 540 мкг в пробе с использованием стандартов (Supelco, США) “F.A.M.E. Mix, C4–C24, 100 mg neat” и “Methyl cis-4,7,10,13,16,19-Docosahexaenoic ester, 10 mg/mL in heptane” (70–1000 мкг в пробе). Градировочные коэффициенты k изменялись в диапазоне значений от 0.2801 (для МЭ докозагексаеновой кислоты 4,7,10,13,16,19-С22:6) до 1.1050 (для МЭ докозановой кислоты С12:0). Кроме значений k индивидуальных соединений, рассчитывали средние значения k для групп НЖК (k = 1.0491, n = 14), МНЖК (k = 0.9966, n = 8) и ПНЖК с количеством двойных связей от 2 до 6 (k = 0.6389, n = 10) с целью определения в пробах соединений ЖК, отсутствующих в стандартных смесях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Оптимизация стадии экстракции липидов. Учитывая трудоемкость отбора природных проб и наращивания биомассы байкальских организмов in vitro, предложено использовать минимально возможные навески (от 0.0004 до 0.2 г сырой массы), что снижает расход реактивов (3.6 мл экстрагента на пробу). Показано, что экстракция липидов из сырых навесок биомассы бактерий (0.008–0.02 г в пересчете на сухую массу), планктона (0.0003–0.02 г в пересчете на сухую массу), губок (0.01–0.02 г в пересчете на сухую массу), жира рыб и тюленя (0.0004–0.0008 г жира), исключая высушивание, снижает деструкцию ПНЖК и СЖК и повышает надежность методики. Так, показано, что содержание СЖК в пробах фитопланктона снижается при +24°С более чем на 20 и 60% за 24 и 96 ч соответственно.
Для экстракции липидов за основу нами был взят метод Фолча [37] как менее деструктивный [39, 49]. Нам удалось достичь полного извлечения липидов и ПНЖК из проб (~95%) УЗ-обработкой проб с растворителем. Эффективность извлечения аналитов при такой УЗ-обработке выше (до 35%) по сравнению с классической экстракцией по Фолчу (24–72 ч при +4°С), в то время как длительность экстракции составляет 15 мин, что в ~100 раз быстрее по сравнению с методом Фолча. Микроскопический анализ иллюстрирует эти результаты (рис. 1).
Рис. 1.
Световая микроскопия клеток байкальских диатомей: (а) – до экстракции липидов; (б) – пустые створки после экстракции в ультразвуковой ванне; (в) – выход липидов.

Оптимизация стадии получения метиловых эфиров жирных кислот. Получение метиловых эфиров свободных и этерифицированных ЖК из липидов возможно в ходе реакций, катализируемых кислотами и щелочами [50, 60] (схемы 1–3 ).
Схема 1 . Кислотная этерификация свободных жирных кислот.
Схема 2 . Кислотная трансэтерификация липидов.
Схема 3 . Щелочная трансэтерификация липидов.
Диатомовые микроводоросли S. acus являются доминирующими в озере Байкал. Согласно работе Верещагина [65] они содержат до 50% ПНЖК и по нашим подсчетам содержат свободные ЖК. Для метилирования как свободных, так и связанных ЖК использовали кислотный катализатор. Отметим, что 2%-ная H2SO4 в метаноле обеспечивает не только получение МЭЖК, но и разрушение хлорофилла А (рис. 2), исключая очистку экстрактов на сорбентах. Уменьшение концентрации кислоты не обеспечивает разрушение хлорофилла (рис. 2), а увеличение – повышает выход побочных продуктов. Исключение составляют пробы губок. Показано, что добавление 8%-ной H2SO4 в материал проб губки за 1–2 мин до экстракции липидов смесью Фолча позволяет извлекать до 96% МЭЖК, а отсутствие этой стадии снижает выход МЭЖК губок более чем на 40% по причине их сложной многокомпонентной матрицы.
Рис. 2.
Спектры светопоглощения экстрактов метиловых эфиров жирных кислот в УФ- и видимой областях в зависимости от доли H2SO4 в метанольном растворе, добавляемом к фракции липидов, выделенных из проб: 1 – базовая линия. Доля H2SO4 в метанольном растворе, %: 2 – 8, 3 – 4.6, 4 – 2, 5 – 1, 6 – 1–0.5.
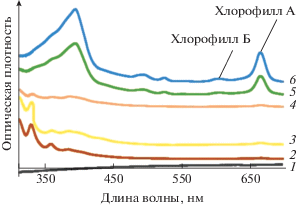
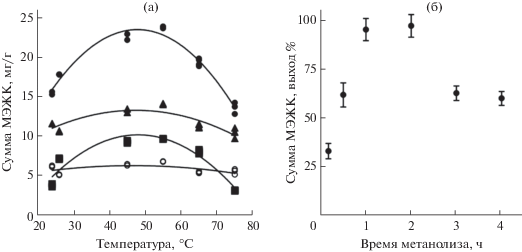
Доля липидов в исследуемых нами пробах оценена в широком диапазоне – от ~0.7 до 97%, содержание ЖК – от 20 до 2000 мкг в навеске, а ΣМЭЖК – от 7 до 205 мг/г сухой массы пробы (число проб m = 65, число параллельных навесок n = 2). При этом наблюдали существенные отличия состава НЖК/МНЖК/ПНЖК. Для фитопланктона соотношение ЖК в зависимости от степени их насыщенности составляет 30/30/40, для зоопланктона – 39/15/46, для цианобактерий – 59/40/1, для термофильных бактерий – 92/8/0, для жира нерпы – 13/68/19, для губок – 15/25/60. Учитывая такую разницу и повышенную склонность ПНЖК к окислению, в данной работе предложены условия метилирования ЖК разной степени насыщенности. На примере проб биомассы установлено, что ПНЖК и МНЖК в условиях кислотного катализа наименее подвержены деструкции при 40–60°С в течение 1–2 ч (рис. 3). Увеличение температуры приводит к деструкции ПНЖК, а уменьшение не обеспечивает полноты выхода. Для сравнения выход ΣМЭЖК фитопланктона, полученных в жестких условиях (растворы NaOH или KOH, 55–85°С, 0.2–1.5 ч) не превышает 0.5% вследствие деструкции ЖК. Таким образом, предложенные условия метилирования (см. “Экспериментальную часть”) позволяют снизить окисление ПНЖК как минимум до 40% по сравнению с известными методиками [11, 12, 67, 71, 72].
Рис. 3.
(а) Выход (мг/г сухой массы проб) в зависимости от температуры реакции: (⚫) – ΣМЭЖК, (◼) – ПНЖК, (⚪) – НЖК (▲) – НЖК + МНЖК; продолжительность реакции 1.5 ч. (б) Выход (%) суммы метиловых эфиров жирных кислот байкальского фитопланктона и культуры бактерий Geobacillus sp. в зависимости от продолжительности реакции (средние значения, n = 2–6 для каждой точки, 65°С).
Предложено проводить раздельное определение свободных и связанных ЖК в две стадии (см. “Экспериментальную часть”):
1 стадия – щелочная трансэтерификация и последующая экстракция ЭЖК н-гексаном;
2 стадия – нейтрализация оставшегося раствора сульфатом меди(II), кислотная этерификация и экстракция СЖК н-гексаном.
Предложенный способ отличается эффективностью, обеспечивая выход ΣМЭЖК ~85–90% (табл. 1) и простотой, исключая применение токсичных реагентов. Для сравнения определили ЭЖК и СЖК в пробах фитопланктона с использованием ТБАБ в качестве катализатора и иодметана в качестве метилирующего реагента согласно методикам Уколова и Орловой с соавт. [41, 42] по определению ЖК в биожидкостях человека. Результаты метилирования ЖК двумя способами приведены в табл. 2. Как видно, метилирование ЖК в предлагаемых нами условиях кислотного катализа обеспечивает лучший выход метиловых эфиров СЖК, ЭЖК и ПНЖК – до 30%, НЖК и МНЖК – до 20%, чем в условиях катализа, исключая токсичные реагенты (иодметан). Полнота извлечения МЭЖК зависит главным образом от количества в них двойных связей (рис. 4а) и, как следствие, разной растворимости в воде (рис. 4б) [73, 74]. Так, для полного (≥97%) извлечения ПНЖК необходима как минимум 2-кратная экстракция, в отличие от НЖК, для которых достаточно проведения одной.
Таблица 1.
Получение метиловых эфиров жирных кислот диатомеи S. acus методами алкилирования жирных кислот иодметаном при катализе тетрабутиламмония бромидом и алкилирования метанолом при кислотном катализе
| Способ получения МЭЖК | МЭЖК | Содержание МЭЖК, мг/г сухой пробы* | |||
|---|---|---|---|---|---|
| сумма | НЖК | МНЖК | ПНЖК | ||
| Щелочная трансэстерификация ЭЖК и катализ ТБАБ реакции метилирования СЖК иодметаном | Σ(МЭ ЭЖК и МЭ СЖК | 11.2 ± 1.0 | 3.3 ± 0.3 | 3.2 ± 0.3 | 4.6 ± 0.4 |
| Σ(МЭ ЭЖК) | 3.6 ± 0.3 | 1.25 ± 0.11 | 0.96 ± 0.07 | 1.34 ± 0.12 | |
| Σ(МЭ СЖК) | 7.6 ± 0.7 | 2.07 ± 0.19 | 2.24 ± 0.20 | 3.29 ± 0.29 | |
| Кислотный катализ реакции метилирования ЭЖК и СЖК метанолом (см. “Экспериментальную часть”) | Σ(МЭ ЭЖК и МЭ СЖК) | 14.6 ± 1.3 | 3.8 ± 0.3 | 4.1 ± 0.4 | 6.8 ± 0.6 |
* Число значащих цифр в ∆x в таблицах представляли согласно рекомендациям Смагуновой с соавт. [55]. Если первая значащая цифра в ∆x была больше 2, то результат округляли до одной значащей цифры. Если же первая значащая цифра была 1 или 2, то приводили две или три значащие цифры. Сокращение числа значащих цифр до одной в нашем случае увеличивает погрешность до 30%.
Таблица 2.
Получение суммы метиловых эфиров жирных кислот диатомеи S. acus в ходе алкилирования метанолом при кислотном катализе и раздельное определение свободных и этерифицированных жирных кислот с применением сульфата меди(II)
| Способ получения МЭЖК | МЭЖК | Содержание МЭЖК, мг/г сухой пробы | |||
|---|---|---|---|---|---|
| сумма | НЖК | МНЖК | ПНЖК | ||
| Кислотный катализ реакции метилирования ЭЖК и СЖК метанолом | Σ(МЭ ЭЖК и МЭ СЖК) | 15.6 ± 1.4 | 5.7 ± 0.5 | 4.7 ± 0.4 | 4.7 ± 0.4 |
| Щелочная трансэтерификация ЭЖК, нейтрализация раствора CuSO4 и кислотный катализ реакции метилирования СЖК метанолом | Σ(МЭ ЭЖК и МЭ СЖК) | 14.2 ± 1.3 | 5.7 ± 0.5 | 4.0 ± 0.4 | 4.0 ± 0.4 |
| Σ(МЭ ЭЖК) | 4.9 ± 0.4 | 2.20 ± 0.20 | 1.42 ± 0.13 | 1.42 ± 0.13 | |
| Σ(МЭ СЖК) | 9.3 ± 0.8 | 3.5 ± 0.3 | 2.53 ± 0.22 | 2.53 ± 0.22 | |
Известно [50], что компенсировать потери ЖК при пробоподготовке можно добавкой суррогатных стандартов ЖК с нечетным числом атомов углерода (С17:0, С19:0) до стадии экстракции липидов. Недостатками такого подхода являются наличие указанных насыщенных кислот в ряде гидробионтов [75], а также значимая разница в отклике ПИД по отношению к насыщенным и полиненасыщенным кислотам. Так, градуировочный коэффициент (k) при определении НЖК методом ГХ с ПИД в указанных условиях составляет 1.0491 (R2 = 0.9928), МНЖК – 0.9966 (R2 = = 0.9939), а ПНЖК – 0.6389 (R2 = 0.9832–0.9989). Учитывая удовлетворительную полноту извлечения аналитов по предложенной методике, для количественного определения МЭЖК к экстрактам перед ГХ-анализом добавляли внутренний стандарт – раствор в н-гексане дидецилового эфира (C20H42O). Значение tR данного соединения лежит примерно посредине интервала времен выхода МЭЖК исследуемых объектов. Дидециловый эфир дает интенсивный пик на хроматограммах, полученных с применением пламенно-ионизационного и масс-спектрального детекторов, не перекрываясь с пиками аналитов, устойчив при хранении экстрактов (≥12 мес.), доступен в коммерческой сети, удобен и прост в использовании.
Повторяемость результатов определения суммы метиловых эфиров жирных кислот в пробах байкальских бактерий и фитопланктона. По архивным данным текущих анализов рабочих проб [55] рассчитавали точечные оценки повторяемости результатов определения суммы МЭЖК групп НЖК, МНЖК и ПНЖК и индивидуальных соединений в биологических пробах. При этом содержание суммы МЭЖК изменялось от 6 до 60 мг/г сухой массы пробы для проб бактериальной биомассы, от 10 до 60 мг/г сухой массы для проб фитопланктона. Ширина указанных диапазонов обусловила необходимость группировки проб в два поддиапазона (табл. 3). Внутри поддиапазонов значение ${{\bar {x}}_{j}}$ изменялось в 3–4 раза, поэтому при расчете дисперсии использовали относительное отклонение: δji = ${{({{x}_{{ji}}} - {{{\bar {x}}}_{j}})} \mathord{\left/ {\vphantom {{({{x}_{{ji}}} - {{{\bar {x}}}_{j}})} {{{{\bar {x}}}_{j}}}}} \right. \kern-0em} {{{{\bar {x}}}_{j}}}}.$ Выборочные дисперсии $V_{i}^{2}$ каждого поддиапазона указаны в талице (табл. 3). Принадлежность сомнительных результатов к конкретной совокупности оценивали с помощью r-критерия, сопоставляя его с табличным значением [55].
Таблица 3.
Сравнение выборочных дисперсий $V_{r}^{2}$ результатов определения суммы метиловых эфиров жирных кислот в пробах гидробионтов по критерию Фишера
| Объект | Диапазон | ΣМЭЖК, мг/г | ${V_{i}^{{\text{2}}}}$ (fi)* | F(α, f1, f2) = F(0.05, 10, 9) | ${\overline V _{i}^{{\text{2}}}}$ (fi)* |
|---|---|---|---|---|---|
| Бактерии | I | 6–20 | 0.1011 (f = 11) | FI–II = 1.01<=F(0.05,10,9) = 3.14 | 0.0978 (f = 20) |
| II | 20–60 | 0.0993 (f = 10) | |||
| Фитопланктон | I | 10–20 | 0.0744 (f = 15) | FI–II = 1.53 <= F(0.05,15,15) = 2.40 | 0.0619 (f = 31) |
| II | 20–60 | 0.0488 (f = 15) |
При сравнении по F-критерию установлена однородность выборочных дисперсий для соседних поддиапазонов содержания ΣМЭЖК в биомассе бактерий и фитопланктона, что позволило объединить их оценки [55]. Усредненные дисперсии $\bar {V}_{i}^{2},$ характеризующие повторяемость результатов определения ΣМЭЖК в биомассе бактерий и фитопланктона, мало отличаются, поэтому оценивали их однородность, используя критерий Бартлетта [59]. Сравнение рассчитанного значения B с табличными значениями χ2-критерия показало, что χ2(0.01, 51) = 76 > В = 29 < χ2(0.05, 51) = 68. Таким образом, можно принять, что сравниваемые дисперсии результатов определения ΣМЭЖК в данных пробах однородны. Усреднение данных дисперсий с учетом числа степеней свободы каждой позволило рассчитать среднюю дисперсию $\bar {V}_{i}^{2}$ = 0.0060 (fΣ = 52) и коэффициент вариации Vr = 7.7% для указанных проб. Внутрилабораторная прецизионность (ВЛП) определения Σ(МЭЖК) для бактерий и фитопланктона оценена значениями 6 и 10% соответственно, ВЛП для индивидуальных соединений ≤15%.
Правильность результатов определения метиловых эфиров жирных кислот в пробах. Литературные данные по оценке правильности определения ЖК в природных объектах нами не найдены, что, вероятно, связано с отсутствием на мировом рынке стандартных образцов состава ЖК. Для оценки правильности определения МЭЖК в исследуемых объектах по описанной методике мы предлагаем оценку детерменированной систематической составляющей погрешности (ДПСП) определения МЭЖК в исследуемых объектах путем добавки известного количества жира Fish Oil T14165QC (далее Fish Oil) в материал рабочих проб. Содержания индивидуальных ЖК в образце жира Fish Oil установлены в определенном доверительном диапазоне на основе оценки разными методами в 46 независимых лабораториях согласно FAPAS (Food Chemistry Proficiency Test Report 14165. Omega-3, Omega-6 and Omega-9 Fatty Acids in Fish Oil) (далее Test Report), но не являются сертифицированными [76]. В первую очередь определили содержание ЖК в образце Fish Oil по методике ГОСТ [64] получения МЭЖК растительных масел и животных жиров. К навеске 0.03–0.04 г материала Fish Oil добавляли 0.1 мл свежеприготовленного метилата натрия NaOCH3, экстрагировали 1.9 мл н-гексана (2 × 5 мин), промывали водой, сушили безводным Na2SO4, центрифугировали, добавляли стандарт, анализировали. Полученные содержания МЭЖК (n = 2) пересчитывали на массу ЖК и сравнивали с установленными в документе Test Report. Полученные значения не выходили за рамки доверительного диапазона для Fish Oil и были приняты в качестве опорных при введении такого же количества добавки Fish Oil в материал проб ($\bar {x}$) (табл. 4). Такой подход опробован впервые. Результаты метилирования ЖК жира Fish Oil при помощи CH3ONa (методика ГОСТ) и при помощи CH3OH (см. “Экспериментальную часть”) сопоставимы – значения ΣМЭЖК составляют 172 ± 6 и 177 ± 7 г/100 г пробы соответственно. Отмечено, что методика ГОСТ непригодна для анализа сложных матриц (фитопланктон, губка и др.) из-за низкого выхода МЭЖК. Из табл. 4 видно, что найденная величина добавки соответствует введенной и ДПСП при определении большинства ЖК фитопланктона не выявлена. Исключение составляют C20:5 и C22:6 ω-3-ЖК, содержание которых в образце Fish Oil намного ниже их содержания в байкальском фитопланктоне. Для оценки правильности определения этих незаменимых кислот вместо Fish Oil использовали препарат рыбьего жира (жир лососевых рыб, содержание ω-3-кислот ~300 мг/г, Израиль), содержание C20:5 и C22:6 ω-3-ЖК в котором найдено и сопоставимо с таковым для фитопланктона оз. Байкал. При этом ДПСП при определении C20:5 и C22:6 ω-3-ЖК также не выявлена.
Таблица 4.
Правильность определения метиловых эфиров жирных кислот и их суммы в байкальском фитопланктоне
| МЭЖК* | $\bar {x}$, мкг | Введено, мкг | $\bar {x}$', мкг | Найдено, мкг |
|---|---|---|---|---|
| C18:1(n-9) | 2.4 ± 0.3 | 118 ± 15 | 120 ± 15 | 118 ± 15 |
| C18:2(n-9,12) | 4.9 ± 0.6 | 32 ± 4 | 35 ± 4 | 30 ± 4 |
| C18:4(n-6,9,12,15) | 0.37 ± 0.03 | 0.54 ± 0.05 | 1.01 ± 0.09 | 0.64 ± 0.06 |
| C18:3(n-9,12,15) | 0.43 ± 0.04 | 12.4 ± 1.3 | 13.3 ± 1.4 | 12.9 ± 1.3 |
| C20:1(n-11) | 0.107 ± 0.019 | 5.9 ± 0.9 | 6.0 ± 1.0 | 6.0 ± 1.0 |
| 20:2 (n-11,14) | 0.27 ± 0.04 | 0.85 ± 0.12 | 1.13 ± 0.16 | 0.86 ± 0.12 |
| C20:4(n-5,8,11,14) | 0.075 ± 0.007 | 0.096 ± 0.009 | 0.182 ± 0.018 | 0.108 ± 0.011 |
| C20:5(n-5,8,11,14,17) | 31 ± 5 | 1.11 ± 0.16 | 34 ± 5 | 3.3 ± 0.5 |
| C20:5(n-5,8,11,14,17)** | 31 ± 5 | 21 ± 3 | 56 ± 8 | 25 ± 4 |
| C20:4(n-8,11,14,17) | 0.04 ± 0.01 | 0.19 ± 0.04 | 0.20 ± 0.04 | 0.16 ± 0.04 |
| C22:1(n-11) | 0.20 ± 0.05 | 3.6 ± 0.8 | 3.74 ± 0.88 | 3.5 ± 0.8 |
| C22:1(n-13) | 0.60 ± 0.09 | 2.7 ± 0.4 | 3.12 ± 0.49 | 2.5 ± 0.4 |
| C22:6(n-4,7,10,13,16,19) | 1.875 ± 0.202 | 0.42 ± 0.05 | 2.41 ± 0.26 | 0.53 ± 0.06 |
| C22:6(n-4,7,10,13,16,19)** | 1.875 ± 0.202 | 4.0 ± 0.4 | 6.5 ± 0.7 | 4.5 ± 0.5 |
| C22:5(n-7,10,13,16,19) | 0.101 ± 0.011 | 0.146 ± 0.016 | 0.218 ± 0.023 | 0.119 ± 0.013 |
| Сумма МЭЖК | 40 ± 4 | 177 ± 16 | 220 ± 20 | 180 ± 16 |
Результаты анализа байкальских гидробионтов. Для указанных видов байкальских бактерий и цианобактерий идентифицировано от 15 до 24 ЖК. Жирные кислоты с длиной цепи С13–С21 отвечают за пластичность мембран [77]. В жире нерпы определено 44 ЖК, из которых ~80% приходится на МНЖК и ~20% – на ПНЖК. Для лабораторной культуры диатомовых микроводорослей Synedra acus (стадия 2/3 экспоненциального роста), обитающих во многих пресноводных водоемах, доля ПНЖК составляет ~25% (наши данные), а для культуры Synedra sp. Ehrenberg ~30% [75]. Для природных проб Synedra acus доля ПНЖК составляет 30–50%. Минимальные значения найдены для прибрежных, а бо́льшие – для пелагиальных проб, что, вероятнее всего, обусловлено физико-химическими свойствами среды обитания. Высокое содержание ПНЖК в байкальской диатомее Melosira baicalensis ~40–50% сопоставимо с содержанием в арктической Melosira arctica (Баренцево море) ~40–60% [78]. Высокое содержание свободных ЖК (до 25%) в Melosira arctica оказалось ниже, чем в байкальской S. acus (4–40%). Вероятно, СЖК фитопланктона в силу их токсичности по отношению к бактериям выполняют защитную роль, чем можно объяснить различие сезонных пиков цветения байкальских фито- и бактериопланктона. Стоит отметить небольшое число публикаций по данной тематике. Имеется сообщение [79] о высоком содержании СЖК в пробах мицелярных грибов и о возможности их направленного синтеза в противоположность мнению об образовании в результате распада клеток, а также об их роли в диагностической медицине [80]. Кроме того, нами отмечено увеличение ΣСЖК и снижение содержания свободных ПНЖК с увеличением содержания органических загрязняющих веществ в пробах прибрежного фитопланктона и воды прибрежной зоны озера в районе городов и поселков. Таким образом, СЖК фитопланктона могут являться биомаркером состояния водной экосистемы озера. В работе [81] показано, что при введении с кормом для крыс диэтилгексилфталата содержание СЖК в плазме растет, а усвоение незаменимых ПНЖК падает [82]. Влияние загрязнения и прочих внешних факторов на состав ЖК фитопланктона требует более тщательного рассмотрения. Можно говорить о явном влиянии токсикантов на байкальский фитопланктон, от благополучия которого зависит состояние всей экосистемы озера.
Статья и эпиграф посвящены светлой памяти Антонины Никоновны Смагуновой, преподавателя, профессора, д. т. н., заслуженного деятеля науки РФ, отличника просвещения, чьей помощью и усердием написаны три раздела этой работы…
Исследование выполнено в рамках гос. задания Министерства науки и высшего образования РФ (проекты ФАНО № 0345-2018-0001 “Исследование эволюционных, экологических и молекулярно-биологических аспектов кремний-зависимых хромист…”, № 0345-2018-0008 “Оценка и прогноз экологического состояния озера Байкал и сопряженных территорий…”, № 0345-2018-0001 “Микроорганизмы глубинной биосферы…”, № 0345-2018-0003 “Микробные и вирусные сообщества в биопленках пресноводных экосистем…”) на оборудовании приборного ЦКП физико-химического ультрамикроанализа ЛИН СО РАН.
Авторы выражают благодарность зав. лаб. гидрохимии и химии атмосферы ЛИН СО РАН д. г. н., проф. Т.В. Ходжери к. х. н., с. н. с. И.И. Маринайте за любезно предоставленное оборудование GC-2010 Plus (Shimadzu) и реактивы, благодарность академику РАН, д. х. н., проф., г. н. с. М.А. Грачеву и д. б. н., проф., зав. отделом ультраструктуры клетки ЛИН СО РАН Е.В. Лихошвай за предоставленное оборудование приборного центра коллективного пользования “Ультрамикроанализ”. Авторы выражают особую благодарность научному руководителю, зав. лаб. хроматографии ЛИН СО РАН, к. х. н., доц. А.Г. Горшкову за неоценимую помощь.
Список литературы
Кулаковская Е.В., Миронов А.А. Устойчивость к целлобиозолипидам и особенности липидного состава у дрожжей // Прикладная биохимия и микробиология. 2016. Т. 52. № 6. С. 584.
Suzuki K.I., Komagata K. Taxonomic significance of cellular fatty acid composition in some corineform bacteria // Int. J. Syst. Bacteriol. 1983. V. 83. № 2. P. 188.
O’Leary W.M. The fatty acid of bacteria // Bacteriol. Rev. 1962. V. 26. № 4. P. 421.
Takai K., Inoue A., Horikoshi K. Themaerobacter marianensis gen. nov., sp. nov., an aerobic extremely thermophilic marine bacterium from the 11000 m deep Mariana Trench // Int. J. Syst. Bacteriol. 1999. V. 49. P. 619.
Spanevello M., Yamamoto H., Patel B.K.C. Thermaerobacter subterraneus sp. nov., a novel aerobic bacterium from the Great Artesian Basin of Australia, and emedation of the genus Thermaerobacter // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 795.
Řezanka T., Dor I., Prell A., Dembitsky V.M. Fatty acid composition of six freshwater wild cyanobacterial species // Folia Microbiol. 2003. V. 48. № 1. P. 71.
Řezanka T., Viden I., GO J.V., Dor I., Dembitsky V.M. Polar lipids and fatty acids of three wild cyanobacterial strains of the genus Chroococcidiopsis // Folia Microbiol. 2003. V. 48. № 6. P. 781.
Li R., Yokota A., Sugiyama J., Watanabe M., Hiroki M., Watanabe M.M. Chemotaxonomy of planktonic cyanobacteria based on non-polar and 3-hydroxy fatty acid composition // Phycoiogicai Res. 1998. V. 46. № 1. P. 21.
Guides A.C., Amaro H.M., Barbosa C.R., Pereira R.D., Malcata F.X. Fatty acid composition of several wild microalgae and cyanobacteria, with a focus on eicosapentaenoic, docosahexaenoic and α-linolenic acids for eventual dietary uses // Food Res. Int. 2001. V. 44. P. 2721.
Younsi M., Ramanandraibe E., Bonaly R., Donner M., Coulon J. Amphotericin B resistance and membrane fluidity in kluyveromyces lactis strains // Antimicrob. Agents Chemother. 2000. V. 44. №7. P. 1911.
Zhila N.O., Kalacheva G.S. Effect of salinity on the biochemical composition of the alga Botryococcus braunii Kütz IPPAS H-252 // J. Appl. Phycol. 2011. V. 23. P. 47.
Wagenen J.V., Miller T.W., Hobbs S., Hook P., Crowe B., Huesemann M. Effect of light and temperature on fatty acid production in Nannochloropsis Salina // Energies. 2012. V. 5. P. 731.
Temperature adaptation in a changing climate: nature at risk (Climate & Weather) / Eds. Storey K.B., Tanino K.K. CAB International, 2012, 238 p.
Кирпенко Н.И., Усенко О.М., Мусий Т.О. Влияние аллелопатического фактора на формирование соотношения белков, углеводов и липидов в клетках зеленых микроводорослей // Гидробиол. журн. 2016. Т. 52. № 6. С. 74.
Браун А.Д., Моженок Т.П. Неспецифический адаптационный синдром клеточной системы. Л.: Наука, 1987. 232 с.
Abedi E., Sahari A.M. Long-chain polyunsaturated fatty acid sources and evaluation of their nutrition and functional properties. Review // Food Sci. Nutr. 2014. V. 2. № 5. P. 1.
Li Y., Naghdi F.G., Garg S., Adarme-Vega T.C., Thurecht K.J., Ghafor W.A., Tannock S., Schenk M. A comparative study: the impact of different lipid extraction methods on current microalgal lipid research // Microbial Cell Factories. 2014. V. 13. № 14. P. 1.
Hiltunen M. The role of zooplankton in the trophic transfer of fatty acids in boreal lakes food web. Joensu, Finland: Publications of the University of Eastern Finland Dissertations in Forestry and Natural Sciences, 2015. № 210. 66 p.
Базарсадуева С.В., Раднаева Л.Д. Жирнокислотный состав глубоководных байкальских амфипод Ommatogammarus albinus // Химия в интересах устойчивого развития. 2013. № 21. 533.
Мурзина С.А., Нефедова З.А., Немова Н.Н. Влияние жирных кислот (маркеров пищевых источников рыб) на механизмы адаптации в условиях высоких широт // Труды Карельского научного центра. 2012. № 2. С. 18.
Perhap G.M. Arhonditsis G.B., Brett M.T. Modelling the role of highly unsaturated fatty acids in planctonic food web processes: A mechanistic approach // Environ. Rev. 2012. V. 20. P. 1.
Глызина О.Ю., Дзюба Е.В., Смирнова-Залуми Н.С., Башарина Т.Н., Смирнов В.В., Глызин А.В. Спектр жирных кислот различных морфоэкологических групп байкальского омуля Coregonus autumnalis migratorius (Georgi, 1775) // Химия в интересах устойчивого развития. 2010. № 18. С. 139.
Авеина Е.С., Пинтаева Е.Ц., Раднаева Л.Д. Жирнокислотный состав подкожного жира байкальской нерпы разного возраста // Вестник Бурятского гос. ун-та. 2009. № 3. С. 61.
Kozlova T.A., Khotimchenko S.V. Lipids and fatty acids of two pelagic cottoid fishes (Comephorus spp.) endemic to Lake baikal // Comp. Biochem. Physiol. B. Biochem. Mol. Biol. 2000. V. 126. № 4. P. 477.
Басова М.М. Жирнокислотный состав некоторых видов микроводорослей // Альгология. 2005. Т. 15. № 4. С. 415.
Сущик Н.Н. Роль незаменимых жирных кислот в трофометаболических взаимодействиях в пресноводных экосистемах (обзор) // Журн. общ. биол. 2008. Т. 69. № 4. 299.
Дейнека В.И., Дейнека Л.А., Габрук Н.Г., Фофанов Г.М., Манохина Л.А., Сидельникова Н.А. Анализ растительных масел с использованием ВЭЖХ // Журн. аналит. химии. 2003. Т. 58. № 12. С. 1294. (Deineka V.I., Gabruk N.G., Fofanov G.M., Deineka L.A., Manokhina L.A., Sidel’nikova N.A. Analysis of vegetable oils by high-performance liquid chromatography // J. Analyt. Chem. 2003. V. 58. № 12. P. 1160.)
Куличенко С.А., Шевченко А.М. Алкалиметрическое определение кислотного числа масел и жиров в ПАВ-стабилизированных эмульсиях // Журн. аналит. химии. 2003. Т. 58. № 1. с. 58. (Kulichenko S.A. and Shevchenko A.M. Alkalimetric Determination of the Acid Number of Oils and Fats in Surfactant-Stabilized Emulsions // J. Analyt. Chem. 2003. V. 58. № 1. P. 58.)
ГОСТ 5476-80 (СТ-СЭВ 4715-84) Масла растительные. Методы определения кислотного числа. Масла растительные. Методы анализа. М.: Изд-во стандартов, 1998. 36 с.
Лапшина Т.М., Шарудина С.Я., Турьян Я.И. Способ определения кислотного числа масел и жиров. Патент СССР 1825423 АЗ. Заявка 5008066/13 от 01.11.1991, опубл. 30.06.1993.
Лапшина Т.М., Турьян Я.И., Данильчук С.И. pH-метрическое определение кислотного числа масел // Журн. аналит. химии. 1991. Т. 46. № 6. С. 1150. (Lapshina T.M., Tur’yan Ya.I., Danil’chuk S.I. pH-Metric determination of acid numbers for oils // J. Analyt. Chem. 1991. V. 46. № 6. P. 1150.)
Эшворт М.Р.Ф. Титриметрические методы анализа органических соединений. Методы косвенного титрования. М.: Химия, 1972. Т. 2. 534 с.
Рувинский О.Е., Выскубова Е.Н., Шарудина С.Я. Редокс-потенциометричекое измерение кислотного числа растительных масел без проведения титрования // Изв. ВУЗов. Пищевая технол. 2000. № 4. С. 108.
Стрельникова Е.Б., Стахина Л.Д., Петренко Т.В. Концентрирование нефтяных органических кислот и кетонов двуступенчатой хроматографией с использованием модифицированного сорбента // Журн. аналит. химии. 2009. Т. 64. № 1. С. 12. (Strel’nikova E.B., Stakhina. L.D., Petrenko T.V. Preconcentration of petroleum organic acids and ketones by two-stage chromatography using a modified adsorbent// J. Analyt. Chem. 2009. V. 64. № 1. P. 8.)
Иванова Л.В., Кошелев В.Н., Сокова Н.А., Буров Е.А., Примерова О.В. Нефтяные кислоты и их производные. Получение и применение (обзор) // Труды РГУ нефти и газа им. И.М. Губкина. 2013. № 1(270). С. 68.
Рахманько Е.М., Жилко В.В., Егоров В.В. Фотометрическое определение примесей карбоновых кислот в полимерах и органических жидкостях с использованием ионнного ассоциата тринонилоктадециламмония с бромтиоловым синим в качестве окрашенного реагента // Журн. аналит. химии. 2005. Т. 60. № 1. С. 22. (Rakhman’ko E.M., Zhilko V.V., Egorov V.V. Photometric determination of carboxylic acid impurities in polymers and organic liquids with the use of the ion pair of trinonyloctadecylammonium and bromothymol blue as the colored reagent // J. Analyt. Chem. 2005. V. 60. № 1. P. 16.)
Folch J., Lees M., Stanley G.H.S. A simple method for the isolation and purification of total lipids from animal tissues // J. Biol. Chem. 1957. V. 226. № 1. P. 497.
Рыжова Г.Л., Тюнина М.А., Дычко К.А. Определение жирных кислот в продуктах вибромагнитной переработки сапропеля методом хромато-масс-спектрометрии // Журн. аналит. химии. 2013. Т. 68. № 8. С. 808. (Ryzhova G.L., Tyunina M.A., Dychko K.A. Determination of fatty acids in products of the vibromagnetic treatment of sapropel by chromatography-mass spectrometry // J. Analyt. Chem. 2003. V. 68. № 8. P. 736.)
Blight E.G., Dyer W.J. A rapid method of total lipid extraction and purification // Canadian J. Biochem. Physiol. 1959. V. 37. № 8. P. 911.
Хасанов В.В., Макарычева А.И., Слижов Ю.Г. Определение алифатических кислот в природных водах с применением дистилляции и твердофазной экстракции // Журн. аналит. химии. 2016. Т. 71. № 10. С. 1075. (Khasanov V.V., Makarycheva A.I., Slizhov Yu.G. Determination of aliphatic acids in natural waters using distillation and solid-phase extraction // J. Analyt. Chem. 2003. V. 68. № 8. P. 1028.)
Уколов А.И., Орлова Т.И., Савельева В.И., Радилов А.С. Хромато-масс-спектрометрическое определение свободных жирных кислот в плазме крови и моче с использованием экстрактивного алкилирования // Журн. аналит. химии. 2015. Т. 70. № 9. С. 975. (Ukolov A.I., Orlova T.I., Savel’eva E.I., Radilov A.S. Chromatographic–mass spectrometric determination of free fatty acids in blood plasma and urine using extractive alkylation // J. Analyt. Chem. 2015. V. 70. № 9. P. 1123.)
Орлова Т.И., Уколов А.И., Савельева В.И., Радилов А.С. Определение свободных и этерифицированных жирных кислот в плазме крови методом газовой хроматографии с масс-селективным детектированием // Аналитика и контроль. 2015. Т. 19. № 2. С. 183.
Kornprobst J.M., Barnathan G. Demospongic Acids Revisted // Marine Drugs. 2010. V. 8. № 10. P. 2569.
Chiu S.Y., Kao C.Y., Chen C.H., Kuan T.C., Ong S.C., Lin C.S. Reduction of CO2 by a high-density culture of Chlorella sp. in a semicontinuous photobioreactor // Bioresource Technol. 2008. V. 99. № 9. P. 3389.
Tsai H.P., Chuang L.T., Chen C.N.N. Production of long chain omega-3 fatty acids and carotenoids in tropical areas by a new heat-tolerant microalga Tetraselmis sp. DS3 // Food Chem. 2016. V. 1. № 192. P. 682.
Latyshev N.A., Zhukova N.V., Efremova S.M., Imbs A.B., Glysina O.Y. Effect of habitat on participation of symbionts in formation of the fatty acid pool of freshwater sponges of Lake Baikal // Comp. Biochem. Physiol. 1992. V. 102B. № 4. P. 961.
Глызина О.Ю., Базарсадуева С.В., Глызин А.В., Раднаева Л.Д. Изменение липидного состава пресноводных губок при повышении среды обитания // Экология. 2016. № 2. С. 152.
Родькина С.А. Зависимость состава жирных кислот морской губки Halichondria panicea от сезона, места сбора и морфологических особенностей // Известия ТИНРО. 2003. Т. 135. С. 327.
Iverson S.J., Lang S.L., Cooper M.H. Comparison of the Blight and Dyer and Folch methods for total lipid determination in a broad range of marine tissues // Lipids. 2001. V. 36. № 11. P. 1283.
Christie W.W. Preparation of ester derivatives of fatty acids for chromatographic analysis / Advances in Lipid Methodology. 1993. V. 2. P. 69.
Leveille J.-C., Amblard C., Bourdier G. Fatty acids as specific algal markers in a natural lacustrian phytoplankton // J. Plankton Res. 1997. V. 19. № 4. P. 469.
Иванкин А.Н., Олиференко Г.Л., Куликовский А.В., Чернуха И.М., Семенова А.А., Спиридонов К.И., Насонова В.В. Определение ненасыщенных жирных кислот с мигрирующей двойной связью в сложных биологических матрицах методом газовой хроматографии с пламенно-ионизационным и масс-спектрометрическим детектированием // Журн. аналит. химии. 2016. Т. 71. № 11. С. 1188. (Ivankin A.N., Oliferenko G.L., Kulikovskii A.V., Chernukha I.M., Semenova A.A., Spiridonov K.I., Nasonova V.V. Determination of unsaturated fatty acids with a migrating double bond in complex biological matrices by gas chromatography with flame ionization and mass spectrometry detection // J. Analyt. Chem. 2016. V. 71. № 11. P. 1131.).
Taipale S., Strandberg U., Peltomaa E., Galloway A., Ojala A., Brett M.T. Fatty acid composition as biomarkers of freshwater microalgae: analysis of 37 strains of microalgae in 22 genera and in seven classes // Aquat Microbiol. Ecol. 2013. V. 71. P. 165
Li Y., Naghdi F.G., GArg S., Adarme-Vega T.C., Thurecht K.J., Ghafor W.A., Tannock S., Schenk P.M. A comparison study: The impact of different lipid extraction methods on current microalgal lipid research // Microbial Cell Factories. 2014. V. 13. Article number 14. DOI 101186/1475-2859-13-14
Смагунова А.Н. Методы математической статистики в аналитической химии. Иркутск: Изд-во Иркут. гос. ун-та, 2008. 339 с.
Albert B.B., Cameron-Smith D., Hofman P.L., Cutfield W.S. Oxidation of marine omega-3 supplements and human health. Review article // BioMed Res. V. 2013. Article 464 921. https://doi.org/10.1155/2013/464921
James A.T., Martin A.G.P. Gas-liquid chromatography: the separation and identification of methyl esters of saturated and unsaturated acids from formic acid to n-octadecanoic acid // Biochem. J. 1956. V. 63. № 1. P. 144.
Brunton N.P., Mason C., Collins M.J.J. Rapid microwave assisted preparation of fatty acid methyl esters for the analysis of fatty acid profiles in food // Журн. аналит. химии. 2015. Т. 70. № 10. С. 1056.
Fournier V., Destaillats F., Juaneda P., Dionisi F., Lambelet P., Sebedio J.-L., Berdeaux O. Thermal degradation of long-chain polyunsaturated fatty acids during deodorization of fish oil // Eur. J. Lipid Sci. Technol. 2006. № 108. P. 33.
Ichihara K., Fukubayashy Y. Preparation of fatty acid methyl esters for gas-liquid chromatography // J. Lipid Res. 2010. V. 51. P. 635.
Sicko-Goad L., Lazinsky D., Hall J., Simmons M.S. Effects of chlorinated benzenes on diatom fatty acid composition and quantitative morphology. I. 1,2,4,-Trichlorobenzene // Arch. Environ. Contam. Toxicol. 1989. V. 18. P. 629.
Zaikin V., Halket J.M. A Handbook of Derivatives for Mass Spectrometry. UK: IM Publications LLP, 2009. 514 p.
Rosenfeld J.M. Application of analytical derivatization to the quantitative and qualitative determination of fatty acids // Anal. Chim. Acta. 2002. V. 465. P. 93.
ГОСТ Р 51486-99. Масла растительные и жиры животные. Получение метиловых эфиров жирных кислот. М.: ИПК Издательство стандартов, 2001. 8 с.
Верещагин А.Л., Глызина О.Ю., Башарина Т.Н., Сафонова Т.А., Латышев Н.А., Любочко С.А., Корнева Е.С., Петрова Д.П., Анненков В.В., Даниловцева Е.Н., Чебыкин Е.П., Волокитина Н.А., Грачев М.А. Культивирование пресноводной диатомеи Synedra acus в столитровом фотобиореакторе и оценка состава полученной биомассы // Биотехнология. 2008. № 4. С. 55.
Leu E., Daase M., Schulz K.G., Stuhr A., Riebesell U. Effect of ocean acidification on the fatty acid composition of a natural plankton community // Biogeosciences. 2013. V. 10. P. 1143.
Maghraby D.M.E., Fakhry E.M. Lipid content and fatty acid composition of Mediterranian macro-algae as dynamic factors for biodiesel production // Oceanologia. 2015. V. 57. P. 86.
Christie W.W. Gas Chromatography and Lipids. Ayr, Scotland: The Oily Press, 1989. 307 p.
Shishlyannikov S.M., Nikonova A.A., Bukin U.S., Gorshkov A.G. Fatty acid trophic markers in Lake Baikal phytoplankton: a comparison of endemic and cosmopolitan diatom-dominated phytoplankton assemblages // Ecol. Indic. 2018. V. 85. P. 878.
Widdel F., Back F. The genus Desulfotomaculum / The Prokaryotes. 3rd Ed. / Eds. Dworkin M., Falkow S., Rosenberg E., Schleifer K.-H., Stackebrandt E. N.Y.: Springer, 1992. V. 4. P. 787.
Gladyshev M.I., Emelianova A.Y., Kalachova G.S. Gut content analysis of Gammarus lacustris from a Siberian lake using biochemical and biophysical methods // Hydrobiologia. 2000. V. 431. P. 155.
Koussoroplis A.-M., Bec A., Perga M.-E., Koutrakis E., Desvilettes C., Bourdier G. Nutritional importance of minor dietary sources for leaping grey mullet Liza saliens (Mugilidae) during settlement: insights from fatty acid δ13C analysis // Mar. Ecol. Prog. Ser. 2010. V. 404. P. 207.
Krop H.B., v. Velzen J.M., J.R. Parsons, H.A.J.Govers. Determination of environmentally relevant physical-chemical properties of some fatty acid esters // J. Am. Oil Chem. Soc. 1997. V. 74. № 3. P. 309.
Sander R. Compilation of Henry’s law constants for inorganic and organic species of potential importance in environmental chemistry. Ver. 3. Germany: Air Chemistry Department, 1999. 107 p.
Socorro J.-V., M. del Pilar S.-S. Growth and fatty acid profiles of microalgae species isolated from the Baja California Peninsula, México // Lat. Am. J. Aquat. Res. 2016. V. 44. № 4. P. 689.
FAPAS – Food Chemistry Proficiency Test Report 14165. Omega-3, Omega-6 and Omega-9 Fatty Acids in Fish Oil. September – November 2016. The report was prepared by Michael Knaggs. FAPAS. Fera Science Ltd (Fera). National Agri-Food Innovation Campus. Sand Hutton, York, UK, 2016. P. 38.
Захарова Ю.В., Сухих А.С. Хроматографический анализ жирных кислот клеточных стенок бифидобактерий с различной гидрофобностью // Сорбционные и хроматографические процессы. 2015. Т. 15. № 6. С. 776.
Falk-Petersen S., Sargent J.R., Henderson J., Hegseth E.N., Hop H., Okolodkov Y.B. Lipids and fatty acids in ice algae and phytoplankton from the Marginal Ice Zone in the Barents Sea // Polar Biol. 1998. V. 20. P. 41.
Бабицкая В.Г., Черноок Т.В., Щерба В.В., Пучкова Т.А., Филимонова Т.В., Осадчая О.В. Характеристика липидов глубинного мицелия грибов // Вестн. Белорус. гос. ун-та. Сер. 2. Химия. Биология. География. 2009. Т. 4. Ч. 1. С. 101.
Вельков В.В. Свободные жирные кислоты – фактор риска инсулинорезистентности и ишемии: перспективы для оценки рисков и диагностики // ЛАБОРАТОРИЯ. Журн. для врачей. 2008. № 1. С. 16.
Sakurai T., Miyazawa S., Hashimoto T. Effects of di-(2-ethylhexyl)phthalate administration on carbohydrate and fatty acid metabolism in rat liver // J. Biochem. 1978. V. 83. № 1. P. 313.
Xu Y., Agrawal S., Cook T.J., Knipp G.T. Maternal di-(2-ethylhexyl)-phthalate exposure influences essential fatty acid homeostasis in rat placenta // Placenta. 2008. V. 29. № 11. P. 962.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии









