Журнал аналитической химии, 2020, T. 75, № 10, стр. 921-930
Особенности хромато-масс-спектрометрической идентификации моноалкилфталатов
И. Г. Зенкевич *
Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: izenkevich@yandex.ru
Поступила в редакцию 06.02.2020
После доработки 05.03.2020
Принята к публикации 07.05.2020
Аннотация
Сходство масс-спектров с ионизацией электронами различных алкиловых эфиров бензол-1,2-дикарбоновой (фталевой) кислоты предъявляет особые требования к надежности идентификации моноалкилфталатов, часто опознаваемых как диалкилфталаты и наоборот. Предложен оригинальный масс-спектрометрический критерий групповой идентификации (отнесения к подгруппе гомологов) моноалкилфталатов, предполагающий вычисление суммарной относительной интенсивности пиков ионов с m/z > 170. В масс-спектрах моноалкиловых эфиров эта величина не превышает 1%, тогда как в случае диалкиловых эфиров – варьирует в пределах от 1 до 172%. В пределах установленных подгрупп изомеров для дальнейшей детализации результатов идентификации становится эффективным использование гомологических инкрементов индексов удерживания, iRI = RI – 100x, где x = int(M/14). По предварительно определенным значениям iRI с использованием соотношения М ≈ 0.14(RI – iRI) + y возможна оценка молекулярных масс соединений, в масс-спектрах которых сигналы молекулярных ионов не регистрируются или малоинтенсивны (в том числе моноалкилфталатов). Кроме того, величины iRI во многих случаях информативны для оценки числа разветвлений sp3-углеродного скелета молекул (Z) на основании регрессионных соотношений вида iRI = aZ + b. Рассмотрение гомологических инкрементов индексов удерживания диалкилфталатов позволило выявить аномально выраженную зависимость их значений от числа атомов углерода в алкильных фрагментах молекул: от +125 (СН3) до –33 (С10Н21). В подгруппе моноалкилфталатов подобные аномалии не наблюдаются.
Основой эффективности современной хромато-масс-спектрометрии как метода идентификации компонентов сложных смесей органических соединений является существование подробного и хорошо систематизированного информационного обеспечения (масс-спектры с ионизацией электронами, ИЭ, и газохроматографические индексы удерживания на стандартных неполярных и полярных фазах). Так, версия 2017 г. базы данных NIST [1] содержит масс-спектры ИЭ 267 376 соединений и газохроматографические индексы удерживания (RI) 99400 соединений. Однако как отдельные соединения, так и их совокупности (гомологические ряды, группы конгенеров, изомеров и др.) по объективным причинам остаются не представленными в базах данных. Из главных причин отсутствия информации можно назвать следующие [2, 3]:
1) Практическое применение тех или иных соединений неочевидно, что обусловливает отсутствие интереса к ним со стороны химиков-синтетиков.
2) Соединения не были обнаружены в природных объектах; нет сведений об их биологической активности, токсичности и т.д.
3) Соединения нестабильны и/или обладают высокой реакционной способностью.
4) Непосредственное хроматографическое разделение невозможно, требуется получение производных (дериватизация).
5) Синтез сложен или характеризуется низкими выходами.
6) Большое число изомеров высших гомологов любых рядов, исчерпывающая характеристика всего многообразия которых невозможна.
7) Можно полагать, что ошибочная идентификация тех или иных аналитов, встречающихся в реальных образцах, иногда обусловлена именно недостатком информационного обеспечения и сходством масс-спектров соединений разных классов.
Отсутствие информации в сочетании со сходством масс-спектров соединений разных групп является основной причиной большого числа ошибок II рода [4]11. Одну из обширных групп плохо охарактеризованных соединений образуют неполные эфиры как органических, так и неорганических многоосновных кислот. Из производных неорганических кислот можно отметить диалкилтиофосфаты, масс-спектры которых с ионизацией электрораспылением трудно отличимы от спектров триалкиловых эфиров монотиофосфорной кислоты [5]. Для кислых эфиров органических поликарбоновых кислот эта проблема выявлена для моноалкиловых эфиров бензол-1,2-дикарбоновой кислоты (моноалкилфталатов) [6, 7], масс-спектры ИЭ которых сходны с масс-спектрами диалкилфталатов. Причинами сходства масс-спектров являются аналогичные закономерности фрагментации: в масс-спектрах моноэфиров C6H4(CO2H)(CO2CnH2n+ 1) регистрируются сигналы первичных осколочных ионов [M–CnH2n+ 1O]+ → → [C6H4(CO)2OH]+ c m/z 149, сигналы которых максимальны. Возможен альтернативный двухстадийный путь образования этих ионов, а именно [M–CnH2n –1] (m/z 167) → [M–CnH2n– 1–H2O]+ → → [C6H4(CO)2OH]+ (m/z 149). Для более подробно охарактеризованных диэфиров C6H4(CO2CnH2n + 1)2 [8] аналогичные ионы с m/z 149 образуются в две стадии M+. → [M–CnH2n+ 1O]+ → [M–CnH2n+ 1O–CnH2n]+ → [C6H4(CO)2OH]+ (m/z 149), но возможна и альтернативная трехстадийная последовательность процессов фрагментации M+. → [M–CnH2n–1]+ → [M–CnH2n –1–CnH2n]+ (m/z 167) → → [M–CnH2n – 1–CnH2n–H2O]+ → [C6H4(CO)2OH]+ (m/z 149). Сигналы углеводородных ионов [CmH2m+ 1]+, [CmH2m– 1]+ (m < n) и других в масс-спектрах всех эфиров фталевой кислоты недостаточно характеристичны. Перечисленные факторы в сочетании с низкими интенсивностями сигналов молекулярных ионов объясняют сложности аналитической дифференциации моно- и диалкилфталатов.
Сообщалось об обнаружении моно(2-этилгексил)фталата в составе эфирных масел некоторых растений [9–12], однако такой эфир образуется, наиболее вероятно, в результате частичного гидролиза бис(2-этилгексил)фталата – одного из самых распространенных пластификаторов полимерных композиций из поливинилхлорида [13]. Токсические эффекты этого пластификатора рассмотрены в обзоре [14]. Другие примеры обнаружения моноалкилфталатов в различных объектах упомянуты в работе [7]. Однако проверка правильности их идентификации в большинстве случаев приводит к выявлению многочисленных несоответствий и ошибок. Так, например, по данным базы [1] RI монобутилфталата равен 1828 и согласуется со значениями RI других гомологов. В то же время в работе [9] для этого же моноэфира указано явно ошибочное (заниженное) значение RI = 1520. Для монобутилфталата известен индекс удерживания на стандартной полярной фазе [10] (RI = 2552), однако он представляется слишком малым для столь полярного соединения. Причиной такого предположения является недостаточно большая разность RI на стандартной полярной и неполярной (1849 [1]) фазах, равная всего 2552 – 1828 = 724, тогда как, например, для незамещенной бензойной кислоты такая разность по данным [1] может быть оценена как (2427 ± 22) – ‒ (1170 ± 20) = 1247 ± 30.
Некоторые важные свойства моноалкилфталатов установлены сравнительно недавно. Показано, что такие эфиры нестабильны в условиях газохроматографического разделения и частично разлагаются в хроматографической колонке с образованием соответствующих спиртов и фталевого ангидрида [6, 7]. Возможность такого разложения при меньших температурах и структурная аналогия, в частности, монометилфталата C6H4(CO2H)COOCH3 и ацетилсалициловой кислоты (аспирин) C6H4(CO2H)OCOCH3 позволили предположить, что именно нестабильность моноалкилфталатов может обусловливать их токсичность [7].
Детальное рассмотрение справочных значений индексов удерживания диалкилфталатов позволяет выявить такую важную проблему, как недостаточная надежность соотнесения их значений со структурами соединений. Возможные несоответствия могут быть обусловлены как ошибочной идентификацией фталатов в реальных образцах, так и небрежностями используемой номенклатуры. Один и тот же префикс “изо” в названиях фталатов может отражать разные варианты разветвлений углеродного скелета или относиться к техническим смесям нескольких изомеров. Дополнительной причиной разброса RI могут быть различия в полярности стандартных неполярных полидиметилсилоксановых неподвижных фаз и их аналогов, содержащих 5% фенильных групп (по принятой в базе данных [1] классификации их относят к разряду semi-standard). Так, по данным [1] значение RI диоктилфталата C24H38O4 (нет разветвлений углеродного скелета) на стандартной неполярной фазе составляет 2686 ± 3 ед. инд. (см. табл. 1), но для изомерного ему децил 2-этилбутилфталата (одно разветвление углеродного скелета) на фазе с 5% фенильных групп известное значение RI больше (2701), что не согласуется с общепризнанным влиянием числа таких разветвлений на индексы удерживания. Однако при этом оценка RI на стандартной неполярной фазе по аддитивной схеме [15] еще больше (2768), поскольку она базируется на значениях RI других гомологов. Столь заметные несоответствия, во-первых, делают неэффективным использование подобных ненадежных справочных данных для идентификации, а, во-вторых, заставляют усомниться, что значение 2686 ± 3 действительно принадлежит ди-н-октилфталату. В то же время RI бис(2-этилгексил)фталата равен 2505 ± 4, что представляется слишком низким для изомера с двумя разветвлениями углеродного скелета, тогда как для бис(2,4,4-триметилпентил)фталата (шесть разветвлений) он достигает 2587, что слишком велико и не согласуется с предыдущей величиной. К сожалению, исправление подобных несоответствий требует либо дополнительной экспериментальной проверки, либо использования специальных алгоритмов “перекрестного” контроля справочных данных.
Таблица 1.
Газохроматографические индексы удерживания некоторых диалкиловых эфиров фталевой кислоты (по данным базы [1]) и их гомологические инкременты в зависимости от суммарного числа разветвлений углеродного скелета алкильных заместителей, iRI(Z)
| Диалкилфталат | Мол. масса | RI [1] | iRI | Число разветвлений углеродного скелета |
|---|---|---|---|---|
| Диметил | 194 | 1425 ± 10 | 125* | 0 |
| Диэтил | 222 | 1564 ± 13 | 64 | 0 |
| Дипропил | 250 | 1744 ± 8 | 44 | 0 |
| Диизопропил | 250 | 1640 ± 1 | −60 | 2 |
| Дибутил | 278 | 1924 ± 12 | 24 | 0 |
| Диизобутил | 278 | 1850 ± 16 | −50 | 2 |
| Ди-(2-бутил) | 278 | 1855** | −45 | 2 |
| Этил, 2-этилбутил | 278 | 1939 | 39 | 1 |
| Этил, 3-гексил | 278 | 1888 | −12 | 1 |
| Пропил, изопентил | 278 | 1936 | 36 | 1 |
| Бутил, изобутил | 278 | 1924 | 24 | 1 |
| Дипентил | 306 | 2122 ± 3 | 22 | 0 |
| Диизопентил | 306 | 2045 | −55 | 2 |
| Пентил, изопентил | 306 | 2132 | 32 | 1 |
| Пропил, 1-этилпентил | 306 | 2057 | −43 | 1 |
| Изопентил, 2-этилбутил | 306 | 2066 | −34 | 2 |
| Изобутил, 1,3-диметилбутил | 306 | 1986 | −114 | 3 |
| Пропил, 2,4-диметил-3-пентил | 306 | 2015 | −85 | 3 |
| Ди-неопентил | 306 | 1938 | −162 | 4 |
| Дигексил | 334 | 2306 ± 2 | 6 | 0 |
| Дигептил | 362 | 2495 ± 4 | −5 | 0 |
| Диоктил | 390 | 2686 ± 3 | −14 | 0 |
| Динонил | 418 | 2876 | −24 | 0 |
| Дидецил | 446 | 3067 | −33 | 0 |
| Средние значения iRI (Z): | +11 ± 31 (0, 1) −49 ± 10 (2) −100 ± 21 (3) −162 (4) |
|||
Таким образом, достоверная хромато-масс-спектрометрическая идентификация моноалкилфталатов с использованием надежных значений аналитических параметров относится к числу актуальных задач. В число таких параметров обычно входят стандартные масс-спектры с ионизацией электронами и индексы удерживания на стандартных неполярных неподвижных фазах. Однако повышение надежности справочных данных и, как следствие, результатов идентификации на их основе заставляет обратиться к рассмотрению “гибридных” величин, таких как гомологические инкременты индексов удерживания, объединяющих масс-спектрометрическую и хроматографическую информацию.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Описание синтеза моноалкилфталатов из фталевого ангидрида и соответствующих спиртов в присутствии каталитических количеств ортофосфорной кислоты, условия их хромато-масс-спектрометрического определения и полные масс-спектры ИЭ (70 эВ) моноалкилфталатов приведены в работах [6, 7]. Масс-спектры диалкилфталатов для вычисления спектра ионных серий ряда заимствованы как из доступных баз данных, так и получены экспериментально. Ниже обсуждаются газохроматографические индексы удерживания моноалкилфталатов и их комбинированные хромато-масс-спектрометрические характеристики в сравнении с диалкилфталатами. Статистическую обработку данных и построение графиков проводили с использованием программного обеспечения ORIGIN (версии 4.1 и 8.2).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение и применение гомологических инкрементов индексов удерживания. Масс-спектрометрические и газохроматографические характеристики аналитов допускают совместную интерпретацию, в том числе в форме гомологических инкрементов индексов удерживания (iRI):
где х = int(M/14), М – молекулярное массовое число (целочисленное), int – функция, обозначающая целую часть числа (эквивалентно записи M = 14x + yМ), уМ – номер гомологической группы соединения, yМ ≡ M(mod14).Гомологические инкременты индексов удерживания наряду с аналогичными инкрементами других свойств предложены в середине 1980-х гг. [16] с целью использования при хромато-масс-спектрометрической идентификации аналитов. Как и другие дифференциальные аналитические параметры [17], они обладают свойством инвариантности в пределах гомологических рядов (с обсуждаемыми ниже некоторыми оговорками) и, следовательно, применимы на стадии групповой идентификации (отнесения к соответствующим рядам).
По определению, хроматографические индексы удерживания – аддитивные величины: переход к следующему гомологу за счет добавления гомологической разности – фрагмента СН2 – увеличивает значения RI приблизительно на 100 ед. инд., что делает их непосредственное сравнение для разных гомологов невозможным. Однако такие инварианты как iRI допускают сравнение хромато-масс-спектрометрических характеристик разных членов рядов. Отсюда следует еще одно важное применение гомологических инкрементов индексов удерживания – выявление ошибочных или сомнительных значений RI и в целом повышение надежности справочной информации.
Особенностью iRI, как и самих индексов удерживания изомеров, является их зависимость от числа разветвлений углеродного скелета молекул (Z). В первом приближении можно не дифференцировать топологическую неэквивалентность различных разветвлений sp3-углеродного скелета молекул, но следует учитывать, что третичные атомы углерода соответствует одному, а четвертичные – двум разветвлениям. Зависимость iRI = f(Z) несколько усложняет процедуру групповой идентификации, так как приходится принимать во внимание несколько альтернативных значений Z, однако подобное сравнение гипотез относится к типичным приемам интерпретации масс-спектрометрической информации.
Отсутствие или низкая интенсивность сигналов молекулярных ионов в масс-спектрах (наиболее типично для масс-спектров ИЭ) делает невозможным определение значений М и, следовательно, вычисление iRI. Однако именно в таких случаях становится актуальным решение “обратной” задачи: оценки молекулярных масс аналитов, в масс-спектрах которых сигналы молекулярных ионов не регистрируются или малоинтенсивны на основании предварительно определенных значений iRI. Подстановка в формулу (1) соотношения х = (M – yМ)/14 и решение полученного уравнения относительно М приводят к следующему выражению для оценки молекулярных массовых чисел:
Особенность округления вычисляемых значений М состоит в том, что его выполняют не до ближайшего целого числа, а до ближайшего значения М, сравнимого с уМ по модулю 14, или, в символике теории вычетов, М ≡ уМ(mod14). Такая задача рассмотрена на примерах гомологов рядов диалкилфосфонатов и триалкилфосфитов [18, 19].
Если располагать информацией о молекулярных массовых числах аналитов, то существование зависимостей iRI = f(Z) позволяет оценивать суммарное число разветвлений sp3-углеродного скелета алкильных фрагментов молекул по хромато-масс-спектрометрическим данным. Для удобства оценок такие зависимости можно использовать в виде обратных функций Z = φ(iRI). Зависимости iRI = f(Z) и Z = φ(iRI) − убывающие, т.е. чем больше суммарное количество разветвлений углеродного скелета молекул, тем меньше значения iRI (с учетом знаков), которые с приемлемой точностью могут быть аппроксимированы уравнениями линейной регрессии:
Коэффициенты а и b вычисляют методом наименьших квадратов.
Для многих гомологических рядов области значений iRI при разных Z не перекрываются друг с другом, что соответствует однозначному определению числа разветвлений по значениям iRI. Решение подобной задачи проиллюстрировано [3] на примере серии гомологов ряда 2,2-диалкилзамещенных 1,3-диоксоланов.
Кроме перечисленных примеров, значения iRI рекомендованы в качестве нового критерия полярности органических соединений [20].
Гомологические инкременты индексов удерживания ди- и моноалкилфталатов. Рассмотрение значений iRI в ряду моноалкилфталатов приводит к важным заключениям относительно особенностей их идентификации. Учитывая отмеченное выше сходство масс-спектров различных эфиров фталевой кислоты, данные для моноалкилфталатов целесообразно рассматривать в постоянном сравнении с диалкилфталатами. В табл. 1 приведены газохроматографические индексы удерживания некоторых диалкиловых эфиров фталевой кислоты (по данным базы [1]) и их гомологические инкременты в зависимости от суммарного числа разветвлений углеродного скелета алкильных фрагментов молекул, iRI(Z). В нижней части таблицы сопоставлены средние значения 〈iRI(Z)〉 при одинаковых значениях Z, а на рис. 1а зависимость iRI(Z) представлена графически. Прямая линия соответствует уравнению линейной регрессии; параметры уравнения приведены в подписи к рис. 1.
Рис. 1.
Зависимости значений гомологических инкрементов индексов удерживания (iRI) от суммарного числа разветвлений углеродного скелета алкильных фрагментов молекул для диалкилфталатов (а), для моноалкилфталатов (б). Параметры уравнений линейной регрессии: (а): a = 21.2 ± 9.7, b = –37.9 ± 6.1, R = –0.813, S0 = 33; (б): a = 336 ± 6, b = –74 ± 7, R = ‒0.925, S0 = 19.
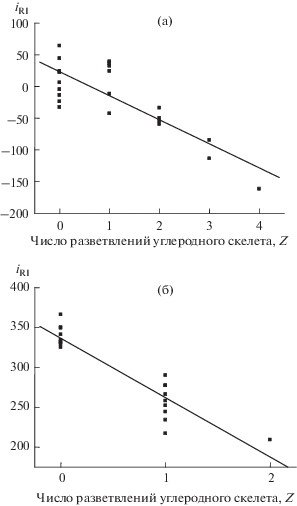
Выше отмечено, что увеличение суммарного числа разветвлений углеродного скелета алкильных фрагментов приводит к заметному уменьшению значений iRI: при Z = 2, 3 и 4 средние значения iRI составляют –49, –100 и –162. На этом “фоне” обращает на себя внимание отсутствие существенных отличий значений iRI для Z = 0 и 1, что хорошо видно на рис. 1. Подобное несоответствие проявляется в относительно невысокой абсолютной величине коэффициента корреляции (R = –0.813). Наиболее вероятной причиной этого могут быть отмеченные выше несоответствия справочных значений индексов удерживания диалкилфталатов структурам молекул, обусловленные как сложностями идентификации таких эфиров, так и неоднозначностью интерпретации префикса “изо” в названиях соединений этого класса. Еще одной возможной причиной может быть аномально выраженная зависимость iRI от числа атомов углерода в алкильных заместителях: их значения закономерно убывают от +125 при R = CH3 до –33 при R = С10Н21. Иными словами, если простейший гомолог – диметилфталат – представляет собой достаточно полярное соединение, более полярное, чем, например, 2-алканолы (для 2-бутанола М = 74, RI = 586 ± 5 [1], следовательно, iRI = 86) и лишь незначительно уступающее по полярности 2,3-алкандиолам (для 2,3-бутандиола М = 90, RI = 756 ± 9 [1] и, следовательно, iRI = 156), то дидецилфталат оказывается менее полярным, чем н-алканы, для которых значения iRI по определению равны нулю. Вместе с тем отсутствие различий значений iRI для Z = 0 и 1 позволяет утверждать, что по крайней мере часть справочных данных, особенно для диалкилфталатов с несимметричными алкильными фрагментами, заслуживает проверки и уточнения. С другой стороны, наблюдается хорошая корреляция индексов удерживания моно- и диалкилфталатов (с одинаковым числом атомов углерода в алкильных заместителях) друг с другом [7], что позволяет оценивать недостающие значения RI по данным для другой подгруппы гомологов.
В табл. 2 приведена аналогичная информация для моноалкиловых эфиров фталевой кислоты, включающая газохроматографические индексы удерживания и их гомологические инкременты в зависимости от суммарного числа разветвлений углеродного скелета алкильных заместителей, iRI(Z). Для повышения надежности результаты работ [6, 7] сопоставлены со значениями RI базы [1]; среднее значение их разности (с учетом знака для 11 пар гомологов) составляет +3 ± 10 ед. инд., что подтверждает надежность обоих независимых источников информации. Это немедленно сказывается на значениях iRI(Z), которые, в отличие от данных табл. 1, уже не демонстрируют никаких аномалий при Z = 0 и 1. Графическая интерпретация этой зависимости на рис. 1б подтверждает возможность однозначного установления числа разветвлений Z по значениям iRI, поскольку интервалы разброса величин iRI для разных Z, в отличие от рис. 1а, не перекрываются. Лучшая корреляция iRI(Z) сказывается и на абсолютной величине коэффициента корреляции, который в данном случае составляет –0.925. Большие положительные значения гомологических инкрементов индексов удерживания моноалкилфталатов (339 ± 13 при Z = 0) подтверждают их высокую полярность, которая сравнима с полярностью аренкарбоновых кислот (для бензойной кислоты М = = 122, RI = 1170 ± 20 [1], следовательно, iRI = 320) или фенолов (для п-крезола М = 108, RI = 1052 ± 4 [1], следовательно, iRI = 352). При этом для моноалкилфталатов не наблюдается заметного уменьшения значений iRI при увеличении числа атомов углерода в алкильных заместителях: их значения лишь незначительно убывают от 366 при R = CH3 до всего 331 при R = С10Н21. Следовательно, такой эффект в случае диалкилфталатов заслуживает более подробного рассмотрения.
Таблица 2.
Газохроматографические индексы удерживания моноалкиловых эфиров фталевой кислоты на неполярных фазах, содержащих 5% фенильных групп (по данным базы [1] и публикаций [6, 7]), и их гомологические инкременты в зависимости от суммарного числа разветвлений углеродного скелета алкильных заместителей, iRI(Z)
| Моноалкилфталат | Мол. масса | RI [1] | RI [7] | iRI | Число разветвлений углеродного скелета (Z) |
|---|---|---|---|---|---|
| Метил | 180 | 1530* | 1566 ± 18 | 366 | 0 |
| Этил | 194 | 1651 | 1641 ± 5 | 341 | 0 |
| Пропил | 208 | 1731 | 1734 ± 6 | 334 | 0 |
| Изопропил | 208 | 1667 | 1666 ± 2 | 266 | 1 |
| Бутил | 222 | 1828 | 1849 ± 11 | 349 | 0 |
| Изобутил | 222 | 1771 | 1777 ± 3 | 277 | 1 |
| 2-Бутил | 222 | 1764* | 1758 ± 3 | 258 | 1 |
| Пентил | 236 | 1926 | 1929 ± 11 | 329 | 0 |
| Изопентил | 236 | – | 1890 ± 7 | 290 | 1 |
| 2-Пентил | 236 | 1842 | 1844 ± 2 | 244 | 1 |
| Неопентил | 236 | 1809 | – | 209** | 2 |
| Гексил | 250 | 2023 | 2029 ± 6 | 329 | 0 |
| 2-Этилбутил | 250 | 1977 | – | 277 | 1 |
| Гептил | 250 | 2128 | 2132 ± 6 | 332 | 0 |
| 2-Гептил | 264 | – | 2017 ± 10 | 217 | 1 |
| Октил | 278 | 2236 | 2250 ± 17 | 350 | 0 |
| 2-Октил | 278 | 2143 | 2134 | 234 | 1 |
| 2-Этилгексил | 278 | 2152 | – | 252** | 1 |
| Нонил | 292 | 2325 | – | 325** | 0 |
| Децил | 306 | 2431 | – | 331** | 0 |
| Средние значения iRI (Z): | 339 ± 13 (0) 257 ± 23 (1) 209 (2) |
||||
Сигналы молекулярных ионов в масс-спектрах как моно-, так и диалкилфталатов малоинтенсивны, за исключением метилового и этилового эфиров, поэтому для них актуальна проблема оценки молекулярных массовых чисел. Достаточно простое применение соотношения (2) для этих целей может быть проиллюстрировано следующими примерами:
Дипентилфталат: RI = 2122 ± 3, iRI = +11 ± 31 (в предположении Z = 0). Тогда М ≈ 0.14 × (2122 – 11) + + 12 ≈ 307.5 → 306 ≡ 12(mod14) (правильный ответ).
Монопентилфталат: RI = 1929 ± 11, iRI = 339 ± 13 (в предположении Z = 0). Тогда М ≈ 0.14 × (1929 – ‒ 339) + 12 ≈ 234.6 → 236 ≡ 12(mod14) (правильный ответ).
Масс-спектрометрические различия моно- и диалкилфталатов. Перечисленные выше возможности применения гомологических инкрементов индексов удерживания наиболее эффективно могут быть реализованы только тогда, когда гомологические ряды аналитов однозначно установлены (иначе необходима проверка нескольких альтернативных гипотез). В рассматриваемом случае газохроматографические параметры удерживания, полезные на стадии уточнения структуры аналитов, лишь ограниченно информативны для групповой идентификации и необходимо вновь обращаться к масс-спектрометрическим данным. В наибольшей степени проблема групповой идентификации актуальна именно для моноалкилфталатов, так как отнесение диэфиров к соответствующей подгруппе фталатов достаточно надежно. Это положение легко подтвердить результатами библиотечного поиска, например, с использованием базы NIST [1]. Для этого выберем масс-спектры диизодецил- и монодецилфталатов и сравним их с содержащимися в этой же базе другими масс-спектрами при значениях фактора совпадения Q > 0.800 (табл. 3). Таким образом, из найденных для диизодецилфталата 38 результатов библиотечного поиска на уровне групповой идентификации правильны 37 (относятся к ряду диалкилфталатов), тогда как для монодецилфталата правильные ответы составляют менее половины. Аналогичная ситуация наблюдается и для других моно- и диалкилфталатов. Причиной этого является отмеченное выше сходство процессов фрагментации молекулярных ионов соединений этих рядов в условиях ИЭ. Таким образом, проблема отнесения к соответствующей подгруппе гомологов наиболее актуальна именно для моноалкилфталатов.
Таблица 3.
Сравнение числа правильных и ошибочных отнесений диизодецилфталата и монодецилфталата к диалкил- и моноалкилфталатам с использованием базы данных NIST [1]
| Соединение | Число ответов для фактора совпадения Q > 0.800 | Опознано | |
|---|---|---|---|
| диалкилфталаты | моноалкилфталаты | ||
| Диизодецилфталат | 38 | 38 | Нет |
| Монодецилфталат | 17 | 9 | 8 |
Использование для групповой идентификации таких масс-спектрометрических инвариантов, как спектры ионных серий [16] не позволяет надежно опознавать моноалкилфталаты. Масс-спектры ионных серий представляют собой совокупности 14 чисел {I(y)} (0 ≤ y ≤ 13), каждое из которых равно суммарной интенсивности пиков ионов гомологических групп (0 ≤ y ≤ 13) в суммарном ионном токе, ΣIy = 100, y ≡ m/z(mod14). После усреднения таких совокупностей чисел для нескольких гомологов получаем статистически обработанные наборы данных {I(y)s(y)}, применимые для отнесения аналитов к соответствующим гомологическим рядам (в подстрочных индексах указаны стандартные отклонения):
Диалкилфталаты: 11, 76, 0, 0, 0, 0, 53, 22, 0, 677, 82, 0, 0, 105.
Моноалкилфталаты: 65, 32, 0, 22, 11, 11, 44, 62, 22, 5111, 83, 43, 0, 126.
Спектры ионных серий подтверждают, что наибольшей интенсивностью в масс-спектрах всех эфиров обладают сигналы гомологической группы у = 9, так как к ним относятся максимальные пики с m/z 149. Из этих же спектров следует, что принципиальных различий для моно- и диэфиров в них нет; диапазоны большинства значений Iy перекрывается в пределах удвоенных стандартных отклонений, так что групповая идентификация моно- и диэфиров фталевой кислоты возможна только как исключение. Так, лишь для отдельных диалкилфталатов суммарные интенсивности сигналов гомологической группы у = 1 (7 ± 6%) статистически значимо отличаются от их интенсивностей в масс-спектрах моноалкилфталатов (3 ± 2%), что вполне закономерно из-за неодинакового числа алкильных фрагментов в молекулах. То же можно сказать про сигналы группы у = 7 (5 ± 3 и 6 ± 2% соответственно), а также группы у = 11 (0 и 4 ± 3%). Однако такой критерий целесообразно рассматривать только в качестве дополнительного к более надежным признакам. Попытки дифференциации моно- и диалкилфталатов по относительным интенсивностям пиков отдельных ионов с использованием методов хемометрики (линейный дискриминантный анализ, LDA) показали их невысокую эффективность и были признаны неприемлемыми. В частности, модель опознания моноалкилфталатов по критерию убывания интенсивностей пиков в последовательности массовых чисел 105 > 77 > 69 > 57 приводит к ошибочным результатам для 5 из 19 гомологов.
Тем не менее, способ, позволяющий более надежно дифференцировать моно- и диалкилфталаты именно на уровне групповой идентификации (отнесения к подгруппам гомологов) существует. Он основан на отмеченных выше особенностях фрагментации молекулярных ионов этих эфиров в условиях ИЭ. Дело в том, что наиболее характеристические ионы с m/z 149 (соответствуют максимальным сигналам масс-спектров) моноалкилфталатов получаются преимущественно в две стадии, т.е. М+. → [M – CnH2n+ 1O]+ → [M – CnH2n+ 1O]+ → → [C6H4(CO)2OH]+ (m/z 149), а в случае диалкилфталатов – на одну стадию больше: М+.→ [M–CnH2n+ 1O]+ → [M–CnH2n + 1O–CnH2n]+ → → [C6H4(CO)2OH]+ (m/z 149). Можно полагать, что дополнительные “промежуточные” ионы так или иначе должны проявляться в масс-спектрах, в результате чего суммарные интенсивности ионов с бóльшими массовыми числами в случае диалкилфталатов должны быть выше, чем у моноалкилфталатов. Если формализовать это условие в приемлемом для практического применения виде “суммарная относительная интенсивность пиков с m/z > 170”, то получаем результаты, представленные в табл. 4.
Таблица 4.
Оценки количества правильных отнесений диалкил- и моноалкилфталатов к соответствующим подгруппам гомологов
| Подгруппа фталатов | Число гомологов | Диапазон молекулярных масс | Критерий отнесения | Число правильных ответов |
|---|---|---|---|---|
| Диалкилфталаты | 37* | 194–306 | Σ[Iотн(m/z > 170] ≥ 1% | 36** |
| Моноалкилфталаты | 18*** | 222–418 | Σ[Iотн(m/z > 170] < 1% | 17**** |
* Больше чем в табл. 1 за счет рассмотрения сокращенных (10 пиков) масс-спектров из базы [1]; ** (2-метилбутил)пропилфталат ошибочно опознан по масс-спектру из базы [1]; *** без учета монометил- и моноэтилфталатов, в масс-спектрах которых регистрируются сигналы молекулярных ионов, %; **** ошибочно опознан моноэтилфталат.
Для большинства моноалкилфталатов вне зависимости от размера алкильных фрагментов суммарные относительные интенсивности сигналов с m/z > 170 близки к нулевым. Единственное исключение составляет моноэтилфталат, но это не следует считать существенным ограничением выбранного критерия. Во-первых, в масс-спектре этого эфира достаточно надежно регистрируется сигнал молекулярных ионов (Iотн ≈ 1%). Во-вторых, единственным изобарным моноэтилфталату соединением ряда фталатов является диметилфталат, а масс-спектры и индексы удерживания этих эфиров существенно различаются. В масс-спектрах диалкилфталатов суммарные относительные интенсивности пиков ионов с m/z > 170 варьируют в диапазоне 1–172%. Такой критерий характеризуется достаточной надежностью и не требует дополнительных вычислений, например выражения интенсивностей пиков в суммарном ионном токе.
Из дополнительно проверенных критериев групповой идентификации моно- и диалкилфталатов можно упомянуть относительные интенсивности сигналов ионов с m/z 167 и 149. Интересно отметить, что в случае моноалкилфталатов интенсивность пиков с m/z 167 больше (13 ± 5%), чем для диалкилфталатов (7 ± 5%). Однако такой критерий нельзя считать статистически достоверным, так как разность средних значений меньше суммы их стандартных отклонений. То же относится к другому критерию – интенсивностям сигналов с m/z 149 (чаще всего они максимальны в масс-спектрах) в суммарном ионном токе: для моноалкилфталатов среднее значение составляет 0.49 ± 0.14, а для диалкиловых эфиров – 0.69 ± 0.07.
* * *
Таким образом, несмотря на значительное сходство масс-спектров ИЭ различных алкиловых эфиров фталевой кислоты, специальная обработка хромато-масс-спектрометрических данных позволяет исключить ошибочную идентификацию моноалкилфталатов. Масс-спектрометрическим критерием отнесения аналитов к подгруппе моноэфиров является низкая суммарная относительная интенсивность пиков ионов с m/z > 170 (менее 1%). После отнесения к подгруппе гомологов использование гомологических инкрементов индексов удерживания позволяет оценивать молекулярные массы аналитов и суммарное число разветвлений в алкильных фрагментах молекул. Не исключается также идентификация алкилфталатов непосредственно по индексам удерживания на стандартных неполярных фазах.
Работа выполнена при частичном финансировании по гранту РФФИ № 18-03-00151/А. Обсуждаемые в настоящей работе экспериментальные данные получены с использованием оборудования ресурсного центра по направлению “Химия” при Институте химии Санкт-Петербургского государственного университета. Автор благодарит сотрудников центра за содействие. Автор благодарит проф. Кароли Хебергера (Исследовательский центр естественных наук Академии наук Венгрии, Будапешт) за заключения, касающиеся возможностей применения методов хемометрики для дифференциации алкилфталатов.
Список литературы
The NIST 17 Mass Spectral Library (NIST17/2017/EPA/NIH). Software/Data Version (NIST17); NIST Standard Reference Database, Number 69, June 2017. National Institute of Standards and Technology, Gaithersburg, MD 20899: http://webbook.nist.gov (дата обращения: январь 2020 г.).
Зенкевич И.Г., Лукина В.М. Хроматомасс-спектрометрическая характеристика диэтилкеталей алифатических карбонильных соединений // Аналитика и контроль. 2019. Т. 23. № 3. С. 410–424. https://doi.org/10.15826/analitika.2019.23.3.009
Елисеенков Е.В., Зенкевич И.Г. Хроматомасс-спектрометрическая характеристика замещенных 1,3-диоксоланов и 1,3-диоксанов // Масс-спектрометрия. 2020. Т. 20. № 1. С. 40.
Зeнкeвич И.Г. Prevention of a dangerous tendency in the presentation of the results of GC-MS identification // Anal. Bioanal. Chem. 2013. V. 405. P. 3075. https://doi.org/10.1007/s00216-013-6751-2
Зенкевич И.Г., Пушкарева Т.И., Каракашев Г.В. Особенности характеристики триалкилтиофосфатов индексами удерживания в обращенно-фазовой высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией // Аналитика и контроль. 2019. Т. 23. № 3. С. 425. https://doi.org/10.15826/analitika.2019.23.3.012
Зенкевич И.Г., Фахретдинова Л.Н. Термическая нестабильность моноалкиловых эфиров фталевой кислоты в условиях газохроматографического разделения // Аналитика и контроль. 2015. Т. 19. № 2. С. 175. https://doi.org/10.15826/analitika.2015.19.2.013
Зенкевич И.Г., Фахретдинова Л.Н. Хроматографическая и хромато-спектральная характеристика моноэфиров дикарбоновых кислот // Журн. аналит. химии. 2016. Т. 71. № 12. С. 1296. (Zenkevich I.G., Fakhretdinova L.N. Chromatographic and chromatospectral characteristic of dicarboxylic acid monoesters // J. A-nalyt. Chem. 2016. V. 71. № 12. P. 1204.) https://doi.org/10.7868/S004445021612015X
Hamming M.G., Foster N.G. Interpretation of mass spectra of organic compounds. N.Y.: Academic Press, 1979. 694 p.
Kim N.-S., Lee D.S. Characterization of Rosemary fragrances by solid phase microextraction and GC−MS // Anal. Sci. 2001. V. 17. Suppl. A383.
Pasenzotto L., Gracco L., Conte L. Solid phase microextraction (SPME) applied to honey quality control // J. Sci. Food Agric. 2001. V. 83. P. 1037.
Syeda F.A., Habib-ur-Rehman, Choudahry M.I., Ata-ur-Rahman. GC-MS analysis of petroleum ether extract (oil) and bioassays of crude extracts of Iris germanica // Int. J. Genetics. Molec. Biol. 2011. V. 3. № 7. P. 95.
Bagavathi P.E., Ramasamy N. GC-MS analysis of phytocomponents in the ethanol extract of Polygonum chinense L. // Pharmacognosy Res. 2012. V. 14. № 1. P. 11. https://doi.org/10.4103/0974-8490.91028
Kawakami T., Isama K., Matsuoka A. Analysis of phthalic acid diesters, monoester, and other plasticizers in polyvinyl chloride household products in Japan // J. Environ. Sci. Health. Part A. 2011. V. 46. № 8. P. 855. https://doi.org/10.1080/10934529.2011.579870
Rowdhwal S.S.S., Chen J. Toxic effects of di-2-ethylhexyl phthalate: An overview // BioMed Res. Internat. 2018. Art. ID 1750368. 10 p. https://doi.org/10.1155.2018.1750368
Stein S.E., Babushok V.I., Brown R.L., Linstrom P.J. Estimation of Kovats retention indices using group contributions // J. Chem. Inf. Model. 2007. V. 47. P. 975. https://doi.org/10.1021/ci600548y
Зенкевич И.Г., Иоффе Б.В. Интерпретация масс-спектров органических соединений. Л.: Химия, 1986. 176 с.
Зенкевич И.Г. Особенности использования дифференциальных характеристик органических соединений для их групповой идентификации // Журн. общей химии. 2017. Т. 87. № 4. С. 665. (Zenkevich I.G. Specificies of using differential characteristics of organic compounds for their group identification // Russ. J. General Chem. 2017. V. 87. № 4. P. 795.) https://doi.org/10.1134/S1070363217040211
Зенкевич И.Г., Носова В.Э. Особенности обнаружения триалкилфосфитов в составе реакционных смесей и их хроматомасс-спектрометрическая характеристика // Масс-спектрометрия. 2018. Т. 15. № 2. С. 119. (Zenkevich I.G., Nosova V.E. Features of the identification of trialkyl phosphites in reaction mixtures and their characterization by gas chromatography – mass spectrometry // J. Analyt. Chem. 2019. V. 74. № 13. P. 1297.) https://doi.org/10.1134/S1061934819130124
Зенкевич И.Г., Носова В.Э. Газохроматографические индексы удерживания в хроматомасс-спектрометрической идентификации алкилдихлорфосфатов, диалкилхлорфосфатов и их тиоаналогов // Масс-спектрометрия. 2019. Т. 16. № 1. С. 58. (Zenkevich I.G., Nosova V.E. Gas chromatographic retention indices in GC/MS identification of alkyl dichlorophosphates, dialkyl chlorophosphates, and their thio analogues // J. Analyt. Chem. 2019. V. 74. № 14. P. 1413.) https://doi.org/10.1134/S1061934819140120
Зенкевич И.Г. Гомологические инкременты газохроматографических индексов удерживания как характеристика полярности органических соединений // Журн. общей химии. 2019. Т. 89. № 3. С. 331. (Zenkevich I.G. Homologous increments of gas chromatographic retention indices as characteristic of organic substances polarity // Russ. J. General Chem. 2019. V. 89. № 3. P. 369.) https://doi.org/10.1134/S1070363219030010
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


