Журнал аналитической химии, 2020, T. 75, № 11, стр. 963-979
Гомогенная жидкостная микроэкстракция органических соединений
С. Г. Дмитриенко a, В. В. Апяри a, *, М. В. Горбунова a, В. В. Толмачева a, Ю. А. Золотов a, b
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, ГСП-1, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
* E-mail: apyari@mail.ru
Поступила в редакцию 25.02.2020
После доработки 23.03.2020
Принята к публикации 25.05.2020
Аннотация
Обобщены и систематизированы литературные данные о различных вариантах гомогенной жидкостной микроэкстракции (ГЖМЭ) органических соединений, приведена классификация этих вариантов. Обсуждены основные способы осуществления ГЖМЭ. Приведены примеры использования ГЖМЭ для выделения органических соединений при анализе объектов окружающей среды, пищевых продуктов и биологических жидкостей.
Задача определения органических соединений в разнообразных объектах становится все более значимой в условиях производства и использования огромного числа химических веществ [1, 2]. Как правило, определению органических соединений предшествует подготовка проб, включающая выделение искомых соединений из анализируемой матрицы, отделение их от мешающих компонентов и концентрирование [3–6]. В рамках миниатюризации методов пробоподготовки в настоящее время активно разрабатываются и развиваются различные варианты жидкостно-жидкостной микроэкстракции (ЖЖМЭ), которые не противоречат принципам “зеленой аналитической химии”, а также являются эффективным способом повышения чувствительности аналитических методов [6–8]. Под ЖЖМЭ подразумевают экстракцию из водного раствора в небольшое количество несмешивающегося с водой растворителя (до 100 мкл). Применение ЖЖМЭ позволяет значительно упростить пробоподготовку, уменьшить или полностью исключить применение токсичных растворителей, сократить продолжительность анализа, объединить в одну стадию экстракцию и введение пробы в прибор [9].
Известно несколько методов ЖЖМЭ органических соединений, различающихся по способу осуществления процесса: дисперсионная жидкостно-жидкостная микроэкстракция (dispersive liquid–liquid мicroextraction), капельная микроэкстракция (single drop liquid-phase microextraction), мембранная микроэкстракция в полое волокно (hollow fiber microextraction) [10, 11] и гомогенная жидкостная (жидкостно-жидкостная) микроэкстракция (ГЖМЭ, homogenous liquid–liquid microextraction, HLLME) [12, 13]. В отличие от первых трех методов, в ГЖМЭ в качестве экстрагентов используют смешивающиеся с водой гидрофильные растворители. Метод ГЖМЭ нашел применение для выделения полярных органических соединений из различных объектов и их последующего определения непосредственно в экстрактах методами ВЭЖХ и капиллярного электрофореза. В настоящем обзоре обобщены работы, описывающие различные варианты ГЖМЭ, приведена классификация таких вариантов, описаны способы осуществления, особенности сочетания с другими методами пробоподготовки и методами последующего определения органических соединений в различных объектах.
ПРИНЦИП ГОМОГЕННОЙ ЖИДКОСТНОЙ ЭКСТРАКЦИИ, ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ
Гомогенная жидкостная (жидкостно-жидкостная) экстракция (ГЖЭ, homogenous liquid–liquid extraction, HLLE), или экстракция гидрофильными растворителями, была предложена в 1973 г. на волне интереса к выделению полярных органических соединений и биологически активных веществ, которые плохо экстрагируются гидрофобными органическими растворителями [14]. В этом способе в качестве экстрагентов используют полярные растворители, полностью (ацетонитрил, ацетон, этанол, пропанол, изопропанол) или частично (бутанол, изобутанол, пентанол, изопентанол, метилэтилкетон) смешивающиеся с водой [15]. В первых работах, посвященных ГЖЭ, фазовое разделение двух- или трехкомпонентных систем растворителей осуществляли за счет введения в водную пробу больших количеств нейтральных солей – высаливателей [16–19]. Соли снижают растворимость гидрофильных растворителей в воде, в результате чего образуется самостоятельная органическая фаза. При этом бинарная система с неограниченной смешиваемостью превращается в тройную с ограниченной растворимостью органического растворителя в водном растворе высаливателя [20]. В качестве высаливателей применяют нитраты, сульфаты, хлориды, карбонаты калия, натрия или аммония. Позже было показано, что фазовое разделение двух- или трехкомпонентных систем растворителей можно осуществлять также путем добавления сахаров [21], изменения рН [22], температуры [23] или введения в гомогенный раствор небольшого количества гидрофобного растворителя [24].
К гомогенной экстракции относится и экстракция полиэтиленгликолями и различными водорастворимыми полимерами. В этом способе в качестве экстрагентов используют водные растворы экологически безопасных полиэтиленгликолей, поливиниловый спирт, поливинилпирролидон и другие водорастворимые полимеры, полностью смешивающиеся с водой, легко разлагаемые микроорганизмами [25–27]. Система также расслаивается на две водные несмешивающиеся фазы за счет введения больших количеств неорганических солей – фазообразователей. Верхний слой представляет собой насыщенный водный раствор полимера (играет роль органической фазы), тогда как нижний водный слой насыщен солью-фазообразователем. К достоинствам использования водорастворимых полимеров в качестве экстрагентов можно отнести незначительное влияние гидратации на перенос экстрагируемого вещества из одной фазы в другую (обе фазы содержат значительные количества воды) и высокую комплексообразующую способность полимеров по отношению к биологически активным веществам.
В последние годы метод ГЖЭ все чаще реализуют в варианте гомогенной жидкостной микроэкстракции (ГЖМЭ, 2009 г.) [28]. В ГЖМЭ в качестве экстрагентов используют небольшие объемы (микролитры) гидрофильных органических растворителей. Как и в “классической” ГЖЭ, в ГЖМЭ одновременно происходит фазовое разделение гомогенного раствора и извлечение органических соединений в фазу экстрагента. Благодаря чрезвычайно большой площади поверхности раздела между водной и органической фазами, равновесие в этом методе устанавливается очень быстро. ГЖМЭ – простой и универсальный метод концентрирования, обеспечивающий снижение расхода реагентов и растворителей, времени экстракции и стоимости анализа. Отпадает необходимость в реэкстракции, так как получаемый концентрат смешивается с водой, что существенно упрощает последующее определение. В зависимости от причины, вызвавшей разделение фаз, различают ГЖМЭ с высаливанием экстрагента, ГЖМЭ с высахариванием экстрагента, ГЖМЭ, основанную на изменении рН, температуры или добавлении гидрофобного растворителя. Классификация вариантов ГЖМЭ в зависимости от фактора, вызывающего образование фазы экстрагента, приведена в табл. 1.
Таблица 1.
Классификация вариантов гомогенной жидкостной микроэкстракции в зависимости от причины, вызывающей образование фазы экстрагента
| Полное и сокращенное название способа | Причина, вызывающая образование фазы экстрагента |
|---|---|
| Гомогенная жидкостная микроэкстракция с высаливанием экстрагента (salting-out assisted liquid–liquid extraction, SALLE) | Введение в гомогенный раствор большого количества солей |
| Гомогенная жидкостная микроэкстракция с высахариванием экстрагента (sugaring-out assisted liquid–liquid extraction, SULLE) | Введение в гомогенный раствор большого количества сахаров |
| Гомогенная жидкостная микроэкстракция, основанная на изменении рН (pH-assisted homogeneous liquid–liquid microextraction) | Изменение кислотности гомогенного раствора |
| Гомогенная жидкостная микроэкстракция, основанная на изменении температуры системы (subzero-temperature assisted liquid–liquid extraction, STLLE) | Понижение температуры |
| Гомогенная жидкостная микроэкстракция, основанная на введении в гомогенный раствор небольшого количества гидрофобного растворителя (hydrophobic-solvent assisted liquid–liquid extraction, HSLLE) | Введение в гомогенный раствор небольшого количества гидрофобного растворителя и/или последующее разбавление водой |
| Гомогенная жидкостная микроэкстракция, основанная на использовании трехкомпонентных гомогенных систем | Введение в гомогенный раствор солей или разбавление водой |
| Гомогенная жидкостная микроэкстракция, основанная на использовании глубоких эвтектических растворителей | Введение в гомогенный раствор апротонных растворителей |
ГОМОГЕННАЯ ЖИДКОСТНАЯ МИКРОЭКСТРАКЦИЯ С ВЫСАЛИВАНИЕМ ЭКСТРАГЕНТА
Из различных вариантов ГЖМЭ наибольшее распространение получила гомогенная жидкостная микроэкстракция с высаливанием экстрагента. В этом случае самостоятельная органическая фаза образуется в результате добавления неорганических солей (высаливателей, высаливающих агентов), которые снижают растворимость полярных растворителей в воде. За этим методом в англоязычной литературе закрепился ряд терминов, таких как salting-out assisted liquid–liquid extraction, miniaturized salting-out liquid–liquid extraction, salting-out homogenous extraction, salting-out homogenous liquid–liquid extraction, что зачастую затрудняет поиск необходимой информации. Метод получил широкое распространение, прежде всего, в анализе биологических объектов, о чем свидетельствует информация, представленная в обзорах [29, 30].
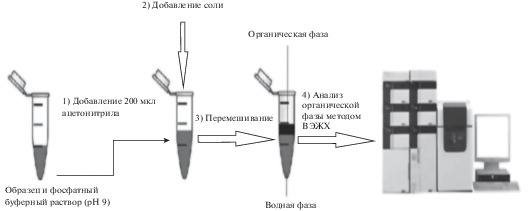
Чаще всего ГЖМЭ с высаливанием экстрагента проводят в центрифужных пробирках, а небольшие количества органической фазы отбирают при помощи микрошприцев или миниатюрных стеклянных сосудов. Приведем несколько примеров. На рис. 1 приведена схема ГЖМЭ, которую использовали для выделения из плазмы крови ламивудина и зидовудина, входящих в состав противовирусного препарата [31]. В микропробирку (2 мл) помещали 500 мкл плазмы крови и 400 мкл фосфатного буферного раствора. Затем добавляли 200 мкл ацетонитрила и 0.25 г сульфата натрия в качестве экстрагента и высаливателя соответственно. Смесь встряхивали с использованием вихревого смесителя в течение 2 мин. Для определения применяли 10 мкл ацетонитрильного экстракта, который непосредственно вводили в систему ВЭЖХ с ультрафиолетовым детектором (ВЭЖХ-УФ). Пределы обнаружения ламивудина и зидовудина составили 6 и 3 нг/мл.
Рис. 1.
Схема осуществления гомогенной жидкостной микроэкстракции с высаливанием в микропробирке [31].
Предложенную в работе [32] схему проведения ГЖМЭ использовали для концентрирования сульфаниламидов из речной воды, мочи и разбавленного водой меда; органическую фазу отбирали микрошприцем. В пробирку (1 мл) помещали 0.5 мл анализируемого раствора, добавляли 0.5 г хлорида натрия и 100 мкл ацетонитрила, перемешивали в течение 1 мин и переносили в шприц объемом 1 мл. Шприц переворачивали острием иглы вверх и оставляли в таком положении на 10 мин для образования двух отдельных фаз. После этого плунжером шприца выдавливали органическую фазу, отбирали 10 мкл, разбавляли подвижной фазой в соотношении 1 : 2 для последующего определения сульфаниламидов методом ВЭЖХ-УФ. Пределы обнаружения сульфаниламидов составили 1.4–4.5 нг/мл.
Интересный вариант осуществления ГЖМЭ, основанный на использовании пары шприцев, соединенных между собой, предложен для выделения сульфаниламида из различных сложных матриц (речной воды, плазмы крови, мочи, молока) [33]. В первый шприц отбирали 0.5 мл анализируемой пробы, из которой предварительно удаляли твердые частицы и белки, добавляли хлорид натрия (250 мг/мл) и перемешивали в течение 10 с до образования гомогенного раствора. Затем во второй шприц отбирали 250 мкл ацетонитрила. Шприцы соединяли и попеременно, 5 раз, перекачивали их содержимое из одного в другой. После завершения последнего цикла шприцы размещали вертикально, разъединяли и дожидались разделения фаз в течение 2 мин. Затем плунжером шприца выдавливали верхний слой (ацетонитрильный концентрат) к узкому кончику шприца, отбирали 20 мкл органической фазы и определяли сульфаниламиды методом ВЭЖХ-УФ с пределом обнаружения 0.3 нг/мл.
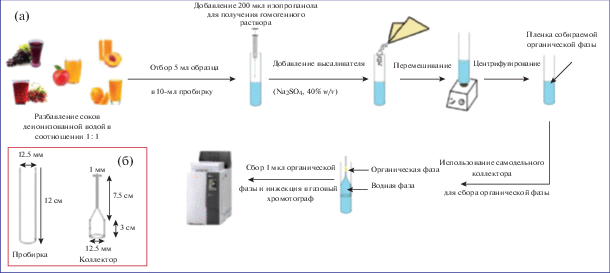
Чтобы облегчить сбор экстракта после ГЖМЭ, в работах [34, 35] использовали специальный сосуд со встроенным стеклянным капилляром. Схема ГЖМЭ, которую применили для выделения пестицидов из соков, и изображение соответствующего устройства с указанием размеров приведены на рис. 2.
Рис. 2.
Схема гомогенной жидкостной микроэкстракции, которую использовали для выделения пестицидов из соков (а), и коллектор органической фазы (б) [34].
Для повышения производительности ГЖМЭ в сочетании с последующим определением аналитов методом ВЭЖХ–тандемной масс-спектрометрии (ВЭЖХ–МС/МС) предложено использовать 96-луночные планшеты со съемными пробирками или планшеты с глубокими лунками емк. 2.0–2.2 мл [36, 37]. В пробирки помещали от 5 до 500 мкл анализируемых образцов (плазма, моча), от 50 до 200 мкл раствора соли и от 200 мкл до 1 мл органического растворителя. Соотношение компонентов подбирали таким образом, чтобы общий объем смеси не превышал 1.5 мл. Несмотря на то, что две фазы образуются в течение нескольких минут после добавления соли, для облегчения разделения фаз проводили центрифугирование.
Основными параметрами, которые варьируют при выборе условий ГЖМЭ, являются природа растворителя [28, 31–35, 38–50] и высаливателя [28, 31, 34, 35, 39, 41–45, 48, 49, 51, 52]. В качестве полярного растворителя – экстрагента в ГЖМЭ в основном используют ацетонитрил [28, 31–33, 36–42, 45, 48–51, 53–59]. По сравнению с ацетоном [43, 47], изопропиловым спиртом [34, 35, 60], тетрагидрофураном [44] и этанолом [61], которые реже применяют в качестве экстрагентов, для разделения фаз необходим меньший объем ацетонитрила. В ацетонитрильный экстракт хорошо извлекаются не только гидрофильные, но и некоторые гидрофобные органические соединения. Ацетонитрильные экстракты содержат меньшее количество воды и солей, вследствие чего матричные компоненты, присутствующие в пробе, загрязняют их в меньшей степени. По сравнению с другими растворителями, ацетонитрил лучше сочетается с последующим определением аналитов методом ВЭЖХ или капиллярного электрофореза (КЭ), так как он часто входит в состав подвижных фаз. Кроме того, при анализе биологических проб на первом этапе ацетонитрил часто используют для отделения белков [29, 30, 40].
Высаливатели обычно подбирают эмпирически для каждой конкретной системы, однако есть ряд общих требований, которые необходимо учитывать при их выборе. Высаливатели должны хорошо растворяться в воде и практически не растворяться в полярном органическом растворителе. Желательно, чтобы ионы, входящие в состав солей-высаливателей, обладали большими энергиями гидратации. Известно, что высаливающая способность катионов и анионов уменьшается в лиотропных рядах: Mg2+ > Са2+ > Sr2+ > Ва2+ > Li+ > > Na+ > K+ > ${\text{NH}}_{{\text{4}}}^{ + }$ > Rb+ > Cs+ и ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ > CH3COO– > > Cl– > ${\text{NO}}_{{\text{3}}}^{ - }$ > Br– > I– > CNS– [29, 30, 62]. Кроме того, при выборе высаливателей учитывают природу экстрагируемых органических соединений, тип анализируемой пробы, а также метод последующего определения. Высаливающий эффект проявляется при концентрациях солей, близких к насыщению, и в зависимости от используемой соли ее концентрация составляет от 1–3 М.
Среди описанных комбинаций растворитель/высаливатель можно отметить следующие: ацетонитрил/сульфат аммония [28, 38, 39, 42, 52, 59], ацетонитрил/хлорид натрия [32, 33, 40, 56], ацетонитрил/сульфат натрия [31, 53], ацетонитрил/формиат аммония [37, 54], ацетонитрил/ацетат аммония [48, 58], ацетонитрил/карбонат натрия [57], ацетонитрил/сульфат магния [45], ацетонитрил/хлорид магния [46], изопропанол/сульфат натрия [34, 60], изопропанол/сульфат аммония [35], ацетон/хлорид магния [43], ацетон/сульфат натрия [47], тетрагидрофуран/сульфат натрия [44], этанол/сульфат аммония [61]. В некоторых случаях в качестве высаливателей используют комбинации из двух солей: ацетонитрил/хлорид натрия/сульфат магния [41], ацетонитрил/сульфат натрия/хлорид натрия [55] (а также гидроксид натрия [49, 50]).
Для биологических объектов, подлежащих анализу методом ВЭЖХ–МС, в качестве высаливателей предпочитают использовать органические соли, не мешающие масс-спектрометрическому детектированию, например формиат аммония [37, 54] или ацетат аммония [58], и стараются не использовать хлорид натрия, так как наличие ионов натрия усложняет интерпретацию масс-спектров. Напротив, хлорид натрия является идеальным высаливающим агентом при сочетании ГЖМЭ с КЭ [40], так как в этом методе его часто используют в составе подвижных фаз. В сочетании с ВЭЖХ-УФ чаще других применяют сульфат аммония [28, 35, 38, 42, 52, 59] и хлорид натрия [32, 33, 56].
Наряду с водорастворимыми органическими растворителями в ГЖМЭ начали применять ионные жидкости (ИЖ) [63–68]. Часто такой вариант называют экстракцией в двухфазных водных системах (ionic liquid-based aqueous biphasic systems, или ionic liquid-based aqueous two phase systems) [68]. В качестве примера приведем методику, которую использовали для концентрирования фторхинолонов и сульфаниламидов из молока [65].
Важными факторами при выборе условий пробоподготовки органических соединений с применением метода ГЖМЭ являются объемы анализируемой пробы и экстрагента, так как их соотношение прежде всего сказывается на значениях коэффициентов концентрирования. Объемы анализируемой пробы и экстрагента варьируют в зависимости от типа анализируемого объекта и природы полярного растворителя, выбранного в качестве экстрагента, а также чувствительности метода последующего определения. Так, при анализе плазмы крови объем анализируемой пробы варьирует от 25 до 500 мкл, а объем экстрагента – ацетонитрила от 50 до 200 мкл, тогда как при анализе мочи эти объeмы составляют 100–1000 и 150–500 мкл соответственно. При анализе водных растворов объем анализируемой пробы может изменяться от 1 до 10 мл, а объем экстрагента от 100 до 800 мкл. При выборе объема экстрагента важно учитывать минимальный объем, который может образоваться из гомогенного раствора после добавления высаливателя. В работе [32] показано, что для образования второй фазы к 1 мл водной фазы необходимо добавить 500, 300 и 800 мкл изопропилового спирта, ацетонитрила и ацетона соответственно.
Для повышения эффективности концентрирования ГЖМЭ комбинируют с дисперсионной ЖЖМЭ [69, 70] или дисперсионной твердофазной экстракцией [71, 72]. В некоторых случаях ГЖМЭ сочетают с дериватизацией, которую проводят для превращения аналитов в окрашенные или флуоресцирующие производные [28, 46, 49, 52, 53]. Для получения производных в этом случае требуются очень небольшие объемы дериватизирующих реагентов и растворителей.
Чаще всего ГЖМЭ с высаливанием экстрагента применяют для выделения лекарственных соединений из различных биологических объектов: плазмы [29–31, 36–38, 46–48, 50, 51, 64] и сыворотки [38, 43, 44] крови человека, мочи [29, 30, 32, 33, 38, 40, 44, 47, 50, 56, 58], слюны [49], плазмы крови животных [45, 54], тканей [55]. С использованием ГЖМЭ из перечисленных биологических объектов выделяли ламивудин и зидовудин [31], сульфаниламиды [32, 33, 64], лопинавир и ритонавир [36], симвастатин и симвастатиновую кислоту [37], амоксапин и нортриптилин в виде производных с тиомочевиной [38], аторвастатин [43], биомаркеры нервных агентов [44], витамин К и его гомологи [46], энантиомеры варфарина [40], энтекавир [51], фторхинолоновые антибиотики [45, 47], фебуксостат [48], диклофенак [49], метформин, буформин и фенформин [50], триметазидин [54], метоксетамин [55], амфетамины [56], β-блокаторы и их метаболиты [58]. Выделенные аналиты определяли непосредственно в концентратах методом ВЭЖХ с ультрафиолетовым [31–33, 38, 42, 50, 56, 58, 64], флуоресцентным [45–47], диодно-матричным [48], масс-спектрометрическим [51] и тандемным масс-спектрометрическим [36, 37, 54, 55] детекторами, методом газовой хроматографии с пламенно-ионизационным детектором [34] и методом КЭ [40, 73]. ГЖМЭ с высаливанием экстрагента применяли также для выделения карбонильных соединений [28], сульфаниламидов [32, 33], фторхинолонов [42, 45], гербицидов – производных сульфонилмочевины [42] и красителей [39] из природных вод. Из соков с помощью этого метода выделяли пестициды [34, 60], гербициды [42, 66]; из напитков – биогенные амины [52]; из меда – сульфаниламиды [32, 33, 59], фторхинолоны [45] и неоникотиноидные инсектициды [58]; из молока – фторхинолоны [45, 63]. Одной из важных и все еще не решенных проблем является автоматизация как самой процедуры ГЖМЭ, так и всего анализа с применением ГЖМЭ. Работ в этом направлении выполнено немного [74–76].
К достоинствам ГЖМЭ с высаливанием можно отнести быстрое установление равновесия, простоту осуществления, низкую стоимость. К недостаткам этого варианта ГЖМЭ можно отнести то, что фазы разделяются при высокой концентрации солей, наличие которых в экстракционной системе может привести к нежелательным химическим реакциям, вызвать проблемы с загрязнением и коррозией оборудования и затруднить последующее определение, например, оказать влияние на ионизацию соединений в условиях масс-спектрометрического детектирования. В качестве альтернативы традиционным неорганическим солям-высаливателям предложено использовать сахариды, которые по аналогии с высаливателелями стали называть “высахаривающими агентами”.
ГОМОГЕННАЯ ЖИДКОСТНАЯ МИКРОЭКСТРАКЦИЯ С ВЫСАХАРИВАНИЕМ ЭКСТРАГЕНТА
Гомогенная жидкостная микроэкстракция с высахариванием экстрагента основана на экстракции веществ в полярный органический растворитель (обычно ацетонитрил) и разделении фаз за счет добавления больших количеств моно- или дисахаридов (“высахаривающиющих агентов”), которые снижают растворимость полярных растворителей в воде. Не так давно (2008 г.) установлено, что ацетонитрил, который смешивается с водой в любой пропорции, образует двухфазные системы в присутствии глюкозы, фруктозы, ксилозы, мальтозы, арабинозы и сахарозы [21, 77–80]. Эффект высахаривания (sugaring-out effect) объясняют способностью сахаридов – полярных молекул, содержащих большое количество гидроксильных групп, образовывать более прочные водородные связи с водой по сравнению с ацетонитрилом и экстрагируемыми органическими соединениями. При добавлении сахаридов к гомогенному раствору вода–ацетонитрил–аналит происходит отрыв молекул воды от гидратированных молекул ацетонитрила. Дегидратированные молекулы ацетонитрила агрегируют с образованием новой фазы, содержащей молекулы экстрагированного органического соединения.
Выше отмечено, что в качестве экстрагента в методе ГЖМЭ с высахариванием экстрагента в основном используют ацетонитрил [81–90]. Единичные работы, опубликованные в последние годы, указывают на то, что эффект высахаривания наблюдается и в смесях вода–изопропанол [91], вода–1-бутанол [92], вода–этилацетат [93], однако эти растворители пока не нашли применения в ГЖМЭ.
Основными параметрами, которые варьируют при выборе условий экстракции, являются тип высахаривающего агента [82–85], объем ацетонитрила в водно-ацетонитрильном растворе и концентрация сахарида [82–86, 90]. В качестве высахаривающего агента в этом варианте ГЖМЭ в основном используют глюкозу из-за более низкой вязкости ее раствора [81–87]. Как правило, применяют растворы, содержащие равные объемы ацетонитрила и воды, так как при меньшем количестве ацетонитрила не происходит разделения фаз, а при увеличении количества ацетонитрила до 70% снижается концентрация целевых аналитов в ацетонитрильном экстракте, что приводит к уменьшению чувствительности определения. В водно-ацетонитрильном растворе с объемным соотношением компонентов 1 : 1 разделение фаз наблюдается при концентрации глюкозы 15 мг/мл или выше. Как правило, концентрацию глюкозы выбирают эмпирически, так как ее количество влияет не только на разделение фаз, но и на степени извлечения аналитов в ацетонитрильный экстракт. В большинстве случаев ГЖМЭ проводят при концентрации глюкозы 100–200 мг/мл. При определении органических соединений в меде дополнительное введение сахаров не требуется, так как мед по химическому составу практически на 80% состоит из моно- и олигосахаридов [88–90]. Для повышения эффективности ГЖМЭ в отдельных случаях в экстракционную систему вводят соли [84, 86, 89, 90].
Гомогенную жидкостную микроэкстракцию с высахариванием экстрагента применяли для выделения лопинавира и ритонавира из плазмы крови человека [81]; прокаинамида из мочи [83]; хонокиола, магнолола [82] и 2,4-дихлорбензилового спирта, амилметакрезола, красителей [85] из лекарственных препаратов; пестицидов из соков [84]; 10-гидрокси-2-деценовой кислоты [86] и бис-фенолов [87] из пчелиного молочка; сульфаниламидов [88], фенольных соединений [89] и полициклических ароматических углеводородов (ПАУ) [90] из меда. После ГЖМЭ выделенные аналиты определяли непосредственно в экстрактах методом ВЭЖХ с масс-спектрометрическим [81], спектрофотометрическим [82, 86], флуоресцентным [87, 88, 90] или электрохимическим [89] детектированием. Для повышения производительности анализа разработаны полностью автоматизированные методы, основанные на on-line сочетании экстракции с последующим определением аналитов методом ВЭЖХ-УФ [83, 85] и ВЭЖХ–МС/МС [84].
По сравнению с ГЖМЭ с высаливанием, ГЖМЭ в высахариванием экстрагента имеет ряд преимуществ. Биоразлагаемые и нетоксичные сахара не реагируют с определяемыми аналитами, они меньше влияют на окружающую среду, их присутствие в экстракционной системе не вызывает коррозию и загрязнение оборудования. Кроме того, смесь ацетонитрил/вода является одной из наиболее широко используемых подвижных фаз в ВЭЖХ, что позволяет после процедуры высахаривания непосредственно вводить в ВЭЖХ-систему ацетонитрильную фазу, обогащенную аналитом. Недостатком использования ацетонитрила в описанных выше вариантах ГЖМЭ является необходимость проведения экстракции при соотношении объемов водной и органической фаз 1 : 1, что обусловливает низкий коэффициент концентрирования. В качестве экстрагентов, позволяющих устранить этот недостаток, предложены растворители с переключаемой гидрофильностью, обладающие уникальной способностью изменять гидрофильность в зависимости от pH среды.
ГОМОГЕННАЯ ЖИДКОСТНАЯ МИКРОЭКСТРАКЦИЯ, ОСНОВАННАЯ НА ИЗМЕНЕНИИ рН
В ГЖМЭ, основанной на изменении рН, в качестве экстрагентов применяют растворители с переключаемой гидрофильностью (РПГ, switchable hydrophilicity solvents, 2010 г.), которые называют также “умными растворителями” [94]. Они способны существовать в водных растворах в двух формах, одна из которых является гидрофобной и не смешивается с водой, а другая – гидрофильной и полностью растворяется в воде. Такими свойствами обладают некоторые органические основания: амидины, вторичные или третичные амины и диамины [94–99]. Преобразование одной формы в другую инициируется пропусканием через систему углекислого газа или добавлением сухого льда. Кислотно-основная реакция между гидрофобной формой амина и гидратированным углекислым газом приводит к образованию гидрокарбоната протонированного амина, который полностью растворим в воде. Обратный переход гидрофильной формы растворителя в гидрофобную происходит либо при удалении СО2 из раствора путем барботирования азота/воздуха или добавления минеральной кислоты, либо при депротонировании амина за счет добавления раствора щелочи. Для снижения растворимости амина в отдельных случаях в систему вводят соль или более гидрофильный амин [94–98].
Несмотря на то, что число РПГ постоянно расширяется [97–99], в этом варианте ГЖМЭ пока нашли применение лишь диметилциклогексиламин (ДМЦГА) [100–103], дипропиламин [104–107], диизобутиламин [108], триэтиламин [109] и октиламин [110]. Для получения растворимой формы аминов в большинстве работ их смешивали с равным объемом воды, после чего смесь многократно обрабатывали сухим льдом, а для разделения фаз использовали раствор NaOH [100–104, 106, 109]. Недостаток такого варианта ГЖМЭ связан с необходимостью использовать сухой лед для получения гидрофильной формы растворителя. На примере дипропиламина – биоразлагаемого, коммерчески доступного и недорогого вторичного амина, показано, что относительно длительная процедура получения растворимой формы экстрагента при помощи углекислого газа может быть заменена на более простую, основанную на добавлении соляной кислоты [105]. Позже [107] было показано, что в системе вода–дипропиламин гомогенный раствор образуется при понижении температуры до 5°С, а последующее нагревание до 25°С приводит к появлению фазы экстрагента. При использовании в качестве экстрагента растворимого в воде октиламина для разделения фаз использовали ацетонитрил [110].
Оснóвные растворители с переключаемой гидрофильностью применяли в ГЖМЭ для выделения ПАУ [100], триазиновых гербицидов [101], ибупрофена, кетопрофена, диклофенака, мефенамовой кислоты, напроксена и 17-β-эстрадиола [103], нитротолуола, 2,4-динитротолуола и 2,6-динитротолуола [104] и фталатов [107] из природных вод; бисфенолов из молока и соков [102]; метамфетамина [105], метадона и трамадола из мочи [106]; пестицидов из соков [108]; параквата из речной воды, сока, мочи и плазмы крови [109]; меропенема из мочи и плазмы крови [110]. Выделенные аналиты определяли методом газовой хроматографии с масс-спектрометрическим [101, 105, 107] или пламенно-ионизационным [104, 106, 108] детекторами; методом ВЭЖХ со спектрофотометрическим [102, 109, 110] или диодноматричным [103] детекторами; флуоресцентным методом [100].
В качестве кислотных РПГ в методе ГЖМЭ нашли применение октановая [111, 112], гептановая [113, 114], нонановая [115], пивалевая [116] и ди-(2-этилгексил)фосфорная [117] кислоты, которые полностью растворимы в водных щелочных растворах, но образуют двухфазную систему при добавления концентрированных минеральных кислот. Гомогенные растворы октановой кислоты получали путем ее растворения в фосфатном буферном растворе [111, 112], гептановой [113], пивалевой [116] и ди-(2-этилгексил)фосфорной [117] – в аммиаке. Образующуюся после добавления минеральных кислот органическую фазу отделяли центрифугированием.
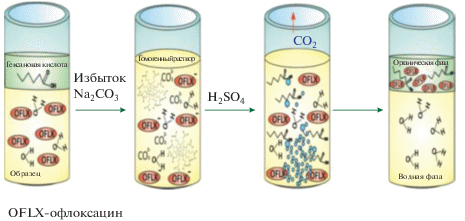
Для устранения стадии центрифугирования в работах [114, 115] использовали новый вариант метода, сочетающий ГЖМЭ и микроэкстракцию путем диспергирования экстрагента, – гомогенную жидкостную микроэкстракцию с разделением фаз углекислым газом. В англоязычной литературе такой вариант микроэкстракции получил название “Effervescence assisted liquid phase microextraction” [118]. Для осуществления перехода высшей карбоновой кислоты в гомогенную фазу применяют карбонат натрия. Избыток карбоната натрия позволяет осуществить фазовое разделение благодаря углекислому газу, который выделяется в результате взаимодействия карбонат-ионов с минеральной кислотой. При этом нет необходимости проводить дополнительную стадию центрифугирования. Схема ГЖМЭ с разделением фаз углекислым газом приведена на рис. 3. Достоинством такого подхода является возможность автоматизации процедуры концентрирования и последующего определения [114].
Рис. 3.
Предполагаемая схема гомогенной жидкостной микроэкстракции с разделением фаз углекислым газом [114].
При выборе условий ГЖМЭ, основанной на изменении рН, чаще всего варьируют соотношение объемов анализируемого раствора и РПГ, объемы и концентрации сильных кислот или оснований, необходимых для разделения фаз.
Кислотные РПГ применяли в ГЖМЭ для выделения из природных вод хлорфенолов [111, 117], хлорбензолов [112], фенолов [113], стероидных гормонов [115]; из мочи – офлоксацина [114]; из соков – пиретроидных инсектицидов [116]. Соединения определяли методом ВЭЖХ со спектрофотометрическим [111–113, 115, 117] и флуоресцентным [114] детекторами, а также методом газовой хроматографии с масс-спектрометрическим детектированием [116].
ДРУГИЕ ВАРИАНТЫ ГОМОГЕННОЙ ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ
Помимо солей, сахаров и изменения рН разделение фаз в ГЖМЭ можно инициировать изменением температуры или добавлением другого гидрофобного растворителя. Среди других вариантов можно выделить ГЖМЭ с использованием трехкомпонентных гомогенных систем и ГЖМЭ с использованием глубоких эвтектических растворителей.
Гомогенная жидкостная микроэкстракция, основанная на охлаждении. Этот вариант ГЖМЭ основан на явлении фазового разделения гомогенного водно-ацетонитрильного раствора при низких температурах (–20°С и ниже) [23, 119–122]. Верхний слой, образующийся при разделении фаз, представляет собой фазу, обогащенную ацетонитрилом и аналитами, а нижняя фаза представляет собой замерзшую фазу, обогащенную водой. ГЖМЭ, основанная на охлаждении, не требует использования дополнительных реагентов, экстракты намного чище по сравнению с получаемыми при высаливании, однако стадия охлаждения длится от 30 до 60 мин, что значительно увеличивает продолжительность анализа. Кроме того, степени выделения органических соединений ниже, чем в других описанных вариантах ГЖМЭ. В отечественной литературе этот метод получил название экстракционное вымораживание (extractive freezing-out) [123–131]. Для повышения эффективности отделения экстракта от водной замерзшей части предложено осуществлять концентрирование одновременно с центрифугированием пробы [129, 130].
Гомогенную жидкостную микроэкстракцию, основанную на охлаждении, использовали для выделения из плазмы и сыворотки крови бензодиазепинов [23], барбитурата тиамилала [119], кофеина [125]; производных антрахинона из жидких лекарственных форм [120]; полифенолов из прополиса [121]; нитрофенолов [122] и фенолов [124, 126] из вод; 1,4-бензодиазепинов [125] и пировалерона из мочи [131].
Гомогенная жидкостная микроэкстракция, основанная на введении в гомогенный раствор небольшого количества гидрофобного растворителя. Еще одним способом разделения фаз в гомогенном водно-ацетонитрильном растворе является добавление к нему небольших количеств неполярных растворителей, таких как метил-трет-бутиловый эфир [132] или хлороформ [133, 134]. Хлороформ растворим в ацетонитриле, но нерастворим в воде, из-за чего в его присутствии снижается растворимость ацетонитрила в воде, индуцируя его выделение в виде собственной фазы. Кроме того, в присутствии гидрофобного растворителя увеличиваются степени выделения гидрофобных соединений. Помимо хлороформа, разделение фаз в водно-ацетонитрильном растворе вызывают небольшие добавки толуола [135].
В качестве примера можно привести методику определения лекарственных веществ (андрографолида, силденафила и финастерида) в плазме крови методом хромато-масс-спектрометрии. Процедура включала следующие операции: 1 мл плазмы смешивали с 700 мкл ацетонитрила, а затем к раствору добавляли 70 мкл хлороформа. После центрифугирования из верхней органической фазы объемом 370 мкл отбирали 10 мкл и непосредственно вводили в систему ВЭЖХ–МС [134]. Пределы обнаружения андрографолида, силденафила и финастерида составили 40, 2 и 0.5 нг/мл соответственно.
Трехфазная гомогенная жидкостная микроэкстракция. Помимо двухфазных гомогенных систем, содержащих полярный органический растворитель и воду, в ГЖМЭ применяют и трехкомпонентные гомогенные системы типа полярный органический растворитель/неполярный органический растворитель/вода [136–144]. В таких системах полярный растворитель обеспечивает растворимость неполярного, а также гомогенное состояние всей системы. В этом варианте ГЖМЭ разделение фаз вызывают добавлением солей [136–139] или воды [140–142], которые инициируют выделение неполярного органического соединения в отдельную фазу.
Для выделения органических соединений из различных объектов предложены следующие системы: ацетон/CCl4/вода/NaCl [136], метанол/хлороформ/вода/NaCl [137], метанол/толуол/вода/NaCl [138], метанол/гексан/вода/Na2SO4 [139]. Приведем несколько примеров. Для выделения пестицидов малатиона, лямбда-цигалотрина и циперметрина из почв [136] на первом этапе из проб почвы массой 4 г извлекали пестициды 10 мл ацетона при перемешивании в течение 30 мин на механическом шейкере. К 1 мл ацетонового экстракта, перенесeнного в стеклянную центрифужную пробирку емк. 10 мл, добавляли 40 мкл CCl4 и перемешивали смесь до образования гомогенного раствора. Затем для выделения фазы экстрагента добавляли 0.3 г NaCl. После центрифугирования в течение 4 мин из нижней органической фазы объемом 22 мкл отбирали 1 мкл для определения пестицидов методом газовой хроматографии с детектором электронного захвата. Пределы обнаружения пестицидов составили 0.01–0.04 нг/г.
Для определения хлорорганических пестицидов в молоке [139] к 5 г молока добавляли 10 мл метанола, перемешивали в течение 60 с и центрифугировали при 3500 об/мин в течение 5 мин для осаждения белков. Затем к 5.0 мл метанольного экстракта добавляли 1.0 мл н-гексана и энергично встряхивали смесь в течение 30 с. Насыщенный раствор сульфата натрия (4 мл) добавляли в раствор экстракта и затем отделяли фазу н-гексана (верхний слой). Для определения пестицидов методом газовой хроматографии с электронозахватным детектором использовали 2.0 мкл экстракта, который непосредственно вводили в хроматографическую систему. Пределы обнаружения составили 0.03–0.7 нг/мл.
Кроме солей, в трехфазных системах растворителей образование отдельной фазы можно вызвать добавлением воды. Полярный растворитель неограниченно смешивается как с водой, так и с неполярным растворителем, и при добавлении воды, которая смешивается только с полярным растворителем, растворимость неполярного растворителя в системе уменьшается, что приводит к его выделению в отдельную фазу. В этом варианте нашли применение системы растворителей метанол/гексан/вода [140, 141] ацетонитрил/хлороформ/вода [142], ацетонитрил/бутилацетат/вода [143] и этанол/дихлорметан/вода [144], которые использовали для выделения ПАУ [140] и пестицидов [141] из почв, пестицидов из рыбы [142] и молока [143], кофеина из чая и кофе [144].
Гомогенная жидкостная микроэкстракция, основанная на использовании глубоких эвтектических растворителей. В качестве альтернативных растворителей в жидкостной микроэкстракции в последние годы начали использовать глубокие эвтектические растворители (ГЭР, deep eutectic solvent, DES) [145, 146]. Их получают смешиванием двух соединений, одно из которых выступает в роли акцептора водородных связей, а второе является донором водородных связей. В результате специфических взаимодействий между этими соединениями, в основном за счет образования водородных связей, образуется эвтектическая смесь с гораздо более низкой температурой плавления, чем у любого из двух компонентов.
Глубокие эвтектические растворители и ионные жидкости имеют близкие физико-химические свойства. Они обладают повышенной растворяющей способностью и низким давлением пара, высокими электропроводностью, вязкостью и поверхностным натяжением, негорючи, легко регенерируются и, как правило, не представляют опасности для окружающей среды. По сравнению с ионными жидкостями этот новый класс растворителей обладает такими преимуществами, как простота получения, легкая доступность относительно недорогих и экологичных компонентов, биоразлагаемость [147].
В различных методах ЖЖМЭ в большинстве случаев применяют глубокие эвтектические растворители на основе хлорида холина (2-оксиэтилтриметиламмоний хлорид). Широкому применению хлорида холина способствуют его нетоксичность, низкая стоимость, доступность и биоразлагаемость. Хлорид холина условно относят к комплексу витаминов группы В и используют как добавку в производстве премиксов и компонентов кормов для скота. Помимо хлорида холина применяют и другие галогениды (метилтрифенилфосфоний бромид, бензилтрифенилфосфоний хлорид, ацетилхолинхлорид, тетраметиламмоний хлорид) [146, 147].
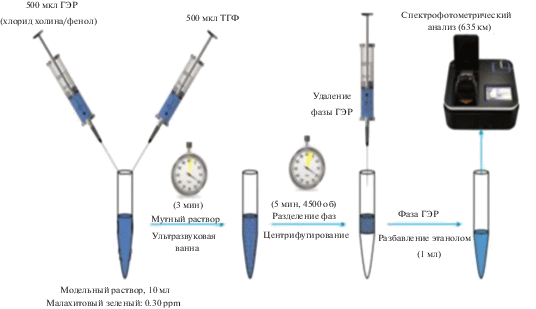
В ГЖМЭ в качестве экстрагентов используют водорастворимые растворители на основе хлорида холина и соединений – доноров водородных связей: фенола [148–151], этиленгликоля [152, 153], щавелевой кислоты [154], а также на основе тетрабутиламмоний хлорида и декановой кислоты [155] и на основе тетрабутиламмоний бромида и гептанола [156]. Соотношение компонентов в таких эвтектических смесях составляло 1 : 2, 1 : 3 либо 1 : 4. Разделение фаз осуществляют добавлением небольших количеств апротонных растворителей: тетрагидрофурана [148–151, 155], гексана [152], этилацетата [153] и циклогексана [154]. Обычно после добавления апротонного органического растворителя наблюдается образование мутного раствора, поэтому для ускорения разделения фаз проводят ультразвуковую обработку и центрифугирование анализируемых проб. Схема ГЖМЭ, основанная на применении в качестве экстрагента смеси хлорида холина с фенолом (1 : 4), которую использовали для определения малахитового зеленого в водах, приведена на рис. 4 [149].
Рис. 4.
Схема гомогенной жидкостной микроэкстракции, основанной на применении в качестве экстрагента смеси хлорида холина с фенолом (1 : 4) для определения малахитового зеленого в водах [149].
Новый прием разделения фаз в этом варианте ГЖМЭ предложен в работе [156]. Обнаружено, что глубокий эвтектический растворитель, образованный из тетрабутиламмоний бромида и гептанола, разлагается при его добавлении к анализируемой водной фазе, что приводит к образованию in situ дисперсной органической фазы, в которую экстрагируются органические соединения.
Для выделения нестероидных противовоспалительных препаратов (НПВП) из мочи и молока те же авторы предложили синтезировать глубокий эвтектический растворитель in situ путем добавления к анализируемому раствору ментола. Процедура предполагает выделение НПВП из водной фазы образца путем формирования in situ глубоких эвтектических смесей за счет образования водородной связи между гидроксильной группой ментола и атомами кислорода карбоксильных групп НПВП [157, 158].
Глубокие эвтектические растворители применяли в ГЖМЭ для выделения бензола, толуола и ПАУ [148], малахитового зеленого [149], хлорорганических пестицидов [153], родамина В [155] из природных вод; кофеина из напитков [150, 151]; феруловой, кофейной и коричной кислот из оливкового, миндального и кунжутного масел [152]; ПАУ из морских рыб и водорослей [154]; родамина В из косметической продукции [155]; стероидных эстрогенов из лекарственных препаратов [156]; НПВП из мочи [157] и молока [158]. Соединения определяли непосредственно в экстрактах методом ВЭЖХ сo спектрофотометрическим [148, 150–152, 156, 157] и флуоресцентным [154] детекторами, методом газовой хроматографии с масс-спектрометрическим детектированием [153], а также спектрофотометрическим методом [149, 155].
* * *
Гомогенная жидкостная микроэкстракция представляет собой миниатюрную версию гомогенной жидкостно-жидкостной экстракции. В отличие от других методов ЖЖМЭ, в этом методе в качестве экстрагентов используют смешивающиеся с водой гидрофильные растворители (преимущественно ацетонитрил). В различных вариантах ГЖМЭ применяют разные способы образования фазы экстрагента: высаливание, высахаривание, изменение рН или температуры, добавление небольшого количества гидрофобного растворителя. Метод ГЖМЭ нашел применение, прежде всего, в биоанализе для выделения полярных органических соединений и их последующего определения непосредственно в экстрактах без дополнительной очистки современными аналитическими методами: ВЭЖХ–МС, ВЭЖХ–МС/МС, ВЭЖХ-УФ, КЭ. Простота процедуры подготовки образцов с применением ГЖМЭ и возможность адаптации ее к автоматизированным системам анализа, быстрое установление равновесия, низкий расход экстрагентов, сокращение продолжительности экстракции и стоимости анализа вызывают все больший интерес к этому методу. Современный этап развития метода связан с появлением и применением в анализе “зеленых” экстрагентов – растворителей с переключаемой гидрофильностью и глубоких эвтектических растворителей. Этот метод пробоподготовки находит все более широкое применение в анализе биологических проб, объектов окружающей среды, пищевых продуктов для концентрирования органических соединений в широком диапазоне полярностей.
Работа выполнена в рамках темы по госзаданию АААА-А16-116111750033-9.
Список литературы
Xu W., Wang X., Cai Z. Analytical chemistry of the persistent organic pollutants identified in the Stockholm Convention: A review // Anal. Chim. Acta. 2013. V. 790. P. 1.
Lorenzo M., Campo J., Picó Y. Analytical challenges to determine emerging persistent organic pollutants in aquatic ecosystems // Trends Anal. Chem. 2018. V. 103. P. 137.
Другов Ю.С., Родин А.А., Кашмет В.В. Пробоподготовка в экологическом анализе М.: Лаб-Пресс, 2005. 695 с.
Другов Ю.С., Родин А.А. Анализ загрязнений почвы и опасных отходов. М.: Бином, 2007. 424 с.
Другов Ю.С., Родин А.А. Контроль безопасности и качества продуктов питания и товаров детского ассортимента. М.: Бином, 2012. 440 с.
Tobiszewski M., Mechlińska A., Zygmunt B., Namieśnik J. Green analytical chemistry in sample preparation for determination of trace organic pollutants // Trends Anal. Chem. 2009. V. 28. P. 943.
Carasek E., Merib J., Mafra G., Spudeit D. A recent overview of the application of liquid-phase microextraction to the determination of organic micro-pollutants // Trends Anal. Chem. 2018. V. 108. P. 203.
Armenta S., Garrigues S., Esteve-Turrillas F.A., de la Guardia M. Green extraction techniques in green analytical chemistry // Trends Anal. Chem. 2019. V. 116. P. 248.
Yamini Y., Rezazadeh M., Seidi S. Liquid-phase microextraction – the different principles and configurations // Trends Anal. Chem. 2019. V. 112. P. 264.
Hashemi B., Zohrabi P., Kim K.-H., Shamsipur M., Deep A., Hong J. Recent advances in liquid-phase microextraction techniques for the analysis of environmental pollutants // Trends Anal. Chem. 2017. V. 97. P. 83.
Rutkowska M., Płotka-Wasylka J., Sajid M., Andruch V. Liquid–phase microextraction: A review of reviews // Microchem. J. 2019. V. 149. Article 103989. https://doi.org/10.1016/j.microc.2019.103989
Anthemidis A.N., Ioannou K.I.G. Recent developments in homogeneous and dispersive liquid–liquid extraction for inorganic elements determination. A review // Talanta. 2009. V. 80. P. 413.
Moradi M., Yamini Y., Ebrahimpour B. Emulsion-based liquid-phase microextraction: A review // J. Iran. Chem. Soc. 2014. V. 11. P. 1087.
Matkovich C.E. Salting-out of acetone from water- basis of a new solvent extraction system // Anal. Chem. 1973. V. 45. № 11. P. 1915.
Tabata M., Kumamoto M., Nishimoto J. Chemical Properties of water-miscible solvents separated and their application to solvent extraction // Anal. Sci. 1994. V. 10. P. 383.
Leggett D.C., Jenkins T.F., Miyares P.H. Salting-out solvent extraction for preconcentration of neutral polar organic solutes from water // Anal. Chem. 1990. V. 62. P. 1355.
Коренман Я.И., Ермолаева Т.Н., Кучменко Т.А. Извлечение фенолов из водных сред водорастворимыми спиртами // Журн. прикл. химии. 1991. Т. 64. С. 573.
Коренман Я.И., Кучменко Т.А., Ермолаева Т.Н. Экстракция фенолов из водных растворов гидрофильными растворителями // Журн. аналит. химии. 1991. Т. 46. С. 1530.
Parkin J. E. Salting-out solvent extraction for pre-concentration of benzalkonium chloride prior to high-performance liquid chromatography // J. Chro-matogr. A. 1993. V. 635. № 1. P. 75.
Grover P.K., Ryall R.L. Critical appraisal of salting-out and its implications for chemical and biological sciences // Chem. Rev. 2005. V. 105. № 1. P. 1.
Wang B., Ezejias T., Feng, H., Blaschek H. Sugaring-out: a novel phase separation and extraction system // Chem. Eng. Sci. 2008. V. 63. P. 2595.
Igarashi S., Yotsuyanagi T. Homogeneous liquid−liquid extraction by pH dependent phase separation with a fluorocarbon ionic surfactant and its application to the preconcentration of porphyrin compounds // Mikrochim. Acta. 1992. V. 44. P. 37.
Yoshida M., Akane A. Subzero-temperature liquid−liquid extraction of benzodiazepines for high performance liquid chromatography // Anal. Chem. 1999. V. 71. P. 1918.
Ebrahimzadeh H., Yamini Y., Kamarei F., Shariati S. Homogeneous liquid–liquid extraction of trace amounts of mononitrotoluenes from waste water samples // Anal. Chim. Acta. 2007. V. 594. P. 93.
Зварова Т.И., Шкинев В.М., Спиваков Б.Я., Золотов Ю.А. Жидкостная экстракция в системах водный раствор соли – водный раствор полиэтиленгликоля // Докл. АН СССР. 1983. Т. 273. № 1. С. 107. (Zvarova T., Shkinev V., Spivakov B., Zolotov I. Liquid extraction in the system of aqueous salt solution – aqueous polyethylene-glycol solution // Doklady Akademii Nauk USSR. 1983. V. 273. № 1. P. 107.)
Videira M., Aires-Ban-O M.R. Liquid−liquid extraction of clavulanic acid two-phase system of polyethylene glycol phosphate using an aqueous and potassium // J. Chromatogr. A. 1994. V. 668. P. 237.
Шкинев B.M., Мокшина Н.Я., Хохлов В.Ю. Экстракция биологически активных веществ в двухфазных системах на основе поли-N-винилпирролидона // Доклады РАН. 2013. Т. 448. С. 427.
Gupta M., Jain A., Verma K.K. Salt-assisted liquid–liquid microextraction with water-miscible organic solvents for the determination of carbonyl compounds by high-performance liquid chromatography // Talanta. 2009. V. 80. P. 526.
Tang Y.Q., Weng N. Salting-out assisted liquid–liquid extraction for bioanalysis // Bioanalysis. 2013. V. 5. P. 1583.
Valente I.M., Rodrigues J.A. Recent advances in salt-assisted LLE for analyzing biological samples // Bioanalysis. 2015. V. 7. P. 2187.
Heydari R., Lotfi Z., Ramezani M. Simultaneous determination of zidovudine and lamivudine in plasma samples using miniaturized homogenous liquid–liquid extraction and high-performance liquid chromatography // J. Analyt. Chem. 2018. V. 73. № 11. P. 1105.
Liu J., Jiang M., Li G., Xu L. C. Xie M. Liu J. Miniaturized salting-out liquid–liquid extraction of sulfonamides from different matrices // Anal. Chim. Acta. 2010. V. 679. P. 74.
Sereshti H., Khosraviani M., Amini-fazl M.S. Miniaturized salting-out liquid–liquid extraction in a coupled-syringe system combined with HPLC–UV for extraction and determination of sulfanilamide // Talanta. 2014. V. 121. P. 199.
Farajzadeh M.A., Mohebbi A., Mogaddam M.R.A., Davaran M., Norouzi M. Development of salt-induced homogenous liquid–liquid microextraction based on iso-propanol/sodium sulfate system for extraction of some pesticides in fruit juices // Food Anal. Methods. 2018. V. 11. P. 2497.
Chen M.J., Liu Y.T., Lin C.W., Ponnusamy V.K., Jen J.F. Rapid determination of triclosan in personal care products using new in-tube based ultrasound-assisted salt-induced liquid–liquid microextraction coupled with high performance liquid chromatography-ultraviolet detection // Anal. Chim. Acta. 2013. V. 767. P. 81.
Myasein F., Kim E., Zhang J., Wu H., El-Shourbagy T.A. Rapid, simultaneous determination of lopinavir and ritonavir in human plasma by stacking protein precipitations and salting-out assisted liquid /liquid extraction, and ultrafast LC–MS/MS // Anal. Chim. Acta. 2009. V. 651. P.112.
Zhang J., Rodila R., Gage E., Hautman M., Fan L., King L.L., Wu H., El-Shourbagy T.A. High-throughput salting-out assisted liquid/liquid extraction with acetonitrile for the simultaneous determination of simvastatin and simvastatin acid in human plasma with liquid chromatography // Anal. Chim. Acta. 2010. V. 661. P. 167.
Gupta M., Jain A., Verma K.K. Determination of amoxapine andnortriptyline in blood plasma and serum by salt-assisted liquid–liquid microextraction and high-performance liquid chromatography // J. Sep. Sci. 2010. V. 33. P. 3774.
Razmara R.S., Daneshfar A., Sahrai R. Determination of methylene blue and sunset yellow in wastewater and food samples using salting-out assisted liquid–liquid extraction // J. Ind. Eng. Chem. 2011. V. 17. № 3. P. 533.
Wang M., Cai Z., Xu L. Coupling of acetonitrile deproteinization and salting out extraction with acetonitrile stacking in chiral capillary electrophoresis for the determination of warfarin enantiomers // J. Chromatogr. A. 2011. V. 1218. № 26. P. 4045.
Valente I.M., Gonc L.M., Rodrigues J.A. Another glimpse over the salting-out assisted liquid–liquid extraction in acetonitrile/water mixtures // J. Chromatogr. A. 2013. V. 1308. P. 58.
Gure A., Lara F.J., Moreno-González D., Megersa N., Olmo-Iruela M., García-Campaña A. M. Salting-out assisted liquid–liquid extraction combined with capillary HPLC for the determination of sulfonylurea herbicides in environmental water and banana juice samples // Talanta. 2014. V. 127. P. 51.
Hassan J., Bahrani S.H. Determination of atorvastatin in human serum by salting out assisted solvent extraction and reversed-phase high-performance liquid chromatography–UV detection // Arab. J. Chem. 2014. V. 7. № 1. P. 87.
Røen B.T., Sellevåg S.R., Lundanes E. Quantification of nerve agent biomarkers in human serum and urine // Anal. Chem. 2014. V. 86. P. 11833.
Du D., Dong G., Wu Y., Wang J., Gao M., Wang X., Li Y. Salting-out induced liquid–liquid microextraction based on the system of acetonitrile/magnesium sulfate for trace-level quantitative analysis of fluoroquinolones in water, food and biological matrices by high-performance liquid chromatography with a fluorescence detector // Anal. Methods-UK. 2014. V. 6. P. 6973.
Ahmed S., Mahmoud A.M. A novel salting-out assisted extraction coupled with HPLC-fluorescence detection for trace determination of vitamin K homologues in human plasma // Talanta. 2015. V. 144. P. 480.
Wang H., Gao M, Wang M., Zhang R., Wang W., Dahlgren R.A., Wang X. Integration of phase separation with ultrasound-assisted saltinduced liquid–liquid microextraction for analyzing the fluoroquinones in human body fluids by liquid chromatography // J. Chromatogr. B. 2015. V. 985. P. 62.
Tandel D., Shah P., Patel K., Thakkar V., Patel K., Gandhi T. Salting-out assisted liquid–liquid extraction for quantification of febuxostat in plasma using RP-HPLC and its pharmacokinetic application // J. Chromatogr. Sci. 2016. V. 54. P. 1827.
Pochivalov A., Vakh C., Andruch V., Moskvin L., Bulatov A. Automated alkaline-induced salting-out homogeneous liquid−liquid extraction coupled with in-line organic-phase detection by an optical probe for the determination of diclofenac // Talanta. 2017. V. 169. P. 156.
Alshishani A., Salhimi S. M., Saad B. Salting-out assisted liquid-liquid extraction coupled with hydrophilic interaction chromatography for the determination of biguanides in biological and environmental samples // J. Chromatogr. B. 2018. V. 1073. P. 51.
Zhao F.-J., Tang H., Zhang Q.-H., Yang J., Davey A.K., Wang J. Salting-out homogeneous liquid–liquid extraction approach applied in sample preprocessing for the quantitative determination of entecavir in human plasma by LC–MS // J. Chromatogr. B. 2012. V. 881–882. P. 119.
Jain A., Gupta M., Verma K. K. Salting-out assisted liquid–liquid extraction for the determination of biogenic amines in fruit juices and alcoholic beverages after derivatization with 1-naphthylisothiocyanate and high-performance liquid chromatography // J. Chromatogr. A. 2015. V. 1422. P. 60.
Diuzheva A., Balogh J., Studenyak Y., Cziáky Z., Jekőb J. A salting-out assisted liquid−liquid microextraction procedure for determination of cysteine followed by spectrophotometric detection // Talanta. 2019. V. 194. P. 446.
Xiong X., Yang L. Salting-out-assisted liquid–liquid extraction with acetonitrile for the determination of trimetazidine in rat plasma using liquid chromatography–mass spectrometry // Biomed. Chromatogr. 2015. V. 29. P. 268.
Hajkova K., Jurasek B., Sykora D., Palenicek T., Miksatkova P., Kuchar M. Salting-out-assisted liquid–liquid extraction as a suitable approach for determination of methoxetamine in large sets of tissue samples // Anal. Bioanal. Chem. 2016. V. 408. P. 1171.
Akramipour R., Fattahi N., Pirsaheb M., Gheini S. Combination of counter current salting-out homogenous liquid–liquid extraction and dispersive liquid– liquid microextraction as a novel microextraction of drugs in urine samples // J. Chromatogr. B. 2016. V. 1012. P. 162.
Heydari R., Mousavi M. Simultaneous determination of saccharine, caffeine, salicylic acid and benzoic acid in different matrixes by salt and air-assisted homogeneous liquid−liquid extraction and high-performance liquid chromatography. // J. Chil. Chem. Soc. 2016. V. 61. P. 3090.
Magiera S., Kolanowska A., Baranowski J. Salting-out assisted extraction method coupled with hydrophilic interaction liquid chromatography for determination of selected β-blockers and their metabolites in human urine // J. Chromatogr. B. 2016. V. 1022. P. 93.
Giroud B., Bruckner S., Straub L., Neumann P., Williams G.R., Vulliet E. Trace-level determination of two neonicotinoid insecticide residues in honey bee royal jelly using ultra-sound assisted salting-out liquid liquid extraction followed by ultra-high-performance liquid chromatography−tandem mass spectrometry // Microchem. J. 2019. V. 151. Article 104249. https://doi.org/10.1016/j.microc.2019.104249
Farajzadeh M.A., Mohebbi A., Mogaddam M.R.A., Davaran M., Norouzi M. Development of salt-induced homogenous liquid−liquid microextraction based on iso-propanol/sodium sulfate system for extraction of some pesticides in fruit juices // Food Anal. Methods. 2018. V. 11. P. 2497.
Fu H., Sun Y., Teng H., Zhang D., Xiu Z. Salting-out extraction of carboxylic acids // Sep. Purif. Technol. 2015. V. 139. P. 36.
Hyde A. M., Zultanski S. L., Waldman J. H., Zhong Y.-L., Shevlin M., Peng F. General principles and strategies for salting-out informed by the Hofmeister series // Org. Process Res. Dev. 2017. V. 21. № 9. P. 1355.
Gao S.Q., Jin H.Y., Ding Y., Zhang N., Wang Y., Ren R.B., Zhang R., Zhang H. Ionic liquid-based homogeneous liquid−liquid microextraction for the determination of antibiotics in milk by high-performance liquid chromatography // J Chromatogr A. 2011. V. 1218. P. 7254.
Liu Z., Yu W., Zhang H., Gu F., Jin X. Salting-out homogenous extraction followed by ionic liquid/ionic liquid liquid–liquid micro-extraction for determination of sulfonamides in blood by high performance liquid chromatography // Talanta. 2016. V. 161. P. 748.
Wang H., Gao M., Gao J., Yu N., Huang H., Yu Q., Wang X. Determination of fluoroquinolone antibiotics via ionic-liquid-based, salt-induced, dual microextraction in swine feed // Anal. Bioanal. Chem. V. 408. P. 6105.
Zhang L., Yu R., Yu Y., Wang C., Zhang D. Determination of four acetanilide herbicides in brown rice juice by ionic liquid/ionic liquid-homogeneous liquid−liquid micro-extraction high performance liquid chromatography // Microchem. J. 2019. V. 146. P. 115.
Li Y., Dai J.-Y., Xiu Z.-L. Salting-out extraction of acetoin from fermentation broths using hydroxylammonium ionic liquids as extractants // Sep. Purif. Technol. 2020. https://doi.org/10.1016/j.seppur.2020.116584
Плетнев И.В., Смирнова С.В., Шведене Н.В. Новые направления применения ионных жидкостей в аналитической химии. 1. Жидкостная экстракция // Журн. аналит. химии. 2019. Т. 74. С. 1.
Farajzadeh M.A., Feriduni B., Mogaddam M.R.A. Development of a new extraction method based on counter current salting-out homogenous liquid–liquid extraction followed by dispersive liquid–liquid microextraction: Application for the extraction and preconcentration of widely used pesticide // Talanta. 2016. V. 146. P. 772.
Shi Z., Huai Q., Li X., Ma H., Zhou C., Chu X., Zhang H. Combination of counter current salting-out homogenous liquid−liquid extraction with dispersive liquid−liquid microextraction for the high-performance liquid chromatographic determination of environmental estrogens in water samples // J. Chromatogr. Sci. 2020. V. 58. P. 171.
Rezaei F., Hosseini M.-R.M. New method based on combining ultrasonic assisted miniaturized matrix solid-phase dispersion and homogeneous liquid–liquid extraction for the determination of some organochlorinated pesticides in fish // Anal. Chim. Acta. 2011. V. 702. P. 274.
Jia C., Zhu X., Wang J., Zhao E., He M., Chen L., Yu P. Combination of dispersive solid-phase extraction and salting-out homogeneous liquid−liquid extraction for the determination of organophosphorus pesticides in cereal grains // J. Sep. Sci. 2014. V. 37. P. 1862.
Ahmed O.S., Ladner Y., Montels J., Philibert L., Perrin C. Coupling of salting-out assisted liquid–liquid extraction with on-line stacking for the analysis of tyrosine kinase inhibitors in human plasma by capillary zone electrophoresis. // J. Chromatogr. A. 2018. V. 1579. P. 121.
Vakh Ch., Falkova M., Timofeeva I., Moskvin A., Moskvin L., Bulatov A. Flow analysis: A novel approach for classification // Crit. Rev. Anal. Chem. 2016. V. 46. № 5. P. 374.
Lezov A., Vakh C., Pochivalov A., Bulatov A., Lebedinets S., Moskvin L., Cherkashina K. An automated salting-out assisted liquid−liquid microextraction approach using 1-octylamine: on-line separation of tetracycline in urine samples followed by HPLC-UV determination // Talanta. 2018. V. 184. P. 122.
Ahmed O. S., Ladner Y., Xia J., Montels J., Philibert L., Perrin C. A fully automated on-line salting-out assisted liquid−liquid extraction capillary electrophoresis methodology: Application to tyrosine kinase inhibitors in human plasma // Talanta. 2020. V. 208. Article 120 391. https://doi.org/10.1016/j.talanta.2019.120391
Wang B., Feng H., Ezeji T., Blaschek H. Sugaring-out separation of acetonitrile from its aqueous solution // Chem. Eng. Technol. 2008. V. 31. P. 1869.
Dhamole P.B., Mahajan P., Feng H. Phase separation conditions for sugaring-out in acetonitrile–water systems // J. Chem. Eng. Data. 2010. V. 55. № 9. P. 3803.
Dhamole P.B., Mahajan P., Feng H. Sugaring out: A new method for removal of acetonitrile from preparative RP-HPLC eluent for protein purification // Process Biochem. 2010. V. 45. № 10. P. 1672.
Cardoso G.B., Mourao T., Pereira F.M., Freire M.G., Fricks A.T., Soares C.M.F., Lima A.S. Aqueous two-phase systems based on acetonitrile and carbohydrates and their application to the extraction of vanillin // Sep. Purif. Technol. 2013. V. 104. P. 106.
Zhang J., Myasein F., Wu H.Q., El-Shourbagy T.A. Sugaring-out assisted liquid/liquid extraction with acetonitrile for bioanalysis using liquid chromatography−mass spectrometry // Microchem. J. 2013. V. 108. P. 198.
Shi Z., Li Z., Qiu L., Sun M., Zhang D., Zhang H. Sugaring-out assisted liquid/liquid extraction coupled with HPLC for the analysis of honokiol and magnolol in traditional Chinese herbal formula huoxiang-zhengqi oral liquid // J. Liq. Chromatogr. Relat. Technol. 2015. V. 38. P. 722.
Nugbienyo L., Malinina Y., Garmonov S., Bulatov A. Automated sugaring-out liquid-liquid extraction based on flow system coupled with HPLC-UV for the determination of procainamide in urine // Talanta. 2017. V. 167. P. 709.
Timofeeva I., Shishov A., Kanashina D., Dzema D., Bulatov A. On-line in-syringe sugaring-out liquid−liquid extraction coupled with HPLC−MS/MS for the determination of pesticides in fruit and berry juices // Talanta. 2017. V. 167. P. 761.
Shishov A., Nechaeva D., Moskvin L., Andruch V., Bulatov A. Automated solid sample dissolution coupled with sugaring-out homogenous liquid−liquid extraction. Application for the analysis of throat lozenge samples // J. Mol. Liq. 2017. V. 233. P. 149.
Tu X.J., Sun F.Y., Wu S.Y., Liu W.Y., Gao Z.S., Huang S.K., Chen W.B. Comparison of salting-out and sugaring-out liquid−liquid extraction methods for the partition of 10-hydroxy-2-decenoic acid in royal jelly and their co-extracted protein content // J. Chromatogr. B. 2018. V. 1073. P. 90.
Tu X.J., Wu S.Y., Liu W.Y., Gao Z.S., Huang S.K., Chen W.B. Sugaring-out assisted liquid-liquid extraction combined with high-performance liquid chromatography−fluorescence detection for the determination of bisphenol A and bisphenol B in royal jelly // Food Anal. Methods. 2019. V. 12. P. 705.
Tsai W.H., Chuang H.Y., Chen H.H., Wu Y.W., Cheng S.H., Huang T.C. Application of sugaring-out extraction for the determination of sulfonamides in honey by high-performance liquid chromatography with fluorescence detection // J. Chromatogr. A. 2010. V. 1217. P. 7812.
Zhu Z., Zhang Y., Wang J., Li X., Wang W., Huang Z. Sugaring-out assisted liquid−liquid extraction coupled with high performance liquid chromatography−electrochemical detection for the determination of 17 phenolic compounds in honey // J. Chromatogr. A. 2019. V. 1601. P. 104.
Koltsakidou A., Zacharis C.K., Fytianosa K. A validated liquid chromatographic method for the determination of polycyclic aromatic hydrocarbons in honey after homogeneous liquid–liquid extraction using hydrophilic acetonitrile and sodium chloride as mass separating agent // J. Chromatogr. A. 2015. V. 1377. P. 46.
Yan L., Sun Y., Xiu Z. Sugaring-out extraction coupled with fermentation of lactic acid // Sep. Purif. Technol. 2016. V. 161. P. 152.
Ebrahimi N., Sadeghi R. Propanol–sugar aqueous biphasic systems as a suitable platform for biomolecules extraction // J. Chromatogr. A. 2018. V. 1581–1582. P. 156.
Dai J.-Y., Ma L.-H., Wang Z.-F., Guan W.-T., Xiu Z.-L. Sugaring-out extraction of acetoin from fermentation broth by coupling with fermentation // Bioproc. Biosyst. Eng. 2017. V. 40. № 3. P. 423.
Jessop P.G., Phan L., Carrier A., Robinson S., Durr C.J., Harjani J.R. A solvent having switchable hydrophilicity // Green Chem. 2010. V. 12. P. 809.
Vanderveen J.R., Durelle J., Jessop P.G. Design and evaluation of switchable hydrophilicity solvents // Green Chem. 2014. V. 16. P. 1187.
Durelle J., Vanderveen J. R., Jessop P.G. Modeling the behavior of switchable hydrophilicity solvents // Phys. Chem. Chem. Phys. 2014. V. 16. P. 5270.
Durelle J., Vanderveen J.R., Quan Y., Chalifoux C.B., Kostin J.E., Jessop P.G. Extending the range of switchable-hydrophilicity solvents // Phys. Chem. Chem. Phys. 2015. V. 17. № 7. P. 5308.
Jessop P.G., Kozycz L., Rahami Z.G., Schoenmakers D., Boyd A.R., Wechsler D., Holland A.M. Tertiary amine solvents having switchable hydrophilicity // Green Chem. 2011. V. 13. P. 619.
Vanderveen J. R., Zhang S., Geng J., Jessop P. G. Diamines as switchable-hydrophilicity solvents with improved phase behavior // RSC Adv. 2018. V. 8. № 48. P. 27 318.
Lasarte-Aragonés G., Lucena R., Cárdenas S., Valcárcel M. Use of switchable solvents in the microextraction context // Talanta. 2015. V. 131. P. 645.
Lasarte-Aragonés G., Lucena R., Cárdenas S., Valcárcel M. Use of switchable hydrophilicity solvents for the homogeneous liquid–liquid microextraction of triazine herbicides from environmental water samples // J. Sep. Sci. 2015. V. 38. P. 990.
Wang, X., Gao M., Zhang Z., Gu H., Liu T., Yu N., Wang X., Wang H. Development of CO-mediated switchable hydrophilicity solvent-based microextraction combined with HPLC-UV for the determination of bisphenols in foods and drinks // Food Anal. Methods. 2018. V. 11. P. 2093.
Lasarte-Aragonés G., Álvarez-Lueje A., Salazar R., Toledo-Neira C. Application of switchable hydrophobicity solvents for extraction of emerging contaminants in wastewater samples // Molecules. 2020. V. 25. № 1. P. 86.
Rameshgar J., Hasheminas K.S., Adlnas L., Ahmar H. Switchable-hydrophilicity solvent-based microextraction combined with gas chromatography for the determination of nitroaromatic compounds in water samples // J. Sep. Sci. 2017. V. 40. P. 3114.
Shahvandi S.K., Banitabab M.H., Ahmara H. Development of a new pH assisted homogeneous liquid−liquid microextraction by a solvent with switchable hydrophilicity: Application for GC−MS determination of methamphetamine // Talanta. 2018. V. 184. P. 103.
Ahmar H., Nejati-Yazdinejad M., Najafi M., Hasheminasab K.S. Switchable hydrophilicity solvent-based homogenous liquid–liquid microextraction (SHS-HLLME) combined with GC−FID for the quantification of methadone and tramadol // Chromatographia. 2018. V. 81. P. 1063.
Shahvandi S.K., Banitaba M.H., Ahmar H., Karimi P. A novel temperature controlled switchable solvent based microextraction method: Application for the determination of phthalic acid esters in water samples // Microchem. J. 2020 V. 152. Article 104300. https://doi.org/10.1016/j.microc.2019.104300
Farajzadeh M.A., Mohebbi A., Feriduni B. Development of a simple and efficient pretreatment technique named pH-dependent continuous homogenous liquid–liquid extraction // Anal. Methods. 2016. V. 8. P. 5676.
Kakavandi N.R., Ezoddin M., Abdi K., Ghazikhansari M., Amini M., Shahtaheri S.J. Ion-pair switchable-hydrophilicity solvent based homogeneous liquid-liquid microextraction for the determination of paraquat in environmental and biological samples before high-performance liquid chromatography // J. Sep. Sci. 2017. V. 40. P. 3703.
Cherkashina K., Lebedinets S., Pochivalov A., Lezov A., Vakh C., Bulatov A. Homogeneous liquid−liquid microextraction based on primary amine phase separation: A novel approach for sample pretreatment // Anal. Chim. Acta. 2019. V. 1074. P. 117.
Ebrahimpour B., Yamini Y., Esrafili A. Acid–induced homogenous liquid–phase microextraction: application of medium–chain carboxylic acid as extraction phase // J. Sep. Sci. 2013. V. 36. № 8. P. 1493.
Ebrahimpour B., Yamini Y. Homogeneous liquid-phase microextraction followed by filtration-based phase separation coupled to high-performance liquid chromatography // J. Sep. Sci. 2014. V. 37. № 15. P. 2002.
Shih H.K., Shu T.Y., Ponnusamy V.K., Jen J.F. A novel fatty-acid-based in-tube dispersive liquid–liquid microextraction technique for the rapid determination of nonylphenol and 4-tertoctylphenol in aqueous samples using high-performance liquid chromatography–ultraviolet detection // Anal. Chim. Acta. 2015. V. 854. P. 70.
Vakh C., Pochivalov A., Andruch V., Moskvin L., Bulatov A. A fully automated effervescence-assisted switchable solvent-based liquid phase microextraction procedure: liquid chromatographic determination of ofloxacin in human urine samples // Anal. Chim. Acta. 2016. V. 907. P. 54.
Shishov A., Sviridov I., Timofeeva I., Chibisova N., Moskvin L., Bulatov A. An effervescence tablet-assisted switchable solvent-based microextraction: On-site preconcentration of steroid hormones in water samples followed by HPLC-UV determination // J. Mol. Liq. 2017. V. 247. P. 246.
Torbati M., Farajzadeh M.A., Torbati M., Nabil A.A.A., Mohebbi A., Mogaddam M.R.A. Development of salt and pH–induced solidified floating organic droplets homogeneous liquid–liquid microextraction for extraction of ten pyrethroid insecticides in fresh fruits and fruit juices followed by gas chromatography−mass spectrometry // Talanta. 2018. V. 176. P. 565.
Çabuk H., Köktürk M., Ata S. pH–assisted homogeneous liquid–liquid microextraction using dialkylphosphoric acid as an extraction solvent for the determination of chlorophenols in water samples // J. Sep. Sci. 2014. V. 37. P. 1343.
Liu X., Shen Z., Wang P., Liu C., Zhou Z., Liu D. Effervescence assisted on-site liquid phase microextraction for the determination of five triazine herbicides in water // J. Chromatogr. A. 2014. V. 1371. P. 58.
Yoshida M., Akane A., Nishikawa M., Watabiki T., Tsuchihashi H. Extraction of thiamylal in serum using hydrophilic acetonitrile with subzero-temperature and salting-out methods // Anal. Chem. 2004. V. 76. P. 4672.
Zhang H.Y., Li S.S., Liu X.Z., Yuan F.F., Liang Y. H., Shi Z.H. Determination of five anthraquinone derivatives in sticky traditional Chinese patent medicines by subzero-temperature liquid−liquid extraction combined with high-performance liquid chromatography // J. Liq. Chromatogr. Relat. Technol. 2015. V. 38. P. 584.
Shi Z., Li Z., Zhang S., Fu H., Zhang H. Subzero-temperature liquid−liquid extraction coupled with UP-LC−MS−MS for the simultaneous determination of 12 bioactive components in traditional Chinese medicine gegen-qinlian decoction // J. Chromatogr. Sci. 2015. V. 53. № 8. P. 1407.
Zhang H., Wu Z., Zhao J., Wang Z. A conversion of sample medium from water to acetonitrile by subzero temperature liquid−liquid extraction for acetonitrile-salt stacking in capillary electrophoresis // IERT Procedia. 2013. V. 5. P. 277.
Bekhterev V.N. Extractive freezing-out in the determination of organic compounds in aqueous media // Mendeleev Commun. 2007. V. 17. P. 241.
Бехтерев В.Н. Выделение фенолов из воды экстракционным вымораживанием // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1045. (Bekhterev V.N. Recovery of phenols from water by extraction freezing // J. Analyt. Chem. 2008. V. 63. № 10. P. 950).
Бехтерев В.Н., Гаврилова С.Н., Кошкарева Е.В. Использование экстракционного вымораживания для решения фармакологических и биохимических задач // Хим.-фарм. журн. 2008. Т. 42. № 2. С. 44.
Подолина Е.А., Рудаков О.Б., Тхинь Ф.В., Рудакова Л.В. Низкотемпературная жидкостная экстракция как способ пробоподготовки фенолов для анализа методом обращенно-фазовой ВЭЖХ // Журн. аналит. химии. 2010. Т. 65. № 2. С. 121. (Podolina E.A., Rudakov O.B., Thin F.V., Rudakova L.V. Low temperature liquid extraction as a method of the pretreatment of phenol samples for reversed phase HPLS // J. Analyt. Chem. 2010. V. 65. № 2. P. 117.)
Бехтерев В.Н., Гаврилова С.Н., Козина Е.П., Маслаков И.В. Экспресс-определение кофеина в крови методом экстракционного вымораживания // Судебно-медицинская экспертиза. 2010. Т. 53. № 5. С. 22.
Бехтерев В.Н. Закономерности поведения растворенных органических веществ в условиях экстракционного вымораживания // Журн. аналит. химии. 2011. Т. 66. № 6. С. 608.
Бехтерев В.Н. Экстракционное вымораживание карбоновых кислот из водного раствора в ацетонитрил в условиях действия поля центробежных сил // Сорбционные и хроматографические процессы. 2015. Т. 15. № 5. С. 683.
Бехтерев В.Н. Экстракционное вымораживание одноосновных карбоновых кислот из воды в ацетонитрил в условиях действия центробежных сил // Журн. физ. химии. 2016. Т. 90. № 10. С. 1558.
Бехтерев В.Н., Гаврилова С.Н., Кошкарева Е.В., Шипанов И.Н. Газохроматографическое определение пировалерона в моче методом экстракционного вымораживания в сочетании с центрифугированием // Судебно-медицинская экспертиза. 2017. Т. 60. № 3. С. 27.
Hu L., Tao Y., Luo D., Feng J., Wang L., Yu M., Li Y., Covaci A., Mei S. Simultaneous biomonitoring of 15 organophosphate flame retardants metabolites in urine samples by solvent induced phase transition extraction coupled with ultra-performance liquid chromatography−tandem mass spectrometry // Chemosphere. 2019. V. 233. P. 724.
Zhang M.S., Li S.J., Yao S.Z., Liu G.Z., Chen B. Solvent induced phase transition extraction method for high performance liquid chromatography−mass spectrometry analysis of plasma samples of pretreatment // Chem. J. Chinese U. 2010. V. 31. № 8. P. 1517.
Liu G.Z., Zhou N.Y., Zhang M.S., Li S.J., Tian Q.Q., Chen J.T., Chen B., Wu Y.N., Yao S.Z. Hydrophobic solvent induced phase transition extraction to extract drugs from plasma for high performance liquid chromatography−mass spectrometric analysis // J. Chromatogr. A. 2010. V. 1217. P. 243.
Cai B.D., Ye E.C., Yuan B.F., Feng Y.Q. Sequential solvent induced phase transition extraction for profiling of endogenous phytohormones in plants by liquid chromatography-mass spectrometry // J. Chromatogr. B. 2015. V. 1004. P. 23.
Wang X., Zhao X., Liu X., Li Y., Fu L., Hu J., Huang C. Homogeneous liquid–liquid extraction combined with gas chromatography – electron capture detector for the determination of three pesticide residues in soils // Anal. Chim. Acta. 2008. V. 620. P. 162.
Yazdanfar N., Yamini Y., Ghambarian M. Homogeneous liquid–liquid microextraction for determination of organochlorine pesticides in water and fruit samples // Chromatographia. 2014. V. 77. P. 329.
Hosseini M.H., Rezaee M., Akbarian S., Mizani F., Pourjavid M.R., Arabieh M. Homogeneous liquid– liquid microextraction via flotation assistance for rapid and efficient determination of polycyclic aromatic hydrocarbons in water samples // Anal. Chim. Acta. 2013. V. 762. P. 54.
Amoli J.S., Hassan J., Taleshi M.S. Development of low density miniaturized homogeneous liquid–liquid extraction for determination of organochlorine pesticide residues in cow’s milk by gas chromatography/electron capture detector // Austin. Chromatogr. 2014. V. 1. № 2. P. 2379.
Shamsipur M., Hassan J. A novel miniaturized homogenous liquid–liquid solvent extraction-high performance liquid chromatographic−fluorescence method for determination of ultra traces of polycyclic aromatic hydrocarbons in sediment samples // J. Chromatogr. A. 2010. V. 1217. P. 4877.
Hassan J., Farahani A., Shamsipur M., Damerchili F. Rapid and simple low density miniaturized homogeneous liquid–liquid extraction and gas chromatography/mass spectrometric determination of pesticide residues in sediment // J. Hazard. Mater. 2010. V. 184. P. 869.
Rezaei F., Hosseini M.M. New method based on combining ultrasonic assisted miniaturized matrix solid-phase dispersion and homogeneous liquid–liquid extraction for the determination of some organochlorinated pesticides in fish // Anal. Chim. Acta. 2011. V. 702. № 2. P. 274.
Hassan J. Low density miniaturized homogeneous liquid−liquid solvent extraction: a new high throughput sample preparation technique for the determination of polar pesticides in cow milk // J. Anal. Chem. 2014. Т. 69. № 9. С. 851.
Amini T., Hashemi P. Preconcentration and GC–MS determination of caffeine in tea and coffee using homogeneous liquid–liquid microextraction based on solvents volume ratio alteration // J. Chromatogr. B 2018. V. 1092. P. 252.
Shishov A., Bulatov A., Locatelli M., Carradori S., Andruch V. Application of deep eutectic solvents in analytical chemistry. A review // Microchem. J. 2017. V. 135. P. 33.
Cunha S.C., Fernandes J.O. Extraction techniques with deep eutectic solvents // Trends Anal. Chem. 2018. V. 105. P. 225.
Makoś P., Słupek E., Gębicki J. Hydrophobic deep eutectic solvents in microextraction techniques–A review // Microchem. J. 2020. V. 152. Article 104384. https://doi.org/10.1016/j.microc.2019.104384
Khezeli T., Daneshfar A., Sahraei R. Emulsification liquid–liquid microextraction based on deep eutectic solvent: an extraction method for the determination of benzene, toluene, ethylbenzene and seven polycyclic aromatic hydrocarbons from water samples // J. Chromatogr. A. 2015. V. 1425. P. 25.
Aydin F., Yilmaz E., Soylak M. A simple and novel deep eutectic solvent based ultrasoundassisted emulsification liquid phase microextraction method for malachite green in farmed and ornamental aquarium fish water samples // Microchem. J. 2017. V. 132. P. 280.
Shishov A., Volodina N., Nechaeva D., Gagarinova S., Bulatov A. An automated homogeneous liquid−liquid microextraction based on deep eutectic solvent for the HPLC-UV determination of caffeine in beverages // Microchem. J. 2018. V. 144. P. 469.
Sivrikaya S. A deep eutectic solvent based liquid phase microextraction for the determination of caffeine in Turkish coffee samples by HPLC-UV // Food Addit. Contam. A. 2020. V. 37. P. 488.
Khezeli T., Daneshfar A., Sahraei R. A green ultrasonic-assisted liquid–liquid microextraction based on deep eutectic solvent for the HPLC-UV determination of ferulic, caffeic and cinnamic acid from olive, almond, sesame and cinnamon oil // Talanta. 2016. V. 150. P. 577.
Matong J., Mpupa A., Nomngongo P.N. Ultrasound assisted-homogeneous liquid−liquid phase microextraction based on deep eutectic solvents and ethyl acetate for preconcentration of selected organochlorine pesticides in water samples. // Eurasian J. Anal. Chem. 2018. V. 13. № 5. Article em59. https://doi.org/10.29333/ejac/97219
Helalat-Nezhad Z., Ghanemi K., Fallah-Mehrjardi M. Dissolution of biological samples in deep eutectic solvents: an approach for extraction of polycyclic aromatic hydrocarbons followed by liquid chromatography−fluorescence detection // J. Chromatogr. A. 2015. V. 1394. P. 46.
Yilmaz E., Soylak M. A novel and simple deep eutectic solvent based liquid phase microextraction method for rhodamine B in cosmetic products and water samples prior to its spectrophotometric determination // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2018. V. 202. P. 81.
Shishov A., Chromá R., Vakh C., Kuchár J., Simon A., Andruch V., Bulatov A. In situ decomposition of deep eutectic solvent as a novel approach in liquid−liquid microextraction // Anal. Chim. Acta. 2019. V. 1065. P. 49.
Shishov A.Y., Chislov M.V., Nechaeva D.V., Moskvin L.N., Bulatov A.V. A new approach for microextraction of non-steroidal anti-inflammatory drugs from human urine samples based on in-situ deep eutectic mixture formation // J. Mol. Liq. 2018. V. 272. P. 738.
Shishov A., Nechaeva D., Bulatov A. HPLC-MS/MS determination of non-steroidal anti-inflammatory drugs in bovine milk based on simultaneous deep eutectic solvents formation and its solidification // Microchem. J. 2019. V. 150. Article 104080. https://doi.org/10.1016/j.microc.2019.104080
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


