Журнал аналитической химии, 2020, T. 75, № 12, стр. 1059-1079
Современное состояние метода капиллярного электрофореза
Л. А. Карцова a, *, Д. В. Макеева a, Е. А. Бессонова a
a Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Университетский просп., 26, Петродворец, Россия
* E-mail: kartsova@gmail.com
Поступила в редакцию 18.03.2020
После доработки 24.04.2020
Принята к публикации 02.06.2020
Аннотация
С момента своего возникновения метод капиллярного электрофореза превратился в мощный аналитический инструмент анализа пищевых продуктов и объектов окружающей среды, криминалистического и биоаналитического анализа. В обзоре рассмотрены основные тенденции в развитии электрофоретического метода: применение наноматериалов как принципиально новый подход к электрофоретическому разделению аналитов; поиск и реализация эффективных вариантов on-line и in-line концентрирования; сочетание системы капиллярного электрофореза с масс-спектрометрическим детектором для целевого и нецелевого метаболического профилирования.
За последние 10 лет метод капиллярного электрофореза (КЭ) претерпел значительную эволюцию [1]. Главные тенденции дальнейшего развития метода КЭ – это применение наноматериалов как принципиально новый подход к электрофоретическому разделению аналитов; развитие on-line и in-line концентрирования и решение таким образом важнейших проблем метаболомики и протеомики. Немало публикаций посвящено сочетанию системы капиллярного электрофореза с масс-спектрометрическим детектированием (КЭ–МС) с новыми техническими решениями в конструкции интерфейса [2]. В последние годы стали популярны наноспрейные интерфейсы [1]. Общей проблемой, затрудняющей прямое соединение системы КЭ с масс-спектрометрическим детектором, является мешающее влияние нелетучих компонентов фонового электролита (ФЭ) на процесс электроспрей-ионизации. Предложены различные варианты, включая автономное фракционирование, альтернативную ионизацию, разбавление, дериватизацию и др. Системы двумерного варианта капиллярного электрофореза (ВЭЖХ–КЭ или 2D КЭ) представляются многообещающими при реализации обозначенных задач [1]. Особое внимание уделяется двойным системам детектирования [3]. Другое перспективное направление – разработка новых стационарных фаз для капиллярной электрохроматографии (КЭХ). Одна из современных тенденций – применение в качестве стационарных фаз биоматериалов, в частности, бактерий [4].
Существенно расширены и области применения метода КЭ. В качестве объектов, наряду с образцами мочи, сыворотки и плазмы крови, которые остаются по-прежнему золотыми стандартами в клинической, токсикологической и судебно-медицинской экспертизе, активно востребован и электрофоретический анализ таких биологических жидкостей, как грудное молоко, пот, слюна, околоплодные воды, спинномозговая жидкость и др. Специальное внимание, включая режим чип-формата, уделяется электрофоретическому определению в этих биообъектах небольших ионов и молекул: неорганических катионов/анионов, лекарств, аминокислот, пептидов и других низкомолекулярных аналитов [5]. Методами КЭ проводят анализ клеточного метаболизма и отдельных клеток. Капиллярный зонный электрофорез (КЗЭ) оказался перспективным для разделения различных моноклональных антител (mAb) [6, 7].
РАЗДЕЛЕНИЕ ЭНАНТИОМЕРОВ И ПОЛУЧЕНИЕ ХАРАКТЕРИСТИЧЕСКИХ ЭЛЕКТРОФОРЕТИЧЕСКИХ ПРОФИЛЕЙ АНАЛИТОВ
Метод капиллярного электрофореза все шире применяют в области хирального разделения [8]. Добавление хирального селектора непосредственно в фоновый электролит в режиме электрокинетической хроматографии обеспечивает достаточно высокую гибкость хирального КЭ. Кроме того, небольшое количество реагентов, растворителей и образцов, необходимых для КЭ, хорошо вписывается в принципы “зеленой” химии. В работах [9, 10] обсуждаются часто применяемые в капиллярной электрохроматографии хиральные стационарные фазы. В качестве хиральных селекторов применяют циклодекстрины (ЦД), циклофруктаны, белки, соли желчных кислот, полисахариды, ионные жидкости (ИЖ), нуклеотиды, антибиотики и др. Если хиральный селектор обладает свойствами поверхностно-активных веществ (ПАВ), то его добавляют в ФЭ в концентрации выше критической концентрации мицеллообразования (ККМ) [11–14]. Наиболее перспективными оказались хиральные ионные жидкости с хиральным катионом, анионом либо и с тем, и с другим [15]. Синтез новых хиральных ИЖ и оценка их применимости в КЭ рассмотрена в работах [16–20]. Тем не менее, пока не найдены хиральные селекторы, конкурирующие с циклодекстринами с точки зрения доступности, разнообразия и универсальности областей применения. Сочетание хирального КЭ с исследованиями ЯМР и молекулярным моделированием позволяет сделать предположения относительно механизма взаимодействия селектора с аналитом [21].
Метод КЭ–МС активно применяется для получения характеристических электрофоретических профилей аналитов с последующей их хемометрической обработкой [22], что эффективно дополняет другие аналитические платформы при определении полярных и ионогенных метаболитов: сахаров, аминокислот, нуклеотидов, нуклеозидов и др. Данный подход реализован при метаболическом профилировании сыворотки крови при выявлении заболеваний печени [23], образцов сыворотки крови и слюны с целью поиска диагностических маркеров болезни Альцгеймера [24] и шизофрении [25]. Получены электрофоретические профили аминокислот в экстрактах гомогенатов тканей с колоректальной карциномой и аденомой [26]. Показано, что указанные патологии можно различить по содержанию метионина, тирозина, валина и изолейцина. Осуществлен поиск специфичных биомаркеров сыворотки крови для отличия больных гриппом и больных энцефалопатией, провоцированной гриппом [27]. Проанализированы [28] электрофоретические профили образцов слюны больных раком полости рта и поджелудочной железы с обнаружением 57 метаболитов. В работе [29] методом КЭ получены характеристические алкалоидные профили растения Sophora flavescens. На основании концентраций трех алкалоидов – матрина, софоридина и оксиматрина – методом главных компонент (МГК) построена модель, демонстрирующая удовлетворительное разделение двух сортов растений на отдельные кластеры. Применение к алкалоидным профилям метода проекции на латентные структуры (ПЛС) позволило найти связь между химическим составом и антиоксидантной активностью. В работе [30] найдены электрофоретические условия получения характеристических профилей N-связанных гликанов при анализе ряда клеточных линий (HeLa, MCF7 и HepG2). Рассмотрена [31] возможность профилирования внутриклеточных катионных метаболитов методом КЭ–МС в экстрактах, полученных всего из пяти клеток линии HepG2. В работе [32] методом КЭ–МС проведена валидация методики определения моноклональных антител.
Важным направлением является контроль технологических процессов производства пищевых продуктов. Методом КЭ–МС получены характеристические профили образцов зеленых кофейных зерен и зерен, прошедших различную термическую обработку [33]. Применение хемометрических методов (МГК, ПЛС) позволило выявить маркеры процесса обжарки кофе: пиридин, пиррол, бетаин и индол.
Анализу пищевых продуктов посвящена работа [34], в которой методом КЭ–УФ получены характеристические профили жирных кислот оливкового масла. Авторами работы [35] рассмотрены характеристические профили хмеля (Humulus lupulus L.). Изучено влияние различных способов предварительной обработки сигнала и проведена хемометрическая обработка методом главных компонент как по всему профилю, так и по отдельным компонентам. Высокочувствительное профилирование нуклеотидов в клетках млекопитающих методом КЗЭ–МС обсуждается в работе [36]. Метоболическим профилям анионных соединений в различных биологических объектах посвящен обстоятельный обзор [37], а в работе [38] рассмотрены электрофоретические аминокислотные профили плазмы крови.
Методом капиллярного электрофореза получены характеристические профили 16 растений, богатых полифенольными соединениями и эфирными маслами [39]. Результаты проанализированы методом искусственной нейронной сети, что позволило выделить 8 растений, обладающих противовирусной активностью против модельного вируса инфекционного бронхита. Авторы выявили высокую корреляцию между концентрацией полифенольных соединений и противовирусной активностью растений.
МИКРОЭМУЛЬСИОННАЯ ЭЛЕКТРОКИНЕТИЧЕСКАЯ ХРОМАТОГРАФИЯ
Микроэмульсионную электрокинетическую хроматографию (МЭЭКХ) активно используют для определения липофильности кислотных соединений и антибиотиков [40, 41]. Предложено одновременное определение ципрофлоксацина, норфлоксацина, сульфаметоксазола, тетрациклина и окситетрациклина в комбикормах с помощью метода МЭЭКХ. Использование фуллеренов в качестве добавки обеспечило разделение антибиотиков за счет π−π-взаимодействий с ароматическими группами аналитов [41, 42]. Рассмотрено применение микроэмульсий в жидкостной и электрокинетической хроматографии в качестве перспективных экстрагентов для извлечения гидрофобных аналитов из пищевых, фармацевтических, экологических и др. образцов [43]. Немало публикаций посвящено сочетанию МЭЭКХ и мицеллярной электрокинетической хроматографии (МЭКХ) с различными вариантами концентрирования при определении экотоксикантов (хлорфенолов) [44], лигнанов в плодах лимонника [45, 46], рутениевых противоопухолевых агентов [47] и алкалоидов [48].
МЕТОДЫ IN-LINE И ON-LINE КОНЦЕНТРИРОВАНИЯ В КАПИЛЛЯРНОМ ЭЛЕКТРОФОРЕЗЕ
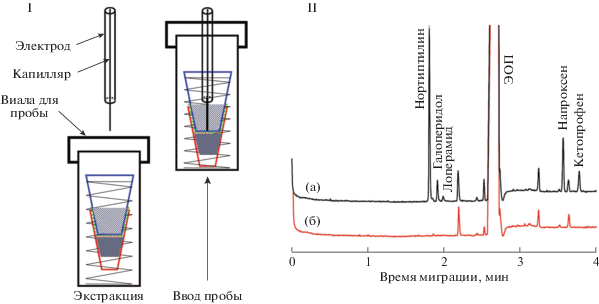
Несмотря на то, что метод КЭ имеет ряд достоинств по сравнению с ВЭЖХ, при обнаружении следовых количеств аналитов в сложной матрице сферу его применения ограничивает недостаточная концентрационная чувствительность. Требуется использование высокочувствительных детекторов (флуориметрический, МС), грамотная стратегия пробоподготовки, включая различные варианты концентрирования. При реализации режима in-line устройство для предварительной подготовки образца соединяется с системой КЭ посредством специального интерфейса до ввода пробы. В случае режима on-line обработка и концентрирование происходят непосредственно внутри капилляра во время или после введения анализируемой пробы [49–55]. Значительное количество публикаций последних лет посвящено сочетанию методов жидкостной микроэкстракции (ЖМЭ) с системой КЭ в режиме in-line [49–66]. Успешно зарекомендовали себя варианты подобного сочетания – капельная микроэкстракция (single drop microextraction, SDME), микроэкстракция внутри капилляра (in-tube microextraction, ITME) и жидкостная экстракция с твердой поверхности (liquid extraction surface analysis, LESA) [49, 50]. В условиях in-line капельной микроэкстракции капля экстрагента (так называемого акцептора) выдавливается прямо на входном конце кварцевого капилляра. Благодаря высокому соотношению фаз экстрагента и раствора пробы достигаются высокие степени концентрирования аналитов [49, 56–60]. Предложен совместный вариант in-line/on-line концентрирования [56, 57]: сначала проводят in-line экстракцию аналитов в каплю пентанола, удерживаемую на конце капилляра с помощью специальной тефлоновой втулки, затем – стэкинг с большим объемом пробы и удалением матрицы элетроосмотическим потоком (ЭОП) (рис. 1) и в завершение проводят анализ методом КЭ–МС/МС [56–58].
Рис. 1.
Схемы in-line капельной микроэкстракции (SDME) и on-line концентрирования (стэкинг с большим объемом пробы с удалением матрицы электроосмотическим потоком, large volume sample stacking, LVSEP) методом КЭ–МС/МС. I – Капельная микроэкстракция с использованием большой капли пентанола в качестве акцептора; II – схема процесса in-line концентрирования: ввод пентанола на входном конце капилляра (а); формирование капли пентанола на конце капилляра и проведение концентрирования (б); введение большого объема экстракта в капилляр (в); on-line концентрирование и удаление матрицы пробы обратным электроосмотическим потоком (г); электрофоретическое разделение и МС/МС-детектирование (д) [57].

В случае трехфазной in-line ЖМЭ аналиты экстрагируются из фазы водного образца в каплю водного экстрагента через тонкий слой органического растворителя. Движущей силой экстракции для ионогенных аналитов является разность значений рН между раствором пробы и экстрагентом [59, 60]. В работе [61] предложена in-line трехфазная микроэлектроэкстракция при определении биогенных аминов в моче методом КЭ. Пределы обнаружения (ПО) составили 15–33 нМ. Для их достижения потребовалось дополнительное on-line концентрирование – динамический скачок рН. При этом, несмотря на явные достоинства капельной микроэкстракции в сочетании с КЭ, нестабильность капли экстрагента на конце кварцевого капилляра ограничивает использование такого подхода. Решение достигнуто с применением варианта in-tube микроэкстракции, когда капля экстрагента находится внутри капилляра. Впервые этот вариант был реализован при электрофоретическом определении хлорфенолов в вине [62], а в работе [63] такой подход успешно применили для определения фенолов в озерной воде. Метод in-line жидкостной капельной микроэкстракции в КЭ реализован и для экстракции компонентов непосредственно с твердой поверхности образца, что снижает влияние матрицы пробы [64]. Достигнутые ПО в ~20 раз ниже допустимых пределов, кроме того, процесс анализа может быть легко автоматизирован [65]. Важной областью применения высокоскоростной in-line микроэкстракции с твердой поверхности является картирование состава поверхности биологических или технических образцов. Предложено [66] сочетание этого подхода с системой КЭ–МС для отбора и концентрирования проб эндогенных метаболитов с поверхностей образцов тканей головного мозга, спинного мозга и почек при целевом и нецелевом профилировании биологически активных аналитов. Выявлены метаболиты и полипептиды из разных участков поверхности исследуемых биологических систем (рис. 2).
Рис. 2.
Схема системы in-line микроэкстракции с твердой поверхности в сочетании с КЭ–МС и пример анализа трех областей ткани мозга крысы (коры, гиппокампуса и таламуса) [67]. ГАМК – γ-аминомасляная кислота.

Ряд публикаций посвящен жидкофазной мембранной микроэкстракции в сочетании с электрофоретическим разделением аналитов [67–74]. В работе [68] рассмотрены возможности одновременного анализа смесей основных и кислотных лекарственных препаратов в образцах мочи. Полипропиленовую мембрану, пропитанную органическим растворителем, помещали во входном флаконе между двумя водными фазами (раствором пробы и фазой акцептора). Экстрагированные аналиты вводили в кварцевый капилляр прямо с поверхности мембраны (рис. 3). Предложенный подход позволяет эффективно устранять мешающее влияние матрицы и хорошо совместим с коммерческими системами КЭ.
Рис. 3.
I – Схема мембранной микроэкстракции с поверхности жидкой мембраны. II – Электрофореграмма совместного определения основных и кислотных лекарственных препаратов в образцах мочи с добавкой (а) и без добавки (б) стандартов. Условия экстракции: раствор образца – 150 мМ NaCl, содержащий 10 мкг/мл пяти препаратов; раствор акцептора – 2.5 мМ NaOH; жидкая полипропиленовая мембрана. Условия капиллярного электрофореза: фоновый электролит – 30 мМ раствор ацетата аммония, pH 4.2, +25 кВ, 50 мбар, 5 с, 214 нм [68].
Интересный вариант мембранной ЖМЭ обсуждается в работе [69]. Микроэлектромембранная экстракционная установка заполнена пятью последовательными слоями несмешивающихся водных и органических растворов; водный образец располагается между двумя жидкими мембранами и двумя экстрагирующими растворами. При наложении электрического потенциала неорганические катионы и анионы из раствора образца мигрируют в противоположных направлениях, проникая через мембраны, в то время как целевые компоненты остаются в образце. Таким образом, осуществляется эффективное удаление мешающих веществ и обессоливание образца до электрофоретического анализа.
При in-line твердофазной экстракции (ТФЭ)–КЭ концентрирующая колонка закрепляется (или синтезируется в виде монолитной пористой колонки) непосредственно на входном конце капилляра. В результате экстракция, концентрирование, ввод пробы и разделение аналитов происходит в одном и том же кварцевом капилляре. Процесс легко поддается автоматизации. Для заполнения капилляров используют те же сорбенты, что и для off-line ТФЭ. В работе [75] рассмотрены сорбционные материалы для in-line ТФЭ–КЭ. Для нецелевого метаболического профилирования плазмы крови и поиска биомаркеров болезни Гентингтона методом КЭ–МС использовали in-line микрокартридж с сорбентом С18 [76]. Однако из-за сложности матрицы плазмы крови картриджи необходимо было менять через каждые 10 анализов. Методом in-line ТФЭ–КЭ оптимизированы условия синтеза монолитного сорбента в капилляре для концентрирования гидроксилсодержащих аналитов в образцах мочи [77]. На примере катехоламинов достигнуто количественное извлечение и концентрирование аналитов из образцов мочи объемом 2 мкл. Пределы обнаружения составили ~4.8 нг/мл.
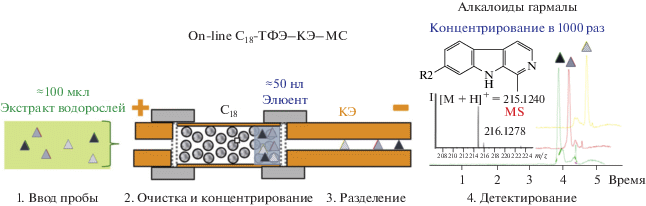
Для концентрирования предложены также системы on-line ТФЭ–КЭ, в которых миркокартридж для ТФЭ подключали к системе капиллярного электрофореза через специальный интерфейс с целью автоматического переключения потоков [78], что позволило оптимизировать условия концентрирования и разделения сульфамидных антибиотиков, содержащихся в сточных водах. Вариант on-line ТФЭ–КЭ успешно применен [79] для определения алкалоидов в водорослях Undaria pinnatifida, достигнуты крайне низкие пределы обнаружения (на уровне ∼ppt) (рис. 4 ). Несмотря на привлекательность данного подхода, есть и ограничения: недостаточная воспроизводимость и отсутствие коммерчески доступных капилляров и приборов.
Рис. 4.
Схема on-line ТФЭ–КЭ алкалоидов в экстрактах водорослей с использованием микрокартриджа с сорбентом С18, расположенным между двумя частями кварцевого капилляра [79].
Методы on-line концентрирования в КЭ основаны на изменении скорости миграции аналитов в капилляре. Одним из наиболее известных является стэкинг с усилением поля, при котором степень концентрирования зависит от соотношений проводимости растворов пробы и фонового электролита. Большие значения факторов концентрирования (до 1000) можно получить, если вводить пробу электрокинетически (электростэкинг) [79–84]. Для увеличения фактора концентрирования матрица образца должна быть удалена до электрофоретического разделения, что достигается переключением полярности или с помощью обращенного ЭОП [85]. Для высокосолевых образцов требуется дополнительная стадия подготовки образца: разбавление пробы или обессоливание. Так, в работе [80] при определении нейротоксина N-метиламино-L-аланина в различных типах моллюсков методом КЭ–МС/МС в сочетании со стэкингом потребовалась предварительное проведение off-line ТФЭ на сильном катионообменнике. Тем не менее, приемы стэкинга по-прежнему активно используются благодаря простоте выполнения и совместимости с различными модификациями КЭ и системами детектирования [86–94].
Поскольку многие биологические пробы и образцы окружающей среды представляют собой сложные матрицы с высокой проводимостью, более востребованными являются методы on-line концентрирования (динамический рН скачок, свипинг, концентрирование аналитов с разрушением мицелл и т.д.). При динамическом рН скачке создается градиент рН между зонами пробы и фонового электролита [94]. Ионная форма аналитов, входящих в зону ФЭ, меняется, что приводит к изменению их электрофоретической подвижности. Подобный вариант концентрирования прекрасно зарекомендовал себя в области протеомики и метаболомики [95–98]. Динамический рН скачок хорошо совместим с масс-спектрометрическим детектированием и обычно не требует дополнительной стадии off-line пробоподготовки [98–101]. В работе [101] применение динамического рН скачка в сочетании с in-line ТФЭ на монолитном катионообменном микрокартридже в КЭ–МС позволило идентифицировать 145 групп белков и 365 пептидов всего лишь в 5.5 нг кишечных бактерий E. coli. digest (кишечная палочка) и 330 групп белков и 872 пептидов в белках 50 нг икры лягушек Xenopus. Образец вводят в раствор с низким значением pH, а десорбируют с использованием оснóвного раствора.
По сравнению со стэкингом с усилением поля динамический pH скачок обеспечивает более эффективное концентрирование белков. В работе [102] удалось идентифицировать около 600 протеоформ и 200 белков в 1 мкл образца.
Другой подход, обеспечивающий концентрирование ионных и нейтральных аналитов, основан на взаимодействии аналитов с псевдостационарной фазой: свипинг [49, 51, 55, 103–111], концентрирование нейтральных аналитов с разрушением мицелл (analyte focusing by micelle collapse, AFMC) [112–114]. Аналогичный подход для заряженных компонентов – стэкинг мицелл на границе с растворителем (micelle to solvent stacking, MSS) [115–118]; ряд публикаций посвящен стэкингу мицелл на границе с циклодекстрином (micelle to cyclodextrin stacking, MCDS) [119–121]. В работе [104] для определения нейтральных биологически активных веществ в китайских лечебных травах разработан вариант свипинга с участием ЦД в мицеллярной электрокинетической хроматографии (МЭКХ), что позволило существенно увеличить степени концентрирования по сравнению с классическим свипингом. Такой вариант часто используют в сочетании с методами off-line твердофазной микроэкстракции (ТФМЭ) [105] и дисперсионной жидкостной микроэкстракции (ДЖЖМЭ) [106–110]. Подобный подход использован для концентрирования фосфорорганических пестицидов в лекарственных растениях (факторы концентрирования ∼6000) [108], бензимидазолов в моче животных [110]. В работе [108] для концентрирования и определения карбамазепина и клобазама в образцах мочи человека методом МЭКХ разработан вариант свипинга в сочетании с off-line дисперсионной жидкостно–жидкостной микроэкстракцией с применением циклодекстрина. Степени концентрирования составили 3575 и 4675, а пределы обнаружения (ПО) – 0.6 и 0.5 нг/мл.
Предложен вариант двойного свипинга [111], в котором аналиты концентрируются катионными мицеллами с одной стороны пробы и анионными – с другой. При включении напряжения мицеллы мигрируют навстречу друг другу. В отличие от традиционного подхода, где аналиты концентрируются за счет взаимодействия с псевдостационарной фазой, в таком варианте концентрирование достигается в результате разрушения комплексов аналит–мицелла [112, 115]. Суть предложенного подхода заключается в переносе, высвобождении из мицелл и концентрировании нейтральных аналитов на границе между зоной пробы и ФЭ. На границе с фоновым электролитом концентрация поверхностно-активных веществ (ПАВ) становится ниже ККМ, что приводит к разрушению мицелл и концентрированию определяемых соединений.
В работе [114] определяли нейтральные пестициды на поверхности кожуры яблока с использованием сочетания автоматической жидкостной экстракции с твердой поверхности и стэкинга с разрушением мицелл с высокой чувствительностью (1.8–6.4 ppb) в течение 10 мин. Мицеллярный раствор с высокой проводимостью, используемый на стадии экстракции, улучшил эффективность извлечения пестицидов и позволил осуществить on-line концентрирование введенного экстракта. Описано [114] определение фталатов в фармацевтических препаратах методом МЭЭКХ с использованием стэкинга с разрушением мицелл. Дополнительное концентрирование достигнуто введением водной пробки до ввода анализируемой пробы.
Вариант on-line концентрирования, получивший название “стэкинг мицелл на границе с растворителем” реализован при определении наркотиков и их метаболитов в образцах мочи [116]; пределы обнаружения составили 50–100 нг/мл. Такой подход использован [118] для электрокинетического удаления мицелл додецилсульфата натрия (ДДСН) из пробы после денатурации белков с целью последующего масс-спектрометрического анализа.
Предложена [119] интересная модификация on-line концентрирования c разрушением мицелл – “стэкинг мицелл на границе с циклодекстрином” (MCDS), основанная на разрушении мицелл на границе между заряженными мицеллами и нейтральными циклодекстринами. Раствор пробы, содержащий мицеллы, и раствор ЦД последовательно вводят в капилляр, заполненный ФЭ. При включении напряжения мицеллы с аналитами проникают в зону с ЦД. Образование стабильных комплексов ЦД–ПАВ вызывает разрушение мицелл за счет образования комплексов включения между ЦД и ПАВ, что уменьшает концентрацию свободных мономеров ПАВ, необходимых для образования мицелл. Этот процесс продолжается до тех пор, пока не разрушатся все мицеллы. В результате компоненты пробы эффективно концентрируются на границе с ФЭ и затем разделяются в условиях КЗЭ или МЭКХ.
Такой подход реализован при электрофоретическом определении низкомолекулярных ионных и нейтральных биологически активных веществ [119–122] и биополимеров [119]. В работе [120] предложен метод двустадийного концентрирования для увеличения чувствительности определения нейтральных аналитов. На примере сапонинов в образцах традиционных китайских лекарственных препаратов достигнуто концентрирование в 140–152 раза. Все обсуждаемые варианты концентрирования подходят для биологических образцов с матрицами с высокой проводимостью и таким образом имеют перспективы применения в биомедицинских исследованиях.
Сочетание различных механизмов концентрирования позволяет достичь наибольших степеней концентрирования одновременно для аналитов различной природы (табл. 1) [122–142].
Таблица 1.
Примеры совместного применения различных механизмов on-line концентрирования в капиллярном электрофорезе
| Метод КЭ | Аналиты | Объекты | Фактор концентрирования | Примечание | Лите-ратура |
|---|---|---|---|---|---|
| Стэкинг-свипинг (раствор пробы не содержит мицелл и имеет проводимость меньше, чем раствор ФЭ) |
|||||
| КЗЭ, МЭКХ | Биогенные амины | Плазма крови, моча | 85 | ИЖ (С12MImCl, C16MImCl) в качестве ПАВ | [74–76] |
| МЭКХ | Стероидные гормоны | Плазма крови, моча | 106 | ИЖ в качестве модификатора ПАВ | [77] |
| КЗЭ с ЦД | Антибиотики (α-аминоцефалоспорины) |
Поверхностные воды | ПО 60 нг/л | Комплексообразование с 2-гидроксипропил-β-ЦД; сочетание с off-line ТФЭ |
[78] |
| МЭКХ | Восемь β-агонистов | Корма для животных | 400–2000 ПО 5 нг/мл |
Диалкиланионное ПАВ ди(2-этилгексил)сульфосукцинат натрия |
[79] |
| МЭКХ | 5-Нитроимидазол | Куриные яйца | ПО 2.1–5.0 нг/г | ДДСН; сочетание с off-line ТФЭ |
[80] |
| Хиральный МЭКХ с ЦД | Энантиомеры метамфетамина | Образцы волос | 190–10 000; ПО 70–90 пг/мл (для каждого изомера) |
ДДСН и сульфо-ЦД | [81] |
| Стэкинг – стэкинг мицелл на границе с растворителем (MSS) (пробу разбавляют органическим растворителем, ФЭ с высокой проводимостью содержит мицеллы) |
|||||
| КЗЭ | Антибиотики (триметоприм, сульфаметоксазол) | Продукты животного происхождения (молочные продукты, яйца, мед) |
301–329 ПО 7.7– 8.5 нг/мл |
Мицеллы ДДСН | [82] |
| Неводный КЗЭ | Противоопухолевый препарат (тамокссифен) и его метаболиты | Сыворотка крови | 50–110 ПО 35 нг/мл |
Мицеллы ДДСН; микрочип-КЭ с кондуктометрическим детектированием |
[83] |
| КЭ | Ванкомицин | Плазма крови | 83 ПО 1.2 мкг/мл |
Микрочип-КЭ с кондуктометрическим детектированием | [84] |
| Свипинг–MSS (раствор пробы и ФЭ не содержат ПСФ; ПСФ вводится между зоной пробы и ФЭ) |
|||||
| КЗЭ | Гербициды (фосфорорганические и четвертичные аммониевые соединения) | Пиво | 90 | Мицеллы ДДСН; сочетание с off-line ЖЖМЭ |
[85] |
| Стэкинг–свипинг – стэкинг мицелл на границе с растворителем (MSS) | |||||
| КЗЭ | Органические кислоты | Моча | 2424 | ИЖ 1-додецил-3-метилимидазолий гидросульфат в качестве ПАВ | [86] |
| Стэкинг – стэкинг мицелл на границе с циклодекстрином (MCDS) | |||||
| МЭКХ | Сапонины | Китайские биологически активные добавки и моча | 140–152 ПО 0.2–0.3 мкг/мл |
Мицеллы ДДСН, для концентрирования MSS используется 2-гидроксипропил-β-ЦД |
[73] |
| ИТФ-свипинг (ИТФ проводится до свипинга; для сочетания ИТФ и свипинга используется ФЭ, содержащий ПСФ, а в пробе она отсутствует) |
|||||
| МЭКХ | Белки | Моча | 196 ПО 0.06 – 1 мкг/мл |
Неионное ПАВ Brij 35; сочетание с in-line ТФЭ |
[87] |
| МЭКХ | Бактерии | Моча и плазма крови | 680 | Неионное ПАВ Brij 35 | [88] |
| ИТФ-свипинг–динамический рН скачок | |||||
| МЭКХ | Хлорфенолы | Вино | 260–790 ПО 5.5–16.0 нг/мл | Неионное ПАВ Brij 35; в сочетании с off-line ЖМЭ |
[89] |
| Динамический рН скачок – свипинг (раствор пробы не содержит мицелл и имеет отличное от ФЭ значение рН) |
|||||
| МЭКХ | Производные глутатиона, аминокислоты (глицин, цистеин, глутаминовая кислота) | Клетки бактерий | 87–430 ПО 0.01– 0.1 нМ |
Мицеллы ДДСН, рН пробы 4.5; рН ФЭ – 9.5 |
[90] |
| Электрокинетическое суперконцентрирование (электростэкинг–ИТФ) | |||||
| МЭКХ | Гербициды | Природная вода | 1500–1800 ПО 0.15 нг/мл |
Терминальный электролит – ЦТАБ; в сочетании с on-line жидкой мембраной на конце капилляра |
[91] |
| КЗЭ | Препараты для лечения гиперлипидемии | Природная вода | 1000 ПО 180 нг/л |
В сочетании с ЖЖЭ. Обращение ЭОП с помощью гексадиметрин бромида |
[92] |
| КЗЭ | Эндокринный (метилпарабен) и фенольные (2-нитрофенол, 4-хлорфенол) загрязнители | Природная вода | 100–737 ПО 1 нг/л–1 мкг/л |
Обращение ЭОП с помощью гексадиметрин бромида | [93] |
| Неводный КЗЭ | Тамоксифен и его метаболиты | Плазма крови | 160–600 ПО 0.05–0.25 нг/мл |
Сочетание с ЖЖЭ | [94] |
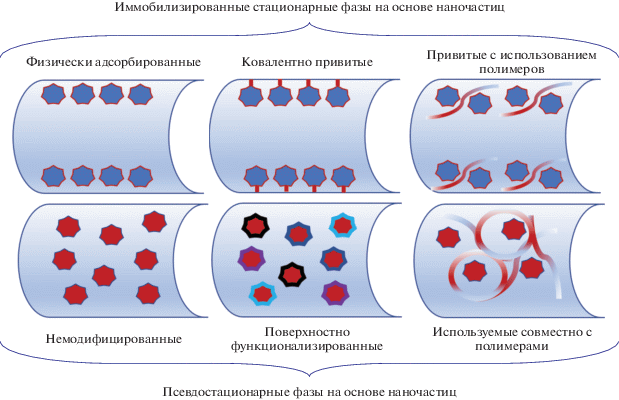
НАНОЧАСТИЦЫ В ЭЛЕКТРОКИНЕТИЧЕСКИХ МЕТОДАХ РАЗДЕЛЕНИЯ
Наночастицы (НЧ) обладают уникально высокой удельной площадью поверхности, образуют устойчивые суспензии в воде и в большинстве используемых в КЭ фоновых электролитах, совместимы со многими органическими растворителями и МС-детектированием [143]. Эти свойства делают их наиболее перспективными модификаторами фонового электролита и стенок кварцевого капилляра в электрокинетических методах разделения. Они могут быть использованы при создании прочных физически адсорбированных и ковалентных покрытий, а также при формировании динамических покрытий, предотвращая сорбцию основных аналитов на стенках капилляра и способствуя повышению селективности электрофоретического разделения за счет взаимодействия со стационарной фазой в условиях капиллярной электрохроматографии. Наночастицы могут выполнить роль псевдостационарных фаз для обеспечения разделения нейтральных аналитов и соединений с близкими электрофоретическими подвижностями. Пример первого такого применения НЧ в мицеллярной электрокинетической хроматографии был опубликован еще в 1989 г., где полимерные НЧ использовали для разделения катехинов [144]. Достигнутые значения эффективности и факторов разрешения были настолько высокими, что за этим сообщением последовала серия публикаций, посвященных применению НЧ на основе золота, серебра, оксида титана, фуллеренов, углеродных нанотрубок и т.д. в качестве покрытий стенок капилляра и псевдостационарных фаз для разделения аналитов различной природы [143, 145, 146]. Ниже будут рассмотрены основные типы наночастиц и сфера их применения в КЭ за последние годы.
Наночастицы, востребованные в электрокинетических методах, включают углеродные, силикагелевые, металлические, металл-оксидные и полимерные материалы [143]. Их подразделяют на неорганические НЧ и органические на полимерной основе (ПНЧ). Последние, в отличие от неорганических, образуют стабильные суспензии в воде и большинстве фоновых электролитов и могут храниться в неизменном состоянии годами [147]. Интересной особенностью ПНЧ является наличие внутримолекулярных полостей, доступных для взаимодействия с аналитами. Наиболее подробно применение ПНЧ в электрокинетических методах разделения рассмотрено в обзоре 2019 г. [148]. Применение металлических и металл-оксидных НЧ нередко сопряжено с необходимостью поверхностной модификации частиц для увеличения их стабильности в водных средах. В качестве модификаторов могут быть использованы ПАВ, заряженные и нейтральные полимеры.
Полимерные наночастицы в качестве покрытий стенок капилляра и псевдостационарных фаз. Полимерным наночастицам из-за большого количества функциональных групп на поверхности свойственны хорошие сорбционные характеристики; они применяются при создании ковалентных и динамических покрытий. Природа функциональных групп определяет режим разделения аналитов с участием ПНЧ. Такие наноразмерные модификаторы могут подавлять или обращать ЭОП, предотвращать сорбцию основных аналитов на стенках капилляра, влиять на селективность их разделения, реализуя ионообменный [149–151], обращенно-фазовый [152, 153] или аффинный механизмы [154], а также способствовать хиральному разделению [155–157].
Первые работы, демонстрирующие перспективы использования наноразмерных ионообменников для концентрирования и электрофоретического разделения неорганических катионов и анионов, рассмотрены в обзорной статье [144]. В работах [149–151] предложено использовать латексные катионо- и анионообменные НЧ для создания трехслойного прочно адсорбированного покрытия стенок капилляра с целью дальнейшего применения при концентрировании органических оснований, щелочных и щелочноземельных металлов. Проблемы низкой емкости созданных покрытий при работе с высокосолевыми матрицами проб решали совместным использованием метакрилатных монолитов и ионообменных ПНЧ [150]. Разработка способа получения полимерных наночастиц на основе стирола и дивинилбензола с терминальными сульфо- и четвертичными аммонийными группами путем размола соответствующих макроионитов [147] открывает перспективы применения таких твердых ионообменных НЧ для разделения неорганических анионов, карбоновых кислот [158], а также оснóвных аналитов – катехоламинов и аминокислот [159] в режиме капиллярной электрохроматографии (КЭХ). Полученные таким образом физически адсорбированные покрытия отличаются стабильностью в широком диапазоне рН и обеспечивают высокие значения эффективности и факторов разрешения. Преимуществом их явилась также возможность применения on-line концентрирования, что привело к существенному снижению ПО аналитов. Аналогичный пример использования ПНЧ на основе модифицированного триметиламином поли(хлорметилстирола) для концентрирования бромат-ионов описан в работе [160]. При этом круг аналитов не ограничивается низкомолекулярными неорганическими и органическими анионами. В работе [161] обсуждается применение наноразмерного анионита для улучшения разрешения и снижения пределов обнаружения тетрациклиновых антибиотиков. Предложен [156] способ модификации ПНЧ на основе сополимера дивинилбензола и винилхлорбензола N,N-диметилдециламино-группами, позволяющий получать стабильные физически адсорбированные покрытия стенок кварцевого капилляра с реализацией обращенно-фазового режима разделения. Полимерные наночастицы с С10 привитыми алкильными радикалами сорбировались на стенках капилляра с привитыми сульфо-группами. Авторы показали пригодность такого покрытия для разделения незаряженных производных ароматических кетонов и альдегидов в условиях обращенно-фазовой КЭХ. Гидрофобные взаимодействия с аналитами приписывают и лизинзамещенным поли(глицидилметакрилатным) наночастицам, используемым в качестве покрытия стенок капилляра при разделении ароматических аминокислот [157].
Легкость функционализации ПНЧ существенно расширила спектр возможных применений капиллярных покрытий на их основе, включающих концентрирование и разделение фосфопептидов в режиме металл-аффинной КЭХ [158], разделение энантиомеров аминокислот и жирорастворимых витаминов [159, 160]. Описаны примеры модифицирования полистирольных НЧ молекулами белков [161], что обеспечило экспрессное (в течение 3 мин) разделение энантиомеров аминокислот.
Другое перспективное направление – использование ПНЧ в качестве псевдостационарных фаз. В отличие от мицелл, образуемых ПАВ, наночастицы проявляют высокую стабильность, совместимость с органическими растворителями и МС-детектированием. Полимерные наночастицы за счет поверхностного заряда имеют собственную электрофоретическую подвижность, а наличие гидрофобных доступных внутримолекулярных полостей позволяет проводить разделение нейтральных аналитов.
В работе [162] подробно описаны наиболее ранние примеры использования ПНЧ в качестве псевдостационарных фаз для электрофоретического разделения производных фенолов, поли-ароматических углеводородов, стероидов, ароматических кислот, катехинов и т.д. Позднее Палмером и сотр. [163] проведено фундаментальное исследование взаимодействий амфифильных полимерных НЧ с заряженными карбоксилатными терминальными группами. Результаты оказали удивительными. Синтезированные ПНЧ проявили в большей степени склонность к гидрофобным взаимодействиям с нейтральными соединениями (алкилфенилкетонами), чем к электростатическим с положительно заряженными аналитами. Дальнейшие работы в этом направлении показали [164], что селективность разделения, а также скорость анализа напрямую зависят от гидрофобности матрицы ПНЧ: чем более гидрофобным является ядро НЧ, тем меньше молекул воды могут проникать в их внутримолекулярные полости, а значит такие частицы имеют более плотный поверхностный заряд и меньший размер частиц, большую электрофоретическую подвижность и силу взаимодействия с нейтральными аналитами. Аналогичные взаимодействия обнаружены и для положительно заряженных ПНЧ с терминальными триметиламмонийными группами [165]. В отличие от низкомолекулярных аналитов, белки проявляют большую склонность к электростатическим взаимодействиям с ПНЧ, выполняющими функции псевдостационарных фаз. В работах [166, 167] обсуждаются возможности использования ПНЧ для улучшения разделения основных белков и изучения механизма взаимодействия в системе “ПНЧ–белки”.
Таким образом, ПНЧ являются весьма перспективными модификаторами ФЭ и стенок кварцевого капилляра благодаря легкости функционализации, высокой удельной поверхности, совместимости с МС-детектированием, устойчивостью к использованию органических растворителей. Ограничением таких модификаторов на органической основе является необходимость воспроизводимого синтеза, позволяющего получать НЧ с одинаковым распределением частиц по размеру.
Наночастицы на неорганической основе в качестве покрытий стенок капилляра и псевдостационарных фаз. Разработка способов получения монодисперсных наночастиц на неорганической основе различной формы и размера расширила области применения НЧ в КЭ в качестве стационарных и псевдостационарных фаз, позволила добиться улучшения селективности разделения широко круга аналитов [168]. Тем не менее, склонность к агломерации и неустойчивость при длительном хранении требуют стабилизации наночастиц за счет использования низко- и высокомолекулярных модификаторов. Молекулы ПАВ или водорастворимых полимеров создают покрытие на поверхности наночастиц, препятствуя агломерации и увеличивая устойчивость в водных средах.
На рис. 5 представлены различные варианты применения наноразмерных модификаторов в капиллярном электрофорезе (с использованием низко- и высокомолекулярных модификаторов и без них) в качестве физически адсорбированных и ковалентно привитых покрытий, а также псевдостационарных фаз.
Преимуществом наночастиц золота (НЧЗ) является способность взаимодействовать со множеством функциональных групп (тиольных –SH, амино –NH2 или гидрокси –OH), содержащихся в молекулах биологически активных соединений. Их используют для регулирования электрофоретических подвижностей аналитов, а следовательно, и селективности их разделения. Склонность к агломерации НЧЗ делает предпочтительным их совместное применение со стабилизирующими модификаторами. В качестве примера можно привести описанный в работе [169] вариант кватернизированной целлюлозы с НЧЗ для создания прочного и стабильного покрытия стенок капилляра, обеспечивающего разделение различных гликоформ протеинов. Имеются примеры применения НЧЗ при определении белков, где в качестве стабилизрующего агента использовали поли(диаллилдиметиламмоний) хлорид [170], а также cовместно с НЧЗ, поли(этиленоксидом) и дидодецилдиметиламмоний бромидом [171]. Вариант создания покрытия стенок капилляра на основе НЧЗ описан в работе [172]: капилляр последовательно обрабатывали поли(диаллилдиметиламмоний хлоридом), отрицательно заряженным поли(стиролсульфонатом) и положительно заряженными наночастицами золота. Синтезированное покрытие проявляло мультифункциональность, способствуя разделению основных и кислотных белков, а также полиароматических углеводородов по обращенно-фазовому механизму. Рассмотрен [173] пример отдельного применения НЧЗ для создания физически адсорбированного, а также ковалентно привитого покрытия за счет дериватизации стенок кварцевого капилляра аминопропилтриэтоксисиланом. Авторы указали на исключительную стабильность такого покрытия, позволяющую проводить до 900 разделений пептидов без потери селективности разделения и эффективности.
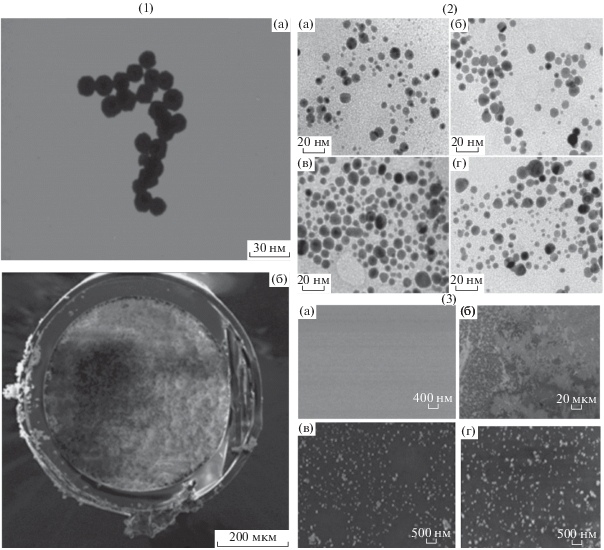
В работе [174] рассмотрено получение циклодекстриновых производных НЧЗ, модифицированных полидопаминовым полимером (ПДА), для разделения энантиомеров 7 оптически активных лекарственных средств. Система НЧЗ–ПДА перспективна в первую очередь за счет возможности проведения совместного внутрикапиллярного синтеза наночастиц и полидопаминового полимера, что приводит к получению воспроизводимых и равномерных покрытий с широким спектром применения: разделение аминокислот [175], энантиомеров биологически активных соединений [176], пептидов [177] и т.д. Некоторые изображения НЧЗ, полученные с помощью сканирующей электронной микроскопии (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ), представлены на рис. 6.
Рис. 6.
ТЭМ- и СЭМ-изображения различных наночастиц золота, используемых в электрокинетических методах, в том числе нанесенных на поверхность стенок кварцевого капилляра. (1) ТЭМ- и СЭМ-фотографии наночастиц золота (а), полимерного монолита, на стенках кварцевого капилляра, модифицированного наночастицами золота (б) [177]; (2) ТЭМ-фотографии наночастиц золота, модифицированных кватернизированной целлюлозой с различным содержанием наночастиц золота, %: 4.6 (а), 7.4 (б), 19.3 (в), 32.4 (г) [169]; (3) СЭМ-фотографии немодифицированного кварца (а), модифицированного полидопаминовым полимером (б), модифицированного полидопаминовым полимером и наночастицами золота (в), модифицированного полидопаминовым полимером, наночастицами золота и молекулами ДНК (г) [176].
Наночастицы на основе силикагеля (СНЧ), коммерчески доступные и стабильные в среде органических растворителей, нашли широкое применение в КЭ в качестве покрытий стенок кварцевого капилляра. В работе [178] предложен синтез покрытия на основе силикагелевых наночастиц с использованием поли(лизинового) полимера в качестве подложки для прикрепления СНЧ к поверхности капилляра. Мультислойное покрытие проявило способность к разделению биогенных аминов с высокими чувствительностью и селективностью. Рассмотрены [179, 180] примеры совместного использования полимеров и СНЧ при электрофоретическом определении белков. Авторы работы [181] добились успешного электрофоретического разделения гликоформ белков с использованием капиллярного покрытия наночастиц на основе TiO2, стабилизированных ПДА. Аналогичный подход предложен в работе [182], где сформированное покрытие стенок кварцевого капилляра применили для разделения алкалоидов и неорганических анионов.
Наночастицы на неорганической основе хорошо зарекомендовали себя в качестве псевдостационарных фаз в мицеллярной электрокинетической хроматографии. Обсуждается [183–186] сфера применения НЧЗ совместно с поли(этиленоксидом) для разделения фрагментов ДНК. Отмечено улучшение разрешения и рост эффективности. Авторы полагают, что высокая удельная поверхность НЧЗ усиливает взаимодействие молекул ДНК с поли(этиленоксидом) в процессе разделения.
В качестве псевдостационарных фаз в МЭКХ нашли применение и функционализированные силикагелевые НЧ за счет легкости модификации. Так, диаминопроизводные СНЧ хорошо зарекомендовали себя при определении органических кислот в пищевых объектах [187], а СНЧ, модифицированные борной кислотой, – при электрофоретическом определении гликозилированного гемоглобина – диагностического маркера сахарного диабета [188]. Введение в фоновый электролит, содержащий хиральный селектор, функционализированных СНЧ, повышает факторы энантиоселективности при разделении рацематов аминокислот и лекарственных препаратов [189, 190]. Сообщается [191] о высокоселективном разделении пятнадцати пар энантиомеров лекарственных препаратов с использованием пепсина в качестве хирального селектора, иммобилизированного на СНЧ. В работе [192] описан пример использования фунционализированных СНЧ одновременно в качестве экстрагентов и псевдостационарных фаз для разделения и концентрирования четырех пищевых красителей.
Перспективными материалами, способными выполнять функции псевдостационарных фаз, являются углеродные нанотрубки (УНТ). Помимо высокой удельной поверхности, они способны взаимодействовать с аналитами за счет π–π стэкинговых, Ван-дер-Ваальсовых взаимодействий и образования водородных связей. Однако из-за низкой растворимости УНТ в водных и водно-органических средах необходима их предварительная модификация. Модифицированные поверхностно-активными веществами УНТ в условиях неводного КЭ применили для селективного разделения пяти алкалоидов [193], для разделения липидов [194], производных фенолов [195], катионов металлов [196], иодсодержащих анионов [197]. Описаны [198] примеры совместного применения УНТ и хиральных ионных жидкостей для увеличения энантиоселективности при разделении рацематов лекарств.
Рост числа публикаций, посвященных успешному электрофоретическому применению наноразмерных модификаторов в качестве псевдостационарных и стационарных фаз, свидетельствует о перспективности подобных исследований.
* * *
Таким образом, за последние пять−десять лет существенно расширены аналитические возможности метода капиллярного электрофореза. Применение динамических и ковалентно связанных покрытий стенок кварцевого капилляра с применением наночастиц и наноструктурированных полимеров позволило реализовать высокоэффективный режим капиллярной электрохроматографии. Новые подходы к внутрикапиллярному концентрированию, наряду с известными ранее, обеспечили существенное снижение пределов обнаружения биологически активных аналитов в сложных матрицах. Метод КЭ–МС активно применяется при метаболическом профилировании биологических жидкостей с целью поиска доминирующих диагностических маркеров. Метод капиллярного электрофореза заметно укрепил свои позиции и в области хирального разделения.
Работа выполнена при финансовой поддержке проекта РНФ № 19-13-00370.
Список литературы
Schlecht J., Jooß K., Neusüß C. Two-dimensional capillary electrophoresis-mass spectrometry (CE−CE−MS): Coupling MS-interfering capillary electromigration methods with mass spectrometry // Anal. Bioanal. Chem. 2018. V. 410. P. 6353
Zhou W., Zhang B., Liu Y., Wang Ch., Sun W., Li W., Chen Z. Advances in capillary electrophoresis-mass spectrometry for cell analysis // Trends Anal. Chem. 2019. V. 117. P. 316.
Beutner A., Herl Th., Matysik F.-M. Selectivity enhancement in capillary electrophoresis by means of two-dimensional separation or dual detection concepts // Anal. Chim. Acta. 2019. V. 1057. P. 18.
Mao Z., Chen Z. Advances in capillary electro-chromatography // J. Pharm. Anal. 2019. V. 9. P. 227.
Kuban P., Dvorak M., Kuban P. Capillary electrophoresis of small ions and molecules in less conventional human body fluid samples: A review // Anal. Chim. Acta. 2019. V. 1075. P. 1.
Jooß K., Hühner J., Kiessig S., Moritz B., Neusüß C. Two-dimensional capillary zone electrophoresis–mass spectrometry for the characterization of intact monoclonal antibody charge variants, including deamidation products // Anal. Bioanal. Chem. 2017. V. 409. P. 6057.
Hühner J., Jooß K., Neusüß C. Interference-free mass spectrometric detection of capillary isoelectric focused proteins, including charge variants of a model monoclonal antibody // Electrophoresis. 2017. V. 38. P. 914.
Bernardo-Bermejo S., Sanchez-Lopez E., Castro-Puyana M., Marina M.L. Chiral capillary electrophoresis // Trends Anal. Chem. 2020. V. 124. P. 115807.
Fanali S., Chankvetadze B. Some thoughts about enantioseparations in capillary electrophoresis // Electrophoresis. 2019. V. 40. P. 2420.
Hajba L., Guttman A. Recent advances in column coatings for capillary electrophoresis of proteins // Trends Anal. Chem. 2017. V. 90. P. 115 807. P. 38.
Greño M., Marina M.L., Castro-Puyana M. Enantioseparation by capillary electrophoresis using ionic liquids as chiral selectors: Critical review // Anal. Chem. 2018. V. 48. P. 429.
Greño M., Castro-Puyana M., García M.A., Marina M.L. Analysis of antibiotics by CE and CEC and their use as chiral selectors: An update // Electrophoresis. 2019. V. 39. P. 235.
Scriba G.K.E. Chiral recognition in separation sciences. Part I: polysaccharide and cyclodextrin selectors // Trends Anal. Chem. 2019. V. 120. P. 115639.
Scriba G.K.E. Chiral recognition in separation sciences. Part II: Macrocyclic glycopeptide, donor-acceptor, ion-exchange, ligand-exchange and micellar selectors // Trends Anal. Chem. 2019. V. 119. P. 115628.
Greño M., Marina M.L., Castro-Puyana M. Effect of the combined use of g- cyclodextrin and a chiral ionic liquid on the enantiomeric separation of homocysteine by capillary electrophoresis // J. Chromatogr. A. 2018. V. 1568. P. 222.
Wahl J., Holzgrabe U. Capillary electrophoresis separation of phenethylamine enantiomers using amino acid based ionic liquids // J. Pharm. Biomed. Anal. 2018. V. 148. P. 245.
Salido-Fortuna S., Greño M., Castro-Puyana M., Marina M.L. Amino acid ~ chiral ionic liquids combined with hydroxypropyl-b-cyclodextrin for drug enantioseparation by capillary electrophoresis // J. Chromatogr. A. 2019. V. 1607. P. 460375.
Casado N., Salgado A., Castro-Puyana M., García M.A., Marina M.L. Enantiomeric separation of ivabradine by cyclodextrin-electrokinetic chromatography. Effect of amino acid chiral ionic liquids // J. Chromatogr. A. 2019. V. 1608. P. 460407.
Zhang Q. Ionic liquids in capillary electrophoresis for enantioseparation // Trends Anal. Chem. 2018. V. 10. P. 145.
Hussain A., Aljam M.F., Hussain I., Ali I., Future of ionic liquids for chiral separations in high-performance liquid chromatography and capillary electrophoresis: Critical review // Anal. Chem. 2019. V. 49. P. 289.
Szabó Z.I., Ludmerczki R., Fiser B., Noszál B., Tóth G. Chiral separation of rasagiline using sulfobutylether-b-cyclodextrin: capillary electrophoresis, NMR and molecular modeling study // Electrophoresis. 2019. V. 40. P. 1897.
Kok M.G.M., Somsen G.W., Jong G.J. The role of capillary electrophoresis in metabolic profiling studies employing multiple analytical techniques // Trends Anal. Chem. 2014. V. 61. P. 223.
Zeng J., Yin P., Tan Y., Dong L., Hu C., Huang Q., Lu X., Wang H., Xu G. Metabolomics study of hepatocellular carcinoma: discovery and validation of serum potential biomarkers by using capillary electrophoresis-mass spectrometry // J. Proteome Res. 2014. V. 13. № 7. P. 3420.
Tsuruoka M., Hara J., Hirayama A., Sugimoto M., Soga T., Shankle W.R., Tomita M. Capillary electrophoresis-mass spectrometry-based metabolome analysis of serum and saliva from neurodegenerative dementia patients // Electrophoresis. 2013. V. 34. № 19. P. 2865.
Yang X., Sun L., Zhao A., Hu X., Qing Y., Jiang J., Yang C., Xu T., Wang P., Liu J., Zhang J., He L., Jia W., Wan C. Serum fatty acid patterns in patients with schizophrenia: A targeted metabonomics study // Transl. Psychiatry. 2017. V. 7. № 7. P. 1176.
Gao P., Zhou C., Zhao L., Zhang G., Zhang Y. Tissue amino acid profile could be used to differentiate advanced adenoma from colorectal cancer // J. Pharm. Biomed. Anal. 2016. V. 118. P. 349.
Torii Y., Kawano Y., Sato H., Sasaki K., Fujimori T., Kawada J., Takikawa O., Lim C.K., Guillemin G.J., Ohashi Y., Ito Y. Quantitative metabolome profiling reveals the involvement of the kynurenine pathway in influenza-associated encephalopathy // Metabolomics. 2016. V. 12. № 5. P. 84.
Sugimoto M., Wong D.T., Hirayama A., Soga T., Tomita M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles // Metabolomics. 2010. V. 6. № 1. P. 78.
Hou Z., Sun G., Guo Y., Yang F., Gong D. Capillary electrophoresis fingerprints combined with Linear Quantitative Profiling Method to monitor the quality consistency and predict the antioxidant activity of Alkaloids of Sophora flavescens // J. Chromatogr. B. 2019. V. 1133. Article 121827.
Kawai T., Otaa N., Imasatoa A., Shirasaki Y., Otsuka K., Tanaka Y. Profiling of N-linked glycans from 100 cells by capillary electrophoresis with large-volume dual preconcentration by isotachophoresis and stacking // J. Chromatogr. A. 2018. V.1565. P. 138.
Zhang W., Guled F., Hankemeier T., Ramautar R. Utility of sheathless capillary electrophoresis-mass spectrometry for metabolic profiling of limited sample amounts // J. Chromatogr. B. 2019. V. 1105. P. 10.
Giorgetti J., D’Atri V., Canonge J., Lechner A., Guillarme D., Colas O., Wagner-Rousset E., Beck A., Leize-Wagner E., François Y.-N. Monoclonal antibody N-glycosylation profiling using capillary electrophoresis – mass spectrometry: Assessment and method validation // Talanta. 2018. V. 178. P. 530.
Pérez-Míguez R., Sánchez-López E., Plaza M., Marina M.L., Castro-Puyana M. Capillary electrophoresis-mass spectrometry metabolic fingerprinting of green and roasted coffee // J. Chromatogr. A. 2019. V. 1605. Article 360353.
Zhang W., Guled F., Hankemeier T., Ramautar R. Profiling nucleotides in low numbers of mammalian cells by sheathless CE–MS in positive ion mode: Circumventing corona discharge // Electrophoresis. 2020. V. 41. P. 1.
van Mever M., Hankemeier T., Ramautar R. CE–MS for anionic metabolic profiling: An overview of methodological developments // Electrophoresis. 2019. V. 40. P. 2349.
Zhang W., Segers K., Mangelings D., Eeckhaut A.V., Hankemeier T., Heyden Y.V., Ramautar R. Assessing the suitability of capillary electrophoresis-mass spectrometry for biomarker discovery in plasma-based metabolomics // Electrophoresis. 2019. V. 40. P. 2309.
Arroyo-Manzanaresa N., Gabriel F., Carpio A., Arce L. Use of whole electrophoretic profile and chemometric tools for the differentiation of three olive oil qualities // Talanta. 2019. V. 197. P. 175.
Duarte L.M., Adriano L.H.C., de Oliveira M.A.L. Capillary electrophoresis in association withchemometrics approach for bitterness hop(HumuluslupulusL.) classification // Electrophoresis. 2018. V. 39. P. 1399.
Drevinskas T., Mickienė R., Maruška A., Stankevičius M., Tiso N., Šalomskas A., Lelešius R., Karpovaitė A., Ragažinskienė O. Confirmation of the antiviral properties of medicinal plants via chemical analysis, machine learning methods and antiviral tests: A methodological approach // Anal. Methods. 2018. V. 10. P. 1875.
Fernández-Pumarega A., Amézqueta S., Fuguet E., Rosés M. Estimation of the octanol–water distribution coefficient of acidic compounds by microemulsion electrokinetic chromatography // J. Pharm. Biomed. Anal. 2020. V. 179. Article 112 981.
Nieto N.K., Rodriguez J.A., Ibarra I.S., Cruz-Borbolla J., Vasquez-Perez J.M. Determination of antibiotics in feedstuff samples by microemulsion electrokinetic chromatography using fullerene as additive // Electrophoresis. 2018. V. 39. № 17. P. 2228.
Hefnawy M., Alzamil A., Abuelizz H., AlShehri M. New bioanalytical microemulsion Electrokinetic chromatography method for the simultaneous determination of Trifluridine with its metabolites and Tipiracil in rat plasma: Application to pharmacokinetic studies // Saudi Pharm. J. 2019. V. 27. № 8. P. 1075.
Пирогов А.В., Шпигун О.А. Применение микроэмульсий в жидкостной хроматографии и электрокинетических методах анализа. достоинства и недостатки подхода // Журн. аналит. химии. 2020. Т. 75. С. 99. (Pirogov A.V., Shpigun O.A. Application of microemulsions in liquid chromatography and electrokinetic methods of analysis: Advantages and disadvantages of the approach // J. Analyt. Chem. 2020. V. 75. № 2. P. 139.)
Shi L., Wang J., Feng J., Zhao S., Wang Z., Tao H., Liu S. Determination of chlorophenols in water using dispersive liquid–liquid microextraction coupled with water-in-oil microemulsion electrokinetic chromatography in normal stacking mode // J. Sep. Sci. 2017. V. 40. № 12. P. 2662.
Chu C., Wei M., Wang S., Zheng L., He Z., Cao J., Yan J. Micro-matrix solid-phase dispersion coupled with MEEKC for quantitative analysis of lignans in Schisandrae Chinensis Fructus using molecular sieve TS-1 as a sorbent // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2017. V. 1063. P. 174–179.
Ma H., Li J., Yu H., Li Z., Gao X. mei, Chang Y. xu. The microemulsion electrokinetic capillary chromatography combined with reversed-electrode polarity stacking mode for enriching and quantifying lignanoids and ginsenosides in TCMs preparation Shengmai injection // Electrophoresis. 2018. V. 39. № 19. P. 2439.
Giringer K., Holtkamp H.U., Movassaghi S., Tremlett W.D.J., Lam N.Y.S., Kubanik M., Hartinger C.G. Analysis of ruthenium anticancer agents by MEEKC-UV and MEEKC–ICP-MS: Impact of structural motifs on lipophilicity and biological activity // Electrophoresis. 2018. V. 39. № 9–10. P. 1201.
Yu L., Cong R., Zhou X., Xu H., Chen L., Lai X., Li Q., Chu K., Xu W. Simultaneous detection of Tripterygium wilfordii sesquiterpene alkaloids by microemulsion electrokinetic chromatography coupled with large volume sample stacking // Microchem. J. 2019. V. 148 P. 449.
Jarvas G., Guttman A., Miekus N., Baczek T., Jeong S., Chung D. S., Pätoprstý V., Masár M., Hutta M., Datinská V., Foret F. Practical sample pretreatment techniques coupled with capillary electrophoresis for real samples in complex matrices // Trends Anal. Chem. 2020. V. 122. Article 115702.
Breadmore M.C., Grochocki W., Kalsoom U., Alves M.N., Phung S.Ch., Rokh M.T., Cabot J.M., Ghiasvand A., Li F., Shallan A.I., Keyon A.S.A., Alhusban A.A., See H.H., Wuethrich A., Dawod M., Quirino J.P. Recent advances in enhancing the sensitivity of electrophoresis and electrochromatography in capillaries and microchips (2016–2018) // Electrophoresis. 2019. V. 40. P. 17.
Niu Z., Zhang W., Yu C., Zhang J., Wen Y. Recent advances in biological sample preparation methods coupled with chromatography, spectrometry and electrochemistry analysis techniques // Trends Anal. Chem. 2018. V. 102. P. 123.
Kitagawa F., Otsuka K. Recent applications of on-line sample preconcentration techniques in capillary electrophoresis // J. Chromatogr. A. 2014. V. 1335. P. 43.
Breadmore M.C., Wuethrich A., Li F., Phung S.C., Kalsoom U., Cabot J.M., Tehranirokh M., Shallan A.I., Abdul Keyon A.S., See H.H., Dawod M., Quirino J.P. Recent advances in enhancing the sensitivity of electrophoresis and electrochromatography in capillaries and microchips (2014–2016) // Electrophoresis. 2017. V. 38. P. 33.
Zhang Z., Qu Y., Dovichi N.J. Capillary zone electrophoresis-mass spectrometry for bottom-up proteomics // Trends Anal. Chem. 2018. V. 108. P. 23.
Карцова Л.А., Бессонова Е.А. Методы on-line концентрирования в капиллярном электрофорезе // Журн. аналит. химии. 2009. Т. 64. № 4. С. 340. (Kartsova L.A., Bessonova E.A. Preconcentration techniques in capillary electrophoresis // J. Analyt. Chem. 2009. V. 64. № 4. P. 326.)
Choi K., Kim S.J., Jin Y.G., Jang Y.O., Kim J.-S., Chung D.S. Single drop microextraction using commercial capillary electrophoresis instruments // Anal. Chem. 2009. V. 81. P. 225.
Kim J., Choi K., Chung D.S. Synergistic coupling of in-line single drop microextraction and on-line large volume sample stacking for capillary electrophoresis/mass spectrometry // Anal. Bioanal. Chem. 2019. V. 411. P. 1067.
Park S.T., Kim J., Choi K., Lee H.R., Chung D.S. Headspace-single drop microextraction with a commercial capillary electrophoresis instrument // Electrophoresis. 2012. V. 33. P. 2961.
Park Y.-K., Choi K., Ahmed A.Y.B.H., ALOthman Z.A., Chung D.S. Selective preconcentration of amino acids and peptides using single drop microextraction in-line coupled with capillary electrophoresis // J. Chromatogr. A. 2010. V. 1217. P. 3357.
Kim J., Choi K., Chung D.S. In-line coupling of single-drop microextraction with capillary electrophoresis-mass spectrometry // Anal. Bioanal. Chem. 2015. V. 407. P. 8745.
Oedit A., Duivelshof B., Lindenburga P.W., Hankemeier T. Integration of three-phase microelectroextraction sample preparation into capillary electrophoresis // J. Chromatogr. A. 2020. V. 1610. P. 460 570.
Lee H.R., Cho S.M., Kim J., Chung D.S. Novel and simple headspace in-tube microextraction coupled with capillary electrophoresis // J. Chromatogr. A. 2014. V. 1346. P. 117.
Yue M.-E., Lin Q., Xu J., Jiang T.-F. Ionic liquid-based headspace in-tube liquid-phase microextraction coupled with CE for sensitive detection of phenols // Electrophoresis. 2018. V. 39. P. 1771.
Sung I.H., Lee Y.W., Chung D.S. Liquid extraction surface analysis in-line coupled with capillary electrophoresis for direct analysis of a solid surface sample // Anal. Chim. Acta. 2014. V. 838. P. 45.
Jeong S., Shakerian F., Chung D.S. Analyte focusing by micelle collapse for liquid extraction surface analysis coupled with capillary electrophoresis of neutral analytes on a solid surface // Electrophoresis. 2019. V. 40. P. 2463.
Duncan K.D., Lanekoff I. Spatially defined surface sampling capillary electrophoresis mass spectrometry // Anal. Chem. 2019. V. 91. P. 7819.
Kuban P., Bocek P. Micro-electromembrane extraction across free liquid membranes. Instrumentation and basic principles // J. Chromatogr. A. 2014. V. 1346. P. 25.
Pantuckova P., Kuban P. In-line coupling of supported liquid membrane extraction to capillary electrophoresis for simultaneous analysis of basic and acidic drugs in urine // J. Chromatogr. A. 2017. V. 1519. P. 137.
Kuban P. Salt removal from microliter sample volumes by multiple phase microelectromembrane extractions across free liquid membranes // Anal. Chem. 2017. V. 89. P. 8476.
Chui M.Q., Thang L.Y., See H.H. Integration of the free liquid membrane into electrokinetic supercharging – capillary electrophoresis for the determination of cationic herbicides in environmental water samples // J. Chromatogr. A. 2017. V. 1481. P. 145.
Alhusban A.A., Breadmore M.C., Gueven N., Guijt R.M. Time-resolved pharmacological studies using automated, online monitoring of five parallel suspension cultures // Sci. Rep. 2017. V. 7. P. 10337.
Ryšavá L., Dvořák M., Kubáň P. The effect of membrane thickness on supported liquid membrane extractions in-line coupled to capillary electrophoresis for analyses of complex samples // J. Chromatogr. A. 2019. V. 1596. P. 226.
Dvorak M., Kuban P. In-line coupling of supported liquid membrane extraction across nanofibrous membrane to capillary electrophoresis for analysis of basic drugs from undiluted body fluids // Electrophoresis. 2019. V. 40. P. 2398.
Ramos-Payán M. Liquid-phase microextraction and electromembrane extraction in millifluidic devices: A tutoriall // Anal. Chim. Acta. 2019. V. 10808. P. 12.
Pont L., Pero-Gascon R., Gimenez E., Sanz-Nebot V., Benavente F. A critical retrospective and prospective review of designs and materials in in-line solid-phase extraction capillary electrophoresis // Anal. Chim. Acta. 2019. V. 10794. P. 1.
Pont L., Benavente F., Jaumot J., Tauler R., Alberch J., Gines S., Barbosa J., Sanz-Nebot V. Metabolic profiling for the identification of Huntington biomarkers by on-line solid-phase extraction capillary electrophoresis mass spectrometry combined with advanced data analysis tools // Electrophoresis. 2016. V. 37. P. 795.
Espina-Benitez M.B., Randon J., Demesmay C., Dugas V. Development and application of a new in-line coupling of a miniaturized boronate affinity monolithic column with capillary zone electrophoresis for the selective enrichment and analysis of cis-diol-containing compounds // J. Chromatogr. A. 2017. V. 1494. P. 65.
Zhang Z., Lin L., Zhang X. A novel automated online SPE-coupled CE system for the analysis of sulfonamide antibiotics in wastewater // Chromatographia. 2017. V. 80. P. 127.
Tascon M., Gagliardi L.G., Benavente F. Parts-per-trillion detection of harmala alkaloids in Undaria pinnatifida algae by on-line solid phase extraction capillary electrophoresis mass spectrometry // Anal. Chim. Acta. 2017. V. 954. P. 60.
Kerrin E.S., White R.L., Quilliam M.A. Quantitative determination of the neurotoxin β-N-methylamino-L-alanine (BMAA) by capillary electrophoresis-tandem mass spectrometry // Anal. Bioanal. Chem. 2017. V. 409. P. 1481.
Ciura K., Pawelec A., Buszewska-Forajta M., Markuszewski M. J., Nowakowska J., Prahl A., Wielgomas B., Dziomba S. Evaluation of sample injection precision in respect to sensitivity in capillary electrophoresis using various injection modes // J. Sep. Sci. 2017. V. 40. P. 1167.
Šesták J., Thormann W. Insights into head-column field-amplified sample stacking: Part I. Detailed study of electrokinetic injection of a weak base across a short water plug // J. Chromatogr. A. 2017. V. 1502. P. 51.
Sestak J., Thormann W. Insights into head-column field-amplified sample stacking: Part II. Study of the behavior of the electrophoretic system after electrokinetic injection of cationic compounds across a short water plug // J. Chromatogr. A. 2017. V. 1512. P. 124.
Sestak J., Theurillat R., Sandbaumhuter F.A., Thormann W. Fundamental aspects of field-amplified electrokinetic injection of cations for enantioselective capillary electrophoresis with sulfated cyclodextrins as selectors // J. Chromatogr. A. 2018. V. 1558. P. 85.
Flores-Aguilar J.F., Medrano L.C., Perez-Escalante E., Rodriguez J.A., Camacho-Mendoza R.L., Ibarra I.S. Large-volume sample stacking with polarity switching for analysis of azo dyes in water samples by capillary electrophoresis // Int. J. Environ. Anal. Chem. 2019. V. 99. P. 1255.
Kitagawa F., Osanai O., Nukatsuka I. LVSEP analysis of cationic analytes in non-aqueous capillary electrophoresis // Chromatography. 2019. V. 40. P. 79.
Yi J., Zeng L., Wu Q., Yang L., Xie T. Sensitive simultaneous determination of synthetic food colorants in preserved fruit samples by capillary electrophoresis with contactless conductivity detection // Food Anal. Methods. 2018. V. 11. P. 1608.
Moreno-Gonzalez D., Krulisova M., Gamiz-Gracia L., Garcia-Campana A. M. Determination of tetracyclines in human urine samples by capillary electrophoresis in combination with field amplified sample injection // Electrophoresis. 2018. V. 39. P. 608.
Polikarpova D., Makeeva D., Kartsova L., Dolgonosov A., Kolotilina N. Nano-sized anion-exchangers as a stationary phase in capillary electrochromatography for separation and on-line concentration of carboxylic acids // Talanta. 2018. V. 188. P. 744.
Zhang Y., Zhang Y., Yu S., Zhang Y., Zhu L., He P., Wang Q. Sensitive analysis of glutathione in bacteria and HaCaT cells by polydopamine/gold nanoparticle-coated microchip electrophoresis via online pre-concentration of field-amplified sample stacking // Microfluid. Nanofluid. 2017. V. 21. P. 97.
Chu C., Liu C., Jiang L., Lian L., Li J., Li H., Lv H., Yan J. On-line synergistic stacking in capillary zone electrophoresis featuring field-amplified sample stacking and micelle to cyclodextrin stacking in the determination of two alkaloids in complicated matrix samples // J. Sep. Sci. 2019. V. 42. P. 3009.
Islas G., Rodriguez J.A., Perez-Silva I., Miranda J.M., Ibarra I.S. Solid-Phase Extraction and Large-Volume Sample Stacking-Capillary Electrophoresis for Determination of Tetracycline Residues in Milk // J. Anal. Methods Chem. 2018. V. 2018. P. 1.
Díaz-Quiroz C.A., Hernández-Chávez F.J., Ulloa-Mercado G., Gortáres-Moroyoqui P., Martínez-Macías R., Meza-Escalante E., Serrano-Palacios D. Simultaneous quantification of antibiotics in wastewater from pig farms by capillary electrophoresis // J. Chromatogr. B: Analyt. Technol. Biomed. Life Sci. 2018. V. 1092. P. 386.
Wang L., MacDonald D., Huang X., Chen D.D. Capture efficiency of dynamic pH junction focusing in capillary electrophoresis // Electrophoresis. 2016. V. 37. P. 1143.
Yan P., Zhang K., Wang L., Tong W., Chen D.D. Quantitative analysis of microcystin variants by capillary electrophoresis mass spectrometry with dynamic pH barrage junction focusing // Electrophoresis. 2019. V. 40. P. 2285.
Chen D.D., Shen X., Sun L. Capillary zone electrophoresis-mass spectrometry with microliter-scale loading capacity, 140 min separation window and high peak capacity for bottom-up proteomics // Analyst. 2017. V. 142. P. 2118.
Zhu G., Sun L., Dovichi N.J. Dynamic pH junction preconcentration in capillary electrophoresis-electrospray ionization-mass spectrometry for proteomics analysis // Analyst. 2016. V. 141. P. 5216.
Yan P., Zhang K., Wang L., Tong W., Chen D.D. Quantitative analysis of microcystin variants by capillary electrophoresis mass spectrometry with dynamic pH barrage junction focusing // Electrophoresis. 2019. V. 40. P. 2285.
Chen D.D., Shen X., Sun L. Capillary zone electrophoresis-mass spectrometry with microliter-scale loading capacity, 140 min separation window and high peak capacity for bottom-up proteomics // Analyst. 2017. V. 142. P. 2118.
Zhu G., Sun L., Dovichi N.J. Dynamic pH junction preconcentration in capillary electrophoresis- electrospray ionization-mass spectrometry for proteomics analysis // Analyst. 2016. V. 141. № 18. P. 5216.
Zhang Z., Zhu G., Peuchen E. H., Dovichi N.J. Preparation of linear polyacrylamide coating and strong cationic exchange hybrid monolith in a single capillary, and its application as an automated platform for bottom-up proteomics by capillary electrophoresis-mass spectrometry // Microchim. Acta. 2017. V. 184. P. 921.
Lubeckyj R.A., McCool E.N., Shen X., Kou Q., Lu X., Sun L. Single-shot top-down proteomics with capillary zone electrophoresis-electrospray ionization-tandem mass spectrometry for identification of nearly 600 escherichia coli proteoforms // Anal. Chem. 2017. V. 89. P. 12059
Chang P.L., Hsieh M.M., Chiu T.C. Recent advances in the determination of pesticides in environmental samples by capillary electrophoresis // Int. J. Environ. Res. Public. Health. 2016. V. 13. P. 409.
Peng L.-Q., Dong X., Zhen X.-T., Yang J., Chen Y., Wang S.-L., Xie T., Cao J. Simultaneous separation and concentration of neutral analytes by cyclodextrin assisted sweeping-micellar electrokinetic chromatography // Anal. Chim. Acta. 2020. V. 1105. P. 224.
Hou X., Zhang X., Lu Y. The application of capillary electrophoretic on-line preconcentration in alkaloid analysis // Anal. Methods. 2017. V. 9. P. 10.
He H., Liu S., Meng Z., Hu S. Dispersive liquid–liquid microextraction for the determination of phenols by acetonitrile stacking coupled with sweeping-micellar electrokinetic chromatography with large-volume injection // J. Chromatogr. A. 2014. V. 1361. P. 291.
Yang Q., Chen B., He M., Hu B. Sensitive determination of seven triazine herbicide in honey, tomato and environmental water samples by hollow fiber based liquid-liquid-liquid microextraction combined with sweeping micellar electrokinetic capillary chromatography // Talanta. 2018. V. 186. P. 88.
Chen S.Y., Chen W.C., Chang S.Y. Cyclodextrin-assisted dispersive liquid-liquid microextraction for the preconcentration of carbamazepine and clobazam with subsequent sweeping micellar electrokinetic chromatography // J. Sep. Sci. 2018. V. 41. P. 1871.
Wei J.C., Hu J., Cao J.L., Wan J.B., He C.W., Hu Y.J., Hu H., Li P. Sensitive detection of organophosphorus pesticides in medicinal plants using ultrasound-assisted dispersive liquid-liquid microextraction combined with sweeping micellar electrokinetic chromatography // J. Agric. Food Chem. 2016. V. 64. P. 932.
Tejada-Casado C., Moreno-Gonzalez D., Del Olmo-Iruela M., Garcia-Campana A.M., Lara F.J. Coupling sweeping-micellar electrokinetic chromatography with tandem mass spectrometry for the therapeutic monitoring of benzimidazoles in animal urine by dilute and shoot // Talanta. 2017. V. 175. P. 542.
Sanuki R., Sueyoshi K., Endo T., Hisamoto H. Double sweeping: highly effective sample preconcentration using cationic and anionic micelles and its application to a multiple enzyme activity assay // Anal. Chem. 2017. V. 89. P. 6505.
Quirino J.P., Haddad P.R. Online sample preconcentration in capillary electrophoresis using analyte focusing by micelle collapse // Anal. Chem. 2008. V. 80. P. 6824.
Jeong S., Shakerian F., Chung D.S. Analyte focusing by micelle collapse for liquid extraction surface analysis coupled with capillary electrophoresis of neutral analytes on a solid surface // Electrophoresis. 2019. V. 40. P. 2463.
Chao H.-C., Liao H.-W., Kuo C.-H. Using water plug-assisted analyte focusing by micelle collapse in combination with microemulsion electrokinetic chromatography for analyzing phthalate esters // J. Chromatogr. A. 2016. V. 1445. P. 149.
Quirino J.P. Micelle to solvent stacking of organic cations in capillary zone electrophoresis with electrospray ionization mass spectrometry // J. Chromatogr. A. 2009. V. 1216. P. 294.
Aturki Z., Fanali S., Rocco A. Online sample concentration and analysis of drugs of abuse in human urine by micelle to solvent stacking in capillary zone electrophoresis // Electrophoresis. 2016. V. 37. P. 2875.
Thang L.Y., See H.H., Quirino J.P. Determination of tamoxifen and its metabolites using micelle to solvent stacking in nonaqueous capillary electrophoresis // Electrophoresis. 2016. V. 37. P. 1166.
Tubaon R.M., Haddad P.R., Quirino J.P. Electrokinetic removal of dodecyl sulfate micelles from digested protein samples prior to electrospray-ionization mass spectrometry // Anal. Chem. 2017. V. 89. P. 13058.
Quirino J.P., Grochocki W., Markuszewski M.J. Sample concentration of charged small molecules and peptides in capillary electrophoresis by micelle to cyclodextrin sacking // Anal. Chem. 2017. V. 89. P. 13422.
Ghiasvand A., Feng Z., Quirino J.P. Enrichment and separation of cationic, neutral, and chiral analytes by micelle to cyclodextrin stacking-micellar electrokinetic chromatography // Anal. Chem. 2019. V. 91. P. 1752.
Liu C., Li J., Zhu L., Lian L., Jiang L., Li H., Yan J., Chu C. A sensitive two-step stacking by coupling field-enhanced sample injection and micelle to cyclodextrin stacking for the determination of neutral analytes // J. Chromatogr. A. 2020. In press. Article 460854. https://doi.org/10.1016/j.chroma.2020.460854
Bessonova E., Kartsova L., Gallyamova V. Ionic liquids based on imidazole for online concentration of catecholamines in capillary electrophoresis // J. Sep. Sci. 2017. V. 40. P. 2304.
Колобова Е.А., Карцова Л.А., Бессонова Е.А., Кравченко А.В. On-line концентрирование биогенных аминов методом капиллярного электрофореза с использованием синтезированных ковалентных покрытий на основе ионных жидкостей // Аналитика и контроль. 2017. Т. 21. № 1. С. 57. (Kolobova E.A., Kartsova L.A., Bessonova E.A., Kravchenko A.V. On-line concentration of biogenic amines by capillary electrophoresis method using the synthesized covalent coating based on the imidazolium ionic liquids // Analytics and Control. 2017. V. 21. № 1. Р. 57.)
Kolobova E., Kartsova L., Kravchenko A., Bessonova E. Imidazolium ionic liquids as dynamic and covalent modifiers of electrophoretic systems for determination of catecholamines // Talanta. 2018. V. 188. P. 183.
Бессонова Е.А., Карцова Л.А., Галлямова В.Ф. Влияние ионной жидкости хлорид 3-метил-1-цетилимидазолия на процессы электрофоретического концентрирования стероидных гормонов // Журн. аналит. химии. 2016. Т. 71. № 7. С. 724. (Bessonova E.A., Kartsova L.A., Gallyamova V.F. Effect of 3-methyl-1-cetylimidazolium chloride ionic liquid on the electrophoretic preconcentration of steroid hormones // J. Analyt. Chem. 2016. V. 71. P. 696.)
Rageh A.H., Klein K.F., Pyell U. Off-line and on-line enrichment of alpha-aminocephalosporins for their analysis in surface water samples using CZE coupled to LIF // Chromatographia. 2016. V. 79. P. 225.
Hsieh S.Y., Wang C.C., Kou H.S., Wu S.M. Dialkyl anionic surfactant in field-amplified sample injection and sweeping-micellar electrokinetic chromatography for determination of eight leanness-promoting beta-agonists in animal feeds // J. Pharm. Biomed. Anal. 2017. V. 141. P. 222.
Airado-Rodriguez D., Hernandez-Mesa M., Garcia-Campana A.M. Cruces-Blanco C. Evaluation of the combination of micellar electrokinetic capillary chromatography with sweeping and cation selective exhaustive injection for the determination of 5-nitroimidazoles in egg samples // Food Chem. 2016. V. 213. P. 215.
Mikuma T., Iwata Y.T., Miyaguchi H., Kuwayama K., Tsujikawa K., Kanamori T., Kanazawa H., Inoue H. Approaching over 10 000-fold sensitivity increase in chiral capillary electrophoresis: Cation-selective exhaustive injection and sweeping cyclodextrin-modified micellar electrokinetic chromatography // Electrophoresis. 2016. V. 37. P. 2970.
Liu L., Wan Q., Xu X., Duan S., Yang C. Combination of micelle collapse and field-amplified sample stacking in capillary electrophoresis for determination of trimethoprim and sulfamethoxazole in animal-originated foodstuffs // Food Chem. 2017. V. 219. P. 7.
Thang L.Y., See H.H., Quirino J.P. Multistacking from two sample streams in nonaqueous microchip electrophoresis // Anal. Chem. 2016. V. 88. P. 9915.
Chong K.C., Thang L.Y., Quirino J.P., See H.H. Monitoring of vancomycin in human plasma via portable microchip electrophoresis with contactless conductivity detector and multi-stacking strategy // J. Chromatogr. A. 2017. V. 1485. P. 142.
Wuethrich A., Haddad P.R., Quirino J.P. Simultaneous electrophoretic concentration and separation of herbicides in beer prior to stacking capillary electrophoresis UV and liquid chromatography-mass spectrometry // Electrophoresis. 2016. V. 37. P. 1122.
Chu C., Wei M., Liu C., Li H., Cao J., Yan J. Over 1000-fold improvement in an online preconcentration of trace anionic compounds by capillary electrophoresis with ionic liquid micelle-based three-step stacking // Anal. Chim. Acta. 2018. V. 1044. P. 191.
Horka M., Karasek P., Roth M., Slais K. Fused silica capillaries with two segments of different internal diameters and inner surface roughnesses prepared by etching with supercritical water and used for volume coupling electrophoresis // Electrophoresis. 2017. V. 38. P. 1260.
Horka M., Karasek P., Roth M., Ruzicka F. Pre-concentration and separation of bacteria by volume coupling electrophoresis on supercritical water-etched fused silica capillary with two segments of different internal diameters and inner surface roughnesses // Anal. Bioanal. Chem. 2018. V. 410. P. 167.
Sun J., Feng J., Shi L., Liu L., He H., Fan Y., Hu S., Liu S. Study of the mechanism of acetonitrile stacking and its application for directly combining liquid-phase microextraction with micellar electrokinetic chromatography // J. Chromatogr. A. 2016. V. 1461. P. 161.
Zhang Y., Chen W., Zhang Y., Zhang Y., Zhu L., He P., Wang Q. Sensitive analysis of reduced glutathione in bacteria and HaCaT cells by capillary electrophoresis via online pre-concentration of transient trapping combined with the dynamic pH junction mode // New J. Chem. 2017. V. 41. P. 12920.
Chui M.Q., Thang L.Y., See H.H. Integration of the free liquid membrane into electrokinetic supercharging – capillary electrophoresis for the determination of cationic herbicides in environmental water samples // J. Chromatogr. A. 2017. V. 1481. P. 145.
Lee H.G., Kwon J.Y., Chung D.S. Electrokinetic supercharging-electrospray ionisation-mass spectrometry for separation and on-line preconcentration of hypolipidaemic drugs in water samples // Talanta. 2018. V. 181. P. 366.
Abdul Karim N., Wan Ibrahim W.A., Sanagi M.M., Abdul Keyon A.S. Online preconcentration by electrokinetic supercharging for separation of endocrine disrupting chemical and phenolic pollutants in water samples // Electrophoresis. 2016. V. 37. P. 2649.
Thang L.Y., Breadmore M.C., See H.H. Electrokinetic supercharging in nonaqueous capillary electrophoresis for online preconcentration and determination of tamoxifen and its metabolites in human plasma // J. Chromatogr. A. 2016. V. 1461. P. 185.
Hu W., Hong T., Ga X., Ji Y. Applications of nanoparticle-modified stationary phases in capillary electrochromatography // Trends Anal. Chem. 2014. V. 61. P. 29.
Wallingford R.A. Ewing A.G. Capillary electrophoresis // Adv. Chromatogr. 1989. V. 29. P. 65.
Nilsson C., Birnbaumb S., Nilsson S. Use of nanoparticles in capillary and microchip electrochromatography // J. Chromatogr. A. 2007. V. 1168. P. 212.
Zhang Z., Yan B., Liao Y., Liu H. Nanoparticle: Is it promising in capillary electrophoresis? // Anal. Bioanal. Chem. 2008. V. 391. P. 925.
Долгоносов А.М., Хамизов Р.Х., Колотилина Н.К., Шайхина С.У., Евстигнеева П.В. Получение, свойства и применение коллоидных растворов ионитов // Сорбционные и хроматографические процессы. 2016. Т. 16. С. 400.
Kartsova L.A., Makeeva D.V., Davankov V.A. Nano-sized polymer and polymer-coated particles in electrokinetic separations // Trends Anal. Chem. 2019. V. 120. Article 115656.
Zhang S., Macka M., Haddad P.R. Preparation and characterisation of dual-layer latex-coated columns for opentubular capillary electrochromatographic preconcentration of cations combined in-line with their separation by capillary electrophoresis // Electrophoresis. 2006. V. 27. P. 1069.
Hutchinson J.P., Macka M., Avdalovic N., Haddad P.R. On-line preconcentration of organic anions in capillary electrophoresis by solid-phase extraction using latex-coated monolithic stationary phases // J. Chromatogr. A. 2006. V. 1106. P. 43.
Hutchinson J.P., Hilder E.F., Macka M., Avdalovic N., Haddad P.R. Preparation and characterisation of anion-exchange latex-coated silica monoliths for capillary electrochromatography // J. Chromatogr. A. 2006. V. 1109. P. 10.
Diao X., Zhang F., Yang B., Xinmiao L., Yanxiong K., Xiaogang C. Preparation and evaluation of C10-cationic latex particle coated open-tubular column for capillary electrochromatography // J. Chromatogr. A. 2012. V. 1267. P. 127.
Xu L., Cui P., Wang D., Tang C., Dong L., Zhang C., Duan H., Yang V.C. Preparation and characterization of lysine-immobilized poly(glycidyl methacrylate) nanoparticle-coated capillary for the separation of amino acids by open tubular capillary electrochromatography // J. Chromatogr. A. 2014. V. 1323. P. 179.
Bakry R., Gjerde D., Bonn G.K. Derivatized nanoparticle coated capillaries for purification and micro-extraction of proteins and peptides // J. Proteome Res. 2006. V. 5. P. 1321.
Chen J.L., Hsieh K.H. Nanochitosan crosslinked with polyacrylamide as the chiral stationary phase for open-tubular capillary electrochromatography // Electrophoresis. 2011. V. 32. P. 398.
Chen J.-L. Molecularly bonded chitosan prepared as chiral stationary phases in open-tubular capillary electrochromatography: Comparison with chitosan nanoparticles bonded to the polyacrylamide phase // Talanta. 2011. V. 85. P. 2330.
Wang D., Song X., Duan Y., Xu L., Zhou J., Duan H. Preparation and characterization of a polystyrene/bovine serum albumin nanoparticle-coated capillary for chiral separation using open-tubular capillary electrochromatography // Electrophoresis. 2013. V. 34. P. 1339.
Polikarpova D., Makeeva D., Kartsova L., Dolgonosov A., Kolotilina N. Nano-sized anion-exchangers as a stationary phase in capillary electrochromatography for separation and on-line concentration of carboxylic acids // Talanta. 2018. V. 188. P. 744.
Макеева Д.В., Карцова Л.А., Поликарпова Д.А. Наноразмерные иониты – стационарные фазы для капиллярной электрохроматографии // Аналитика и контроль. 2018. № 3. С. 273. (Makeeva D.V., Kartsova L.A., Polikarpova D.A. Nano-sized ion exchangers – Stationary phases in capillary electrochromatography // Analytics and Control. 2018. V. 2. P. 273.)
Дзема Д.В., Поликарпова Д.А., Карцова Л.А. Применение высокоосновного наноионита в капиллярном электрофорезе для разделения и концентрирования неорганических анионов // Аналитика и контроль. 2017. № 1. С. 41. (Dzema D.V., Polikarpova D.A., Kartsova L.A. Application of the highly basic nano-sized anionite for the capillary electrophoresis separation and on-line concentration of inorganic anions // Analytics and Control. 2017. V. 21. P. 41.)
Guo Y., Meng L., Zhang Y., Tang W., Zhang W., Xia Y., Ban F., Wub N., Zhang S. Sensitive determination of four tetracycline antibiotics in pig plasma by field-amplified sample stacking open-tubular capillary electrochromatography with dimethylethanolamine aminated polychloromethyl styrene nano-latex coated capillary column // J. Chromatogr. B. 2013. V. 942–943. P. 151.
Nilsson C., Nilsson S. Nanoparticle-based pseudostationary phases in capillary electrochromatography // Electrophoresis. 2006. V. 27. P. 76.
Palmer C.P., Keeffer A., Hilder E.F., Haddad P.R. Retention behavior and selectivity of a latex nanoparticle pseudostationary phase for electrokinetic chromatography // Electrophoresis. 2011. V. 32. P. 588.
Hyslop J.S., Hall L.M., Umansky A.A., Palmer P.C. RAFT polymerized nanoparticles: Influences of shell and core chemistries on performance for electrokinetic chromatography // Electrophoresis. 2014. V. 35. P. 728.
McGettrick J.R., Williamson N.H., Sutton A.T., Palmer C.P. Performance and selectivity of cationic nanoparticle pseudo-stationary phases in electrokinetic chromatography // Electrophoresis. 2017. V. 38. P. 730.
Grela D.A., Zannoni V., Vizioli N.M. Studying the interaction between peptides and polymeric nanoparticles used as pseudostationary phase in capillary electrochromatography // Microchem. J. 2017. V. 130. P. 153.
Huang D., Yang Q., Jin S., Deng Q., Zhou P. Self-assembly of cellulose nanoparticles as electrolyte additive for capillary electrophoresis separation // J. Chromatogr. A. 2014. V. 1367. P. 148.
Vojtech A., Vaculovicova M. CE and nanomaterials – Part II: Nanomaterials in CE // Electrophoresis. 2017. V. 38. P. 2405.
You J., Zhao L., Wang G., Zhou H., Zhou J., Zhang L. Quaternized cellulose-supported gold nanoparticles as capillalary coatings to enhance protein separation by capillary electrophoresis // J. Chromatogr. A. 2014. V. 1343. P. 160.
Al-Hossaini A.M., Suntornsuk L., Lunte S.M. Separation of dynorphin peptides by capillary electrochromatography using a polydiallyldimethylammonium chloride gold nanoparticle-modified capillary // Electrophoresis. 2016. V. 37. P. 2297.
Yu C.J., Su C.L., Tseng W.L. Separation of acidic and basic proteins by nanoparticle-filled capillary electrophoresis // Anal. Chem. 2006. V. 78. P. 8004.
Qu Q., Liu D., Mangelings D., Yang C., Hu X. Permanent gold nanoparticle coatings on polyelectrolyte multilayer modified capillaries for open-tubular capillary electrochromatography // J. Chromatogr. A. 2010. V. 1217. P. 6588.
Hamer M., Yone A., Rezzano I. Gold nanoparticle-coated capillaries for protein and peptide analysis in open-tubular capillary electrochromatography // Electrophoresis. 2012. V. 33. P. 334.
Zhou L., Zhang B., Li S., Yu J., Guo X. Author affiliations Enantioselective open-tubular capillary electrochromatography using a β-cyclodextrin–gold nanoparticles–polydopamine coating as a stationary phase // New J. Chem. 2018. V. 42. P. 17250.
Liang R.P., Meng X.Y., Liu C.M., Qiu J.D. PDMS microchip coated with polydopamine/gold nanoparticles hybrid for efficient electrophoresis separation of amino acids // Electrophoresis. 2011. V. 32. P. 3331.
Zhang Y., Zhang Y., Chen W., Zhang Y., Zhu L., He P., Wang Q. Enantiomeric separation of tryptophan by opentubular microchip capillary electrophoresis using polydopamine/gold nanoparticles conjugated DNA as stationary phase // Anal. Methods. 2017. V. 9. P. 3561.
Zhang A., Ye F., Lu J., Zhao S. Screening a-glucosidase inhibitor from natural products by capillary electrophoresis with immobilised enzyme onto polymer monolith modified by gold nanoparticles // Food Chem. 2013. V.141. P. 1854.
Huang Y.F., Chiang C.K., Lin Y.W., Liu K., Hu C.C., Bair M.J., Chang H.T. Capillary electrophoretic separation of biologically active amines and acids using nanoparticle-coated capillaries // Electrophoresis. 2008. V. 29. P. 1942.
Liu Y., Liu Q., Yu H., Sun S., Xu Y., Wang Y., Qub Q., Yan C. Polymer-modified fibrous mesoporous silica nanoparticles as coating material for open-tubular capillary electrochromatography // J. Chromatogr. A. 2017. V. 1499. P.196.
Shaabani N., Jemere A.B., Harrison D.J. Size-based proteins separation using polymer-entrapped colloidal self-assembled nanoparticles on-chip // Electrophoresis. 2016. V. 37. P. 2602.
Zhang Y., Wang W., Ma X., Jia L. Polydopamine assisted fabrication of titanium oxide nanoparticles modified column for proteins separation by capillary electrochromatography // Anal. Biochem. 2016. V. 512. P. 103.
Han K., Liu S., Tang S., Liu X., Jianga S. Polydopamine assisted liquid phase deposition for preparation of zirconia coated column in capillary electrophoresis // Anal. Methods. 2012. V. 4. P. 4193.
Huang M.F., Huang C.C., Chang H.T. Improved separation of double-stranded DNA fragments by capillary electrophoresis using poly(ethylene oxide) solution containing colloids // Electrophoresis. 2003. V. 24. P. 2896.
Chiou S.H., Huang M.F., Chang H.T. Separation of double-stranded DNA fragments by capillary electrophoresis: Impacts of poly(ethylene oxide), gold nanoparticles, ethidium bromide, and pH // Electrophoresis. 2004. V. 25. P. 2186.
Huang M.F., Kuo Y.C., Huang C.C., Chang H.T. Separation of long double-stranded DNA by nanoparticle-filled capillary electrophoresis // Anal. Chem. 2004. V. 76. P. 192.
Chen Y.L., Shih C.J., Ferrance J., Chang Y.S., Chang J.G., Wu S.M. Genotyping of alpha-thalassemia deletions using multiplex polymerase chain reactions and gold nanoparticle-filled capillary electrophoresis // J. Chromatogr. A. 2008. V. 1216. P. 1206.
Liu F.-J., Ding G.-S., Tang A.-N. Simultaneous separation and determination of five organic in beverages and fruits by capillary electrophoresis using diamino moiety functionalized silica nanoparticles as pseudostationary phase // Food Chem. 2014. V. 145. P. 109.
Hamer M., Bassi N., Agata Grela D. Development of an electrophoretic method based on nanostructured materials for HbA1c determination // Electrophoresis. 2018. V. 39. P. 1048.
Wang B., Chai W., Ding G. The application of functional silica nanoparticles to fulfill the rapid and improved enantioselective capillary electrophoresis separation of amino acid derivatives // J. Sep. Sci. 2015. V. 38. P. 332.
Li W., Ding G.-S., Tang A.-N. Enantiomer separation of propranolol and tryptophan using bovine serum albumin functionalized silica nanoparticles as adsorbents // RSC Adv. 2015. V. 5. P. 93850.
Xu S., Mo R., Jin C., Cui X., Bai R., Ji Y. Mesoporous silica nanoparticles incorporated hybrid monolithic stationary phase immobilized with pepsin for enantioseparation by capillary electrochromatography// J. Pharm. Biomed. Anal. 2017. V. 140. P. 190.
Liu F.-J., Liu C.-T., Li W., Tang A.-N. Dispersive solid-phase microextraction and capillary electrophoresis separation of food colorants in beverages using diamino moiety functionalized silica nanoparticles as both extractant and pseudostationary phase // Talanta. 2015. V. 132. P. 366.
Hou. J., Li G., Wei Y., Lu H., Jiang C., Zhou X., Meng F., Cao J., Liu J. Analysis of five alkaloids using surfactant-coated multi-walled carbon nanotubes as the pseudostationary phase in nonaqueous capillary electrophoresis // J. Chromatogr. A. 2014. V. 1343. P. 174.
Su M.-Y., Chen Y.-Y., Yang J.-Y., Lin Y.-S., Lin Y.-W., Liu M.-Y. Separation of total lipids on human lipoproteins using surfactant-coated multiwalled carbon nanotubes as pseudostationary phase in capillary electrophoresis // Electrophoresis. 2014. V. 35. P. 978.
Xu J.-J., Ye L.-H., Yi L., An M., Cao J., Peng L.-Q. Electrophoretic analysis of natural antioxidants in plant and beverage samples using dynamically coated capillaries with chitosan and multiwall carbon nanotubes // Food Anal. Methods. 2017. V. 10. P. 980.
Peng L.-Q., Ye L.-H., Cao J., Du L.-J., Xu J.-J., Zhang Q.-D. Separation of metal ions via capillary electrophoresis using a pseudostationary phase microfunctionalized with carbon nanotubes // Microchim. Acta. 2017. V. 184. P. 1747.
Xu J.-J., Chang Y.-X., Hao J., An M., Tan Z., Yang R., Cao J., Peng L.-Q. Separation and stacking of iodine species from seafood using surfactant-coated multiwalled carbon nanotubes as a pseudo-stationary phase in capillary electrophoresis // Microchim. Acta. 2016. V. 183. P. 2441.
Zhang Q., Du Y., Du S. Evaluation of ionic liquids-coated carbon nanotubes modified chiral separation system with chondroitin sulfate E as chiral selector in capillary electrophoresis // J. Chromatogr. A. 2014. V. 1339. P. 185.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии