Журнал аналитической химии, 2020, T. 75, № 12, стр. 1080-1096
Энантиоселективные вольтамперометрические сенсоры на основе хиральных материалов
В. Н. Майстренко a, Р. А. Зильберг a, *
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: ZilbergRA@yandex.ru
Поступила в редакцию 09.04.2020
После доработки 01.06.2020
Принята к публикации 04.07.2020
Аннотация
В обзоре представлена исчерпывающая информация за последние 5 лет о тенденциях и методах исследования, разработке и практическом применении энантиоселективных вольтамперометрических сенсоров на основе новых хиральных материалов для распознавания энантиомеров биологически активных и лекарственных соединений. Рассмотрены энантиоселективные сенсоры на основе хиральных наночастиц Cu, Au, Ag, Pt, Pd и монокристаллов, мезопористых металлов с молекулярными отпечатками, одностенных углеродных нанотрубок, “умных” полимеров, металлоорганических каркасных структур и супрамолекулярных сборок, хиральных ионных жидкостей. Приведены примеры распознавания и определения энантиомеров в различных объектах и аналитические характеристики предложенных сенсоров. Обсуждаются проблемы и перспективы применения рассмотренных вольтамперометрических сенсоров для хирального распознавания оптически активных соединений.
Энантиоселективные вольтамперометрические сенсоры можно рассматривать как аналитические устройства, способные различать зеркальные отображения электроактивных молекул [1, 2]. Исследование таких соединений имеет большое значение для понимания процессов, происходящих в живых организмах, поскольку многие из них, включая аминокислоты, белки и сахара, участвуют в хиральных взаимодействиях. Несмотря на то, что история открытия оптической изомерии насчитывает более 170 лет [3], одним из наиболее важных для оптически активных соединений остается вопрос о том, как определить их оптическую чистоту. Даже на сегодняшний день проблема разделения и анализа смесей энантиомеров не является рутинной задачей. В данном случае речь идет как о чистоте веществ, так и о содержании в них хиральных изомеров. Для этих целей применяют методы ЯМР-спектроскопии [4], кругового дихроизма [5], хиральной хроматографии [6–10], капиллярного электрофореза [11, 12], масс-спектрометрию [13], оптические [14], электрохимические [15–23] и масс-сенсоры [24].
Проблема разделения и определения оптических изомеров актуальна еще и потому, что многие лекарственные соединения существуют в виде двух или нескольких пространственных изомеров. Их фармакологическая активность обычно связана с действием лишь одного из них. Другие или проявляют менее выраженное действие, или совсем не активны. Клинические испытания показывают, что использование энантиочистых лекарственных средств уменьшает побочные эффекты их действия и таким образом повышает их эффективность. Все это стимулирует развитие исследований в области распознавания и определения энантиомеров лекарственных соединений [25]. Повышенный интерес вызывает также хиральный анализ пищевых продуктов и напитков, позволяющий получить ценную информацию об их биологической активности, безопасности и происхождении [26]. Следует отметить, что существует два варианта хирального анализа – разделение энантиомеров вследствие различий в их поведении при взаимодействии с хиральными подвижными и неподвижными фазами (хиральная хроматография, капиллярный электрофорез и др.) и раздельное определение в смесях с использованием аналитических методов и сенсоров, способных различать оптические изомеры [2].
Хроматографические методы и капиллярный электрофорез, несмотря на их эффективность, зачастую недостаточно экспрессны и относительно дороги для использования в рутинном анализе, особенно вне стационарных лабораторий, что обусловливает значительный и постоянно растущий интерес к развитию других методов хирального анализа, в том числе на основе энантиоселективных электрохимических сенсоров [15–17, 21]. Среди них большой интерес представляют энантиоселективные вольтамперометрические сенсоры (ЭВС), более чувствительные и универсальные по сравнению с потенциометрическими [17, 27–31]. При разработке ЭВС всегда возникает вопрос, каким образом дискриминировать аналитические сигналы, поскольку в большинстве случаев вольтамперограммы энантиомеров имеют близкие характеристики, а потенциалы пиков их окисления (восстановления) незначительно различаются между собой. Эффективность распознавания энантиомеров определяется разницей в свободных энергиях взаимодействия энантиомеров с хиральной поверхностью электрода либо с другими хиральными объектами, иммобилизованными на его поверхности, а также за счет использования хиральных сред, в частности, ионных жидкостей.
Для объяснения механизма хирального распознавания энантиомеров предложен ряд моделей, которые во многих случаях основаны на модели “трехточечного взаимодействия” Далглиша [32], определяющей условия, достаточные для возникновения энантиоселективности. Согласно этой модели, для получения энантиодифференцированного сигнала-отклика требуется взаимодействие распознаваемого (определяемого) хирального соединения (одного или в смеси энантиомеров) и хирального селектора. Во многих случаях такое взаимодействие определяется наличием у селектора как минимум трех центров связывания, взаимное расположение которых и характеристики взаимодействия с энантиомерами определяют селективность распознавания [33, 34]. При этом один энантиомер имеет оптимальное строение и образует более устойчивое “трехточечное” соединение с селектором, в то время как другой энантиомер связан с ним менее прочно из-за наличия только двух точек контакта. Однако эта модель действительна лишь для относительно простых селекторов с планарной хиральностью без учета того, что большинство селекторов не являются плоскими, а представляют собой трехмерные структуры. Модель не отражает также характер взаимодействия энантиомеров с селектором при образовании диастереомерных комплексов.
В случае диастереомеров (стереоизомеров, имеющих несколько стереоцентров, не являющихся зеркальными отражениями и отличающихся друг от друга физическими и химическими свойствами) такие комплексы образуются за счет нековалентных взаимодействий: водородных связей, ионных, диполь-дипольных, ван-дер-ваальсовых и π−π-взаимодействий, образования супрамолекулярных структур [35] и др. Как следствие, один диастереомер может иметь более “идеальную” форму для взаимодействия с селектором по сравнению с другим. Стерические факторы, обусловленные несоответствием размера полости селектора молекулам диастереомеров, также могут оказывать влияние на кинетику и характер электродного процесса. Энантиоселективность взаимодействий зависит также от состава и ионной силы раствора, pH, природы растворителя, наличия тех или иных заместителей в молекуле селектора и др. Казалось бы, понимание механизма хирального распознавания позволяет предсказать, какой селектор лучше всего будет распознавать энантиомеры и может быть использован в ЭВС. Однако многие селекторы представляют собой хиральные макро- или полимерные молекулы сложной структуры, прогнозировать энантиоселективность которых достаточно непросто, в том числе и из-за необходимости учета сольватационных эффектов. Различным может быть и распределение молекул селектора на поверхности сенсора.
Универсальных селекторов, как и способов их синтеза и применения, не существует из-за сложности молекулярного распознавания отдельных энантиомеров. Каждый селектор имеет свою область распознавания, часто ограниченную одним конкретным соединением, которая определяется экспериментально. Гетерогенные условия электродной реакции вносят свои особенности в характеристики связывания энантиомеров с селектором. В связи с этим параметры селективности сенсоров могут не совпадать с характеристиками разделения энантиомеров в гомогенных условиях. Не вдаваясь в детали механизмов реализации энантиоселективных взаимодействий в ЭВС, отметим, что до последнего времени большинство разработок в этой области базировалось на применении комплексов включения [19, 20, 36–48], полимеров с молекулярными отпечатками [22, 49–53], элементов живых систем и их аналогов [54–59], а также других селекторов на основе хиральных органических и неорганических структур, иммобилизованных на поверхности электрода [2, 15–18, 21–23, 35, 60–72]. Однако даже самые удачные по конструкции ЭВС не всегда позволяют обнаружить заметную разницу между потенциалами пиков и величинами максимальных токов энантиомеров на вольтамперограммах. Кроме того, многие протоколы иммобилизации хиральных селекторов на поверхности электрода достаточно сложные, а образующийся сенсорный слой механически неустойчив и нестабилен во времени. В связи с этим исследования по разработке недорогих и простых в изготовлении ЭВС, способных к дискриминации аналитических сигналов широкого спектра энантиомеров, представляют большой интерес.
Сенсоры на основе монокристаллов и наночастиц металлов. Используемые в ЭВС электроды можно разделить на две большие группы – те, поверхность которых сама является хиральной, например наночастицы Cu (643), Au (321), Ag (643), Pt (531), Pd (321), монокристаллы алмаза, кварца и некоторых других материалов [73–76], и те, поверхность которых модифицирована хиральными селекторами [15–17]. Последние разработки в этой области свидетельствуют, что изменяя технологию синтеза, можно создавать любые хиральные материалы с требуемыми свойствами и геометрией. Важным преимуществом сенсоров первой группы является отсутствие выраженной специализации. Они обеспечивают определение энантиомеров различных веществ, в том числе структурно достаточно далеких друг от друга [77–79]. Примером являются сенсоры на основе монокристаллов алмаза [80], которые отличаются широким диапазоном рабочих потенциалов и высокой устойчивостью в агрессивных средах. Так, применение алмазов в составе пастовых электродов позволяет распознать L- и D-энантиомеры дезоксигалактозы (фукозы) [1]. На алмазных электродах оптические изомеры фукозы окисляются с образованием на вольтамперограммах двух хорошо выраженных пиков, для которых разность потенциалов составляет 120 мВ. Достоверность определения одного энантиомера в присутствии другого составляет 99.5−99.7% при мольном соотношении энантиомеров от 2 : 1 до 9 : 1. На основе такого электрода предложена методика определения энантиомеров фукозы в сыворотке крови и моче человека в условиях дифференциальной импульсной вольтамперометрии (ДИВ). Разработан также алмазный пастовый электрод для определения L- и D-пипеколиновых кислот при совместном присутствии [77]. Из полученных данных следует, что различия в структуре энантиомеров и энергиях взаимодействия с селектором отражаются на электрохимических и аналитических характеристиках: величинах токов, потенциалах, форме пиков на вольтамперограммах, пределах обнаружения и др.
Помимо монокристаллов алмаза, свойства хиральных материалов проявляют также наночастицы Pt и Au [78, 79, 81–83]. В частности, если на поверхность стеклоуглеродного электрода (СУЭ) из раствора HAuCl4 в 0.1 М растворе KNO3 электрохимически при –0.20 В осадить наночастицы Au [79], то на таком электроде на циклических вольтамперограммах L- и D-тирозина – 2-амино-3-(4-гидроксифенил)-пропионовой кислоты – на фоне 0.01 М HCl в диапазоне потенциалов от 0.70 до 1.60 В наблюдаются анодные и катодные пики энантиомеров. При этом разница между максимальными токами анодных и катодных пиков D- и L-тирозина составила 7.9 и 154 мкА соответственно. Интересно, что на металлическом Au-электроде различия между максимальными токами анодных и катодных пиков D- и L-тирозина составляют 8.8 и 94.6 мкА соответственно. Более высокая энантиоселективность СУЭ, модифицированного наночастицами Au, по сравнению с металлическим Au-электродом обусловлена не только хиральностью их поверхности, но и образованием при осаждении наночастиц золота хиральных нанопор, создающих стерические затруднения при диффузии энантиомеров тирозина к поверхности электрода. Стеклоуглеродный электрод с осажденными на его поверхности нанодендритами золота с высокой селективностью позволяет определять энантиомеры 3,4-дигидроксифенилаланина (ДОФА) в диапазоне концентраций от 10 до 100 мкМ [83]. На таком электроде разность потенциалов между пиками окисления энантиомеров L- и D-ДОФА составляет 108 мВ. Электроокисление на хиральных поверхностях Au, Pt, Pd используется также в устройствах для определения D-глюкозы [78]. Однако такие сенсоры пока не вполне удовлетворяют требованиям количественного определения энантиомеров, особенно в смеси, и нуждаются в дальнейшем совершенствовании.
Сенсоры на основе мезопористых металлов с молекулярными отпечатками. Для изготовления ЭВС перспективно применение мезопористых металлов и наночастиц [84–90], полученных с использованием технологии молекулярного импринтинга (МИП). Хотя для изготовления ЭВС в основном применяют МИП-полимеры [22, 50], сенсоры на их основе имеют существенный недостаток, заключающийся в сложности изготовления и удаления молекул шаблона, а также в ограниченном доступе распознаваемых молекул энантиомеров при их проникновении в полости полимеров с молекулярными отпечатками. По аналогии с МИП-полимерами относительно недавно [84, 86] были предложены ЭВС на основе хиральных мезопористых металлов, полученных при электроосаждении Pt, Pd, Au, Ag, Ni и др. на инертных электродах в присутствии лиотропных жидкокристаллических фаз неионных поверхностно-активных веществ в качестве порогенов и хиральных электроактивных шаблонов. Такие электроды имеют большую площадь поверхности, устойчивы в агрессивных средах, в отличие от сенсоров на основе МИП-полимеров топология хиральных полостей в них практически не меняется со временем. Изменяя условия электролиза, можно достаточно просто регулировать толщину сенсорного слоя и размеры пор. При этом полости, повторяющие конфигурацию молекул шаблона, в основном формируются не в объеме, а на поверхности сенсорного слоя, что существенно облегчает доступ к ним молекул-мишеней. Кроме того, эффективность связывания распознаваемых молекул заметно улучшается из-за образования в мезопористых металлах микрофлюидных каналов.
На примере мезопористой платины с молекулярными отпечатками L-триптофана – 2-амино-3-(1Н-индол-3-ил)пропионовой кислоты – показано [86], что такие каналы после удаления шаблона проявляют ярко выраженную хиральность, эффективность которой зависит от потенциала электрода и толщины металлической фазы, температуры, природы и количества порогена, концентрации шаблона при импринтинге. В частности, хиральная мезопористая платина с молекулярными отпечатками L-ДОФА позволяет устанавливать соотношение энантиомеров L- и D-ДОФА по токам пиков их окисления, которые отличаются между собой более чем на 40% [84]. Хиральные полости в мезопористой платине, полученные с помощью энантиомеров миндальной кислоты в качестве шаблона, могут использоваться также для распознавания других энантиомеров, например ДОФА, конфигурация которых близка к конфигурации молекулярных отпечатков [85].
Наряду с платиной, для получения металлических мезопористых и композитных МИП-материалов используют также Ni, Au, Pd и другие металлы. Так, на электроде из хирального мезопористого никеля с молекулярными отпечатками S‑фенилэтанола при электровосстановлении ацетофенона до фенилэтанола с 80%-ной эффективностью образуется его S-энантиомер [87]. Электроосаждением Au при –0.2 В на Au-электроде из раствора состава 2 мМ HAuCl4, 0.2 мМ энантиомеров L- или D-триптофана и 0.1 М пиррола в 100 мл 0.1 М HCl получен хиральный мезопористый МИП-электрод для распознавания и определения энантиомеров триптофана [88]. Линейный концентрационный диапазон сенсора – от 0.013 до 13 мМ с пределами обнаружения 0.012 и 0.009 мкМ для L- и D-триптофана соответственно. Осаждением Ag на поверхности меди в присутствии R- или S‑энантиомеров диаминоциклогексана в качестве мостиковых лигандов получены хиральные наноструктурированные пленки R-и S-Ag [76].
Еще один пример сенсоров на основе хиральных нанокомпозитов металлов – сенсоры, основанные на применении магнитных наноматериалов, облегчающих предварительное концентрирование и разделение энантиомеров [91]. В этом случае появляется возможность их выделения из образца с помощью внешнего магнитного поля вместо того, чтобы выполнять стадии фильтрации или центрифугирования. Такой подход позволяет упростить экспериментальные процедуры и, более того, повысить селективность и чувствительность сенсоров. На сегодняшний день используют в основном три типа магнитных наночастиц: на основе никеля, Fe3O4 и биметаллических наноматериалов, состоящих из железа и других металлов, таких как Cu или Ag. Преимуществом магнитных наноматериалов является возможность создания на их основе различных ЭВС [92, 93].
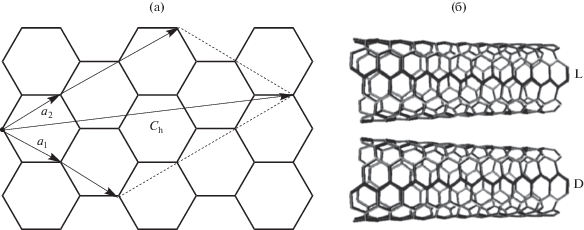
Одностенные углеродные нанотрубки. Среди материалов с топологической (спиральной) хиральностью больший интерес вызывают одностенные хиральные углеродные нанотрубки (УНТ) [18, 94–99] диаметром от 0.4 до 2.5 нм и длиной от нескольких микрометров до десятых долей миллиметра. Углеродные нанотрубки можно представить в виде свернутого в цилиндр листа графена – 2D сетки из правильных шестиугольников, в вершинах которых расположены атомы углерода. Характеристики УНТ зависят от угла сворачивания листа графена относительно оси нанотрубки, который задает ее хиральность и определяет, в частности, электропроводность.
Угол сворачивания графенового листа определяется вектором хиральности (Ch):
Ch = ma1 + na2,
где m и n − число элементарных ячеек нанотрубки в направлениях векторов решетки графена a1 и a2 (рис. 1а). Для хиральных УНТ вектор хиральности может принимать любые значения за исключением m = n (кресельные нанотрубки) и m = 0 (зигзагообразные нанотрубки). В соответствии с вектором хиральности УНТ могут иметь лево- и правостороннюю спиральную хиральность (рис. 1б), от которой зависит их способность к распознаванию энантиомеров [18, 95]. В литературе приведены примеры по применению одностенных хиральных УНТ для распознавания и определения энантиомеров биологически активных и лекарственных соединений. В частности, на СУЭ, модифицированном одностенными хиральными УНТ, в условиях ДИВ отношение максимальных токов пиков L- и D-ДОФА в случае левосторонней спиральности УНТ составило 2.05, а правосторонней – 1.90 [18]. Установлена линейная зависимость между содержанием L-ДОФА в смеси энантиомеров и величинами максимальных токов пиков на вольтамперограммах. В условиях квадратно-волновой вольтамперометрии на подобном электроде можно определять от 30 до 100 мМ энантиомеров ДОФА [98]. Обнаружено также, что одностенные хиральные УНТ образуют связи с ДНК [99] и энантиомерами триптофана [97].
“Умные” сенсорные материалы. Относительно недавно были предложены ЭВС с использованием “умных” наноструктурированных олиго- и полимерных электропроводящих материалов, содержащих стереогенные элементы [21, 64, 100–106]. Такие сенсоры интересны прежде всего практически неограниченной возможностью выбора материала для модифицирования поверхности электрода, когда один и тот же структурный элемент позволяет получить модификатор не только с соответствующими физико-химическими свойствами, но и обеспечивает хиральность сенсора. Так, осажденные электрохимически на поверхности СУЭ полимерные модификаторы на основе (R)-2'-гидроксиметил-3,4-этилендиокситиофена и (S)-2'-гидроксиметил-3,4-этилендиокситиофена позволяют успешно распознать D‑ и L-энантиомеры ДОФА и триптофана, R- и S-энантиомеры пропранолола [104]. Предложены также электроды на основе полимеров хиральных производных 3,4-пропилендиокситиофена для распознавания энантиомеров ДОФА. Отношение максимальных токов пиков окисления L‑ и D-энантиомеров ДОФА (ID/IL или IL/ID) на таких электродах в условиях ДИВ составило 1.85 и 1.06 [106].
Заметим, что в большинстве хиральных полимерных модификаторов хиральность обеспечивается в основном за счет “внешней подвески” хиральных заместителей к цепи полимера. В частности, широкий спектр электропроводящих хиральных полимеров синтезирован на основе N‑замещенных пирролов и производных тиофена, содержащих хиральные заместители в тиофеновом фрагменте [107, 108]. Особый интерес представляют полимеры, хиральность которых обусловлена не внешними хиральными заместителями, а “скрученностью” (спиральностью) основной цепи полимера [64, 102, 105]. В этих полимерах стереогенный элемент является ответственным не только за хиральность, но и за электропроводность полимера. В последнее десятилетие появилось большое число работ, в которых подобные полимеры используют в энантиоселективных сенсорных устройствах, стереоселективном катализе, супрамолекулярных сборках, для получения жидких кристаллов и др. Кроме того, сочетание хиральности с электропроводностью позволяет регулировать способность полимеров различать энантиомеры при изменении потенциала электрода, т.е. такие сенсоры являются “умными” сенсорами, стереоселективность которых можно регулировать в процессе измерений.
В качестве “умных” сенсорных материалов изучены олиго- и полимерные пленки на основе атропоизомерных систем 3,3'-дибензотиофена [96, 102, 103, 105], 3,3'-дитиофена [109], 2,2'-дииндола [64] и др. Такие пленки сохраняют спиральную конфигурацию (R или S) исходного мономера. Модифицированные энантиочистыми пленками олиготиофенов СУЭ позволяют однозначно распознать R- и S-энантиомеры N,N-диметил-1-ферроценилэтиламина, L- и D-тирозина и L- и D-метил-ДОФА в 3 мМ тестовых растворах [64]. С помощью СУЭ, модифицированного циклическими олигомерами 2,2'-бис[2-(5,2'-дитиенил)]3,3'-дитианафтена, распознаны R- и S‑энантиомеры офлоксацина в 1−10 мМ растворах в ацетонитриле и L- и D-ДОФА в 4 мМ водном растворе [96]. Следует отметить, что на “умных” электродах с изначально хиральными полимерными поверхностями наблюдается не только различие в максимальных токах пиков энантиомеров на циклических вольтамперограммах, но и дискриминация энантиомеров по потенциалам пиков (Ep). Такие сенсоры позволяют распознать энантиомеры эпинефрина, тирозина, ДОФА и их метиловых эфиров в 0.001−0.01 М водных растворах [103]. Существенно также, что хиральность сенсорной поверхности и “скрученность” молекул олигомеров можно регулировать метилированием карбоксильных групп, заменой катехиновой группы на фенол и др.
Хиральные олиго- и полисахариды. К полимерам с изначальной хиральностью относятся также природные олиго- и полисахариды, например целлюлоза, хитозан и их композиты с электропроводящими материалами [2, 70, 71, 110–113]. Не рассматривая подробно методы модифицирования электродов полисахаридами, остановимся на особенностях их применения в энантиоселективных сенсорах. Целлюлозы объединяют группу веществ, вырабатываемых из растительного сырья и состоящих преимущественно из линейных полимеров глюкопиранозы, соединенных 1,4-мостиковыми связями [114]. Наличие асимметричного атома углерода придает глюкопиранозному циклу макромолекулы целлюлозы хиральность. В отличие от других природных полисахаридов, целлюлоза не растворяется, а лишь набухает в воде, что накладывает ограничения на хиральность поверхностного слоя сенсоров и селективность их взаимодействий с энантиомерами. Исключение составляют модификаторы на основе микрокристаллической целлюлозы, образующей коллоидные системы. Однако их применение ограничено необходимостью стабилизации таких систем на стадиях иммобилизации других компонентов при получении композитов.
Микрокристаллическая целлюлоза и композиты на ее основе используются в ЭВС в основном для распознавания и определения хиральных аминокислот [2, 70, 112, 113]. В частности, на основе производных целлюлозы с 2,2,6,6-тетраметилпиперидин-1-оксилом, иммобилизованных на модифицированном L-цистеином Au-электроде, разработан сенсор для определения энантиомеров фенилаланина, лейцина и валина [112]. Для повышения чувствительности определений в матрицу целлюлозы вводят наночастицы оксида графена, УНТ, фуллерены, либо модифицируют поверхность электрода таким образом, чтобы она имела различное сродство к энантиомерам. При этом наблюдается синергетический эффект хирального распознавания энантиомеров вследствие усиления сигнала из-за введения УНТ [70].
Кроме целлюлозы, внимание исследователей привлекают хитозан и его хиральные нанокомпозиты [2, 71, 115–124]. Хитозан – продукт деацетилирования хитина (полимера 2-ацетамидо-2-дезокси-D-глюкозы) – образует на электроде прочные и устойчивые хиральные пленки. В отличие от синтетических полимеров, он обладает высокой биологической совместимостью, что имеет существенное значение при создании сенсоров, имплантируемых в живые организмы. Как и для целлюлозы, наличие асимметричных атомов углерода в глюкозаминных циклах хитозана является причиной хиральности макромолекул в целом, которая зависит от их конформации и надмолекулярной структуры. Из-за плохой электропроводности пленок хитозана для распознавания и определения энантиомеров биологически активных и лекарственных соединений в ЭВС обычно используют композиты с УНТ, наночастицами золота, платиновых металлов и оксида графена.
Так, для определения энантиомеров фенилаланина, атенолола, триптофана и миндальной кислоты предложены вольтамперометрические сенсоры на основе N-карбоксиметил- и гидроксипропилхитозана [116, 118], полиэлектролитного комплекса хитозана с его сукцинамидом [28], композитов с УНТ [116, 119], наночастицами оксида графена [120, 121], либо последний применяют для непосредственного модифицирования электродной поверхности [122]. С помощью таких сенсоров определяют энантиомеры фенилаланина [71, 122], триптофана [116, 117, 119, 121] и ДОФА [120]. Для экспрессного распознавания и определения энантиомеров в лекарственных средствах и установления их соотношения разработана универсальная сенсорная платформа на основе композитной пленки хитозана и оксида графена с молекулярными отпечатками R- и S‑пропранолола [124]. Разность потенциалов между Ep энантиомеров пропранолола в диапазоне концентраций от 50 до 1000 мкМ составляет 135 мВ. Для определения L- и D-энантиомеров триптофана предложен электрод на основе композита оксида графена, 3,4,9,10-перилентетракарбоновой кислоты и хитозана. На таком электроде отношение максимальных токов пиков окисления энантиомеров триптофана IL/ID равно 3.0 [117]. Заметим, что применение природных полисахаридов в электрохимических сенсорах, столь популярное в начале века, в настоящее время сокращается из-за недостаточной стабильности и дрейфа показаний сенсоров, а также вследствие появления других, более удобных хиральных модификаторов.
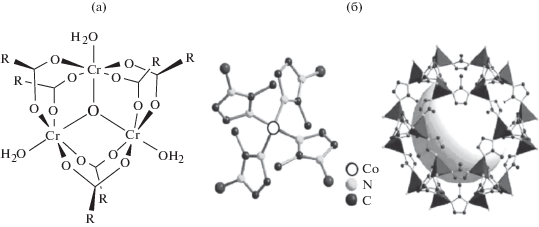
Металлоорганические каркасные материалы. Для изготовления ЭВС перспективно применение металлоорганических каркасных материалов (MOF-структур), образующих наноразмерные поры [125–127]. Основное преимущество MOF перед другими материалами – большое разнообразие и возможность варьирования топологии структур при формировании пористых пространственных решеток. Особенно интересны хиральные MOF-структуры, которые находят применение для селективного распознавания и обнаружения энантиомеров [128–134]. При этом можно использовать как гомохиральные MOF-структуры, так и хирально модифицированные ахиральные MOF-матрицы. По сравнению с хиральными электропроводящими полимерами композиты на основе MOF-структур проявляют более высокую энантиоселективность, имеют хорошую пористость и проводимость. В частности, модифицированный камфоросульфоновой кислотой композит полианилина с мезопористым (поры диаметром менее 2 нм) каркасным терефталатом Cr-MIL-101 (рис. 2а) позволяет с высокой селективностью распознать L- и D-энантиомеры карвона в диапазоне концентраций от 1.0 до 15.0 мг/мл [126]. Более компактная конфигурация L-карвона способствует лучшему проникновению молекул энантиомера в нанопоры композита, что является причиной большего электрохимического отклика.
Сенсор на основе СУЭ, модифицированного гомохиральными MOF-структурами [Cu4L4]n, где H2L = N-(2-гидроксибензил)-L-лейцин, с высокой эффективностью позволяет различить энантиомеры α-метилбензиламина и определить их количественно в концентрационном диапазоне от 0.002 до 0.1 мМ с пределом обнаружения 1.3 мкМ [128]. При этом пространственная структура R-энантиомера α-метилбензиламина имеет более благоприятную конформацию для проникновения через нанопоры [Cu4L4]n к поверхности СУЭ, что отражается на величине аналитического сигнала, который для R-энантиомера заметно выше.
В отличие от описанного выше сенсора, который является достаточно редким примером сенсоров на основе гомохиральных MOF-структур, в большинстве ЭВС используют хиральные нанокомпозиты, содержащие в своем составе MOF-структуры. Так, для определения энантиомеров тирозина предложен композитный электрод Cu-MOF/УКТ/NiF (УКТ – углеродные квантовые точки), полученный электроосаждением MOF-структуры на основе Cu‑TDPAT, где H6TDPAT = 2,4,6-трис(3,5-дикарбоксил-фениламино)-1,3,5-триазин, и хиральных углеродных квантовых точек на фольгу из никеля [131]. Такой электрод является не только высокочувствительным и селективным по отношению к энантиомерам тирозина, но позволяет также определить их соотношение в смеси энантиомеров.
Подобный сенсор (Ni-MOF/УКТ/CuF) разработан для определения энантиомеров пеницилламина [130]. В этом случае MOF-структуру получали электроосаждением на медную фольгу из раствора 0.9 мМ Ni(NO3)2 ⋅ 6H2O и 0.72 мМ 2-аминотерефталевой кислоты в диметилформамиде в присутствии УКТ при –1.5 В. Установлено, что с помощью данного сенсора можно определять энантиомеры пеницилламина в диапазоне концентраций от 100 до 600 мкМ. Для определения пеницилламина предложен также MOF-сенсор h‑HDGA-ZIF-67/СУЭ на основе нанокристаллов Co-ZIF-67 (рис. 2б), модифицированных хиральными (спиральная хиральность) производными L-глутаминовой кислоты (h-HDGA), образующими энантиоселективный самоорганизующийся монослой. На таком электроде в условиях циклической вольтамперометрии в 0.5 М растворе KOH потенциалы пиков окисления 6.5 мМ растворов L- и D-пеницилламина при скорости сканирования 50 мВ/с отличаются на 272 мВ (отношение IL/ID равно 1.33) [132]. Сенсор с высокой чувствительностью и селективностью позволяет определять энантиомеры пеницилламина в концентрационном диапазоне от 0.065 мкМ до 6.5 мМ с пределами обнаружения 0.022 и 0.015 мкМ для L- и D-энантиомеров соответственно. Заметим, что каркасные MOF-структуры с топологией цеолитов, образующиеся при взаимодействии тетраэдрически координированных ионов переходных металлов (Fe, Co, Cu, Zn и др.) с производными имидазола (ZIF-материалы), широко применяют в различных областях химии и химической технологии, поскольку подбором органического линкера в таких структурах можно целенаправленно регулировать размер пор. При этом, в отличие от цеолитов, форма пор в них весьма разнообразна [125].
Разработан сенсор на основе СУЭ, модифицированного композитом восстановленного оксида графена с нанопористым Cu-MOF-материалом, полученным при взаимодействии водного раствора CuCl2 c тримезиновой (1,3,5-бензолтрикарбоновой) кислотой при комнатной температуре [135], содержащий “корону” из хиральных молекул L-лизина, для определения L- и D-энантиомеров триптофана в спинномозговой жидкости человека [134]. Биосенсор на основе 2D композита Zr-MOF-структуры с нанокластерами золота позволяет определять кокаин в диапазоне концентраций 0.001–1.0 нг/мл с пределами обнаружения 0.44 и 0.75 пг/мл в условиях электрохимической импедансной спектроскопии и ДИВ соответственно [133].
В недавно опубликованной работе [136] описан угольный пастовый электрод (УПЭ), модифицированный образующимися спонтанно при 80°С хиральными гибридными MOF-материалами D/L-[Cu(H2O)(en)2]2{[Cu(H2O)2(en)][SiCuW11O39]} . 5H2O (en – этилендиамин) на основе Cu-замещенных полиоксоанионов K8[α-SiW11O39].13H2O и комплексов Cu(II) с этилендиамином для распознавания L- и D-энантиомеров винной кислоты. Интересно, что при повышении температуры до 140°С образующиеся MOF-структуры не проявляют хиральности.
Супрамолекулярные сборки. Повышенное внимание привлекает новый класс хиральных материалов, так называемые 2D материалы на основе хиральных супрамолекулярных сборок, образующихся при самоорганизации хиральных и ахиральных малых молекул [23, 35, 137–142]. В отличие от супрамолекулярных систем на основе хиральных молекул и супрамолекулярных систем с индуцированной хиральностью, при построении сборок из ахиральных молекул образование супрамолекулярных хиральных структур возможно лишь при внешнем воздействии или в присутствии частиц, индуцирующих хиральность [138, 143–147], например, под действием поляризованного света, температуры, перемешивания и др. Этот эффект характерен для органических соединений, молекулы которых образуют связи с другими молекулами с образованием двумерных 2D структур [35]. Образование хиральных структур может быть инициировано также при осаждении ахиральных молекул на поверхности электрода [148–150].
Выше отмечено, что в органических соединениях возникновение хиральности обусловлено наличием хирального центра, который представляет собой атом, содержащий несовместимые в трехмерном пространстве заместители, совпадающие при зеркальном отображении [33]. В принципе, хиральным может быть любой 3D объект. Тем не менее, этот вывод не относится к структурам, образующимся при самосборке ахиральных молекул, и росту нанокристаллов, симметричных по своей природе. В частности, осаждение неорганических соединений и ахиральных молекул при интенсивном перемешивании может привести к образованию хиральных структур [143–145]. При самосборке ахиральных органических молекул обычно образуются рацемические смеси продуктов реакции. Исключением является случай, когда самосборка происходит так, что одна из начальных структур может послужить “затравкой” для сборки только одной хиральной структуры, у которой хиральность вызвана не наличием асимметрических атомов углерода, а взаимным расположением атомов и молекул, приводящим к формированию структур без зеркальной симметрии [145]. В литературе имеется относительно немного сообщений о структуре хиральных сборок ахиральных органических молекул, предположительно, потому что их трудно охарактеризовать аналитическими методами [138, 141, 142]. Для этих целей в основном используют методы электронной микроскопии и кругового дихроизма.
Единого механизма образования хиральных наноструктур не существует, хотя некоторые из них похожи в принципе. Учитывая огромное число возможных форм молекул и нанокристаллов, имеется много способов, чтобы нарушить симметрию во время их синтеза или сборки. При этом вероятность возникновения хиральности в двумерном пространстве существенно больше, чем в трехмерном. Известны случаи, когда ахиральные в трехмерном пространстве молекулы становятся хиральными в двумерном, например, при адсорбции на плоской поверхности [141, 142, 150]. Важным аспектом при спонтанном образовании таких сборок является их дальний порядок, т.е. хиральность различных частей структуры, например, повторяющиеся хиральные петли в материалах с топологической хиральностью (спирали, пропеллеры и т.п.).
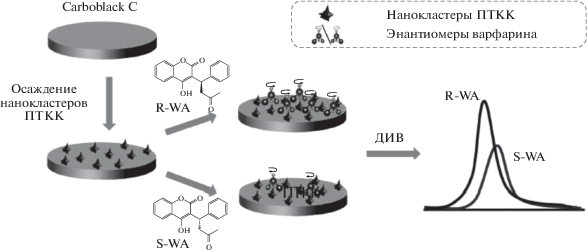
На основе пастового электрода из графитированной сажи Carboblack C, модифицированной циануровой кислотой, разработан хиральный сенсор для селективного распознавания энантиомеров тирозина. Распознавание D- и L-энантиомеров тирозина обусловлено различиями в стерических препятствиях между энантиомерами тирозина и нанопорами супрамолекул циануровой кислоты, что отражается на величинах токов и форме вольтамперограмм в условиях ДИВ, тогда как на немодифицированном пастовом электроде они практически не отличаются между собой [30]. Указанный сенсор позволяет определять соотношение энантиомеров тирозина в смеси, плазме крови и моче человека. По той же причине наблюдаются различия между вольтамперограммами энантиомеров варфарина на Carboblack C пастовом электроде, модифицированном нанокластерами 3,4,9,10-перилентетракарбоновой кислоты. Принцип действия электрода изображен на рис. 3 [31].
Рис. 3.
Распознавание энантиомеров варфарина на Carboblack С пастовом электроде, модифицированном 3,4,9,10-перилентетракарбоновой кислотой (ПТКК) [31].
Предложен также сенсор на основе УПЭ, модифицированного супрамолекулами урацила, для распознавания энантиомеров пропранолола. В отличие от тирозина и варфарина, лимитирующей стадией электроокисления энантиомеров которых является скорость диффузии молекул деполяризатора к поверхности электрода при “проникновении” через нанопоры модификатора, для молекул пропранолола дискриминация сигналов-откликов энантиомеров обусловлена различной устойчивостью их диастереомерных комплексов с супрамолекулами урацила [151].
Следует отметить, что в некоторых случаях при взаимодействии хиральных молекул с хиральными супрамолекулярными сборками механизм их распознавания отличается от обычного, характерного для хирального распознавания с участием хиральных селекторов. В случае пропранолола это обусловлено тем, что S-пропранолол образует с урацилом две связи (О-урацил и N-урацил), а R‑пропранолол образует связь только через атом кислорода, что отражается на потенциалах пиков окисления энантиомеров пропранолола, величинах токов и форме вольтамперограмм. Аналогичным образом функционирует хиральный сенсор для распознавания энантиомеров триптофана на основе модифицированного оксидом графена и чередующимися слоями катионов и анионов пиллар[5]аренов СУЭ [48]. Установлено, что причиной различий в токах и потенциалах пиков энантиомеров триптофана на нем являются различия в их стерических конфигурациях. Заметим также, что при модифицировании поверхности сенсоров хиральными супрамолекулярными структурами всегда необходимо учитывать возможность взаимодействия последних с другими компонентами модификатора c полным (или частичным) исчезновением хиральности. Так, при модифицировании СУЭ полиариленфталидными композитами циануровой кислоты или меламина между вольтамперограммами энантиомеров пропранолола наблюдаются лишь незначительные различия [27].
Таким образом, ЭВС на основе хиральных материалов, сигналы-отклики которых обусловлены изменением энергетических характеристик переноса электрона при взаимодействии энантиомеров с поверхностью электрода, весьма перспективны, хотя и не всегда удовлетворяют требованиям количественного определения энантиомеров, особенно в смеси, и нуждаются в дальнейшем совершенствовании. В частности, многое может дать применение хиральных ионных жидкостей и жидкокристаллических материалов либо использование принципиально новых хиральных сенсоров, включая спин-зависимые хиральные электроды [152, 153].
Хиральные ионные жидкости. Имеющиеся публикации свидетельствуют о растущем значении хиральных ионных жидкостей для улучшения характеристик ЭВС [46, 69, 154–156]. По сравнению с обычными органическими растворителями они имеют низкую летучесть и более высокую электропроводность, что делает их привлекательными для использования в электрохимических сенсорах. Хиральные ионные жидкости применяют в качестве хиральных модификаторов, для изготовления композитных электродов, функционализации наноматериалов и др. Они оказались альтернативой традиционным непроводящим вязким жидкостям (минеральные масла, олигомеры, парафины), используемым в качестве связующего в пастовых электродах. Вследствие хорошей электропроводности хиральных ионных жидкостей токи на таких электродах существенно выше, чем на обычных, что важно при обнаружении следовых количеств аналитов. Более того, из-за высокой сольватирующей способности хиральные ионные жидкости могут действовать как диспергирующие агенты для графена (восстановленного оксида графена), фуллеренов, MOF и УНТ, что помогает гомогенизировать пасты на основе этих материалов и улучшать аналитические характеристики сенсоров.
Такие сенсоры, как правило, имеют более высокую чувствительность по сравнению с обычными ЭВС вследствие лучшей электропроводности и более высокой скорости электронного переноса. Синергетические эффекты, вызываемые совместным действием модификаторов и хиральных ионных жидкостей, также являются объектом пристального внимания ученых, работающих в области химической сенсорики. Существуют два основных класса хиральных ионных жидкостей: функционализированные хиральными селекторами (циклодекстрины, краун-эфиры, каликсарены и др.) катионы (анионы) ионных жидкостей и ионные жидкости, которые сами по себе являются хиральными материалами. Благодаря способности участвовать во взаимодействиях типа “гость−хозяин” с хиральными молекулами, функционализированные циклодекстринами и краун-эфирами ионные жидкости доказали свою эффективность в процессах разделения энантиомеров в хиральной хроматографии и капиллярном электрофорезе [155, 157], а также в электрохимических сенсорах, прежде всего, для увеличения их чувствительности и селективности [155]. Так, ток окисления 2,4-дихлорфенола на УПЭ, модифицированном тозилатом 6-дезокси-6-(3-бензилимидазолий)-β-циклодекстрина, по сравнению с немодифицированным УПЭ возрастает с 0.78 до 1.28 мА [158]. При этом положительный заряд имидазолиевого кольца обеспечивает для молекул аналита “благоприятный” путь к поверхности электрода. Модифицированный УНТ, гексафторфосфатом 1-бутил-1-метил пиридиния и 18-краун-6 стеклоуглеродный электрод позволяет определять соотношение энантиомеров триптофана в смеси, а также является хорошей платформой для распознавания хиральных соединений в реальных объектах [46].
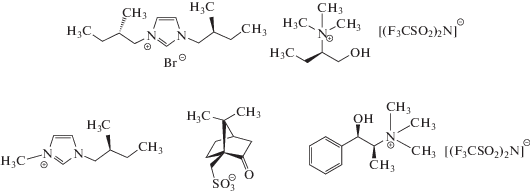
Другой класс – недавно предложенные хиральные ионные жидкости [156, 159]. Примеры катионов и анионов некоторых из них приведены на рис. 4. Помимо применения в ЭВС их используют также в качестве фоновых электролитов, в хиральной хроматографии и капиллярном электрофорезе, в ЯМР-спектроскопии, включая обмен хиральными лигандами. Даже небольшие добавки таких солей к фоновым электролитам позволяют анализировать смеси хиральных соединений на ахиральных электродах. При этом с увеличением концентрации “хиральной добавки” дискриминация энантиомеров на вольтамперограммах возрастает. В частности, для L- и D-энантиомеров метиловых эфиров ДОФА разница между потенциалами пиков составила 360 мВ [156].
Из рассмотренных примеров следует, что хиральность является всеобъемлющим свойством материи – от субатомных и молекулярных до супрамолекулярных и макроскопических масштабов. Несмотря на успехи в разработке ЭВС, основные надежды в этой области связаны с появлением новых материалов. В последние годы эта тенденция только усилилась. Недавняя Нобелевская премия за графен вызвала всплеск работ по изучению и применению этого материала и его композитов. Более того, появилась целая область исследований, базирующаяся на изучении синергетических эффектов и возможностей применения нанокомпозитов графена. Нет сомнений, что хиральные сенсоры на основе графена (восстановленного оксида графена) по своим электрохимическим и аналитическим характеристикам являются одними из лучших в своем классе, однако, как уже отмечалось, их реализация зависит от архитектуры материала (пористости и размера пор), его состава и структуры, а также применяемых хиральных модификаторов. Не решены также проблемы увеличения механической прочности графеновых электродов и устранения дефектов структуры.
Одно из перспективных направлений по применению хиральных материалов в ЭВС – органические транзисторы [160–163] и микрофлюидные системы [164]. По конструкции органические транзисторы напоминают конденсаторы, состоящие из двух обкладок: одна обкладка – проводящий канал между истоком и стоком, а другая – затвор, управляющий током в этом канале. На поверхность затвора (Au, Pt, графен и др.) осаждают материал, селективный к тем или иным энантиомерам, проводимость которого, ток, протекающий через канал, и напряжение, подаваемое на затвор, зависят от концентрации распознаваемого энантиомера. Подобные датчики имеют относительно высокую селекивность по отношению к распознаваемым энантиомерам и чувствительность на уровне нмоль/л. Так, для энантиомеров триптофана и тирозина отношение IL/ID равно 14.1 и 17.2 соответственно [161]. Для энантиомеров аспарагиновой кислоты эта величина составляет 20. Особенно удобны такие датчики для контроля качества лекарственных средств.
* * *
В представленном обзоре в основном цитируются научные статьи, опубликованные после 2015 г., хотя некоторые ссылки, без которых невозможно было рассмотреть изложенный материал, опубликованы раньше. Из огромного массива ссылок по данной проблеме предпочтение было отдано обзорным статьям.
Работа выполнена при поддержке Российского фонда фундаментальных исследований: грант № 18-03-00537.
Список литературы
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: Бином. Лаборатория знаний, 2010. 416 с.
Майстренко В.Н., Евтюгин Г.А., Зильберг Р.А. Энантиоселективные вольтамперо-метрические сенсоры. Уфа: Изд-во БашГУ, 2018. 188 с.
Pasteur L. Recherches sur les relations qui peuvent exister entre la forme crystalline, la composition chimique et le sens de la polarisation rotatoire // Ann. Chim. Phys. 1848. V. 24. P. 442.
Silva M.S. Recent advantes in multinuclear NMR spectroscopy for chiral recognition of organic compounds // Molecules. 2017. V. 22. Article 247.
Yao H., Wynendaele E., Xu X.L., Kosgei A., De Spiegeleer B. Circular dichroism in functional quality evaluation of medicines // J. Pharm. Biomed. Anal. 2018. V. 147. P. 50.
Scriba G.K.E. Chiral recognition mechanisms in analytical separation sciences // Chromatographia. 2012. V. 75. P. 815.
Elbashir A.A., Aboul-Enein H.Y. Multidimensional gas chromatography for chiral analysis // Crit. Rev. Anal. Chem. 2018. V. 48. P. 416.
Zhang C.H., Rodriguez E., Bi C., Zheng X.W., Suresh D., Suh K., Li Z., Elsebaei F., Hage D.S. High performance affinity chromatography and related separation methods for the analysis of biological and pharmaceutical agents // Analyst. 2018. V. 143. P. 374.
Chen X.X., Yuan L.M. A comment on chiral thin layer chromatography // Chin. J. Chromatogr. 2016. V. 34. P. 28.
Mao Z.K., Chen Z.L. Advances in capillary electrochromatography // J. Pharm. Anal. 2019. V. 9. P. 227.
Pan C.J., Wang W.F., Chen X.G. Recent developments of chiral separation by capillary electrophoresis // Chin. J. Chromatogr. 2016. V. 34. P. 16.
Zhang C.H., Woolfork A.G., Suh K., Ovbude S., Bi C., Elzoeiry M., Hage D.S. Clinical and pharmaceutical applications of affinity ligands in capillary electrophoresis: A review // J. Pharm. Biomed. Anal. 2020. V. 177. Article 112 882.
Chen X.L., Kang Y., Zeng S. Analysis of stereoisomers of chiral drug by mass spectrometry // Chirality. 2018. V. 30. P. 609.
Zhou Y., Yoon J. Recent progress in fluorescent and colorimetric chemosensors for detection of amino acids // Chem. Soc. Rev. 2012. V. 41. P. 52.
Zor E., Bingol H., Ersoz M. Chiral sensors // Trends Anal. Chem. 2019. V. 121. Article 115662.
Zhu G., Kingsford O.J., Yi Y., Wong K.-Y. Review-recent advances in electrochemical chiral recognition // J. Electrochem. Soc. 2019. V. 166. P. H205.
Майстренко В.Н., Сидельников А.В., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры: новые решения // Журн. аналит. химии. 2018. Т. 73. С. 3. (Maistrenko V.N., Sidel’nikov A.V., Zil’berg R.A. Enantioselective voltammetric sensors: new solutions // J. Analyt. Chem. 2018. V. 73. P. 1.)
Pu C., Xu Y., Liu Q., Zhu A., Shi G. Enantiomers of single chirality nanotube as chiral recognition interface for enhanced electrochemical chiral analysis // Anal. Chem. 2019. V. 91. P. 3015.
Wang S.-Y., Li L., Xiao Y., Wan Y. Recent advances in cyclodextrins-based chiral recognizing platforms // Trends Anal. Chem. 2019. V. 121. Article 115691.
Niu X., Mo Z., Yang X., Sun M., Zhao P., Li Z., Ouyang M., Liu Z., Gao H., Guo R., Liu N. Advances in the use of functional composites of β-cyclodextrin in electrochemical sensors // Microchim. Acta. 2018. V. 185. P. 328.
Arnaboldi S., Magni M., Mussini P.R. Enantioselective selectors for chiral electrochemistry and electroanalysis: stereogenic elements and enantioselection performance // Cur. Opin. Electrochem. 2018. V. 8. P. 60.
Canfarotta F., Rapini R., Piletsky S. Recent advances in electrochemical sensors based on chiral and nano-sized imprinted polymers // Cur. Opin. Electrochem. 2018. V. 7. P. 146.
Mandler D. Chiral self-assembled monolayers in electrochemistry // Cur. Opin. Electrochem. 2018. V. 7. P. 42.
Xie M.-H., Cheng F., Wang Y., Yao B.-X., Wang W., Guan R.-F., Yang X.-L. QCM based enantioselective discrimination of enantiomers by a pair of serine derived homochiral coordination polymers // Biosens. Bioelectron. 2019. V. 144. Article 111 667.
Chiral Drugs: Chemistry and Biological Action / Eds. Lin G.-Q., You Q.-D., Cheng J.-F. New Jersey: Wiley, 2011. 456 p.
Alvarez-Rivera G., Bueno M., Ballesteros-Vivas D., Cifuentes A. Chiral analysis in food science // Trends Anal. Chem. 2020. V. 123. Article 11576.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarka-eva Y.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. P. 619.
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for the recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. P. 1886.
Зильберг Р.А., Майстренко В.Н., Яркаева Ю.А., Дубровский Д.И. Энантиоселективная вольтамперометрическая сенсорная система для распознавания D- и L-триптофана на основе стеклоуглеродных электродов, модифицированных композитами полиариленфталида с α-, β- и γ-циклодекстринами // Журн. аналит. химии. 2019. Т. 74. С. 941. (Zil’-berg R.A., Maistrenko V.N., Yarkaeva Y.A., Dubrov-skii D.I. An eantioselective voltammetric sensor system based on glassy carbon electrodes modified by polyarylenephthalide composites with α-, β-, and γ-cyclodextrins for recognizing D- and L-tryptophans // J. Analyt. Chem. 2019. V. 74. P. 1245.)
Зильберг Р.А., Майстренко В.Н., Кабирова Л.Р., Гуськов В.Ю., Хамитов Э.М., Дубровский Д.И. Хиральный вольтамперометрический сенсор на основе модифицированного циануровой кислотой пастового электрода для распознавания и определения энантиомеров тирозина // Журн. аналит. химии. 2020. Т. 75. С. 80. (Zil’berg R.A., Maistrenko V.N., Kabirova L.R., Gus’kov V.Yu., Khamitov E.M., Dubrovskii D.I. A chiral voltammetric sensor based on a paste electrode modified by cyanuric acid for the recognition and determination of tyrosine enantiomers // J. Analyt. Chem. 2020. V. 75. P. 101.)
Zilberg R.A., Maistrenko V.N., Zagitova L.R., Gus’kov V.Y., Dubrovsky D.I. Chiral voltammetric sensor for warfarin enantiomers based on carbon black paste electrode modified by 3,4,9,10-perylenetetracarboxylic acid // J. Electroanal. Chem. 2020. V. 861. Article 113986.
Dalgliesh C.E. The optical resolution of aromatic amino-acids on paper chromatograms // J. Chem. Soc. 1952. V. 137. P. 3940.
Илиел Э., Вайлен С., Дойл М. Основы органической стереохимии. Пер. с англ. М.: Бином. Лаборатория знаний, 2007. 704 с.
Berthod A. Chiral recognition mechanisms // Anal. Chem. 2006. V. 78. P. 2093.
Liu M.H., Zhang L., Wang T.Y. Supramolecular chirality in self-assembled systems // Chem. Rev. 2015. V. 115. P. 7304.
Lenik J. Cyclodextrins based electrochemical sensors for biomedical and pharmaceutical analysis // Curr. Med. Chem. 2017. V. 24. P. 2359.
Yi Y., Zhang D., Ma Y., Wu X., Zhu G. Dual-signal electrochemical enantiospecific recognition system via competitive supramolecular host-guest interactions: the case of phenylalanine // Anal. Chem. 2019. V. 91. P. 2908.
Wu D., Kong Y. Dynamic interaction between host and guest for enantioselective recognition: application of β-cyclodextrin based charged catenane as electrochemical probe // Anal. Chem. 2019. V. 91. P. 5961.
Upadhyay S.S., Srivastava A.K. Hydroxypropyl β-cyclodextrin cross-linked multiwalled carbon nanotube based chiral nanocomposite electrochemical sensors for the discrimination of multichiral drug atorvastatin isomers // New J. Chem. 2019. V. 43. Article 11178.
Upadhyay S.S., Kalambate P.K., Srivastava A.K. Enantioselective biomimetic sensor for discrimination of R- and S-clopidogrel promoted by β-cyclodextrin complexes employing graphene and platinum nanoparticle modified carbon paste electrode // J. Electroanal. Chem. 2019. V. 840. P. 305.
Niu X., Yang X., Mo Z., Guo R., Liu N., Zhao P., Liu Z. Perylene functionalized graphene sheets modified with β-cyclodextrin for the voltammetric discrimination of phenylalanine enantiomers // Bioelectrochem. 2019. V. 129. P. 189.
Niu X., Yang X., Mo Z., Guo R., Liu N., Zhao P., Liu Z., Ouyang M. Voltammetric enantiomeric differentiation of tryptophan by using multiwalled carbon nanotubes functionalized with ferrocene and β-cyclodextrin // Electrochim. Acta. 2019. V. 297. P. 650.
Song J., Yang C., Ma J., Han Q., Ran P., Fu Y. Voltammetric chiral discrimination of tryptophan using a multilayer nanocomposite with implemented amino-modified β-cyclodextrin as recognition element // Microchim. Acta. 2018. V. 185. Article 230.
Si K., Sun C., Cheng S., Wang Y., Hu W. Cyclodextrin functionalized reduced graphene oxide for electrochemical chiral differentiation of tartaric acid // Anal. Methods. 2018. V. 10. P. 3660.
Liang W., Rong Y., Fan L., Dong W., Dong Q., Yang C., Zhong Z., Dong C., Shuang S., Wong W.-Y. 3D graphene/hydroxypropyl-β-cyclodextrin nanocomposite as an electrochemical chiral sensor for the recognition of tryptophan enantiomers // J. Mater. Chem. C. 2018. V. 6. P. 12822.
Atta N.F., Galal A., Ahmed Y.M. Highly conductive crown ether/ionic liquid crystal-carbon nanotubes composite based electrochemical sensor for chiral recognition of tyrosine enantiomers // J. Electrochem. Soc. 2019. V. 166. P. B623.
Yang J.P., Li Z.Q., Tan W.S., Wu D.T., Tao Y.X., Kong Y. Construction of an electrochemical chiral interface by the self-assembly of chiral calix[4]arene and cetyltrimethylammonium bromide for recognition of tryptophan isomers // Electrochem. Commun. 2018. V. 96. P. 22.
Zhao G., Zhou X., Ran X., Tan X., Li T., Cao M., Yang L., Du G. Layer-by-layer assembly of anionic-/cationic-pillar[5]arenes multilayer films as chiral interface for electrochemical recognition of tryptophan isomers // Electrochim. Acta. 2018. V. 277. P. 1.
Bel Bruno J.J. Molecularly imprinted polymers // Chem. Rev. 2019. V. 119. P. 94.
Iacob B.-C., Bodoki E., Oprean R. Chiral electrochemical sensors based on molecularly imprinted polymers with pharmaceutical applications / Handbook of Sustainable Polimers: Processing and Applications / Eds. Thakur V.K., Thakur M.R. Jenny Stanford Publishing, 2016. P. 587.
Radi A.-E., Wahdan T., El-Basiony A. Electrochemical sensors based on molecularly imprinted polymers for pharmaceuticals analysis // Curr. Anal. Chem. 2019. V. 15. P. 219.
Rutkowska M., Płotka-Wasylka J., Morrison C., Wieczorek P.P., Namieśnik J., Marć M. Application of molecularly imprinted polymers in analytical chiral separations and analysis // Trends Anal. Chem. 2018. V. 102. P. 91.
Zhong C., Yang B., Jiang X., Li J. Current progress of nanomaterials in molecularly imprinted electrochemical sensing // Crit. Rev. Anal. Chem. 2018. V. 48. P. 15.
Ma W., Xu L.G., Wang L.B., Xu C.L., Kuang H. Chirality-based biosensors // Adv. Funct. Mater. 2019. V. 29. Article 1805512
Zhu G., Zhang D., Ma Y., Yi Y. Electrochemical chiral recognition for a complex system based on specific enzymatic reactions // J. Electrochem. Soc. 2020. V. 167. Article 027523.
Zhai F., Yu Q., Zhou H., Liu J., Yang W., You J. Electrochemical selective detection of carnitine enantiomers coupling copper ion dependent DNAzyme with DNA assistant hybridization chain reaction // J. Electroanal. Chem. 2019. V. 837. P. 137.
Ye Q., Guo L., Wu D., Yang B., Tao Y., Deng L., Kong Y. Covalent functionalization of bovine serum albumin with graphene quantum dots for stereospecific molecular recognition // Anal. Chem. 2019. V. 91. P. 11864.
Ye Q., Hu J., Wu D., Yang B., Tao Y., Qin Y., Kong Y. Smart construction of an efficient enantioselective sensing device based on bioactive tripeptide // Anal. Methods. 2019. V. 11. P. 1951.
Liu H., Shao J., Shi L., Ke W., Zheng F., Zhao Y. Electroactive NPs and D-amino acids oxidase engineered electrochemical chiral sensor for D-alanine detection // Sens. Actuators B. 2020. V. 304. Article 127333.
Naveen M.H., Gurudatt N.G., Shim Y.-B. Applications of conducting polymer composites to electrochemical sensors: a review // Appl. Mater. Today. 2017. V. 9. P. 419.
George J.M., Antony A., Mathew B. Metal oxide nanoparticles in electrochemical sensing and biosensing: a review // Microchim. Acta. 2018. V. 185. Article 358.
Zhong C., Yang B., Jiang X., Li J. Current progress of nanomaterials in molecularly imprinted electrochemical sensing // Crit. Rev. Anal. Chem. 2018. V. 48. P. 15.
Srivastava A.K., Upadhyay S.S., Rawool C.R., Punde N.S., Rajpurohit A.S. Voltammetric techniques for the analysis of drugs using nanomaterials based chemically modified electrodes // Curr. Anal. Chem. 2019. V. 15. P. 249.
Arnaboldi S., Cauteruccio S., Grecchi S., Benincori T., Marcaccio M., Biroli A.O., Longhi G., Licandro E., Mussin P.R. Thiahelicene-based inherently chiral films for enantioselective electroanalysis // Chem. Sci. 2019. V. 10. P. 1539.
Zor E., Morales-Narváez E., Alpaydin S., Bingol H., Ersoz M., Merkoçi A. Graphene-based hybrid for enantioselective sensing applications // Biosens. Bioelectron. 2017. V. 87. P. 410.
Nag A., Mitra A., Mukhopadhyay S.C. Graphene and its sensor-based applications: A review // Sens. Actuators A. 2018. V. 270. P. 177.
Rowley-Neale S.J., Randviir E.P., Dena A.S.A., Banks C.E. An overview of recent applications of reduced graphene oxide as a basis of electroanalytical sensing platforms // Appl. Mater. Today. 2018. V. 10. P. 218.
Hou X., Xu T., Wang Y., Liu S., Chu R., Zhang J., Liu B. Conductive and chiral polymer modified metal-organic framework for enantioselective adsorption and sensing // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 26 365.
Wu D., Yang J., Peng Y., Yu Y., Zhang J., Guo L., Kong Y., Jiang J. Highly enantioselective recognition of various acids using polymerized chiral ionic liquid as electrode modifies // Sens. Actuators B. 2019. V. 282. P. 164.
Zhang Y., Liu G., Yao X., Gao S., Xie J., Xu H., Lin N. Electrochemical chiral sensor based on cellulose nanocrystals and multiwall carbon nanotubes for discrimination of tryptophan enantiomers // Cellulose. 2018. V. 25. P. 3861.
Li Z., Mo Z., Yan P., Meng S., Wang R., Niu X., Liu N., Guo R. Amino acid inspired electrochemical recognition of phenylalanine enantiomers by amphoteric chitosan // New J. Chem. 2018. V. 42. P. 6817.
Alarcon-Angeles G., Palomar-Pardave M., Merkoci A. 2D Materials-based platforms for electroanalysis application // Electroanalysis. 2018. V. 30. P. 1271.
Attard G.A. Electrochemical studies of enantioselectivity at chiral metal surfaces // J. Phys. Chem. B. 2001. V. 105. P. 3158.
Gellman A.J. Chiral surfaces: Accomplishments and challenges // ACS Nano. 2010. V. 4. P. 5.
Jin R.-H. Understanding silica from the viewpoint of asymmetry // Chem. Eur. J. 2019. V. 25. P. 1.
Ma L., Cao Y., Duan Y., Han L., Che S. Silver films with hierarchical chirality // Angew. Chem. Int. Ed. 2017. V. 56. P. 8657.
Stefan R.L., Nejem R.M. Determination of L- and D-pipecolic acids using a diamond paste based electrode // Instrum. Sci. Technol. 2004. V. 32. P. 311.
Park S., Boo H., Chung T.D. Electrochemical non-enzymatic glucose sensors // Anal. Chim. Acta. 2006. V. 556. P. 46.
Zhou J., Chen Q., Wang Y., Han Q., Fu Y. Stereoselectivity of tyrosine enantiomers in electrochemical redox reactions on gold matrices // Electrochim. Acta. 2012. V. 59. P. 45.
Yang N., Yu S., Macpherson J.V., Einaga Y., Zhao H., Zhao G., Swain G.M., Jiang X. Conductive diamond: synthesis, properties, and electrochemical applications // Chem. Soc. Rev. 2019. V. 48. P. 157.
Garzon I.L., Reyes-Nava J.A., Rodriguez-Hernandez J.I., Sigal I., Beltran M.R., Michaelian K. Chirality in bare and passivated gold nanoclusters // Phys. Rev. B. 2002. V. 66. N 073403.
Gautier C., Burgi T. Chiral gold nanoparticles // ChemPhysChem. 2009. V. 10. P. 483.
Lian H., Huang S., Wei X., Guo J., Sun X., Liu B. Gold nanodendrite-based differential potential ratiometric sensing strategy for enantioselective recognition of DOPA // Talanta. 2020. V. 210. Article 120654.
Wattanakit C., Come Y.B.S., Lapeyre V., Bopp P.A., Heim M., Yadnum S., Nokbin S., Warakulwit C., Limtrakul J., Kuhn A. Enantioselective recognition at mesoporous chiral metal surfaces // Nat. Commun. 2014. V. 5. Article 3325.
Yutthalekha T., Warakulwit C., Limtrakul J., Kuhn A. Enantioselective recognition of DOPA by mesoporous platinum imprinted with mandelic acid // Electroanalysis. 2015. V. 27. P. 2209.
Assavapanumat S., Yutthalekha T., Garrigue P., Goudeau B., Lapeyre V., Perro A., Sojic N., Wattanakit C., Kuhn A. Potential induced fine-tuning the enantioaffinity of chiral metal phases // Angew. Chem. Int. Ed. 2019. V. 58. P. 3471.
Assavapanumat S., Ketkaew M., Kuhn A., Wattanakit C. Synthesis, characterization, and electrochemical applications of chiral imprinted mesoporous Ni surfaces // J. Am. Chem. Soc. 2019. V. 141. P. 18870.
Niu X., Yang X., Mo Z., Pan Z., Liu Z., Shuai C., Gao Q, Liu N., Guo R. Electrochemical chiral recognition at molecular imprinting Au surfaces // J. Electrochem. Soc. 2019. V. 166. P. B1126.
Fang Y., Li C., Bo J., Henzie J., Yamauchi Y., Asahi T. Chiral sensing with mesoporous Pd@Pt nanoparticles // ChemElectroChem. 2017. V. 4. P. 1832.
Pachon L.D., Yosef I., Markus T.Z., Naaman R., Avnir D., Rothenberg G. Chiral imprinting of palladium with cinchona alkaloids // Nat. Chem. 2009. V. 1. P. 160.
Yang Y.K., Yan W.Y., Guo C.X., Zhang J.H., Yu L.G., Zhang G.H., Wang X.M., Fang G.Z., Sun D.D. Magnetic molecularly imprinted electrochemical sensors: a review // Anal. Chim. Acta. 2020. V. 1106. P. 1.
Munoz J., González-Campo A., Riba-Moliner M., Baeza M., Mas-Torrent M. Chiral magnetic-nanobiofluids for rapid electrochemical screening of enantiomers at a magneto nanocomposite graphene-paste electrode // Biosens. Bioelectron. 2018. V. 105. P. 95.
Sun B., Ni X., Cao Y., Cao G. Electrochemical sensor based on magnetic molecularly imprinted nanoparticles modified magnetic electrode for determination of Hb // Biosens. Bioelectron. 2017. V. 91. P. 354.
Bati A.S.R., Yu L.-P., Batmunkh M., Shapter J.G. Recent advances in applications of sorted single-walled carbon nanotubes // Adv. Funct. Mater. 2019. V. 29. Article 1902273.
Chen X.-Q., Liao X.-Y., Yu J.-G., Jiao F.-P., Jiang X.-Y. Chiral carbon nanotubes and carbon nanotube chiral composites: Preparation and applicftions // Nano. 2013. V. 8. Article 1330002.
Arnaboldi S., Benincori T., Cirilli R., Kutner W., Magni M., Mussini P.R., Noworyta K., Sannicolò F. Inherently chiral electrodes: The tool for chiral voltammetry // Chem. Sci. 2015. V. 6. P. 1706.
Bhattacharyya T., Roy S., Dasgupta A.K. Chirality sensitive binding of tryptophan enantiomers with pristine single wall carbon nanotubes // Phys. Chem. Chem. Phys. 2014. V. 16. Article 14651.
Chen L., Chang F., Meng L., Li M., Zhu Z. A novel electrochemical chiral sensor for 3,4-dihydroxyphenylalanine based on the combination of single-walled carbon nanotubes, sulfuric acid and square wave voltammetry // Analyst. 2014. V. 139. P. 2243.
He W., Dai J., Li T., Bao Y., Yang F., Zhang X., Uyama H. Novel strategy for the investigation on chirality selection of single-walled carbon nanotubes with DNA by electrochemical characterization // Anal. Chem. 2018. V. 90. P. 12810.
Иванов А.Е., Зубов В.П. “Умные” полимеры как поверхностные модификаторы биоаналитических устройств и биоматериалов: теория и практика // Успехи химии. 2016. Т. 85. С. 565. (Ivanov A.E., Zubov V.P. Smart polymers as surface modifiers for bioanalytical devices and biomaterials: Theory and practice // Russ. Chem. Rev. 2016. V. 85. P. 565.)
Ruiz J.A.R., Sanjuán A.M., Vallejos S., García F.C., García J.M. Smart polymers in micro and nano sensory devices // Chemosensors. 2018. V. 6. Article 12.
Sannicolo F., Arnaboldi S., Benincori T., Bonometti V., Cirilli R., Dunsch L., Kutner W., Longhi G., Mussini P.R., Panigati M., Pierini M., Rizzo S. Potential-driven chirality manifestations and impressive enantioselectivity by inherently chiral electroactive organic films // Angew. Chem. Int. Ed. 2014. V. 53. P. 2623.
Arnaboldi S., Benincori T., Cirilli R., Grecchi S., Santagostini L., Sannicolò F., Mussini P.R. Inherently chiral thiophene-based electrodes at work: a screening of enantioselection ability toward a series of pharmaceutically relevant phenolic or catecholic amino acids, amino esters, and amine // Anal. Bioanal. Chem. 2016. V. 408. P. 7243.
Dong L., Zhang Y., Duan X., Zhu X., Sun H., Xu J. Chiral PEDOT-based enantioselective electrode modification material for chiral electrochemical sensing: mechanism and model of chiral recognition // Anal. Chem. 2017. V. 89. P. 9695.
Arnaboldi S., Grecchi S., Magni M., Mussini P. Electroactive chiral oligo- and polymer layers for electrochemical enantiorecognition // Cur. Opin. Electrochem. 2018. V. 7. P. 188.
Niu J.-L., Chai K.-K., Zeng M.-X., Wang T.-T., Zhang C.-Y., Chen S., Xu J.-K., Duan X.M. Boc-phenylalanine grafted poly(3,4-propylenedioxythiophene) film for electro-chemically chiral recognition of 3,4-dihydroxyphenylalanine enantiomers // Chin. J. Polym. Sci. 2019. V. 37. P. 451.
Kane-Maguire L.A.P., Wallace G.G. Chiral conducting polymers // Chem. Soc. Rev. 2010. V. 39. P. 2545.
Cichosz S., Masek A., Zaborski M. Polymer-based sensors: A review // Polymer Testing. 2018. V. 67. P. 342.
Sannicolo F., Mussini P.R., Benincori T., Martinazzo R., Arnaboldi S., Appoloni G., Panigati M., Procopio E.Q., Marino V., Cirilli R., Casolo S., Kutner W., Noworyta K., Pietrzyk-Le A., Iskierko Z., Bartold K. Inherently chiral spider-like oligothiophenes // Chem. Eur. J. 2016. V. 22. P. 10839.
Van Rie J., Thielemans W. Cellulose–gold nanoparticle hybrid materials // Nanoscale. 2017. V. 9. P. 8525.
Wang R., Mo Z., Niu X., Yan M., Feng H., Zhang H., Guo R., Liu N. A regular self-assembly micro-nano structure based on sodium carboxymethyl cellulose-reduced graphene oxide (rGO-EDA-CMC) for electrochemical chiral sensor // J. Electrochem. Soc. 2019. V. 166. P. B173.
Bi Q., Dong S., Sun Y., Lu X., Zhao L. An electrochemical sensor based on cellulose nanocrystal for the enantioselective discrimination of chiral amino acids // Anal. Biochem. 2016. V. 508. P. 50.
Bao L., Chen X., Yang B., Tao Y., Kong Y. Construction of electrochemical chiral interfaces with integrated polysaccharides via amidation // ACS Appl. Mater. Interfaces. 2016. V. 8. Article 21710.
Суров О.В., Воронова М.И., Захаров А.Г. Функциональные материалы на основе нанокристаллической целлюлозы // Успехи химии. 2017. Т. 86. С. 907. (Surov O.V., Voronova M.I., Zakharov A.G. Functional materials based on nanocrystalline cellulose // Russ. Chem. Rev. 2017. V. 86. P. 907.)
Yang X., Niu X., Mo Z., Guo R., Liu N., Zhao P., Liu Z. Perylene-functionalized graphene sheets modified with chitosan for voltammetric discrimination of tryptophan enantiomers // Microchim. Acta. 2019. V. 186. Article 333.
Li Z., Mo Z., Yan P., Meng S., Wang R., Niu X., Liu N., Guo R. Chiral electrochemical recognition of tryptophan enantiomers at a multi-walled carbon nanotube-N-carboxymethyl chitosan composite-modified glassy carbon electrode // New. J. Chem. 2018. V. 42. P. 11635.
Mo Z., Niu X., Gao H., Li Z., Meng S., Guo R. Electrochemical recognition for tryptophan enantiomers based on 3, 4, 9, 10-perylenetetracarboxylic acid–chitosan composite film // J. Solid State Electrochem. 2018. V. 22. P. 2405.
Li Z., Mo Z., Meng S., Gao H., Niu X., Guo R., Wei T. The construction of electrochemical chiral interfaces using hydroxypropyl chitosan // RSC Adv. 2017. V. 7. P. 8542.
Li Z., Mo Z., Guo R., Meng S., Wang R., Gao H., Niu X. Electrochemical enantiorecognition of tryptophan enantiomers based on a multi-walled carbon nanotube–hydroxyethyl chitosan composite film // Anal. Methods. 2017. V. 9. P. 5149.
Lin L., Lian H., Sun X., Yu Y., Liu B. An L-DOPA electrochemical sensor based on graphene doped molecularly imprinted chitosan film //Anal. Methods. 2015. V. 7. P. 1387.
Ou J., Tao Y., Xue J., Kong Y., Dai J., Den L. Electrochemical enantiorecognition of tryptophan enantiomers based on graphene quantum dots-chitosan composite film // Electrochem. Commun. 2015. V. 57. P. 5.
Naghib S.M., Rabiee M., Omidinia E. Electrochemical biosensor for L-phenylalanine based on a gold electrode modified with graphene oxide nanosheets and chitosan // Int. J. Electrochem. Sci. 2014. V. 9. P. 2341.
Niu X., Yang X., Mo Z., Wang J., Pan Z., Liu Z., Shuai C., Liu G., Liu N., Guo R. Fabrication of an electrochemical chiral sensor via an integrated polysaccharides/3D nitrogen-doped graphene-CNT frame // Bioelectrochemistry. 2020. V. 131. Article 107396.
Liu B., Lian H., Chen L., Wei X., Sun X. Differential potential ratiometric sensing platform for enantiorecognition of chiral drugs // Anal. Biochem. 2019. V. 574. P. 39.
Бутова В.В., Солдатов М.А., Гуда А.А., Ломаченко К.А., Lamberti C. Металл-органические каркасные структуры: строение, свойства, методы синтеза и анализа // Успехи химии. 2016. Т. 85. С. 280. (Butova V.V., Soldatov M.A., Guda A.A., Lomachenko K.A., Lamberti C. Metal-organic frameworks: structure, properties, methods of synthesis and characterization // Russ. Chem. Rev. 2016. V. 85. P. 280.)
Hou X., Xu T., Wang Y., Liu S., Chu R., Zhang J., Liu B. Conductive and chiral polymer-modified metal–organic framework for enantioselective adsorption and sensing // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 26365.
Tashiro S., Shionoya M. Novel porous crystals with macrocycle-based well-defined molecular recognition sites // Acc. Chem. Res. 2020. V. 53. P. 632.
Kuang R., Zheng L., Chi Y., Shi J., Chen X., Zhang C. Highly efficient electrochemical recognition and quantification of amine enantiomers based on a guest-free homochiral MOF // RSC Adv. 2017. V. 7. P. 11 701.
Duan D., Yang H., Ding Y., Li L., Ma G. A three-dimensional conductive molecularly imprinted electrochemical sensor based on MOF derived porous carbon/carbon nanotubes composites and prussian blue nanocubes mediated amplification for chiral analysis of cysteine enantiomers // Electrochim. Acta. 2019. V. 302. P. 137.
Liu Z., Kuang X., Sun X., Zhang Y., Wei Q. Electrochemical enantioselective recognition penicillamine isomers based on chiral C-dots/MOF hybrid arrays // J. Electroanal. Chem. 2019. V. 846. Article 113151.
Hou Y., Liu Z., Tong L., Zhao L., Kuang X., Kuang R., Ju H. One-step electrodeposition of the MOF@CCQDs/NiF electrode for chiral recognition of tyrosine isomers // Dalton Trans. 2020. V. 49. P. 31.
Zhao L., Kuang X., Kuang R., Tong L., Liu Z., Hou Y., Sun X., Wang Z., Wei Q. MOF-based supramolecule helical nanomaterials: Toward highly enantioselective electrochemical recognition of penicillamine // ACS Appl. Mater. Interfaces. 2020. V. 12. P. 1533.
Su F., Zhang S., Ji H., Zhao H., Tian J.Y., Liu C.S., Zhang Z., Fang S., Zhu X., Du M. Two-dimensional zirconium-based metal-organic framework nanosheet composites embedded with Au nanoclusters: A highly sensitive electrochemical aptasensor toward detecting cocaine // ACS Sens. 2017. V. 2. P. 998.
Guo J.L., Wei X.F., Lian H.T., Li L.S., Sun X.Y., Liu B. Urchin-like chiral metal-organic framework/reduced graphene oxide nanocomposite for enantioselective discrimination of D/L-tryptophan// ACS Appl. Nano Mater. 2020. V. 3. P. 3675.
Sel K., Demirci S., Meydan E., Yildiz S., Ozturk O.F., Al-Lohedan H., Sahiner N. Benign preparation of metal–organic frameworks of trimesic acid and Cu, Co or Ni for potential sensor applications // J. Electron. Mater. 2015. V. 44. P. 136.
Yang M.-X., Zhou M.-J., Cao J.-P., Han Y.-M., Hong Y.-L., Xu Y. Application of temperature-controlled chiral hybrid structures constructed from copper(II)-monosubstituted Keggin polyoxoanions and copper(II)-organoamine complexes in enantioselective sensing of tartaric acid // RSC Adv. 2020. V. 10. Article 13759.
Hembury G.A., Borovkov V.V., Inoue H. Chirality-sensing supramolecular systems // Chem. Rev. 2008. V. 108. P. 1.
Wang Y., Xu J., Wang Y., Chen H. Emerging chirality in nanoscience // Chem. Soc. Rev. 2013. V. 42. P. 2930.
Wang Q., Li Z., Tao D.-D., Zhang Q., Zhang P., Guo D.-P., Jiang Y.-B. Supramolecular aggregates as sensory ensembles // Chem. Commun. 2016. V. 52. Article 12929.
Tao Y., Gu X., Yang B., Deng L., Bao L., Kong Y., Chu F., Qin Y. Electrochemical enantioselective recognition in a highly ordered self-assembly framework // Anal. Chem. 2017. V. 89. P. 1900.
Gus'kov V.Y., Sukhareva D.A., Gainullina Y.Y., Khamitov E.M., Galkin Y.G., Maistrenko V.N. Chiral recognition capabilities of melamine and cyanuric acid supramolecular structures // Supramol. Chem. 2018. V. 30. P. 940.
Gus'kov V.Yu., Gainullina Yu.Yu., Musina R.I., Zaripova A.I. Pavlova I.N. The emergence of chirality in cyanuric acid conglomerates by Viedma ripening: Surface characterization, chirality assessment and applications in chromatography // Sep. Sci. Technol. 2020. V. 55. Article 1723030.
Viedma C. Chiral symmetry breaking during crystallization: complete chiral purity induced by nonlinear autocatalysis and recycling // Phys. Rev. Lett. 2005. V. 94. Article 065504.
Iggland M., Maggioni G.M., Mazzotti M. Viedma ripening and its role in the chiral separation of optical isomers / Engineering Crystallography: From Molecule to Crystal to Functional Form / Eds. Roberts K.J., Docherty R. Springer, 2015. P. 331.
Sang Y., Yang D., Duan P., Liu M. Towards homochiral supramolecular entities from achiral molecules by vortex mixing-accompanied self-assembly // Chem. Sci. 2019. V. 10. P. 2718.
Wang Y., Zhou D., Li H., Li R., Zhong Y., Sun X., Sun X. Hydrogen-bonded supercoil self-assembly from achiral molecular components with light-driven supramolecular chirality // J. Mater. Chem. 2014. V. 2. P. 6402.
Purcell-Milton F., McKenna R., Brennan L.J., Cullen C.P., Guillemeney l., Tepliakov N.V., Baimuratov A.S., Rukhlenko I.D., Perova T.S., Duesberg G.S., Baranov A.V., Fedorov A.V., Gun’ko Y.K. Induction of chirality in two-dimensional nanomaterials: Chiral 2D MoS2 nanostructures // ASC Nano. 2018. V. 12. P. 954.
Pigot C., Dumur F. Recent advances of hierarchical and sequential growth of macromolecular organic structures on surface // Materials. 2019. V. 12. Article 662.
Dutta S., Gellman A.J. Enantiomer surface chemistry: conglomerate versus racemate formation on surfaces // Chem. Soc. Rev. 2017. V. 46. P. 7787.
Zhang H.-M., Xie Z.-X., Long L.-S., Zhong H.-P., Zhao W., Mao B.-W., Xu X., Zheng L.-S. One-step preparation of large-scale self-assembled monolayers of cyanuric acid and melamine supramolecular species on Au(III) surfaces // J. Phys. Chem. C. 2008. V. 112. P. 4209.
Сидельников А.В., Майстренко В.Н., Зильберг Р.А., Яркаева Ю.А., Хамитов Э.М. Энантиоселективный вольтамперометрический сенсор для распознавания стереоизоме- ров пропранолола // Журн. аналит. химии. 2017. Т. 72. С. 486. (Sidel’nikov A.V., Maistrenko V.N., Zil’berg R.A., Yarkaeva Yu.A., Khamitov E.M. An enantioselective voltammetric sensor for the recognition of propranolol stereo-isomers // J. Analyt. Chem. 2017. V. 72. P. 575.)
Gazzotti M., Arnaboldi S., Grecchi S., Giovanardi R., Cannio M., Pasquali L., Giacomino A., Abollino O., Fontanesi C. Spin-dependent electrochemistry: enantio-selectivity driven by chiral-induced spin selectivity effect // Electrochim. Acta. 2018. V. 286. P. 271.
Benincori T., Arnaboldi S., Magni M., Grecchi S., Fontanesi C., Mussini P.R. Highlighting spin selectivity properties of chiral electrode surfaces from redox potential modulation of an achiral probe under applied magnetic field // Chem. Sci. 2019. V. 10. P. 2750.
Abo-Hamad A., Al Saadi M.A.H., Hayyan M., Ibrahim Juneidi I., Hashim M.A. Ionic liquid-carbon nanomaterial hybrids for electrochemical sensor applications: A review // Electrochim. Acta. 2016. V. 193. P. 321.
Hui B.Y., Raoov M., Zain N.N.M., Mohamad S., Osman H. Combination of cyclodextrin and ionic liquid in analytical chemistry: current and future perspectives // Crit. Rev. Anal. Chem. 2017. V. 47. P. 454.
Rizzo S., Arnaboldi S., Mihali V., Cirilli R., Forni A., Gennaro A., Isse A.A., Pierini M., Mussini P.R., Sannicolo F. Inherently chiral ionic-liquid media: effective chiral electro-analysis on achiral electrodes // Angew. Chem. Int. Ed. 2017. V. 56. P. 1.
Yu J., Zuo L., Liu H., Zhang X.G. Synthesis and application of a chiral ionic liquid functionalized β-cyclodextrin as a chiral selector in capillary electrophoresis // Biomed. Chromatogr. 2013. V. 27. P. 1.
Rasdi F.L.M., Mohamad S., Manan N.S.A., Nodeh H.R. Electrochemical determination of 2,4-dichlorophenol at β-cyclodextrin functionalized ionic liquid modified chemical sensor: voltammetric and amperometric studies // RSC Adv. 2016. V. 6. P. 100186.
Wu D., Tan W., Yu Y., Yang B., Li H., Kong Y. A facile avenue to prepare chiral graphene sheets as electrode modification for electrochemical enantiorecognition // Anal. Chim. Acta. 2018. V. 1033. P. 58.
Liao C., Zhang M., Niu L. Zheng Z., Yan F. Organic electrochemical transistors with graphene-modified gate electrodes for highly sensitive and selective dopamine sensors // J. Mater. Chem. B. 2014. V. 2. P. 191.
Zhang L., Wang G., Xiong C., Zheng L., He J., Ding Y., Lu H., Zhang G., Cho K., Qiu L. Chirality detection of amino acid enantiomers by organic electrochemical transistor // Biosens. Bioelectron. 2018. V. 105. P. 121.
Zhang L., Liu Z., Xiong C., Zheng L., Ding Y., Lu H., Zhang G., Qiu L. Selective recognition of histidine enantiomers using novel molecularly imprinted organic transistor sensor // Org. Electron. 2018. V. 61. P. 254.
Zhang L., Li Q., Li Z., Du Z., Hong X., Qiu L. An enzyme biosensor based on organic transistors for recognizing α-amino acid enantiomers // J. Electrochem. Soc. 2020. V. 167. Article 067517.
Bakır M., Karaaslan M., Unal E., Karadag F., Alkurt F.O., Altıntas O., Dalgac S., Sabah G. Microfluidic and fuel adulteration sensing by using chiral metamaterial sensor // J. Electrochem. Soc. 2018. V. 165. P. B475.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии