Журнал аналитической химии, 2020, T. 75, № 12, стр. 1097-1107
Влияние хлорида на фотометрическое определение тиоцианатов в растворах с помощью железа(III)
А. Н. Крачак a, *, И. Г. Рарова a, Р. Х. Хамизов a
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: annakrchak@mail.ru
Поступила в редакцию 19.08.2019
После доработки 05.02.2020
Принята к публикации 03.07.2020
Аннотация
При определении тиоционатов фотометрическим методом в виде комплексов с железом в хлоридсодержащих растворах необходимо учитывать сложную зависимость оптической плотности растворов от их состава в связи с образованием хлоридных комплексов железа, а также тройных окрашенных комплексов железа с тиоционатом и хлоридом. Разработана математическая модель, связывающая равновесные концентрации компонентов в растворах c суммарными концентрациями всех форм этих компонентов, и на ее основе определены молярные коэффициенты поглощения комплексов [Fe(SCN)]2+ и [Fe(SCN)Cl]+. Рассмотрен пример технологического процесса очистки тиоционатсодержащего раствора двухтемпературным сорбционным методом, аналитическое обеспечение которого с помощью известных методик приводит к некорректным результатам, но возможно с использованием разработанной модели.
Методика фотоколориметрического или спектрофотометрического определения содержания тиоцианатов, основанная на образовании окрашенного комплекса c солями Fe3+ [Fe(SCN)n]m [1], а также методика определения железа в виде таких комплексов [1–3] широко применяются в анализe природных и сточных вод, биологических объектов. Исследовано [4] влияние сопутствующих компонентов, в частности хлорид-ионов, на результаты определения SCN–, отмечена необходимость внесения существенных поправок в получаемые первичные результаты при избыточном содержании хлорид-иона в анализируемом растворе. Влияние хлорида, как и других анионов, авторы работы [4] связывают с конкурентным образованием их комплексов с Fe3+, что снижает концентрацию окрашенных комплексов с тиоцианатом. Эффект снижения оптической плотности растворов роданида железа в присутствии Cl– был замечен еще в 50-х годах прошлого столетия [5, 6]. Так, была показана [6] возможность образования окрашенных тройных комплексов Fe3+, SCN– и Cl–. Для получения корректных данных при анализе каждого конкретного объекта, например сточной воды или технологического раствора с высоким содержанием хлоридов, актуально моделирование и количественное описание зависимости значения аналитического сигнала (оптической плотности) от концентрации различных компонентов в возможно широком диапазоне их изменений.
В настоящей работе представлена и апробирована простая модель, позволяющая проводить корректное определение тиоцианатов в присутствии избытка хлорид-ионов в широком диапазоне условий. Необходимость такого исследования возникла при оптимизации параметров двухтемпературных и комбинированных процессов очистки сточных вод [7, 8].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В соответствии с методикой [1] пробу, содержащую тиоцианаты и хлориды (например, калия, натрия или аммония), смешивают с раствором хлорида железа(III), подкисленного соляной кислотой. Обозначим исходные (суммарные) молярные концентрации ионов SCN–, Fe3+ и Cl–: c0, SCN, c0, Fe, c0, Cl соответственно. Компоненты рассматриваемой системы вступают в реакции, образуя комплексные формы [Fe(SCN)n]m± , [FeClp]m± , а также [Fe(SCN)nClp]m± (n изменяется в пределах 1–6, p – 1–4, m – от +2 до –3). Согласно методике спектрофотометрического определения тиоцианатов [1], условиям ее проведения и составам анализируемых проб, максимальное значение индекса n может составлять 3 для тиоцианатов и 2 для хлоридов [5]. При этом равновесия в системе описываются уравнениями для обратимых химических реакций образования и распада комплексов:
В условиях, задаваемых методикой [1], в частности, в кислой среде с рН ≤ 1, можно не рассматривать реакции образования гидроксокомплексов Fe(OH)2+ и Fe(SCN)(OH)+, поскольку в работе [9] указано, что ионы железа и тиоцианатного комплекса [Fe(SCN)]2+ гидролизуются наполовину (рН = рK) при значениях рН 2.8 и 4.2 соответственно.
Пусть cSCN, cFe, cCl, cFeSCN, ${{c}_{{{\text{Fe}}{{{({\text{SCN}})}}_{{\text{2}}}}}}},$ ${{c}_{{{\text{Fe}}{{{({\text{SCN}})}}_{{\text{3}}}}}}},$ cFeCl, ${{c}_{{{\text{FeC}}{{{\text{l}}}_{{\text{2}}}}}}},$ cFeSCNCl – равновесные концентрации присутствующих в растворе различных форм SCN, Fe и Cl. Количественные соотношения между равновесными концентрациями компонентов описываются системой уравнений, состоящей из двух групп. Первую группу составляют уравнения, связывающие равновесные концентрации компонентов через константы устойчивости соответствующих комплексов:
(2)
${{c}_{{{\text{Fe}}{{{\left( {{\text{SCN}}} \right)}}_{2}}}}} = k_{2}^{{{\text{SCN}}}}{{c}_{{{\text{Fe}}}}}c_{{{\text{SCN}}}}^{2},$(3)
${{c}_{{{\text{Fe}}{{{\left( {{\text{SCN}}} \right)}}_{3}}}}} = k_{3}^{{{\text{SCN}}}}{{c}_{{{\text{Fe}}}}}c_{{{\text{SCN}}}}^{3},$(6)
${{c}_{{{\text{Fe}}\left( {{\text{SCN}}} \right){\text{Cl}}}}} = k_{2}^{{{\text{SCNCl}}}}{{c}_{{{\text{Fe}}}}}{{c}_{{{\text{SCN}}}}}{{c}_{{{\text{Cl}}}}}.$Вторую группу образуют уравнения материального баланса:
(7)
$\begin{gathered} {{c}_{{0,{\text{Fe}}}}} = {{c}_{{{\text{Fe}}}}} + {{c}_{{{\text{FeSCN}}}}} + {{c}_{{{\text{FeSC}}{{{\text{N}}}_{2}}}}} + {{c}_{{{\text{FeSC}}{{{\text{N}}}_{3}}}}} + {{c}_{{{\text{FeCl}}}}} + \\ + \,\,{{c}_{{{\text{FeC}}{{{\text{l}}}_{2}}}}} + {{c}_{{{\text{Fe}}\left( {{\text{SCN}}} \right){\text{Cl}}}}}, \\ \end{gathered} $(8)
$\begin{gathered} {{c}_{{0,{\text{SCN}}}}} = {{c}_{{{\text{SCN}}}}} + {{c}_{{{\text{FeSCN}}}}} + 2{{c}_{{{\text{FeSC}}{{{\text{N}}}_{2}}}}} + \\ + \,\,3{{c}_{{{\text{FeSC}}{{{\text{N}}}_{3}}}}} + {{c}_{{{\text{Fe}}\left( {{\text{SCN}}} \right){\text{Cl}}}}}, \\ \end{gathered} $(9)
${{c}_{{0,{\text{Cl}}}}} = {{c}_{{{\text{Cl}}}}} + {{c}_{{{\text{FeCl}}}}} + 2{{c}_{{{\text{FeC}}{{{\text{l}}}_{2}}}}} + {{c}_{{{\text{Fe}}\left( {{\text{SCN}}} \right){\text{Cl}}}}}.$При подстановке значений равновесных концентраций соответствующих комплексов из уравнений (1)–(6) в выражения (7)–(9) и некоторых простых преобразований получаем:
(10)
$\begin{gathered} 1 + k_{1}^{{{\text{SCN}}}}{{c}_{{{\text{SCN}}}}} + k_{2}^{{{\text{SCNCl}}}}{{c}_{{{\text{SCN}}}}}{{c}_{{{\text{Cl}}}}} + k_{2}^{{{\text{SCN}}}}c_{{{\text{SCN}}}}^{2} + \\ + \,\,k_{3}^{{{\text{SCN}}}}c_{{{\text{SCN}}}}^{3} + k_{1}^{{{\text{Cl}}}}{{c}_{{{\text{Cl}}}}} + k_{2}^{{{\text{Cl}}}}c_{{{\text{Cl}}}}^{2} = {{c}_{{0,{\text{Fe}}}}}{\text{/}}{{c}_{{{\text{Fe}}}}}, \\ \end{gathered} $(11)
$\begin{gathered} {{c}_{{{\text{SCN}}}}}{\text{/}}{{c}_{{{\text{Fe}}}}} + k_{1}^{{{\text{SCN}}}}{{c}_{{{\text{SCN}}}}} + k_{2}^{{{\text{SCNCl}}}}{{c}_{{{\text{Cl}}}}}{{c}_{{{\text{SCN}}}}} + 2k_{2}^{{{\text{SCN}}}}c_{{{\text{SCN}}}}^{2} + \\ + \,\,3k_{3}^{{{\text{SCN}}}}c_{{{\text{SCN}}}}^{3} = {{c}_{{0,{\text{SCN}}}}}{\text{/}}{{c}_{{{\text{Fe}}}}}, \\ \end{gathered} $(12)
$\left( {1{\text{/}}{{c}_{{{\text{Fe}}}}} + k_{1}^{{{\text{Cl}}}} + k_{2}^{{{\text{SCNCl}}}}{{c}_{{{\text{SCN}}}}}} \right){{c}_{{{\text{Cl}}}}} + 2k_{2}^{{{\text{Cl}}}}c_{{{\text{Cl}}}}^{2} = {{c}_{{0,{\text{Cl}}}}}{\text{/}}{{c}_{{{\text{Fe}}}}}.$Дальнейшее упрощение уравнений (10)–(12) зависит от решаемой аналитической задачи. Прямое спектрофотометрическое определение концентрации тиоцианатов по реакции комплексообразования с избытком железа(III), как правило, проводят с использованием рабочих растворов в концентрационном диапазоне аналита c0, SCN < 1 × 10–3 М, в котором сохраняется линейность градуировки [1]. С учетом этого, а также значений констант комплексообразования, приведенных в справочнике [10], можно считать, что при cSCN ≤ c0, SCN:
Таким образом, в условиях определения тиоцианатов можно пренебречь образованием комплексов [Fe(SCN)2]– и Fe(SCN)3. Кроме того, очевидно, что $k_{1}^{{{\text{SCN}}}}{{c}_{{{\text{SCN}}}}} \ll 1.$ Это означает, что из уравнения (10) можно исключить члены, относящиеся ко всем чисто тиоцианатным комплексам.
С учетом этих упрощений искомая модель после некоторых преобразований с хорошим приближением описывается системой уравнений:
Система алгебраических уравнений (13)–(15) легко решается численным методом, например, с помощью программы MathCad, и позволяет для любых наборов заданных значений c0, Cl, c0, Fe, c0, SCN и при известных константах комплексообразования найти равновесные концентрации cCl, cFe, cSCN.
Значения констант устойчивости тиоцианатных комплексов приведены во многих источниках, включая [6 и 10]. Мы применили часто используемый набор констант, приведенный в справочнике [10]: $k_{1}^{{{\text{SCN}}}}$ = 1071.5 М–1; $k_{1}^{{{\text{Cl}}}}$ = 28.2 М–1; $k_{2}^{{{\text{Cl}}}}$ = 125.9 М–2. Значение константы образования тройного комплекса задавали с учетом соотношения, приведенного в работе [6]: $k_{2}^{{{\text{SCNCl}}}}$ ≈ $2k_{1}^{{{\text{SCN}}}}.$
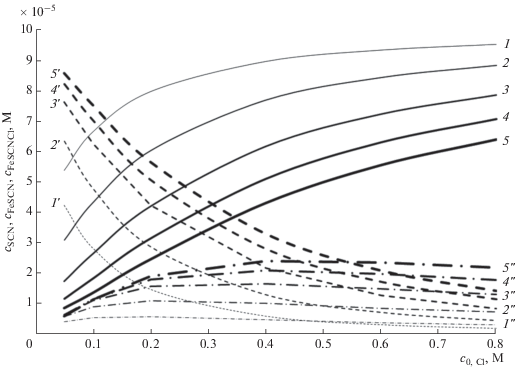
Используя этот набор констант, можно построить расчетные зависимости равновесного содержания светопоглощающих форм – двойных и тройных комплексов – от исходного состава системы (рис. 1 и 2). Как видно, в условиях, определяемых методикой анализа, равновесные содержания поглощающих свет форм [Fe(SCN)]2+ и [Fe(SCN)Cl]+ практически линейно зависят от суммарного содержания определяемого иона SCN–, при этом наклон линейной зависимости определяется содержанием железа. Концентрация [Fe(SCN)]2+ уменьшается с повышением содержания хлорида, в то время как зависимость для [Fe(SCN)Cl]+ имеет более сложный характер. Эти зависимости в итоге определяют зависимость суммарной оптической плотности раствора (A) от тех же параметров. Наиболее общим подходом к анализу смеси окрашенных комплексов является использование правила аддитивности [11]. Для изучаемой системы выражение для оптической плотности в общем виде можно записать следующим образом:
(16)
$~A{\text{/}}l = {{{\varepsilon }}_{1}}{{c}_{{{\text{FeSCN}}}}} + ~{{{\varepsilon }}_{2}}{{c}_{{{\text{FeSCNCl}}}}},$(17)
$A{\text{/}}l = {{\varepsilon }_{1}}k_{1}^{{{\text{SCN}}}}{{c}_{{{\text{Fe}}}}}{{c}_{{{\text{SCN}}}}} + {{\varepsilon }_{2}}k_{2}^{{{\text{SCNCl}}}}{{c}_{{{\text{Fe}}}}}{{c}_{{{\text{SCN}}}}}{{c}_{{{\text{Cl}}}}}.$Рис. 1.
Расчетная зависимость равновесного содержания комплексных ионов [Fe(SCN)]2+ (1–5) и [Fe(SCN)Cl]+ (1'–5') от c0,SCN при исходном содержании хлорида: 0.05 М и железа(III): 0.002 (1, 1'), 0.005 (2, 2'), 0.01 (3, 3'), 0.015 (4, 4'), 0.02(5, 5') M.
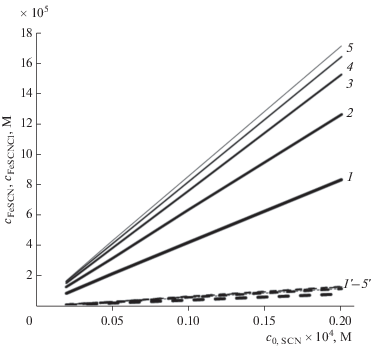
Рис. 2.
Расчетная зависимость равновесного содержания ионов SCN– (1–5, сплошные линии), [Fe(SCN)]2+ (1'–5', пунктирные линии) и [Fe(SCN)Cl]+ (1''–5'', штрих-пунктирные линии) от c0, Cl для c0, SCN = 0.0001 и c0, Fe = 0.002 (1, 1', 1''), 0.005 (2, 2', 2''), 0.01 (3, 3', 3''), 0.015 (4, 4', 4''), 0.02 (5, 5', 5'') М.
Способ использования этого уравнения зависит от решаемой экспериментальной задачи. Если изучают модельный раствор, для которого известны значения c0,Cl, c0,Fe, c0,SCN и A, а также один из коэффициентов ε1 или ε2, то можно решить отдельно систему уравнений (13)–(15) и найти значения равновесных концентраций cCl, cSCN, cFe, а затем с помощью уравнения (17) найти значение другого коэффициента.
Таким же образом, если измеряют оптические плотности нескольких модельных растворов, для которых известны все наборы исходных (суммарных) концентраций, то с использованием определенных ограничений и условий, показанных ниже, можно определить оба значения ε1 и ε2.
Если же стоит задача определения содержания тиоционата в анализируемом хлоридсодержащем растворе, то необходимо решить систему из 4 уравнений: (13)–(15) и (17) при известных значениях c0,Cl, c0,Fe, констант комплексообразования, молярных коэффициентов поглощения и четырех неизвестных концентрациях: cCl, cSCN, cFe и c0,SCN. Последняя концентрация и есть искомая величина. Система уравнений (13)–(15), (17) решается также численно. Решать ее аналитическим способом для нахождения конечной формулы для c0,SCN слишком трудоемко и не имеет смысла.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали стандарт-титр аммония роданистого ТУ 2642-002-96994494-08, хлорид натрия, тиоцианаты калия и аммония, хлорид железа(III) (FeCl3 · 6H2O) и соляную кислоту квалификации х. ч. Оптическую плотность растворов измеряли на ФЭК КФК-2 при λ = 490 нм. Измерения проводили в кюветах c длиной оптического пути l = 2 см. Концентрацию Cl– и SCN– в исходных (индивидуальных) растворах определяли меркурометрическим методом [1, с. 224], концентрацию железа в растворе реагента – комплексонометрическим методом. Раствор реагента, содержащий 0.69 моль/л FeCl3 и 7.59 моль/л HCl, готовили в соответствии с методикой [1, c. 248]. В экспериментах по определению молярных коэффициентов поглощения комплексных форм тиоцианата с железом готовили модельные растворы, смешивая рассчитанные количества исходных 1 М раствора NaCl, 0.1 М раствора KSCN, а также раствора реагента. Экспериментально изученные составы растворов приведены в табл. 1.
Таблица 1.
Экспериментальные значения A/l растворов для различных наборов исходных концентраций (М) компонентов и соответствующие им расчетные значения равновесных концентраций (М) ионных форм тиоцианата
| Эспериментальные данные | Расчетные данные | |||||
|---|---|---|---|---|---|---|
| A/l | c0,Fe | c0,Cl | c0,SCN × 105 | cSCN × 105 | cFeSCN × 105 | cFeSCNCl × 105 |
| 0.588 | 0.0049 | 0.123 | 40 | 19.8 | 16.4 | 3.86 |
| 0.145 | 0.0049 | 0.123 | 9.9 | 4.83 | 4.14 | 0.97 |
| 0.548 | 0.0049 | 0.143 | 40 | 21.2 | 14.8 | 4.06 |
| 0.140 | 0.0049 | 0.143 | 9.9 | 5.19 | 3.72 | 1.02 |
| 0.448 | 0.0049 | 0.223 | 40 | 25.6 | 10 | 4.35 |
| 0.123 | 0.0049 | 0.223 | 9.9 | 6.31 | 2.53 | 1.1 |
| 0.013 | 0.0049 | 0.223 | 1.0 | 0.632 | 0.255 | 0.11 |
| 0.398 | 0.0049 | 0.323 | 40 | 29.1 | 6.66 | 4.21 |
| 0.103 | 0.0049 | 0.323 | 9.9 | 7.21 | 1.68 | 1.06 |
| 0.010 | 0.0049 | 0.323 | 1.0 | 0.722 | 0.169 | 0.106 |
| 0.323 | 0.0049 | 0.523 | 40 | 32.9 | 3.48 | 3.59 |
| 0.083 | 0.0049 | 0.523 | 9.9 | 8.17 | 0.873 | 9.0 |
| 0.664 | 0.0065 | 0.104 | 40 | 15.3 | 20.7 | 4.02 |
| 0.162 | 0.0065 | 0.104 | 9.9 | 3.72 | 5.21 | 1.01 |
| 0.014 | 0.0065 | 0.104 | 1.0 | 0.371 | 0.524 | 0.102 |
| 0.671 | 0.0065 | 0.124 | 40 | 16.8 | 18.8 | 4.38 |
| 0.158 | 0.0065 | 0.124 | 9.9 | 4.11 | 4.73 | 1.1 |
| 0.555 | 0.0065 | 0.204 | 40 | 21.8 | 13.1 | 5.1 |
| 0.142 | 0.0065 | 0.204 | 9.9 | 5.37 | 3.29 | 1.28 |
| 0.012 | 0.0065 | 0.204 | 1.0 | 0.537 | 0.331 | 0.129 |
| 0.478 | 0.0065 | 0.304 | 40 | 26.1 | 8.78 | 5.16 |
| 0.127 | 0.0065 | 0.304 | 9.9 | 6.44 | 2.21 | 1.3 |
| 0.418 | 0.0065 | 0.504 | 40 | 30.8 | 4.63 | 4.57 |
| 0.011 | 0.0065 | 0.504 | 1.0 | 0.765 | 0.117 | 0.115 |
| 0.219 | 0.0129 | 0.210 | 9.9 | 3.64 | 4.56 | 1.74 |
| 0.212 | 0.0129 | 0.230 | 9.9 | 3.88 | 4.26 | 1.79 |
| 0.200 | 0.0129 | 0.310 | 9.9 | 4.73 | 3.3 | 1.91 |
| 0.181 | 0.0129 | 0.410 | 9.9 | 5.55 | 2.47 | 1.92 |
| 0.161 | 0.0129 | 0.610 | 9.9 | 19.8 | 16.4 | 3.86 |
В экспериментах по оценке правильности результатов использовали серию стандартных растворов с заданными общими концентрациями SCN–, Fe3+ и Cl–. Экспериментальные результаты были получены по трем независимым измерениям. Относительная погрешность измерения A для всех исследованных условий не превышала 0.07.
Для демонстрации возможности искажения результатов определения тиоционата в растворах без учета эффекта влияния хлорида и целесообразности применения предложенной модели использовали пример анализа выходных кривых в исследованиях сорбции–десорбции SCN- в двухтемпературном процессе концентрирования тиоцианата с целью его выделения из хлоридных растворов по методике [6]. Для градуировки использовали серию стандартных растворов с заданными общими концентрациями SCN–, Fe3+ и Cl–.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены результаты измерения нормированной оптической плотности A/l для различных наборов экспериментальных значений суммарных (исходных) концентраций компонентов изучаемых модельных растворов, а также рассчитанные с использованием предложенной модели равновесные концентрации ионных форм тиоцианата: SCN–, [Fe(SCN)]2+ и [Fe(SCN)Cl]+. Полученные экспериментальные и расчетные данные могут быть использованы для проверки разработанной математической модели. В случае ее адекватности должна существовать возможность раздельного определения молярных коэффициентов поглощения ε1 и ε2 для окрашенных комплексов [Fe(SCN)]2+ и [Fe(SCN)Cl]+ соответственно. При этом одна и та же пара постоянных величин этих коэффициентов, связанных друг с другом выражением (17), должна в результате расчета приводить к значениям оптической плотности растворов, совпадающим с экспериментальными для всех наборов исходных данных. Для проверки этого утверждения для всей совокупности экспериментальных данных выяснили, можно ли подобрать такое значение ε1, при котором величина ε2, рассчитанная по уравнению (17), остается постоянной для всех экспериментальных значений исходных концентраций определенного компонента, например c0, Cl, или для всех значений расчетных равновесных концентраций, например cFeSCNCl. Рис. 3 иллюстрирует пример такого анализа (приведены зависимости только для трех заданных значений коэффициента ε1). На рис. 4 приведены подобные зависимости коэффициента ε2 от равновесной концентрации тройного комплекса.
Рис. 3.
Зависимость расчетных значений ε2 от c0, Cl при заданных значениях ε1: 1000 (◇), 1750 (◼), 3000 (∆).
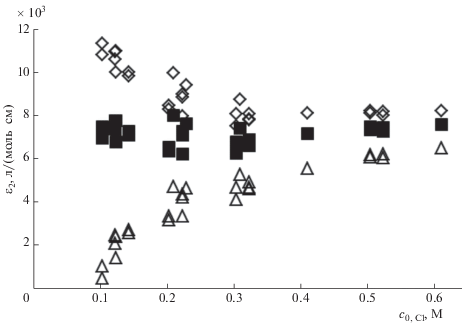
Рис. 4.
Зависимость расчетных значений ε2 от cFeSCNCl при заданных значениях ε1: 1000 (◇), 1750 (⚫), 3000 (∆).
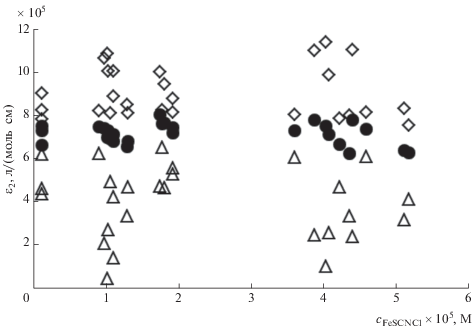
С некоторым приближением, определяемым точностью экспериментальных и модельных расчетных данных, результаты, представленные на рисунках, позволяют заключить, что: 1) значения молярных коэффициентов поглощения не могут быть произвольными; 2) лишь при определенном значении ε1 существует постоянное для всего набора экспериментальных данных значение ε2; 3) результаты расчетов с использованием разных данных совпадают друг с другом.
Приближенно оценить абсолютное значение молярного коэффициента поглощения ε1 комплекса [Fe(SCN)]2+ можно с помощью расчета среднеквадратичного отклонения расчетных значений ε2 для комплекса [Fe(SCN)Cl]+ от средней величины ${{\bar {\varepsilon }}_{2}}$ при условии совпадения экспериментальной и расчетной оптических плотностей для всех наборов исходных данных. Зависимость среднеквадратичного отклонения от значения ε1 представлена на рис. 5.
Рис. 5.
Среднеквадратичное отклонение ε2 от среднего его значения ${{\bar {\varepsilon }}_{2}}$ в зависимости от величины ε1.
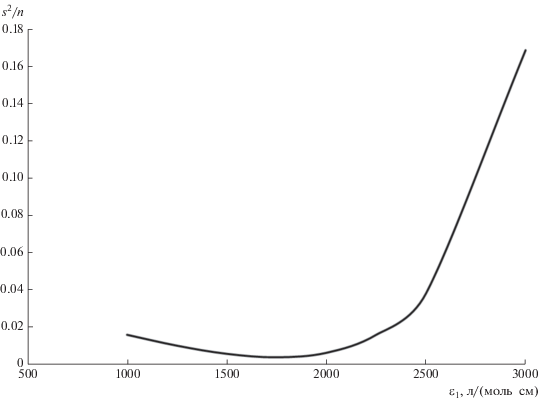
Полученные результаты позволяют сделать приближенные оценки коэффициентов молярного поглощения (при 490 нм) раздельно для окрашенных комплексов [Fe(SCN)]2+ и [Fe(SCN)Cl]+, в том числе впервые для тройного комплекса с хлоридом: ε1 = = 1750 ± 250 л/(моль см), ε2 = 7000 ± 700 л/(моль см). Эти оценки качественно согласуются с известными данными. Так, в работе [6] указано, что значение молярного коэффициента поглощения тройного комплекса больше, чем [Fe(SCN)]2+ в области максимума поглощения двойного комплекса. На первый взгляд, значение ε1 может показаться заниженным по сравнению с данными работы [9] (3900 л/(моль см)), полученными также с помощью математического моделирования. Однако следует учесть сильную зависимость коэффициента поглощения от значения рН [9] и возможность избыточного содержания в растворе тиоцианата по сравнению с Fe(III) в случае, когда целью анализа является определение железа. Впервые Бабко и соавт. [5] показали, что при содержании железа в растворе, превышающем эквивалентное содержание тиоцианата, значения эффективного молярного коэффциента поглощения могут быть меньше 2000 л/(моль см), в то время как даже небольшой избыток тиоцианата приводит к образованию комплексов [Fe(SCN)2]+ и Fe(SCN)3, отличающихся весьма большими значениями эффективного коэффициента поглощения. Как известно, при определении тиоцианата (в отличие от методики определения железа) всегда сохраняется условие ${{c}_{{0,{\text{Fe}}}}} \gg {{c}_{{0,{\text{SCN}}}}}.$
Строго говоря, определенные выше молярные коэффициенты поглощения не являются физико-химическими константами, а лишь расчетными коэффициентами, позволяющими количественно связать определяемые величины с измеренной оптической плотностью для заданных экспериментальных условий. Эти параметры, как и результаты проведенного исследования влияния хлоридов на фотометрическое определение тиоционатов, могут быть полезны для корректного химического анализа растворов, получаемых в ходе различных технологических процессов.
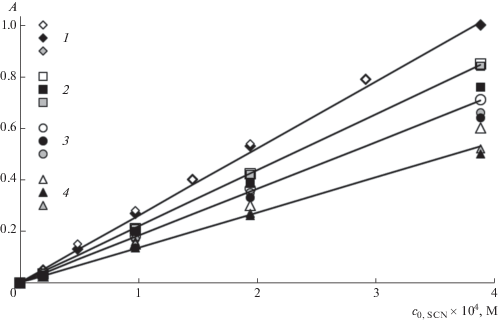
Адекватность предложенной модели и правильность получаемых результатов можно продемонстрировать с помощью сравнения экспериментальных и расчетных значений оптической плотности растворов, не использованных при определении модельных параметров. Рис. 6 иллюстрирует хорошее совпадение таких результатов.
Рис. 6.
Зависимость оптической плотности растворов KSCN в присутствии 0.0036 M FeCl3 от c0, SCN при концентрации NaCl 0.13 (1), 0.23 (2), 0.33 (3) и 0.53 (4) M. Линии – результаты расчета по предлагаемой модели, точки – экспериментальные данные (точки разного цвета относятся к трем независимым сериям измерений).
В табл. 2 приведены данные по проверке правильности определения концентрации тиоционата в растворе методом введено–найдено, которые свидетельствуют о возможности внесения корректировок в известную аналитическую методику [1] c использованием предложенного метода. Представленные результаты получены путем измерения оптической плотности растворов, приготовленных из стандартного образца тиоцианата аммония, с последующим расчетом концентрации по обычной градуировочной кривой и по предлагаемой математической модели.
Таблица 2.
Оценка правильности результатов определения тиоцианат-ионов методом введено–найдено (n = 3, P = 0.95)
| Введено, c0,SCN × 104, М | c0,Cl | Найдено, ${{\bar {c}}_{{0,{\text{SCN}}}}}$ × 104, М* | |
|---|---|---|---|
| 1 | 2 | ||
| 0.19 | 0.23 | 0.12 ± 0.04 | 0.16 ± 0.03 |
| 0.97 | 0.23 | 0.76 ± 0.07 | 0.96 ± 0.07 |
| 1.94 | 0.23 | 1.51 ± 0.25 | 1.89 ± 0.25 |
| 3.88 | 0.23 | 3.0 ± 0.6 | 3.8 ± 0.6 |
| 0.19 | 0.33 | 0.12 ± 0.05 | 0.16 ± 0.03 |
| 0.97 | 0.33 | 0.6 ± 0.3 | 0.9 ± 0.1 |
| 1.94 | 0.33 | 1.3 ± 0.2 | 2.0 ± 0.2 |
| 3.88 | 0.33 | 2.5 ± 0.5 | 3.8 ± 0.5 |
| 0.19 | 0.53 | 0.09 ± 0.03 | 0.17 ± 0.05 |
| 0.97 | 0.53 | 0.6 ± 0.1 | 1.1 ± 0.2 |
| 1.94 | 0.53 | 1.0 ± 0.2 | 2.0 ± 0.4 |
| 3.88 | 0.53 | 2.0 ± 0.5 | 3.9 ± 0.9 |
* 1 – результаты, получены по методике [1] (с использованием экспериментальной градуировочной кривой); 2 – результаты, скорректированные с применением предлагаемой математической модели.
Следует отметить, что мы не ставили цель разработать методику определения тиоционатов в реальных (природных и техногенных) растворах, однако полученные результаты исследования модельных равновесий в системе SCN––Cl––Fe3+ позволяют предложить некоторые универсальные процедуры, которые будут полезны при выборе методики определения тиоцианата для каждого конкретного типа анализируемых растворов, а также при разработке методик анализа таких объектов (как с помощью градуировочных кривых, так и с использованием метода добавок). Ниже рассмотрена последовательность операций при анализе различных типов проб.
1) Определяют содержание хлорида в неизвестном анализируем растворе, а также в реагенте – смеси FeCl3 и HCl. Рассчитывают концентрацию хлорида, вносимую в пробу с реагентом, и его добавочную концентрацию, вносимую в пробу с аликвотой анализируемого раствора. Пользуясь математической моделью, рассчитывают величины аналитического сигнала (A) при различных концентрациях тиоцианата для проб, в которых присутствует только хлорид из реагента, и для проб, в которых присутствует добавочное количество хлорида, вносимое с анализируемым раствором. Если расхождение этих величин не превышает обычной для фотометрического метода погрешности измерения, то концентрацию хлорида можно считать пренебрежимо малой. Тогда при отсутствии других влияющих на величину аналитического сигнала примесей можно проводить анализ методом градуировочной кривой [1].
2) Если концентрация хлорида не является пренебрежимо малой, но в пробе отсутствуют значимые концентрации других примесей, влияющих на величину оптической плотности, рассчитывают общее содержание хлорида и железа (c0, Cl, c0, Fe) в каждой пробе, определяют оптическую плотность раствора после добавления реагента, а затем с помощью системы из 4 уравнений (13)–(15), (17) при всех известных параметрах с четырьмя неизвестными, в том числе c0, CNS, рассчитывают искомую величину – общую концентрацию тиоционата в растворе.
3) Если же объект анализа – реальный природный или технологический раствор, в котором помимо хлорида присутствуют и другие примеси, влияющие на величину оптической плотности пробы, полученное расчетное значение общей концентрации тиоционата в растворе (см. предыдущий пункт) считают ориентировочным для последующего использования метода добавок. В этом случае, зная расчетную ориентировочную концентрацию тиоционата, готовят аналогичную пробу с добавкой стандартного раствора с соизмеримым количеством тиоцианата. Использование соизмеримых количеств тиоцианата пробы и добавки особенно важно при содержании хлоридов в растворе >0.5 M (при этом в соответствии с рис. 6 зависимости оптической плотности от концентрации имеют “пологий” характер). Готовят параллельно еще один образец с добавкой того же количества тиоционата и добавляют в него хлорид, при этом соотношение концентраций хлорида и тиоционата должно быть примерно таким же, как в анализируемом растворе перед измерением оптической плотности. Измеряют оптические плотности обоих растворов с добавками и по результатам каждого измерения рассчитывают концентрацию тиоционата с использованием математической модели. Если полученные значения совпадают, то зависимости A = f(c0, CNS) близки к линейным, каждая со своим коэффициентом для каждой концентрации хлорида (как линии на рис. 6 для модельных растворов, которые близки к линейным в изученной области концентраций компонентов). В этом случае дальнейший анализ растворов из данного источника можно проводить методом добавок в соответствии с методикой [4]: определить оптическую плотность двух проб – с добавкой известного количества стандартного раствора тиоцианата и без такой добавки (c предварительным расчетом c0, SCN для оптимизации этой методики). Если результаты измерений не совпали, то в выбранной области концентраций компонентов линейность зависимости A = f(c0, CNS) нарушена и дальнейший анализ необходимо проводить, изменив условия – аликвоту анализируемого раствора в измеряемой пробе, добавку стандартного раствора, и т.д. – пока не будет достигнута линейность для всех анализируемых проб.
Из полученных нами данных следует, что для модельных растворов, содержащих только хлориды и тиоцианаты, линейность указанной зависимости соблюдается в диапазоне c0, SCN ≤ 2 × 10–4 M, c0, Cl ≤ 1 M. Расчетные зависимости содержания поглощающих свет форм тиоцианата сохраняют свой вид и при более высоких значениях c0, Cl, вплоть до соответствующих растворимости хлорида натрия.
Примером процесса, требующего корректировки результатов определения содержания тиоцианатов в растворах, является очистка от тиоцианатов сточных вод, характеризующихся избыточным содержанием хлоридов. Одним из наиболее перспективных методов такой очистки является двухтемпературный ионообменный метод, основанный на сильной температурной зависимости (уменьшении) селективности высокоосновного анионита к выделяемому целевому компоненту и не требующий реагентов для регенерации ионита [7, 8]. На рис. 7 представлены выходные кривые тиоцианата в одном из циклов повторяющегося циклического процесса пропускания модельного раствора сточной воды через колонну с анионитом АВ-17 при периодическом изменении температуры: сначала при t1 = 5°С (сорбционная очистка), затем при t2 = 80°С (концентрирование и десорбция раствора тиоцианата).
Рис. 7.
Выходные кривые тиоцианата на анионите АВ-17 в двухтемпературном процессе. Состав раствора: 1 М NaCl, 0.001 М KSCN. t1 = 5°C (сплошная линия), t2 = 80°C (пунктир). Относительные концентрации SCN– определены фотоколориметрическим методом: 1 – как соотношение оптических плотностей раствора текущей пробы и исходного раствора (c/c0= A/A0); 2 – по градуироровочной кривой (методика [1]); 3 – после корректировки с использованием математической модели.
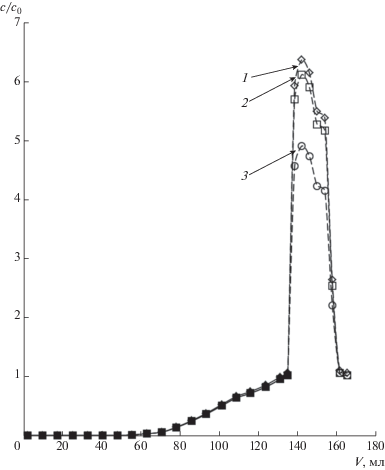
Правильное аналитическое сопровождение такого процесса требует сравнения возможностей различных методик. Измерение относительного оптического поглощения проб выходящего из колонны фильтрата по сравнению с поглощением исходного раствора (если принять, что A/A0= = c/c0) может привести к некорректным результатам определения тиоцианата, так как по ходу процесса и в результате выполнения аналитической методики меняется соотношение концентраций компонентов. Такой эффект мало сказывается на выходной кривой сорбционной очистки при пониженной температуре из-за того, что во всем диапазоне концентраций тиоционата сохраняется чрезвычайно большой избыток хлорида. Однако сравнение кривых 1 и 3 на рис. 7 показывает, что погрешность при анализе проб десорбции тиоционата может быть заметной. Результат анализа может быть некорректным также при использовании известной методики определения тиоционатов [1] (кривая 2 на рис. 7). Очевидно, что проблема состоит в том, что используемые для градуировок (или сравнения) растворы должны содержать все компоненты в концентрациях, близких к концентрациям в каждой из анализируемых проб, однако решение этой задачи в каждом конкретном случае сделало бы методику весьма трудоемкой. Кривая 3 на рис. 7 получена после внесения корректировок в кривую 2 с использованием представленной выше математической модели. Для этого применили пропорциональное соотношение AAS = AGS$c_{{{\text{SCN}}}}^{*}$(AS)/c0, SCN(GS), где обозначения AS и GS относятся к анализируемым пробам и растворам сравнения, искомое значение суммарной концентрации тиоцианата в анализируемой пробе находили в виде функции c0, SCN(AS) = f$\left( {c_{{{\text{SCN}}}}^{*}} \right)$ = f(ε1cFeSCN + ε2cFeSCNCl), с использованием математической модели. Интересно, что расчет (корректировка) абсолютных концентраций тиоционата показал, что на обеих стадиях двухтемпературного процесса их правильные значения выше, чем концентрации, найденные по градуировочной кривой. Однако экспериментатора в большей степени интересуют относительные значения, связанные с температурным коэффициентом концентрирования, которые, как показывает рис. 7, в данном случае в результате корректировки на стадии сорбции не изменяются, а на стадии десорбции оказываются ниже определенных другими способами величин.
Список литературы
Лурье Ю.Ю. Анализ промышленных сточных вод. М.: Химия, 1984. 448 с.
Ivsic A.C., Tamhina B. Extraction and formation of iron(III) thiocyanate complexes: Application for spectrophotometric determination of iron // Croat. Chem. Acta. 2003. V. 76. № 4. P. 323.
Иванов В.М., Фигуровская В.Н., Чинь Тхи Тует Май, Ершова Н.И., Барбалат Ю.А. Цветометрические характеристики тиоцианата железа(III) // Вестн. Моск. ун-та. Сер. 2. Химия. 2004. Т. 45. № 5. С. 309.
Басова Е.М., Иванов В.М., Апендеева О.К. Спектрофотометрическое определение тиоцианат-ионов в пластовых водах // Вестн. Моск. ун-та. Сер. 2. Химия. 2014. Т. 55. № 1. С. 15.
Бабко А.К. Роданидные комплексы металлов // Успехи химии. 1956. Т. 25. № 7. С. 872.
Lister M.W., RivingtonD.E. Some ferric halide complexes and ternary complexes with thiocyanate ions // Canad. J. Chem. 1955. V. 33. № 10. P. 1603.
Khamizov R.Kh., Ivanov V.A., Madani A. Dual-temperature ion exchange: A review // React. Funct. Polym. 2010. V. 70. P. 521.
Крачак А.Н., Хамизов Р.Х., Кузьминова И.Г. Двухтемпературный безреагентный и комбинированный методы выделения тиоцианатов из растворов на высокоосновном анионите // Сорбционные и хроматографические процессы. 2016. Т. 16. № 1. С. 8.
Lister M.W., Rivington D.E. Some measurements on the iron(III)-thiocyanate system in aqueous solutions // Canad. J. Chem. 1955. V. 33. № 10. P. 1572.
Лурье Ю.Ю. Справочник химика. М.: Химия, 1989. 488 с.
Основы аналитической химии / Под ред. Золотова Ю.А. В 2-х тт. М.: Изд. центр “Академия”, 2012. Т. 2. 408 с.
Бабко А.К., Пилипенко А.Т. Колориметрический анализ. М.-Л.: ГНТИ химической литературы, 1951. С. 169.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


