Журнал аналитической химии, 2020, T. 75, № 2, стр. 171-184
Комплексное исследование покрытия волос древнеегипетских мумий
Е. Б. Яцишина a, В. М. Пожидаев a, *, Я. Э. Сергеева a, С. Н. Малахов a, И. С. Слушная a
a Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
* E-mail: pojidaev2006@yandex.ru
Поступила в редакцию 26.07.2018
После доработки 11.09.2018
Принята к публикации 29.03.2019
Аннотация
Определен состав нанесенного покрытия волос трех древнеегипетских мумий, датируемых I тысячелетием до н. э., из коллекции Государственного музея изобразительных искусств им. А.С. Пушкина с использованием комплекса аналитических методов: оптической микроскопии, ИК-спектроскопии, газовой хроматографии и масс-спектрометрии. Показано, что для покрытия волос при мумификации в древнем Египте использовали специальные бальзамирующие составы, отличные от составов для бальзамирования тел мумий. В рецептуру бальзамирующих составов для покрытия волос трех исследованных мумий входили говяжий жир, касторовое масло, пчелиный воск и сосновая смола, полученная в процессе сухой перегонки древесины. В бальзамический состав покрытия волос двух из трех исследованных мумий также добавляли ароматическое масло фисташкового дерева.
Обряд мумификации покойного был неотъемлемой составляющей культуры Древнего Египта. На сегодня наиболее древние из найденных захоронений с искусственно мумифицированными телами относятся к периоду культуры Накада-II (около 3600 г. до н. э.) [1]. Высушенное тело покойного бальзамировали, обмазывая смолами, маслами и жирами, а затем оборачивали в нарезанные лоскуты ткани – чаще всего льняные, реже хлопковые или шелковые. Между слоями и, особенно, по поверхности ткани покрывали специальным бальзамирующим составом.
Согласно литературным данным, для бальзамирующих составов при мумификации в разные периоды Древнего Египта использовали большое число веществ органической природы: пчелиный и растительный воск, природный битум, деготь, смолы хвойных пород деревьев, животные жиры, растительные масла, а также ароматические смолы некоторых растений. Применение различных способов мумификации было обусловлено как изменяющимися традициями в культах, посвященных древнеегипетским богам, течениями в одном культе в разные эпохи, так и различным социальным статусом умерших [1–3].
По древнеегипетским источникам практически невозможно реконструировать этапы процесса мумификации. Каких-либо строгих рекомендаций по осуществлению этого процесса и составам используемых веществ до нас не дошло. Для каждой конкретной мумии характерен индивидуальный состав веществ, использованный при бальзамировании. В современной зарубежной литературе можно встретить много примеров исследования составов, применявшихся в процессах мумификации, с помощью инструментальных физико-химических методов анализа. При этом как качественный состав, так и количественное соотношение индивидуальных компонентов мумифицирующего состава существенно различаются [4–10].
Дополнительную сложность при проведении подобных исследований представляет тот факт, что мумии пролежали в захоронениях не одно тысячелетие, и многие органические вещества, входящие в бальзамирующие рецептуры, подверглись значительной деградации. Это относится главным образом к различным ненасыщенным соединениям, присутствующим в растительных маслах, в жирах, восках, смолах хвойных деревьев, ароматическим и благовонным маслам. Многие из этих соединений распадаются, образуя ряд продуктов. Таким образом, если число органических соединений, входящих в исходные бальзамы для мумификации может достигать нескольких десятков, то с учетом деградации во время длительного захоронения их число иногда превышает сотню. Все эти компоненты при помощи хроматографических методов можно разделить и идентифицировать с использованием масс-спектрометрического детектора [11, 12]. Далее можно реконструировать исходный состав и сделать окончательный вывод об использованном бальзамирующем составе.
При исследовании внешнего вида различных мумий в большинстве случаев обращает на себя внимание тот факт, что на поверхность тканевых бинтов бальзамирующие смолы нанесены достаточно толстым слоем, часто неравномерным, достигающим местами толщины 1−2 мм. При хранении и транспортировке часто происходит осыпание кусочков смолы на отдельных фрагментах бинтов, что позволяет отбирать образцы для исследований, не прибегая к разрушающему воздействию на смоляное покрытие. Волосы же этих мумий выглядят тщательно уложенными, локон к локону. Этот позволяет предположить, что обработка волос при мумификации представляет собой отдельную процедуру, с использованием особых бальзамирующих составов, отличных от тех, которые применяли для обработки тел. В Древнем Египте уход за волосами был довольно сложным. Для закрепления прически использовали пчелиный воск, миндальное, оливковое, кунжутное, льняное или касторовое масла. Наряду с растительными маслами в древнем Египте широко использовали и животные жиры.
Цель настоящего исследования – определение состава покрытия волос древнеегипетских мумий, датируемых I тысячелетием до н. э., из коллекции Государственного музея изобразительных искусств (ГМИИ) им. А.С. Пушкина с применением комплекса аналитических методов: оптической микроскопии, ИК-спектроскопии, газовой хроматографии и масс-спектрометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Отбор проб. При проведении компьютерной томографии в Курчатовском комплексе НБИКС-природоподобных технологий ряда мумифицированных фрагментов из древнеегипетской коллекции ГМИИ им. А.С. Пушкина отобрали образцы волос трех мумий. Описание исследуемых экспонатов представлено в табл. 1.
Таблица 1.
Описание голов древнеегипетских мумий для исследования составов покрытия волос (возраст экспонатов – I тыс. до н. э.)
| Шифр образца | Шифр экспоната по классификации ГМИИ им. А.С. Пушкина | Описание экспоната |
|---|---|---|
| ВМ-4 | КП-876 I-1а № 1297 |
Голова мужской мумии. Обхват 52 см, высота 25 см |
| ВМ-8 | КП-4076 I-1а № 6506 |
Голова женской мумии. Обхват 53.5 см, высота 25 см |
| ВМ-11 | ИГ-3922 I-1а № 5934 |
Голова женской мумии. Обхват 52 см, высота 24 см |
Реагенты. Использовали растворители: метанол, хлороформ, н-гексан, диэтиловый эфир х. ч., ацетилхлорид ч.
Аппаратура и вспомогательное оборудование. Хроматографическая система 1. Газовый хроматограф НР 6890 с масс-спектрометрическим детектором MSD 5975 фирмы “Agilent Technologies” (ГХ–МС). Условия хроматографирования: капиллярная колонка DB-5ms длинной 30 м, внутренним диаметром 0.25 мм и толщиной пленки неподвижной фазы 0.25 мкм. Температурная программа: начальная температура термостата колонки 100°С; повышение температуры от 100 до 280°С со скоростью 15 град/мин, выдержка при конечной температуре 10 мин. Газ-носитель гелий, расход 1 мл/мин, деление потока 1 : 10. Температура дозатора 280°С, интерфейса детектора 280°С. Объем пробы 1 мкл. Детектирование проводили в режиме сканирования по полному ионному току.
Хроматографическая система 2. Газовый хроматограф фирмы “Bruker” модели 430 GС с пламенно-ионизационным детектором (ГХ-ПИД). Условия хроматографирования: капиллярная колонка SelectTM Biodisel for FAME длиной 30 м, внутренним диаметром 0.32 мм и толщиной пленки неподвижной фазы 0.25 мкм. Температурная программа колонки: начальная температура 140°C, выдержка 4 мин, повышение температуры до 260°C со скоростью 4 град/мин и выдержка в изотермическом режиме в течение 10 мин при 260°C. Температура дозатора 260°C, детектора 260°C. Расход потока газа-носителя (азота) 2 мл/мин, деление потока 1 : 20. Объем пробы 2 мкл. Метиловые эфиры жирных кислот (МЭЖК) идентифицировали с использованием стандартной смеси МЭЖК (Supelco 37 Component FAMEMix) и сравнением параметров удерживания соединений с данными [11, 12].
ИК-спектроскопия. ИК-спектры записывали на ИК-спектрометре с Фурье-преобразованием Nicolet iS5 (Thermo Fisher Scientific, США) с использованием приставки нарушенного полного внутреннего отражения iD5 ATR (кристалл алмаз). Спектральный диапазон 4000−550 см–1, спектральное разрешение 4 см–1, число сканов – 32.
Пробоподготовка. Исследуемые образцы волос мумий обрабатывали в соответствии со схемой, приведенной на рис. 1. Для этого к навеске исследуемого образца (∼100 мг) добавляли 4 мл смеси растворителей хлороформ–метанол (2 : 1, по объему) и экстрагировали в ультразвуковой (УЗ) ванне (20 мин, 60°С). При необходимости полученную взвесь центрифугировали в течение 15 мин при 4000 об./мин, надосадочную жидкость аккуратно переносили в испарительную чашку и удаляли растворитель при комнатной температуре до сухого остатка. К сухому остатку добавляли по 1 мл н-гексана и 5%-ного раствора KOH в смеси этанол–вода (9 : 1, по объему) и обрабатывали в УЗ-ванне при комнатной температуре в течение 30 мин. Реакционную смесь выдерживали до четкого разделения слоев. После этого отделяли гексановый верхний слой, фильтровали через слой безводного сульфата натрия и упаривали до сухого остатка. Сухой остаток растворяли в 50 мкл н-гексана, получая нейтральную фракцию экстракта покрытия волос.
К водному раствору добавляли около 0.5 мл 5%-ного водного раствора борной кислоты до рН 5 и 2 мл диэтилового эфира. Реакционную смесь обрабатывали в УЗ-ванне при комнатной температуре в течение 30 мин, а затем выдерживали до четкого разделения слоев. Отделяли эфирный верхний слой, фильтровали через слой безводного сульфата натрия и упаривали до сухого остатка. Сухой остаток растворяли в 200 мкл хлороформа, получая кислую фракцию экстракта покрытия волос.
Метиловые эфиры жирных кислот (МЭЖК). Для подтверждения наличия жирных кислот в экстракте получали МЭЖК. Для этого 100 мкл кислой фракции в хлороформе обрабатывали метанолом в присутствии ацетилхлорида по методике, описанной нами ранее [13].
Получение триметилсилильных (ТМС) производных. Для получения ТМС-производных 100 мкл кислой фракции в хлороформе обрабатывали 70 мкл N,О-бис(триметилсилил)трифторацетамида, содержащего 1% триметилхлорсилана (70°С, 30 мин). Реакционную смесь упаривали до сухого остатка. Триметилсилильные производные растворяли в 50 мкл н-гексана.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
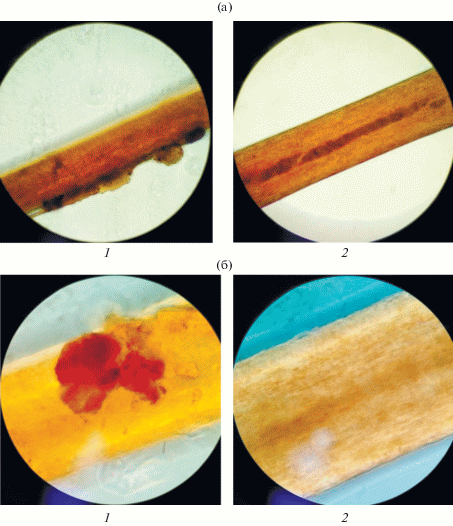
При внешнем осмотре мумий из древнеегипетской коллекции ГМИИ имени А.С. Пушкина обнаружили, что их волосы выглядят хорошо уложенными даже после более чем тысячелетнего захоронения. На рис. 2 представлена фотография локона волос с головы одной из мумий. На первом этапе исследования использовали метод оптической микроскопии. Микроскопическому изучению подвергали волосы мумий без обработки и после смыва возможного покрытия смесью растворителей. Фотографии образцов волос до и после обработки представлены на рис. 3. Из приведенных фотографий видно, что образцы волос мумий имеют характерные жироподобные покрытия.
Рис. 3.
Данные оптической микроскопии образца волоса мумии ВМ-11 до (1) и после (2) смыва покрытия при увеличении ×400 (а) и ×1000 (б).
Для анализа органической составляющей покрытия волос получали ИК-спектры волос до и после обработки растворителями. ИК-спектроскопию с Фурье-преобразованием достаточно широко используют в исследованиях археологических материалов [4, 14–17], благодаря отсутствию необходимости подготовки пробы. ИК-спектры образца волос одной их мумий до и после обработки растворителями приведены на рис. 4. Как видно, отличия от спектра образца волоса современного человека, позволяющие идентифицировать покрытие, отсутствуют. В спектрах имеются широкие интенсивные полосы поглощения 3200–3400 см–1 (наложение полос валентных ОН- и NH-групп), узкие интенсивные полосы 1640–1646 см–1 (валентные колебания карбонильной С=О группы, так называемая полоса “амид I”), полосы средней интенсивности 1522–1532 см–1 (деформационные колебания N-H и валентные C‒N, полоса “амид II”), а также полосы 2850–2870 и 2920–2940 см–1 (валентные колебания метиленовых и метильных групп соответственно) и полосы поглощения в области 1470–1320 см–1 (деформационные колебания метиленовых и метильных групп соответственно) [18, 19]. Эти полосы являются характеристичными для фибриллярных белков (кератинов) волос.
Рис. 4.
ИК-спектры волоса одной из исследуемых мумий до (а) и после (б) обработки растворителями и современного волоса (в).

Для более подробного изучения состава органических соединений методом ИК-спектроскопии жироподобное покрытие исследуемых волос мумий экстрагировали смесью растворителей. Полученные экстракты имели окраску разной интенсивности от желто-коричневого до темно-коричневого цветов. ИК-спектры экстрактов записывали после нанесения по 10 мкл раствора покрытия волос непосредственно на кристалл ZnSe и испарения растворителя. Полноту удаления растворителя контролировали по отсутствию его характеристичных полос поглощения. ИК-спектр экстракта покрытия образца волос одной их мумий приведен на рис. 5. Здесь же приведен ИК-спектр экстракта смоляного покрытия тела этой же мумии, полученный в аналогичных условиях.
Рис. 5.
ИК-спектры экстракта покрытия волос (а) и раствора смоляного покрытия с поверхности тела (б) одной из исследуемых мумий.
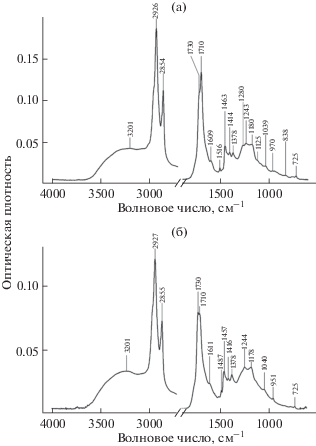
В ИК-спектрах исследуемых образцов присутствуют: широкая полоса поглощения 3100–3400 см–1 (валентные колебания ОН-группы димеров карбоновых кислот), полосы около 2927 и 2855 см–1 (валентные колебания метиленовых и метильных групп), а также полосы поглощения в области 1609–1611 см–1 (деформационные колебания СН-группы ароматического цикла) и 1470–1320 см–1 (деформационные колебания метиленовых и метильных групп) и полоса около 725 см–1 (характеристичные скелетные колебания длинных линейных алифатических углеродных цепей) [18, 19]. Все перечисленные полосы поглощения присутствуют в спектрах экстрактов и волос, и растворов смол, отобранных с тел этих мумий. С точки зрения определения различия бальзамических составов, использованных для обработки волос и тела мумии интересна интенсивная дублетная полоса 1710–1730 см–1 (валентные колебания карбонильной группы сложных эфиров карбоновых кислот) [18, 19]. Эта полоса присутствует в спектрах обоих образцов, однако соотношение интенсивностей дублета разное. Так, в спектре экстракта покрытия волоса более интенсивна полоса около 1710 см–1, в то время как у смоляного покрытия тела мумии более интенсивна полоса около 1730 см–1. Наличие полос поглощения ароматических структур и сложных эфиров в ИК-спектрах обоих образцов характерно для продуктов сухой перегонки сосновой древесины [4, 20, 21]. Присутствие полосы поглощения длинных линейных алифатических углеродных цепей предполагает наличие жирных кислот ацилглицеридов растительных масел и/или животных жиров [4, 16].
В целях более достоверной идентификации полученные экстракты покрытия волос мумий анализировали методом ГХ–МС. Нейтральную фракцию анализировали на капиллярной колонке НР-5. Хроматограмма нейтральной фракции покрытия волос одной из мумий приведена на рис. 6. Соединения идентифицировали по масс-спектрам и индексам удерживания банка данных NIST 14 2014/EPA/NIH [22]. Индексы удерживания пиков рассчитывали экспериментально [23] с использованием насыщенных парафиновых углеводородов нормального строения С10–С44. Результаты идентификации основных соединений в составе нейтральной фракции покрытия волос представлены в табл. 2. Анализ хроматограмм нейтральных фракций показал отсутствие профиля н-алканов, характерного для натурального битума. В нейтральных фракциях экстрактов покрытия волос обнаружены н-алканы с нечетным числом атомов углерода – С27, С29, С31 и С33, а также жирные спирты нормального строения с числом углеродных атомов С20–С26, которые характерны для пчелиного воска [24–28]. В составах бальзамирующих смол тел этих же мумий обнаружены парафиновые углеводороды натурального битума, что подтверждает гипотезу об индивидуальной процедуре обработки волос при мумифицировании тел. Среди соединений нейтральной фракции экстрактов покрытия волос мумий обнаружены холестерин – стероидный биомаркер животных жиров, а также β-ситостерол – наиболее характерный биомаркер растительных масел [11, 12].
Рис. 6.
Хроматограмма нейтральной фракции экстракта покрытия волос одной из исследуемых мумий на капиллярной колонке НР-5. Отнесение пиков приведено в табл. 2.

Таблица 2.
Соединения, идентифицированные в нейтральной фракции экстрактов покрытия волос мумий
| № пика* | Соединение | Индекс удерживания | Содержание в образцах покрытия волос, % | |||
|---|---|---|---|---|---|---|
| эксперимен-тальный | справочный [22] |
ВМ-4 | ВМ-8 | ВМ-11 | ||
| 1 | α-Пинен | 943 | 940 | –** | 0.3 | 1.1 |
| 2 | п-Этилгваякол (4-этил-2-метоксифенол) | 1285 | 1287 | – | 0.7 | 1.0 |
| 3 | β-Элемен (2,4-Диизопропенил-1- метил-винилциклогексан) | 1393 | 1394 | – | 0.6 | 4.4 |
| 4 | 2-Метилфенантрен | 1953 | 1945 | 1.7 | 4.4 | 0.9 |
| 5 | 19-Норабиета-8,11,13-триен | 1965 | 1969 | 1.1 | 2.1 | 2.0 |
| 6 | Дитерпен | 1980 | 1.5 | 15.2 | 9.3 | |
| 7 | 18-Норабиета-8,11,13-триен | 1965 | 1969 | 29.0 | 36.3 | 17.0 |
| 8 | 1,7-Диметил-фенантрен | 2060 | 2067 | 0.9 | 0.2 | 1.3 |
| 9 | 10,18-Биснорабиета-5,7,9,(10),11,13- пентаен | 2080 | 2082 | 0.2 | 1.1 | 2.8 |
| 10 | Ретен (1-метил, 7-изопропилфенатрен) | 2175 | 2178 | 16.7 | 3.8 | 2.1 |
| 11 | Абиетатриенон | 2187 | 2180 | 10.2 | 5.3 | 5.0 |
| 12 | Эйкозанол-1 (С20ОН) | 2285 | 2280 | 2.5 | 0.1 | 1.1 |
| 13 | н-Трикозан (С23) | 2300 | 2300 | 0.9 | 0.8 | 1.2 |
| 14 | Метиловый эфир дегидроабиетиновой кислоты | 2374 | 2377 | 4.6 | 1.7 | 1.6 |
| 15 | н-Пентакозан (С25) | 2500 | 2500 | 1.6 | 2.6 | 3.8 |
| 16 | Докозанол-1 (С22ОН) | 2453 | 2460 | 2.0 | 2.4 | 3.8 |
| 17 | н-Гептакозан (С27) | 2700 | 2700 | 3.8 | 2.4 | 2.2 |
| 18 | Тетракозанол-1 (С24ОН) | 2690 | 2680 | 1.4 | 1.8 | 2.4 |
| 19 | Пентакозанол-1 (С25ОН) | 2722 | 2730 | 6.5 | 3.7 | 1.3 |
| 20 | н-Нонакозан (С29) | 2900 | 2900 | 2.9 | 1.3 | 1.4 |
| 21 | Гексакозанол-1 (С26ОН) | 2890 | 2880 | 0.5 | 0.9 | |
| 22 | Холестерин | 3078 | 3075 | 2.3 | 1.0 | 1.1 |
| 23 | н-Гептатриаконтан (С31) | 3100 | 3100 | 0.5 | 0.3 | 0.3 |
| 24 | β-Ситостерол | 3197 | 3197 | 0.8 | 0.8 | 1.2 |
Состав экстракта кислой фракции покрытия волос мумий определяли методом ГХ на кварцевой капиллярной колонке SelectTM Biodisel for FAME CP 9080 после предварительной этерификации метиловым спиртом для получения МЭЖК. Хроматограмма МЭЖК кислой фракции покрытия волос одной из мумий приведена на рис. 7. Результаты идентификации соединений кислой фракции покрытия волос исследуемых мумий приведены в табл. 3. Можно отметить наличие метиловых эфиров монокарбоновых насыщенных жирных кислот (ЖК) нормального строения с четным и нечетным числом углеродных атомов в цепи – лауриновой (С12:0), миристиновой (С14:0), пентадекановой (С15:0), пальмитиновой (С16:0), маргариновой (С17:0), стеариновой (С18:0), а также ненасыщенных кислот – олеиновой (С18:1) и линолевой (С18:2). Также идентифицировали метиловый эфир 12-гидрокси-9-цис-октадеценовой (рицинолевой) кислоты. Обнаружение монокарбоновых насыщенных и ненасыщенных кислот свидетельствует об использовании растительных масел и/или животных жиров в составе бальзамирующей жидкости для покрытия волос.
Рис. 7.
Хроматограмма кислой фракции экстракта покрытия волос мумии на колонке SelectTM Biodisel for FAME CP 9080. Отнесение пиков приведено в табл. 3.
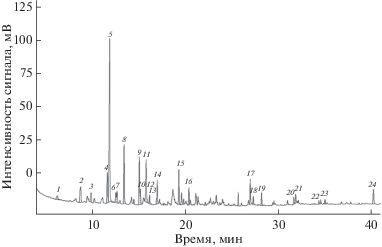
Таблица 3.
Идентифицированные соединения в кислой фракции экстрактов покрытия волос мумий
| № пика* | Соединение | Содержание, % | ||
|---|---|---|---|---|
| ВМ-4 | ВМ-8 | ВМ-11 | ||
| 1 | МЭ 12 : 0 | 0.6 | 0.9 | 0.8 |
| 2 | МЭ 14 : 0 | 1.7 | 3.9 | 2.5 |
| 3 | МЭ 15 : 0 | 0.9 | 2.0 | 2.2 |
| 4 | МЭ i-16 : 0 | 1.1 | 5.4 | 3.3 |
| 5 | МЭ 16 : 0 | 34.8 | 32.0 | 33.2 |
| 6 | МЭ 16 : 1 | 0.9 | 1.7 | 1.3 |
| 7 | МЭ i-17 : 0 | 1.3 | 2.1 | 1.9 |
| 8 | МЭ 17 : 0 | 2.6 | 8.6 | 6.5 |
| 9 | МЭ18 : 0 | 11.6 | 7.7 | 12.8 |
| 10 | МЭ t-18 : 1(9) | 1.0 | 2.2 | 1.5 |
| 11 | МЭ c-18 : 1(9) | 13.0 | 7.1 | 5.1 |
| 12 | МЭ t-18 : 1(7) | 0.3 | 0.5 | 0.2 |
| 13 | МЭ c-18 : 1(7) | 1.4 | 1.1 | 0.6 |
| 14 | МЭ 18 : 2 | 1.8 | 3.1 | 2.7 |
| 15 | МЭ 9-ОН 18 : 0 | 2.8 | 4.8 | 3.9 |
| 16 | МЭ 11-ОН 18 : 0 | 1.5 | 2.3 | 1.6 |
| 17 | МЭ рицинолевой кислоты | 13.3 | 3.2 | 2.5 |
| 18 | МЭ ДГАК | 3.1 | 1.1 | 1.6 |
| 19 | МЭ абиетиновой кислоты | 2.7 | 1.7 | 9.5 |
| 20 | МЭ 9,10-ОН 18 : 0 Эритро | 0.7 | 1.1 | 1.4 |
| 21 | МЭ 9,10-ОН 18 : 0 Трео | 0.4 | 1.4 | 2.5 |
| 22 | МЭ 7-оксо-ДГАК | 3.8 | 1.1 | 1.1 |
| 23 | МЭ 7-оксоабиетиновой кислоты | 0.3 | 0.5 | 0.4 |
| 24 | МЭ мороновой кислоты | 2.9 | 2.7 | 5.5 |
| – | Отношение содержания стеариновой и олеиновой кислот | 0.9 | 1.1 | 2.5 |
| – | Отношение содержания пальмитиновой и стеариновой кислот | 3.0 | 4.2 | 2.6 |
* Номера пиков соответствуют приведенным на рис. 7.
Обозначения: МЭ – метиловый эфир, i – изо, t – транс, c − цис.
Для идентификации растительных и животных жиров используют количественные соотношения содержания различных ЖК в жирнокислотном профиле [29–51]. Литературные данные по содержанию различных ЖК в жирно-кислотном профиле современных растений и животных приведены в табл. 4. Видно, что в профиле ЖК животных жиров преобладают насыщенные кислоты, а для растительных масел характерно преобладание ненасыщенных жирных кислот. Отношение содержания пальмитиновой и стеариновой кислот для животных жиров находится в диапазоне 1–2 (в молочном жире 2.1–2.5), в рас-тительных маслах это соотношение достигает 2–5. В растительных маслах практически отсутствуют лауриновая (С12:0) и миристиновая кислоты (С14:0), а в животных жирах эти кислоты присутствуют. Так, количество миристиновой кислоты в свином жире достигает 2%, в говяжьем и бараньем – до 4%, в козьем – до 7%, в молочном жире – до 14% [29–35].
Таблица 4.
| Жир/масло | С12:0 | С14:0 | С14:1 | С16:0 | С16:1 | С18:0 | С18:1 | С18:2 | С18:3 | С20:0 | С/О2 | П/С3 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Животные жиры | ||||||||||||
| Говяжий (21)1 | 0.3–2.1 | 2.1–3.9 | 0.6–1.9 | 23–32 | 2.3–7.1 | 18–30 | 28–48 | 1.7–5.6 | 0.3–1.7 | – | 0.6–0.8 | 0.9–1.3 |
| Бараний (23) | 0.1–1.5 | 1.8–4.0 | 0.3–1.4 | 17–48 | 0.8–2.7 | 20–32 | 23–46 | 2.3–6.9 | 1.5–3.6 | – | 0.7–0.9 | 0.8–1.3 |
| Свиной (32) | 0.2–1.2 | 0.7–2.1 | 0.2–0.6 | 24–30 | 0.7–4.5 | 11–21 | 33–53 | 4.3–19.5 | 0.4–2.0 | – | 0.2–0.3 | 1.7–2.3 |
| Растительные масла | ||||||||||||
| Оливковое (36) | – | 0.01 | – | 7.5–20 | 0.6–3.5 | 1.5–5.0 | 55–95 | 3.5–13.5 | 0.3–1.5 | 0.2–0.8 | 0.02–0.03 | 5.3–7.3 |
| Льняное (5) | – | – | – | 4–11.3 | 0.1–0.5 | 2–8 | 10–32 | 8.3–27 | 30–67 | 0.4–1.0 | 0.2–0.4 | 4.2–6.3 |
| Касторовое (3) | – | – | – | 1.0–1.5 | – | 1.0–1.5 | 3.0–4.0 | 4.0–4.2 | 0.3–0.4 | – | 0.3–0.4 | 1.1–1.5 |
| Миндальное (3) | – | – | – | 5–6 | – | 1–2 | 65–70 | 20–22 | – | – | 0.02–0.04 | 3.6–6.1 |
| Фисташковое (3) | – | – | – | 10–12 | – | 0.8–1 | 60–65 | 18–20 | – | – | 0.02–0.03 | 6.8–9.8 |
| Кунжутное (3) | – | – | – | 6.5–9.5 | 0.1–0.2 | 4.5–5.5 | 36–40 | 32–47 | 0.3–0.4 | – | 0.13–0.16 | 2.5–3.5 |
Данные по составам ЖК масел и жиров получены разными авторами в разных условиях хроматографирования с использованием неполярных капиллярных колонок. На неполярных колонках некоторые МЭЖК разделяются неполностью или выходят одним пиком (например, МЭЖК С18:3, С18:2 и С18:1), что является причиной больших погрешностей определения и приводит к весьма значительному разбросу экспериментальных данных, что хорошо видно из данных табл. 5.
Таблица 5.
Экспериментальные данные по определению составов ЖК в современных животных жирах и растительных маслах (n − количество исследованных образцов масла или жира – указано в скобках, Р = 0.95)
| Жир/масло | С14:0 | С15:0 | С16:0 | С16:1 | С17:0 | С18:0 | С18:1(9) (цис-) | С18:1(7) | С18:2 | С18:3 | C/О1 | П/С2 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Животные жиры | ||||||||||||
| Говяжий3 (25) | 2.4 ± 0.8 | 0.7 ± 0.2 | 26 ± 3 | 1.9 ± 0.7 | 1.6 ± 0.6 | 25 ± 9 | 29 ± 9 | 3.4 ± 0.8 | 4 ± 1 | 1.0 ± 0.4 | 0.9 ± 0.2 | 1.1 ± 0.4 |
| Свиной (29) | 1.3 ± 0.4 | 0.10 ± 0.02 | 23 ± 3 | 2.0 ± 0.6 | 0.2 ± 0.1 | 11 ± 2 | 39 ± 8 | 3.0 ± 0.9 | 17 ± 6 | 0.8 ± 0.2 | 0.3 ± 0.1 | 2.1 ± 0.2 |
| Бараний (14) | 4 ± 1 | 0.9 ± 0.3 | 26 ± 4 | 1.0 ± 0.4 | 1.8 ± 0.4 | 20 ± 3 | 34 ± 8 | 3.3 ± 0.6 | 3 ± 1 | 1.4 ± 0.5 | 0.6 ± 0.1 | 1.2 ± 0.2 |
| Растительные масла | ||||||||||||
| Миндальное (8) | – | – | 8 ± 2 | 0.7 ± 0.2 | – | 1.1 ± 0.3 | 66 ± 12 | 1.6 ± 0.4 | 16.9 ± 4.5 | – | 0.02 ± 0.004 | 7.5 ± 2.0 |
| Кунжутное (6) | – | – | 10.2 ± 2.5 | 11.3 ± 2.4 | – | 5 ± 1 | 41 ± 6 | 1.1 ± 0.2 | 42 ± 6 | 0.4 ± 0.1 | 0.13 ± 0.03 | 2.2 ± 0.4 |
| Оливковое (11) | – | – | 14 ± 2 | 11.1 ± 0.4 | – | 2.7 ± 0.5 | 72.3 ± 14.5 | 1.1 ± 0.3 | 9 ± 1 | 0.6 ± 0.2 | 0.04 ± 0.01 | 5.2 ± 0.1 |
| Льняное (5) | – | – | 6 ± 1 | 0.2 ± 0.1 | – | 4.1 ± 0.7 | 18 ± 3 | 0.5 ± 0.2 | 15.1 ± 3.5 | 50.2 ± 7.9 | 0.23 ± 0.04 | 1.5 ± 0.3 |
| Касторовое4 (5) | – | – | 1.6 ± 0.4 | 0.03 ± 0.01 | – | 1.7 ± 0.3 | 3.8 ± 0.7 | 0.7 ± 0.2 | 6 ± 1 | 0.6 ± 0.2 | 0.45 ± 0.06 | 1.0 ± 0.3 |
Для более достоверной идентификации природы масла или жира в составе покрытия волос мы определили составы ЖК некоторых современных растительных масел и животных жиров на специально предназначенной для селективного разделения МЭЖК полярной колонке SelectTM Biodisel for FAME CP 9080. Селективность и эффективность такой колонки позволяет достичь полного разделения не только позиционных изомеров ЖК, но и геометрических изомеров ненасыщенных кислот. Результаты определения приведены в табл. 5. В составе МЭЖК покрытий волос (табл. 3) идентифицированы лауриновая и миристиновая и кислоты с нечетным числом атомов углерода С15–С17. Такие кислоты характерны для профилей животных жиров и отсутствуют в растительных маслах [30, 31]. Кроме этого, обнаруживаются кислоты с разветвленной углеродной цепью (изо-C16:0, изо-С17:0), идентифицируемые исключительно в жирнокислотных профилях жвачных животных [31]. Отношения содержаний пальмитиновой и стеариновой кислот находится в пределах 2.6–4.2, что несколько превышает это отношение для животных жиров, но заметно меньше такового в растительных маслах.
В жирнокислотном профиле кислой фракции покрытия волос мумий обнаружена рицинолевая (12-гидрокси-9-цис-октадеценовая) кислота – основная кислота касторового масла. По литературным данным содержание этой кислоты в жирнокислотном профиле касторового масла может достигать 90%, что позволяет рассматривать ее в качестве биомаркера масла клещевины обыкновенной (Ricinus commúnis, Euphorbiaceae). Рицинолевая кислота ранее идентифицирована в образцах смол некоторых древнеегипетских мумий [52].
На основании полученных результатов можно констатировать наличие в составе покрытия волос мумий смеси животного жира, растительного масла и пчелиного воска. Из растительных масел достаточно очевидно использование касторового масла. Из других растительных масел, как отмечалось ранее, в древнем Египте могли применять оливковое, льняное, кунжутное и миндальное масла.
Анализируя составы ЖК-покрытия волос мумий, можно отметить наличие довольно больших количеств ненасыщенных кислот – олеиновой, линолевой и рицинолевой, а также следовые количества продуктов их окислительного распада – дикарбоновых (азелаиновой, пимелиновой), гидрокси- и дигидроксиоктадекановых кислот. Относительные скорости окислительной деградации ненасыщенных ЖК в зависимости от количества кратных связей для олеиновой, линолевой, линоленовой кислот оцениваются как 1 : 50 : 500 [32, 39, 50]. Обнаружение линолевой кислоты (около 3%) может свидетельствовать о том, что степень окислительной деградации олеиновой и рицинолевой ЖК невелика. Это, видимо, является следствием условий захоронения мумий, препятствующих окислительному распаду ненасыщенных кислот. Учитывая это обстоятельство, можно с большой долей достоверности использовать соотношения ЖК современных растительных масел для оценки их присутствия в составах бальзамирующих покрытий волос мумий.
Из табл. 3 видно, что соотношение стеариновой и олеиновой кислот в составе покрытия волос образцов ВМ-4 и ВМ-8 примерно одинаково (0.9–1.1), в образце ВМ-11 это отношение составляет 2.5. В современных растительных маслах это соотношение (см. табл. 4 и 5) составляет: оливковое – 0.03, кунжутное – 0.11, миндальное – 0.01, льняное – 0.07, фисташковое – 0.02, касторовое – 0.33. Таким образом, даже предполагая трехкратную деградацию олеиновой кислоты, по значениям отношений содержаний стеариновой и олеиновой кислот можно исключить из состава покрытия волос все рассмотренные масла, кроме касторового, наличие которого уже подтверждено.
В составе ЖК-покрытия волос (табл. 3) идентифицированы транс-изомеры элаидиновой С18:1(9) и вакценовой С18:1(7) кислот. По данным [35, 53] транс-изомеры этих кислот присутствуют в говяжьем (до 6%), конском (до 8%) и фазаньем (до 7%) жире. Цис−транс-изомеризация ненасыщенных ЖК может происходить при нагревании жиров [35, 50, 53]. Однако даже если для приготовления и нанесения бальзамирующего покрытия волос использовали нагревание исходной смеси веществ, то не до таких высоких температур, которые могли бы привести к цис−транс-изомеризации. Подтверждением этому может служить факт отсутствия рицинэлаидиновой (12-гидрокси-9-транс-октадеценовая) кислоты – транс-изомера рицинолевой кислоты. Таким образом, обнаруженные в составе кислой фракции экстрактов покрытия транс-изомеры ЖК могут служить косвенным доказательством того, что для приготовления бальзамирующих составов покрытия волос этих мумий, наиболее вероятно, использовали говяжий жир.
В составе идентифицированных соединений в кислой фракции экстрактов покрытия волос мумий (табл. 3) обнаружены смоляные кислоты абиетанового ряда: абиетиновая и дегидроабиетиновая, а также продуты их окисления – 7-оксоабиетиновая и 7-оксодегидроабиетиновая. В нейтральной фракции экстрактов покрытия (табл. 2) также обнаружены продукты окисления смоляных кислот этого ряда: метилфенантрен, ретен, норабиетатриены, биснорабиетапентаен, абиетатриенон и метиловый эфир дегидроабиетиновой кислоты (ДГАК). Абиетиновая кислота и ДГАК – наиболее известные смоляные кислоты, преобладающие в составе смолы деревьев семейства Pinaceae. Обнаружение сосновых смол в бальзамирующих составах мумий достаточно подробно описано [54–57]. Обнаружение этих смоляных кислот и продуктов их окисления в экстрактах покрытия волос мумий предполагает использование в бальзамирующих составах сосновой смолы. В экстрактах покрытия волос мумий обнаружены производные фенантрена: ретен (1-метил, 7-изопропилфенатрен), метилфенантрен, производные 10,18-бис-норабиета-5,7,9(10),11,13-пентаена, а также метиловый эфир ДГАК, что позволяет предположить наличие смолы, подвергнутой термической обработке. Особенно интересно присутствие в нейтральной фракции метилового эфира ДГАК, который может образовываться при взаимодействии этой смоляной кислоты с метанолом – продуктом сухой перегонки древесины [20, 21, 58].
Среди соединений нейтральной фракции экстрактов покрытия волос двух мумий обнаружены небольшие количества α-пинена, β-элемена и п‑этилгваякола (табл. 2), а также мороновой кислоты в кислой фракции (табл. 3), которые входят в состав ароматической смолы фисташкового дерева (Pistacia, сем. Anacardiaceae) [8–10, 59]. Предположительно, эту смолу использовали в бальзамирующем составе покрытия волос мумий ВМ-8 и ВМ-11 в качестве ароматического масла.
* * *
Таким образом, проведенное исследование показало, что при мумификации в Древнем Египте использовали специальные бальзамирующие составы для покрытия волос, отличные от составов для бальзамирования тел. В состав бальзамирующих составов для покрытия волос трех исследованных мумий входили говяжий жир, касторовое масло, пчелиный воск и сосновая смола, полученная в процессе сухой перегонки древесины. В бальзамический состав покрытия волос двух из трех исследованных мумий добавляли ароматическое масло фисташкового дерева. Несмотря на практически аналогичные составы, использованные для бальзамического покрытия волос этих мумий, можно отметить, что количественные соотношения ингредиентов различаются. Подобная ситуация описана в литературе, когда при исследовании бальзамирующих составов 16 древних Египетских мумий были идентифицированы: сосновые смолы (0.3–11%), экстракты ароматических растений (2.4–54%), природный нефтяной битум (0.2–19%), растительное масло и/или животный жир (34–95%), воски (0.2–7%) [6]. Это может свидетельствовать об оригинальном рецепте, использованном мастером мумификации. С другой стороны, это может быть причиной отсутствия достаточно точных мер веса или объема, поэтому в каждом конкретном случае мастер использовал свои измерительные инструменты и доступные ему материалы.
Работа выполнена при поддержке грантов РФФИ офи-м 17-29-04100 и 17-29-04144.
Список литературы
Pettigrew T.J. A History of Egyptian Mummies. London: Longman, Rees, Orme, Brown, Green and Longman, 1834. 264 p.
Лукас А. Материалы и ремесленные производства древнего Египта. М.: Иностранная литература, 1958. 848 с.
Bahn P.G. The making of a mummy // Nature. 1992. V. 356. P. 109.
Menager M., Azémard C., Vieillescazes C. Study of Egyptian mummification balms by FT-IR spectroscopy and GC–MS // Microchem. J. 2014. V. 114. P. 32.
Buckley S.A., Evershed R.P. Organic chemistry of embalming agents in Pharaonic and Graeco-Roman mummies // Nature. 2001. V. 413. P. 837.
Jones J., Higham T.F.G., Oldfield R., O’Connor T.P., Buckley S.A. Evidence for prehistoric origins of Egyptian mummification in late neolithic burials // PLOS ONE. 2014. V. 9. № 8. Article e103608.
Regert M., Colinart S., Degrand L., Decavallas O. Chemical alteration and use of Beeswax through time: Accelerated ageing tests and analysis of archaeological samples from various environmental contexts // Archaeometry. 2001. V. 43. № 4. P. 549.
Brettell R., Martin W., Atherton-Woolham S., Stern B., McKnight L. Organic residue analysis of Egyptian votive mummies and their research potential // Stud. Conserv. 2017. V. 62. P. 68.
Kavkler K., Frelih M. Analysis of a Ptolemaic mummy foot from Slovene ethnographic museum // Procedia Chemistry. 2013. V. 8. P. 159.
Clark K.A., Ikram S., Evershed R.P. The significance of petroleum bitumen in ancient Egyptian mummies // Phil. Trans. R. Soc. A. 2015. V. 374. № 2079. Article № 20160229.
Łucejko J.J., Connan J., Orsini S., Ribechini E., Modugno F. Chemical analyses of Egyptian mummification balms and organic residues from storage jars dated from the Old Kingdom to the Copto-Byzantine period // J. Archaeol. Sci. 2017. V. 85. P. 1.
Łucejko J.J., Lluveras-Tenorio A., Modugno F., Ribechini E., Colombini M.P. An analytical approach based on X-ray diffraction, Fourier transform infrared spectroscopy and gas chromatography/mass spectrometry to characterize Egyptian embalming materials // Microchem. J. 2012. V. 103. P. 110.
Пожидаев В.М., Сергеева Я.Э., Камаев А.В. Хромато-масс-спектрометрическое исследование археологического артефакта // Журн. аналит. химии. 2017. Т. 72. № 6. С. 589.
Font J., Salvado N., Buti S., Enrich J. Fourier transform infrared spectroscopy as a suitable techniques in the study of the materials used in waterproofing of archaeological amphorae // Anal. Chim. Acta. 2007. V. 598. P. 119.
Romanus K., Baeten J., Poblome J., Accardo S., Degryse P., Jacobs P., De Vos D., Waelkens M. Wine and olive permeation in pitched and non-pitched ceramics: Relation with results from archaeological amphorae from Sagalassos Turkey // J. Archaeol. Sci. 2009. V. 36. P. 900.
Daher C., Paris C., Le Hô A.S., Bellot-Gurlet L., Échard J.P. A joint use of Raman and Infrared spectroscopies for the identification of natural organic media used in ancient varnishes // J. Raman Spectrosc. 2010. V. 41. P. 1204.
Monnier G., Frahm E., Luo B., Missal K. Developing FTIR microspectroscopy for analysis of plant residues on stone tools // J. Archaeol. Sci. 2017. V. 78. P. 158.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965. 216 с.
Colombini M.P., Modugno F., Ribechini E. Direct exposure electron ionization mass spectrometry and gas chromatography/mass spectrometry techniques to study organic coatings on archaeological amphorae // J. Mass Spectrom. 2005. V. 40. P. 675.
Izzo F.C., Zendri E., Bernardi A., Balliana E., Sgobbi M. The study of pitch via gas chromatography-mass spectrometry and Fourier- transformed infrared spectroscopy: The case of the Roman amphoras from Monte Poro, Calabria (Italy) // J. Archaeol. Sci. 2013. V. 40. P. 595.
База данных NIST 14 2014/EPA/NIH.
Вигдергауз М.С. Расчеты в газовой хроматографии. М.: Химия, 1978. 248 с.
Heron C., Nemcek N., Bonfield K.M., Dixon J., Ottoway B.S. The chemistry of neolithic beeswax // Naturwissenschaften. 1994. V. 81. P. 266.
Maurer J., Mohring T., Rullkotter J. Plant lipids and fossil hydrocarbons in embalming material of roman period mummies from the Dakhleh oasis, Western desert, Egypt // J. Archaeol. Sci. 2002. V. 29. P. 751.
Regert M., Langlois J., Colinart S. Characterisation of wax works of art by gas chromatographic procedures // J. Chromatogr. A. 2005. V. 1091. P. 124.
Chemistry and Biochemistry of Natural Waxes / Ed. Kolattukudy P.E. Amsterdam: Elsevier Scientific Pub. Co., 1976. 459 p.
Tulloch A.P. Beeswax: structure of the esters and their component hydroxy acids and diols // Chem. Phys. Lipids. 1971. V. 6. P. 235.
Mills J., White R. Organic Chemistry of Museum Objects. 2nd Ed. New-York: Butterworth-Heinemann, 2000. 206 p.
Copley M.S., Bland H.A., Rose P., Horton M., Evershed R.P. Gas chromatographic, mass spectrometric and stable carbon isotopic investigations of organic residues of plant oils and animal fats employed as illuminants in archaeological lamps from Egypt // Analyst. 2005. V. 130. P. 860.
Evershed R.P., Dudd S.N., Copley M.S., Berstan R., Stott A.W.S., Mottram H., Buckley S.A., Crossman Z. Chemistry of archaeological animal fats // Acc. Chem. Res. 2002. V. 35. P. 660.
Eerkens J.W. GC-MS analysis and fatty acid ratios of archaeological potsherds from the Western Great Basin of North America. // Archaeometry. 2005. V. 47 (1). P. 83.
Malainey M.E., Przybylski R., Sherriff B.L. The fatty acid composition of native food plants and animals of western Canada // J. Archaeol. Sci. 1999. V. 26. P. 83.
Malainey M.E., Przybylski R., Sherriff B.L. The effects of thermal and oxidative degradation on the fatty acid composition of food plants and animals of western Canada: implications for the identification of archaeological vessel residues // J. Archaeol. Sci. 1999. V. 26. P. 95.
Malainey M.E., Przybylski R., Sherriff B.L. Identifying the former contents of late precontact period pottery vessels from western Canada using gas chromatography // J. Archaeol. Sci. 1999. V. 26. P. 425.
Тютюнников Б.Н. Химия жиров. М.: Колос, 1992. 448 с.
Щербаков В.Г. Технология получения растительных масел. М.: Колос, 1992. 206 с.
Яновая С.М. Химия жиров. М.: НОРМА, 2002. 636 с.
The lipid handbook / Eds. Gunstone F.D., Harwood J.L., Dijkstra A.J. 3rd Ed. Boca Raton: CRC Press Taylor & Francis Group, 2007. 791 p.
Glushenkova A. Lipids, Lipophilic Components and Essential Oils from Plant Sourses. London: Springer, 2012. 992 p.
Hamilton R.J., Bhati A. Fats and Oils: Chemistry and Technology. London: Applied Science Publishers Ltd, 1980. 255 p.
Fatty Acids and Glycerides. Handbook of Lipid Research. V. 1. / Ed. Kuksis A. New York: Plenum Press, 1978. 469 p.
Nicholson P.T., Shaw I. Ancient Egyptian Materials and Technology. Cambridge: Cambridge Univ. Press, 2000. 702 p.
Арутюнян Н.С., Аришева Е.А. Лабораторный практикум по химии жиров. М.: Пищевая промышленность, 1979. 176 с.
Богданов Л.М. Химический состав и свойства молочного жира // Пищевая и перерабатывающая промышленность. 1987. № 8. С. 48.
Канарейкина С.Г., Слинкин А.А. Исследование жирнокислотного состава продуктов с использованием сухого кобыльего молока // Аграрный вестник Урала. 2011. № 3 (82). С. 56.
Скурихин И.М., Тутельян В.А. Таблицы химического состава и калорийности российских продуктов питания. Справочник. М.: ДеЛи принт, 2007. 276 с.
Скурихин И.М., Нечаев А.П. Все о пище с точки зрения химика. М.: Высшая школа, 2001. 288 с.
Беззубов Л.П. Химия жиров. М.: Пищевая промышленность, 1975. 280 с.
О’Брайен Р. Жиры и масла. Производство, состав и свойства, применение. СПб: Профессия, 2007. 752 с.
Горяев М.И., Евдакова Н.А. Справочник по хроматографии органических кислот. Алма-Ата: Наука, 1977. 551 с.
Tchapla A., Méjanelle P., Bleton J., Goursaud S. Characterisation of embalming materials of a mummy of the Ptolemaic era. Comparison with balms from mummies of different eras // J. Sep. Sci. 2004. V. 27. P. 217.
Журавлев А.В. Трансжиры: что это такое и с чем их едят. М.: 2012, 138 с.
Abdel-Maksoud G., El-Amin A.R. A review on the materials used during the mummification processes in Ancient Egypt // Mediterr. Archaeol. Archaeometry. 2011. V. 11. P. 129.
Edwards H.G.M., Currie K.J., Ali H.R.H., Jorge Villar S.E., David A.R., Denton J. Raman spectroscopy of natron: Shedding light on ancient Egyptian mummification // Anal. Bioanal. Chem. 2007. V. 388. P. 683.
Colombini M.P., Modugno C., Silvano F., Onor M. Characterization of the balm of an Egyptian mummy from the seventh century B.C. // Stud. Conserv. 2000. V. 45. P. 19.
Buckley S.A., Clark K.A., Evershed R.P. Complex organic chemical balms of Pharaonic animal mummies // Nature. 2004. V. 431. P. 294.
Hjulstrom B., Isaksson S., Hennius A. Organic geochemical evidence for pine tar production in middle Eastern Sweden during the Roman Iron Age // J. Archaeol. Sci. 2006. V. 33. P. 283.
Serpico M., White R. Resins, amber and bitumen / Ancient Egyptian Materials and Technology / Eds. Nicholson P.T., Shaw I. Cambridge: Cambridge Univ. Press, 2000. P. 430.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




