Журнал аналитической химии, 2020, T. 75, № 2, стр. 162-170
Влияние способа иммобилизации рецепторного слоя на аналитические характеристики безметочного электрохимического иммуносенсора для определения антител к вирусу кори
Т. С. Свалова a, Н. Н. Малышева a, *, А. К. Бубекова a, А. А. Сайгушкина a, М. В. Медведева a, А. Н. Козицина a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург,
ул. Мира, 19, Россия
* E-mail: natalymalysheva@mail.ru
Поступила в редакцию 20.09.2018
После доработки 07.02.2019
Принята к публикации 08.08.2019
Аннотация
Проведена количественная оценка влияния способа иммобилизации рецепторного слоя на аналитические характеристики безметочных электрохимических иммуносенсоров для определения антител к вирусу кори. Иммобилизацию рецепторного слоя – антигена вируса кори выполняли путем капельного нанесения модельной суспензии на поверхность стеклоуглеродного электрода электрода с последующим высушиванием на воздухе и методом ковалентной сшивки посредством электрографтинга хлорида п-нитрофенилдиазония с применением в качестве сшивающего агента глутарового альдегида. Зависимости величины тока пика медиаторной системы от концентрации антител (АТ) к вирусу кори в модельных суспензиях линейны и описываются уравнениями: I = –(28 ± 1)сАТ − (30 ± 4) и I = −(19 ± 2)сАТ − (15 ± 5) в случае ковалентной иммобилизации и капельного нанесения рецепторного слоя соответственно. Иммобилизация биорецептора методом ковалентной сшивки не приводит к существенному улучшению чувствительности определения, однако позволяет расширить линейный диапазон концентраций в 10 раз и сократить общую продолжительность процедуры иммуноанализа до 20 мин по отношению к иммуносенсору с капельно-иммобилизованным антигеном.
Дифференциальная диагностика является первой и наиболее важной задачей при возникновении инфекционного заболевания. Среди огромного множества вирусных инфекций, одной из наиболее опасных является корь. Заболевание характеризуется чрезвычайно высоким уровнем восприимчивости (близким к 100%), развивается стремительно, поражает преимущественно слизистые оболочки верхних дыхательных путей и кожные покровы [1]. Актуально детектирование как самого возбудителя – вируса кори, так и антител к нему, концентрация которых в крови увеличивается в несколько раз через 2−3 дня после заражения [2]. Такой двойной контроль позволяет судить не только о правильности постановки диагноза, но и об эффективности проводимой терапии. Количественное определение “антител памяти” дает информацию о состоянии иммунитета пациента после перенесенного заболевания или профилактической прививки.
Лабораторные методы дифференциальной диагностики недостаточно экспрессны, дороги в обслуживании и недоступны широкому кругу населения. Развитие концепции “point-of-care” диагностики и биосенсоров позволяет существенно упростить задачу экспресс-обнаружения инфекционных агентов. Электрохимические иммуносенсоры характеризуются простотой, надежностью, портативностью, сравнительно невысокой стоимостью оборудования, возможностью достижения низких пределов обнаружения и небольшими операционными объемами проб. Опубликовано большое количество работ отечественных и зарубежных авторов, посвященных разработке электрохимических иммуносенсоров [3–10]. В электрохимическом иммуноанализе используют сигналообразующие метки – ферменты [11, 12], наноматериалы [13–15], электроактивные органические молекулы [16, 17], конъюгированные с одним из компонентов иммунореакции. Однако исследователей сегодня все больше привлекают “безметочные” процедуры иммуноанализа, более простые и экспрессные по сравнению с классическими “меточными” аналогами. Главный недостаток безметочных иммуносенсоров – невысокие чувствительность и точность определения, поскольку электрохимический отклик медиаторной системы зависит от целого ряда факторов: природы и геометрии поверхности рабочего электрода, структуры иммобилизованных слоев модификаторов, матрицы пробы и др.
Важную роль в обеспечении требуемых аналитических характеристик иммуносенсоров, в особенности безметочных, играет способ иммобилизации рецептора на поверхности рабочего электрода. Выделяют аффинные, физические и ковалентные методы иммобилизации биорецептора [18–20]. Методы физической иммобилизации наиболее просты и доступны, однако не позволяют достичь пространственно-ориентированного расположения биомолекул и прочного их удерживания на поверхности электрода в течение длительного времени. Наиболее эффективны ковалентные методы, основанные на химическом взаимодействии биорецептора с линкером, предварительно иммобилизованным на поверхности электрода [21, 22].
Открытый в 1992 г. Пинсоном и коллегами метод электроосаждения органических соединений – электрографтинг − является экспрессным и универсальным инструментом для адресной функционализации электродов [23, 24]. Опубликованы работы по электроосаждению аминов [25, 26], карбоксилатов [27, 28], спиртов [29], винилов [30, 31], галогенидов [32, 33] и др. По данным авторов работ [34–36] более половины всех публикаций по электрографтингу посвящено электроосаждению солей арилдиазония. Так, в работе [37] представлен вольтамперометрический иммуносенсор для определения β-лактоглобулина на основе углеродсодержащих печатных электродов, модифицированных графеном. In situ генерированную соль 4-нитрофенилдиазония электроосаждали на поверхности сенсора, после чего посредством глутарового альдегида иммобилизовали антитела. Электрохимический отклик от медиаторной системы гексацианоферратов калия регистрировали в дифференциально-импульсном режиме. Разработанный иммуносенсор имеет предел обнаружения 0.85 пг/мл и линейный диапазон концентраций аналита 1 пг/мл−100 нг/мл. Безметочный электрохимический аптасенсор для определения бактериальных агентов Salmonella typhimurium предложен в работе [38]. Авторы использовали толстопленочные углеродсодержащие электроды, модифицированные электроосажденной солью 4-карбоксифенилдиазония и аптамером. Аналитический сигнал регистрировали методом электрохимической импедансной спектроскопии в системе гексацианоферратов. Предел обнаружения сенсора составил 6 КОЕ/мл, линейный диапазон 10−108 КОЕ/мл. В работе [39] разработан электрохимический иммуносенсор для определения бактериофага MS2. Антитела иммобилизовали посредством ковалентной сшивки с солью гидразинфенилдиазония, предварительно электроосажденной на поверхности золотого электрода. Разработанный импедиметрический иммуносенсор имеет предел обнаружения 214 КОЕ/мл.
Электрографтинг позволяет создавать на поверхности электрода изолированные слои, содержащие функциональные группы, доступные для последующей конъюгации с биорецептором. Неоспоримыми преимуществами электрографтинга являются экспрессность, прочность, адресность иммобилизации биорецептора, отсутствие необходимости в нанесении дополнительных массивных олигомерных слоев модификаторов на поверхности сенсора. Однако электровосстановление солей диазония – достаточно сложный и трудоемкий процесс ввиду их крайней неустойчивости при хранении. Кроме того, межмолекулярные взаимодействия радикалов арилдиазония, образующихся в приэлектродном слое при электровосстановлении, неизбежно приводят к образованию массивных олигомерных структур на поверхности рабочего электрода [32, 40]. Это, вероятно, затрудняет процессы переноса заряда и массопереноса, что в конечном счете может привести к снижению чувствительности и точности детектирования.
Целью настоящей работы являлась количественная оценка влияния способа иммобилизации рецепторного слоя (капельное нанесение или ковалентная сшивка посредством электрографтинга соли диазония) на аналитические характеристики безметочных вольтамперометрических иммуносенсоров для определения антител к вирусу кори в модельных суспензиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и рабочие растворы. Особое внимание уделяли чистоте реактивов, растворов и посуды. В работе применяли реактивы квалификации ос. ч. и х. ч. Для приготовления растворов использовали деионизированную воду, полученную на комбинированной мембранной установке серии ДВС-М/1НА(18)-N (Медиана-Фильтр, Москва).
Использовали следующие реактивы и растворы: 4-нитроанилин (НеваРеактив, Санкт-Петербург); нитрит натрия (НеваРеактив, Санкт-Петербург); глутаровый альдегид (Новохим, Томск); хлористоводородную кислоту (НеваРеактив, Санкт-Петербург); бычий сывороточный альбумин (БСА) (Диаэм, Москва); антиген (АГ) вируса кори (NovO/96), концентрация 2.33 мг/мл (ГНЦ ВБ “Вектор”, Новосибирск); антитела к вирусу кори 1 мг/мл (ГНЦ ВБ “Вектор”, Новосибирск); сыворотку морской свинки к Salmonella typhimurium титр 1 : 5120 (ГНЦ ВБ “Вектор”, Новосибирск); фосфатный буферный раствор (pH 7.4 и 7.0).
Методики эксперимента. Синтез хлорида п-нитрофенилдиазония: 0.17 г 4-нитроанилина растворяли в 5 мл конц. HCl и при постоянном перемешивании, по каплям добавляли раствор нитрита натрия (0.087 г NaNO2, растворенного в 0.33 мл воды) при 0−5°С и, продолжая перемешивать, оставляли при 0−5°С на 15 мин.
Электрографтинг хлорида п-нитрофенилдиазония на поверхности стеклоуглеродного электрода. Стеклоуглеродный электрод выдерживали в растворе нитрофенилдиазониевой соли при потенциале −0.4 В в течение 10 с для получения 4-нитрофенильной пленки на рабочей поверхности электрода. Затем электрод тщательно промывали водой, переносили в 0.1 М раствор KCl и подвергали пятикратному циклическому вольтамперометрическому сканированию от 0.4 до −1.4 В (скорость сканирования 0.1 В/с) с целью восстановления нитрогрупп пленки до аминогрупп.
Капельное нанесение антигена вируса кори. 10 мкл суспензии антигена (сАГ = 2.33 × 10–2 мг/мл) наносили на рабочую зону стеклоуглеродного электрода с использованием микропипетки, после чего электрод высушивали на воздухе при комнатной температуре.
Ковалентную иммобилизацию антигена вируса кори с применением глутарового альдегида проводили по известной методике [37]. В качестве сшивающего агента применяли глутаровый альдегид. Аминофенильную пленку на поверхности электрода инкубировали с 2.5%-ным раствором глутарового альдегида в фосфатном буферном растворе (pH 7.0) в течение 1 ч. Далее электрод инкубировали в суспензии антигена (сАГ = 2.33 × 10–2 мг/мл) при комнатной температуре. Для удаления избытка реагентов после каждой стадии электрод промывали фосфатным буферным раствором с рН 7.4. Непрореагировавшие альдегидные и аминогруппы блокировали путем инкубации электрода в течение 45 мин в 0.25%-ном растворе БСА.
Формирование иммунокомплекса на поверхности стеклоуглеродного электрода. Модельные суспензии антител готовили методом последовательного разведения. Концентрации антител пересчитывали в международные единицы (МЕ) согласно паспорту исходного образца (выдан ГНЦ ВБ “Вектор”, Новосибирск) и каталогу референтных препаратов Всемирной организации здравоохранения. Формирование иммунокомплекса осуществляли путем погружения стеклоуглеродного электрода с иммобилизованным антигеном в модельные суспензии антител на 10−30 мин при комнатной температуре с последующим ополаскиванием деионизированной водой.
Электрохимические измерения проводили с использованием потенциостата/гальваностата μAutolab type III (Metrohm, Швейцария) со встроенным программным обеспечением Nova 1.11 в комплекте с трехэлектродной ячейкой. Рабочим электродом служил стеклоуглеродный дисковый электрод (СУЭ) (Metrohm, Швейцария), в качестве вспомогательного электрода и электрода сравнения использовали стеклоуглеродный стержень и хлоридсеребряный электрод соответственно. Линейные вольтамперограммы регистрировали в 5 мМ растворе K3[Fe(CN)6]/K4[Fe(CN)6] в нейтральной среде (фосфатный буферный раствор с рН 7.0).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
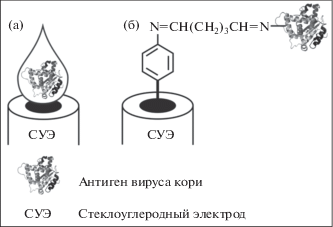
Рецепторный слой антигена вируса кори иммобилизовали двумя способами: путем капельного нанесения модельной суспензии на поверхность СУЭ с последующим высушиванием на воздухе и ковалентной иммобилизации с использованием электрографтинга хлорида п-нитрофенилдиазония и глутарового альдегида в качестве сшивающего агента (рис. 1).
Рис. 1.
Схема иммобилизации антигена вируса кори на поверхности стеклоуглеродного электрода методом капельного нанесения (а) и ковалентной сшивки с глутаровым альдегидом (б).
После иммобилизации биорецептора сенсоры инкубировали в модельной суспензии антител к вирусу кори и затем регистрировали аналитический сигнал – максимальный ток окисления медиаторной системы K3[Fe(CN)6]/K4[Fe(CN)6], величина которого закономерно снижалась с увеличением количества слоев модификаторов на поверхности рабочего электрода как в случае с капельно нанесенным, так и с ковалентно иммобилизованным антигеном вируса кори (рис. 2, 3).
Рис. 2.
Циклические вольтамперограммы, полученные на стеклоуглеродном электроде: немодифицированном (1), после электровосстановления хлорида п‑нитрофенилдиазония на поверхности (2), с ковалентно иммобилизованным антигеном к вирусу кори (3) и иммунокомплексом антиген−антитело (4); (5) – фоновый электролит (фосфатный буферный раствор с рН 7.0). Медиаторная система − 5 мМ раствор K3[Fe(CN)6]/K4[Fe(CN)6].

Рис. 3.
Циклические вольтамперограммы, полученные на стеклоуглеродном электроде: немодифицированном (1), с капельно нанесенным антигеном вируса кори (2), с иммунокомплексом антиген−антитело (3); (4) – фоновый электролит (фосфатный буферный раствор с рН 7.0). Медиаторная система − 5 мМ раствор K3[Fe(CN)6]/K4[Fe(CN)6].

Рабочие условия проведения анализа – концентрацию раствора хлорида п-нитрофенилдиазония, продолжительность электролиза, ковалентной сшивки антигена и формирования иммунокомплекса на поверхности рабочего электрода − выбирали, определяя содержание антител к вирусу кори в модельных однокомпонентных суспензиях в диапазоне концентраций 0.01−0.2 МЕ/мл (рис. 4).
Рис. 4.
(а) – Градуировочные зависимости, полученные на стеклоуглерлдном электроде (СУЭ) после электрографтинга из растворов с содержанием хлорида п-нитрофенилдиазония 0.25 (1), 0.5 (2), 1 мМ (3); (б) – зависимость величины аналитического сигнала медиаторной системы от времени электрографтинга хлорида п-нитрофенилдиазония на поверхности СУЭ (с = 0.25 мМ); (в) – зависимость величины аналитического сигнала медиаторной системы от времени инкубации СУЭ с электроосажденным слоем в суспензии антигена вируса кори; (г) – зависимость величины аналитического сигнала медиаторной системы от времени формирования иммунокомплекса антиген вируса кори–антитело на поверхности СУЭ с ковалентно иммобилизованным (1) и капельно нанесенным (2) рецепторным слоем.
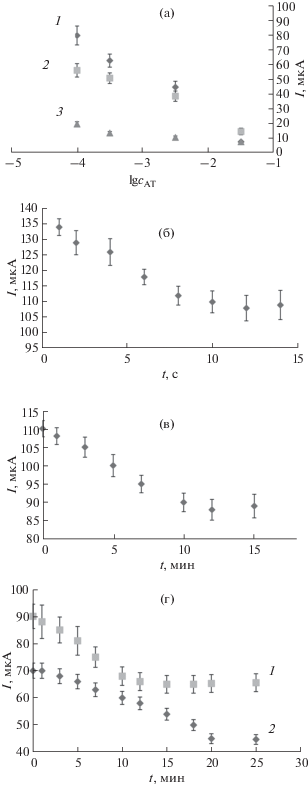
Как видно из рис. 4а, с увеличением концентрации хлорида п-нитрофенилдиазония в рабочем растворе закономерно уменьшается коэффициент чувствительности определения антител к вирусу кори (табл. 1). Вероятно, это связано с образованием массивных олигомерных слоев на поверхности рабочего электрода, что весьма характерно для таких молекул и широко освещено в литературе [41, 42]. Следует отметить, что заполнение поверхности электрода происходит в течение первых 10 с электролиза (рис. 4б). Таким образом, в дальнейших исследованиях электровосстановление хлорида п-нитрофенилдиазония проводили в течение 10 с, используя 0.25 мМ рабочий раствор.
Таблица 1.
Градуировочные зависимости для определения антител с использованием иммуносенсоров с различным содержанием хлорида п-нитрофенилдиазония
| c, мМ | Уравнение регрессии I (А) = (а ± Δа) lgcАТ + (b ± Δb) |
R2 |
|---|---|---|
| 0.25 | I (A) = −(28 ± 1)lgcАТ – (30 ± 4) | 0.979 |
| 0.5 | I (A) = −(16.0 ± 0.5)lgcАТ – (6.6±0.8) | 0.965 |
| 1 | I (A) = −(4.0 ± 0.2)lgcАТ + (0.68 ± 0.04) | 0.895 |
Зависимости на рис. 4в, 4г выходят на плато после инкубации в течение 10 мин и 10-минутного формирования иммунокомплекса антиген вируса кори−антитело на поверхности СУЭ при ковалентной иммобилизации антигена. В случае капельной иммобилизации антигена вируса кори наблюдается общее выраженное снижение пиков токов медиаторной системы и увеличение времени формирования иммунокомплекса на поверхности сенсора до 20 мин по отношению к иммуносенсору с ковалентно-иммобилизованным антигеном. Полученные закономерности, вероятно, обусловлены более равномерным распределением и ориентированным расположением белковых молекул антигена вируса кори, а также формированием более тонкого функционального слоя на поверхности электрода в случае иммобилизации методом ковалентной сшивки по сравнению с методом капельного нанесения антигена. Это подтверждают данные спектроскопии электрохимического импеданса, представленные на рис. 5. Величина сопротивления переноса заряда в эквивалентной ячейке Рэндлса на границе электрод−раствор составила 1.6 ± 0.2 кОм в случае капельного нанесения антигена, тогда как на электроде с ковалентно-иммобилизованным биорецептором Ret = 1.2 ± 0.1 кОм.
Рис. 5.
Диаграммы Найквиста и схема эквивалентной электрохимической ячейки Рэндлса. Ret – величина сопротивления переноса электрона на границе электрод/раствор, C – емкость двойного электрического слоя на границе электрод/раствор, Rs – сопротивление раствора: (1) – немодифицированный СУЭ, 2 – СУЭ с капельно нанесенным антигеном, 3 – СУЭ с ковалентно иммобилизованным антигеном.

Аналитические характеристики способа определения антител оценивали при выбранных рабочих условиях с использованием как модельных суспензий антител к вирусу кори, так и модельных смесей, содержащих помимо целевого аналита различные количества антител к бактерии Salmonella typhimurium. Выбор состава и соотношения компонентов модельных смесей обусловлен близкими размерами молекул биорецепторов, а также актуальностью дифференциальной диагностики бактериальных и вирусных агентов. В табл. 2 приведены уравнения регрессии, рассчитанные пределы обнаружения и линейные диапазоны определяемых концентраций антител к вирусу кори. В табл. 3 представлены результаты оценки правильности определения антител к вирусу кори в модельных суспензиях методом введено−найдено. Табл. 4 содержит результаты определения антител к вирусу кори в модельных смесях.
Таблица 2.
Метрологические характеристики способов определения антител к вирусу кори (n = 3, P = 0.95).
| Способ иммобилизации рецептора | Уравнение регрессии I = (a ± Δа)сАТ − (b ± Δb) | R2, % | cmin, МЕ/мл | Линейный диапазон, МЕ/мл |
|---|---|---|---|---|
| Ковалентная сшивка | I = –28 ± 1)сАТ − (30 ± 4) | 0.939 | 9.3 × 10–6 | 0.3−3 × 10–5 |
| Капельное нанесение | I = –(19 ± 2)сАТ − (15 ± 5) | 0.983 | 1.5 × 10–5 | 0.3−3 × 10–4 |
Таблица 3.
Оценка правильности результатов определения антител к вирусу кори методом введено−найдено (введено 3 × 10–2 МЕ/мл антител; n = 3, P = 0.95)
| Ковалентная иммобилизация | Капельное нанесение | ||
|---|---|---|---|
| найдено, сср, МЕ/мл | с1/с2, % | найдено, сср × 102, МЕ/мл | с1/с2, % |
| (2.9 ± 0.2) × 10–2 | 97 | (2.9 ± 0.2) × 10–2 | 97 |
| (3.0 ± 0.3) × 10–3 | 100 | (2.8 ± 0.3) × 10–2 | 93 |
| (3.1 ± 0.3) × 10–4 | 103 | (2.7 ± 0.3) × 10–2 | 90 |
Таблица 4.
Результаты (сср × 102, МЕ/мл, антител к вирусу кори) анализа модельных смесей антитела к вирусу кори + антитела к Salmonella typhimurium (сАТ к вирусу кори 0.03 МЕ/мл; n = 3, P = 0.95)
| Соотношение концентраций антител корь/S. typhi | Ковалентная иммобилизация | Капельное нанесение | ||
|---|---|---|---|---|
| найдено | с1/с2, % | найдено | с1/с2, % | |
| 1 : 1 | 3.0 ± 0.2 | 100 | 2.8 ± 0.2 | 93 |
| 1 : 10 | 3.1 ± 0.2 | 103 | 3.2 ± 0.2 | 106 |
| 1 : 100 | 3.2 ± 0.3 | 106 | 3.3 ± 0.3 | 110 |
Как видно из табл. 2, градуировочные зависимости линейны. В случае иммуносенсора с ковалентно-иммобилизованным антигеном имеет место увеличение коэффициента чувствительности и закономерное снижение предела обнаружения по сравнению с иммуносенсором с капельно-нанесенным биорецептором (9.3 × 10–6 против 1.5 × × 10–5 МЕ/мл). Ковалентная иммобилизация антигена вируса кори позволила на 10 единиц расширить линейный диапазон иммуносенсора. По-видимому, посредством ковалентной иммобилизации удалось реализовать более тонкий слой и достичь более равномерного распределения антигена на поверхности сенсора по сравнению с методом капельного нанесения. Величина относительного стандартного отклонения в обоих случаях не превысила 10%.
Результаты определения антител к вирусу кори в модельных суспензиях и смесях (табл. 3 и 4) показали, что метод иммобилизации рецептора не влияет существенно на точность определения. Имеет место тенденция к завышению результатов анализа модельных смесей при увеличении концентрации антител к Salmonella typhimurium. Однако даже при стократном избытке антител к Salmonella typhimurium соотношение с1/с2 не превысило 110%, что указывает на высокую точность измерений. Стоит отметить, что в случае капельного нанесения антигена расхождение величин с1/с2 при анализе модельных смесей больше (93−110%), чем в случае ковалентной иммобилизации (100−106%).
* * *
Таким образом, оценено влияние способа иммобилизации рецепторного слоя – капельного нанесения и ковалентной сшивки посредством электрографтинга хлорида п-нитрофенилдиазония с применением в качестве сшивающего агента глутарового альдегида – на аналитические характеристики безметочных электрохимических иммуносенсоров для определения антител к вирусу кори. Иммобилизация биорецептора методом ковалентной сшивки позволяет незначительно снизить предел обнаружения по отношению к иммуносенсору с капельно-иммобилизованным антигеном. Путем ковалентной иммобилизации антигена удалось расширить линейный диапазон иммуносенсора в область меньших концентраций антител и сократить общую продолжительность процедуры иммуноанализа за счет уменьшения длительности формирования иммунокомплекса на поверхности рабочего электрода. Метод иммобилизации антигена вируса кори существенно не влияет на точность определения антител. Несмотря на улучшение аналитических характеристик иммуносенсора с ковалентно-иммобилизованным антигеном по отношению к сенсору с капельно-нанесенным рецепторным слоем, трудоемкость процедуры в совокупности с крайней нестабильностью солей диазония ограничивает повсеместное применение электрографтинга хлорида п-нитрофенилдиазония для ковалентной иммобилизации биорецепторов. Ковалентная иммобилизация рецепторного слоя с применением метода электрографтинга п-нитрофенилдиазония может быть актуальна при определении ультрамалых концентраций антигенов, когда требуется ориентированная иммобилизация антител на поверхности электрода; с целью адресной иммобилизации рецепторного слоя на миниатюрных поверхностях; при изготовлении проточных или повторно-используемых иммуносенсоров. Однако вопрос стандартизации структуры формируемой поверхности (толщина слоя, число функциональных групп и их доступность для биоконъюгации) на сегодняшний день остается открытым.
Работа выполнена при финансовой поддержке постановления № 211 Правительства Российской Федерации, контракт № 02.A03.21.0006.
Список литературы
Moss W.J., Griffin D.E. Measles // Lancet. 2012. № 379. P. 153.
Tipples G., Hiebert J. Detection of measles, mumps, and rubella viruses // Methods Mol. Biol. 2011. № 665. P. 183.
Малышева Н.Н., Глазырина Ю.А., Ждановских В.О., Свалова Т.С., Матерн А.И., Козицина А.Н. Бесферментный электрохимический метод определения антигена вируса кори с использованием синтезированных IgG-(Fe3O4-SiO2) конъюгатов в качестве сигналообразующей метки // Изв. АН, сер. хим. 2014. Т. 63 № 7. С. 1633 (Malysheva N.N., Glazyrina Yu.A., Zhdanovskikh V.O., Svalova T.S., Matern A.I., Kozitsina A.N. Nonenzymatic electrochemical method for determination of the measles virus antigen using the synthesized IgG-(Fe3O4-SiO2) conjugate as the signal label // Russ. Chem. Bul. 2014. V.63. № 7. P. 1633).
Evtugyn G.A., Eremin S.A., Shaljamova R.P., Ismagilova A.R., Budnikov H.C. Amperometric immunosensor for nonylphenol determination based on peroxidase indicating reaction // Biosens. Bioelectron. 2006. V. 22. № 1. P. 56.
Варламова Р.М., Медянцева Э.П., Будников Г.К. Тест-системы на основе иммобилизованных антител и амперометрического детектирования // Бутлеровские сообщения. 2009. Т. 15. № 1. С. 40.
Маланичева Т.Г., Глушко Н.И., Халдеева Е.В., Файзуллина Е.В. Диагностические возможности иммуноферментного сенсора при кандидозах // Иммунопатология, аллергология, инфектология. 2004. № 1. С. 33.
Ugo P., Moretto L.M. Electrochemical immunosensors and aptasensors / Electrochemical Immunosensors and Aptasensors / Eds. Ugo P., Moretto L.M. Basel, Switzerland: MDPI, 2018. P. 173.
Tian K., Prestgard M., Tiwari A. A review of recent advances in nonenzymatic glucose sensors // Mater. Sci. Eng. C. 2014. № 41. P. 100.
Higson S. Biosensors for Medical Applications. Philadelphia, Oxford : Woodhead Publishing, 2012. 360 p.
Ahmed M.U., Hossain M.M., Tamiya E. Electrochemical biosensors for medical and food applications // Electroanalysis. 2008. V. 20. № 6. P. 616.
Kämäräinen S., Mäki M., Tolonen T., Palleschi G., Virtanen V., Micheli L., Sesay A.M. Disposable electrochemical immunosensor for cortisol determination in human saliva // Talanta. 2018. № 188. P. 50.
Felix F.S., Angnes L. Electrochemical immunosensors – a powerful tool for analytical applications // Biosens. Bioelectron. 2018. № 102. P. 470.
Sharma A., Rao V.K., Kamboj D.V., Gaur R., Upadhyay S., Shaik M. Relative efficiency of zinc sulfide (ZnS) quantum dots (QDs) based electrochemical and fluorescence immunoassay for the detection of Staphylococcal enterotoxin B (SEB) // Biotech. Rep. 2015. № 6. P. 129.
Malhotra B.D., Ali M.A. Ch. 1. Nanomaterials in biosensors: fundamentals and applications micro and nano technologies / Nanomaterials for Biosensors / Eds. Malhotra B.D., Ali M.A. Netherlands: Elsevier, 2018. P. 1.
Zhang Q., Chen X., Tu F., Yao C. Ultrasensitive enzyme-free electrochemical immunoassay for free thyroxine based on three dimensionally ordered macroporous chitosan–Au nanoparticles hybrid film // Biosens. Bioelectron. 2014. № 59. P. 377.
Akter R., Kyun Rhee C., Rahman M.A. A stable and sensitive voltammetric immunosensor based on a new non-enzymatic label // Biosens. Bioelectron. 2013. № 50. P. 118.
Pingarrón J.M., Campuzano S., González-Cortés A., Yáñez-Sedeño P. Electrochemical Immunosensors for Clinical Diagnostics. Oxford: Elsevier, 2018. P. 156.
Свалова Т.С., Малышева Н.Н., Козицина А.Н. Cтруктура рецепторного слоя в электрохимических иммуносенсорах. Современные тенденции и перспективы развития // Изв. АН, сер. хим. 2017. № 10. С. 1797.
Wang C., Feng B. Research progress on site-oriented and three-dimensional immobilization of protein // Mol. Biol. 2015. № 49. P. 1.
Vashist S.K., Lam E., Hrapovic S., Male K.B., Luong J.H.T. Immobilization of antibodies and enzymes on 3-aminopropyltriethoxysilane-functionalized bioanalytical platforms for biosensors and diagnostics // Chem. Rev. 2014. V. 114. № 21. P. 11083.
Kozitsina A.N., Svalova T.S., Malysheva N.N., Okho-khonin A.V., Vidrevich M.B., Brainina K.Z. Sensors based on bio and biomimetic receptors in medical diagnostic, environment, and food analysis // Biosensors. 2018. № 8. P. 35.
Dou Y.-H., Haswell S.J., Greenman J., Wadhawan J. Voltammetric immunoassay for the detection of protein biomarkers // Electroanalysis. 2012. V. 24. № 2. P. 264.
Bélanger D., Pinson J. Electrografting: a powerful method for surface modification // Chem. Soc. Rev. 2011. V. 40. № 7. P. 3995.
Adenier A., Combellas C., Kanoufi F., Pinson J., Podvorica F. I. Formation of polyphenylene films on metal electrodes by electrochemical reduction of benzenediazonium salts // Chem. Mater. 2006. V. 18. № 8. P. 2021.
Herlem G., Goux C., Fahys B., Dominati F., Gonçalves A.M., Mathieu C., Sutter E., Trokourey A., Penneau J.-F. Surface modification of platinum and gold electrodes by anodic oxidation of pure ethylenediamine // J. Electroanal. Chem. 1997. № 435. P. 259.
Adenier A., Chehimi M.M., Gallardo I., Pinson J., Vilà N. Electrochemical oxidation of aliphatic amines and their attachment to carbon and metal surfaces // Langmuir. 2004. V. 20. № 19. P. 8243.
Andrieux C.P., Gonzalez F., Savéant J.-M. Derivatization of carbon surfaces by anodic oxidation of arylacetates. Electrochemical manipulation of the grafted films // J. Am. Chem. Soc. 1997. V. 119. № 18. P. 4292.
Astudillo P.D., Galano A., Gonzalez F.J. Radical grafting of carbon surfaces with alkylic groups by mediated oxidation of carboxylanes // J. Electroanal. Chem. 2007. № 610. P. 137.
Maeda H., Yamauchi Y., Hosoe M., Li T.-X., Yamaguchi E., Kasamatsu M., Ohmori H. Direct covalent modification of glassy carbon surfaces with 1-alkanols by electrochem. oxidation // Chem. Pharm. Bull. 1994. V. 42. № 9. P. 1870.
Claes M., Voccia S., Detrembleur C., Jérôme C., Gilbert B., Leclère Ph., Geskin V.M., Gouttebaron R., Hecq M., Lazzaroni R., Jérôme R. Polymer coating of steel by a combination of electrografting and atom-transfer radical polymerization // Macromolecules. 2003. V. 36. № 16. P. 5926.
Ignatova M., Voccia S., Gilbert B., Markova N., Mercuri P.S., Galleni M., Sciannamea V., Lenoir S., Cossement D., Gouttebaron R., Jérôme R., Jérôme C. Synthesis of copolymer brushes endowed with adhesion to stainless steel surfaces and antibacterial properties by controlled nitroxide-mediated radical polymerization // Langmuir. 2004. V. 20. № 24. P. 10718.
González M.C.R., Carro P., Hernández Creus A. Morphological changes in electrografted aryl-based thin films induced by using diazonium salts or aryl iodides // Chem. Electro. Chem. 2018. V. 3. № 5. P. 464.
Koefoed L., Pedersen S.U., Daasbjerg, K. Covalent modification of glassy carbon surfaces by electrochemical grafting of aryl iodides // Langmuir. 2017. V. 13. № 33. P. 3217.
Yáñez-Sedeño P., Campuzano S., Pingarrón, J.M. Integrated affinity biosensing platforms on screen-printed electrodes electrografted with diazonium salts // Sensors (Basel, Switzerland). 2018. № 18. P. 635.
Liu G., Chockalingham M., Khor S.M., Gui A.L., Gooding J.J. A comparative study of the modification of gold and glassy carbon surfaces with mixed layers of in situ generated aryl diazonium compounds // Electroanalysis. 2010. № 22. P. 918.
Strzemińska I., Strzemińska I., Sainte Rose Fanchine S., Anquetin G., Reisberg S., Noël V., Pham M.C., Piro B. Grafting of a peptide probe for prostate-specific antigen detection using diazonium electroreduction and click chemistry // Biosens. Bioelectron. 2016. № 81. P. 131.
Eissa S., Tlili C., L’Hocine L., Zourob M. Electrochemical immunosensor for the milk allergen β-lactoglobulin based on electrografting of organic film on graphene modified screen-printed carbon electrodes // Biosens. Bioelectron. 2012. № 38. P. 308.
Bagheryan Z., Raoof J.-B., Golabi M., Turner A.P.F., Beni V. Diazonium-based impedimetric aptasensor for the rapid label-free detection of Salmonella typhimurium in food sample // Biosens. Bioelectron. 2016. № 80. P. 566.
Prieto-Simón B., Saint C., Voelcker N.H. Electrochemical biosensors featuring oriented antibody immobilization via electrografted and self-assembled hydrazide chemistry // Anal. Chem. 2014. V. 86. № 3. P. 1422.
Palacin S., Bureau C., Charlier J., Deniau G., Mouanda B., Viel P. Molecule-to-metal bonds: electrografting polymers on conducting surfaces // Chem. Phys. Chem. 2004. V. 5. № 10. P. 1468.
Jiang C., Silvaa S.M., Fan S., Wu Y., Tanzirul M.A., Liu G., Goodinga J.J. Aryldiazonium salt derived mixed organic layers: from surface chemistry to their applications // J. Electroanal. Chem. 2017. № 785. P. 265.
Bouden S., Pinson J., Vautrin-Ul C. Electrografting of diazonium salts: A kinetics study // Electrochem. Com. 2016. № 81. P.120.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


