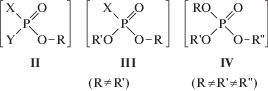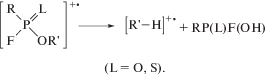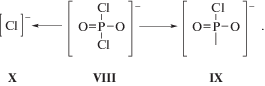Журнал аналитической химии, 2020, T. 75, № 2, стр. 132-144
Идентификация и установление молекулярной структуры эфиров фосфорных кислот путем совместного применения масс-спектров электронной ионизации с регистрацией положительных и отрицательных ионов
А. Г. Терентьев a, *, Ю. И. Морозик b, М. В. Иванова b, А. В. Дудкин b
a 27 Научный центр Министерства обороны Российской Федерации
105005 Москва, Бригадирский пер., 13, Россия
b Военная академия радиационной, химической, биологической защиты
имени Маршала Советского Союза С.К. Тимошенко
156005 Кострома, ул. Горького, 16, Россия
* E-mail: tag2278@mail.ru
Поступила в редакцию 07.11.2018
После доработки 04.12.2018
Принята к публикации 14.08.2019
Аннотация
Пути распада отрицательных молекулярных ионов эфиров фосфорных кислот, образовавшихся в условиях резонансного захвата электронов, отличаются однотипностью и вследствие этого предсказуемостью. Сочетание полученных таким образом масс-спектров изучаемых веществ с масс-спектрами положительных ионов, записанных в обычном режиме электронной ионизации, существенно расширяет возможности их идентификации и установления характеристик их молекулярной структуры. При этом возможно использование только одного масс-спектрометра, легко переключаемого с одного режима на другой.
Проблема быстрой и надежной идентификации токсичных веществ, особенно в полевых условиях, остается актуальной. Трудности такой идентификации обусловлены тем, что для обнаружения токсичных веществ в малых количествах в сложных матрицах (почва и вода и др.) эффективной является лишь масс-спектрометрия электронной ионизации с регистрацией положительных ионов (МС–ЭИ–ПИ) в сочетании с газовой хроматографией [1–3]. Однако многолетняя практика показывает, что применение лишь одного спектрального метода, как правило, не позволяет идентифицировать неизвестное вещество с высокой надежностью, если его спектра нет в справочной базе данных [4, 5].
В списке 1а Конвенции о запрещении химического оружия [6] (далее “Конвенция”) под номерами 1−3 представлены целые классы фосфорорганических токсичных веществ, подлежащих контролю. Количество соединений в этих классах варьирует от десятков до сотен тысяч, в то время как изучены лишь несколько сотен представителей каждого класса. Так, в случае О-алкилалкилфторфосфонатов (формула I),
где R = CH3, C2H5, C3H7, (CH3)2CH; R' = алкильный или циклоалкильный радикал с числом углеродных атомов 1−10, из более чем 24000 веществ этого класса [7], подлежащих контролю согласно Конвенции [6], в справочных базах спектральных данных представлено лишь около 300−350.В сложившейся ситуации признано целесообразным проведение идентификации в два этапа. На первом этапе устанавливают принадлежность исследуемого соединения к известной таксономической единице – классу или гомологическому ряду (или какой-либо его группе) без полной расшифровки молекулярной структуры этого соединения [3, 8], т.е. осуществляют групповую идентификацию. От выводов, получаемых на этом этапе, зависит целесообразность полного определения молекулярной структуры вещества на втором этапе. С практической точки зрения подразделение на два этапа вполне оправдано, так как все вещества одного класса оказывают однотипное физиологическое действие на человека. Необходимо отметить, что результаты групповой идентификации О-алкилалкилфторфосфонатов (№ 1 в списке 1а Конвенции), а также наиболее токсичных их всех фосфорорганических соединений О-алкил-S-2-(N,N-диалкиламино)этилалкилтиофосфонатов (V-газов) с помощью сочетания газовой хроматографии и МС–ЭИ–ПИ нельзя считать достаточно надежными. Основной причиной является недостаточное количество групповых характеристических признаков в МС–ЭИ–ПИ этих соединений и наличие многих из этих признаков у соединений родственных классов [9].
Отметим еще одну проблему. Большинство токсичных фосфорорганических соединений и многие из их предшественников и продуктов превращения являются эфирами фосфорных кислот (фосфорной, алкилфосфоновых, алкилфосфонистых, алкилтионфосфоновых). Длина и строение алкоксильных радикалов в большой мере определяют токсичность веществ, а также их физико-химические свойства [10]. Несмотря на некоторые довольно успешные попытки определить эти структурные характеристики “классическим” масс-спектрометрическим методом [11] в общем случае это весьма затруднительно даже для моноэфиров (формула II). Трудности возрастают в случае ди- и триэфиров фосфорных кислот с различными алкоксильными радикалами в одной молекуле (формулы III и IV).
В этом случае “классическая” масс-спектрометрия с электронной ионизацией бывает даже более эффективна, чем метод ЯМР 13С [12]. Тем не менее, задача определения, например, числа атомов углерода в радикалах R, R1, R2 таких молекул даже с использованием совокупности спектральных методов, рекомендованных Организацией по запрещению химического оружия (ЯМР, ИК-спектроскопия, МС–ЭИ–ПИ), а также газовой хроматографии общего решения не имеет. Масс-спектрометрия отрицательных ионов резонансного захвата электронов (МС–ОИ–РЗЭ) может позволить эффективно решить эту задачу.
Академик РАН Ю.А. Золотов по поводу масс-спектрометрии отрицательных ионов резонансного захвата электронов писал: “Для работы в данном режиме можно модернизировать практически любой масс-спектрометр, однако сделать это не очень просто. Сложность метода, отсутствие серийного выпуска соответствующих приборов или хотя бы приставок к распространенным масс-спектрометрам стали причиной того, что метод не получил широкого распространения, несмотря на накопленный материал (порядка 400 публикаций…). Тем не менее, метод характеризуется немалыми возможностями” [13].
Добавим, что метод не получил широкого распространения, поскольку до недавнего времени на применяемом для таких исследованиях оборудовании эксперимент был очень сложен, требовал больших затрат времени и не был пригоден для серийного анализа [14, 15]. А.Г. Терентьеву с участием М.В. Ивановой в тесном содружестве со специалистами из уфимского Института физики молекул и кристаллов удалось модифицировать серийный хроматографический масс-спектрометрический комплекс с квадрупольным масс-анализатором “Кристалл 5000.1/DSQ Thermo Finnigan” для работы с отрицательными ионами при малых (до 15 эВ) энергиях ионизации [16]. В результате модификации прибора метод МС–ОИ–РЗЭ теперь можно использовать для серийного анализа, причем продолжительность эксперимента не больше, чем в “классическом” режиме положительной электронной ионизации. Таким образом, появилась возможность исследования закономерностей образования масс-спектров ОИ–РЗЭ для широкого круга химических соединений.
Масс-спектры отрицательных ионов резонансного захвата электронов наблюдаются в общем случае в областях, соответствующих различным резонансным значениям энергии ионизирующих электронов [17, 18]. Нами установлено, что резонансные области образования отрицательных ионов изучаемых фосфорорганических соединений находятся около 4 эВ и, следовательно, при этих энергиях ионизирующих электронов регистрируются наиболее интенсивные сигналы полного ионного тока.
Цель настоящей работы − изучение сходства и различия основных направлений фрагментации эфиров фосфорных кислот в режимах электронной ионизации с регистрацией положительных и отрицательных ионов резонансного захвата электронов. Кроме того, была поставлена цель показать существенное повышение достоверности и расширение возможностей групповой идентификации эфиров фосфорных кислот, а также установить строение алкоксильных радикалов в молекулах этих соединений при совместном применении двух указанных выше модификаций масс-спектрометрического метода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперимент проводили на комплексе, состоящем из газового хроматографа Кристалл 5000.1 (СКБ “Хроматэк”, Йошкар-Ола) и масс-спектрометрического квадрупольного детектора DSQ Thermo Finnigan. Условия работы газового хроматографа: кварцевая капиллярная колонка DB-5MS (30 м × × 0.25 мм × 0.25 мкм), температура в испарителе − 250°С, режим программирования температуры термостата от 40 до 250°С со скоростью 10 град/мин, выдержка температуры после ввода пробы 1 мин, расход газа-носителя гелия 1.1 мл/мин, температура интерфейса 255°С. Параметры масс-селективного детектора: температура источника ионов 257°С, энергия ионизирующих электронов при регистрации положительных ионов (ПИ) 70 эВ, при регистрации отрицательных ионов 4 ± 0.5 эВ, диапазон сканируемых масс 30−500 Да.
Моно- и диалкилзамещенные хлорфосфаты (чистота не менее 95%) синтезировали по известной методике [19]. Концентрации исследуемых веществ в растворе составляли 0.1 мг/мл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сравнение основных направлений распада эфиров фосфорных кислот в режимах электронной ионизации с регистрацией положительных и отрицательных ионов резонансного захвата электронов. Ранее нами предложены схемы фрагментации эфиров фосфорных кислот общей формулы (RO)nP(O)Xn –3, где X = R, галоген, OCH3, NR2 в режиме МС–ЭИ–ПИ [12].
Одно из двух основных направлений фрагментации таких соединений заключается в последовательном отщеплении алкоксильных радикалов, которое сопровождается миграцией одного или двух атомов водорода к фосфорсодержащему фрагменту. Этот процесс состоит из нескольких стадий, число которых определяется числом алкоксильных радикалов в молекуле [12].
Для моноэфиров (RO)P(O)XY, где X и Y – алкильный радикал, галоген, псевдогалоген (например, группа −CN), группа −OCH3, аминогруппа, рассматриваемый процесс является одностадийным:
Как видно из уравнения (1), отщепление от молекулярного иона алкоксильного радикала сопровождается обратной миграцией двух атомов водорода к фосфорсодержащему фрагменту с образованием иона V. Такую перегруппировку иногда называют “Мак-Лафферти + 1” [18].
Вторым главным направлением фрагментации моноэфиров фосфорных кислот (так же как и многих других монофункциональных соединений [20]) является разрыв той же связи O−C, приводящий к отщеплению от молекулярного иона алкенового катион-радикала [R−H]+• [21] (типичный пример перегруппировки Мак-Лафферти [18] с локализацией заряда на олефиновом фрагменте):
Так называемый “алкеновый субспектр” общего масс-спектра вещества [20], состоящий из пика этого катион-радикала и пиков продуктов его распада, потенциально содержит информацию о числе атомов углерода алкоксильного радикала и его строении. Для моноэфиров получение такой информации в ряде случаев возможно. Этот вопрос достаточно подробно рассмотрен в работах [11, 20] и здесь далее не обсуждается, так как определение строения алкоксильных радикалов в моноэфирах не является предметом исследования настоящей работы. В качестве примера приведем масс-спектры электронной ионизации с регистрацией положительных ионов О-(3-метил)бутилметилфторфосфоната и О-(1-метил)пентилметилфторфосфоната (рис. 1). Пик иона V в масс-спектрах ПИ О-алкилалкилфторфосфонатов, так же как и других моноэфиров фосфорных кислот, почти всегда является главным, что подтверждает рис. 1.
Рис. 1.
Масс-спектры положительных ионов О-3-(метил)бутилметилфторфосфоната (а) и О-1-(метил)пентилметилфторфосфоната (б) [22].

Для диэфиров XP(O)(OR')(OR'') процесс распада по основному направлению является двухстадийным и соответствует следующей схеме [12]:
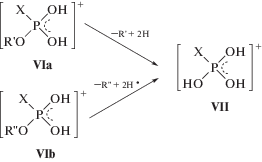
Как видно из уравнений (3) и (4), на первой стадии основной реакции происходит отрыв одного алкоксильного радикала с миграцией двух атомов водорода к фосфорсодержащему фрагменту и образованием промежуточных ионов VIa и (или) VIb. В случае симметричных диэфиров (R' = R'') образуется один промежуточный ион VI. Отметим, что первая стадия рассматриваемой реакции (уравнение (3)) полностью совпадает с основным направлением распада моноэфиров, например О-алкилалкилфторфосфонатов [11].
На второй стадии (уравнение (4)) отщепляется второй алкоксильный радикал и получается основной ион VII, очень похожий на ион V (уравнение (1)). В качестве примера на рис. 2 приведен масс-спектр ПИ О-децил-О-пентилметилфосфоната [12]. Судя по полученным экспериментальным данным (рис. 2), здесь реализуется вариант известного общего правила [18]: на первой стадии (уравнение (3)) преимущественно отщепляется более длинный радикал.
Схему распада триэфиров фосфорных кислот в режиме МС–ЭИ–ПИ не приводим, так как она в целом аналогична уравнениям (3) и (4) за исключением того, что добавляется еще одна стадия, в ходе которой отщепляется последний третий алкоксильный радикал и образуется катион [P(OH)4]+ [12].
Далее рассмотрим масс-спектры отрицательных ионов исследуемых соединений, полученные в режиме резонансного захвата электронов. Сразу следует указать, что общее (и основное) направление фрагментация всех изученных эфиров фосфорных кислот (всего 33 вещества) однотипно. Независимо от числа эфирных групп в молекуле всегда протекает разрыв связи O−C с отщеплением от молекулярного иона одного из алкоксильных радикалов. В общем виде соответствующее уравнение реакции можно записать следующим образом:
где X,Y в данном случае не только алкильный радикал, галоген, псевдогалоген (например, CN-группа), группа OCH3, аминогруппа, но и группа OR.Рассмотрим некоторые особенности масс-спектров ОИ−РЗЭ моноэфиров, диэфиров и триэфиров. Изучено семь О-алкилдихлорфосфатов, два О-алкилалкилфторфосфоната и один О,О-диалкилдиалкилпирофосфонат. На рис. 3 приведены масс-спектры ОИ-РЗЭ трех моноэфиров фосфорных кислот: О-(2-этил)бутилдихлорфосфата, О-пинаколилметилфторфосфоната (зомана), О,О-диэтилдиметилпирофосфоната. Как видно из рис. 3а, в случае первого соединения общее и основное направление фрагментации приводит к отщеплению алкоксильного (в данном случае 2-этилбутильного) радикала с образованием иона VIII. То же самое наблюдается и при фрагментации двух других соединений, спектры которых представлены на рис. 3б и 3в. Массовое число образующегося при этом иона VIII всегда равно массе молекулы за вычетом массы алкоксильного радикала (218 – 85 = 133 Да для первого соединения и для всех О-алкилдихлорфосфатов).
Рис. 3.
Масс-спектры отрицательных ионов резонансного захвата электронов моноэфиров фосфорных кислот: (а) – О-(2-этил)бутилдихлорфосфат, (б) – О-пинаколилметилфторфосфонат, (в) – О,О-диэтилдиметилпирофосфонат.

В случае О-алкилдихлорфосфатов, к которым принадлежит первое соединение (рис. 3а) протекает дальнейший частичный распад иона VIII с отщеплением атома хлора. При этом отрицательный заряд локализуется в основном на образующемся фосфорсодержащем ионе IX, но частично и на отходящем атоме хлора (ион X).
Аналогичные результаты получены для всех семи изученных О-алкилдихлорфосфатов. Кластерная структура пика иона IX подтверждает наличие только одного атома хлора (рис. 3а).
В масс-спектре пирофосфоната (рис. 3в) наблюдается довольно интенсивный сигнал иона с m/z 229, образующегося в результате отщепления от молекулярного иона атома водорода, а также пик иона, получающегося при простом разрыве одной из связей P−O (m/z 123), причем заряд закономерно локализуется на фрагменте, содержащем три атома кислорода.
Изучены масс-спектры ОИ-РЗЭ 28 ди- и триэфиров фосфорных кислот: десяти О,О-диалкилхлорфосфатов, четырех О,О-диалкилалкилфосфоната, одного О,О-диалкилфторфосфатa, восьми О,О-диалкилпирофосфатов и пяти О,О,О-триалкилфосфатов. Характерные спектры приведены на рис. 4. Как видно, фрагментация ди- и триэфиров фосфорных кислот подчиняется общим закономерностям (уравнение (5)), т.е. от отрицательного молекулярного иона отрывается один из алкоксильных радикалов. Особенностью распада диэфиров (OR)(OR')P(O)X, где R ≠ R', X=Cl, F, алкильный радикал, является то, что процессы отщепления различных алкоксильных радикалов идут параллельно и с разными скоростями.
Рис. 4.
Масс-спектры отрицательных ионов резонансного захвата электронов ди- и триэфиров фосфорных кислот: (а) – О,О-диизопропилфторфосфат, (б) – О-бутил,О-пропилхлорфосфат, (в) – О-этил-S-2-(N,N-диизопропиламино)этилметилтиофосфонат, (г) – О,О,О-трибутилфосфат.

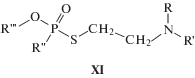
К группе диэфиров можно условно отнести также О-алкил-S-2-(N,N-диалкиламино)этилалкилтиофосфонаты (V-газы), самые токсичные из всех фосфорорганических соединений, строение которых описывается общей структурной формулой XI.
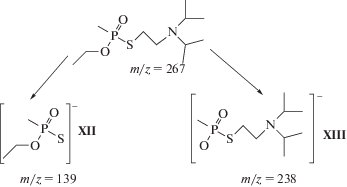
Нами изучены два таких соединения. Фрагментация V-газов в стандартных условиях МС–ЭИ–ПИ своеобразна, а получаемые масс-спектры относительно малоинформативны. В первом приближении вид масс-спектров определяется строением радикалов у атома азота (R, R'), в то время как влияние радикалов у атома фосфора (R'') и эфирного кислорода (R''') довольно незначительно [7, 9]. В связи с этим возникают трудности как с групповой идентификацией, так и с установлением строения алкильных радикалов молекулы, что подробнее рассмотрено ниже. Однако в режиме ОИ-РЗЭ эти вещества по своему поведению очень напоминают диэфиры фосфорных кислот, по-видимому, из-за сходства электронного строения атомов кислорода и серы. Из анализа спектра на рис. 4в следует, что фрагментация молекулярных ионов таких соединений в основном сводится к двум конкурирующим процессам: простым разрывам связей O−C и S−C c отщеплением соответствующих нейтральных фрагментов. Заряд при этом локализуется, как обычно для диэфиров, на фосфорсодержащем фрагменте [23]. Ниже приведена схема фрагментации О-этил-S-2-(N,N-диизопропиламино)этилметилтиофосфоната в режиме МС–ОИ–РЗЭ:
Как видно из спектра на рис. 4в, преимущественно отщепляется S-2-N,N-диалкиламиноэтильный радикал, т.е. преобладает “левое” направление на приведенной выше схеме. Таким образом, приведенные спектры вполне подтверждают указанную выше общую закономерность: во всех случаях протекает общий процесс распада, заключающийся в разрыве связи PO−C (а в данном случае и связи PS−C) в молекуле и отщеплении О-алкильного (S-алкильного) радикала. Соответственно массовое число образующегося при этом иона (XII или XIII) всегда равно массе молекулы за вычетом массы этого радикала. Однотипность фрагментации эфиров фосфорных кислот делает МС–ОИ–РЗЭ ценным и надежным методом идентификации рассматриваемых соединений и установления важных характеристик их молекулярной структуры.
Групповая идентификация моноэфиров фосфорных кислот. Групповая идентификация некоторых высокотоксичных фосфорорганических соединений по данным МС–ЭИ–ПИ недостаточно надежна. Основном причиной этого является недостаточное количество групповых характеристических признаков в масс-спектрах ПИ этих соединений и совпадение многих из этих признаков с соединениями родственных классов. Рассмотрим этот вопрос более подробно. В работе [7] предложен алгоритм групповой идентификации (классификации) высокотоксичных О-алкилалкилфторфосфонатов по масс-спектрам ПИ. Ограничимся лишь основной группой этого класса, содержащей почти все его соединения (число атомов углерода в алкоксильном радикале больше 1). Эту группу разобьем на 4 подгруппы в зависимости от вида радикала у атома фосфора (R − метил, этил, пропил, изопропил в соответствии с требованиями Конвенции). Отправной точкой групповой идентификации является наличие в масс-спектре исследуемого вещества пика с m/z = 47, принадлежащего группировке P=O. После этого принадлежность к каждой из четырех подгрупп устанавливают по набору характеристических пиков фосфорсодержащих ионов [7].
Например, принадлежность к подгруппе О-алкилметилфторфосфонатов с общей формулой CH3P(O)(OR)F определяют по наличию пиков с m/z = 47, 99 Да (пик V, почти всегда главный) и пика с m/z = 81. Аналогичным образом принадлежность изучаемого вещества к подгруппе О-алкилэтилфторфосфонатов устанавливают по наличию пиков с m/z = 47, 113 (пик V), 84, 95 Да. Во многих случаях этот алгоритм работает, но далеко не всегда. Достаточно посмотреть на спектры рис. 1, чтобы убедиться, насколько ненадежно может быть такое отнесение. Во-первых, в спектрах обоих веществ отсутствуют пики с m/z = 47 (они всегда малоинтенсивны) и, следовательно, вся схема идентификации рушится. Кроме того, характеристические пики с m/z 81, 95, 84 Да также малоинтенсивны. Во-вторых, пики с m/z 81, 95, 84 Да могут принадлежать не характеристическим фосфорсодержащим ионам, а пикам рассмотренного выше алкенового или циклоалкенового субспектра, который никакой информации о групповой принадлежности вещества не содержит [уравнение (2)] [20]. Так, пик с m/z = 84 Да в спектре О-(1-метил)пентилметилфторфосфоната (рис. 1б) относится к промежуточному алкеновому катион-радикалу [C6H12]+• [21]. При увеличении длины алкоксильного радикала пики характеристических фосфорсодержащих ионов все больше теряются среди пиков алкенового субспектра или налагаются на них [11]. Положение усугубляется вследствие сильной зависимости масс-спектров положительной электронной ионизации О-алкилалкилфторфосфонатов от разветвленности алкоксильного радикала [11].
Таким образом, в настоящее время мы не располагаем достаточно надежным алгоритмом групповой идентификации высокотоксичных О‑алкилалкилфторфосфонатов (веществ типа зарин) по данным масс-спектров положительной электронной ионизации, поскольку в спектрах из объявленных 3−4 групповых признаков [7] надежным часто является только один: интенсивный пик иона V со структурой [RP(OH)2F]+. Безусловно, этот характеристический признак идеален именно для групповой идентификации. Во-первых, пик иона V очень интенсивен, во-вторых, его массовое число однозначно связано с ближайшим окружением атома фосфора в молекуле и не зависит от строения алкоксильных радикалов. В этом отношении он превосходит даже химический сдвиг ЯМР 31Р. Однако очевидно, что одного признака недостаточно для надежной групповой идентификации.
Выходом из положения является использование масс-спектров ОИ–РЗЭ. В соответствии с уравнением (5) основное направление фрагментации приводит к образованию иона VIII, который в случае О-алкилметилфторфосфонатов имеет строение:
и массовое число 97 Да.
Ион VIII также обладает идеальным строением для групповой идентификации и очень близок по строению к иону V, от которого его массовое число отличается на 2 Да. Кроме того, он самый интенсивный или второй по интенсивности в масс-спектрах ОИ–РЗЭ эфиров фосфорных кислот.
Таким образом, исходя из найденных закономерностей, с высокой степенью вероятности можно утверждать, что в масс-спектрах основной группы О‑алкилметилфторфосфонатов RP(O)(OR′)F будут наблюдаться главные пики, представленные в табл. 1 (в случае ПИ пик иона V очень редко может быть вторым по интенсивности):
Таблица 1.
Главные пики О-алкилалкилфторфосфонатов при регистрации положительных и отрицательных ионов
| R | m/z пика V (МС–ЭИ–ПИ) | m/z пика VIII (МС–ОИ–РЗЭ) |
|---|---|---|
| CH3 | 99 | 97 |
| C2H5 | 113 | 111 |
| C3H7 | 127 | 125 |
| CH(CH3)2 | 127 | 125 |
На основании изложенного выше предложен подход к групповой идентификации О-алкилалкилфторфосфонатов по хромато-масс-спектральным данным. Сначала проводят хромато-масс-спектральное исследование образца в режиме МС–ЭИ–ПИ. При обнаружении вещества, в масс-спектре которого имеется интенсивный сигнал с массовым числом 99, 113, 127 Да, записывают масс-спектр в режиме ОИ–РЗЭ. Если в спектре вещества с тем же временем газохроматографического удерживания массовое число, соответствующее главному пику, меньше на 2 Да, то вещество идентифицируют как представителя соответствующей подгруппы О-алкилалкилфторфосфонатов. Кроме высокой надежности, этот способ намного проще сложного и многошагового алгоритма, предложенного в работе [7]. Получены правильные результаты для всех представленных в работе О-алкилалкилфторфосфонатов. Необходимо отметить, что при использовании данного подхода круг соединений, относящихся к О-алкилалкилфторфосфонатам, следует расширить. Это значит, что радикал R' может быть не только алкильным и циклоалкильным, но и содержать в дальних положениях двойную связь, гетероатомы и функциональные группы. Предложенный способ является средством надежного выявления ближайшего окружения атома фосфора, которое соответствует таковому в молекулах О-алкилалкилфторфосфонатов.
Поскольку для всех изученных эфиров фосфорных кислот направление фрагментации, описываемое уравнением (5), является главным и преобладающим, аналогичные подходы можно применять для групповой идентификации других моноэфиров, например О-алкилдихлорфосфатов. В масс-спектрах ПИ этих соединений наблюдается интенсивный (главный для всех 7 изученных веществ) пик иона [Cl2P(OH)2]+ c массовым числом 135 Да. Соответственно в масс-спектрах ОИ–РЗЭ имеется интенсивный пик иона [Cl2P(O)2]– c массовым числом 133 Да (рис. 3а). По нашему мнению, благодаря характерной кластерной структуре для групповой идентификации О-алкилдихлорфосфатов достаточно с указанной выше оговоркой только одного метода: МС–ЭИ–ПИ или МС–ОИ–РЗЭ, для других моноэфиров необходимо использовать оба метода. Среди таких соединений можно указать О-алкилдифторфосфаты, О-алкилдииодфосфаты, О-алкилдицианфосфаты, О-алкилалкилцианфосфонаты и многие другие.
Представляется весьма перспективным применение описанного выше подхода и для групповой идентификации самых токсичных фосфорорганических веществ – О-алкил-S-2-(N,N-диалкиламино)этилалкилтиофосфонатов (V-газов). Способы групповой идентификации этих веществ по масс-спектрам ПИ предложены в работах [7] и [9]. Хотя способ, разработанный в работе [9], намного проще и занимает меньше времени, принципиально положение не меняется. В работе [9] показано, что из-за недостатка характеристических признаков в масс-спектрах ЭИ-ПИ невозможно или крайне трудно отличить V-газы от широкого круга соединений, содержащих фрагменты P–S–CH2CH2NR2 или P–O–CH2CH2NR2, например, от их предшественников с атомом фосфора(III). Так, показатели совпадения масс-спектра О-этил-О-2-(N,N-диизопропиламино)этилметилфосфонита
с масс-спектром чрезвычайно токсичного вещества О-этил-S-2-(N,N-диизопропиламино)этилметилтиофосфоната , найденные с помощью информационно-поисковой программы NIST [24], составляют 833 по прямому поиску и 860 по обратному поиску (алгоритм Similarity), т.е. весьма высоки. На практике это обстоятельство может иметь далеко идущие последствия, если относительно малотоксичные предшественники будут приняты за чрезвычайно токсичные V-газы. Привлечение масс-спектров ОИ–РЗЭ с очень высокой вероятностью позволит устранить эту неопределенность. В самом деле, главным пиком в масс-спектрах ОИ–РЗЭ V-газов является пик с m/z = 139 (рис. 4в), относящийся к 13 гомологической группе [25, 26]. Появление интенсивного пика этой гомологической группы в масс-спектрах ОИ–РЗЭ О-алкил-О-2-(диалкиламино)этилметилфосфонитов крайне маловероятно, если исходить из найденной нами закономерности фрагментации эфиров фосфорных кислот [уравнение (5)], от которой не выявлено отклонений.
Установление числа атомов углерода в алкоксильных радикалах диэфиров фосфорных кислот. Задача определения числа атомов углерода в алкоксильных радикалах диэфиров и триэфиров фосфорных кислот весьма сложна и общего решения не имеет. Положение осложняется тем, что при удлинении алкоксильных радикалов сигналы от “внутренних” атомов углерода в спектре ЯМР 13С имеют тенденцию к слиянию (см., например, спектры № 362, 455, 480 из базы [27]).
Определенные возможности для получения информации такого рода дает масс-спектрометрия ПИ. В работе [12] установлено, что в масс-спектре диалкилалкилфосфонатов RP(O)(OR’)(OR'') с R' ≠ R'' наблюдаются сигналы от двух различных промежуточных ионов VIа и VIb, число атомов углерода в которых легко определяется по формулам:
(7)
$\begin{gathered} {{n}_{1}} = {{\left[ {m{\text{/}}z({\mathbf{VIа}})--m{\text{/}}z({\mathbf{VII}})} \right]} \mathord{\left/ {\vphantom {{\left[ {m{\text{/}}z({\mathbf{VIа}})--m{\text{/}}z({\mathbf{VII}})} \right]} {14}}} \right. \kern-0em} {14}}, \\ {{n}_{2}} = {{\left[ {m{\text{/}}z({\mathbf{VIb}})--m{\text{/}}z({\mathbf{VII}})} \right]} \mathord{\left/ {\vphantom {{\left[ {m{\text{/}}z({\mathbf{VIb}})--m{\text{/}}z({\mathbf{VII}})} \right]} {14}}} \right. \kern-0em} {14}}, \\ \end{gathered} $К сожалению, в случае алкоксильных радикалов, разветвленных в α- и β-положениях, надежность такого способа определения числа атомов углерода резко падает из-за уменьшения интенсивностей пиков ионов VI до нескольких процентов относительно пика VII [12] даже в случае симметричных соединений. Естественно, когда алкоксильные радикалы разные, эти значения еще меньше, а общая спектральная картина усложняется, что препятствует надежному установлению искомых характеристик.
Интенсивность пиков VI бывает очень низкой и в масс-спектрах ПИ других диэфиров фосфорных кислот. На рис. 5 представлены масс-спектры ПИ О-бутил-О-пропилхлорфосфата [23] и О‑гептил-О-пентилхлорфосфата. Видно, что в спектрах обоих соединений пики предполагаемых ионов VIа (m/z 159 и 187 Да) малоинтенсивны, а пики ионов VIb (m/z 173 и 217 Да) практически не наблюдаются. Из-за этого определение искомых структурных характеристик невозможно или весьма ненадежно. Обращает на себя внимание тот факт, что пик иона VII (m/z = 117 Да) преобладает над другими пиками, вследствие чего масс-спектры ПИ веществ рассматриваемого класса очень похожи. В целом можно отметить, что масс-спектры ПИ диалкилхлорфосфатов содержат недостаточно данных для надежной групповой идентификации и практически не позволяют определять число атомов углерода в алкоксильных радикалах молекулы.
Рис. 5.
Масс-спектры положительных ионов несимметричных диалкилхлорфосфатов: (а) – О-бутил-О-пропилхлорфосфат, (б) – О-гептил-О-пентилхлорфосфат.

Обе эти задачи можно решить, привлекая данные спектров ОИ–РЗЭ, например, О-бутил-О-пропилхлорфосфата (рис. 4б). В соответствии с уравнением (5) в нем имеются два пика ионов VIIIa и VIIIб с массовыми числами 157 и 171 Да соответственно. Легко убедиться, что массовые числа ионов VIIIa и VIIIb на две единицы меньше, чем ионов VIa иVIb (рис. 5) в масс-спектрах ПИ, однако, в отличие от последних, их пики являются основными в спектре.
Предложен следующий способ одновременного проведения групповой идентификации О,О-диалкилхлорфосфатов и определения числа атомов углерода в обоих алкоксильных радикалах. Сначала проводят хромато-масс-спектральное исследование образца в режиме ПИ. При обнаружении в спектре вещества главного пика с характерной кластерной структурой и массовым числом 117 Да выполняют хромато-масс-спектральное исследование образца в режиме МС–ОИ–РЗЭ. Если в спектре вещества с тем же временем газохроматографического удерживания имеется интенсивный пик или два пика с массовым числом, соответствующим третьей гомологической группе [26] и превышающим массовое число иона V (т.е. 143, 157, 171 Да и т.д.), делают вывод о принадлежности вещества к классу О,О-диалкилхлорфосфатов с ациклическими алкоксильными радикалами. Далее определяют число атомов углерода в алкоксильных радикалах по формуле:
(8)
$n = {\text{ }}{{\left[ {m{\text{/}}z({\mathbf{VIII}}) - m{\text{/}}z({\mathbf{V}}) + 2} \right]} \mathord{\left/ {\vphantom {{\left[ {m{\text{/}}z({\mathbf{VIII}}) - m{\text{/}}z({\mathbf{V}}) + 2} \right]} {14}}} \right. \kern-0em} {14}},$Для вещества, спектр которого изображен на рис. 4б (О-пропил-О-бутилхлорфосфат) получаем:
Если в масс-спектре ОИ-РЗЭ имеется только один пик, то число атомов углерода в алкоксильных радикалах в молекуле одинаково. После этого можно легко определить молекулярную массу вещества.
Правильные результаты с применением описанного выше способа получены для всех изученных пяти О,О-диалкилхлорфосфатов (О,О-диметилхлорфосфат, О,О-диэтилхлорфосфат, О-пропил-О-бутилхлорфосфат, О,О-дибутилхлорфосфат, О-пропил,О-(2-метил)бутилхлорфосфат) и пяти О,О,О-триалкилфосфатов (О,О,О-триизопропилфосфат, О,О-дипропил-О-бутилфосфат, О,О-дибутил-О-пропилфосфат, О,О,О-трибутилфосфат, О-пропил-О-бутил-О-пентилфосфат).
* * *
Таким образом, сочетание масс-спектрометрии ПИ и ОИ-РЗЭ является эффективным способом групповой идентификации и определения важных структурных характеристик эфиров фосфорных кислот. Получаемую при этом структурную информацию часто весьма трудно, если вообще возможно, получить с помощью других инструментальных методов. Успешная оптимизация режима записи масс-спектров ОИ–РЗЭ (см. “Экспериментальную часть”) позволит применять этот метод и при изучении веществ других классов. Метод масс-спектрометрии ОИ–РЗЭ заслуживает широкого внедрения в аналитическую практику.
Список литературы
Recommended operating procedures for analysis in the verification of chemical disarmament / Ed. Vanniner P. Department of Chemistry University of Helsinki, Finland: VERIFIN, 2011. P. 458.
Бродский Е.С., Киреев А.Ф. Применение масс-хроматограмм по характеристическим ионам и разностям масс ионов для идентификации и определения компонентов химического оружия // Журн. аналит. химии. 1997. Т. 52. № 8. С. 884. (Brodskii E.S., Kireev A.F. Identification and determination of chemical warfare components and their decomposition products using mass chromatograms in characteristic ions and in ion mass differences // J. Analyt. Chem. 1997. V. 52. № 8. P. 801).
Лебедев А.Т., Лебедев К.С., Мясоедов Б.Ф., Рыбальченко И.В., Сигейкин Г.И., Суворкин В.Н. Масс-спектрометрическая идентификация высокотоксичных алкилфторфосфонатов // Масс-спектрометрия. 2006. Т. 3. № 4. С. 277.
Иоффе Б.В., Костиков Р.Р., Разин В.В. Физические методы определения строения органических соединений. М.: Высшая школа, 1984. С. 336.
Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. Пер с англ. М.: Бином. Лаборатория знаний, 2012. С. 557.
Конвенция о запрещении разработки, производства и применения химического оружия и о его уничтожении. GE. 9261926. Париж, 1993. С. 133. (The Convention on the prohibition of the development, production, stockpiling and use of chemical weapons and on their destruction. GE 9261926. Paris, 1993. P. 133.)
Киреев А.Ф., Рыбальченко И.В., Савчук В.И., Суворкин В.Н., Холстов В.И. Качественный хромато-масс-спектрометрический анализ высокотоксичных производных алкилфторфосфонатов и алкилтиофосфонатов // Журн. аналит. химии. 2002. Т. 57. № 8. С. 842. (Kireev A.F., Rybal’chenko I.V., Savchuk V.I., Suvorkin V.N., Tipukhov I.A., Khamidi B.A. Qualitative chromatographic-mass spectrometric analysis of highly toxic alkyl phosphonate and alkyl thiophosphonate derivatives // J. Analyt. Chem. 2002. V. 57. № 8. P. 708.)
Note by the director–General. Revised Standard Operation Procedure for Evaluation of the Results of OPCW Proficiency Tests. The Hague, OPCW, Technical Secretariat, 1998.
Морозик Ю.И., Кучинский Е.В., Галяев Г.В., Смирнов А.О. Библиотека спектральных образов как средство быстрой и надежной идентификации высокотоксичных O-алкил-S-2-((N,N-диалкиламино)этил-алкилтиофосфонатов по масс-спектрам с электронной ионизацией // Журн. аналит. химии. 2013. Т. 68. № 8. С. 750. (Morozik Y.I., Kuchinskii E.V., Galyaev G.V., Smirnov A.O. A library of spectral patterns as a tool for the rapid and reliable identification of highly toxic O-alkyl-S-2-(N,N-dialkylamino)ethyl alkyl thiophosphonates based on electron-ionization mass spectra // J. Analyt. Chem. 2013. V. 68. № 8. P. 680.)
Розенгарт В.И., Шерстобитов О.Е. Избирательная токсичность фосфорорганических инсектоакарицидов. Л.: Наука, 1972. С. 174.
Лебедев А.Т., Морозик Ю.И., Мясоедов Б.Ф., Рыбальченко И.В., Фоменко П.В. Установление строения О-алкилалкилфторфосфонатов методом масс-спектрометрии и компьютерное прогнозирование их масс-спектров // Масс-спектрометрия. 2007. Т. 4. № 4. С. 255.
Смирнов А.О., Морозик Ю.И., Фоменко П.В. Влияние строения алкоксильных радикалов на масс-спектральную фрагментацию диалкилалкилфосфонатов // Журн. общ. химии. 2009. № 2. С. 315. (Smirnov A.O., Morozik Yu.I., Fomenko P.V. Effect of the structure of alkoxy radicals on the mass-spectral fragmentation of dialkyl alkylphosphonates // Russ. J. Gen. Chem. 2009. V. 79. № 2. P. 203.)
Золотов Ю.А. Российский вклад в аналитическую химию. М.: ИП Лысенко А.Д., 2017. С. 190.
Мазунов В.А., Щукин П.В., Хатымов Р.В., Муфтахов М.В. Масс-спектрометрия отрицательных ионов в режиме резонансного захвата электронов // Масс-спектрометрия. 2006. Т. 3. № 1. С. 11.
Муфтахов М.В., Хатымова Л.З., Хатымов Р.В., Мазунов В.А. Инструментальный метод масс-спектрометрии резонансного захвата электронов для фундаментальных и прикладных исследований органических соединений // Изв. Уфимского науч. центра РАН. 2014. № 4. С. 38.
Терентьев А.Г., Иванова М.В., Хатымов Р.В., Дудкин А.В. Устройство для сохранения катода масс-спектрометра при работе с малыми энергиями ионизации. Патент № 158407 РФ. Заявка 2015106407/07 от 25.02.2015, опубл. 27.12.2015.
Хвостенко В.И. Масс-спектрометрия отрицательных ионов в органической химии. М.: Наука, 1981. С. 159.
Лебедев А.Т. Масс-спектрометрия в органической химии. М.: Бином, 2003. С. 493.
Kirby A.J., Warren S.G. The Organic Chemistry of Phosphorus. Amsterdam, New York: Elsevier, 1967. Ch. 7, 10, 11.
Ткачук Ю.В., Морозик Ю.И., Дудкин А.В. Общая схема фрагментации монофункциональных органических соединений в условиях электронной ионизации // Журн. общ. химии. 2015. Т. 85. № 3. С. 390. (Tkachuk Yu.V., Morozik Yu.I., Dudkin A.V. General scheme of fragmentation of monofunctional organic compounds under electron ionization // Russ. J. Gen. Chem. 2015. V. 85. № 3. P. 556.)
Морозик Ю.И., Дудкин А.В., Рыбальченко И.В., Наумов А.Р. Групповая идентификация о-алкилалкилтион-фторфосфонатов по масс-спектрам электронной ионизации на основе обобщенных спектральных образов таксономических групп // Масс-спектрометрия. 2017. Т. 14. № 3. С. 209.
OPCW Central Analytical Database, e-OCAD V. 2016, Technical Secretariat of the Organization for the Prohobition of Chemical Weapons, Heulweg, The Netherlands, 2014.
Терентьев А.Г., Морозик Ю.И., Рыбальченко И.В., Дудкин А.В., Смирнов А.О., Галяев Г.В. Определение структурных характеристик О-алкил-S-2-(N,N-диалкиламино)этилалкилтиофосфонатов по масс-спектрам электронной ионизации // Масс-спектрометрия. 2015. Т. 12. №. 4. С. 259. (Terentyev A.G., Morozik Y.I., Dudkin A.V., Smirnov A.O., Galyaev G.V., Rybal’chenko I.V. Determination of the structural features of O-alkyl-S-2-(N,N-dialkylamino) ethyl alkylthiophosphonates from their electron ionization mass spectra // J. Analyt. Chem. 2016. V. 71. № 13. P. 1266.)
NIST Mass Spectral Search Program for the NIST/EPA/NIH Mass Spectral Library. Version 2.2. June 10, 2014.
Иоффе Б.В. Применение масс-спектров ионных серий для идентификации органических соединений // Журн. орг. химии.1996. Т. 32. № 5. С. 653.
Зенкевич И.Г., Иоффе Б.В. Интерпретация масс-спектров органических соединений / Под ред. Иоффе Б.В. Л.: Химия, 1986. С. 176.
Johnson Le Roy F., Jankowski William C. Carbon-13 NMR-Spectra. A Collection of Assigned, Coded and Indexed Spectra. New York, London, Sydney, Toronto: John Wiley & Sons, 1980.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии