Журнал аналитической химии, 2020, T. 75, № 2, стр. 153-161
Приготовление и исследование Ti/TiO2,SbOx рН-электродов
М. С. Васильева a, b, *, В. С. Руднев a, b, Н. Е. Забудская a, b, А. Ю. Устинов a, b, Л. А. Засухина a, Г. И. Маринина a
a Дальневосточный федеральный университет
690950 Владивосток, ул. Суханова, 8, Россия
b Институт химии Дальневосточного отделения Российской академии наук
690022 Владивосток, просп. 100 лет Владивостока, 159, Россия
* E-mail: vasileva.ms@dvfu.ru
Поступила в редакцию 23.10.2018
После доработки 04.04.2019
Принята к публикации 15.08.2019
Аннотация
Электроды состава Ti/TiO2,SbOx получены одностадийным методом плазменно-электролитического оксидирования в водных электролитах с гидроксокомплексами сурьмы. Морфология поверхности и состав нанесенных на титан слоев TiO2,SbOx изучены методами электронной сканирующей микроскопии, рентгенофазового анализа и рентгеновской фотоэлектронной спектроскопии. Сформированные слои содержат TiO2 в анатазной модификации и до 1 ат. % сурьмы в виде Sb2O3 и Sb2O5. Полученные электроды Ti/TiO2,SbOx тестированы в качестве рН-сенсоров. Они имеют близкую к нернстовской электродную функцию в интервале рН от 2 до 10 (53 ± 1 мВ/рН). При кислотно-основном титровании сильной (HCl) и слабой (СН3СООН) кислот с Ti/TiO2,SbOx-электродами получены скачки потенциала, не уступающие по величине скачку потенциала для стеклянного электрода. Показана возможность применения электродов Ti/TiO2,SbOx для определения щелочности техногенных вод.
В настоящее время наиболее точным, быстрым и распространенным методом определения рН водных сред является потенциометрический метод. В качестве потенциометрического рН-датчика широко используют стеклянный электрод. Однако его применение затруднительно при решении многих современных задач, например, при удаленном мониторинге, миниатюризации сенсора, его повышенной механической прочности, деформируемости или исполнении в определенной геометрической форме. В качестве рН-сенсоров исследуют различные по составу металлические и металлоксидные электроды, в том числе сурьмяный [1], висмутовый [2, 3], из нержавеющей стали [4], WO3 [5–7], IrO2 [8–12], PbO2 [13, 14], PtO2 [14], RuO2 [15–17], SnO2 [18], Ta2O5 [19], TiO2 [20], смешанные системы SnO, TiO2, SnO2 [21], RuO2–TiO2 [22, 23], Ti/Co3O4/PbO2/(SnO2 + Sb2O3) [24], Ti/PbO2/Sb2O3 [25], Ti/TiO2/SnO2(Sb) [26], Au–PbO2 [27], CeO2, Ce0.8Sm0.2O2 и Ce0.8Zr0.2O2 [28].
Среди исследуемых материалов представляют интерес электроды на основе диоксида титана, который является полупроводником n-типа, имеет невысокую стоимость и характеризуется стойкостью в агрессивных средах [14, 20, 29–36]. В частности, представляет интерес диоксид титана, нанесенный слоями на металлические токопроводящие основы [14, 30–36].
В предшествующих работах [34–36] нами показано, что рН-чувствительные электроды Ti/TiO2 могут быть получены методом плазменно-электролитического оксидирования (ПЭО) титановых пластин. В общем случае метод ПЭО – это формирование оксидных слоев на поверхности металлов и сплавов в условиях действия в прианодной области электрических искровых и микродуговых разрядов [37, 38]. Метод позволяет получать многокомпонентные оксидные слои на металлических образцах со сложной геометрией. Он достаточно прост в технологическом исполнении, а полученные электроды имеют невысокую стоимость.
Согласно данным [21–28] в последнее время значительное внимание уделяется не индивидуальным, а смешанным оксидным системам. Одним из путей улучшения рН-чувствительности ПЭО-электродов Ti/TiO2 может являться введение модифицирующей добавки в состав оксидного слоя, например, учитывая данные [24–26], оксидов сурьмы. Следует отметить, что модифицирование оксидами сурьмы различных материалов используют также при получении индикаторных электродов для вольтамперометрии [39], оптических устройств [40], анодных материалов для литиевых ионных батарей [41] и т.д.
Целью настоящей работы являлось одностадийное плазменно-электролитическое формирование смешанных оксидных слоев TiO2 + SbOx на титане и исследование их фазового и элементного состава, строения поверхности, электроаналитических свойств в прямой рН-метрии и кислотно-основном титровании.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электроды изготавливали из листового титана марки ВТ1-0 в виде пластинок размером 2.0 × 2.0 см. Для снятия поверхностного слоя металла и стандартизации поверхности образцы химически полировали в смеси конц. HF и HNO3 (1 : 3) при 60−80°С в течение 2−3 с.
Оксидные пленки на титане формировали методом ПЭО в гальваностатических условиях при эффективной плотности тока i = 0.1 А/см2 в течение 10 мин. Источник тока − тиристорный преобразователь типа ТЕР4-100/460Н с импульсной однополярной формой тока. Процесс ПЭО вели в сосуде из термостойкого стекла емк. 1 л. Катод − трубчатый змеевик из нержавеющей стали марки Х18Н9Т, охлаждаемый водопроводной водой. Начальная температура электролитов составляла 14−23°С. После ПЭО образцы промывали водой и сушили на воздухе при комнатной температуре.
Для приготовления электролитов использовали реактивы Sb2O3 ⋅ 3H2O (ч. д. а.) и NaOH (ч. д. а.). В зависимости от состава электролита для ПЭО сформированные образцы получили обозначения, приведенные в табл. 1.
Таблица 1.
Состав электролита и обозначения электродов, полученных методом плазменно-электролитического оксидирования
| Обозначение электрода | Электролит для ПЭО |
|---|---|
| Ti/TiO2 | 0.1 M NaOH |
| Ti/TiO2,SbOх[I] | 0.1 M NaOH + 0.01 М Sb2O3 |
| Ti/TiO2,SbOх[II] | 0.1 M NaOH + 0.05 М Sb2O3 |
При изучении рН-чувствительности ПЭО-слоев на титане использовали буферные растворы с известными значениями рН. Поведение исследуемых электродов в потенциометрическом кислотно-основном титровании изучали на примере титрования 0.1 М НCl 0.1 М раствором NaOH. В качестве электрода сравнения использовался хлоридсеребряный электрод ЭВЛ-1-М-1.
В качестве реальных объектов исследования использовали техногенные воды, отобранные в промышленных зонах ликвидированных угольных шахт “Углекаменская” и “Нагорная” (Партизанск, Приморский край, Россия).
Щелочность исследуемых вод (мг-экв/л) определяли методом кислотно-основного титрования в сравнении с методикой визуального титрования (ГОСТ 31957-2012). В качестве индикаторных электродов использовали стеклянный электрод (СЭ) и полученные ПЭО-электроды. Объем исследуемой воды составлял 50 мл. В качестве титранта использовали 0.1 М HCl.
Фазовый состав образцов определяли методом рентгенофазового анализа (РФА) на дифрактометре D8 ADVANCE (Германия) в CuKα-излучении по стандартной методике. Соединения, входящие в состав исследуемых образцов, идентифицировали в автоматическом режиме поиска EVA с использованием банка данных (PDF-2).
Данные по морфологии, элементному составу поверхности получали методом сканирующей электронной микроскопии (СЭМ) с помощью микроскопа Hitachi S-5500 (Япония) с системой энергодисперсионного рентгеноспектрального микроанализа. Глубина анализируемого слоя составляла ∼1 мкм.
Для определения элементного состава поверхности оксидных покрытий использовали рентгеновскую фотоэлектронную (РФЭ) спектроскопию. Спектры получали на сверхвысоковакуумной установке фирмы Specs (Германия) с 150-миллиметровым электростатическим полусферическим анализатором. Для ионизации применяли MgKa-излучение. Глубина анализируемого поверхностного слоя составляла около 3 нм. Для удаления верхнего слоя применяли ионное травление (энергия ионов Ar+ + ${\text{N}}_{2}^{ + }$ 5000 эВ, время сканирования поверхности 5 мин, скорость травления ~0.01 нм/с). Спектры калибровали по С1s-линиям углеводородов, энергию которых полагали равной 285.0 эВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование Sb-содержащих покрытий методом плазменно-электролитического оксидирования и их характеристики. При выборе состава электролита учитывали следующие факты. Известно, что в результате реакции между оксидом сурьмы(III) и гидроксидом натрия в водных растворах образуются гидроксокомлексы сурьмы Na[Sb(OH)4] и Na3[Sb(OH)6] согласно уравнениям:
(1)
${\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{2NaOH}} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{2Na}}[{\text{Sb}}{{({\text{OH}})}_{{\text{4}}}}]{\text{,}}$Отрицательно заряженные Sb-содержащие ионные частицы будут попадать в прианодное пространство и встраиваться под действием электрических разрядов при ПЭО в растущий на анодно-поляризованном титане оксидный слой TiO2.
Согласно результатам энергодисперсионного анализа (табл. 2) в водных электролитах в присутствии 0.1 М NaOН сформированы ПЭО-слои, которые содержат кислород, титан и до 2 ат. % углерода. В электролитах с анионными комплексами сурьмы получены оксидные слои, содержащих наряду с перечисленными выше элементами до ∼1 ат. % сурьмы.
Таблица 2.
Элементный состав (ат. %) Sb-содержащих оксидных слоев, полученных методом плазменно-электролитического оксидирования, по данным энергодисперсионного анализа
| Образец | O | Ti | Sb | C |
|---|---|---|---|---|
| Ti/TiO2 | 58.9 | 36.7 | – | 2.1 |
| Ti/TiO2,SbOх[I] | 59.1 | 40.1 | 0.5 | – |
| Ti/TiO2,SbOх[II] | 58.2 | 40.8 | 0.8 | 0.8 |
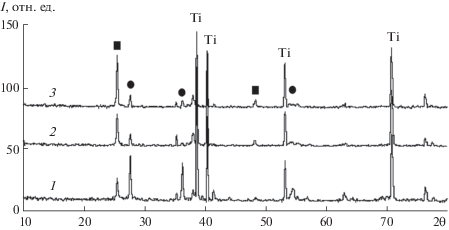
На рис. 1 приведены рентгенограммы покрытий, сформированных в исследуемых электролитах. На рентгенограммах всех образцов имеются достаточно интенсивные рефлексы титана и диоксида титана в анатазной и рутильной модификациях. Рефлексы, соответствующие оксидам сурьмы, отсутствуют. Между тем, в составе покрытий, сформированных в электролитах, содержащих оксид сурьмы (рис. 1, кривые 2, 3), рефлексы, отнесенные к анатазной модификации, больше по величине, чем рефлексы, отнесенные к рутильной модификации. Иными словами во всех случаях преобладает анатазная модификация оксида титана. На рентгенограммах покрытий, полученных в 0.1 М растворе NaOH (рис. 1, кривая 1), наблюдается противоположная картина – в составе покрытий преобладает рутильная модификация диоксида титана. Таким образом, наличие в электролите анионных гидроксокомплексов сурьмы и встраивание сурьмы в состав растущего слоя TiO2 приводят к стабилизации его анатазной модификации.
Рис. 1.
Рентгенограммы образцов: (1) – Ti/TiO2; (2) – Ti/TiO2,SbOх[I]; (3) – Ti/TiO2,SbOх[II]. (⚫) – рутил, (◼) – анатаз.
По данным РФЭ-спектроскопии (табл. 3) в составе поверхностных слоев толщиной ~3 нм образцов Ti/TiO2,SbOх[I] и Ti/TiO2,SbOх[II] содержание сурьмы составляет 4 и 3 ат. % соответственно. Анализ спектров РФЭ (рис. 2) свидетельствует о том, что сурьма в поверхностных слоях образцов находится в окисленном состоянии, вероятно, в виде Sb2O3 и Sb2O5, для которых характерна энергия связи (Есв) Sb3d5/2 ~ 530.0 и 530.8 эВ соответственно [42]. Титан имеет энергию связи 2р3/2 электронов (табл. 3), характерную для диоксида титана (стандартное значение – 458.8 эВ).
Таблица 3.
Значения энергии связи в максимуме полосы и элементный состав образцов Ti/TiO2,SbOх[I] и Ti/TiO2,SbOх[II] по данным рентгеновской фотоэлектронной спектроскопии
| Химический состав поверхности | Ti/TiO2,SbOх[I] | Ti/TiO2,SbOх[II] | ||
|---|---|---|---|---|
| Eсв, эВ | с, ат. % | Eсв, эВ | с, ат. % | |
| Sb (3d3/2) | 540.1/537.5, 539.9 | 4.0/2.3 | 540.2/537.5, 539.9 | 3.0/1.6 |
| O (1s) | 530.5/530.3 | 60.5/69.7 | 530.5/530.5 | 58.5/68.3 |
| Ti (2p3/2) | 458.7/458.7 | 9.1/24.2 | 458.8/458.7 | 9.7/24.6 |
| C (1s) | 285.0/285.0 | 26.4/3.9 | 285.0/285.0 | 28.7/5.5 |
Рис. 2.
Обзорные рентгеновские фотоэлектронные спектры Ti/TiO2,SbOх[I] до травления (1) и после травления поверхности (2).
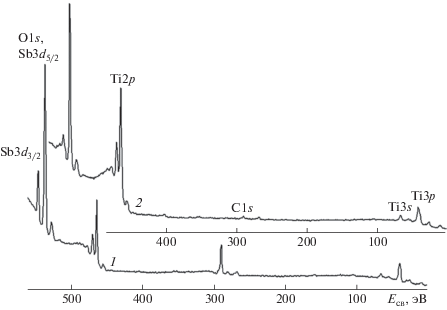
Травлением поверхности образцов удаляли верхний слой (ориентировочно стравливали около 3–5 нм поверхностного слоя). В приповерхностном слое по сравнению с исходным увеличена доля окисленных форм титана, существенно меньше углерода, меньшее количество сурьмы, которая находится в двух различных состояниях – окисленном и “металлическом” (рис. 2).
Сравнение данных, полученных методами РФЭ-спектроскопии (табл. 3) и энергодисперсионного анализа (табл. 2), показало, что в верхних слоях покрытий повышено содержание сурьмы. В поверхностном слое покрытия присутствует как окисленная сурьма, по-видимому, в виде Sb2O3 и Sb2O5, так и металлическая. На поверхности обоих образцов имеется значительное количество алифатического углерода. Углерод фиксируется в составе многих ПЭО-покрытий, формируемых в щелочных электролитах. Его встраивание связывают с заметным поглощением углекислого газа из воздуха щелочными электролитами [43, 44].
На рис. 3 приведены СЭМ-изображения поверхности сформированных методом ПЭО покрытий. Покрытие, сформированное в электролите только с гидроксидом натрия, визуально имеет двухслойное строение. В каналообразных разрывах внешнего плотного стеклообразного слоя видны участки лежащего ниже пронизанного порами покрытия. Добавление в электролит оксида сурьмы приводит к более плотному заполнению поверхности внешним слоем. Причем внешний слой в этих случаях построен из хорошо выраженных гранул. Из-за наличия большого числа небольших разрывов во внешнем слое поверхность Sb-содержащих покрытий выглядит более развитой.
Рис. 3.
СЭМ-изображения поверхности электродов: (a) – Ti/TiO2; (б) – Ti/TiO2,SbOх[I]; (в) – Ti/TiO2,SbOх[II].

Потенциометрическое исследование поведения ПЭО-электродов прямой рН-метрией проводили в интервале pH 2–10. Электродные функции Е–рН всех исследуемых ПЭО-электродов линейны во всем указанном диапазоне рН. Параметры соответствующих уравнений вида Е = a – b(рН) приведены в табл. 4. Коэффициенты аппроксимации для всех ПЭО-электродов приближаются к единице, что также свидетельствует о линейности функции Е−рН. Значения коэффициентов b для электродов, сформированных в электролите, содержащем 0.1 М NaOH, составляют 45 ± 5 мВ/рН, в то время как для электродов Ti/TiO2,SbOх[I] 51 ± ± 3 мВ/рН и Ti/TiO2,SbOх[II] 53 ± 1 мВ/рН (табл. 4). Очевидно, наличие в составе слоя TiO2 до 1 ат. % сурьмы увеличивает чувствительность к рН формируемых электродов. Это может быть связано с тем, что электродная реакция протекает с участием оксидов и сурьмы и титана. Кроме того, это может быть связано с наличием в модифицированных слоях преимущественно анатазной модификации оксида титана, а также более развитой поверхности их внешнего слоя.
Таблица 4.
Параметры уравнения Е = а – b рН и значения скачков потенциала (ΔE/ΔV) при потенциометрическом кислотно-основном титровании 0.1 М НCl 0.1 М раствором NaOH (n = 5, P = 0.95)
| Электрод | a, мВ | b, мВ/рН | R2 | ΔE/ΔV, мВ/мл |
|---|---|---|---|---|
| Стеклянный электрод | 394 ± 21 | 57 ± 1 | 0.99 | 1856 |
| Ti/TiO2 | 311 ± 56 | 45 ± 5 | 0.99 | 1263 |
| Ti/TiO2,SbOх[I] | 433 ± 33 | 51 ± 3 | 0.99 | 1785 |
| Ti/TiO2,SbOх[II] | 432 ± 31 | 53 ± 1 | 0.98 | 2100 |
Величина коэффициента а в уравнении Е = = a − b(рН) зависит от состояния поверхности электрода, природы оксидов и др. Введение сурьмы в состав оксидных слоев приводит к повышению коэффициента а на ~120 мВ (табл. 4), что свидетельствует о повышении термодинамической устойчивости ПЭО-электродов.
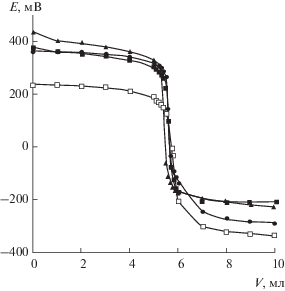
На рис. 4 представлены интегральные кривые кислотно-основного титрования 0.1 М НCl 0.1 М раствором NaOH с исследуемыми электродами. На всех кривых наблюдаются выраженные скачки потенциала. Следует отметить, что скачки потенциала на электродах со Sb-содержащими оксидными слоями сопоставимы или превышают по величине скачок потенциала для стеклянного электрода, тогда как для Ti/TiO2-электрода значение скачка потенциала несколько ниже (рис. 4, табл. 4). В целом можно отметить, что наблюдается корреляция между поведением ПЭО-электродов в прямой потенциометрии и кислотно-основном титровании.
Рис. 4.
Интегральные кривые кислотно-основного титрования 0.1 М HCl 0.1 М раствором NaOH c различными электродами: (◼) – Ti/TiO2,SbOх[II], (▲) – Ti/TiO2,SbOх[I], (◻) – Ti/TiO2, (◆) – стеклянный электрод.
Результаты количественного определения сильной кислоты (НCl) с использованием исследуемых ПЭО-электродов приведены в табл. 5. Видно, что относительная погрешность определения НCl с использованием Ti/TiO2 ПЭО-электрода достигает ∼6%, тогда как использование Sb-содержащих электродов позволяет снизить ее до ∼2%.
Таблица 5.
Результаты потенциометрического титрования 0.1 М HCl с использованием различных электродов (введено 18.23 мг HCl, n = 5, P = 0.95)
| Электрод | Найдено HCl, мг |
$\frac{{\Delta m}}{m},$ % | sr |
|---|---|---|---|
| Ti/TiO2 | 19.3 ± 0.2 | 5.9 | 7 × 10–3 |
| Ti/TiO2,SbOх[I] | 17.9 ± 0.3 | 1.6 | 1.6 × 10–2 |
| Ti/TiO2,SbOх[II] | 18.7 ± 0.2 | 2.0 | 8 × 10–3 |
В табл. 6 приведены результаты потенциометрического титрования водных растворов 0.025, 0.05 и 0.075 М слабой кислоты (CH3COOH) с применением Ti/TiO2,SbOх[II]-электрода в качестве индикаторного. Анализ результатов свидетельствует о том, что сформированные Sb-содержащие электроды можно применять и для определения слабой кислоты с относительной погрешностью не более 2%.
Таблица 6.
Результаты потенциометрического титрования уксусной кислоты различной концентрации с использованием Ti/TiO2,SbOх[II]-электрода (n = 5, P = 0.95)
| с(СН3ООН), М | Введено СН3ООН, мг |
Найдено СН3ООН, мг |
$\frac{{\Delta m}}{m},$ % | sr |
|---|---|---|---|---|
| 0.025 | 7.51 | 7.56 ± 0.01 | 0.7 | 8 × 10–5 |
| 0.05 | 15.01 | 14.9 ± 0.8 | 0.5 | 2.0 × 10–2 |
| 0.075 | 22.52 | 22.14 ± 0.01 | 1.7 | 3 × 10–5 |
Щелочность техногенных вод ликвидированных шахт Углекаменская и Нагорная определяли методом потенциометрического кислотно-основного титрования. В качестве индикаторных электродов использовали СЭ и Sb-содержащие ПЭО-электроды. Мониторинг таких техногенных вод крайне важен ввиду опасности разлива шахтных вод и загрязнения близлежащих земель и водоемов. Одним из важнейших гидрохимических показателей качества техногенных и природных водных объектов является щелочность, которая обусловлена присутствием в воде веществ, содержащих гидроксид-ион, а также веществ, реагирующих с сильными кислотами (соляной, серной).
На рис. 5 представлены дифференциальные кривые кислотно-основного титрования техногенной воды Углекаменская и Нагорная 0.1 М HCl. Видно, что при титровании данных типов вод на СЭ и Ti/TiO2,SbOх[I]-электроде наблюдаются сопоставимые по величине скачки потенциала вблизи точки эквивалентности.
Рис. 5.
Дифференциальные кривые кислотно-основного титрования техногенных вод Углекаменская (а) и Нагорная (б) с использованием электродов Ti/TiO2,SbOx[I] (◼) и СЭ (⚫).

Согласно данным табл. 7, данные по щелочности, полученные потенциометрическим титрованием с использованием как СЭ, так и Ti/TiO2,SbOх[I]-электрода, совпадают, но ниже найденных методом визуального титрования в соответствии с требованиями ГОСТ 31957-2012. Поскольку визуальные методы анализа связаны со значительными субъективными погрешностями, результаты потенциометрического определения щелочности можно считать более точными.
Таблица 7.
Результаты (мг-экв/л) определения щелочности техногенных вод промышленных зон ликвидированных угольных шахт (n = 10, P = 0.95)
| Электрод | Шахта Углекаменская | Шахта Нагорная |
|---|---|---|
| СЭ | 26.8 ± 0.1 | 37.1 ± 0.2 |
| Ti/TiO2,SbOx[I] | 26.8 ± 0.1 | 37.1 ± 0.2 |
| Ti/TiO2,SbOx[II] | 26.8 ± 0.1 | 37.1 ± 0.2 |
| Визуальное титрование | 27.8 ± 0.3 | 39.8 ± 0.2 |
Таким образом, электроды на основе ПЭО-слоев на титане можно применять в качестве индикаторных электродов при потенциометрическом определении щелочности техногенных вод. Следует отметить, что существенными недостатками стеклянного электрода являются высокое сопротивление и хрупкость, необходимость предварительной обработки и вымачивания в растворе определяемого иона, которых лишены твердофазные ПЭО-электроды.
* * *
Таким образом, полученные оксидные ПЭО-слои на титане, модифицированные сурьмой, проявляют высокую рН-чувствительность, позволяют определять концентрации сильных и слабых кислот в водных растворах, могут быть легко миниатюризированы, просты в изготовлении, имеют невысокую стоимость, вследствие чего являются перспективными рН-сенсорами для различного применения. Одностадийность метода ПЭО, стабильность и возможность многократного применения Sb-содержащих электролитов, позволяет говорить о технологичности метода и относительной безопасности его для окружающей среды.
Работа поддержана грантом РФФИ № 18-03-00418.
Список литературы
Edwall G. Influence of crystallographic properties on antimony electrode potential-I. Polycrystalline material // Electrochim. Acta. 1979. V. 24. № 6. P. 595.
Маринина Г.И., Тырин В.И. Поведение висмутового металлоксидного электрода при потенциометрической индикации реакции комплексообразования // Журн. аналит. химии. 1982. Т. 38. № 11. С. 1948.
Metelka R., Žeravík M., Vytřas K. Carbon paste electrode containing dispersed bismuth powder for pH measurements / Sensing in Electroanalysis. Pardubice, Czech Republic: University Press Centre, 2010. V. 5. P. 257.
Nomura K., Ujihira Y. Response of oxide films on stainless steel as a pH sensor // J. Anal. Chem. 1988. V. 60. № 23. P. 2564.
Campos R. de C., Cestarolli D.T., Mulato M., Guerra E.M. Comparative sensibility study of WO3 pH Sensor using EGFET and ciclic voltammetry // Mat. Res. 2015. V. 18. № 1. P. 15.
Zhang W.-De, Xu B. A solid-state pH sensor based on WO3-modified vertically aligned multiwalled carbon nanotubes // Electrochem. Commun. 2009. V. 11. № 5. P. 1038.
Santos L., Neto J.P., Crespo A., Nunes D., Costa N., Fonseca I.M., Barquinha P., Pereira L., Silva J., Martins R., Fortunato E. WO3 nanoparticle-based conformable pH sensor // ACS Appl. Mater. Interfaces. 2014. V. 6. P. 12226.
Huang W.-D., Cao H., Deb S., Chiao Mu, Chiao J.C. A flexible pH sensor based on the iridium oxide sensing film // Sens. Actuators A. 2011. V. 169. № 1. P. 1.
Kim T.Y., Yang S. Fabrication method and characterization of electrodeposited and heat-treated iridium oxide films for pH sensing // Sens. Actuators B. 2014. V. 196. P. 31.
Nguyen C.M., Rao S., Seo Y., Schadt K., Hao Y., Chiao J.C. Micro pH sensors based on iridium oxide nanotubes // IEEE Trans. Nanotechnol. 2014. V. 13. № 5. P. 945.
Prats-Alfonso E., Abad L. Casañ-Pastor N., Gonzalo-Ruiz J., Baldrich E. Iridium oxide pH sensor for biomedical applications. Case urea–urease in real urine samples // Biosens. Bioelectron. 2013. V. 39. № 1. P. 163.
Yao S. Wang M., Madou M. pH electrode based on melt-oxidation iridium oxide // J. Electrochem. Soc. 2001. V. 148. № 4. P. H29.
Razmi H., Heidari H., Habibi Es. pH-sensing properties of PbO2 thin film electrodeposited on carbon ceramic electrode // J. Solid State Electrochem. 2008. V. 12. № 12. P. 1579.
Fog A., Buck R.P. Electronic semiconducting oxides as pH sensors // Sens. Actuators. 1984. V. 5. № 2. P. 137.
Maurya D.K., Sardarinejad A., Alameh K. High-sensitivity pH sensor employing a sub-micron ruthenium oxide thin-film in conjunction with a thick reference electrode // Sens. Actuators A. 2013. V. 203. P. 300.
Sardarinejad A., Maurya D.K., Alameh K. The effects of sensing electrode thickness on ruthenium oxide thin-film pH sensor // Sens. Actuators A. 2014. V. 214. P. 15.
Liao Y.-H., Chou J.-C. Preparation and characteristics of ruthenium dioxide for pH array sensors with real-time measurement system // Sens. Actuators B. 2008. V. 128. № 2. P. 603.
Pan C.-W., Chou J.-C., Sun T.-P., Hsiung S.-K. Development of the real-time pH sensing system for array sensors // Sens. Actuators B. 2005. V. 108. № 1–2. P. 870.
Chen M., Jin Y., Qu X., Jin Q., Zhao J. Electrochemical impedance spectroscopy study of Ta2O5-based EIOS pH sensors in acid environment // Sens. Actuators B. 2014. V. 192. P. 399.
Chou J.C., Liu C.H., Chen C.C. Electrochromic property of sol−gel derived TiO2 thin film for pH sensor // IFMBE Proc. 2011. V. 35. P. 69.
Gill E., Arshak K., Arshak A., Korostynska O. Mixed metal oxide films as pH sensing materials // Microsyst. Technol. 2008. V. 14. № 10. P. 499.
Маринина Г.И., Васильева М.С., Лапина А.С. Поведение пленочного оксидного рутениево-титанового электрода в потенциометрии // Журн. аналит. химии. 2012. Т. 67. № 6. С. 608. (Marinina G.I., Vasilyeva M.S., Lapina A.S. Behavior of a ruthenium-titanium oxide film electrode (RTOE) in potentiometry // J. Analyt. Chem. 2012. V. 67. № 6. P. 550).
Pocrifka L.A., Gonçalves C., Grossi P., Colpa P.C., Pereira E. C. Development of RuO2–TiO2 (70–30) mol % for pH measurements // Sens. Actuators B. 2006. V. 113. № 2. P. 1012.
Ghalwa N.A., Hamada M., Abu-Shawish H.M., Swareh A.A., Askalany M.A., Siam T. Using of Ti/Co3O4/PbO2/(SnO2 + Sb2O3) modified electrode as indicator electrode in potentiometric and conductometric titration in aqueous solution // J. Electroanal. Chem. 2012. V. 664. P. 7.
Hamada M. Development of Ti/PbO2/Sb2O3 electrode as indicator electrode for pH measurements and conductometric titrations in aqueous solutions // Int. J. Pharm. Bio. Sci. 2014. V. 5. № 1. P. 50.
Маринина Г.И., Шуб Д.М., Прочанкин С.Ю. Исследование электроаналитических свойств композиционных металлоксидных электродов // Изв. ВУ-Зов. Химия и хим. технология. 1984. Т. 27. № 8. С. 900.
Arida H. Novel pH microsensor based on a thin film gold electrode modified with lead dioxide nanoparticles // Microchim. Acta. 2015. V. 182. № 1–2. P. 149.
Betelu S., Polychronopoulou K., Rebholz C., Ignatiadis I. Novel CeO2-based screen-printed potentiometric electrodes for pH monitoring // Talanta. 2011. V. 87. P. 126.
Shin P.K. The pH-sensing and light-induced drift properties of titanium dioxide thin films deposited by MO-CVD // Appl. Surf. Sci. 2003. V. 214. № 1–4. P. 214.
Zhao R., Xu M., Wang J., Chen G. A pH sensor based on the TiO2 nanotube array modified Ti electrode // Electrochim. Acta. 2010. V. 55. № 20. P. 5647.
Simić M., Manjakkal L., Zaraska K., Stojanović G.M., Dahiya R. TiO2 based thick film pH sensor // IEEE Sens. J. 2016. V. 17. №. 2. P. 248.
Гордиенко П.С. Образование покрытий на аноднополяризованных электродах в водных электролитах при потенциалах искрения и пробоя. Владивосток: Дальнаука, 1996. 216 с.
Маринина Г.И., Резник М.Ф., Тырин В.И., Гордиенко П.С. Электроаналитические свойства некоторых пленочных оксидных электродов // Журн. аналит. химии. 1996. Т. 51. № 9. С. 975. (Marinina G.I., Reznik M.F., Tyrin V.I., Gordienko P.S. Electroanalytical properties of some oxide film electrodes // J. Analyt. Chem. 1996. V. 51. № 9. P. 896.)
Marinina G.I., Vasilyeva M.S., Lapina A.S., Ustinov A.Yu., Rudnev V.S. Electroanalytical properties of metal–oxide electrodes formed by plasma electrolytic oxidation // J. Electroan. Chem. 2013. V. 689. P. 262.
Маринина Г.И., Лапина А.С., Васильева М.С., Арефьева О.Д., Кондриков Н.Б. Металлоксидные электроды, полученные плазменно-электролитическим оксидированием, для потенциометрического определения щелочности и хлоридов в техногенных водах // Аналитика и контроль. 2013. Т. 17. № 3. С. 281.
Vasilyeva M.S., Rudnev V.S., Arefieva O.D., Lapina A.S., Plyusnina V.I., Marinina G.I. Ti/TiO2 indicator electrodes formed by plasma electrolytic oxidation for potentiometric analysis // Int. J. Environ. Anal. Chem. 2016. V. 96. № 12. P. 1128.
Yerokhin A.L., Nie X., Leyland A., Matthews A., Dowey S.J. Plasma electrolysis for surface engineering // Surf. Coat. Technol. 1999. V. 122. № 2−3. P. 73.
Суминов И.В., Белкин П.Н., Эпельфельд А.В., Людин В.Б., Крит Б.Л., Борисов A.M. Плазменно-электролитическое модифицирование поверхности металлов и сплавов. В 2-х тт. Т. 2 / Под ред. Суминова И.В. М.: Техносфера, 2011. 512 с.
Serrano N., Díaz-Cruz J.M., Ariño C., Esteban M. Antimony- based electrodes for analytical determinations // Trends Anal. Chem. 2016. V. 77. P. 203.
Lakhdar M.H., Smida Y.B., Amlouk M. Synthesis, optical characterization and DFT calculations of electronic structure of Sb2O3 films obtained by thermal oxidation of Sb2S3 // J. Alloys Compd. 2016. V. 681. P. 197.
Tan Y., Chen L., Chen H., Hou Q., Chen X. Synthesis of a symmetric bundle-shaped Sb2O3 and its application for anode materials in lithium ion batteries // Mater. Lett. 2018. V. 212. P. 103.
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. Handbook of X-ray Photoelectron Spectroscopy. Eden Prairie, MN, USA: Physical Electronics Inc., 1995. 261 c.
Вовна В.И., Гнеденков С.В., Гордиенко П.С., Кузнецов М.В., Синебрюхов С.Л., Чередниченко А.И., Хрисанфова О.А. Рентгеноэлектронное исследование поверхностных слоев на титане, полученных методом микродугового оксидирования // Электрохимия. 1998. Т. 34. № 10. С. 1208. (Vovna V.I., Gnedenkov S.V., Gordienko P.S., Kuznetsov M.V., Sinebryukhov S.L., Cherednichenko A.I., Khrisanfova O.A. Surface layers produced on titanium by microarc oxidation: An X-ray diffractometry study // Russ. J. Electrochem. 1998. V. 34. № 10. P. 1090).
Руднев В.С., Ваганов-Вилькинс А.А., Устинов А.Ю., Недозоров П.М. Углерод в оксидных слоях, формируемых действием электрических разрядов // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 3. С. 277. (Rudnev V.S., Vaganov-Vil’Kins A.A., Ustinov A.Y., Nedozorov P.M. Carbon in oxide layers formed under electric discharge conditions // Prot. Met. Phys. Chem. Surf. 2011. V. 47. № 3. P. 330).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


