Журнал аналитической химии, 2020, T. 75, № 3, стр. 273-280
Особенности определения микроэлементного состава ногтей человека
С. С. Савинов a, *, Р. М. Шарыпова a, А. И. Дробышев a
a Санкт-Петербургский государственный университет, Институт химии
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: s.s.savinov@spbu.ru
Поступила в редакцию 27.05.2019
После доработки 20.06.2019
Принята к публикации 14.09.2019
Аннотация
Экспериментально установлены особенности анализа образцов ногтей человека на содержание микроэлементов методом дуговой атомно-эмиссионной спектрометрии по способу сухого остатка после кислотной минерализации. Наблюдается относительное постоянство концентраций определяемых элементов при мониторинге в течение 6–10 месяцев. Для одного донора содержание кадмия кратковременно увеличивалось, что по времени совпало с непродолжительным изменением места пребывания. Таким образом подтверждена возможность использования ногтей как источника информации о прошедшем воздействии. Показано, что содержания Mg, Cu и Zn в выборке из 73 образцов различных доноров подчиняются нормальному закону, содержания Al и Ca – логнормальному. Выявлено влияние пола доноров на содержание меди в ногтях, на содержание свинца влияет курениe доноров (в последнем случае недостаточная статистическая значимость может быть обусловлена небольшим количеством курящих доноров и невозможностью определения концентрации во всех образцах). Обнаружены положительные корреляции между содержаниями ряда элементов, в частности, Mg/Ca, Cu/Zn, Cu/Al, Cu/Mg, Cd/Pb, отрицательная корреляция Ca/Cd.
Стабильность химического состава организма является одним из важнейших и обязательных условий его нормального функционирования, поскольку отклонения в содержании химических элементов, вызванные экологическими, профессиональными, климатогеографическими факторами или заболеваниями приводят к широкому спектру нарушений в состоянии здоровья [1, 2]. Для получения информации о концентрациях микроэлементов в организме человека используют различные образцы [3, 4], которые имеют свои преимущества и ограничения. Производные эпидермиса (волосы, ногти) являются информативным материалом, поскольку фиксируют состав и соотношение накопленных за фазу роста веществ и микроэлементов [5]. Ногти имеют ряд преимуществ для микроэлементного анализа: неинвазивность пробоотбора (по сравнению с отбором образцов крови и тканей), простота транспортировки, возможность длительного хранения образцов без специальных условий, возможность оценки как краткосрочного, так и долгосрочного воздействия, выявление динамики накопления веществ [3, 6]. Ногти имеют преимущества по сравнению с волосами, поскольку элементный состав последних зависит от их цвета (что необходимо учитывать при сравнительном анализе) [7].
Для корректного применения биомаркеров необходимо учитывать следующие факторы: пол, возраст, диету, социально-экономический статус, условия экспозиции, генную изменчивость и чувствительность, поскольку они способны влиять на содержание элементов в организме [3, 8]. Можно привести ряд примеров, иллюстрирующих подобное влияние: различаются содержания Ca, Mg, Sr, Zn, Cu и Pb в зубах доноров разных возраста и пола, содержание Sr – в зубах разных типов [9]; изменяются с возрастом и зависят от пола содержания Cu и Zn в определенных местах сетчатки глаза человека (а также связаны с накоплением кадмия) [10]; в биообразцах женщин (кровь, моча, волосы, слюна) по сравнению с мужчинами больше содержания Cr и Ni и меньше содержание Mn [11]; концентрации Ca, Cu, Fe, Mg, Zn значимо отличаются в различных твердых биопробах (волосы, ногти) у мужчин и женщин [12]. С возрастом увеличивается концентрация кадмия в моче [13], а также в крови и слюне [11]. Содержания Ni [14] и Cd [15] в ногтях курящих и некурящих людей различаются. Концентрации Cd и Pb выше в образцах ногтей доноров, проживающих в городах, по сравнению с донорами из сельской местности, для Fe и Zn наблюдается обратная тенденция [6]. Содержания As и Cd выше в волосах и ногтях доноров, потребляющих воду из подземных источников, в отличие от доноров, пользующихся централизованным водоснабжением [16]. Концентрации Cu и Zn выше в образцах ногтей доноров-вегетарианцев [14].
Цель данной работы – изучение особенностей ногтей человека как анализируемого объекта при определении в них макро- и микроэлементов, что поможет выявить возможности и ограничения использования данной биопробы при проведении биомониторинга.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы ногтей отбирали путем среза стальными ножницами (предварительно обработанными этиловым спиртом) со всех пальцев обеих рук, помещали в чистые полиэтиленовые пакеты и анонимизировали. Волонтеры – люди в возрасте от 9 до 68 лет, большинство из которых проживает в Санкт-Петербурге более 5 лет. Для удаления поверхностного загрязнения каждый образец массой ~0.1 г промывали порцией (~5 мл) деионированной воды 18.2 МОм/см (Аквилон, Россия) и ацетона (~5 мл) ос. ч. (Вектон, Россия). Затем образцы высушивали, взвешивали и минерализовали по схеме, описанной ранее [17]. Навеску пробы ~0.1 г помещали в предварительно очищенный тефлоновый автоклав, добавляли 1 мл конц. HNO3 ос. ч. (Вектон, Россия) и 1 мл конц. H2O2 ос. ч. (НеваРеактив, Россия). Автоклав устанавливался в микроволновую печь MDS-6 (Sineo, Китай). Разложение проводили при 1.2 МПа в течение 10 мин, после чего система остывала в течение 20 мин. Полученный раствор количественно переносили в мерную колбу емк. 2 мл, общий объем раствора доводили до метки деионированной водой.
В качестве основы для определения элементов в минерализатах ногтей использовали методику прямого дугового атомно-эмиссионного анализа слюны и минерализатов волос человека [17–21]. Ее достоинствами являются существенно меньшая стоимость оборудования и расходных материалов по сравнению с атомно-эмиссионной спектрометрией с индуктивно связанной плазмой и отсутствие влияния состава и содержания биоматрицы на правильность результатов анализа за счет использования спектрального буфера [19, 20]. Угольные электроды изготавливали из стержней класса F (Карботек, Россия), проводили их обжиг в дуговом разряде при силе тока 20 А в течение 20 с для удаления микропримесей. Затем на торце электродов выпаривали по одной капле (20 мкл) раствора (0.3 мас. %) полистирола в толуоле ос. ч. (Вектон, Россия) для создания защитной пленки. На подготовленные электроды последовательно наносили и высушивали под ИК-лампой по 10 капель (по 10 мкл каждая) минерализата. Затем в качестве легкоионизируемой добавки на торец электрода наносили и выпаривали каплю (10 мкл) раствора NaCl (15 г/л), приготовленного с использованием NaCl ос. ч. (Merck, Германия) и деионированной воды.
Электрод с пробой и противоэлектрод устанавливали в штатив дугового разряда с межэлектродным расстоянием 3 мм. Спектры регистрировали на установке МФС‑8 (ЛОМО, Россия) с детектором МАЭС (ВМК-Оптоэлектроника, Россия) [22], который регистрирует спектр в интервале 197‒343 нм. Для увеличения светосилы использовали ширину входной щели 50 мкм [23, 24]. Для электропитания дугового разряда переменного тока использовали генератор ИВС‑28 (АОМЗ, Россия) с дополнительным внешним сопротивлением. Для управления работой системы и обработки данных применяли программу “Атом” [25]. Спектр пробы возбуждали при силе тока 20 А. Время полной экспозиции спектра составляло 20 с, время базовой экспозиции – 2 с. Для каждого минерализата выполняли по 8 параллельных определений. В качестве аналитического сигнала использовали интегральную по длинам волн интенсивность спектральной линии за вычетом уровня фонового излучения дугового разряда с учетом сигнала контрольного опыта [26].
Растворы сравнения для построения градуировочных графиков готовили путем разбавления деионированной водой стандартного многоэлементного раствора CertiPUR IV (Merck, Германия) с концентрацией элементов 1 мг/мл. Градуировочные графики, построенные в логарифмических координатах, прямолинейны в диапазоне до четырех‒пяти порядков величины содержания аналитов. Проверка правильности путем сравнительного анализа одного образца по описанной схеме с различным наносимым на торец электрода объемом пробы подтвердила отсутствие влияния макросостава на результаты анализа [17].
Поскольку этапы пробоподготовки и измерения сигнала занимают значительное время, в ряде случаев (например, при анализе большого количества образцов) экономически целесообразно выполнять минерализацию нескольких проб, а затем определять в них элементы, причем последнюю операцию можно отложить во времени. Однако данный вариант можно использовать только в случае, если при хранении минерализатов не происходит потерь аналитов (например, за счет сорбции на стенках посуды или образования малорастворимых форм). Для проверки возможности хранения образцов выполнили серию анализов проб через различные промежутки времени между пробоподготовкой и измерением: сразу после минерализации, через 2 дня и через 8 дней. Обнаружено, что даже по истечении 8 дней не происходит значимого изменения аналитического сигнала. Таким образом, растворы после микроволнового разложения устойчивы в течение продолжительного времени, что позволяет разделить во времени процедуры пробоподготовки и определения содержаний элементов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
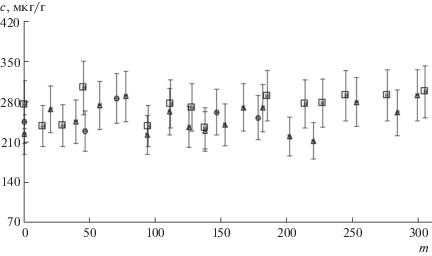
Возможность использования концентраций элементов в биопробах в качестве биомаркера обусловлена, среди прочего, постоянством их значений в отсутствие влияния внешних факторов. Для того, чтобы узнать, как меняется содержание элементов в течение длительного периода в ногтях одного и того же человека, у трех доноров в течение 6–10 мес. отбирали и анализировали образцы ногтей. Полученные данные свидетельствуют об относительном постоянстве концентраций определяемых элементов, отклонения результатов анализа единичных проб от среднего значения обычно не превышают 30% (на рис. 1 представлена для примера зависимость для цинка). Поскольку концентрации элементов не изменяются в течение продолжительного времени, выявление их существенного изменения может свидетельствовать о наличии какого-либо внешнего воздействия на организм человека.
Рис. 1.
Концентрация цинка в образцах ногтей трех доноров при продолжительном мониторинге (m – день взятия образца): (◻) – донор 1, (∆) – донор 2, (⚪) – донор 3.
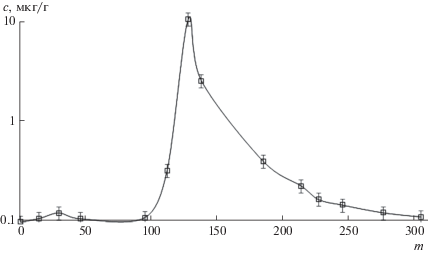
При мониторинге содержания кадмия в образцах одного из доноров (рис. 2) обнаружено резкое увеличение его содержания, что по временным рамкам совпало с непродолжительным изменением места пребывания донора (данная информация была получена в результате дополнительного анкетирования). После возвращения на постоянное место жительства содержание кадмия постепенно уменьшилось до выхода на постоянное значение, совпавшее с исходным. Данный пример может служить подтверждением возможности использования ногтей как источника информации о прошедшем воздействии.
Рис. 2.
Концентрация кадмия (логарифмическая шкала) в образцах ногтей одного донора при продолжительном мониторинге (m – день взятия образца).
Проанализированы 73 образца ногтей различных доноров. Для расчета среднего содержания элементов в ногтях в выборке проб описано использование среднего арифметического [6, 14–16], среднего геометрического [27] и/или медианы [15, 16]. Мы считаем, что способ расчета среднего следует выбирать в зависимости от вида распределения содержания элемента в серии проб. Для обработки данных применяли программное обеспечение Statistica (StatSoft, США), для установления вида распределения каждого элемента в выборке проб использовали χ2-критерий Пирсона (с доверительной вероятностью 0.95) [28]. В данной работе вид распределения устанавливали для элементов, которые были достоверно обнаружены в большинстве проб ногтей исходной серии (Al, Ca, Cu, Mg, Zn).
На первом этапе оценивали соответствие нормальному закону. После построения экспериментальных распределений содержаний элементов в пробах обнаружено, что это соответствие выполняется только для Mg, Cu и Zn. При этом для меди значение χ2-критерия, равное 12.3, оказалось близким к критическому 14.1, что может свидетельствовать о влиянии внешних (субпопуляционных) факторов на распределение элемента. Распределения Al и Ca не подчиняются нормальному закону (на рис. 3а для примера приведено распределение для кальция), значения χ2-критерия для них существенно выше критического. По этой причине далее поводили проверку соответствия логнормальному распределению, т.е. нормальному распределению логарифмов концентраций элементов (поскольку форма экспериментально полученных распределений (см. пример на рис. 3а) близка к логнормальному закону). В этом случае, как видно из рис. 3б, функция соответствует логнормальному распределению, значения χ2-критерия меньше критического значения. Следует отметить, что несоответствие нормальному закону также установлено для ряда элементов в различных биопробах [11, 19, 29, 30]. После установления закона распределения рассчитали средние значения и диапазоны содержаний в серии проб (табл. 1); для элементов, которые не были обнаружены в большинстве образцов, указаны медианы и верхние границы диапазона. Для сравнения в табл. 1 приведены концентрации элементов, определенные в ногтях человека другими исследователями. Видно, что они различаются между собой по всем цитируемым публикациям, что, вероятно, связано с проживанием доноров образцов в разных географических регионах, “микроэлементная” экология которых различна. Тем не менее, с учетом диапазонов содержаний элементов наблюдается согласованность с литературными данными.
Рис. 3.
Частотное распределение концентрации (а) и логарифма концентрации (б) кальция в ногтях для всей выборки проб.
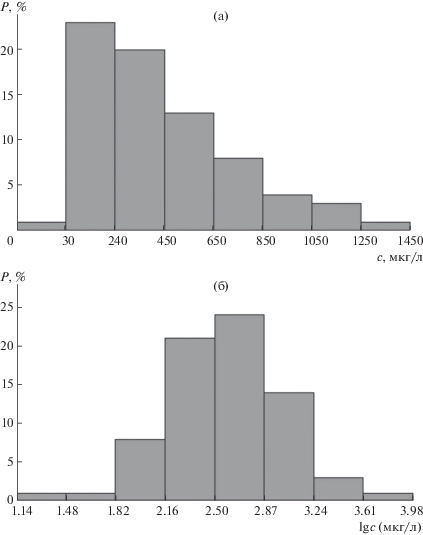
Таблица 1.
Среднестатистические концентрации (мкг/г) микроэлементов (с указанием диапазона концентраций в выборке проб) в ногтях человека
| Элемент | Данная работаа | [6]* | [12]* | [14]* | [15]*/** | [16]*/** | [27]*** | [31]** |
|---|---|---|---|---|---|---|---|---|
| Ag | 0.19** (<8.3), 49 |
–**** | – | – | 0.108/0.294 (0.019–1.76) |
– | 0.184 (0.033–7.57) |
– |
| Al | 5.5*** (0.33–54), 73 |
– | – | – | 32/36 (12–137) |
– | 8.62 (0.78–49.6) |
– |
| Ca | 337*** (14–1274), 73 |
96.8 (28.5–344.5) |
710 | – | 650/670 (345–1160) |
– | 464 (116–1040) |
– |
| Cd | 0.15** (<17), 60 |
0.73 (<3.70) |
0.25 | 0.99 | 0.061/0114 (0.013–0.438) |
0.024/0.074 (<2.125) |
– | – |
| Cr | <10** (<21), 12 |
– | 1.81 | 86.62 | 0.76/1.16 (0.224–3.20) |
– | – | – |
| Cu | 2.9* (1.13–10), 73 |
– | 7.6 | 7.63 | 7.6/8.4 (4.2–17) |
– | 5.18 (2.96–10.4) |
4.90 (1.80–22.0) |
| Fe | 16** (<58), 40 |
66.9 (27.5–166.0) |
53.7 | 286.6 | 37/42 (12–189) |
– | 17.7 (10.2–41.2) |
– |
| Mg | 93* (4.5–264), 73 |
– | 94.2 | – | 93/100 (55–191) |
– | 77.6 (28.4–174) | – |
| Mn | <0.4** (<1.2), 17 |
– | – | 10.17 | 0.650/0.900 (0.19–3.30) |
– | 0.482 (0.117–1.76) | – |
| Ni | <2** (<13), 24 |
– | 2.88 | 56.24 | 0.84/1.65 (0.14–6.95) |
– | – | – |
| Pb | 0.29** (<25), 49 |
27.5 (7.0–30.0) |
1.18 | 20.21 | 1.06/1.38 (0.27–4.75) |
9.574/70.98 (1.71–4956) |
– | – |
| Zn | 259* (175–446), 73 |
94.8 (34.4–317.0) |
138.5 | 180.6 | 116/120 (80–191) |
– | 104 (80.4–159) | 79 (27–183) |
а Последним для каждого элемента указано число проб из общей выборки из 73 образцов, в которых он был обнаружен. * В качестве среднего значения указано среднее арифметическое; ** в качестве среднего значения указана медиана; *** в качестве среднего значения указано среднее геометрическое; **** элемент в данной работе не определяли.
В данной работе влияние различных факторов устанавливали с помощью однофакторного дисперсионного анализа с использованием программного обеспечения Statistica (StatSoft, США). Выявлено влияние (уровень значимости 0.05) пола донора на содержание меди: среднее содержание элемента в ногтях доноров-мужчин (n = 35) составило 2.7 ± 0.3 мкг/г, в ногтях доноров-женщин (n = 38) – (3.8 ± 0.3) мкг/г. В литературе также упоминается влияние данного фактора на содержание в ногтях ряда элементов, в частности, Bi, Na, Mg, Si, K [15], Cr и Pb, хотя наблюдаемая разница в концентрации меди оказалась статистически незначимой [12].
Рассматривали также влияние курения на концентрации элементов в ногтях. Обнаружено, что содержание свинца в ногтях курящих людей (4 ± 1 мкг/г, n = 13) превышает его содержание в ногтях некурящих людей (1.4 ± 0.6 мкг/г, n = 60). Однако из-за небольшого числа курящих доноров, а также невозможности определения концентрации элемента во всех образцах от некурящих доноров, выявленное различие не является статистически значимым при уровне значимости 0.05. Отметим, что повышение концентрации свинца (а также Cd и Cu) в ногтях курящих доноров по сравнению с некурящими обнаружено и другими исследователями [14]. В то же время в некоторых работах различие в содержании свинца не являлось статистически значимым (в отличие от кадмия, концентрация которого в ногтях курящих доноров была выше) [15, 16]. Для прочих изучаемых факторов (включая возраст доноров и регион проживания) не удалось выявить значимого влияния, что может быть обусловлено как небольшим объемом выборки проб, так и невозможностью определения большого количества элементов во всех образцах.
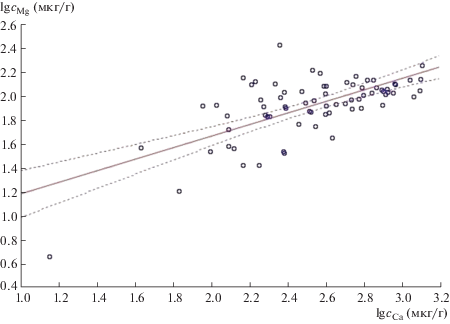
Помимо выявления влияния различных факторов на содержание элементов при статистической обработке полученных результатов проводили корреляционный анализ с помощью программного обеспечения Statistica (StatSoft, США) с уровнем значимости 0.05. Наиболее выраженная корреляция имеет место для логарифмов концентраций Mg и Ca (рис. 4), хотя обнаружена зависимость и для самих концентраций (r = 0.676 и 0.458 соответственно). Также выявлены связи логарифмов концентраций Al/Ca (r = 0.510), Al/Mg (r = 0.488). Более слабые зависимости (r < 0.3) обнаружены для Cu/Zn, Cu/Al, Cu/Mg, Cd/Pb, отрицательная корреляция для Ca/Cd (в последних двух случаях рассматривали данные только для образцов, в которых элементы были достоверно определены). В литературе также упоминаются корреляции между содержаниями различных элементов в ногтях, в частности, содержание Pb и Cd отрицательно коррелирует с содержанием Zn и Fe (Pb/Zn r = –0.256; Pb/Fe r = –0.188; Cd/Fe r = = –0.241) [6], обнаружена корреляция Cu/Zn с r = = 0.68 [31], щелочных металлов (Cs/Rb r = 0.59, K/Na r = 0.91), щелочноземельных металлов (Sr/Mg r = 0.91) [15] и некоторых других элементов (Na/K r = 0.859, Na/Mg r = 0.359, Na/Se r = –0.388) [27]. Выявление корреляций может помочь в понимании способов попадания элементов в организм и механизмов их влияния, а существенное несоблюдение корреляций в индивидуальных случаях – в обнаружении отклонений в организме.
* * *
Таким образом, показано, что в связи с относительным постоянством концентраций микроэлементов в ногтях в течение продолжительного мониторинга выявление их существенного изменения может свидетельствовать о наличии какого-либо внешнего воздействия на организм. Поскольку концентрации не всех элементов подчиняются нормальному распределению, в качестве среднего значения содержания в выборке образов необходимо использовать адекватный параметр (среднее арифметическое, среднее геометрическое, медиану). Показано влияние ряда индивидуальных и субпопуляционных факторов на содержание ряда микроэлементов в биопробах, что необходимо учитывать для корректного сопоставления результатов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00022 мол_а. Авторы выражают благодарность ресурсному центру Научного парка СПбГУ “Ресурсный Образовательный Центр по направлению химия” и ООО “ВМК-Оптоэлектроника”, чье оборудование было использовано при выполнении исследования.
Список литературы
Авцын А.П., Жаворонков А.А., Риш М.А., Строчкова Л.С. Микроэлементозы человека. Этиология, классификация, органопатология. М.: Медицина, 1991. 496 с.
Скальный А.В. Микроэлементозы человека: гигиеническая диагностика и коррекция // Микроэлементы в медицине. 2000. № 1. С. 2.
Esteban M., Castano A. Non-invasive matrices in human biomonitoring: A review // Environ. Int. 2009. V. 35. № 2. P. 438.
Нагорная Н.В., Дубовая А.В. Нарушения минерального обмена у человека (методическое пособие для врачей). Донецк, 2006. 82 с.
МУ 4.2.2039-05 (утв. Роспотребнадзором 23.12.2005).
Were F.H., Njue W., Murungi J., Wanjau R. Use of human nails as bio-indicators of heavy metals environmental exposure among school age children in Kenya // Sci. Total Environ. 2008. V. 393. № 2–3. P. 376.
Chojnacka K., Gorecka H., Gorecki H. The effect of age, sex, smoking habit and hair color on the composition of hair // Environ. Toxicol. Pharmacol. 2006. V. 22. № 1. P. 52.
Kakkar P., Jaffery F.N. Biological markers for metal toxicity // Environ. Toxicol. Pharmacol. 2005. V. 19. № 2. P. 335.
Burguera E., Romero Z., Burguera M., Burguera J.L., de Arenas H., Rondon C., di Bernado M.L. Determination of some cationic species in temporary teeth // J. Trace Elem. Med. Biol. 2002. V. 16. № 2. P. 103.
Wills N.K., Ramanujam V.M.S., Kalariya N., Lewis J.R., van Kuijk F.J.G.M. Copper and zinc distribution in the human retina: Relationship to cadmium accumulation, age, and gender // Exp. Eye Res. 2008. V. 87. № 2. P. 80.
Gil F., Hernandez A.F., Marquez C., Femia P., Olmedo P., Lopez-Guarnido O., Pla A. Biomonitorization of cadmium, chromium, manganese, nickel and lead in whole blood, urine, axillary hair and saliva in an occupationally exposed population // Sci. Total Environ. 2011. V. 409. № 6. P. 1172.
Przybylowicz A., Chesy P., Herman M., Parczewski A., Walas S., Piekoszewski W. Examination of distribution of trace elements in hair, fingernails and toenails as alternative biological materials. Application of chemometric methods // Cent. Eur. J. Chem. 2012. V. 10. № 5. P. 1590.
Kippler M., Nermell B., Hamadani J., Tofail F., Moore S., Vahter M. Burden of cadmium in early childhood: Longitudinal assessment of urinary cadmium in rural Bangladesh // Toxicol. Lett. 2010. V. 198. № 1. P. 20.
Mehra R., Juneja M. Fingernails as biological indices of metal exposure // J. Biosci. 2005. V. 30. № 2. P. 253.
Rodushkin I., Axelsson M.D. Application of double focusing sector field ICP-MS for multielemental characterization of human hair and nails. Part II. A study of the inhabitants of northern Sweden // Sci. Total Environ. 2000. V. 262. № 1–2. P. 21.
Wongsasuluk P., Chotpantarat S., Siriwong W., Robson M. Using hair and fingernails in binary logistic regression for bio-monitoring of heavy metals/metalloid in groundwater in intensively agricultural areas, Thailand // Environ. Res. 2018. V. 162. P. 106.
Савинов С.С., Будаляева Р.М., Дробышев А.И. Атомно-эмиссионный анализ ногтей человека на содержание микроэлементов // Журн. аналит. химии. 2018. Т. 73. № 2. С. 106. (Savinov S.S., Budalyaeva R.M., Drobyshev A.I. Atomic emission analysis of human nails for the content of trace elements // J. Analyt. Chem. 2018. V. 73. №. 2. P. 133.)
Савинов С.С., Анисимов А.А., Дробышев А.И. Проблемы и оптимизация отбора образцов, их хранения и пробоподготовки при определении микроэлементного состава слюны человека // Журн. аналит. химии. 2016. Т. 71. № 10. С. 1063. (Savinov S.S., Anisimov A.A., Drobyshev A.I. Problems and optimization of sampling, storage, and sample preparation in the determination of the trace element composition of human saliva // J. Analyt. Chem. 2016. V. 71. № 10. P. 1016.)
Дробышев А.И., Рядчикова Н.А., Савинов С.С. Атомно-эмиссионный анализ волос человека на содержание микроэлементов // Журн. аналит. химии. 2016. Т. 71. № 7. С. 745. (Drobyshev A.I., Ryadchikova N.A., Savinov S.S. Atomic emission analysis of human hair for the presence of trace elements // J. Analyt. Chem. 2016. V. 71. № 7. P. 717.)
Дробышев А.И., Савинов С.С. Дуговой атомно-эмиссионный цифровой спектрографический анализ жидких биопроб с использованием МАЭС // Заводск. лаборатория. Диагностика материалов. 2015. № 1 (II). С. 142.
Савинов С.С., Дробышев А.И. Возможности атомно-эмиссионной цифровой спектрографии с дуговым возбуждением спектра в анализе жидких объектов // Вестн. СПбГУ. Серия 4: физика, химия. 2013. № 3. С. 98.
Лабусов В.А., Гаранин В.Г., Шелпакова И.Р. Многоканальные анализаторы атомно-эмиссионных спектров. Современное состояние и аналитические возможности // Журн. аналит. химии. 2012. Т. 67. № 7. С. 697. (Labusov V.A., Garanin V.G., Shelpakova I.R. Multichannel analyzers of atomic emission spectra: current state and analytical potentials // J. Analyt. Chem. 2012. V. 67. № 7. P. 632.)
Дробышев А.И., Савинов С.С. Экспериментальное исследование светосилы цифрового спектрографа на базе МФС−МАЭС // Оптика и спектроскопия. 2016. Т. 120. № 2. С. 349. (Drobyshev A.I., Savinov S.S. An experimental study of the luminosity of an MFC–MAES-based digital spectrograph // Optics Spectrosс. 2016. V. 120. № 2. P. 335.)
Дробышев А.И., Савинов С.С. Экспериментальное исследование аппаратной функции и разрешающей способности оптического цифрового спектрографа на базе полихроматора МФС // Оптический журн. 2014. Т. 81. № 1. С. 44. (Drobyshev A.I., Savinov S.S. Experimental study of the spread function and resolving power of an optical digital spectrograph based on an MFS polychromator // J. Optic. Technol. 2014. V. 81. № 1. P. 33.)
Гаранин В.Г., Неклюдов О.А., Петроченко Д.В., Семёнов З.В., Шаталов И.Г., Панкратов С.В. Программное обеспечение атомно-эмиссионного спектрального анализа (программа “Атом”) // Заводск. лаборатория. Диагностика материалов. 2012. Т. 78. № 1(2). С. 69.
Дробышев А.И., Савинов С.С. О некоторых особенностях регистрации спектра и фотометрирования спектральных линий с помощью цифрового спектрографа на базе МФС–МАЭС // Приборы и техника эксперимента. 2013. № 6. С. 56. (Drobyshev A.I., Savinov S.S. On certain features of spectrum recording and photometric measurements of spectral lines using a MFS–MAES-based digital spectrograph // Instrum. Exp. Tech. 2013. V. 56. № 6. P. 693.)
Wee B.S., Ebihara M. Neutron activation analysis and assessment of trace elements in fingernail from residents of Tokyo, Japan // Sains Malaysiana. 2017. V. 46. № 4. P. 605.
Родинков О.В., Бокач Н.А., Булатов А.В. Основы физико-химических измерений и химического анализа. СПб: ВВМ, 2010. 132 с.
Савинов С.С., Анисимов А.А., Зверьков Н.А., Разживин А.В., Дробышев А.И. Определение элементов в слюне человека методом дуговой атомно-эмиссионной спектрометрии с использованием МАЭС // Заводск. лаборатория. Диагностика материалов. 2019. Т. 85. № 1 (II). С. 67.
Wilhelm M., Pesch A., Rostek U., Begerow J., Schmitz N., Idel H., Ranft U. Concentrations of lead in blood, hair and saliva of German children living in three different areas of traffic density // Sci. Total Environ. 2002. V. 297. № 1–3. P. 109.
Gerhardsson L., Englyst V., Lundstrom N.G., Sandberg S., Nordberg G. Cadmium, copper and zinc in tissues of deceased copper smelter workers // J. Trace Elem. Med. Biol. 2002. V. 16. № 4. P. 261.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии