Журнал аналитической химии, 2020, T. 75, № 3, стр. 266-272
Количественное определение основного вещества противовирусного препарата Триазид® с использованием метода вольтамперометрии
Н. А. Малахова a, *, А. В. Ивойлова a, А. А. Замана a, В. Л. Русинов a, b, И. С. Алямовская a, А. В. Иванова a, А. Н. Козицина a
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Химико-технологический институт
620002 Екатеринбург, ул. Мира, 19, Россия
b Институт органического синтеза Российской академии наук им. И.Я. Постовского
620990 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: n.a.malahova@urfu.ru
Поступила в редакцию 02.08.2018
После доработки 04.10.2018
Принята к публикации 03.10.2019
Аннотация
Новый российский препарат Триазид® является высокоэффективным противовирусным средством. Активное вещество препарата (5-метил-6-нитро-7-оксо-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинид l-аргининия моногидрат, триазид) относится к соединениям азолоазинового ряда. С помощью метода циклической вольтамперометрии установлено, что электрохимическая активность триазида (ТД) в водных буферных растворах Бриттона−Робинсона (ББР) на стеклоуглеродном электроде обусловлена электровосстановлением нитрогруппы, связанной с сопряженной ароматической системой. Величина максимального тока восстановления триазида в интервале потенциалов 0.0–(–1.25) В использована в качестве аналитического сигнала. Разработан способ количественного определения триазида методом прямой катодной квадратно-волновой вольтамперометрии. Область линейности градуировочного графика с использованием разработанного метода в растворе ББР (рН 4) составляет 10–500 мг/л (R2 = 0.9998) с пределом обнаружения ТД 1.9 мг/л. Разработанный метод применен для анализа фармацевтической субстанции “Триазид” на содержание ТД. Полученные результаты удовлетворяют заявленным требованиям проекта фармакопейной статьи предприятия “ТРИАЗИД субстанция” на содержание ТД, определяемого методом ВЭЖХ.
Определение соединений с широким спектром полезной биологической активности, являющихся основой для создания новых лекарственных препаратов, – одна из важнейших задач аналитической химии. За последние два десятилетия число публикаций (база данных Scopus), посвященных вольтамперометрическому определению лекарственных препаратов, существенно выросло.
Основным условием для разработки электрохимического метода определения фармацевтического вещества является наличие электроактивной группы. Анализ литературы показал, что в случае нитросоединений наиболее полезным для количественного определения является сигнал электровосстановления нитрогруппы [1]. К преимуществам такого сигнала можно отнести как большое количество электричества, вырабатываемое на 1 моль электроактивного соединения, так и относительно низкую потребность в энергии для восстановления нитрогруппы. Это позволяет получать высокое соотношение ток/концентрация при низких потенциалах восстановления.
На основе нитросодержащих азолоазиниевых соединений Уральским федеральным университетом и Институтом органического синтеза (Уральский филиал Российской академии наук) разработаны лекарственные препараты с широким спектром противовирусного действия – Триазавирин® и Триазид®. Азолоазины, содержащие в структуре молекулы мостиковый атом азота – 1,2,4-триазоло[1,5-а]триазины и 1,2,4-триазоло[1,5-а]пиримидины, занимают важное место среди синтетических гетероциклических соединений, обладающих противовирусным действием. Интерес к азолоазинам обусловлен прежде всего их структурным сходством с нуклеиновыми основаниями. Благодаря этой особенности, они могут выступать в роли антиметаболитов, проявляя противовирусное действие.
Препарат Триазавирин® является зарегистрированным лекарственным препаратом, прошедшим все стадии клинических испытаний. Активн-ое вещество препарата (7-метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид натрия со структурой триазолотриазина, триазавирин) эффективно в отношении широкого спектра вирусов гриппа. Среди ряда структурных аналогов триазавирина – солей 5-метил-6-нитро-1,2,4-триазоло[1,5-a]пиримидин-7-онов – для проведения испытаний в качестве лекарственного средства был отобран триазид [2].
Биологический скрининг триазида методами in vitro и in vivo в НИИ гриппа (Санкт-Петербург) показал более высокую активность против вирусов гриппа по сравнению с близким по химическому строению триазавирином. В то же время острая токсичность триазида оказалась в несколько раз ниже по сравнению с триазавирином. Таким образом, при совместной оценке противовирусного действия и токсичности показано, что триазид является более эффективным по сравнению с соединением-прототипом [3]. В настоящее время ведутся клинические испытания препарата Триазид®.
Способы определения триазида в литературе не описаны. Имеющиеся данные по определению основного вещества в объектах фармации показывают, что вольтамперометрия (ВА) практически не уступает по чувствительности и селективности методу ВЭЖХ, который играет ключевую роль в фарманализе. При этом ВА отличается быстротой, простым, недорогим и портативным оборудованием, не требует применения токсичных органических растворителей и привлечения квалифицированного персонала и часто может служить альтернативой методу ВЭЖХ [4].
Цель данной работы – изучение вольтамперометрического поведения ТД на стеклоуглеродном электроде, разработка и оценка метрологических характеристик методики количественного определения активного вещества в фармацевтической субстанции “Триазид”.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы, образцы. Использовали водные растворы стандартного образца (СО) состава субстанции триазид и фармацевтической субстанции “Триазид”, предоставленные разработчиком – Институтом органического синтеза им. И.Я. Постовского УрО РАН. Около 0.5 г (точная навеска) СО или субстанции высушивали при температуре от 96 до 97°С не менее 5 ч в течение нескольких дней до постоянной массы. Основной водный раствор ТД с концентрацией 10 г/л готовили из СО и хранили в темноте при комнатной температуре. Рабочие растворы СО ТД готовили разведением основного раствора. Использовали кислоты и соли марки х. ч. от российских производителей без дополнительной очистки. Для приготовления растворов использовали деионизированную воду, полученную на установке ДВС-М/1НА(18)-N от (Медиана фильтр, Россия). Растворы ББР готовили согласно рекомендациям [5]. В качестве идентифицированной примеси применяли стандартный образец 5-метил-7-оксо-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинида L-аргининия. Для полировки поверхности стеклоуглеродного электрода применяли набор kit 6.2802.010 (Metrohm, Швейцария), включающий оксид алюминия с дисперсностью частиц 0.3 мкм и ткань.
Для подготовки лекарственной формы к анализу около 0.05 г субстанции “Триазид” (точная навеска) растворяли в воде в мерной колбе емк. 25 мл, доводили объем раствора до метки водой и тщательно перемешивали. Величину аликвотны испытуемого раствора пробы, помещаемую в электрохимическую ячейку, рассчитывали в соответствии с уравнением регрессии по градировочной кривой для определения ТД.
Оборудование и средства измерений. Электрохимические исследования проводили в стандартной трехэлектродной ячейке с использованием потенциостата/гальваностата μAutolab Type III (Metrohm, Швейцария) в комплекте с магнитной мешалкой. Индикаторным электродом служил стеклоуглеродный диск, впрессованный во фторопласт диаметром 0.3 см (Metrohm, Швейцария). В качестве вспомогательного электрода использовали стержень из стеклоуглерода диаметром 0.2–0.3 см (Metrohm, Швейцария). Электродом сравнения служил одно/двухключевой хлоридсеребряный электрод типа ЭСр-10101/3.5 моль/л. Значения рН измеряли иономером Эксперт-рН (Эконикс-эксперт, Россия). Для продувки растворов использовали аргон чистотой 99.9%.
Методика эксперимента. Перед анализом поверхность индикаторного стеклоуглеродного электрода (СУЭ) полировали с помощью суспензии оксида алюминия. Для удаления следов абразива поверхность СУЭ промывали 0.1 М HNO3 и ополаскивали деионизированной водой.
Для удаления растворенного кислорода, волна восстановления которого на СУЭ регистрируется в области катодного тока ТД, через раствор интенсивно (5–6 пузырьков в секунду) в течение 10 мин продували аргон. Затем уменьшали скорость продувки до 1 пузырька в секунду, опускали электроды в раствор, сопло направляли таким образом, чтобы выходящие пузырьки газа не попадали на электроды, выключали мешалку, выжидали 5 с для успокоения раствора и регистрировали вольтамперограмму. После регистрации каждой вольтамперограммы СУЭ выдерживали в течение 3 мин при потенциале 0.0 В.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
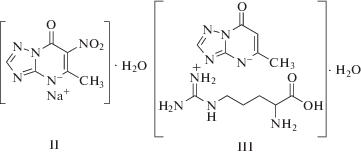
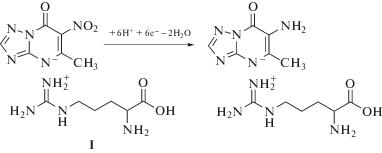
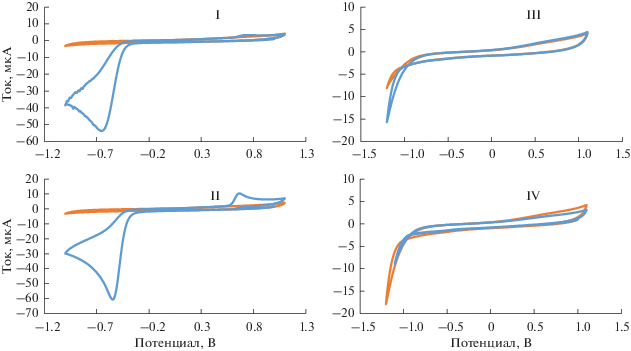
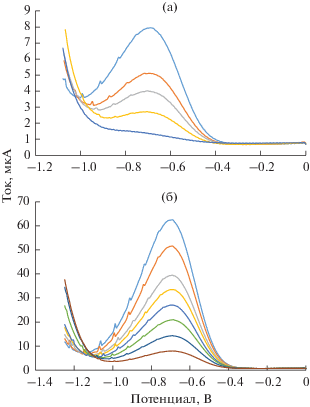
Электрохимическое поведение триазида на стеклоуглеродном электроде. На рис. 1 представлены катодно-анодные циклические вольтамперограммы (ЦВА), зарегистрированные на СУЭ в 0.1 М HNO3 без добавления и после добавления 1 мМ 5-метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-a]пиримидинид аргинина моногидрата (триазид, I, структурную формулу см. ниже на схеме 2), 5-метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-a]пиримидинид натрия моногидрата (II, схема 1), 5-метил-7-оксо-1,2,4-триазоло[1,5-a]пиримидинид аргинина моногидрата (III, схема 1) и L-аргинина (IV). Как видно, на ЦВА соединений I и II, имеющих в своей структуре нитрогруппу, наблюдается пик восстановления, который отсутствует на ЦВА соединений, не содержащих нитрогруппу. Вероятно, полученный катодный сигнал обусловлен протеканием процесса электровосстановления нитрогруппы, связанной с сопряженной ароматической системой.
Схема 1. Структурные формулы 5-метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-a]пиримидинид натрия моногидрата (II) и 5-метил-7-оксо-1,2,4-триазоло[1,5-a]пиримидинид аргинина моногидрата (III).
Рис. 1.
Катодно-анодные циклические вольтамперограммы, зарегистрированные на стеклоуглеродном электроде при скорости сканирования 0.1 В/с в 0.1 М HNO3 после продувки аргоном без добавления и после добавления 1 мМ соединений I–IV.
Число электронов, участвующих в восстановлении нитрогруппы в составе ТД, рассчитывали параллельно двумя методами: 1) путем сравнения количества электричества, затраченного на электрохимическое (ЭХ) превращение исследуемого вещества, с количеством электричества, затраченного на ЭХ-превращение модельной системы гексацианоферрата(III) калия; 2) с применением уравнения Коттрелла [6]. Среднее значение числа электронов, рассчитанное обоими методами, составило 6. Ниже представлена возможная схема процесса ЭХ-восстановления ТД, составленная на основе имеющихся в литературе [7, 8] и полученных нами [6] данных (схема 2):
Схема 2. Возможная схема процесса электрохимического восстановления триазида.
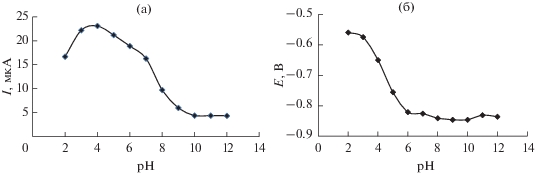
Влияние кислотности раствора на ток восстановления триазида. Влияние кислотности растворов ББР на ток и потенциал восстановления ТД изучали в области рН 2–12. Ток восстановления ТД (рис. 2а) достаточно стабилен при рН 3–5 и достигает максимального значения при рН 4. Снижение величины пика ТД в более кислой среде может быть обусловлено экранированием поверхности СУЭ выделяющимся при катодной поляризации водородом. В растворах с рН ≥ 5 катодный ток уменьшается. С увеличением рН раствора фонового электролита от 2 до 6 максимум пика восстановления ТД смещается в сторону отрицательных значений потенциала (рис. 2б), после чего стабилизируется в щелочных буферных растворах. Полученные результаты могут свидетельствовать об участии ионов водорода в процессе электровосстановления соединения. Дальнейшие исследования проводили в растворах ББР с рН 4.
Рис. 2.
Влияние рН буферных растворов Бриттона−Робинсона на ток и потенциал пика восстановления 180 мг/л триазида. Условия регистрации квадратно-волновых вольтамперограмм: шаг развертки 0.005 В, амплитуда импульса 0.05 В, скорость развертки 0.15 В/с.
Выбор режима вольтамперометрических измерений. Сравнение различных вариантов вольтамперометрии (линейной, дифференциально-импульсной (ДИП) и квадратно-волновой (КвВ)) показало, что оптимальным при работе с ТД с использованием СУЭ в растворе ББР при pH 4 является режим КвВ. В этом случае ток восстановления ТД (аналитический сигнал, АС) симметричен и может быть измерен с высокой точностью, в отличие от линейного режима регистрации, а величина тока восстановления выше примерно в два раза по сравнению с режимом ДИП. Чувствительность метода КвВ можно увеличить путем устранения тока заряжения и измерения в основном фарадеевской составляющей тока. Главным преимуществом КвВ является высокая скорость развертки потенциала порядка 0.1–2 В/с. Вольтамперограмма может быть зарегистрирована в течение нескольких секунд (по сравнению с 2–3 мин в режиме ДИП). В результате продолжительность анализа в целом существенно сокращается. Перечисленные преимущества нашли отражение в частом использовании режима КвВ для анализа лекарственных форм различных биологически активных соединений [9].
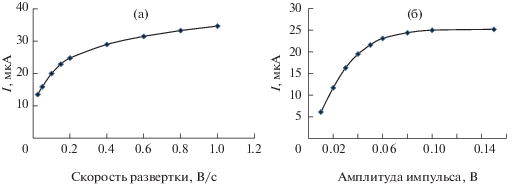
Величина АС в режиме КвВ существенно зависит от скорости развертки потенциала и амплитуды импульса (рис. 3). Как видно, величина тока восстановления ТД резко возрастает в интервале скоростей развертки 0.025–0.15 В/с, после чего рост существенно замедляется (рис. 3а). При скорости развертки 0.15 В/с и шаге развертки 0.005 В АС ТД растет практически линейно с увеличением амплитуды импульса в области 0.01–0.05 В (рис. 3б). При дальнейшем увеличении амплитуды импульса до 0.10 В величина АС возрастает нелинейно, после чего рост прекращается. Для аналитических целей выбрана скорость развертки 0.15 В/с (частота импульса 30 Гц) с амплитудой импульса 0.05 В. Предварительная выдержка СУЭ в перемешиваемом растворе ББР с добавлением 180 мг/л ТД в течение 1–300 с в интервале потенциалов 1.0–0.1 В, в котором ТД электрохимически не активен, не приводит к увеличению АС за счет возможной адсорбции аналита на поверхности индикаторного электрода. Это позволяет использовать метод прямой КвВ ВА для определения ТД.
Рис. 3.
Зависимости аналитического сигнала 180 мг/л триазида от скорости развертки потенциала и амплитуды импульса, полученные в буферном растворе Бриттона−Робинсона с рН 4 с использованием квадратно-волнового режима регистрации вольтамперограмм. Условия: шаг развертки 0.005 В, амплитуда импульса 0.05 В (а), скорость развертки 0.15 В/с (б).
Характеристики градуировочного графика триазида. При оптимальных условиях регистрации ток пика линейно растет при концентрациях ТД в растворе в интервале 10–500 мг/л. На рис. 4а, 4б приведены соответствующие КвВ-вольтамперограммы для разных концентраций ТД в растворе. Уравнение регрессии имеет вид: I (мкA) = (0.1176 ± ± 0.0002)c (мг/л) – (0.317 ± 0.069) с коэффициентом корреляции 0.9998. Предел обнаружения, рассчитанный по градуировочной кривой, составляет 1.9 мг/л, предел определения – 5.8 мг/л.
Рис. 4.
Квадратно-волновые вольтамперограммы триазида, зарегистрированные в буферном растворе Бриттона−Робинсона при рН 4 с добавлением 0, 10, 20, 30, 50 (а) и 50, 100, 150, 200, 250, 300, 400, 500 мг/л триазида (б). Условия регистрации вольтамперограмм см. в подписи к рис. 2.
Аналитические характеристики разработанной методики количественного определения триазида в фармацевтической субстанции “Триазид”. Основные показатели методики оценивали в соответствии с ОФС.1.1.0012.15 “Валидация аналитических методик” [10].
Для оценки правильности и специфичности применяли искусственные смеси. Стандартный образец триазида в количестве 50, 100 и 150% от ожидаемого уровня в 100 мг/л вводили в раствор, содержащий идентифицированную примесь в максимально возможных концентрациях, соответствующих составу фармацевтической субстанции “Триазид” (суммарное содержание примесей не более 2%).
Показатель правильности рассчитывали для каждого уровня концентраций ТД. Исследовали три концентрации растворов, каждое определение повторяли три раза. Рассчитывали показатель правильности и доверительный интервал среднего значения, стандартное отклонение (s), относительное стандартное отклонение (sr, %). Показатель правильности для различных уровней концентраций близок к 100%. Среднее значение для процента восстановления составило 99.8 ± 0.5%. Доверительный интервал среднего результата анализа включает значение 100%. Значение s составило 0.61, sr – 0.6%.
Сходимость (повторяемость) методики оценивали по результатам шести анализов образца с содержанием ТД, близким к номинальному. Каждый испытуемый водный раствор СО ТД готовили по точной навеске. Результат единичного определения получали методом стандартной добавки.
Внутрилабораторную прецизионность методики оценивали в условиях работы одной лаборатории: разные дни, разные исполнители. Полученные результаты приведены в табл. 1. Разработанный метод соответствует критериям прецизионности для электроанализа [11], является правильным и селективным, что позволяет использовать его для анализа фармацевтической субстанции “Триазид” на содержание основного вещества.
Таблица 1.
Оценка прецизионности разработанной методики определения триазида (n = 6, P = 0.95)
| Прецизионность | Найдено ТД, г/л | s | sr, % | |
|---|---|---|---|---|
| расчет | рекомендованное значение [11] | |||
| Сходимость | 1.99 ± 0.02 | 0.017 | 0.9 | ≤1 |
| Внутрилабораторная прецизионность | 1.97 ± 0.03 | 0.031 | 1.6 | ≤2 |
Результаты анализа различных партий фармацевтической субстанции. Согласно проекту фармакопейной статьи “ТРИАЗИД субстанция” содержание ТД (количественное определение методом ВЭЖХ) должно составлять не менее 98.0% и не более 102.0% в пересчете на сухое вещество. Результаты анализа трех разных партий субстанции (табл. 2) удовлетворяют заявленным требованиям.
Таблица 2.
Результаты анализа различных партий фармацевтической субстанции “Триазид” методом прямой квадратно-волновой вольтамперометрии (n = 3, Р = 0.95)
| № партии субстанции “Триазид” | Навеска субстанции “Триазид”, г | Найдено ТД, % | sr, % |
|---|---|---|---|
| 1 | 0.0102 | 100 ± 1 | 1.0 |
| 2 | 0.0100 | 99.7 ± 0.9 | 0.6 |
| 3 | 0.0101 | 100.3 ± 0.9 | 0.6 |
Исследование выполнено за счет гранта Российского научного фонда (проект № 17-13-01096).
Список литературы
Squella J.A., Bollo S., Núñez-Vergara L.J. Recent developments in the electrochemistry of some nitro compounds of biological significance // Curr. Org. Chem. 2005. V. 9. № 6. P. 565.
Чупахин О.Н., Чарушин В.Н., Русинов В.Л., Уломский Е.Н., Котовская С.К., Киселев О.И., Деева Э.Г., Саватеев К.В., Борисов С.С. 5-Метил-6-нитро-7-оксо-4,7-дигидро-1,2,4-триазоло[1,5 альфа]пиримидинид L-аргининия моногидрат. Патент № 2 529 487 РФ. Заявка 2013116765/04 от 15.04.2013, опубл. 27.09.2014.
Саватеев К.В. Синтез, строение, свойства и биологическая активность нитроазолопиримидинов. Дис. … канд. хим. наук. Екатеринбург: Уральский федеральный университет имени первого Президента России Б.Н. Ельцина, 2017. 182 с.
Ozkan S.A., Uslu B., Aboul-Enein H.Y. Analysis of pharmaceuticals and biological fluids using modern electroanalytical techniques // Crit. Rev. Anal. Chem. 2003. V. 33. № 3. P. 155.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. 448 с.
Баушева А.В., Цмокалюк А.Н., Саватеев К.С., Воинков Е.К., Уломский Е.Н., Иванова А.В., Козицина А.Н., Русинов В.Л. / Тез. докл. Третьего Междисциплинарного Симпозиума по медицинской, органической и биологической химии и фармацевтике 2017 “МОБИ-ХимФарма2017”. Москва. 28–31 мая 2017. С. 95.
Бейзер М., Лунд Х. Органическая электрохимия. Т. 1. М.: Химия, 1988. 469 с.
Томилов А.П., Майрановский С.Г., Фиошин М.Я., Смирнов В.А. Электрохимия органических соединений. М.: Химия, 1968. 592 с.
Dogan-Topal B., Ozkan S. A., Uslu B. The analytical applications of square wave voltammetry on pharmaceutical analysis // The Open Chem. Biomed. Methods J. 2010. V. 3. P. 56.
Государственная фармакопея Российской Федерации. XIII издание. Т. 1. М.: ФЭМБ, 2015. 1470 с.
Gumustas M., Ozkan S.A. The role of and the place of method validation in drug analysis using electroanalytical techniques // The Open Anal. Chem. J. 2011. V. 5. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии