Журнал аналитической химии, 2020, T. 75, № 5, стр. 442-448
Изучение полифенольных компонентов в экстрактах арктических бурых водорослей вида fucus vesiculosus методами жидкостной хроматографии и масс-спектрометрии
Д. В. Овчинников a, *, К. Г. Боголицын a, А. С. Дружинина a, П. А. Каплицин a, А. Э. Паршина a, И. И. Пиковской a, О. Ю. Хорошев a, П. Н. Турова b, А. Н. Ставрианиди b, О. А. Шпигун b
a Северный (Арктический) федеральный университет имени М.В. Ломоносовa
163002 Архангельск, ул. Набережная Северной Двины, 17, Россия
b Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: ovchinniko-deni@yandex.ru
Поступила в редакцию 25.01.2019
После доработки 26.03.2019
Принята к публикации 03.11.2019
Аннотация
Проведена экстракция полифенольной составляющей арктических бурых водорослей вида Fucus vesiculosus и последующее фракционирование экстракта методом колоночной хроматографии на сорбенте Сефадекс LH-20. Полученные фракции охарактеризованы методами эксклюзионной хроматографии, ВЭЖХ с УФ и масс-спектрометрическим детектированием (ВЭЖХ-УФ-МС) и масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (МС-МА-ЛДИ). Методом МС-МАЛДИ установлено наличие олигомерных соединений, содержащих до 13 флороглюциновых структурных единиц. Методом ВЭЖХ-УФ-МС выявлены олигомерные соединения в диапазоне масс 374–870 Да (тримеры–октамеры), а также оценено их соотношение.
Арктические бурые водоросли являются уникальным по составу сырьем для получения целого ряда веществ, обладающих широким спектром потребительских свойств. Они содержат минеральные вещества, пигменты, липиды, полифенолы, белки, аминокислоты, целлюлозу, альгиновую кислоту, маннит, ламинаран и фукоидан [1, 2].
Одной из наиболее значительных групп соединений, определяющих фармакологическое значение арктических бурых водорослей, являются полифенолы, а именно полимеры флороглюцина – флоротаннины, содержание которых в биомассе варьируется в зависимости от вида бурых водорослей и места их произрастания и может достигать до 20% от абсолютно сухой массы (а. с. м.) [3, 4]. Так, в работе [2] установлено высокое содержание полифенолов в водорослях вида Fucus vesiculosus (15.4–18.6% а. с. м.) и Ascophyllum nodosum (14.6–14.8% а. с. м.), произрастающих в Белом и Баренцевом морях. Флоротаннины представляют собой весьма разнородную группу молекул, различаясь структурой и степенью полимеризации [5], что значительно осложняет определение индивидуальных полифенольных соединений.
Для фракционирования и очистки флоротаннинов широко используют декстрановый эпоксимодифицированный сорбент Сефадекс LH-20 [6–8]. В случае соединений фенольной природы удерживание обусловлено образованием водородных связей с гидроксильными группами аналитов. Таким образом, сила адсорбции прямо пропорциональна числу фенольных атомов водорода и соответственно молекулярной массе соединения. Использование подходящих систем элюентов позволяет разделить полифенолы в зависимости от степени полимеризации на основании их способности к образованию водородных связей. Так, в работе [9] предложено использовать систему из шести элюентов, полярность которых уменьшается за счет пошагового увеличения концентрации ацетона в смеси ацетон–этанол. Поскольку большинство флоротаннинов элюировалось из колонки в последних трех фракциях, авторы предположили, что флоротаннины в водорослях вида Fucus vesiculosus состоят в основном из высокомолекулярных соединений.
Наиболее распространенным аналитическим методом разделения и характеристики фенольных соединений является ВЭЖХ в сочетании с масс-спектрометрией, что позволяет анализировать сложные матрицы, сочетая эффективную разделительную способность с возможностью определения структуры исследуемых соединений [10, 11]. Отдельно стоит упомянуть метод матрично-активированной лазерной десорбции/ионизации (МАЛДИ) – десорбционный метод мягкой ионизации путем воздействия импульсов лазерного излучения на матрицу с определяемым веществом, позволяющий детектировать более высокомолекулярные соединения по сравнению с квадрупольными масс-спектрометрами [12, 13].
Цель данной работы – характеристика полифенольного комплекса арктических бурых водорослей вида Fucus vesiculosus путем фракционирования с последующим исследованием полимолекулярных свойств и компонентного состава полученных подфракций методами ВЭЖХ−МС и МС-МАЛДИ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. В качестве материала для проведения эксперимента использовали воздушно-сухие образцы бурых водорослей вида Fucus vesiculosus, отобранные в ходе комплексных научно-исследовательских экспедиций “Арктический Плавучий университет” в 2017 г. в акватории острова Большой Соловецкий Белого моря.
Реактивы и материалы. В работе использовали ацетонитрил (LC/MS grade, Merck, Германия), этанол технический (96%), хлороформ (99%, Компонент-реактив, Россия), ацетон (99%, Компонент-реактив, Россия), этилацетат, н-бутанол, муравьиную кислоту (99.8%, Sigma Aldrich, Германия), концентрированную соляную кислоту, деионизованную воду с сопротивлением не менее 18.0 МОм см, полученную с использованием установки Milli-Q Advantage A10 (Millipore, США).
Выделение и фракционирование. Измельченный образец воздушно-сухих водорослей обрабатывали хлороформом для удаления липидно-пигментного комплекса. Далее водоросли трижды обрабатывали водой в соотношении 1 : 20 при 60°С в течение часа. Полученный экстракт отфильтровывали, концентрировали на роторном испарителе, обессоливали, после чего к нему добавляли этанол в соотношении раствор−этанол (1 : 3) (для осаждения полисахаридов) и выдерживали в течение 48 ч при –15°С для осаждения маннита. Полученный раствор концентрировали на роторном испарителе до удаления этанола и доводили до рН 2 соляной кислотой. Полифенолы извлекали методом жидкостно–жидкостной экстракции смесью этилацетат–бутанол (4 : 1, по объему). Проводили четырехкратную экстракцию при исходном объемном соотношении водный раствор–органический растворитель (5 : 2).
Лиофильно высушенный полифенольный экстракт фракционировали методом колоночной хроматографии на сорбенте Сефадекс LH-20. Для этого данную фракцию растворяли в растворе этанол–вода (1 : 1, по объему) и вводили в колонку, заполненную сорбентом Сефадекс LH-20 (15 г), объемом 57 см3 и длиной 32 см. Далее проводили ступенчатое элюирование шестью элюентами: смесями этанол–вода (1 : 1 и 3 : 1, по объему), этанолом, смесями этанол–ацетон с соотношением (5 : 1, 3 : 1 и 1 : 1, по объему), объем каждого элюента составлял 120 мл.
Определение содержания флоротаннинов. Суммарное содержание полифенольной фракции определяли фотометрическим методом с применением реактива Фолина−Чокальтеу по методике [14]. В качестве стандарта использовали флороглюцин.
Изучение полимолекулярного состава методом гель-фильтрационной хроматографии. Образцы анализировали методом эксклюзионной ВЭЖХ с использованием системы LC-20 Prominence (Shimadzu, Япония), состоящей из автоматического дозатора SIL-20A, двухплунжерного насоса LC-20AD, вакуумного дегазатора DGU-A3, термостата колонок STO-20A и спектрофотометрического детектора SPD-20A. Разделение проводили на колонке для анализа водорастворимых полимеров MCX (300 × 8.0 мм, размер пор 1000 Å) (PSS, Германия). В качестве элюента использовали 0.1 М раствор NaOH. Градуировали систему по стандартным образцам поли(стиролсульфоната) натрия (PSS, Германия) с известной молекулярной массой в диапазоне от 800 до 680 000 Да. Условия анализа: расход подвижной фазы 1.0 мл/мин, температура термостата 40°С, объем вводимой пробы 20 мкл, продолжительность анализа 25 мин, аналитическая длина волны 275 нм. Концентрация анализируемых и стандартных образцов составляла 1 мг/мл (растворитель – 0.1 М раствор NaOH). Сбор и обработку данных осуществляли с помощью программы WinGPC (PSS, Германия).
Анализ методом ВЭЖХ с УФ и масс-спектрометрическим детектированием. Компонентный состав экстрактов исследовали на жидкостном хроматографе Dionex Ultimate 3000 (Thermo, США) c диодно-матричным детектором DAD-3000(RS) и гибридным тройным квадрупольным масс-анализатором 3200 QTrap (ABSciex, Канада) с программным обеспечением Analyst 1.5. В качестве неподвижной фазы использовали колонку Acclaim RSLC 120 C18 (2.1 × 150 мм, 2.2 мкм). Элюент А – вода с добавкой 0.1 об. % муравьиной кислоты, элюент В – ацетонитрил. Условия анализа: расход подвижной фазы 0.4 мл/мин, температура термостата 35°С, объем пробы 10 мкл, длина волны 254 нм. Программа градиента: 0–2 мин – 10% В, 9–17 мин – 95% В, 17–21 мин – 10% В.
Условия работы масс-селективного детектора: ионизация электрораспылением в режиме отрицательных ионов, напряжение 5.5 кВ, 350°С, давление газа-завесы 10 psi, давление газа-распылителя 40 psi, давление газа-осушителя 45 psi, потенциал декластеризации 40 В, энергия соударений 5 В, сканирование в диапазоне m/z 100–1300.
Анализ методом масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией. Анализ осуществляли с использованием времяпролетного масс-спектрометра Axima Resonanse (Shimadzu Biotech, Великобритания). В качестве матрицы использовали 2,5-дигидроксибензойную кислоту с чистотой более 99% (Sigma Aldrich, Германия). Масс-спектры записывали в режиме регистрации положительных ионов с применением рефлектрона в диапазоне масс 700–4000 Да. В качестве источника излучения использовали азотный УФ-лазер с длиной волны 337 нм и энергией лазерного излучения 100 отн. ед. Массовую шкалу прибора градуировали непосредственно перед записью масс-спектров исследуемых образцов с использованием стандартной смеси пептидов (Bruker, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определены содержания и молекулярные массы флоротаннинов для полученных на Сефадексе LH-20 подфракций и исходной полифенольной фракции; результаты представлены в табл. 1. Видно, что наибольшие выходы полифенолов наблюдаются для подфракций LH-1 и LH-6 (28.8 и 33.7 отн. % соответственно). В то же время содержание полифенолов в подфракции LH-1 значительно ниже (55.4 г ФГЭ/100 г экстракта), чем в остальных подфракциях (89.2–98.9 г ФГЭ/100 г экстракта), а средняя молекулярная масса выше, что обусловлено наличием большого количества компонентов неароматической природы, элюируемых на первой стадии фракционирования на данном сорбенте.
Таблица 1.
Характеристики полифенольной фракции и полученных на Сефадексе LH-20 подфракций (n = 3, P = 0.95)
| Фракция/подфракция | Элюент | Выход* ПФ, мас. % |
Содержание ПФ, г ФГЭ/100 г экстракта | M, кДа |
|---|---|---|---|---|
| Полифенольная фракция | – | – | 76 ± 3 | 4.6 ± 0.1 |
| LH-1 | э/в (1 : 1) | 29 ± 2 | 55 ± 2 | 5.2 ± 0.3 |
| LH-2 | э/в (3 : 1) | 5.9 ± 0.3 | 91 ± 4 | 1.64 ± 0.05 |
| LH-3 | э | 2.2 ± 0.3 | 89 ± 4 | 1.26 ± 0.02 |
| LH-4 | э/а (5 : 1) | 6.4 ± 0.9 | 94 ± 4 | 1.92 ± 0.03 |
| LH-5 | э/а (3 : 1) | 11 ± 1 | 91 ± 4 | 3.9 ± 0.2 |
| LH-6 | э/а (1 : 1) | 34 ± 3 | 99 ± 1 | 6.5 ± 0.3 |
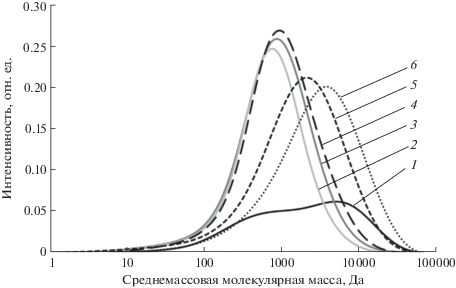
Увеличение доли этанола приводит к элюированию флоротаннинов с относительно невысокой молекулярной массой, по всей видимости, мономеров и олигомеров. При повышении в элюенте доли ацетона молекулярная масса препаратов возрастает. Молекулярно-массовое распределение полученных на Сефадексе LH-20 подфракций представлено на рис. 1. Стоит отметить наличие двух максимумов для подфракции LH-1, что также подтверждает наличие высокомолекулярных примесей.
Рис. 1.
Молекулярно-массовое распределение полученных на Сефадексе LH-20 подфракций: 1 – LH-1, 2 – LH-2, 3 – LH-3, 4 – LH-4, 5 – LH-5, 6 – LH-6.
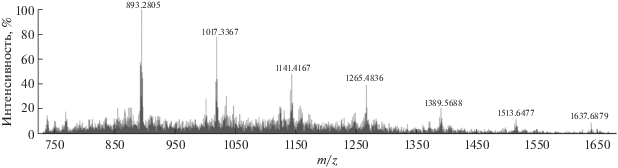
Для изучения состава полифенольной фракции использовали метод МС-МАЛДИ, который позволяет обнаруживать соединения с молекулярной массой до нескольких тысяч дальтон. Полученный спектр представлен на рис. 2. В полифенольной фракции обнаружены ионы [M + + Na]+ в диапазоне масс 893–1637 Да. Таким образом, сами флоротаннины имеют массы от 870 до 1614 а.е.м., что соответствует соединениям с 8–13 флороглюциновыми единицами.
С целью получения более подробной информации о компонентном составе полифенольную фракцию и полученные на Сефадексе LH-20 подфракции исследовали методом ВЭЖХ-УФ-МС (рис. 3 и 4). Как следует из данных табл. 2, олигомерные флоротаннины обнаружены во фракциях LH-2, LH-3, LH-4 и LH-5. В то же время во фракциях LH-1 и LH-6 методом масс-спектрометрии не удалось обнаружить флоротаннины из-за наличия большого количества затрудняющих определение примесей во фракции LH-1, а также высокой степени полимеризации флоротаннинов во фракции LH-6, что согласуется с данными по молекулярно-массовому распределению. Стоит отметить наличие на хроматограммах образцов LH-2–LH-6 размытого пика на 4.5–7.5 мин, вероятно, представляющего собой высокомолекулярную фракцию флоротаннинов (рис. 4). Исходя из площади пика полимерной фракции, оценено ее относительное содержание в каждой подфракции. Результаты представлены в табл. 2.
Рис. 3.
Хроматограммы исходного экстракта, полученные с УФ (а) и масс-спектрометрическим детектированием (б).

Таблица 2.
Характеристика компонентного состава полученных на Сефадексе LH-20 подфракций (спектрофотометрический детектор)
| Время удерживания, мин | Молекулярный ион, m/z | Компонент | Значения площадей пиков, А × 103, мин | ||||
|---|---|---|---|---|---|---|---|
| полифенольная фракция | LH-2 | LH-3 | LH-4 | LH-5 | |||
| 1.3 | 373 | Тример | 22 | 39 | |||
| 1.8 | 621 | Пентамер | 47 | 174 | 74 | ||
| 2.15 | 497 | Тетрамер | 22 | 243 | 10 | ||
| 2.25 | 479 | Тетрамер | 10 | 10 | |||
| 2.7 | 745 | Гексамер | 29 | 54 | 570 | 174 | |
| 3.6 | 869 | Гептамер | 37 | 981 | |||
| 4.55 | 993 | Октамер | 10 | 292 | |||
| 4.8 | 727 | Гексамер | 12 | 234 | 8 | ||
| 5.1 | 1117 | Нонамер | 5 | 80 | |||
| 5.6 | 603 | Пентамер | 180 | ||||
| 5.7 | 851 | Гептамер | 4 | 102 | 39 | ||
| 4.5–7.5 | Площади пика полимерной фракции, А × 103, мин | 2600 | 2180 | 3080 | 1530 | ||
| Полимерная фракция, отн. % | 83.3 | 76.9 | 61.3 | 99.5 | |||
Для подтверждения структур обнаруженных соединений применили метод тандемной масс-спектрометрии в режиме регистрации отрицательно заряженных ионов. Полученные фрагментные сигналы перечислены в табл. 3. В первую очередь можно отметить, что для всех соединений при ионизации наблюдается отщепление молекулы воды (373 – 355 = 18), причем для гексамеров и гептамеров вода отщепляется дважды (745–727–709). Также наблюдается отщепление единиц флороглюцина (355 – 125 = 230, 353 – 124 = 229, 603 – 126 = 477, 477 – 126 = 351 и т.д.). Часть продуктов фрагментации образуется в результате разрушения фенольных колец (353 – 44 = 309, 351 – 62 = 289 и т.д.). Стоит также отметить наличие совпадающих фрагментов для разных молекулярных ионов, следовательно, обнаруженные соединения являются близкими структурными аналогами.
Таблица 3.
Фрагментные ионы обнаруженных флоротаннинов
| Молекулярный ион, m/z | Компонент | Фрагментные ионы |
|---|---|---|
| 373 | Тример | 355 (373 – 18), 230 (355 – 125), 219, 215, 205, 139, 123, 111 |
| 479 | Тетрамер | 461 (479 – 18), 230, 215, 175, 163, 149 |
| 497 | Тетрамер | 479 (497 – 18), 353 (479 – 126), 339 (353 – 14), 325 (339 – 14), 229 (353 – 124), 205, 139, 125, 123, 111 |
| 603 | Пентамер | 585 (603 – 18), 339, 245, 230, 217, 205 |
| 621 | Пентамер | 603 (621 – 18), 559 (603 – 44), 541 (559 – 18), 477 (621 – 126), 459 (477 – 18), 351 (477 – 126), 289 (351 – 62), 205, 165 (289 – 124) |
| 727 | Гексамер | 709 (727 – 18), 691 (709 – 18), 567 (691 – 124), 561, 455, 437 (561 – 124, 455 – 18), 289, 271 (289 – 18), 165 (289 – 165), 139 |
| 745 | Гексамер | 727 (745 – 18), 709 (727 – 18), 585 (709 – 124), 579, 455 (579 – 124), 437 (455 – 18), 289, 271 (289 – 18), 165 (289 – 124), 139, 121, 111 |
| 851 | Гептамер | 833 (851 – 18), 789 (833 – 44), 685, 561 (685 – 124), 517 (561 – 44), 455 (517 – 62), 411 (455 – 44), 349 (411 – 62), 289, 271 (289 – 18), 245 (289 – 44), 229, 165, 139 |
| 869 | Гептамер | 851 (869 – 18), 833 (851 – 18), 708 (833 – 125), 703, 579 (703 – 124), 455 (579 – 124), 437 (455 – 18), 413, 289 (413 – 124), 165 (289 – 124), 139, 125 |
* * *
Таким образом, путем фракционирования полифенольного комплекса арктических бурых водорослей вида Fucus vesiculosus на сорбенте Сефадекс LH-20 получены различающиеся по молекулярным массам препараты, характеризующиеся высокой чистотой (содержание полифенолов более 90%), при этом доля высокомолекулярных соединений составляет от 61 до 100%. Методом МС-МАЛДИ обнаружены соединения с массами вплоть до 1614 Да, что соответствует 13 флороглюциновым структурным единицам. Методом ВЭЖХ-УФ-МС выявлены соединения в диапазоне масс 374–870 Да (тримеры−октамеры), а также оценено их соотношение. Обнаружен пик полимерной полифенольной фракции, масс-спектр которой содержал сигналы, совпадающие по значениям m/z с полифенольными фрагментами длиной от 2 до 10 звеньев.
Научно-исследовательская работа выполнена в рамках проектной части государственного задания Министерства образования и науки РФ в сфере научной деятельности № 4.3273.2017/ПЧ. Уникальный идентификатор RFMEFI59417X0013. Работа выполнена с использованием оборудования ЦКП НО “Арктика” Северного (Арктического) федерального университета имени М.В. Ломоносова.
Список литературы
Боголицын К.Г., Каплицин П.А., Добродеева Л.К., Дружинина А.С., Овчинников Д.В., Паршина А.Э., Шульгина Е.В. Энтеросорбционные свойства клетчатки арктических бурых водорослей // Журн. прикл. химии. 2017. Т. 90. № 11. С. 1513.
Клиндух М.П., Облучинская Е.Д. Сравнительное исследование химического состава бурых водорослей Fucus vesiculosus и Ascophyllum nodosum // Вестник МГТУ. 2013. Т. 16. № 3. С. 466.
Van Alstyne K.L. A comparison of three methods for quantifying brown algal polyphenolic compounds // J. Chem. Ecol. 1995. V. 21. P. 45.
Ragan M.A., Glombitza K.W. Phlorotannins, brown algal polyphenols // Progr. Phycol. Res. 1986. V. 4. P. 129.
Heffernan N., Brunton P., FitzGerald R.J., Smyth T.J. Profiling of the molecular weight and structural isomer abundance of macroalgae-derived phlorotannins // Marine Drugs. 2015. V. 13. P. 509.
Li Y., Qian Z.J., Ryu B., Lee S.H., Kim M.M., Kim S.K. Chemical components and its antioxidant properties in vitro: an edible marine brown alga, Ecklonia cava // Bioorg. Med. Chem. 2009. V. 17. P. 1963.
Amarowicz R., Troszynska A., Shahidi F. Antioxidant activity of almond seed extract and its fractions // J. Food Lipids. 2005. № 12. P. 344.
Kim S.M., Kang K., Jeon J.S., Jho E.H., Kim C.Y., Nho C.W., Um B.H. Isolation of phlorotannins from Eisenia bicyclis and their hepatoprotective effect against oxidative stress induced by tert-butyl hyperoxide // A-ppl. Biochem. Biotechnol. 2011. V. 165. P. 1296.
Wang T., Jonsdottir R., Liu H., Gu L., Kristinsson H.G., Raghavan S., Olafsdottir G. Antioxidant capacities of phlorotannins extracted from the brown algae Fucus vesiculosus // J. Agric. Food. Chem. 2012. V. 60. P. 5874.
Zhang R., Yuen A., Magnusson M., Wright J.T., de Nys R., Masters A.F., Maschmeyer T. A comparative assessment of the activity and structure of phlorotannins from the brown seaweed Carpophyllum flexuosum // Algal Res. 2018. V. 29. P. 130.
Li Y., Fu X., Duan D., Liu X., Xu J., Gao X. Extraction and identification of phlorotannins from the brown alga, Sargassum fusiforme (Harvey) Setchell // Marine drugs. 2017. V. 15. № 2. P. 49.
Vissers A.M., Caligiani A., Sforza S., Vinckena J., Gruppen H. Phlorotannin Composition of Laminaria digitata // Phytochem. Anal. 2017. № 28(6). P. 487.
Karthik R., Manigandan V., Sheeba R., Saravanan R., Rajesh P.R. Structural characterization and comparative biomedical properties of phloroglucinol from Indian brown seaweeds // J. Appl. Phycol. 2016. № 28. P. 3561.
Koivikko R., Loponen J., Honkanen T., Jormalainen V. Contents of soluble, cell-wall-bound and exuded phlorotannins in the brown alga Fucus vesiculosus, with implications on their ecological functions // J. Chem. Ecol. 2005. V. 31. P. 195.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии