Журнал аналитической химии, 2020, T. 75, № 5, стр. 473-479
Вольтамперометрическая оценка полифенол-протеиновых взаимодействий и их влияния на антиоксидантную емкость чая
Г. К. Зиятдинова a, *, Е. В. Гусс a, Г. К. Будников a
a Химический институт имени А.М. Бутлерова, Казанский федеральный университет
420008 Казань,
ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 13.03.2019
После доработки 03.12.2019
Принята к публикации 03.12.2019
Аннотация
Разработан вольтамперометрический способ оценки полифенол-протеиновых взаимодействий, основанный на окислении полифенолов на электроде, модифицированном многостенными углеродными нанотрубками и электрополимеризованным кверцетином. В качестве модельных систем рассмотрены полифенолы чая (катехин и эпигаллокатехин галлат) и молочные протеины (казеин, бычий сывороточный альбумин и β-лактоглобулин). Установлено, что протеины связывают рассматриваемые полифенолы (от 10 до 60%) по мере увеличения содержания протеина (от 1 : 0.25 до 1 : 1.5, по объему) в смеси, уменьшая долю свободного полифенола. Разработанный подход применен для оценки влияния молока на антиоксидантные свойства чая (зеленого, белого, полуферментированного и черного), которые выражали через параметр “антиоксидантная емкость” (АОЕ). Показано статистически достоверное 1.8–23-кратное уменьшение АОЕ чая в присутствии 20 об. % молока.
Основным источником полифенолов в рационе человека являются продукты питания, содержащие широкий круг биологически активных веществ различной природы, оказывающих взаимное влияние, что может приводить к изменению свойств отдельных соединений, в том числе их in vivo и in vitro биодоступности. Так, возможно прямое взаимодействие полифенолов с липидами, полисахаридами и протеинами матрицы, причем последнее наиболее значимо, поскольку заметно сказывается на антиоксидантных свойствах фенольных соединений [1, 2]. Очевидно, что разработка способов оценки полифенол-протеиновых взаимодействий представляет практический интерес. Среди протеинов следует выделить молочные протеины, так как наиболее распространенными источниками полифенолов являются чай и кофе, в которые при употреблении часто добавляют молоко.
Для исследования полифенол-протеиновых взаимодействий применяют спектроскопические и калориметрические методы, а также масс-спектрометрию и микроскопию [3]. В последние годы все большее внимание уделяется in-silico методам, позволяющим с помощью биоинформатики устанавливать активные центры и центры связывания молекул, а также прогнозировать их биологическую активность [3, 4].
Полифенолы легко вступают в реакции переноса электрона, что позволяет использовать для решения поставленной задачи методы электроанализа. Так, разработаны способы кулонометрической оценки полифенол-протеиновых взаимодействий по реакциям полифенолов с электрогенерированными гексацианоферрат(III)-ионами [5] и бромом [6]. При этом гексацианоферрат(III)-ионы как одноэлектронный и более мягкий титрант-окислитель предпочтительнее, поскольку селективны по отношению к фенольным соединениям. Электрогенерированный бром взаимодействует с широким кругом антиоксидантов и молочными протеинами, что требует предварительной оценки их вклада в получаемые результаты.
Вольтамперометрия не нашла широкого применения в оценке полифенол-протеиновых взаимодействий. Молочные протеины не проявляют электрохимическую активность в области потенциалов, характерных для электроокисления полифенолов, поэтому в качестве аналитического сигнала можно было бы использовать токи окисления рассматриваемых полифенолов. Однако описан лишь один пример применения циклической вольтамперометрии на стеклоуглеродном электроде (СУЭ), позволяющий установить влияние молока на полифенолы чая и кофе [7]. Учитывая форму вольтамперограмм, для расчетов использовали заряд, прошедший через раствор при сканировании потенциала от –0.1 до 0.4 В.
Для вольтамперометрического определения природных полифенолов (галловой кислоты, катехина и эпигаллокатехин галлата, ЭГКГ) и оценки АОЕ чая предложен СУЭ, модифицированный многостенными углеродными нанотрубками и электрополимеризованным кверцетином (поликверцетин/МУНТ/СУЭ), позволяющий повысить чувствительность отклика аналитов [8].
В настоящей работе показана возможность применения поликверцетин/МУНТ/СУЭ для оценки полифенол-протеиновых взаимодействий и их влияния на АОЕ чая.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. Использовали 98%-ный кверцетин дигидрат, 98%-ный катехин гидрат, 80%-ный ЭГКГ (Sigma, Германия), стандартные растворы (10.0 мМ кверцетина, 3.00 мг/мл катехина и ЭГКГ) которых готовили растворением точных навесок в 5.0 мл этанола (ректификата). Более разбавленные растворы готовили непосредственно перед измерениями. Стандартные растворы β-лактоглобулина (Sigma, Германия), β-казеина из коровьего молока и бычьего сывороточного альбумина (БСА) (Fluka, Германия) с концентрациями 3.0, 3.0 и 0.5 мг/мл соответственно готовили растворением точных навесок в дистиллированной воде. Смеси полифенолов с молочными протеинами готовили по объемным соотношениям. Остальные реактивы были марки х. ч.
Модификация электродов. Рабочую поверхность СУЭ (площадь поверхности 3.14 мм2) обновляли механически, полируя оксидом алюминия с размером частиц 0.05 мкм. Затем электрод ополаскивали ацетоном и дистиллированной водой. Для модифицирования электродной поверхности использовали МУНТ с внешним диаметром 40–60 нм, внутренним диаметром 5–10 нм и длиной 0.5–500 мкм (Aldrich, Германия). Их 0.5 мг/мл гомогенную суспензию в 1%-ном додецилсульфате натрия получали ультразвуковым диспергированием в течение 30 мин. Рабочий электрод модифицировали методом капельного испарения 2 мкл суспензии МУНТ.
Слой поликверцетина получали из 1.0 мМ раствора кверцетина в режиме потенциодинамического электролиза от –0.1 до 1.0 В при скорости изменения потенциала 100 мВ/с в среде 0.1 М NaOH [8].
Вольтамперометрические измерения проводили на потенциостате/гальваностате Autolab PGSTAT 12 (Eco Chemie B.V., Нидерланды) с программным обеспечением GPES 4.9.005 (Eco Chemie B.V., Нидерланды) в трехэлектродной ячейке, состоящей из рабочего поликверцетин/МУНТ/СУЭ, насыщенного хлоридсеребряного электрода сравнения и вспомогательного платинового электрода. Для расчетов в вольтамперометрии применяли коррекцию базовой линии по программе GPES 4.9.005. В электрохимическую ячейку вносили фоновый электролит (фосфатный буферный раствор с рН 7.0), аликвоты стандартных растворов полифенолов (10–750 мкл) и регистрировали дифференциально-импульсные вольтамперограммы в диапазоне от –0.2 до 0.8 В при амплитуде импульса 50 мВ, времени импульса 50 мс и скорости изменения потенциала 10 мВ/с. Для оценки влияния протеинов концентрация полифенолов в ячейке составляла 30 мкг/мл, а долю протеинов варьировали.
Оценку АОЕ чая проводили согласно [8]: в электрохимическую ячейку вносили 250 мкл образца и регистрировали дифференциально-импульсные вольтамперограммы в диапазоне от ‒0.2 до 0.8 В при амплитуде импульса 50 мВ, времени импульса 50 мс и скорости изменения потенциала 10 мВ/с. АОЕ чая выражали в эквивалентах ЭГКГ в пересчете на 100 мл напитка.
Для определения рН фонового электролита использовали рН-метр Эксперт-001 (ООО “Эконикс-Эксперт”, Россия).
Пробоподготовка образцов. Чай готовили по стандартной методике: навеску чая (2.0000 ± 0.0001 г) заливали 200 мл доведенной до кипения водой, настаивали 5 мин, затем фильтровали и использовали раствор для дальнейших исследований. Молоко коровье пастеризованное 3.2% жирности использовали без предварительной пробоподготовки.
Статистическую обработку результатов проводили для 5 измерений при доверительной вероятности 0.95. Результаты представляли как X ± ΔX, где X – среднее значение и ΔX – доверительный интервал. Случайную погрешность определения оценивали по величине относительного стандартного отклонения (sr). Регрессионный анализ выполнен в программе OriginPro 8.0 (OriginLab, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Главными полифенолами чая являются катехины, поэтому в качестве модельных соединений выбрали катехин и ЭГКГ. Показано, что на поликверцетин/МУНТ/СУЭ катехин окисляется при 0.180 и 0.540 В (рис. 1а), а ЭГКГ – при 0.084, 0.180 и 0.590 В (рис. 1б). Окисление катехина и ЭГКГ протекает с участием двух электронов и двух протонов до соответствующих о-хинонов в кольце В [9–11]. Различие в потенциалах окисления по первой ступени для катехина и ЭГКГ связано с присутствием галлатного фрагмента в кольце В молекулы ЭГКГ, который окисляется легче, чем пирокатехиновый фрагмент в структуре катехина [7].
Рис. 1.
Дифференциально-импульсные вольтамперограммы с коррекцией базовой линии 0.0290 (1), 0.290 (2), 1.45 (3), 2.90 (4), 7.26 (5), 14.5 (6), 21.8 (7) и 29.0 (8) мкг/мл катехина (а) и 0.0458 (1), 0.229 (2), 1.15 (3), 2.29 (4), 4.58 (5), 11.5 (6), 22.9 (7), 34.4 (8) и 45.8 (9) мкг/мл ЭГКГ (б) на поликверцетин/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0. Амплитуда импульса 50 мВ, время импульса 50 мс, скорость изменения потенциала 10 мВ/с.
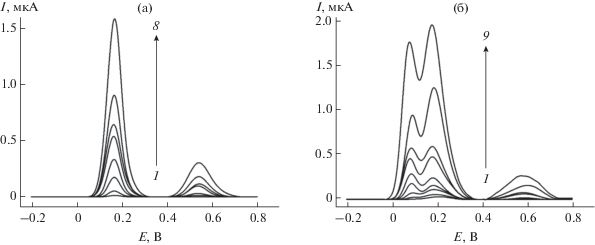
Для обоих аналитов наблюдается линейная зависимость площади пиков окисления от концентрации. Учитывая форму вольтамперограмм для ЭГКГ, для количественной оценки использовали общую площадь пиков окисления при 0.084 и 0.180 В. Диапазоны определяемых содержаний составили 0.0290–2.90 и 2.90–72.6 мкг/мл для катехина (уравнения (1) и (2)) и 0.0458–4.58 и 4.58–45.8 мкг/мл для ЭГКГ (уравнения (3) и (4)), пределы обнаружения – 0.0070 и 0.0064 мкг/мл соответственно.
(1)
$\begin{gathered} S = \left( {{\text{7}} \pm {\text{2}}} \right) \times {\text{1}}{{0}^{{--{\text{1}}0}}} + \\ + \,\,\left( {{\text{8}}.{\text{4}} \pm 0.{\text{2}}} \right) \times {\text{1}}{{0}^{{--{\text{9}}}}}{{с}_{{{\text{катехина}}}}}{\text{ }}\left( {{\text{мкг/мл}}} \right), \\ {{R}^{{\text{2}}}} = 0.{\text{9986}}, \\ \end{gathered} $(2)
$\begin{gathered} S = \left( {{\text{1}}.{\text{93}} \pm 0.0{\text{7}}} \right) \times {\text{1}}{{0}^{{--{\text{8}}}}} + \\ + \,\,\left( {{\text{2}}.{\text{5}}0 \pm 0.0{\text{2}}} \right) \times {\text{1}}{{0}^{{--{\text{9}}}}}{{с}_{{{\text{катехина}}}}}\left( {{\text{мкг/мл}}} \right),~ \\ {{R}^{{\text{2}}}}{\text{ }} = {\text{ }}0.{\text{9996}}, \\ \end{gathered} $(3)
$\begin{gathered} S = \left( {--{\text{2}} \pm {\text{3}}} \right) \times {\text{1}}{{0}^{{--{\text{1}}0}}} + \\ + \,\,\left( {{\text{1}}.{\text{41}} \pm 0.0{\text{1}}} \right) \times {\text{1}}{{0}^{{--{\text{8}}}}}{{с}_{{{\text{ЭГКГ}}}}}{\text{ }}({\text{мкг/мл}}), \\ {{R}^{{\text{2}}}}{\text{ }} = {\text{ }}0.{\text{9995}}, \\ \end{gathered} $(4)
$\begin{gathered} S = \left( {{\text{2}}.{\text{8}} \pm 0.{\text{6}}} \right) \times {\text{1}}{{0}^{{--{\text{8}}}}} + \\ + \,\,\left( {{\text{6}}.{\text{5}} \pm 0.{\text{2}}} \right) \times {\text{1}}{{0}^{{--{\text{9}}}}}{{с}_{{{\text{ЭГКГ}}}}}{\text{ }}({\text{мкг/мл}}), \\ {{R}^{{\text{2}}}} = 0.{\text{9964}}. \\ \end{gathered} $Для оценки влияния протеинов на полифенолы изучены модельные системы, состоящие из рассматриваемых катехинов и молочных протеинов (β-казеина, БСА и β-лактоглобулина). Долю протеинов в смесях варьировали в диапазоне от 0.25 до 1.5. При этом на вольтамперограммах смесей наблюдается заметное снижение пиков окисления при сохранении формы кривой (рис. 2) для всех рассматриваемых протеинов. Показано, что для связывания полифенолов протеинами достаточно 1 мин, поэтому дальнейшие измерения проводили через 1 мин после добавления протеинов. Количественной характеристикой полифенол-протеиновых взаимодействий являлась доля свободного полифенола в смеси. Установлено, что содержание доступного полифенола уменьшается по мере увеличения доли протеина в смеси (рис. 3). Степень связывания катехина и ЭГКГ молочными протеинами уменьшается в ряду β‑казеин > БСА > β-лактоглобулин, причем ЭГКГ связывается в большей степени, чем катехин, что обусловлено присутствием галлатных фрагментов в его структуре. Полученные результаты согласуются с описанными ранее данными для кверцетина и рутина [5]. Как известно [2], полифенолы могут взаимодействовать с протеинами за счет ковалентных или межмолекулярных связей. Ковалентное взаимодействие характерно для танинов [2]. Нековалентное связывание происходит вследствие образования водородных связей (между карбонильной группой пептидной связи и гидроксильными группами полифенолов) и гидрофобных взаимодействий за счет ароматических колец молекул полифенолов и алифатических и ароматических фрагментов протеина [12, 13]. Основная роль при гидрофобных взаимодействиях отводится аминокислотным остаткам пролина, гистидина, аргинина, фенилаланина, триптофана, лизина, цистеина и метионина в структуре протеина. Механизм связывания зависит от структуры протеина, а размеры и стехиометрия образующихся агрегатов зависят от концентраций полифенолов и протеинов и их соотношения [14].
Рис. 2.
Типичные дифференциально-импульсные вольтамперограммы с коррекцией базовой линии эпигаллокатехин галлата (а) и катехина (б) в присутствии молочных протеинов на примере β-казеина на поликверцетин/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0. Доля протеина в смеси составляет 0 (1), 0.25 (2), 0.5 (3), 1.0 (4) и 1.5 (5). Амплитуда импульса 50 мВ, время импульса 50 мс, скорость изменения потенциала 10 мВ/с.
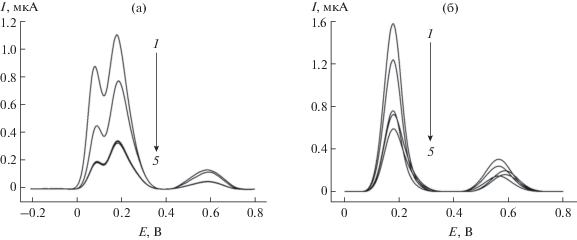
Рис. 3.
Доля свободного эпигаллокатехин галлата (а) и катехина (б) в присутствии β-лактоглобулина (1), бычьего сывороточного альбумина (2) и β-казеина (3) в зависимости от доли протеина в смеси.

Исследование смесей ЭГКГ и катехина с молоком показало, что доля свободного катехина и ЭГКГ резко снижается до 21 ± 1 и 30 ± 1% соответственно уже при соотношении полифенол : молоко = 1 : 0.2. Следует отметить, что молоко является электрохимически неактивным в условиях вольтамперометрического эксперимента.
Разработанный подход применен для оценки влияния молочных протеинов и молока на антиоксидантные свойства чая, являющегося источником природных полифенолов в рационе человека. В качестве параметра, отражающего in vitro биодоступность полифенолов в присутствии молочных протеинов и молока, использовали АОЕ.
На примере зеленого и черного чая показано, что молочные протеины связывают их полифенолы, что приводит к статистически достоверному уменьшению их АОЕ для всех рассматриваемых протеинов (табл. 1). Для зеленого чая наибольшую связывающую способность проявляет β-казеин, а для черного чая – БСА, что обусловлено, вероятно, окислением его катехинов под действием полифенолоксидазы на стадии ферментации с образованием теафлавинов и теарубигинов [15], которые обладают большей гидрофобностью и связываются с протеинами главным образом за счет гидрофобных взаимодействий [2]. Катехины зеленого чая взаимодействуют с белками в большей степени за счет водородных связей [16, 17]. В целом, АОЕ чая статистически достоверно уменьшается в присутствии протеинов (в 1.6–2.3 раза для черного чая и в 1.1–1.3 раза для зеленого чая уже при содержании протеина в смеси 5%).
Таблица 1.
Антиоксидантная емкость чая в присутствии молочных протеинов по данным вольтамперометрии на поликверцетин/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0 (n = 5, P = 0.95)
| Доля протеина в смеси | АОЕ чая в присутствии протеинов, мг ЭГКГ/100 мл | |||||
|---|---|---|---|---|---|---|
| β-казеин | sr | БСА | sr | β-лактоглобулин | sr | |
| Зеленый чай | ||||||
| 0 | 58 ± 1 | 0.02 | 58 ± 1 | 0.02 | 58 ± 1 | 0.02 |
| 0.05 | 48 ± 1 | 0.02 | 45.8 ± 0.7 | 0.01 | 53.2 ± 0.8 | 0.01 |
| 0.1 | 42.6 ± 0.4 | 0.007 | 46.4 ± 0.7 | 0.01 | 45.3 ± 0.8 | 0.01 |
| 0.2 | 24 ± 1 | 0.04 | 42.3 ± 0.7 | 0.01 | 38 ± 1 | 0.03 |
| 0.3 | 18.0 ± 0.3 | 0.02 | 37.9 ± 0.9 | 0.02 | 29.0 ± 0.8 | 0.02 |
| Черный чай | ||||||
| 0 | 11.3 ± 0.2 | 0.01 | 11.3 ± 0.2 | 0.01 | 11.3 ± 0.2 | 0.01 |
| 0.05 | 6.9 ± 0.2 | 0.01 | 4.9 ± 0.2 | 0.04 | 5.9 ± 0.1 | 0.02 |
| 0.1 | 5.1 ± 0.3 | 0.04 | 3.5 ± 0.1 | 0.03 | 4.4 ± 0.3 | 0.06 |
| 0.2 | 4.0 ± 0.1 | 0.02 | 3.5 ± 0.1 | 0.03 | 4.0 ± 0.2 | 0.04 |
| 0.3 | 3.75 ± 0.09 | 0.02 | 3.2 ± 0.3 | 0.05 | 3.70 ± 0.06 | 0.01 |
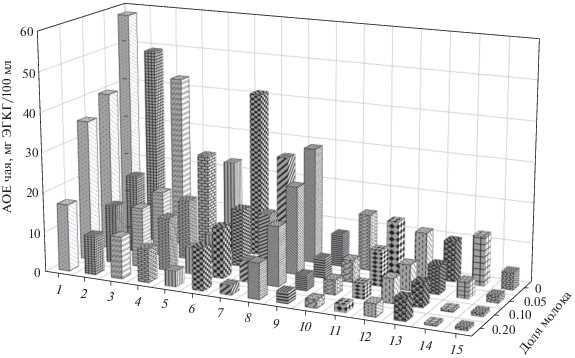
На вольтамперограммах чая с молоком наблюдается постепенное уменьшение токов окисления чая, а также расщепление пика окисления при 0.18–0.20 В с появлением плеча при 0.23–0.25 В по мере увеличения доли молока в смеси (рис. 4). Установлено, что АОЕ чая статистически достоверно уменьшается в присутствии молока независимо от типа чая (рис. 5), причем основная часть полифенолов связывается при содержании молока в смеси 5%. Дальнейшее увеличение доли молока приводит к постепенному уменьшению АОЕ чая. Для некоторых образцов различие статистически недостоверно, что обусловлено, вероятно, их характеристиками. Полученные результаты хорошо согласуются с данными гальваностатической кулонометрии [5, 6].
Рис. 4.
Типичные дифференциально-импульсные вольтамперограммы с коррекцией базовой линии зеленого (а) и черного (б) чая в присутствии молока на поликверцетин/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0. Доля молока составляет 0 (1), 0.05 (2), 0.1 (3) и 0.2 (4). Амплитуда импульса 50 мВ, время импульса 50 мс, скорость изменения потенциала 10 мВ/с.
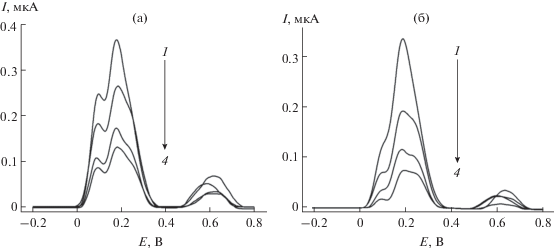
Рис. 5.
Влияние молока на антиоксидантную емкость зеленого (1–5), белого (6, 7), полуферментированного (8, 9) и черного чая (10–15) по данным вольтамперометрии на поликверцетин/МУНТ/СУЭ на фоне фосфатного буферного раствора с рН 7.0.
Проведенные исследования показали, что разработанный вольтамперометрический подход для оценки полифенол-протеиновых взаимодействий, основанный на электроокислении полифенолов чая на электроде, модифицированном поликверцетином, является простым, экспрессным и может рассматриваться как альтернатива существующим методам оценки полифенол-протеиновых взаимодействий для применения в анализе продуктов питания.
Работа выполнена при финансовой поддержке РФФИ (проект 16-03-00507-а).
Список литературы
Ozdal T., Capanoglu E., Altay F. A review on protein–phenolic interactions and associated changes // Food Res. Int. 2013. V. 51. № 2. P. 954.
Зиятдинова Г.К., Будников Г.К. Природные фенольные антиоксиданты в биоаналитической химии: состояние проблемы и перспективы развития // Успехи химии. 2015. Т. 84. № 2. С. 194. (Ziyatdinova G.K., Budnikov H.C. Natural phenolic antioxidants in bioanalytical chemistry: state of the art and prospects of development // Russ. Chem. Rev. 2015. V. 84. № 2. P. 194.)
Poklar Ulrih N. Analytical techniques for the study of polyphenol–protein interactions // Crit. Rev. Food Sci. Nutr. 2017. V. 57. № 10. P. 2144.
Fechner P., Bleher O., Ewald M., Freudenberger K., Furin D., Hilbig U., Kolarov F., Krieg K., Leidner L., Markovic G., Proll G., Proll F., Rau S., Riedt J., Schwartz B., Weber P., Widmaier J. Size does matter! Label-free detection of small molecule-protein interaction // Anal. Bioanal. Chem. 2014. V. 406. № 17. P. 4033.
Ziyatdinova G., Nizamova A., Budnikov H. Novel coulometric approach to evaluation of total free polyphenols in tea and coffee beverages in presence of milk proteins // Food Anal. Methods. 2011. V. 4. № 3. P. 334.
Низамова А.М., Зиятдинова Г.К., Будников Г.К. Электрогенерированный бром – кулонометрический реагент для оценки биодоступности полифенолов // Журн. аналит. химии. 2011. Т. 66. № 3. С. 308. (Nizamova A.M., Ziyatdinova G.K., Budnikov G.K. Electrogenerated bromine as a coulometric reagent for the estimation of the bioavailability of polyphenols // J. Analyt. Chem. 2011. V. 66. № 3. P. 301.)
Kilmartin P.A., Hsu C.F. Characterisation of polyphenols in green, oolong, and black teas, and in coffee, using cyclic voltammetry // Food Chem. 2003. V. 82. № 4. P. 501.
Ziyatdinova G., Kozlova E., Budnikov H. Polyquercetin/MWNT-modified electrode for the determination of natural phenolic antioxidants // Electroanalysis. 2017. V. 29. № 11. P. 2610.
Novak I., Šeruga M., Komorsky-Lovrić Š. Electrochemical characterization of epigallocatechin gallate using square-wave voltammetry // Electroanalysis. 2009. V. 21. № 9. P. 1019.
Novak I., Šeruga M., Komorsky-Lovrić Š. Characterisation of catechins in green and black teas using square-wave voltammetry and RP-HPLC-ECD // Food Chem. 2010. V. 122. № 4. P. 1283.
Roginsky V., Barsukova T., Hsu C.F., Kilmartin P.A. Chain-breaking antioxidant activity and cyclic voltammetry characterization of polyphenols in a range of green, oolong, and black teas // J. Agric. Food Chem. 2003. V. 51. № 19. P. 5798.
Le Bourvellec C., Renard C.M.G.C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms // Crit. Rev. Food Sci. Nutr. 2012. V. 52. № 3. P. 213.
Charlton A.J., Baxter N.J., Khan M.L., Moir A.J., Haslam E., Davies A.P., Williamson M.P. Polyphenol/peptide binding and precipitation // J. Agric. Food Chem. 2002. V. 50. № 6. P. 1593.
Siebert K.J., Troukhanova N.V., Lynn P.Y. The nature of polyphenol-protein interactions // J. Agric. Food. Chem. 1996. V. 44. № 1. P. 80.
Kosińska A., Andlauer W. Antioxidant capacity of tea: Effect of processing and storage / Processing and Impact on Antioxidants in Beverages / Ed. Preedy V. Amsterdam: Elsevier, 2014. P. 109.
Jöbstl E., Howse J.R., Fairclough J.P.A., Williamson M.P. Noncovalent cross-linking of casein by epigallocatechin gallate characterized by single molecule force microscopy // J. Agric. Food Chem. 2006. V. 54. № 12. P. 4077.
Zorilla R., Liang L., Remondetto G., Subirade M. Interaction of epigallocatechin-3-gallate with β-lactoglobulin: molecular characterization and biological implication // Dairy Sci. Technol. 2011. V. 91. № 5. P. 629.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


