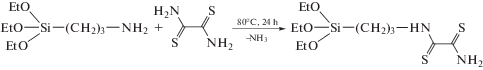Журнал аналитической химии, 2020, T. 75, № 5, стр. 466-472
Потенциометрическое определение палладия(ii) в водных растворах с применением модифицированного угольно-пастового электрода
А. С. Холмогорова a, *, Е. А. Свинцова a, Л. К. Неудачина a, Е. Л. Лебедева a, И. С. Пузырев b
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург,
ул. Куйбышева, 48а, Россия
b Институт органического синтеза имени И.Я. Постовского Уральского отделения Российской академии наук
620990 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: kholmoghorovaa@mail.ru
Поступила в редакцию 12.02.2019
После доработки 04.11.2019
Принята к публикации 04.11.2019
Аннотация
Для сконструированных угольно-пастовых электродов (УПЭ) с содержанием модифицированного дитиооксамидом полисилоксана 0–20% исследованы основные электродные функции по отношению к палладию(II). Подобраны условия потенциометрического титрования палладия(II) с применением модифицированных УПЭ в качестве индикаторных сенсоров: рН 1–2, титрант – растворы ЭДТА и иодида калия, содержание модификатора – 0, 5 и 10%. Разработана методика определения палладия(II) в водных растворах. Методика апробирована на ГСО раствора палладия(II) и промышленно выпускаемом активаторе Pd-600.
Палладий и соединения на его основе широко используют в электротехнической, химической, ювелирной, автомобильной промышленности, в производстве оборудования для космических станций, что обусловлено их уникальными физико-химическими свойствами. Кроме того, координационные соединения палладия обладают антиканцерогенными свойствами, на их основе получают лекарственные препараты для лечения злокачественных новообразований.
К сожалению, широкое использование изделий, содержащих палладий, в повседневной жизни привело к попаданию этого металла в окружающую среду. Так, платиновые металлы, входящие в состав автомобильных каталитических конвертеров, из-за истирания поверхности выбрасываются в атмосферу и загрязняют дороги и прилежащие зоны. Эти частицы имеют размер порядка 1–2 мкм и могут глубоко проникать в легкие человека и оказывать токсическое действие [1]. В связи с этим необходимо осуществлять контроль за выбросом даже следовых количеств палладия в окружающую среду. Таким образом, разработка аналитических методов, позволяющих определять микроконцентрации палладия на фоне макроколичеств компонентов матрицы, – актуальная задача.
Описан ряд методов определения ионов палладия в многокомпонентных образцах: пламенная атомно-абсорбционная спектроскопия (ПААС) [2–4], атомно-абсорбционная спектроскопия с электротермической атомизацией [4, 5], атомно-эмиссионная спектроскопия с индуктивно связанной плазмой [4, 6, 7] и электрохимические методы анализа (ЭХМА). В сравнении с другими ЭХМА потенциометрию отличают точность результатов измерений, экспрессность и высокая чувствительность. По сравнению с оптическими методами потенциометрия является более экономичной.
Разработка потенциометрических ионселективных электродов − актуальная область исследований, она охватывает широкий диапазон определяемых элементов, присутствующих в водных и органических средах [8]. Применение угольно-пастовых электродов в электроанализе в качестве ионселективных сенсоров имеет ряд преимуществ: низкое омическое сопротивление, малое время отклика, низкая стоимость, простота и доступность методики изготовления, удобство практического применения, химическая инертность и возобновляемая поверхность, что способствует получению стабильных и воспроизводимых результатов измерений [9, 10]. Введение в состав УПЭ модификатора позволяет добавить к традиционным свойствам электродной поверхности новые функциональные возможности, которые повышают реакционную и избирательную способности индикаторного электрода [11]. В зависимости от природы соединения, введенного в состав угольной пасты, УПЭ могут давать отклик на различные соединения. Так, в настоящее время активно ведутся исследования по созданию новых модифицированных УПЭ для определения органических и неорганических соединений потенциометрическим методом [12–15].
Ранее нами установлено [16, 17], что сорбент на основе полисилоксана с поверхностно закрепленными группами дитиооксамида (ДТОАП) обладает высокой селективностью в отношении извлечения ионов благородных металлов, в частности, палладия(II), а также высокими емкостными характеристиками.
Цель настоящего исследования – изготовление и аттестация УПЭ, модифицированного полисилоксаном с привитыми группами рубеановодородной кислоты (дитиооксамида), для обнаружения и определения содержания палладия(II) в водных образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез дитиооксамидированного полисилоксана. К 2.40 мл (10 ммоль) раствора 3-аминопропилтриэтоксисилана в 200 мл сухого толуола в атмосфере аргона добавляли 1.020 г (10 ммоль) дитиооксамида (ДТО), выдерживали 24 ч при 80°C и постоянном перемешивании, после чего добавляли 2.23 мл (10 ммоль) тетраэтоксисилана, 65 мл этанола (95%) и выдерживали при 80°C еще 2 ч. После охлаждения осадок фильтровали, промывали этанолом, сушили при 70°C в течение 24 ч. Для удаления из сорбента свободного ДТО использовали горячую экстракцию хлороформом, после чего продукт сушили при 70°C. Получено 1.36 г сорбента.
Приготовление рабочих растворов. Раствор ионов палладия(II) готовили из хлорида палладия (Acros, США) путем растворения точной навески соли в 0.1 М HCl. Растворы ЭДТА, иодида калия и тиомочевины готовили растворением точных навесок соответствующих реактивов квалификации х. ч. в дистиллированной воде.
Изготовление угольно-пастового электрода. Для приготовления угольной пасты к измельченному в ступке и просеянному через сито графиту добавляли пластификатор – парафиновое масло и ДТОАП в качестве модифицирующего компонента. Соотношение масс компонентов приведено в табл. 1. После тщательного перемешивания угольную пасту помещали в инертный пластмассовый корпус, представляющий собой длинную узкую трубку диаметром 6.0 мм, с поршнем и медным токоотводом. Избыток парафинового масла из спрессованной пасты удаляли фильтровальной бумагой, приложенной к торцу сенсора. Изготовленные электроды исследовали после полного высыхания угольной пасты. Перед каждой серией измерений поверхность электрода обновляли путем выдавливания и срезания небольшого количества пасты, торец сенсоров зашлифовывали фильтровальной бумагой.
Таблица 1.
Состав угольной пасты изготовленных электродов (содержание пластификатора – 30 мас. %)
| Электрод | Модификатор, мас. % | Углерод, мас. % |
|---|---|---|
| 1 | 0 | 70 |
| 2 | 5 | 65 |
| 3 | 10 | 60 |
| 4 | 20 | 50 |
Исследование электрохимических свойств угольно-пастовых электродов. Рабочую область рH электродов выбирaли следующим образом: в химический стакан, содержащий раствор палладия(II) и уксусную кислоту, погружали индикаторный УПЭ с определенной степенью модифицирования и двухключевой хлоридсеребряный электрод сравнения ЭСр-10101, присоединенные к милливольтметру АВМ-4307, комбинированный электрод ЭСК-10601/7 и термодатчик, присоединенные к иономеру И-160МИ. Величину ЭДС измеряли в зависимости от величины рН, которую создавали путем добавления в анализируемый раствор концентрированного раствора аммиака.
Основные электродные функции УПЭ изучали при выбранном значении pH в интервале концентраций хлорида палладия(II) от 1 × 10–9 до 0.01 М. По полученным результатам строили зависимости E = f(–lg cPd(II)) и обрабатывали их согласно рекомендациям ИЮПАК [18].
Потенциометрическое титрование раствора палладия(II). В химический стакан с анализируемым раствором помещали индикаторный УПЭ и двухключевой хлоридсеребряный электрод сравнения ЭСр-10101, присоединенные к милливольтметру. Выполняли титрование путем добавления небольших порций титранта и регистрировали значения потенциала системы. Полученные кривые титрования E = f(Vтитранта) обрабатывали согласно рекомендациям ИЮПАК [17]. Концентрацию металла рассчитывали по формуле:
где Р – содержание иона палладия, мг/мл; ститранта – концентрация титранта, М; Vтитранта – объем титранта в точке эквивалентности, мл; M – молярная масса палладия, г/моль; Vал – объем аликвоты анализируемого раствора, мл.Определение палладия(II) методом пламенной атомно-абсорбционной спектрометрии. Концентрацию палладия(II) в растворах определяли на атомно-абсорбционном спектрометре Solaar M6 (Thermo Electron) с атомизацией в пламени ацетилен–воздух по предварительно построенному градуировочному графику. Из ГСО 8432-2003 состава раствора ионов палладия(II) готовили градуировочные растворы с концентрациями палладия(II) 1, 5, 10 и 20 мг/мл. Настройки работы спектрометра: расход ацетилена – 1.0 л/мин; параллельных измерений – 3; время каждого измерения – 4 с; ток лампы – 50%; без фоновой компенсации; длина волны 247.6 нм.
Методика потенциометрического определения палладия(II) в водных растворах. В химический стакан помещали аликвоту анализируемого раствора, создавали значение pH 1–2 добавлением HCl, разбавляли дистиллированной водой. Погружали в раствор индикаторный УПЭ и двухключевой хлоридсеребряный электрод сравнения и титровали путем добавления небольших порций 0.001 М раствора KI. По полученным данным стоили интегральные и дифференциальные кривые титрования, содержание металла в анализируемом образце рассчитывали по формуле, приведенной выше.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и аттестация сорбента – дитиооксамидированного полисилоксана. Ранее для синтеза ДТ-ОАП использовали метод гетерогенного взаимодействия аминопропилполисилоксана с рубеановодородной кислотой [19]. В настоящей работе предпринята попытка усовершенствования метода синтеза путем проведения реакции амидирования ДТО в гомогенных условиях с последующей поликонденсацией in situ. На первой стадии в сухом толуоле проводили реакцию между 3-аминопропилтриэтоксисиланом и рубеановодородной кислотой:
После этого в реакционную смесь добавляли тетраэтоксисилан и водный этанол:
В результате гидролиза ДТОАП образовывался в виде осадка, который после очистки и сушки идентифицировали с использованием данных элементного анализа и ИК-Фурье спектроскопии. Найдено: C – 26.33%, H – 4.81%, N – 12.42%, S – 6.36%. Рассчитанное значение концентрации привитых дитиооксамидных групп – 1.0 ммоль/г.
Аттестация угольно-пастовых электродов. Известно, что концентрация ионов водорода влияет на работу электродов, поэтому определение рабочей области pH УПЭ является важной задачей исследования. Влияние кислотности среды на ЭДС электродов изучали в диапазоне рН от 0.5 до 9.0, используя HCl и аммиачно-ацетатную буферную систему (рис. 1).
Рис. 1.
Зависимость ЭДС ячейки с индикаторным угольно-пастовым электродом от величины pH аммиачно-ацетатного буферного раствора. Содержание сорбента − дитиооксамидированного полисилок-сана – в электроде, %: 1 – 0, 2 – 5, 3 – 10, 4 – 20. Концентрация палладия(II) в растворе 0.001 М.
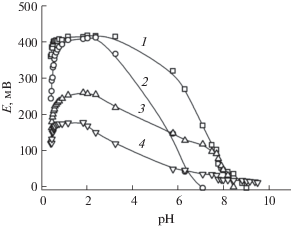
Зависимости, полученные для электродов с различным содержанием модификатора, аналогичны и состоят из нескольких участков. В интервале pH 1−2 имеются прямолинейные участки, где значения ЭДС электродов сохраняют постоянные значения при изменении кислотности раствора. Дальнейшие исследования свойств УПЭ проводили в указанном диапазоне кислотности среды.
Очевидно, отклик УПЭ на палладий(II) обусловлен сорбцией иона металла компонентами углеродной пасты: графитом и ДТОАП, поэтому вид полученных зависимостей можно объяснить с точки зрения влияния кислотности среды на сорбционное извлечение палладия(II) этими компонентами. На углеродных сорбентах [20, 21] и ДТОАП [15, 16] палладий(II) извлекается в сильнокислой области рН, при этом ион металла находится в растворе в виде кинетически лабильных комплексных соединений состава [Pd(H2O)nCl4 –n]n– 2, где n может изменяться от 0 до 3 [22, 23]. При pH > 8 сорбция практически отсутствует, что объясняется образованием химически инертных гидроксо- и аммиачных комплексов палладия(II), во внутренней координационной сфере которых отсутствуют хлорид-ионы [24].
Сконструированные электроды градуировали в растворах хлорида палладия(II) в интервале концентраций 1 × 10–9–0.01 М. По зависимостям E = f(–lg cPd(II)) для всех исследуемых модифицированных УПЭ определили основные электродные функции: области линейности, значения крутизны и пределы обнаружения (табл. 2). Из табл. 2 видно, что крутизна электродной функции для всех электродов превышает справочное значение для двухзарядных ионов. Данную закономерность можно объяснить, во-первых, влиянием природы пластификатора, входящего в состав угольной пасты электрода, во-вторых, протеканием нескольких электродных процессов [25]: образованием в водной системе комплексных ионов палладия(II) различного состава [20, 21], сорбцией ионов металла на поверхности электрода. Диапазон линейности и крутизна электродной функции немодифицированного электрода совпадают с данными [26]. Максимальная величина предела обнаружения наблюдается для электрода, содержащего 20% ДТОАП, что, вероятно, связано с расположением на рабочей поверхности датчика большого числа сорбционных центров.
Таблица 2.
Основные электродные функции угольно-пастового электрода по отношению к палладию(II) (аммиачно-ацетатный буферный раствор, pH 1.5)
| Электрод | Содержание модификатора, мас. % | Область линейности электродной функции, М | Крутизна электродной функции, мВ/pPd | Предел обнаружения, М |
|---|---|---|---|---|
| 1 | 0 | 10–5–10–2 | 106.4 | 1.3 × 10–6 |
| 2 | 5 | 10–5–10–2 | 110.5 | 6.7 × 10–6 |
| 3 | 10 | 10–6–10–2 | 58.6 | 1.2 × 10–6 |
| 4 | 20 | 10–5–10–2 | 66.8 | 1.0 × 10–5 |
Для определения концентрации палладия(II) в растворе методом потенциометрического титрования необходимо выбрать титрант. При выборе раствора титранта учитывали скорость, стехиометрию реакции и величину скачка потенциала в точке эквивалентности. Известно, что образование в системе комплексных соединений способствует более резкому изменению потенциала в точке эквивалентности, поэтому в настоящей работе в качестве титрантов выбрали растворы ЭДТА, KI и тиомочевины. Кривые титрования с разными титрантами приведены на рис. 2.
Рис. 2.
Интегральные кривые титрования 0.01 М раствора палладия(II) 0.01 М растворами тио-мочевины (1), ЭДТА (2), иодида калия (3). Содержание сорбента − дитиооксамидированного полисилоксана − в электроде 5%. Аммиачно-ацетатный буферный раствор с pH 2.

При использовании в качестве титранта раствора тиомочевины не удалось получить кривые титрования с четко выраженным скачком потенциала. В случае растворов KI и ЭДТА зависимости имеют все участки, характерные для интегральных кривых титрования, что указывает на возможность разработки методики потенциометрического определения палладия(II) с применением сконструированных УПЭ. Наименьшая величина скачка потенциала в точке эквивалентности наблюдается для электрода с содержанием модификатора 20%. В дальнейшем для потенциометрического определения палладия(II) использовали УПЭ, содержащие 0, 5 и 10% модификатора, и растворы ЭДТА и KI.
Правильность работы сконструированных УПЭ проверяли титрованием раствора государственного стандартного образца раствора палладия(II) (ГСО 8432-2003), содержащего кроме определяемого компонента 2.0 М HCl. Для создания необходимой кислотности среды использовали аммиачно-ацетатную буферную систему и соляную кислоту. В качестве титранта использовали 0.001 М растворы KI и ЭДТА. На рис. 3 приведены дифференциальные кривые титрования для УПЭ с содержанием ДТОАП 5%. Важно отметить, что при использовании раствора KI скачок потенциала в точке эквивалентности больше по сравнению с ЭДТА, что позволяет более точно определять содержание металла.
Рис. 3.
Дифференциальные кривые титрования ГСО раствора палладия(II). Содержание сорбента − дитиооксамидированного полисилоксана – в электроде 5%. Титрант: 1 – раствор ЭДТА, 2 – раствор KI. Фон – раствор HCl с pH 2.
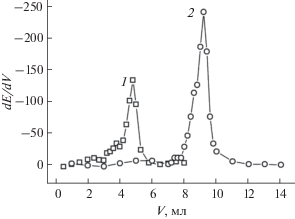
По полученным кривым титрования рассчитали концентрацию палладия(II) в анализируемом растворе и сравнили с аттестованным содержанием в ГСО (табл. 3). Полученные результаты доказывают правильность работы сконструированных электродов. На основании полученных данных разработана методика потенциометрического определения палладия(II) в водных растворах с применением УПЭ.
Таблица 3.
Результаты (мг/мл) определения концентрации палладия(II) в растворе ГСО 8432-2003 методом потенциометрического титрования (n = 10, Р = 0.95)
| Титрант | Содержание модификатора в УПЭ | Аттестованное значение | ||
|---|---|---|---|---|
| 0% | 5% | 10% | ||
| KI | 1.01 ± 0.01 | 0.99 ± 0.01 | 1.00 ± 0.01 | 1.00 ± 0.01 |
| ЭДТА | 1.02 ± 0.03 | 1.03 ± 0.02 | 0.98 ± 0.03 | |
Установлено, что в процессе титрования значение pH растворов не меняется. Это указывает на отсутствие необходимости использовать буферные системы, которые могут осложнить определение аналита. В дальнейшем для создания нужной кислотности среды применяли соляную кислоту.
Сконструированные электроды апробировали в анализе раствора активатора Pd-600, в состав которого входит хлорид палладия (<0.5%) и соляная кислота (<5%). Анализируемый раствор титровали подобранными ранее титрантами без использования буферного раствора. Для определения минимального объема активатора, в котором возможно определить концентрацию палладия(II), титровали различные аликвоты анализируемого раствора (рис. 4). Видно, что электроды чувствительны к ионам палладия(II) во всем интервале объемов активатора и способны определять ион металла даже в малых объемах анализируемого раствора. Установлено, что в случае титрования 0.2 мл активатора 0.01 М раствором ЭДТА рассчитанная концентрация палладия(II) отличается от аттестованного значения более чем в два раза. Таким образом, этот титрант неприменим для количественного анализа пробы с содержанием палладия(II) менее 40 мкг/мл. Рассчитанные значения концентрации палладия(II) в растворе активатора Pd-600 приведены в табл. 4. Раствор анализировали также на пламенном атомно-абсорбционном спектрометре.
Рис. 4.
Дифференциальные кривые титрования 0.2 (1), 0.5 (2), 1.0 (3), 5.0 (4) мл активатора Pd-600 0.01 М раствором KI. Содержание сорбента − дитиооксамидированного полисилоксана – в угольно-пастовом электроде 5%. Фон – раствор HCl с pH 2.
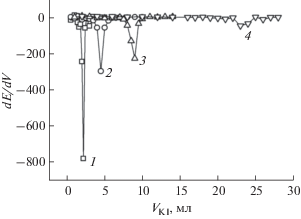
Таблица 4.
Результаты (мг/мл) определения концентрации палладия(II) в растворе активатора методами потенциометрического титрования и пламенной атомно-абсорбционной спектрометрии (n = 10, Р = 0.95)
| Содержание модификатора, % | Титрант | Метод ПААС | |
|---|---|---|---|
| ЭДТА | KI | ||
| 0 | 2.43 ± 0.05 | 2.41 ± 0.01 | 2.4 ± 0.2 |
| 5 | 2.45 ± 0.06 | 2.41 ± 0.01 | |
| 10 | 2.40 ± 0.07 | 2.40 ± 0.01 | |
* * *
Таким образом, в заключение можно отметить, что наиболее узкий интервал допустимой погрешности измерений получен для раствора иодида калия. Аналогичный вывод сделан авторами работ [27, 28] при потенциометрическом определении палладия(II) в растворах различного состава. Кроме того, при определении палладия(II) методом ПААС отклонение результатов от среднего значения больше по сравнению с потенциометрическим методом, что связано с проведением дополнительной процедуры разбавления анализируемого раствора. Таким образом, разработанная нами методика определения палладия(II) c применением УПЭ отличается не только низкой стоимостью аппаратуры, простотой конструкции электрода и доступностью рабочих реактивов, но и выигрывает в точности результатов измерений. Следует отметить, что электроды, содержащие 5 и 10% ДТОАП, не уступают немодифицированному УПЭ в чувствительности. Однако поскольку ДТОАП обладает определенной селективностью к ионам палладия(II) [15, 16], от модифицированных электродов можно ожидать высокой избирательности при определении металла в сложных системах. Принимая во внимание сорбционные свойства и избирательность ДТОАП, можно заключить, что одним из перспективных вариантов его применения в химическом анализе является использование в качестве модификатора графитовых электродов.
Работа выполнена при финансовой поддержке постановления № 211 Правительства Российской Федерации, контракт № 02.A03.21.0006.
Список литературы
Chwastowska J., Skwara W., Sterlińska E., Pszonicki L. Determination of platinum and palladium in environmental samples by graphite furnace atomic absorption spectrometry after separation on dithizone sorbent // Talanta. 2004. V. 64. № 1. P. 224.
Sharma R.K. An optimized procedure for preconcentration, determination and on-line recovery of palladium using highly selective diphenyldiketonemonothiosemicarbazone modified silica gel // J. Hazard. Mater. 2012. V. 209–210. № 1. P. 285.
Ebrahimzadeh H. Determination of very low levels of gold and palladium in wastewater and soil samples by atomic absorption after preconcentration on modified mcm-48 and mcm-41 silica // Talanta. 2010. V. 81. № 4. P. 1183.
Лосев В.Н., Бородина Е.В., Буйко О.В., Мазняк Н.В., Трофимчук А.К. Сорбционно-спектрометрическое определение палладия и золота с использованием силикагеля, химически модифицированного дипропилдисульфидными группами // Журн. аналит. химии. 2014. Т. 69. № 5. С. 462. (Losev V.N., Borodina E.V., Buiko O.V., Maznyak N.V., Trofimchuk A.K. Sorption-spectrometric determination of palladium and gold using silica chemically modified with dipropyl disulfide groups // J. Analyt. Chem. 2014. V. 69. № 5. Р. 413.)
Andrada D. Determination of Ag, Au, and Bi in ethanol by ETAAS using zirconium as permanent modifier // At. Spectrosc. 2005. V. 26. № 4. P. 151.
Гражулене С.С., Телегин Г.Ф., Золотарева Н.И., Редькина А.Н. Определение серебра и палладия методами атомной спектрометрии после сорбционного концентрирования на углеродных нанотрубках // Заводск. лаборатория. Диагностика материалов. 2015. Т. 81. № 8. С. 5.
Jamali M.R. Application of thiophene-2-carbaldehyde-modified mesoporous silica as a new sorbent for separation and preconcentration of palladium prior to inductively coupled plasma atomic emission spectrometric determination // Talanta. 2007. V. 71. № 4. P. 1524.
Bratovčić A., Odobašić A., Ćatić S. The advantages of the use of ion-selective potentiometry in relation to UV/Vis spectroscopy // Agric. Conspec. Sci. 2009. V. 74. № 3. P. 139.
Nour El-Dein F.A., Mohamed G.G., Frag E.Y.Z., Mohamed El-Badry M. Modified screen printed and carbon paste ion selective electrodes for potentiometric determination of naphazoline hydrochloride in pure and pharmaceutical preparations // Int. J. Electrochem. Sci. 2012. V. 7. P. 10266.
Svancara I., Vytras K., Barek J., Zima J. Carbon paste electrodes in modern electroanalysis // Crit. Rev. Anal. Chem. 2001. V. 31. № 4. P. 311.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии, медицине. М.: БИНОМ. Лаборатория знаний, 2009. 416 с.
Abu-Shawish H.M., Ghalwa N.A., Zaggout F.R., Saadeh S.M. Improved determination of tramadol hydrochloride in biological fluids and pharmaceutical preparations utilizing a modified carbon paste electrode // Biochem. Eng. J. 2010. V. 48. № 2. P. 237.
Guo J., Chai Y., Yuan R., Song Z., Zou Z. Lead(II) carbon paste electrode based on derivatized multi-walled carbon nanotubes: Application to lead content determination in environmental samples // Sensor. Actuators B. 2011. V. 155. № 2. P. 639.
Ghaedi M., Shokrollahi A., Salimibeni A.R., Noshadi S., Joybar S. Preparation of a new chromium(III) selective electrode based on 1-[(2-hydroxy ethyl) amino]-4-methyl-9H-thioxanthen-9-one as a neutral carrier // J. Hazard. Mater. 2010. V. 178. № 1–3. P. 157.
Zhang T., Chai Y., Yuan R.-Y., Guo J. Potentiometric detection of silver(I) ion based on carbon paste electrode modified with diazo-thiophenol-functionalized nanoporous silica gel // Mater. Sci. Eng. 2012. V. 32. № 5. P. 1179.
Холмогорова А.С., Неудачина Л.К., Пузырев И.С., Пестов А.В. Сорбционное извлечение переходных металлов дитиооксамидированным полисилоксаном // Журн. прикл. химии. 2014. Т. 87. № 10. С. 1449. (Kholmogorova A.S., Neudachina L.K., Puzyrev I.S., Pestov A.V. Sorption recovery of transition metals with dithiooxamidated polysiloxane // Russ. J. Appl. Chem. 2014. V. 87. № 10. Р. 1450.)
Холмогорова А.С., Неудачина Л.К., Галиева З.Р., Пузырев И.С. Сорбционно-атомно-абсорбционное определение палладия(II) в водных растворах с применением дитиооксамидированного полисилоксана // Заводск. лаборатория. Диагностика материалов. 2018. Т. 84. № 3. С. 5.
Buck P.R., Lindner E. Recommendations for nomenclature of ion-selective electrodes // J. Pure Appl. Chem. 1994. V. 66. № 12. P. 2527.
Пузырев И.С., Холмогорова А.С., Неудачина Л.К., Пестов А.В., Мехаев А.В. Получение сорбционных материалов на основе дитиооксамидированного аминопропилполисилоксана // Журн. прикл. химии. 2014. Т. 87. № 6. С. 715. (Puzyrev I.S., Kholmogorova A.S., Neudachina L.K., Pestov A.V., Mekhaev A.V. Synthesis of sorption materials based on dithiooxamidate aminopropyl polysiloxane // Russ. J. Appl. Chem. 2014. V. 87. № 6. P. 715.)
Chakrapani G., Mahanta P.L., Murty D.S.R., Gomathy B. Preconcentration of traces of gold, silver and palladium on activated carbon and its determination in geological samples by flame AAS after wet ashing // Talanta. 2001. V. 53. № 6. P. 1139.
Sharififard H., Soleimani M., Ashtiani F.Z. Evaluation of activated carbon and bio-polymer modified activated carbon performance for palladium and platinum removal // J. Taiwan Inst. Chem. Eng. 2012. V. 43. № 5. P. 696.
Colombo C., Oates C.J., Monhemius A.J., Plant J.A. Complexation of platinum, palladium and rhodium with inorganic ligands in the environment // Geochem-Explor. Env. A. 2008. V. 8. № 1. P. 91.
Elding L.I. Palladium(II) halide complexes. I. Stabilities and spectra of palladium(II) chloro and bromo aqua complexes // Inorg. Chim. Acta. 1972. V. 6. P. 647.
Millic N.B., Bugarcic Z.D. Hydrolysis of the palladium(II) ion in sodium chloride medium // Transit. Metal. Chem. 1984. V. 9. № 5. P. 173.
Барбалат Ю.А., Власов Ю.Г., Демин В.А., Ермоленко Ю.Е., Золотов Ю.А., Иванов В.М., Калинкин И.П., Карцова А.А., Колодников В.В., Мосичев В.И., Москвин Л.Н., Немец В.М., Никитина Т.Г., Родинков О.В., Сайдов Г.В., Свердлова О.В., Соловьев А.А., Теплых В.Ф., Халонин А.С., Якимова Н.М., Яшин А.Я., Яшин Я.И. Новый справочник химика и технолога. Аналитическая химия. СПб: АНО СПб НПО “Мир и Семья”, 2003. 217 с.
Velmurugan M., Thirumalraj B., Chen S.-M. Development of electrochemical sensor for the determination of palladium ions (Pd2+) using flexible screen printed un-modified carbon electrode // J. Colloid Interf. Sci. 2017. V. 485. № 1. P. 123.
Mohamed T., Mohamed Z., Mohamed A.E1-S.P. Potentiometric determination of silver(I), palladium(II) and gold(III) in mixtures by use of an iodide-selective electrode // Microchim. Acta. 1991. V. 103. № 3–4. P. 191.
Fraser J.G., Beamish F.E., Mcbryde W.A.E. Separation of palladium from lead and the colorimetric determination of palladium with potassium iodide // Anal. Chem. 1954. V. 26. № 3. P. 495.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии