Журнал аналитической химии, 2020, T. 75, № 6, стр. 521-526
Определение элементного состава витаминно-минеральных комплексов методом рентгенофлуоресцентного анализа с полным внешним отражением
Д. В. Данилов a, *, П. Ю. Шаранов a, Н. В. Алов a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: danilov.dmitriy.96@gmail.com
Поступила в редакцию 31.05.2019
После доработки 20.07.2019
Принята к публикации 25.12.2019
Аннотация
Представлены способы определения элементного состава витаминно-минеральных комплексов (Мультифорт®, Компливит®). Предложено использовать современный аналитический метод – рентгенофлуоресцентный анализ с полным внешним отражением. Описаны различия в пробоподготовке для оболочечных и безоболочечных витаминно-минеральных комплексов. Установлено влияние оболочки на результаты анализа. Результаты качественного и количественного анализа сопоставлены с заявленными значениями фирмы-производителя.
Витаминно-минеральные комплексы (ВМК) содержат различные неорганические элементы, которые обладают биохимической активностью. Нехватка этих веществ в организме приводит к физиологическим нарушениям, а также вносит свой вклад в клиническую картину других соматических заболеваний и может служить причиной различных болезней [1]. Задокументировано несколько наиболее известных современных и традиционных методов фармацевтического анализа, однако оптимальные интервалы и предельно допустимые концентрации элементов в данных объектах не регламентированы Государственной фармакопеей РФ [2]. Аналитический контроль элементного состава и его соответствия указанному содержанию в инструкциях является задачей фармацевтического анализа [3]. Содержание различных элементов в ВМК может варьироваться от нескольких микрограммов до десятков миллиграммов на грамм препарата.
Для определения элементного состава ВМК применяют современные и традиционные методы, такие как атомно-эмиссионная спектроскопия с индуктивно связанной плазмой [4], масс-спектрометрия с индуктивно связанной плазмой [5–7], рентгенофлуоресцентный анализ (РФА) [8] и атомно-абсорбционная спектроскопия [9]. Значительную часть времени при анализе этими методами занимает перевод образца в раствор. Кроме того, они характеризуются высокой стоимостью анализа и требуют тщательной градуировки для устранения матричных эффектов либо не позволяют проводить многоэлементный анализ [10].
В настоящей работе предложено использовать современный вариант РФА — рентгенофлуоресцентный анализ с полным внешним отражением (РФА ПВО). В РФА ПВО используют геометрию 0.1°/90° (первичное рентгеновское излучение направляется на образец под скользящим углом ~0.1°), в отличие от классических вариантов РФА (45°/45°). Таким образом, достигается эффект полного внешнего отражения. В РФА ПВО детектор размещают очень близко к поверхности прободержателя, обеспечивая таким образом большой телесный угол сбора излучения и высокую скорость счета. Первичное излучение слабо проникает в подложку и отражается в направлении поглотителя, не попадая в детектор и дополнительно возбуждая образец. Однако благодаря тонкому слою образца и монохроматичности возбуждающего излучения можно добиться пониженного уровня фонового излучения и снизить пределы обнаружения (ПО), достигая в ряде случаев уровней мкг/кг (или мкг/л). Также можно избавиться от явления реабсорбции рентгеновского излучения. При уменьшении толщины слоя образца ниже некоторого критического значения практически не проявляются матричные эффекты [1, 11].
Преимуществами метода РФА ПВО по сравнению с традиционным энергодисперсионным РФА являются низкие пределы обнаружения, высокое отношение сигнал/шум, отсутствие матричных эффектов, а также возможность проведения количественного анализа способом внутреннего стандарта и отсутствие необходимости внешней градуировки. Метод применяют для анализа жидких объектов [12], биологических тканей, почв, геологических и археологических объектов [13].
Цель настоящей работы – разработка способов пробоподготовки для различных типов ВМК и определение элементного состава ВМК методом РФА ПВО, а также сравнение полученных данных с заявленными фирмой-производителем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика эксперимента. В качестве объектов исследования выбрали ВМК “Мультифорт” (ООО “Сантэфарм”, Россия) и “Компливит” (ОАО “УфаВита”, Россия). Измерения проводили на спектрометре РФА ПВО S2 PICOFOX (Bruker Nano GmbH, Германия) с использованием кварцевых подложек-отражателей. Время набора спектра 250 с. Для возбуждения рентгеновской флуоресценции использовали излучение MoKα (17.44 кэВ).
Таблетку ВМК “Мультифорт” помещали в мерную колбу емк. 100 мл и растворяли в дистиллированной воде. Далее отбирали три аликвоты объемом 1 мл каждая, в каждую из которых вводили по 5 мкл внутреннего стандарта. В качестве внутреннего стандарта для различных аликвот выбрали водные растворы никеля, галлия (1000 мкг/мл, Fluka Chemical, Великобритания) и иттрия (1000 мкг/мл, ABCR, Германия). Концентрация всех внутренних стандартов составляла 5 мкг/мл. Объем анализируемого раствора, осаждаемого на кварцевую подложку-отражатель, составлял 2 мкл в каждом из измерений. Пробу, нанесeнную на подложку, высушивали в вакуумном эксикаторе (ISO Lab, Германия).
Таблетки ВМК “Компливит” размалывали в планетарной мельнице Pulverisette 7 (Fritsch, Германия) в твердой фазе в агатовой чаше с агатовыми шарами диаметром 10 мм со скоростью 700 об./мин в течение 6 мин. Далее гомогенизированный образец массой 1.0080 г, взвешенный с точностью до 0.1 мг на аналитических весах ED224S (Sartorius, Германия), помещали в колбу емк. 100 мл и растворяли в смеси 80 мл дистиллированной воды и 20 мл конц. HNO3. Для более полного растворения таблетки смесь перемешивали на лабораторном шейкере MS 3 digital (IKA, США) в течение 300 с. Из полученного раствора отбирали по 1 мл пробы в 3 виалы емк. 1.5 мл, которые далее центрифугировали на приборе MiniSpin (Eppendorf, Германия) со скоростью 8000 об/мин в течение 5 мин для отделения раствора от нерастворившихся частиц оболочки таблетки. В качестве внутреннего раствора использовали растворы иттрия, никеля и галлия (1000 мкг/мл, Fluka Chemical, Великобритания”). Пробу объемом 2 мкл, нанесeнную на кварцевую подложку-отражатель, высушивали в вакуумном эксикаторе.
Другую таблетку пытались также измельчить в агатовой ступке (Carl Roth, Германия), однако после дальнейшей пробоподготовки полученные результаты характеризовались низкой воспроизводимостью и большими погрешностями. Это объясняется тем, что при ручном помоле образец оказывается менее диспергированным и гомогенизированным.
Количественный анализ. Программное обеспечение Spectra 7 (Bruker Nano GmbH, Германия) позволяет вводить информацию о концентрациях внутренних стандартов, которые используются для расчeта содержания каждого обнаруженного элемента. Интенсивности характеристических линий присутствующих элементов автоматически определяются с помощью программного обеспечения. Концентрации обнаруженных элементов могут быть рассчитаны по формуле (1) [11]:
где ci – концентрация определяемого элемента i, cis – концентрация внутреннего стандарта, Ni – число импульсов при измерении спектра определяемого элемента i, Nis – число импульсов при измерении спектра внутреннего стандарта, Si – относительная чувствительность элемента i, Sis – относительная чувствительность элемента – внутреннего стандарта.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор способа пробоподготовки. Методика пробоподготовки ВМК “Компливит” отличается от ВМК “Мультифорт”, поскольку в случае ВМК “Компливит” не происходит полного растворения таблетки в воде. Не растворяется преимущественно оболочка, которая состоит из нерастворимых в воде вспомогательных веществ, не обладающих биологической активностью.
Пробоподготовка для определения элементного состава в фармацевтической индустрии описана достаточно подробно [14]. В настоящей работе в качестве растворителя использовали воду или смесь воды с азотной кислотой без применения органических растворителей. Не требуется также применение ПАВ, что дополнительно упрощает пробоподготовку образцов. Размалывание образцов на планетарной мельнице обеспечивает достаточно высокую степень гомогенности, что на порядок увеличивает производительность анализа. Для корректного выбора способа пробоподготовки учитывали различия в типах выбранных ВМК, один из которых (ВМК “Мультифорт”) является безоболочечным и водорастворимым, а другой (ВМК “Компливит”) – оболочечным и частично водорастворимым.
Выбор внутреннего стандарта. Выбор внутреннего стандарта для анализа витаминно-минеральных комплексов определяется прежде всего элементным составом пробы, а также возможным наложением спектральных линий внутреннего стандарта и образца. Наиболее оптимальными внутренними стандартами для ВМК “Мультифорт” являются Y, Ni и Ga, так как данные элементы не были обнаружены при определении состава препарата. Использование селена в качестве внутреннего стандарта невозможно, поскольку он заявлен фирмой-производителем в составе данного ВМК. Для ВМК “Компливит” лучше всего подходят внутренние стандарты Se, Ni и Ga по аналогичным причинам. Использование в качестве внутреннего стандарта кобальта невозможно, потому что наличие данного элемента в препарате заявлено фирмой-производителем.
Использование нескольких внутренних стандартов необходимо для получения сравнительных данных, отражающих правильность анализа. Пики различных внутренних стандартов находятся в разных энергетических диапазонах, поэтому могут иметь место частичные спектральные наложения на линии определяемых элементов. В области характеристических линий галлия наблюдается постоянный фон рассеянного излучения, поэтому он является наиболее предпочтительным элементом – внутренним стандартом. Галлий чаще всего отсутствует в большинстве исследуемых объектов. Учитывая разрешающую способность детектора (120–150 эВ), при использовании стандартов Ni, Ga, Se, Y возможны спектральные наложения NiKα (7.480 кэВ) – YbLα (7.416 кэВ), Ga-Kα (9.251 кэВ) – IrLα (9.175 кэВ), SeKβ (12.497 кэВ) – PbLβ (12.614 кэВ), YKβ (16.739 кэВ) – NbKα (16.615 кэВ). Среди элементов, для которых имеются спектральные наложения с элементами – внутренними стандартами, отсутствуют заявленные производителями ВМК элементы, что подтверждает возможность использования данных внутренних стандартов.
Элементный состав образцов. Спектр РФА ПВО образца ВМК “Компливит” с внутренним стандартом галлием представлен на рис. 1. Образцы ВМК “Компливит” содержат P, S, K, Ca, Ti, Mn, Fe, Cu, Zn, Br, Sr. В табл. 1 представлены результаты количественного определения и сравнения элементного состава ВМК “Компливит” с заявленным фирмой-производителем. Определение магния, заявленного в составе ВМК, методом РФА ПВО затруднено. Наличие титана среди обнаруженных элементов можно объяснить присутствием его соединений в составе оболочки. Наличие стронция объясняется его изоморфностью по отношению к кальцию; соединения стронция практически всегда сопутствуют соединениям кальция. Среди элементов присутствуют сера и бром, которые входят в состав биологически активных соединений, основные макроэлементы которых указаны в составе препарата. Причина отсутствия кобальта среди обнаруженных элементов, вероятно, заключается в спектральном перекрывании с линией железа: CoKα (6.931 кэВ) – FeKβ (7.059 кэВ).
Рис. 1.
Спектр рентгенофлуоресцентного анализа с полным внешним отражением образца ВМК “Компливит” с внутренним стандартом галлием.
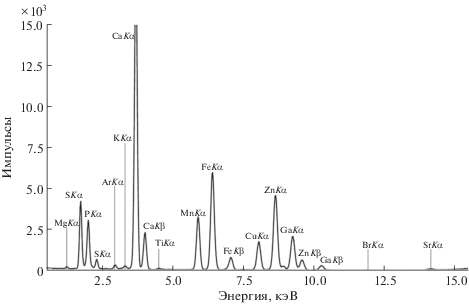
Таблица 1.
Результаты определения элементного состава в образце витаминно-минерального комплекса “Компливит” методом рентгенофлуоресцентного анализа с полным внешним отражением (n = 5, P = 0.95)
| Элемент | Экспериментально найденные концентрации, мг/г | Содержание элементов, рассчитанное на одну таблетку (m = 0.8663 г), мг | Содержание элементов, заявленное производителем, мг | ||||
|---|---|---|---|---|---|---|---|
| Se | Ni | Ga | Se | Ni | Ga | ||
| P | 65 ± 5 | 70 ± 8 | 65 ± 8 | 57 ± 5 | 61 ± 7 | 57 ± 7 | 60.00 |
| Ca | 49 ± 3 | 55 ± 5 | 48 ± 3 | 42 ± 3 | 47 ± 4 | 42 ± 3 | 50.50 |
| Mn | 3.0 ± 0.1 | 3.3 ± 0.3 | 2.9 ± 0.1 | 2.6 ± 0.1 | 2.9 ± 0.3 | 2.5 ± 0.1 | 2.50 |
| Fe | 4.5 ± 0.3 | 5.7 ± 0.5 | 6 ± 1 | 3.9 ± 0.3 | 4.9 ± 0.4 | 5 ± 1 | 5.00 |
| Co | н/о* | н/о | н/о | н/о | н/о | н/о | 0.10 |
| Cu | 0.53 ± 0.05 | 1.3 ± 0.1 | 0.84 ± 0.06 | 0.46 ± 0.04 | 1.2 ± 0.1 | 0.73 ± 0.05 | 0.75 |
| Zn | 2.0 ± 0.1 | 2.2 ± 0.2 | 1.9 ± 0.2 | 1.7 ± 0.1 | 1.9 ± 0.1 | 1.7 ± 0.1 | 2.00 |
Спектр РФА ПВО образца ВМК “Мультифорт” с внутренним стандартом галлием представлен на рис. 2. Образцы ВМК “Мультифорт” содержат S, Cl, K, Ca, Cr, Mn, Cu, Zn, Se, Br, Rb, Sr. В табл. 2 представлены результаты количественного определения и сравнения элементного состава ВМК “Мультифорт” с заявленным фирмой-производителем. Среди заявленных элементов отсутствует иод, определение которого затруднено из-за высоких потерь при пробоподготовке. В работе [15] при исследовании ВМК иод определили с достаточно высокой точностью, однако он являлся единственным определяемым элементом и пробоподготовка была существенно упрощена из-за отсутствия спектральных наложений и примесей. Процесс пробоподготовки отличался тем, что для получения раствора ВМК вместо азотной кислоты использовали раствор аммиака, количество образца, нанесенное на подложку, было больше. Вместо вакуумного эксикатора для получения тонкой пленки образец высушивали в ламинарном боксе при 40°C в течение 30 мин. В качестве внутренних стандартов использовали растворы Y, Cd и Ag различных концентраций. Избыточное содержание калия в ВМК “Мультифорт” объясняется тем, что соединения калия используют в веществе-носителе, не обладающем биохимической активностью. Имеется значительное расхождение в концентрации селена из-за относительно малого содержания в препарате и возможной адсорбции на стенках колбы во время пробоподготовки. Селен также определяли в витаминно-минеральных комплексах и биологических образцах (кровь, урина) в работе [16]. При этом единственное отличие процесса пробоподготовки заключается в использовании водной суспензии с ПАВ. В работе [16] стояла задача определения только селена в многоэлементных пробах. В случае ВМК “Мультифорт” погрешность результатов ниже, а воспроизводимость выше по сравнению с ВМК “Компливит” из-за различных способов изготовления препаратов и соответствующих способов пробоподготовки.
Рис. 2.
Спектр рентгенофлуоресцентного анализа с полным внешним отражением образца ВМК “Мультифорт” с внутренним стандартом галлием.
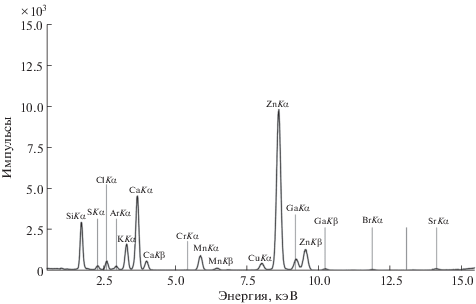
Таблица 2.
Результаты определения элементного состава в образце витаминно-минерального комплекса “Мультифорт” методом рентгенофлуоресцентного анализа с полным внешним отражением (n = 5, P = 0.95)
| Элемент | Экспериментально найденные концентрации, мг/л | Содержание элементов, рассчитанное на одну таблетку (m = 3.9252 г), мг | Содержание элементов, заявленное производителем, мг | ||||
|---|---|---|---|---|---|---|---|
| Y | Ni | Ga | Y | Ni | Ga | ||
| K | 98 ± 4 | 103 ± 6 | 109 ± 3 | 10.0 ± 0.1 | 10 ± 3 | 11.2 ± 0.3 | 2 |
| Ca | 198 ± 2 | 200 ± 70 | 219 ± 15 | 20.2 ± 0.2 | 20 ± 7 | 22 ± 2 | 20 |
| Cr | 0.18 ± 0.04 | 0.2 ± 0.1 | 0.16 ± 0.06 | 0.018 ± 0.007 | 0.02 ± 0.01 | 0.017 ± 0.004 | 0.02 |
| Mn | 14.9 ± 0.3 | 15 ± 4 | 16.3 ± 0.5 | 1.52 ± 0.03 | 1.5 ± 0.4 | 1.66 ± 0.06 | 1.6 |
| Cu | 3.51 ± 0.08 | 3.5 ± 0.2 | 3.7 ± 0.9 | 0.36 ± 0.09 | 0.36 ± 0.02 | 0.37 ± 0.07 | 0.4 |
| Zn | 79.2 ± 0.7 | 80 ± 14 | 87 ± 3 | 8.08 ± 0.06 | 8 ± 1 | 8.8 ± 0.3 | 8 |
| Se | 0.10 ± 0.07 | 0.1 ± 0.3 | 0.1 ± 0.3 | 0.010 ± 0.008 | 0.01 ± 0.03 | 0.01 ± 0.03 | 0.02 |
| I | н/о* | н/о | н/о | н/о | н/о | н/о | 0.15 |
* * *
Таким образом, разработаны способы пробоподготовки ВМК различного типа, проведены качественный и количественный рентгенофлуоресцентный анализ двух препаратов и сравнение полученных данных с заявленными. Выбраны внутренние стандарты Ni, Ga, Se, Y, которые пригодны для количественного анализа ВМК. Воспроизводимость результатов анализа безоболочеченого ВМК “Мультифорт” выше по сравнению с оболочечным ВМК “Компливит”. Предложенные варианты пробоподготовки можно использовать для определения элементного состава ВМК различного типа.
Список литературы
Дроздов В. Н. Рациональное возмещение дефицита витаминов и микроэлементов // Лечебное дело. 2009. № 3. С. 34.
Государственная фармакопея РФ. В 4-х тт. Т. 1 / Под ред. Емшановой С.В., Потаниной О.Г., Будановой Е.В., Чистяковой В.В. М.: ФЭМБ, 2018. 1815 с.
Bradley J. Shaw, David J. Semin, Michael E. Rider, Meredith R. Beebe Applicability of total reflection X-ray fluorescence (TXRF) as a screening platform for pharmaceutical inorganic impurity analysis // J. Pharm. Biomed. Anal. 2012. V. 63. P. 151.
Cui Y., Chang X., Zhai Y. ICP-AES determination of trace elements after preconcentrated with p-dimethylaminobenzaldehyde-modified nanometer SiO2 from sample solution // Microchem. J. 2006. V. 83. P. 35.
Lewen N. The use of atomic spectroscopy in the pharmaceutical industry for the determination of trace elements in pharmaceuticals // J. Pharm. Biomed. Anal. 2011. V. 55. P. 653.
Nageswara Rao R., Kumar Talluri M.V.N. An overview of recent applications of inductively coupled plasma-mass spectrometry (ICP-MS) in determination of inorganic impurities in drugs and pharmaceuticals // J. Pharm. Biomed. Anal. 2007. V. 43. P. 1.
Huang J., Hu X., Zhang J., Li K., Yan Y., Xu X. The application of inductively coupled plasma mass spectrometry in pharmaceutical and biomedical analysis // J. Pharm. Biomed. Analyt. 2006. V. 40. P. 227.
Beckhoff B., Kanngießer B., Langhoff N., Wedell R., Wolff H. Handbook of Practical X-Ray Fluorescence Analysis. Berlin, Germany: Springer, 2006. 983 p.
Barrera E.G., Bazanella D., Castro P.W., Boschetti W., Vale M.G.R., Dessuy M.B. Alternative method for chromium determination in pharmaceutical drugs by HR-CS GF AAS and direct analysis of solid samples // Microchem. J. 2017. V. 132. P. 365.
Шаранов П.Ю., Алов Н.В. Рентгенофлуоресцентный анализ с полным внешним отражением твердотельных объектов металлургической промышленности // Журн. аналит. химии. 2018. Т. 73. № 11. С. 868. (Sharanov P.Yu., Alov. N.V. Total reflection X-ray fluorescence analysis of solid metallurgical samples // J. Analyt. Chem. 2018. V. 73. № 11. P. 1085.)
Wobrauschek P. Total reflection X-ray fluorescence analysis – A review// X-Ray Spectrom. 2007. V. 36. P. 289.
Klockenkaemper R. Total-reflection X-ray fluorescence spectroscopy // Anal. Chem. 1992. V. 64. P. 1115.
Алов Н. В. Рентгенофлуоресцентный анализ с полным внешним отражением: физические основы и аналитическое применение (обзор) // Заводск. лаборатория. Диагностика материалов. 2010. Т. 76. № 1. С. 4. (Alov N. Total reflection X-ray fluorescence analysis: Physical foundations and analytical application (A review) // Inorg. Mat. 2011. V. 47. № 14. P. 1487.)
Frederick J. Antosz, Yanqiao Xiang, Angel R. Diaz, Andrew J. Jensen. The use of total reflectance X-ray fluorescence (TXRF) for the determination of metals in the pharmaceutical industry // J. Pharm. Biomed. Anal. 2012. V. 62. P. 17.
Varga I. Iodine determination in dietary supplement products by TXRF and ICP-AES spectrometry// Microchem. J. 2007. V. 85. P. 127.
Stosnach H. Analytical determination of selenium in medical samples, staple food and dietary supplements by means of total reflection X-ray fluorescence spectroscopy // Spectrochim. Acta B. 2010. V. 65. P. 859.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


