Журнал аналитической химии, 2020, T. 75, № 6, стр. 537-542
Применение хиральной неподвижной фазы на основе 3,4,9,10-перилентетракарбоновой кислоты для разделения энантиомеров в условиях газовой и жидкостной хроматографии
В. Ю. Гуськов a, *, Ю. Ю. Гайнуллина a, Ж. Д. Утеева a, Д. Э. Мусабиров a
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки-Валиди, 32, Россия
* E-mail: guscov@mail.ru
Поступила в редакцию 07.03.2019
После доработки 01.07.2019
Принята к публикации 07.12.2019
Аннотация
Предложена хиральная неподвижная фаза на основе 3,4,9,10-перилентетракарбоновой кислоты (3,4,9,10-perylentetracarbonacid, PTCA). Сама молекула PTCA не является хиральной, однако способна давать хиральные супрамолекулярные структуры. Нарушение симметрии при самосборке супраструктур PTCA осуществлялось аналогично процессу созревания Виедмы. Полученные неподвижные фазы с полислоями PTCA на инертном носителе и силикагеле С18 использованы для разделения рацематов в газовой и жидкостной хроматографии соответственно. Установлено, что предлагаемые неподвижные фазы способны проявлять энантиоселективность по отношению к парам энантиомеров, имеющих гидроксильную группу при асимметрическом атоме углерода. Методом газовой хроматографии разделены энантиомеры бутанола-2, пентанола-2 и 1-метокси-пропанола-2. В режиме нормально-фазовой ВЭЖХ достигнуто разделение ментолов. Показано, что разделение последних возможно вплоть до концентрации 0.04 мг/мл включительно.
Определение энантиомерного состава является одной из наиболее сложных задач хроматографии. Оптические изомеры различаются только способностью вращать плоскость поляризованного света в разные стороны, а также при взаимодействии с другими оптически активными молекулами. На последнем эффекте основываются подходы к разделению энантиомеров в хроматографии: в качестве неподвижной фазы используют вещества, имеющие центры хиральности [1]. Наибольшее распространение в этом качестве получили производные циклодекстрина [2–4]. В жидкостной хроматографии и капиллярном электрофорезе также получили распространение фазы с иммобилизированными макроциклическими антибиотиками [5–7]. Однако явление хиральности не ограничивается лишь понятием центра хиральности. Существуют такие виды хиральности, как аксиальная (осевая), планарная (плоскостная), спиральная и топологическая хиральность [8]. В последние десять лет интерес исследователей вызывает супрамолекулярная хиральность [9–11]. Она возникает при несимметричном пространственном расположении молекул мономеров при их самосборке. Это явление уже нашло применение в энантиоселективном катализе, хиральном молекулярном распознавании и создании нелинейных оптических материалов [12]. Представляет интерес использовать его для создания новых хиральных неподвижных фаз для хроматографии.
В работе предложены хиральные неподвижные фазы на основе супрамолекулярной структуры 3,4,9,10-перилентетракарбоновой кислоты, с индуцированной при самосборке хиральностью. Cупрамолекулярные структуры ее диангидрида детально описаны в литературе [13–16]. Преимуществом PTCA перед ранее предложенными нами неподвижными фазами с супрамолекулярной хиральностью [17–19] является ее растворимость только в концентрированном растворе щелочи. Индуцирование хиральности проводили по механизму созревания Виедмы [20]. Созревание Виедмы характерно для соединений, способных кристаллизоваться в энантиоморфные микрокристаллы. Если при кристаллизации без интенсивного перемешивания 50% вещества кристаллизуется в виде одной энантиоморфной формы, а 50% – в виде другой, то при кристаллизации при перемешивании раствора получается только один вид энантиоморфных конгломератов. При этом сама хиральность по-прежнему возникает вероятностным образом [21]: в 50% случаев образуется 100% одной энантиоморфной формы, и в 50% случаев – 100% другой формы [22]. Образование только одной энантиоморфной формы происходит вследствие сочетания двух процессов: 1) разбиения магнитным перемешивающим элементом кристалла на несколько более мелких такой же хиральности (что создает некоторый избыток центров кристаллизации одной энантиоморфной формы), 2) дальнейшего автокаталитического процесса, при котором каждый центр кристаллизации является катализатором роста микрокристаллов своей хиральности и ингибитором для микрокристаллов другой хиральности. Так как формирование двумерных структур протекает аналогично процессам образования трехмерных конгломератов, представляется возможным использовать технологию созревания Виедмы для получения хиральных неподвижных фаз на основе PTCA.
В настоящей работе образцы модифицированных PTCA инертного носителя и силикагеля С18 использовали для разделения энантиомеров методами газовой и жидкостной хроматографии соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
PTCA наносили на поверхность инертного носителя Inerton NAW-HDMS (Chemapol, Чехия) и силикагеля С18 (Sigma-Aldrich, США) по следующей методике. Коммерчески доступный диангидрид 3,4,9,10-перилентетракарбоновой кислоты (Sigma-Aldrich, США, 97%, CAS 128-69-8) растворяли в NaOH из расчета 50 мг PTCA на 250 мл раствора щелочи. Полученный раствор флуоресцировал зеленым светом, характерным для образования соли 3,4,9,10-перилентетракарбоновой кислоты. ИК-спектры также подтверждают переход ангидрида в соль кислоты. Далее раствор начинали перемешивать со скоростью не менее 500 об/мин и медленно титровали HCl до нейтрального значения рН. После этого раствор выдерживали в течение суток при сохранении интенсивного перемешивания. Затем в раствор вносили навеску инертного носителя или силикагеля С18 и продолжали перемешивать еще 2 ч. Массовая доля нанесенного PTCA составляла 1% от массы инертного носителя/силикагеля С18. Модифицируемый образец отфильтровали, многократно промывали высокочистой водой, высушивали в сушильном шкафу при 100°С до постоянной массы. Полученным сорбентом заполняли насадочные колонки для газовой или жидкостной хроматографии.
Для разделения рацематов методом газовой хроматографии использовали хроматограф Цвет 500М (Цвет, Дзержинск, Россия) с пламенно-ионизационным детектором. Длина колонки составляла 1 м, внутренний диаметр 3 мм, расход газа-носителя азота 10 мл/мин. Температура испарителя и детектора составляла 150°С. В качестве аналитов использовали 2-хлорбутан, 2-бромбутан, 2-хлорпентан, бутанол-2, пентанол-2 и 1-метоксипропанол-2 (CAS № 78-86-4, 78-76-2, 625-29-6, 78-92-2, 6032-29-7, 107-98-2 соответственно, Sigma-Aldrich, США, чистота >98%).
В жидкостной хроматографии в качестве аналитов использовали DL-ментол (Acros Organics, Бельгия, >99%, CAS № 89-78-1), D-ментол (99.9%, Sigma-Aldrich, Милуоки, США, CAS № 15356-60-2), L-ментол (99.4%, Sigma-Aldrich, Милуоки, США, CAS № 2216-51-5), DL-камфору (96%, Acros organics, Geel, Belgium, CAS № 76-22-2), D-камфору (98.8%, Acros organics, Geel, Belgium, CAS № 464-49-3), L-камфору (95.8%, Acros organics, Geel, Belgium, CAS № 464-48-2), L-камфен (80%, Alfa Aesar, Карлсруэ, Германия, CAS № 5794-04-7) и D-камфен (90%, Merck, Дармштадт, Германия, CAS № 5794-03-6). Смесь рацематов разделяли на хроматографе Perkin Elmer series 200 (Perkin Elmer, США) с УФ-детектором и колонкой длиной 25 см. В качестве элюента использовался н-гептан (Экос, Россия, хч, CAS № 142-82-5). Расход элюента 1 мл/мин. Концентрация растворов аналитов в гептане варьировалась от 0.01 до 1 мг/мл.
Поскольку в газохроматографическом эксперименте наблюдали неполные разделения пиков, использовали критерий разделения K2:
где h1 и h2 – высоты первого и второго пиков соответственно, hmin – минимум на кривой элюирования между пиками. Критерий разделения R рассчитывали по следующей формуле:РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Перед использованием адсорбентов для разделения энантиомеров проводили эксперимент по определению размера частиц PTCA, наносимых на поверхность инертного носителя и силикагеля С18. Для этого использовали лазерный анализатор Shimadzu SALT 7101. Полученные данные приведены на рис. 1. Как видно, частицы PTCA имеют размеры от 10 до 80 мкм. Средний размер частиц составил 27 мкм.
Рис. 1.
Распределение частиц 3,4,9,10-перилентетракарбоновой кислоты по размерам перед их нанесением на поверхность адсорбентов.

При попытке разделения рацематов галоген-алканов и спиртов в режиме газовой хроматографии обнаружено, что ни один из рацематов галогеналканов не делится на энантиомеры. В то же время при анализе рацематов бутанола-2, пентанола-2 и 1-метоксипропанола-2 наблюдали разделение на энантиомеры. На рис. 2–4 приведены примеры хроматографического разделения рацематов бутанола-2, пентанола-2 и 1-метоксипропанола-2 соответственно. Как видно, наилучшее разделение наблюдается для рацемата 2-бутанола. В целом для спиртов критерий разделения имеет достаточно низкие значения (табл. 1). Анализ параметров разделения показывает, что с увеличением температуры удерживаемые объемы закономерно уменьшаются. Факторы разделения α для 1-метоксипропанола-2 и бутанола-2 с повышением температуры также понижаются, в то время как для пентанола-2 меняются разнонаправлено. Особенно резким величина α снижается для бутанола-2. При сравнении с результатами хроматографического разделения, полученными на неподвижных фазах с супрамолекулярными структурами меламина, урацила и циануровой кислоты [17, 18, 23], заметно, что значения α на изучаемой фазе в целом ниже. Однако большинство данных на данной фазе получены при более высоких температурах. На хиральных неподвижных фазах, полученных путем индуцирования хиральности в супрамолекулярной структуре, разделение спиртов всегда было сравнительно затруднено по причине образования водородных связей между спиртами и супраструктурой [18]. При этом использование высоких температур приводило к потере со временем неподвижной фазой способности разделять энантиомеры. В связи с этим на неподвижных фазах с супрамолекулярной хиральностью до настоящего времени удалось осуществить всего несколько успешных разделений рацемата бутанола-2 [19]. При этом максимальная рабочая температура для хиральных неподвижных фаз на основе меламина, урацила и циануровой кислоты, при которой колонка оставалась стабильной во времени, не превышала 100°С. На предлагаемой неподвижной фазе на основе PTCA максимальная температура составила 150°С и лимитировалась не изменениями свойств колонки со временем, а отсутствием разделения энантиомеров спиртов при температурах выше 150°С. Таким образом, хиральная неподвижная фаза на основе PTCA показала повышенную термостабильность, что позволило оценить ее энантиоселективность по отношению к спиртам.
Рис. 2.
Газохроматографическое разделение рацемата 2-бутанола на инертном носителе, модифицированном 3,4,9,10-перилентетракарбоновой кислотой: Т = 130°С, α = 2.51, R = 0.66.

Рис. 3.
Газохроматографическое разделение рацемата 2-пентанола на инертном носителе, модифицированном 3,4,9,10-перилентетракарбоновой кислотой: Т = 150°С, α = 1.40, R = 0.51.
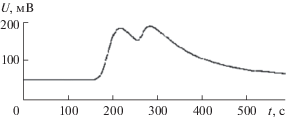
Рис. 4.
Газохроматографическое разделение рацемата 1-метоксипропанола-2 на инертном носителе, модифицированном 3,4,9,10-перилентетракарбоновой кислотой: Т = 150°С, α = 1.35, R = 0.49.

Таблица 1.
Параметры газохроматографического разделения рацематов бутанола-2, пентанола-2 и 1-метоксипропанола-2 на изучаемой неподвижной фазе
| Т, °С | Vg*, мл/г | α | K2 | R | |
|---|---|---|---|---|---|
| первый пик | второй пик | ||||
| Пентанол-2 | |||||
| 120 | 9.6 | 13.0 | 1.31 | 2.4 | 0.47 |
| 130 | 7.9 | 10.2 | 1.24 | 7.0 | 0.68 |
| 135 | 6.2 | 9.0 | 1.35 | 3.2 | 0.53 |
| 140 | 4.5 | 7.9 | 1.53 | 4.3 | 0.59 |
| 150 | 4.2 | 6.6 | 1.40 | 3.4 | 0.51 |
| 1-Метоксипропанол-2 | |||||
| 120 | 5.1 | 9.6 | 1.67 | 2.8 | 0.50 |
| 130 | 4.8 | 8.9 | 1.63 | 3.5 | 0.54 |
| 135 | 4.2 | 7.6 | 1.58 | 4.1 | 0.58 |
| 140 | 3.9 | 6.4 | 1.45 | 3.0 | 0.52 |
| 150 | 3.7 | 5.6 | 1.35 | 2.7 | 0.49 |
| Бутанол-2 | |||||
| 130 | 4.3 | 7.5 | 2.51 | 6.1 | 0.66 |
| 140 | 3.3 | 5.8 | 1.49 | 4.2 | 0.59 |
| 150 | 2.0 | 4.9 | 1.09 | 2.5 | 0.48 |
При попытке разделения рацематов ментола, камфена и камфоры обнаружено, что разделение наблюдается только в случае ментолов (рис. 5), при этом α составил 1.2 (табл. 2). Для того чтобы понять причину отсутствия разделения изучены времена удерживания чистых энантиомеров ментола, камфена и камфоры. Установлено, что времена удерживания энантиомеров камфена и камфоры совпадают друг с другом. В то же время времена удерживания ментолов различаются. Так, время удерживания D-ментола составило 2.5 мин, а L-ментола – 3.1 мин. Это соответствует временам удерживания соответственно первого и второго пиков на хроматограмме рацемата ментола.
Рис. 5.
Разделение рацемата ментола на силикагеле С18, модифицированном 3,4,9,10-перилентетракарбоновой кислотой, в режиме нормально-фазовой ВЭЖХ: с = 0.04 мг/мл, α = 1.22, R = 0.80.
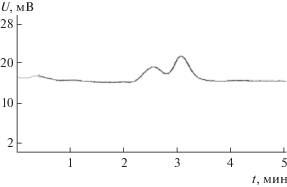
Таблица 2.
Параметры разделения DL-ментола на силикагеле С18, модифицированном 3,4,9,10-перилентетракарбоновой кислотой, в условиях ВЭЖХ
| с, мг/мл | Vg | α | R | |
|---|---|---|---|---|
| первый пик | второй пик | |||
| 0.01 | 2.56 | 3.11 | 1.21 | 0.98 |
| 0.02 | 2.53 | 3.09 | 1.22 | 0.95 |
| 0.03 | 2.54 | 3.09 | 1.22 | 0.91 |
| 0.04 | 2.53 | 3.08 | 1.22 | 0.80 |
| 0.1 | 2.96 | 3.22 | 1.09 | – |
| 0.5 | 2.95 | 3.23 | 1.09 | – |
| 1 | 2.92 | 3.08 | 1.05 | – |
При изменении концентрации DL-ментола с 0.01 до 0.04 мг/мл времена удерживания энантиомеров не изменяются, соответственно остается постоянным коэффициент селективности. При повышении концентрации до 0.1 мг/мл время удерживания D-ментола составляло 2.96 мин, а L-ментола – 3.22 мин. При этом разделения рацемата не наблюдалось. Дальнейшее повышение концентрации ментолов до 1 мг/л включительно сопровождалось незначительным изменением параметров удерживания и коэффициента селективности.
И в газовой, и в жидкостной хроматографии эффективность колонок оставалась сравнительно низкой и составляла около 100 и 1000 теоретических тарелок на метр соответственно. Вероятно, низкая эффективность хроматографических колонок обусловлена сильными донорно-акцепторными взаимодействиями между молекулами PTCA и разделяемыми аналитами за счет карбоксильных групп PTCA и гидроксильных групп аналитов. Для разделения более высококипящих энантиомеров необходимы неподвижные фазы с большей эффективностью. Решением проблемы может стать применение самособирающихся по созреванию Виедмы структур, неспособных к донорно-акцепторным взаимодействиям. Также, причиной низкой эффективности может служить адсорбция разделяемых молекул в каналах/пустотах трехмерной кристаллической решетки, диффузия в которых затруднена.
* * *
Таким образом, неподвижные фазы, модифицированные PTCA, показали энантиоселективность по отношению к соединениям, содержащим гидроксильную группу. При этом у всех разделяемых соединений гидроксильная группа находилась при асимметрическом атоме углерода. Предложенные хиральные неподвижные фазы на основе PTCA являются наиболее термостабильными из всей линейки хиральных фаз на основе супрамолекулярных структур с индуцированной хиральностью и могут найти применение для разделения рацематов, имеющих гидроксильную группу при асимметрическом атоме углерода.
Работа выполнена за счет гранта Российского научного фонда (проект № 17-73-101).
Авторы выражают благодарность д. х. н. проф. Б.И. Кутепову за ИК-спектры 3,4,9,10-перилентетракарбоновой кислоты, а также д. т. н., проф. И.А. Массалимову за анализ размеров частиц модификатора.
Список литературы
Schurig V. Separation of enantiomers by gas chromatography // J. Chromatogr. A. 2001. V. 906. P. 275.
Venema A., Henderiks H., Geest R.V. The enantioselectivity of modified cyclodextrins: Studies on interaction mechanisms // J. High. Resolut. Chromatogr. 1991. V. 14. P. 676.
Xie S.M., Yuan L.M. Recent progress of chiral stationary phases for separation of enantiomers in gas chromatography // J. Sep. Sci. 2017. V. 40. № 1. P. 124.
Adly F.G., Antwi N.Y., Ghanem A. Cyclodextrin-functionalized monolithic capillary columns: preparation and chiral applications // Chirality. 2016. V. 28. № 2. P. 97.
Шаповалова Е.Н., Федорова И.А., Припорова А.А., Ананьева И.А., Шпигун О.А. Определение энантиомерной чистоты пеметрексида на сорбентах с иммобилизованными макроциклическими антибиотиками // Аналитика и контроль. 2016. Т. 20. № 2. С. 168.
Прохорова А.Ф., Кузнецов М.А., Шаповалова Е.Н., Староверов С.М., Шпигун О.А. Разделение энантиомеров tv-производных аминокислот методом капиллярного электрофореза с использованием макроциклических антибиотиков // Вест. Моск. ун-та. Сер. 2. Химия. 2010. Т. 51. № 5. С. 359.
Лебедева М.В., Прохорова А.Ф., Шаповалова Е.Н., Шпигун О.А. Электрофоретическое энантиоразделение профенов в воднометанольных растворах с использованием эремомицина в качестве хирального селектора // Вест. Моск. ун-та. Сер. 2. Химия. 2013. Т. 54. № 5. С. 247.
Ya H. Two-dimensional (2D) Functional Molecular Networks / Ed. Blunt M., London: University College London, 2016. 256 p.
Meijer E.W., Palmans A.R.A. Amplification of chirality in dynamic supramolecular aggregates // Angew. Chem. Int. Educ. 2007. V. 46. P. 8948.
Fujiki M. Supramolecular chirality: Solvent chirality transfer in molecular chemistry and polymer chemistry // Symmetry. 2014. V. 6. P. 677.
Bruin A.G.D., Barbour M.E., Briscoe W.H. Macromolecular and supramolecular chirality: a twist in the polymer tales // Polym. Int. 2014. V. 63. P. 165.
Zhao L., Liu M., Li S., Li A., An H., Ye H., Zhang Y.J. Aggregation and supramolecular chirality of 5,10,15,20-tetrakis-(4-sulfonatophenyl)-porphyrin on an achiral poly(2-(dimethylamino)ethyl methylacrylate)-grafted ethylene-vinyl alcohol membrane // Mater. Chem. C. 2015. V. 3. P. 3650.
Godlewski S., Szymonski M. STM studies of PTCDA supramolecular self-assembling on anisotropic surfaces of reconstructed InSb // Appl. Surf. Sci. 2011. V. 258. P. 1300.
Mannsfeld S., Toerker M., Scgmitz-Hubsch T., Sellam F., Fritz T., Leo K. Combined LEED and STM study of PTCDA growth on reconstructed Au(111) and Au(100) single crystals // Org. Electron. 2001. V. 2. P. 121.
Zhao Y., Wang J. How to obtain high-quality and high-stability interfacial organic layer: insights from the PTCDA self-assembly // J. Phys. Chem. C. 2017. V. 121. № 8. P. 4488.
Sun X., Jonkman H.T., Silly F. Tailoring two-dimensional PTCDA–melamine self-assembled architectures at room temperature by tuning molecular ratio // Nanotechnology. 2010. V. 21. P. 165602.
Гуськов В.Ю., Сухарева Д.А., Арсланова И.В., Мусабиров Д.Э. Газохроматографическое разделение энантиомеров 2-хлорбутана и 2-бромбутана на адсорбенте Carboblack C, модифицированном циануровой кислотой // Журн. аналит. химии. 2017. Т. 72. № 10. С. 65. (Gus’kov V.Yu., Sukhareva D.A., Arslanova I.V., Musabirov D.E. Gas-chromatographic separation of enantiomers of 2-chlorobutane and 2-bromobutane on a cyanuric acid-modified Carboblack C adsorbent // J. Analyt. Chem. 2017. V. 72. № 10. P. 1089.)
Нафикова А.Р., Аллаярова Д.А., Гуськов В.Ю. Разделение энантиомеров 2-бромбутана, 2-хлорбутана, 2-хлорпентана, а также бутанола-2 на неподвижной фазе на основе супрамолекулярной структуры урацила // Журн. аналит. химии. 2019. Т. 74. № 6. С. 415. (Nafikova A.R., Allayarova D.A., Gus’kov V.Yu. Separation of 2-bromobutane, 2-chlorobutane, 2-chloropentane, and 2-butanol enantiomers using a stationary phase based on a supramolecular uracil structure // J. Analyt. Chem. 2019. V. 74. № 6. P. 565.)
Gus’kov V.Y., Sukhareva D.A., Gainullina Y.Y., Hamitov E.M., Galkin Y.G., Maistrenko V.N. Chiral recognition capabilities of melamine and cyanuric acid supramolecular structures // Supramol. Chem. 2018. V. 30. № 11. P. 940.
Viedma C. Chiral symmetry breaking during crystallization: complete chiral purity induced by nonlinear autocatalysis and recycling // Phys. Rev. Lett. 2005. V. 94. P. 065 504.
Davankov V.A. Biological Homochirality on the Earth, or in the Universe? A Selective Review // Symmetry. 2018. V. 10. P. 749.
Sogutoglu L.-C., Steendam R.R.E., Meekes H., Vlieg E., Rutjes F.P.J.T. Viedma ripening: a reliable crystallisation method to reach single chirality // Chem. Soc. Rev. 2015. V. 44. P. 6723.
Гуськов В.Ю., Майстренко В.Н. Новые хиральные неподвижные фазы: получение, свойства, применение в газовой хроматографии // Журн. аналит. химии. 2018. Т. 73. № 10. С. 727. (Gus’kov V.Yu., Maistrenko V.N. New chiral stationary phases: preparation, properties, and applications in gas chromatography // J. Analyt. Chem. 2018. V. 73. № 10. P. 937.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


