Журнал аналитической химии, 2020, T. 75, № 6, стр. 563-569
Ионселективный электрод для определения пертехнетат-ионов
А. В. Копытин a, b, *, К. Э. Герман a, b, **, К. Ю. Жижин a, А. В. Тюремнов a, Т. В. Жукова c, ***, Е. Г. Ильин a
a Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
c Национальный исследовательский ядерный университет МИФИ
115409 Москва, Каширское шоссе, 31, Россия
* E-mail: ionix@igic.ras.ru
** E-mail: guerman_k@mail.ru
*** E-mail: tvzhukova1207@gmail.com
Поступила в редакцию 25.04.2019
После доработки 11.10.2019
Принята к публикации 26.12.2019
Аннотация
Изучены электроаналитические характеристики ионселективного электрода (ИСЭ) с мембраной на основе супрамолекулярной полимерной композиции, содержащей поливинилхлорид, пластификатор о-нитрофенилоктиловый эфир, ионофор пертехнетат тетрадецифосфония и липофильную добавку тетрафенилборат тетрадецифосфония. Достигнут предел обнаружения ИСЭ в водных растворах, содержащих КTcO4, 2 × 10–7 М, при этом крутизна электродной функции при 20°С составляет 58 ± 1 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{pTcO}}_{{\text{4}}}^{ - }}}} \right. \kern-0em} {{\text{pTcO}}_{{\text{4}}}^{ - }}}.$ Определены потенциометрические коэффициенты селективности по отношению к различным анионам. Наблюдается корреляционная зависимость между энергией гидратации ΔGгидр и вычисленными по методу смешанных растворов коэффициентами селективности. Установлено, что изменение pH раствора в диапазоне 2−12 незначительно влияет на потенциал электрода при содержании в анализируемом растворе ${\text{ТсО}}_{{\text{4}}}^{ - }$ 1 × 10–6−0.001 М. Исследовано поведение электродов в сильнокислых растворах.
В атомной промышленности важное значение имеет определение технеция, образующегося при делении урана, в продуктах переработки отработанного ядерного топлива (ОЯТ) и в радиоактивных отходах (РАО) [1]. При этом характер объектов анализа чрезвычайно разнороден. Это и щелочные банки – хранилища исторических отходов от плутониевого производства, и кислотные или высокосолевые растворы современных технологий переработки ОЯТ, и образцы почв, донных отложений или пород, подвергшихся загрязнению и подлежащих ремедиации. Для определения технеция в ОЯТ и РАО используют главным образом радиометрические методы [2], масс-спектрометрический [3, 4] и рентгенофлуоресцентный анализ [1, 5]. Все эти методы требуют достаточно сложной подготовки пробы. Например, для радиометрического определения технеция необходимо его предварительное отделение от других радиоактивных изотопов, а для использования других методов дополнительно требуется дорогостоящее оборудование. В связи с этим указанные выше методы не позволяют проводить экспресс-определение технеция в местах переработки или захоронения ОЯТ и РАО.
Потенциометрический метод экспресс-анализа ОЯТ на содержание технеция с использованием ИСЭ является хорошей альтернативой, так как не требует дорогостоящего оборудования и достаточно прост в применении. Вместе с тем он характеризуется приемлемым пределом обнаружения пертехнетат-ионов (до 1 × 10–7 М) и высокой избирательностью. До настоящего времени потенциометрическое определение технеция использовали достаточно редко из-за отсутствия надежных ${\text{ТсО}}_{{\text{4}}}^{ - }$-селективных электродов.
Соли четвертичных аммониевых и фосфониевых оснований (ЧФС) в составе жидких ионитов (раствор соли в органическом растворителе), в частности, соли тетрадецилфосфония, достаточно часто применяли при получении мембран, обладающих ионной избирательностью по отношению к различным анионам и ацидокомплексам, таким как ${\text{ТlCl}}_{{\text{4}}}^{ - }{\text{,}}$ ${\text{PF}}_{{\text{6}}}^{ - }{\text{,}}$ ${\text{Au(CN)}}_{{\text{2}}}^{ - }$ и др. [6–9]. В общем случае ионселективные свойства таких мембран на основе жидких ионитов (ряд селективности) соответствуют лиофильным сериям и связаны с энергией гидратации аниона или ацидокомплекса. Из сравнения величин энергии гидратации аниона ${\text{ТсО}}_{{\text{4}}}^{ - }$ [10] с энергиями гидратации других неорганических анионов (см. ниже) следует, что мембраны на основе положительно заряженных жидких ионообменников должны обладать высокой избирательностью по отношению к пертехнетат-иону.
| Ион | Сl– | Br– | N${\text{O}}_{3}^{ - }$ | I– | CNS– | ClO4 | Re${\text{O}}_{4}^{ - }$ | Tc${\text{O}}_{4}^{ - }$ |
|---|---|---|---|---|---|---|---|---|
| –ΔG, кДж/моль | 329 | 304 | 295 | 268 | 258 | 242 | 234 | 231 |
С другой стороны, диапазон проявляемой ионной специфичности определяется природой мембранного растворителя (пластификатора) [11]. В ряде случаев растворитель может значительно влиять на селективность мембраны в целом. Растворители с высокой диэлектрической проницаемостью оказывают дифференцирующее действие на селективность мембраны и поэтому их целесообразно использовать в мембранах для анионов с низкой энергией гидратации. На электроаналитические параметры ионселективного электрода также заметно влияет содержание ионофора в мембране и соотношение между поливинилхлоридом (ПВХ) и пластификатором. Наши исследования [8, 9, 12] показали, что для получения оптимальных электроаналитических параметров ионселективного электрода содержание пластификатора в мембране должно находиться в пределах 65–72 мас. %, а ПВХ 28−32 мас. %. Соотношение 30% ПВХ–70% жидкого ионита (анионообменник + растворитель) хорошо обосновано для нитратселективных электродов, которые обладают высокой стабильностью потенциала [12]. При увеличении содержания пластификатора ухудшаются механические свойства мембраны, а его уменьшение приводит к возрастанию электрического сопротивления и ухудшению воспроизводимости потенциала.
В работе [13] описан ИСЭ с жидкой мембраной, специфичный к пертехнетат-ионам, который неудобен в использовании из-за конструкционных особенностей электродов с жидкий ионообменником. Описанный в работе [14] электрод с полимерной мембраной можно использовать в некоторых случаях для экспресс-анализа ОЯТ на содержание технеция.
Цель настоящей работы − разработка состава мембраны ИСЭ для определения пертехнетат-ионов с перспективой его дальнейшего практического использования для определения содержания технеция в продуктах переработки ОЯТ и в радиоактивных отходах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали реактивы марки ч. д. а. либо х. ч., деионизированную воду, поливинилхлорид (high molecular weight, “Selectophore” Fluka, Швейцария), 2-нитрофенилоктиловый эфир (Fluka, Швейцария), циклогексанон свежеперегнанный. Пертехнетат калия был синтезирован и идентифицирован в лаборатории химии технеция ИФХЭ РАН.
Ионофор пертехнетат тетрадецилфосфония получали в результате ионообменной экстракции ионов ${\text{TcO}}_{{\text{4}}}^{ - }$ из 0.01 М водного раствора раствором бромида тетрадецилфосфония в дихлорметане с последующей перекристаллизацией. С этой целью 20 мл 0.05 М раствора бромида тетрадецилфосфония в СН2Сl2 контактировали в делительной воронке с 25 мл 0.05 М раствора пертехнетата калия. Органическую фазу отделяли и промывали 100 мл дистиллированной воды. Степень замещения бромид-ионов в исходной соли определяли, измеряя их содержание в водной фазе после экстракции с помощью бромидселективного электрода с твердой мембраной на основе смеси сульфида и бромида серебра ИОНИКС 211. Установлено, что достаточно двух контактов для 100%-ной замены бромид-ионов анионами ${\text{TcO}}_{{\text{4}}}^{ - }$ в органической фазе. Полученную органическую фазу переносили в чашку Петри. После удаления дихлорметана при комнатной температуре получали порошок белого цвета пертехнетат тетрадецилфосфония [(С10H21)4Р][ТсО4], который использовали при изготовлении мембраны. Состав порошка подтверждали химическим анализом и методами ИК- и 31Р ЯМР-спектроскопии. В ИК-спектрах полосы поглощения в области 1390 и 1470 см–1 отнесены к деформационным колебаниям связей С–Н метильных и метиленовых групп, а интенсивная полоса поглощения при 720 см–1 характерна для углеродных цепей типа [−CH2−]n при n > 4 [15]. Полоса поглощения при 910 см–1 относится к аниону ${\text{ТсО}}_{{\text{4}}}^{ - }$ [16–18]. В спектрах 31Р ЯМР синглет с химическим сдвигом δ = 30.4 обусловлен наличием фосфора в катионе тетрадецилфосфония [7]. Элементный анализ электродноактивных компонентов на содержание углерода и водорода выполняли на автоматическом газоанализаторе CHNS_3 FA 1108 Elemental Analyser (Carlo Erba, Италия). ИК-спектры выделенных ионофоров получали на ИК-Фурье-спектрометре ИН-ФРАЛЮМ ФТ_02 в диапазоне 400–4000 см–1. Образцы готовили суспендированием исследуемого вещества в вазелиновом или во фторированном масле Fluorolube. Спектры 31P ЯМР растворов [(C10H21)4P] TcO4 в CD3CN регистрировали на спектрометре Bruker AVANCE II_300.
Аналогичным образом получали липофильную добавку [(С10H21)4P][B(C6H5)4]. С этой целью 20 мл 0.05 М раствора бромида тетрадецилфосфония в дихлорметане смешивали с 20 мл 0.05 М раствора тетрафенилбората натрия в дихлорметане. Осадок NaBr отфильтровывали. Из полученного раствора путем испарения дихлорметана выделяли белое вещество (в виде порошка) состава [(С10H21)4P][B(C6H5)4], которое затем использовали при изготовлении мембран. Состав порошка подтверждали данными химического анализа и методами ИК-спектроскопии.
Для получения мембраны ИСЭ первоначально готовили жидкий ионит: раствор, содержащий заданные количества ионофора и липофильной добавки [(С10H21)4P][B(C6H5)4] в органическом растворителе-пластификаторе (2-нитрофенилоктиловый эфир) (табл. 1).
Таблица 1.
Составы исследованных мембран и их характеристики
| № | Содержание компонентов в жидком ионите в мембране (соотношение 30% ПВХ−70% ЖИ), М | Наклон S, мВ | Предел обнаружения, М | |
|---|---|---|---|---|
| [(С10H21)4N][ТсО4] | [(С10H21)4P][B(C6H5)4] | |||
| 1 | 0.01 | 0.01 | 56 ± 1 | 2.0 × 10–6 |
| 2 | 0.01 | 0.01 | 56 ± 1 | 2.0 × 10–6 |
| 3 | 5 × 10–3 | 0.01 | 58.0 ± 1.5 | 1.5 × 10–7 |
| 4 | 5 × 10–3 | 0.001 | 55 ± 1 | 6.0 × 10–7 |
| 5* | 5 × 10–4 | 0.01 | 49 ± 2 | (3−5) × 10–7 |
| 6* | 5 × 10–4 | 0.001 | 53 ± 3 | (2−5) × 10–7 |
Для получения полимерной мембраны жидкий ионит вводили в поливинилхлоридную матрицу. С этой целью смешивали рассчитанные количества 10%-ного раствора ПВХ в циклогексаноне и жидкого ионита (ЖИ). Полученную смесь тщательно перемешивали и после удаления пузырьков воздуха переносили в стеклянное кольцо внутренним диаметром 28 мм, помещенное на гладкую стеклянную поверхность. После испарения циклогексанона при контролируемой температуре 30−35°С в течение ~48 ч получали прозрачную полимерную мембрану со средней толщиной ~0.3 мм. Воспроизводимость характеристик мембраны достигалась путем тщательного перемешивания компонентов мембраны в циклогексаноне и контроля испарения растворителя при постоянной температуре. Она также зависела от толщины полученной мембраны. Изготовленную полимерную мембрану отделяли от стеклянной пластины и вырезали диски диаметром 6 мм, которые помещали в стандартный корпус фирмы “Philips” IS 561. Перед измерением электрод выдерживали в 0.01 М растворе пертехнетата калия в течение 4 сут для установления равновесия между мембраной и раствором, что достаточно для получения устойчивых значений потенциалов. Перед выполнением потенциометрических измерений мембрану промывали дистиллированной водой.
Составы мембран приведены в табл. 1, при этом концентрация ионофора в ЖИ составляла 5 × 10–4–0.01 М, а липофильной добавки – 0.001–0.01 М.
При исследовании электроаналитических свойств полученных мембран в качестве электрода сравнения использовали хлоридсеребряный электрод Radelkis ОР-0820. Измерения проводили с помощью рН-ион анализатора Radelkis ОР-300, используя гальваническую цепь вида:
Электроаналитические параметры ИСЭ измеряли согласно рекомендациям IUPAC [19] в диапазоне рН 3–6. Исходный 0.01 М раствор KTcO4 получали путем растворения 2.01 г KTcO4 в 100 мл деионизированной воды. Остальные растворы с концентрациями от 1 × 10–8 до 0.001 М готовили путем последовательного разбавления исходного раствора. Исследуемые растворы перемешивали магнитной мешалкой. Все измерения выполняли при 19 ± 1°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предел обнаружения электрода связан с коэффициентом распределения электродноактивного компонента между водной и органической фазами (мембрана–водный раствор), поэтому чем меньше концентрация электродноактивного компонента (ЭАК) в мембране (в нашем случае [(С10H21)4Р][ТсО4]), тем меньше предел обнаружения. Минимальная концентрация ЭАК лимитируется сопротивлением мембраны, поэтому в качестве оптимального целесообразно использовать содержание ионофора в пределах 0.05−0.07 М [8, 12, 14]. При более низких концентрациях электроаналитические параметры электрода резко ухудшаются за счет высокого сопротивления мембраны. Для понижения предела обнаружения нами предложено понизить концентрацию электродноактивного компонента в жидком ионите, но при этом с целью уменьшения сопротивления мембраны в жидкий ионит вводили липофильную добавку тетрафенилбората тетрадецилфосфония [(С10H21)4P][B(C6H5)4], которая понижает электрическое сопротивление мембраны и практически не участвует в переносе ионов ${\text{ТсО}}_{{\text{4}}}^{ - }{\text{.}}$
Составы исследованных мембран и их характеристики приведены в табл. 1, а электродные функции ИСЭ на их основе − на рис. 1. Из полученных результатов следует, что при оптимальном составе мембраны № 3 линейность электродной функции сохраняется в интервале концентраций пертехнетата 5 × 10–7−0.01 М при угловом наклоне электродной характеристики 58.0 ± 1.5 мВ. Предел обнаружения составил 1.5 × 10–7 М. При такой концентрации активность потенциалопределяющего иона ${\text{ТсО}}_{{\text{4}}}^{ - }$ a(${\text{ТсО}}_{{\text{4}}}^{ - }$) в приэлектродном слое на границе мембрана–раствор минимальна и, как следствие, достигается минимальный предел обнаружения. При увеличении содержания электродноактивного компонента в мембране a(${\text{ТсО}}_{{\text{4}}}^{ - }$) в приэлектродном слое возрастает, и при этом повышается предел обнаружения пертехнетата. Изменение угла наклона может быть связано с увеличением ассоциации солей ЧФС в фазе мембраны. Мембраны №№ 5, 6 (табл. 1) характеризовались плохой воспроизводимостью и нестабильностью потенциала во времени из-за высокого электрического сопротивления. В связи с этим предел обнаружения был оценен с большой погрешностью. Время отклика ИСЭ составило <5 с, время установления равновесного потенциала для разбавленных растворов (1 × 10–5 М и ниже) − 2–3 мин, а для более концентрированных растворов – менее 0.5 мин.
Рис. 1.
Электродные характеристики электродов с различным составом мембраны (табл. 1). Мембрана: 1 − № 1, 2 − № 2, 3 − № 3, 4 − № 4.
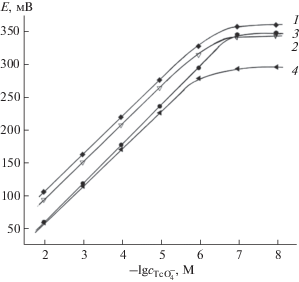
Таблица 2.
Логарифмы потенциометрических коэффициентов селективности
| Ион | $\lg K_{{{\text{TcO}}_{{\text{4}}}^{{\text{ - }}}{\text{/}}{{{\text{J}}}^{ - }}}}^{{{\text{пот}}}}$ | |
|---|---|---|
| I* | II** | |
| N${\text{O}}_{3}^{ - }$ | 3.9 | 3.7 |
| Cl– | 6.1 | >6.0 |
| Br– | 4.7 | 4.4 |
| I– | 2.6 | 2.2 |
| СNS– | 2.0 | 1.6 |
| Re${\text{O}}_{4}^{ - }$ | 0.7 | 0.4 |
| Cl${\text{O}}_{4}^{ - }$ | 0.9 | 0.7 |
| S${\text{O}}_{4}^{{2 - }}$ | >6 | >6.0 |
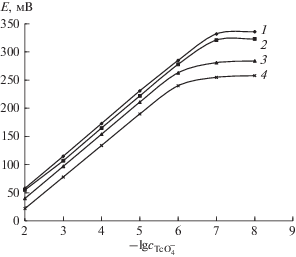
Для электрода с мембраной № 3 оценили влияние рН на потенциал в растворах с содержанием КТсО4 1 × 10–6–1 × 10–3 М. Исследование проводили в солянокислых, нейтральных и щелочных растворах с постоянной концентрацией Cl–-ионов 1 М (рис. 2) в диапазоне рН 0.5–12. Как видно, изменение pH от 2 до 12 практически не влияет на значение потенциала электрода в диапазоне ${\text{pТсО}}_{{\text{4}}}^{ - }$ 3−6. Влияние рН начинает проявляться при рН < 2. В связи с этим исследовали влияние содержания кислоты в анализируемом растворе на электродные характеристики разработанных электродов на примере НСl (рис. 3). Видно, что при возрастании концентрации НСl электродные характеристики смещаются в сторону отрицательной области, что согласуется с результатами исследований [6, 7] для электродов такого типа, а также повышается предел обнаружения, что может быть связано с экстракционными свойствами мембраны и гидратацией электродноактивного компонента в фазе мембраны [7, 11]. При высоких концентрациях кислоты на потенциал электрохимической цепи может существенно влиять и изменение диффузионного потенциала электрода сравнения. Все это следует учитывать при практическом применении разработанного электрода.
Рис. 2.
Зависимость потенциала электрода с мембраной № 3 (табл. 1) от рН при различных концентрациях пертехнетат-иона в растворе (М). p(${\text{ТсО}}_{{\text{4}}}^{ - }$): 1 − 3, 2 − 4, 3 − 5, 4 − 6.

Рис. 3.
Влияние кислотности раствора на электродные характеристики электрода с мембраной с № 3 (табл. 1). сHCl, М: 1 – 0.01, 2 − 0.1, 3 − 1, 4 − 3.
При исследовании селективности мембраны руководствовались приблизительным ионным составом грунтовых вод в месте захоронения радиоактивных отходов. Грунтовые воды постепенно выщелачивают захороненные объекты, в частности, цементные блоки. При этом состав грунтовых вод обычно слабо минерализован. Селективность по отношению к нитрат-ионам следует рассматривать отдельно. Это связано с тем, что растворы радиоактивных отходов переработки ОЯТ содержат преимущественно нитрат-ионы, поскольку переработка ведется в растворах азотной кислоты. Коэффициенты селективности оценивали методами отдельных растворов и смешанных растворов [20]. В первом случае измеряли потенциалы электрода в растворе KTcO4 (0.01 М) и в растворе мешающего иона (0.01 М). Коэффициенты селективности определяли по формуле [19]:
(1)
$\begin{gathered} \lg K_{{{{{\text{ТсО}}_{{\text{4}}}^{ - }} \mathord{\left/ {\vphantom {{{\text{ТсО}}_{{\text{4}}}^{ - }} {{{{\text{J}}}^{ - }}}}} \right. \kern-0em} {{{{\text{J}}}^{ - }}}}}}^{{{\text{пот}}}} = \left( {{{E}_{{{{{\text{J}}}^{ - }}}}} - {{E}_{{{\text{ТсО}}_{{\text{4}}}^{ - }}}}} \right){{zF} \mathord{\left/ {\vphantom {{zF} {2.303RT}}} \right. \kern-0em} {2.303RT}} + \\ + \,\,\left( {1 - {{z}_{{{{{\text{ТсО}}_{{\text{4}}}^{ - }} \mathord{\left/ {\vphantom {{{\text{ТсО}}_{{\text{4}}}^{ - }} {{{z}_{{{{{\text{J}}}^{ - }}}}}}}} \right. \kern-0em} {{{z}_{{{{{\text{J}}}^{ - }}}}}}}}}}} \right)\lg \left[ {a\left( {{\text{ТсО}}_{{\text{4}}}^{ - }} \right)} \right], \\ \end{gathered} $В методе смешанных растворов измеряли потенциалы бинарных растворов, содержащих постоянную концентрацию мешающего иона (0.1 М) и переменную концентрацию пертехнетат-ионов. Коэффициенты селективности определяли графическим методом, рекомендованным ИЮПАК [19] и рассчитывали по уравнению [19]:
(2)
$\lg K_{{{{{\text{ТсО}}_{{\text{4}}}^{ - }} \mathord{\left/ {\vphantom {{{\text{ТсО}}_{{\text{4}}}^{ - }} {\text{J}}}} \right. \kern-0em} {\text{J}}}}}^{{{\text{пот}}}} = \lg a{{\left( {{\text{ТсО}}_{{\text{4}}}^{ - }} \right)} \mathord{\left/ {\vphantom {{\left( {{\text{ТсО}}_{{\text{4}}}^{ - }} \right)} {a({{{\text{J}}}^{ - }})({{z}_{{{\text{ТсО}}_{{\text{4}}}^{ - }}}}{\text{/}}{{z}_{{{{{\text{J}}}^{ - }}}}})}}} \right. \kern-0em} {a({{{\text{J}}}^{ - }})({{z}_{{{\text{ТсО}}_{{\text{4}}}^{ - }}}}{\text{/}}{{z}_{{{{{\text{J}}}^{ - }}}}})}}.$Сравнение полученных значений коэффициентов селективности разработанного электрода с известными показало, что селективность предлагаемого электрода не уступает, а в ряде случаев и превосходит селективность ранее описанных [13, 14].
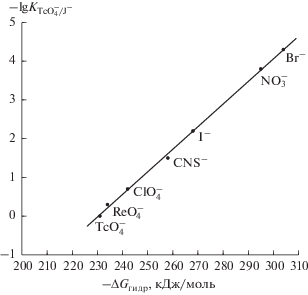
Найденные коэффициенты селективности коррелируют со свободной энергией гидратации неорганических анионов (см. выше). На рис. 4 показана корреляционная зависимость между свободной энергией гидратации (–ΔG, кДж/моль) и найденными значениями коэффициентами селективности $\left( {\lg K_{{{{{\text{ТсО}}_{{\text{4}}}^{ - }} \mathord{\left/ {\vphantom {{{\text{ТсО}}_{{\text{4}}}^{ - }} {\text{J}}}} \right. \kern-0em} {\text{J}}}}}^{{{\text{пот}}}}} \right),$ полученными методом смешанных растворов [19].
Рис. 4.
Корреляционная зависимость логарифмов коэффициентов потенциометрической селективности $ - \lg {{K}_{{{{{\text{ТсО}}_{{\text{4}}}^{ - }} \mathord{\left/ {\vphantom {{{\text{ТсО}}_{{\text{4}}}^{ - }} {{{{\text{J}}}^{ - }}}}} \right. \kern-0em} {{{{\text{J}}}^{ - }}}}}}}$ от свободной энергии гидратации ионов −ΔG (кДж/моль).
Таким образом, разработанный электрод с мембраной № 3 может быть рекомендован для анализа водных растворов на содержание Tc(VII) в виде ${\text{ТсО}}_{{\text{4}}}^{ - }$ в присутствии различных неорганических анионов. Одно из предполагаемых применений разработанного электрода − определение пертехнетат-иона в грунтовых водах в местах захоронения ядерных отходов и в ближней зоне бассейнов – временных хранилищ РАО, где возможно просачивание радионуклидов через технические барьеры. Кроме того, электрод рекомендован в ИФХЭ РАН для исследования процессов выщелачивания ${\text{ТсО}}_{{\text{4}}}^{ - }$ из цементных блоков подземными водами при длительном хранении.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований (номер государственной регистрации № 01 201 353 365).
Список литературы
German K.E. Some general drawbacks in the treatment of radioactive wastes from spent nuclear fuel reprocessing / Fundamental Basis for Advanced Treatment of Radioactive Wastes. Proceedings and selected lectures of the 2nd International school – seminar, Moscow-2018 / Eds. German K.E., Safonov A.V. M.: Publishing house “GRANICA”, 2018. P. 431.
Wigley F., Warwick P.E., Croudace I.W., Caborn J., Sanchez A.L. Optimised method for the routine determination of Technetium-99 in environmental samples by liquid scintillation counting // Anal. Chim. Acta. 1999. V. 380. P. 73.
Richter, R.C., Koirtyohann, R., Jurisson, S.S. Determination of technetium-99 in aqueous solutions by inductively coupled plasma mass spectrometry: Effects of chemical form and memory // J. Anal. At. Spectrom. 1997. V. 12. № 5. P. 557.
Eroglu A.E., McLeod C.W., Leonard K.S., and McCubbin D. Determination of technetium in sea-water using ion exchange and inductively coupled plasma mass spectrometry with ultrasonic nebulization // J. Anal. At. Spectrom. 1998. V. 13. P. 875.
Bermudez J.J., Greaves E.D., Nemeth P., Sajo-Bohus L. Determination of technetium by total reflection X-ray fluorescence // Spectrochim. Acta B. 2001. V. 56. P. 2247.
Kopytin A.V., Gábor-Klatsmányi P., Izvekov V.P., Pungor E., Yagodin G.A. A trichloromercurate(II) ion-selective electrode based on the tetradecylphosphonium salt in polyvinyl chloride // Anal. Chim. Acta. 1983. V. 148. P. 35.
Kopytin A.V., Gábor-Klatsmányi P., Izvekov V.P., Pungor E., Yagodin G.A. Investigation of ion-selective electrodes based on quaternary phosphonium salts. Part 2. A tetrachlorothallate(III) ion-selective electrode // Anal. Chim. Acta. 1984. V. 162. P. 123.
Kopytin A.V., Gábor-Klatsmányi P., Izvekov V.P., Pungor E., Ilyin E.G., Yagodin G.A. Investigation of ion-selective electrodes based on quaternary phosphonium salts. Part 3. An ion-selective electrode for hexafluorophosphate // Anal. Chim. Acta. 1984. V. 162. P. 133.
Копытин А.В., Пятова Е.Н., Жуков А.Ф., Политов Ю.А., Герман К.Э., Цивадзе А.Ю. Ионоселективные сенсоры для определения ${\text{Au}}({\text{CN}})_{2}^{ - }$ с мембранами на основе ионной жидкости – дицианоаурата тетрадецилфосфония // Журн. аналит. химии. 2008. Т. 65. № 9. С. 976.
Джигарханов М.С.-А., Абрамов А.А., Иофа Б.З. Экстракция технеция(VII) растворами солей тетраоктиламмония // Радиохимия. 2002. Т. 44. № 1. С. 14.
Гордиевский А.В., Урусов Ю.И., Сергиевский В.В., Жуков А.Ф., Копытин А.В. Разработка и исследование селективных мембранных электродов. Сообщение 15. Влияние селективного ионного обмена и экстракции кислот на электродные функции жидких ионитов // Журн. аналит. химии. 1979. Т. 34. № 11. С. 1252.
Nielsen H.J., Hansen E.N. New nitrate ion-selective electrodes based on quaternary ammonium compounds in nonporous polymer membranes // Anal. Chim Acta. 1976. V. 85. P. 1.
Akopov G.A. Abdulakhatov M.K., Krinitsyn A.P. Liquid ion-selective electrode for determination of technetium // Radiokhimiya. 1986. № 3. P. 434.
Дорохов А.В., Герман К.Э., Перетрухин В.Ф., Копытин А.В., Пятова Е.Н.,Бурцев М.Ю., Симонофф М., Цивадзе А.Ю. Ион - селективный электрод с пластифицированой ПВХ-мембраной для определения Tc(VII) // Доклады РАН. Сер. физ. химия. 2003. Т. 393. № 4. С. 1.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Иностранная литература, 1963. С. 97.
Стефанович С.Ю., Калинин В.Б., Герман К.Э. Структурная разупорядоченность и сегнетоэлектричество в соединениях A1+B7+O4 // Журн. неорг. химии. 1991. Т. 36. № 9. С. 2200.
Cпицын В.И., Кузина А.Ф., Герман К.Э. Синтез и кристаллическая структура пертехнетата тетраметиламмония // Докл. Акад. Наук СССР. Сер. хим. 1987. Т. 293. № 1. С. 101.
Герман К.Э., Григорьев М.С., Кузина А.Ф. Строение и физико-химические свойства пертехнетатов тетраалкиламмония // Журн. неорг. химии 1987. Т. 32. № 5. С. 1089.
Buck R.P., Lindner E. Recomendations for nomenclature of ion – selective electrodes (IUPAC Recommendations 1994) // Pure Appl. Chem. 1994. V. 66. № 12. P. 2527.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


