Журнал аналитической химии, 2020, T. 75, № 6, стр. 553-562
Сенсоры на основе одно- и двухслойных пластифицированных мембран для потенциометрического определения мефенаминовой и фенилантраниловой кислот
Ж. А. Кормош a, О. Ю. Матвийчук a, И. П. Антал a, Я. Р. Базель b, c, *
a Восточноевропейский национальный университет им. Леси Украинки, химический факультет
43000 Луцк, просп. Воли, 13, Украина
b Университет Павла Йозефа Шафарика
SK 04154 Кошице, ул. Мойзесова, 11, Словакия
c Ужгородский национальный университет
88000 Ужгород, ул. Пидгирна, 46, Украина
* E-mail: yaroslav.bazel@upjs.sk
Поступила в редакцию 18.03.2019
После доработки 25.06.2019
Принята к публикации 19.12.2019
Аннотация
Изготовлены сенсоры для потенциометрического определения мефенаминовой и фенилантраниловой кислот на основе одно- и двухслойных пластифицированных поливинилхлоридных мембран. Для изготовления мембран синтезировали ионные ассоциаты перхлората, мефенаминовой и фенилантраниловой кислоты с фуксином основным. Состав соединений подтвержден методами спектрофотометрии и ИК-спректроскопии. Исследовано влияние различных факторов на характеристики электродов, оптимизирован состав мембран. Предложенная технология изготовления двухслойной мембраны позволяет улучшить свойства сенсоров на мефенаминовую и фенилантраниловую кислоты. Разработанные методики применены для анализа фармацевтических препаратов.
Мефенаминовая и фенилантраниловая кислоты (схема 1 ) близки по структуре, но при этом их сферы применения различаются. Фенилантраниловую кислоту (Фен, C13H11NO2, дифениламин-2-карбоновая кислота) используют как реактив для синтеза биологически активных веществ, а также в аналитической химии как реагент для определения ионов металлов и распространенный окислительно-восcтановительный индикатор [1]. Некоторые производные Фен физиологически активны (противовоспалительные, стрессопротекторные свойства, стимуляция роста растений) и являются антиоксидантами. Мефенаминовая кислота (Меф, C15H15NO2, 2-[(2,3-диметилфенил)амино]бензойная кислота) – производное фенилантраниловой кислоты. Ее используют в фармации как обезболивающее и противовоспалительное средство. Кроме типичных свойств нестероидных противовоспалительных препаратов, мефенаминовая кислота стимулирует образование интерферона и обладает ярко выраженным жаропонижающим эффектом. При попадании мефенаминовой кислоты в организм происходит стабилизация белковых ультраструктур и мембран клеток, уменьшается проницаемость сосудов, нарушаются процессы окислительного фосфорилирования, подавляется синтез мукополисахаридов, повышается резистентность клеток и происходит стимуляция заживления ран. Благодаря перечисленным особенностям физиологического воздействия на организм, мефенаминовую кислоту часто применяют в медицинской практике [2].
Схема. 1. Структурные формулы фенилантраниловой (а) и мефенаминовой (б) кислот.
Для определения мефенаминовой кислоты в большинстве случаев используют хроматографические методы анализа [3–12]. Недостатками хроматографических методик являются высокая стоимость оборудования, а также использование токсичного ацетонитрила как основного компонента подвижной фазы. В большинстве современных хроматографических методик предусматривается предварительное концентрирование пробы, содержащей мефенаминовую кислоту, методами твердофазной [13–15] либо дисперсионной микроэкстракции [16]. Известны также спектрофотометрические методики, основанные на образовании окрашенных комплексов [17–20], ионных ассоциатов (ИА) [21, 22] или продуктов окислительно-восстановительных преобразований [23, 24]. Однако большинство из них неселективны, требуют тщательного контроля кислотности среды, а иногда и температурного режима, что затрудняет проведение анализа. Описанные ртутно-мефенаматный электрод для потенциометрического определения [25] и угольный пастовый электрод для вольтамперометрических измерений [26–28] недостаточно селективны, к тому же работают в узком диапазоне рН среды (табл. 1).
Таблица 1.
Сравнительная характеристика электрохимических сенсоров для определения мефенаминовой кислоты
| Метод измерения аналитического сигнала | Состав мембраны | рН | Диапазон линейности | сmin | tR, с | Литература |
|---|---|---|---|---|---|---|
| Прямая потенциометрия | 1.6 г мефенамата ртути, 0.2 г Hg, 0.8 г графита |
6.0–9.0 | 10–6–10–2 М | 6.2 × 10–7 М | 10–15 | [25] |
| Дифференциальная импульсная вольтамперометрия | 15% комплекса C16H20BrCl2FeN2SO3, 55% графита, 35% минерального масла, диэтиловый эфир | 3.5 | 0.02–150 мкМ | 0.02 мкМ | 70 | [26] |
| Дифференциальная импульсная вольтамперометрия | 10% Сu(II) легированного цеолита, 60% графита, 30% минерального масла | 10 | 0.3–100 мкМ | 0.04 мкМ | 15 | [27] |
| Вольтамперометрия с линейной разверткой потенциала | 0.97 г графита, 0.03 г La(ОН)3 – наночастиц, 0.2 г парафина | 5.7–5.9 | 2 × 10–11– 4 × 10–9 М |
6.0 × 0–12 М | – | [28] |
Современные технологии и материалы позволяют изготавливать сенсоры с определенными свойствами (потенциометрические, кондуктометрические, оптические), селективно реагирующие на различные ионы. Эффективными для аналитического контроля могут быть сенсоры, включающие ионофоры [29, 30]. Они просты в использовании и обслуживании, требуют относительно простых и недорогих приборов для регистрации аналитического сигнала. В ряде публикаций описаны сенсоры для определения мефенаминовой кислоты, изготовленные на основе наноматериалов [31–35]. Однако широкого распространения в анализе перечисленные методы не получили. Европейская фармакопея все еще рекомендует алкалиметрическое определение мефенаминовой кислоты в этаноле с применением индикатора фенолового красного [36]. Методов определения фенилантраниловой кислоты значительно меньше. Так, известны титриметрические методы с визуальным индикаторным или потенциометрическим определением точки эквивалентности [37].
Цель настоящей работы – создание сенсоров для определения Меф и Фен с модифицированными мембранами на основе ИА фуксина основного (ФО) и исследование влияния различных факторов на основные характеристики сенсоров. Для решения поставленной задачи получили двухслойные мембраны, в которых первый слой содержит ИА фуксина основого и Меф (Фен), а второй (внутренний) – ИА фуксина основного и перхлорат-иона. Сенсоры использовали для определения фенилантраниловой кислоты в модельных растворах и мефенаминовой кислоты в фармацевтических препаратах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Стандартные 0.01 М растворы Меф и Фен готовили растворением точной навески препарата в 10 мл 0.5 М раствора NaOH с последующим добавлением дистиллированной воды и универсальной буферной смеси до рН 9. Исходный 0.01 М раствор основного красителя ФО готовили растворением точной навески соли красителя в небольшом количестве метанола с последующим разбавлением дистиллированной водой. Раствор NaClO4 (0.01 М) готовили растворением точной навески соли в дистиллированной воде.
Для получения ионного ассоциата смешивали 0.01 М растворы ФО и Меф (Фен, ${\text{СlО}}_{4}^{ - }$) в соотношении 1 : 1. Готовую смесь оставляли при комнатной температуре на 8–10 ч. Образовавшийся осадок отфильтровывали, несколько раз промывали холодной дистиллированной водой и сушили при комнатной температуре.
Пластифицированные поливинилхлоридные (ПВХ) мембраны готовили согласно рекомендациям [38]. Взвешивали точное количество выделенного ИА (0.05–0.25 г), добавляли 0.075 г ПВХ, после чего смесь тщательно перемешивали. Затем добавляли 0.15 мл пластификатора (дибутилфталат (ДБФ), динонилфталат (ДНФ), диоктилфталат (ДОФ), дибутилсебацинат (ДБС) или трикрезилфосфат (ТКФ)), 0.5 мл растворителя (тетрагидрофуран) и содержимое тщательно перемешивали до получения однородной массы. Полученную смесь переносили в стеклянную форму (кольцо диаметром 1.7–2.0 см, плотно приклеенное к стеклянной подложке) и сушили на воздухе в течение 12–15 ч. Из полученных пленок вырезали диск диаметром 0.5–0.6 см и приклеивали его к торцу поливинилхлоридной трубки. После полного высыхания клея изготовленный электрод заполняли стандартным раствором Меф и погружали в него медную проволоку.
Двухслойные мембраны готовили аналогично. Получали две смеси для мембран на основе ИА ФО с ${\text{СlО}}_{4}^{ - }$ и мефенаминовой или фенилантраниловой кислотами. Для получения первого слоя смесь на основе ИА ФО с ${\text{СlО}}_{4}^{ - }$ помещали в стеклянную форму. Через 50–60 мин сверху наливали вторую смесь с ИА (ФО+)(Меф–) или ИА (ФО+)(Фен–). После полного высыхания мембраны, вырезали диск, который приклеивали к поливинилхлоридной трубке так, чтобы первый слой был направлен внутрь трубки. Внутренним раствором служил 0.01 М раствор NaClO4.
Спектры светопоглощения растворов исследовали на спектрофотометре СФ-2000 (ЛОМО, Россия) в кварцевых кюветах толщиной 1 см. ИК-спектры регистрировали на спектрометре Nicolet iS10 с микроскопом Continuum в интервале длин волн 4000–650 см–1. Потенциометрические измерения проводили с помощью иономера АІ-123 (MLsoft Instruments, Украина), погрешность измерений не превышает ±0.02 мВ/рс. Электродом сравнения служил хлоридсеребрянный электрод ЭВЛ-1МЗ или ЭCР-10103. рН растворов контролировали иономером АІ-123 или И-160 М со стеклянным электродом. Все измерения проводили при комнатной температуре. Кислотность среды поддерживали с помощью буферной смеси (0.04 М CH3COOH, H3BO3, H3PO4 и 0.2 М раствор NaOH). Измерения проводили по классической схеме построения электрохимической ячейки:
Методика определения мефенаминовой кислоты в фармацевтических препаратах. 20 таблеток или содержание 20 капсул гомогенизируют в агатовой ступке до однородного порошкообразного состояния. Навеску полученного порошка, эквивалентного массе одной таблетки или капсулы, растворяют в 10 мл 0.5 М раствора NaOH. Раствор помещают в мерную колбу емк. 100 мл и разбавляют дистиллированной водой до метки, регулируя кислотность с помощью универсального буферного раствора до значения рН 9.5 ± 0.5. Полученный раствор переносят в стакан емк. 150 мл, погружают в него электроды и измеряют электродный потенциал. Концентрацию мефенаминовой и фенилантраниловой кислот определяют по градуировочному графику, полученному в аналогичных условиях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Осаждение ионных ассоциатов сопровождается изменением окраски растворов с последующим образованием мелкокристаллического осадка. Важную роль имеет кислотность среды растворов, поскольку мефенаминовая и фенилантраниловая кислоты могут находиться в однозарядной ионной форме в растворе только в щелочной среде (рН 8–12). Схему образования ионных ассоциатов можно представить следующим образом:
(1)
${\text{А}}{{{\text{n}}}^{ - }} + {\text{C}}{{{\text{t}}}^{ + }} \leftrightarrow \, \downarrow {\kern 1pt} {\text{A}}{{{\text{n}}}^{--}}{\text{C}}{{{\text{t}}}^{ + }},$Образование ИА фуксина основного с мефенаминовой, фенантрониловой кислотами, а также с перхлорат-анионом исследовано методом ИК-спектроскопии (рис. 1). В спектрах Меф наблюдаются характерные пики при 1255 см–1 (валентные колебания группы –ОН и вибрационные группы –COOH), 1647 см–1 (валентные колебания группы –NH), 1572 см–1 (C=O растяжения), 1504 см–1 (ароматические –CH плоские деформации), 1163 см–1 (ароматические –O–CH3) [39].
Рис. 1.
ИК-спектры фуксина основного (1) и его соединений с фенилантраниловой кислотой (2), мефенаминовой кислотой (3), ${\text{СlО}}_{4}^{ - }$ (4).
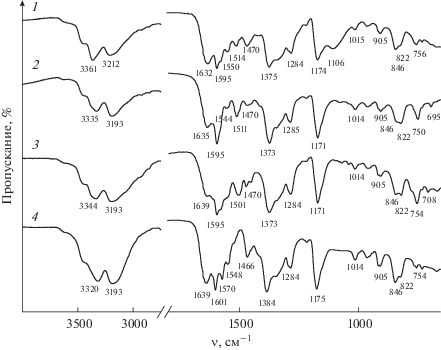
Фенилантраниловая кислота содержит характерные пики при 1657 см–1, которые соответствуют С=О валентному колебанию карбоксильной группы; пики при 1261 см–1 могут быть отнесены к валентным колебаниям группы CN в молекуле Фен [40].
В молекуле фуксина основного содержатся атомы азота, о чем свидетельствуют валентные колебания ν(NH) при 3361, 3212 см–1, деформационные δ(NH) при 1632, 1595, 1550, 1514 см–1 и ν(СN) при 1375, 1284, 1174 см–1.
Во время образования ионных ассоциатов (рис. 1, кривые 2–4) изменяется интенсивность и положение основных полос поглощения. При 3650–3190 см–1 появляется широкая полоса, которая отвечает валентным колебанием NH-связей. Полосы поглощения деформационных колебаний NH-групп наблюдаются при 1595 см–1, а колебания ν(СH) – при 1285–1014 см–1.
Спектрофотометрически установлено, что незначительное увеличение количества Меф или Фен в растворе (в условиях постоянной концентрации красителя) вызывает батохромный сдвиг полосы светопоглощения (рис. 2).
Рис. 2.
Спектры светопоглощения фуксина основного в присутствии фенилантраниловой (а) и мефенаминовой (б) кислот. (а): 6 × 10–5 М фуксин основной; сФен × 104, М: 1 – 0, 2 – 2, 3 – 10, 4 – 16, 5 – 30, 6 – 60. (б): 4 × 10–5 М фуксин основной; сМеф × 104, М: 1 – 0, 2 – 4, 3 – 8, 4 – 12, 5 – 20, 6 – 60.

Появление изобестической точки указывает на образование соединений постоянного состава. Используя спектры светопоглощения растворов ИА можно рассчитать их константы ассоциации Kas, значения которых для Меф и Фен составили соответственно 5.82 × 103 и 2.58 × 103.
Полученные осаждением ионные ассоциаты использовали в качестве электродноактивного вещества (ЭАВ) при изготовлении сенсоров. Зависимость химико-аналитических свойств сенсоров от состава мембран изучали путeм изготовления однотипных мембран с постоянным содержанием всех компонентов, кроме исследуемого.
Известно [41], что природа пластификатора, использованного при изготовлении мембраны, существенно влияет на отклик электродов. Как видно из рис. 3, лучшие характеристики имеют мембранные сенсоры, пластифицированные ТКФ (крутизна электродной функции составляет 54.2 ± 0.3 и 69.0 ± 0.3 мВ/рс для Меф и Фен соответственно).
Рис. 3.
Влияние природы пластификатора на отклик сенсоров к фенилантраниловой (а) и мефенаминовой кислотам (б). (а): 6% ионного ассоциата (ФО+)(Фен–), 65% пластификатора: 1 – ТКФ, 2 – ДБФ, 3 – ДНФ, 4 – ДБС. (б): 6% ионного ассоциата (ФО+)(Меф–), 65% пластификатора: 1 – ТКФ, 2 – ДБФ, 3 – ДНФ, 4 – ДОФ, 5 – ДБС.

В табл. 2 представлены электрохимические характеристики мембран на основе ИА (ФО+)(Меф–) и ИА (ФО+)(Фен–), пластифицированных при помощи ТКФ. Видно, что все мембраны обеспечивают крутизну электродной функции, характерную для однозарядных ионов. Мембраны с высоким содержанием ТКФ (65–75%) более эластичны, и от этого зависит время жизни сенсора. Оптимизированный состав мембран электродов для определения мефенаминовой и фенилантраниловой кислот составляет 4% ИА, 65% ТКФ, 31% ПВХ и 6% ИА, 70% ТКФ, 24% ПВХ соответственно.
Таблица 2.
Характеристики химико-аналитических свойств сенсоров на мефенаминовую и фенилантраниловую кислоты
| Содержание ТКФ, % | Мефенаминовая кислота | Фенилантраниловая кислота | ||||
|---|---|---|---|---|---|---|
| крутизна электродной функции, мВ/рс |
линейный диапазон, М | cmin, М | крутизна электродной функции, мВ/рс |
линейный диапазон, М | cmin, М | |
| 45 | 50.2 | 1 × 10–3–0.01 | 1.9 × 10–4 | 60.0 | 3 × 10–3–0.1 | 9.0 × 10–4 |
| 55 | 60.3 | 1 × 10–3–0.01 | 2.8 × 10–4 | 76.5 | 3 × 10–3–0.1 | 8.1 × 10–4 |
| 65 | 65.6 | 3 × 10–4–0.01 | 1.6 × 10–4 | 64.3 | 1 × 10–3–0.1 | 5.3 × 10–4 |
| 70 | 66.2 | 6 × 10–4–0.01 | 1.7 × 10–4 | 64.3 | 1 × 10–3–0.1 | 3.8 × 10–4 |
| 75 | 68.1 | 1 × 10–3–0.01 | 1.9 × 10–4 | 67.2 | 1 × 10–3–0.1 | 5.0 × 10–4 |
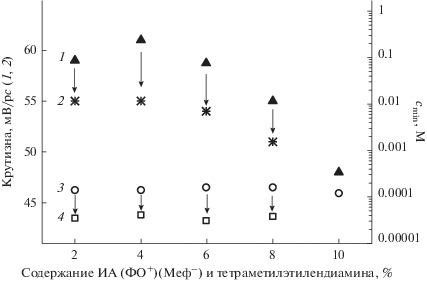
В некоторых случаях добавление липофильного компонента в мембрану может изменить параметры отклика сенсора к потенциалопределяющему иону [42–45]. Нами исследовано влияние добавки тетраметилэтилендиамина (ТМЭД) на электрохимические параметры сенсоров, изготовленных на основе мембран с содержанием ИА (ФО+)(Меф–) 2, 4, 6, 8 и 10%. Установлено, что добавление в мембрану 0.02–0.08 мл ТМЭД приводит к незначительным изменениям характеристик сенсора (рис. 4).
Рис. 4.
Влияние содержания ионного ассоциаиа (ФО+)(Меф–) и липофильной добавки в мембране на крутизну электродной функции и предел обнаружения (cmin) мефенаминовой кислоты. 1 – ИА (ФО+)(Меф–), 2 – ИА (ФО+)(Меф–) и ТМЭД, 3 – ИА (ФО+)(Меф–), 4 – ИА (ФО+)(Меф–) и ТМЭД.
С целью улучшения характеристик сенсоров изготовили двухслойные мембраны на основе ионных ассоциатов Сl${\text{O}}_{4}^{ - }$. Меф и Фен с ФО. Установлено, что использование двухслойных мембран улучшает свойства сенсоров (рис. 5). Кроме того, данная технология позволяет заменить малоустойчивые во времени внутренние растворы Меф или Фен на раствор неорганической соли – 0.01 М раствор NaClO4.
Рис. 5.
Зависимость потенциала сенсора от концентраций мефенаминовой (а) и фенилантраниловой кислот (б). 1 – двухслойная мембрана; 2 – однослойная мембрана, содержащая ТМЭД; 3 – однослойная мембрана.

Изготовленные образцы сенсоров работают в диапазоне рН растворов 8.5–12. Стабильное значение электродных потенциалов устанавливается уже через 10–15 с. Синтезированные мембраны пригодны к работе в течение не менее 4 мес.
Для определения значений коэффициентов селективности сенсоров использовали метод отдельных растворов. Для этого получали зависимость потенциала от концентрации мешающего иона в растворе и находили соотношение активностей исследуемого аА и постороннего аВ ионов при достижении равных потенциалов:
Полученные коэффициенты селективности (рKА/В) для однослойных и двухслойных мембран представлены в табл. 3. Видно, что селективность двухслойных мембран относительно некоторых ионов (бромиды, иодиды, роданиды, перхлораты, бораты, фосфаты, салицилаты) улучшается. Важным преимуществом созданного сенсора по сравнению с известным ртутно-мефенаматным графитовым сенсором [25] является возможность проводить измерения в растворах, содержащих хлорид-ионы.
Таблица 3.
Коэффициенты селективности (рKА/В) сенсоров на мефенаминовую и фенилантраниловую кислоты
| Мешающий ион | Однослойная мембрана | Двухслойная мембрана | Hg(I)–Меф-сенсор [25] | ||
|---|---|---|---|---|---|
| Меф | Фен | Меф | Фен | ||
| Cl– | 4.81 | 3.84 | 3.60 | 4.01 | 0.52 |
| Br– | 2.83 | 3.26 | 3.52 | 3.22 | – |
| I– | 2.28 | 2.46 | 3.41 | 3.42 | – |
| F– | 4.95 | 4.95 | 4.34 | >5 | – |
| SCN– | 1.63 | 1.74 | 2.22 | 2 .17 | – |
| B4${\text{O}}_{7}^{{2 - }}$ | 3.02 | 2.94 | 3.54 | >5 | 5.57 |
| Cl${\text{O}}_{4}^{ - }$ | 0.97 | 1.24 | 1.91 | 1 .35 | – |
| S2${\text{O}}_{3}^{{2 - }}$ | 3.91 | 3.72 | 3.42 | >5 | – |
| N${\text{O}}_{3}^{ - }$ | 4.20 | 3.72 | 3.23 | 3.59 | – |
| P${\text{O}}_{4}^{{3 - }}$ | 4.64 | 4.45 | 4.92 | >5 | – |
| Бензоат | 4.90 | 4.90 | 3.61 | 3.21 | 2.06 |
| Салицилат | 0.71 | 2.66 | 3.24 | 2 .89 | 2.49 |
| Фен | 1.03 | – | 1.40 | – | – |
| Меф | – | 0.65 | – | 0 .70 | – |
Изготовленные сенсоры использовали для определения фенилантраниловой кислоты в модельных растворах и мефенаминовой кислоты в фармацевтических препаратах. Результаты представлены в табл. 4 и 5.
Таблица 4.
Результаты (мг) определения фенилантраниловой кислоты в модельных растворах (n = 3, P = 0.95)
| Мембрана | Введено | Найдено | sr, % | R, % |
|---|---|---|---|---|
| Однослойная | 200 | 196 | 4.2 | 98 |
| 150 | 154 | 3.8 | 103 | |
| 100 | 102 | 4.0 | 102 | |
| Однослойная с ТМЭД | 50 | 53 | 3.2 | 106 |
| 100 | 98 | 2.9 | 98 | |
| 150 | 152 | 3.6 | 101 | |
| Двухслойная | 50 | 52 | 2.5 | 104 |
| 100 | 101 | 2.9 | 101 | |
| 150 | 146 | 2.0 | 97 |
Таблица 5.
Результаты (мг) определения мефенаминовой кислоты в фармацевтических препаратах (n = 3, P = 0.95)
| Препарат (форма) | Тип мембраны | Содержание согласно спецификации | Найдено | sr |
|---|---|---|---|---|
| Мефенаминовая кислота (капсулы) |
Однослойная | 500 | 504 | 0.05 |
| Однослойная с ТМЭД | 500 | 504 | 0.09 | |
| Двухслойная | 500 | 506 | 0.07 | |
| Мефенаминовая кислота (таблетки) |
Однослойная | 500 | 497 | 0.04 |
| Однослойная с ТМЭД | 500 | 495 | 0.04 | |
| Двухслойная | 500 | 497 | 0.06 | |
| Мефенаминовая кислота (капсулы) |
Однослойная | 250 | 246 | 0.09 |
| Однослойная с ТМЭД | 250 | 245 | 0.10 | |
| Двухслойная | 250 | 249 | 0.08 |
Данное исследование было поддержано Агенством по научным грантам VEGA Министерства образования Словацкой Республики и Словацкой Академии Наук (Грант № 1/0033/20).
Список литературы
Zapała L., Kalembkiewicz J. Studies on the distribution of N-phenylanthranilic acid in two-phase system: Aromatic solvent–water // Talanta. 2006. V. 69. № 3. P. 601.
Войтенко Н.Г. Мефенаминовая кислота-Дарница: уменьшая лихорадку, активирует иммунную защиту // Укр. мед. журн. 2011. Т. 81. № 1. С. 75.
Maron N., Wright G. Application of photodiode array UV detection in the development of stability-indicating LC methods: Determination of mefenamic acid // J. Pharm. Biomed. Anal. 1990. V. 8. № 1. P. 101.
United States Pharmacopeia National Formulary, USP 26, NF21. Rockville, 2003. 1141 p.
Niopas I., Mamzoridi K. Determination of indomethacin and mefenamic acid in plasma by high-performance liquid chromatography // J. Chromatogr. B. 1994. V. 656. № 2. P. 447.
Rouini M.R., Asadipour A., Hoseinzadeh Ardakani Y., Aghdasi F. Liquid chromatography method for determination of mefenamic acid in human serum // J. Chromatogr. B. 2004. V. 800. P. 189.
Sun Y., Takaba K., Kido K., Nakashima M.N., Nakashima K. Simultaneous determination of arylpropionic acid non-steroidal anti-inflammatory drugs in pharmaceutical formulations and human plasma by HPLC with UV detection // J. Pharm. Biomed. Anal. 2003. V. 30. № 5. P. 1611.
Hoshina K., Horiyama S., Matsunaga H., Haginaka J. Simultaneous determination of non-steroidal anti-inflammatory drugs in river water samples by liquid chromatography-tandem mass spectrometry using molecularly imprinted polymers as a retreatment column // J. Pharm. Biomed. Anal. 2011. V. 55. № 1. P. 916.
Ibrahim F., Sharaf El-Din M.K., El-Din A.K., Shimizu K. Micellar HPLC method for simultaneous determination of ethamsylate and mefenamic acid in presence of their main impurities and degradation products // J. Chromatogr. Sci. 2017. V. 55. № 1. P. 23.
Morcoss M.M., Abdelwahab N.S., Ali N.W., Elsaady M.T. Different chromatographic methods for simultaneous determination of mefenamic acid and two of its toxic impurities // J. Chromatogr. sci. 2017. V. 55. №. 7. P. 766.
Twinkle P.K., Dhananjay M.B. Development and validation of high performance thin layer chromatography for estimation of mefenamic acid, paracetamol and dicyclomine HCl in tablet dosage form // Int. J. Pharm. Sci. Drug Res. 2015. V. 7. № 4. P. 361.
Rivai H., Putri W.K., Armin F. Development and validation of thinlayer chromatography densitometry method for analysis of mefenamic acid in tablet // J. Chem. Pharm. Res. 2016. V. 8. № 1. P. 565.
Wan Ibrahim W.N., Sanagi M.M., Mohamad Hanapi N.S., Kamaruzaman S., Yahaya N., Wan Ibrahim W.A. Solid-phase microextraction based on an agarose-chitosan-multiwalled carbon nanotube composite film combined with HPLC–UV for the determination of nonsteroidal anti-inflammatory drugs in aqueous samples // J. Sep. Sci. 2018. V. 41. P. 2942.
Asiabi H., Yamini Y., Shamsayei M. Development of electrochemically controlled packed-in-tube solid phase microextraction method for sensitive analysis of acidic drugs in biological samples // Talanta. 2018. V. 185. P. 80.
Al-Khazrajy O.S.A., Boxall A.B.A. Determination of pharmaceuticals in freshwater sediments using ultrasonic-assisted extraction with SPE clean-up and HPLC-DAD or LC-ESI-MS/MS detection // Anal. Methods. 2017. V. 9. P. 4190.
Arghavani-Beydokhti S., Rajabi M., Asghari A. Coupling of two centrifugeless ultrasound-assisted dispersive solid/liquid phase microextractions as a highly selective, clean, and efficient method for determination of ultra-trace amounts of non-steroidal anti-inflammatory drugs in complicated matrices // Anal. Chim. Acta. 2018. V. 997. P. 67.
Rashid M.H., Sarsam S.W., Al-Sabea N. A spectrophotometric method for the determination of Mefenamic acid in pharmaceutical dosage form // Al-Mustansiriyah J. Pharm. Sci. (AJPS). 2017. V. 7. № 2. P. 7.
Alarfaj, N. A., Altamini S. A., Almarshady L. Z. Spectrophotometric determination of mefenamic acid in pharmaceutical preparations // Asian J. Chem. 2009. V. 21. № 1. P. 217.
Das S., Sharma S. C., Talwar S. K., Sethi P. D. Simultaneous spectrophotometric determination of mefenamic acid and paracetamol in pharmaceutical preparations // Analyst. 1989. V. 114. № 1. P. 101.
Zseltvay I., Zheltvay O., Antonovich V. The extraction of aromatic carboxylic acids by the copper complex with Curtis macrocyclic tetramine and its utilization for photometric determination of non-steroidal anti-inflammatory drugs // Acta Pol. Pharm. 2011. V. 68. № 5. P. 629.
Sastry C.S., Prasad Tipirneni A.S., Suryanarayana M.V. Extractive spectrophotometric determination of some anti-inflammatory agents with methylene violet // Analyst. 1989. V. 114. № 4. P. 513.
Кормош Ж.А., Матвийчук О.Ю., Базель Я.Р. Экстракционно-фотометрическое определение мефенаминовой кислоты в фармацевтических препаратах // Журн. аналит. химии. 2014. Т. 69. № 10. С. 1054. (Kormosh Z., Matvijchuk I., Bazel Y. Extraction spectrophotometric determination of mefenamic acid in pharmaceutical preparations // J. Analyt. Chem. 2014. V. 69. № 10. P. 960.)
Othman N.S., Awadis L.S. spectrophotometric determination of mefenamic acid in pharmaceutical preparations via Arsenazo III – Cerium (III) reaction // J. Raf. Sci. 2009. V. 20. № 1. P. 8.
Hashemi M., Zohrabi P., Torkejokar M. Forced vortex assisted liquid phase microextraction for preconcentration and spectrophotometric determination of mefenamic acid in biological samples // Sep. Purif. Technol. 2017. V. 176. P. 126.
Santini A. O., Pezza H., Pezza L. Development of a potentiometric mefenamate-ion sensor for the determination of mefenamic acide in pharmaceuticals and human blood serum // Sens. Actuators B. 2007. V. 128. № 1. P. 117.
Hasanzadeh M., Shadjou N., Saghatforoush L., Dolatabadi J.E. Preparation of a new electrochemical sensor based on iron(III) complexes modified carbon paste electrode for simultaneous determination of mefenamic acid and indomethacin // Colloids Surf. B. Biointerfaces. 2012. V. 92. P. 91.
Babaei A., Khalilzadeh B., Afrasiabi M. A new sensor for the simultaneous determination of paracetamoland mefenamic acid in a pharmaceutical preparationand biological samples using copper(II) doped zeolite modified carbon paste electrode // J. Appl. Electrochem. 2010. V. 40. P. 1537.
Liu L., Song J. Voltammetric determination of mefenamic acid at lanthanum hydroxide nanowires modified carbon paste electrodes // Anal. Biochem. 2006. V. 354. № 1. P. 22.
Печенкина И.А., Михельсон К.Н. Материалы мембран ионоселективных электродов на основе ионофоров: проблемы и достижения // Электрохимия. 2015. Т. 51. № 2. С. 115. (Pechenkina I.A., Mikhelson K.N. Materials for the ionophore based membranes for ion selective electrodes: Problems and achievements // Russ. J. Electrochem. 2015. V. 51. № 2. Р. 93.)
Михельсон К.Н., Пешкова М.А. Химические сенсоры на основе ионофоров: достижения и перспективы // Успехи химии. 2015. Т. 84. № 6. С. 555. (Mikhelson K.N., Peshkova M.A. Advances and trends in ionophore-based chemical sensors // Russ. Chem. Rev. 2015. V. 84. № 6. P. 555.)
Shetti N.P., Nayak D.S., Malode S.J., Kakarla R.R., Shukla S.S. Sensors based on ruthenium-doped TiO2 nanoparticles loaded into multi-walled carbon nanotubes for the detection of flufenamic acid and mefenamic acid // Anal. Chim. Acta. 2019. V. 1051. P. 58.
Tezerjani M.D., Benvidi A., Rezaeinasab M., Jahanbani S., Ardakani M.M. A nanostructured suitable platform based on multi wall carbon nanotubes and graphene nano sheets composite for determination of mefenamic acid // J. Serb. Chem. Soc. 2017. V. 82. P. 1273.
Akbarian Y., Shabani-Nooshabadi M., Karimi-Maleh H. Fabrication of a new electrocatalytic sensor for determination of diclofenac, morphine and mefenamic acid using synergic effect of NiO-SWCNT and 2, 4-dimethyl-N-[1-(2,3-dihydroxy phenyl) methylidene]aniline // Sens. Actuators B. 2018. V. 273. P. 228.
Naeemy A., Gholam-Shahbazi R., Mohammadi A. Simultaneous voltammetric determination of mefenamic acid and paracetamol using graphene nanosheets/nickel oxide nanoparticles modified carbon paste electrode // Electrochem. Sci. Technol. 2017. V. 8. P. 282.
Tarlekar P., Chatterjee S. Enhancement in sensitivity of non-steroidal anti-inflammatory drug mefenamic acid at carbon nanostructured sensor // J. Electroanal. Chem. 2017. V. 803. P. 51.
European Pharmacopeia 5.0, Council of Europe, Strasbourg, France, 2001. P. 1534.
Кобзар Н.П., Ісаєв С.Г., Свєчнікова О.М., Павлій О.О. Кількісний аналіз нових біологічно активних похідних N-фенілантранілової та мефенамінової кислот методом двофазного титрування // Журн. орг. та фарм. хім. 2006. Т. 4. № 16. С. 67.
Камман К. Работа с ионоселективными электродами. М.: Мир, 1980. 283 с.
Romero S., Escalera B., Bustamante P. Solubility behavior of polymorphs I and II of mefenamic acid in solvent mixtures // Int. J. Pharm. 1999. V. 178. № 2. P. 193.
Mudit D., Keshavarao K.P., Selvam P. Improvement of solubility and dissolution rate of mefenamic acid by solid dispersions in PEG4000 // Int. Res. J. Pharm. 2011. V. 2. № 4. P. 207.
Морф В. Принципы роботы ионоселективных электродов и мембранный транспорт. М.: Мир, 1985. 280 с.
Bakker E., Chumbimuni-Torres K. Modern directions for potentiometric sensors // J. Braz. Chem. Soc. 2008. V. 19. № 4. P. 621.
Mikhelson K.N. Variability of selectivity coefficients of ionophore-based ion-selective membranes: Description using multispecies approximation // Методы и объекты химического анализа. 2006. Т. 1. № 1. С. 73.
Ivanova A.D., Koltashova E.S., Solovyeva E.V., Peshkova M.A., Mikhelson K.N. Impact of the electrolyte co-extraction to the response of the ionophore-based ion-selective electrodes // Electrochim. Acta. 2016. V. 213. P. 439.
Mikhelson K.N. Ion-selective Electrodes Lecture Notes in Chemistry. Heidelberg-New York-Dordrecht-London: Springer, 2013. 162 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




