Журнал аналитической химии, 2020, T. 75, № 8, стр. 760-766
Сенсор из арсенида галлия для потенциометрического титрования ионов серебра, меди, свинца и кадмия
В. А. Бурахта a, *, С. С. Сатаева b, **
a Западно-Казахстанский инновационно-технологический университет
009006 Уральск, просп. Достык-Дружба, 208, Республика Казахстан
b Западно-Казахстанский аграрно-технический университет им. Жангир хана
009090 Уральск, ул. Жангир хана, 51, Республика Казахстан
* E-mail: vburakhta@mail.ru
** E-mail: sataeva_safura@mail.ru
Поступила в редакцию 18.03.2019
После доработки 31.05.2019
Принята к публикации 19.12.2019
Аннотация
Разработаны полупроводниковые сенсоры на основе арсенида галлия, модифицированные электрохимическим способом, для потенциометрического титрования ионов металлов. Показано, что после модифицирования поверхности электроаналитические характеристики GaAs-электродов улучшаются: увеличивается крутизна электродной функции, расширяется интервал линейности электродной функции, сокращается время отклика.
Методы потенциометрического титрования с использованием ионселективных электродов широко применяют для анализа различных объектов благодаря их экономичности, простоте и портативности оборудования. Одной из актуальных задач в потенциометрическом анализе является создание новых индикаторных электродов, а также совершенствование уже известных. Для анализа жидких сред часто применяют полупроводниковые электроды, которые имеют ряд преимуществ − доступность, устойчивость в агрессивных средах, механическая прочность, длительный срок службы.
Для улучшения электроаналитических свойств индикаторных электродов используют модифицирование. Модифицированные электроды в последнее время находят все более широкое применение в электроаналитической практике. Модифицирование поверхности позволяет к традиционным свойствам индикаторных электродов добавить новые, которые повышают их реакционную способность и избирательность [1].
Способам целенаправленного модифицирования поверхности ионселективных (ИСЭ), металлических и полупроводниковых электродов и их использованию в потенциометрическом анализе посвящено множество публикаций. Так, в монографии [2] установлена возможность модифицирования поверхности ПАВ-сенсоров поливинилхлоридными мономолекулярными ситами с различным диаметром пор. При этом коэффициент потенциометрической селективности для модифицированных электродов уменьшается на 3–4 порядка, что свидетельствует о возможности раздельного определения ПАВ.
В работе [3] предложено модифицирование поверхности халькогенидных электродов путем химического, электрохимического или механического изменения ее свойств. Установлено, что для халькогенидных сенсоров изменение функции в растворах мешающих катионов металлов связано с протеканием твердофазных реакций, приводящих к образованию в электродноактивном слое более труднорастворимых соединений. При выдерживании мембран из сульфида серебра в растворах хлорида ртути(II) они приобретают ртутную и хлоридную функции.
Ранее в работе [4] разработаны и исследованы характеристики немодифицированных и модифицированных полупроводниковых электродов типа АIIIBV в растворах солей металлов, галогенидов, комплексообразующих реагентов. Предлагаемые электроды пригодны в качестве индикаторных в кислотно-основном, осадительном, комплексометрическом потенциометрическом титровании.
В работе [5] изучены полупроводниковые электроды на основе арсенида галлия (GaAs) и показана возможность их использования в качестве индикаторных в различных вариантах потенциометрического титрования. Предложенное модифицирование полупроводниковой поверхности электрода из GaAs электрохимическим способом позволило улучшить электродную функцию, рабочий интервал, время отклика и воспроизводимость.
Таким образом, исследование электродных свойств твердых полупроводниковых электродов из арсенида галлия в растворах солей металлов и применение их в потенциометрическом титровании является актуальным. Ранее нами исследованы электроаналитические характеристики электрода из GaAs в растворах ионов серебра и галогенидов.
Цель настоящей работы – изучение закономерностей функционирования электрохимически модифицированных электродов на основе полупроводниковых материалов из арсенида галлия (GaAs) в растворах солей серебра, меди, свинца и кадмия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для потенциометрических исследований в качестве электрохимических сенсоров использовали электроды на основе полупроводниковых материалов из арсенида галлия (GaAs). Для изготовления сенсоров в качестве электродноактивных мембран использовали монокристаллические полупроводниковые материалы типа АIIIВV – арсенид галлия. Из приготовленных полупроводниковых материалов вырезали диски диаметром 5–6 мм и толщиной 2.0 ± 0.5 мм и вклеивали их эпоксидным компаундом в корпус электрода. Внутренний токоотвод осуществляли по принципу “твердое−твердое”, характерному для бесконтакного типа электродов. Крепление провода к внутренней стороне мембраны осуществляли с помощью токопроводящего контактола, изготовленного на основе эпоксидного компаунда и мелкодисперсного порошка серебра. Корпус электрода изготавливали из инертно-полимерного материала. На конце проводника припаян разъем для подключения к измерительному прибору.
Поверхность мембраны GaAs-сенсора перед экспериментом предварительно обновляли механической обработкой с помощью тонкой наждачной бумаги, затем тщательно промывали дистиллированной водой и высушивали с помощью фильтровальной бумаги. Между измерениями сенсор хранили в сухом виде.
В качестве индикаторных электродов использовали также твердофазные ионселективные электроды: стеклянные электроды ЭСЛ-43-07 (Гомель), медьселективный (Сu-СЭ) с мембраной состава Ag2S–СuS, свинецселективный (Pb-СЭ) с мембраной Ag2S–PbS, кадмийселективный (Cd-СЭ) с мембраной Ag2S–CdS, разработанные в лаборатории химических сенсоров Санкт-Петербургского государственного университета и в научно-исследовательском институте Западно-Казахстанского аграрно-технического университета им. Жангир хана.
В работе использовали универсальный иономер Анион-4100 в режиме милливольтметра (погрешность измерения ЭДС ± 0.01 мВ). Электрохимическая ячейка состояла из GaAs-электрода и стандартного хлоридсеребряного электрода сравнения ЭВЛ-1МЗ, заполненного насыщенным раствором хлорида калия. Растворы перемешивали магнитной мешалкой.
Поверхность GaAs-электрода модифицировали методом электрохимической обработки в растворах сульфида натрия и нитрата серебра, время обработки варьировали. Модифицирование выполняли в режиме U = 20–25 В, I = 0.05 А с использованием выпрямителя ВУП-2М.
Время выдерживания электродов в растворах-модификаторах варьировали. Оно составило: 3, 5 и 10 мин. В табл. 1 в качестве примера приведены результаты, полученные после электрохимического модифицирования электрода с мембраной из GaAs растворами AgNO3 в зависимости от времени модифицирования и концентрации модифицирующего раствора. Как видно, наилучшие результаты получены при выдерживании мембраны исследуемых электродов в 0.1 М растворе AgNO3, так как при использовании более разбавленных растворов исходные характеристики электродов не изменяются. Рекомендуемое время электрохимического модифицирования, достаточное для получения оптимальных электродных характеристик, составило 5 мин. В этом случае электрод приобретает устойчивую электродную функцию к ионам Ag+ в интервале концентраций 10–5–0.1 М с крутизной 66 ± 2 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{с}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}}}} \right. \kern-0em} {{\text{р}}{{с}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}}}.$
Таблица 1.
Аналитические характеристики модифицированных сенсоров с мембраной из GaAs в 0.1 М растворах Na2S и AgNO3
| Характеристика сенсора | Время модифицирования | ||
|---|---|---|---|
| 3 мин | 5 мин | 10 мин | |
| Е, мВ | –175 | –170 | –170 |
| Интервал линейности электродной функции, Е = f(pcAg+), M | 10–5−0.1 | 10–5–0.1 | 10–5–0.1 |
| Крутизна электродной функции, мВ/pcAg+ | 65 ± 2 | 66 ± 2 | 66 ± 2 |
Для сопоставления результатов и учета воспроизводимости определение проводили многократно, полученные результаты обрабатывали статистически. Время отклика фиксировали секундомером после одной минуты нахождения электродов в растворе. рН раствора контролировали стеклянным электродом. Все измерения проводили при 25 ± 1°С. При переходе от потенциометрического титрования одного металла к другому поверхность полупроводникового сенсора обновляли с помощью наждачной бумаги, после чего функция электрода к определяемому иону оставалось хорошо воспроизводимой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследовали электроаналитические свойства потенциометрических сенсоров на основе полупроводникового материала из арсенида галлия до и после электрохимического модифицирования их поверхностей в растворах солей металлов. Установили, что после электрохимической обработки поверхности функции электродов из арсенида галлия заметно улучшаются за счет реакций, протекающих на поверхности мембран, что приводит к возникновению тонкого модифицированного слоя. При этом в ряде случаев наблюдается расширение диапазона линейности, увеличение угла наклона электродной функции, уменьшение времени отклика.
Для изучения электроаналитических характеристик немодифицированных и модифицированных электродов из GaAs (крутизна электродной функции, интервал линейности функции, время отклика, воспроизводимость) исследовали их поведение в растворах ионов Сu, Pb и Сd. В качестве стандартных электродов взяли классические Ag-СЭ, Сu-СЭ, Pb-СЭ, Сd-СЭ.
Оценили поведение GaAs-электрода в растворах солей серебра. Установили, что GaAs-электроды проявляют наибольшую чувствительность к ионам серебра. Сопоставление данных по немодифицированным и модифицированным GaAs-электродам показало, что зависимость Е−рс прямолинейна в интервале концентраций 10–5−0.1 М для обоих электродов, однако они отличаются по крутизне электродной функции: для модифицированных GaAs-электродов S = 66 ± 2 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{{с}_{{{\text{А}}{{{\text{g}}}^{{\text{ + }}}}}}}}}} \right. \kern-0em} {{{с}_{{{\text{А}}{{{\text{g}}}^{{\text{ + }}}}}}}}},$ в то время как до модифицирования она составляла S = 56 ± 2 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{{с}_{{{\text{А}}{{{\text{g}}}^{{\text{ + }}}}}}}}}} \right. \kern-0em} {{{с}_{{{\text{А}}{{{\text{g}}}^{{\text{ + }}}}}}}}}.$ После обработки поверхности мембран кривая зависимости потенциала от концентрации для GaAs-электрода смещена в область значений потенциалов, характерных для сереброселективного электрода (Аg-СЭ). Время установления стационарных потенциалов не превышает 15–20 с.
Изучено поведение GaAs-электрода в растворах солей меди. Наилучшие результаты получены после обработки поверхности мембран. Крутизна электродной функции GaAs-электрода после модифицирования составила 28 ± 2 мВ, в то время как до модифицирования она равна 20 ± 2 мВ. В результате обработки поверхности GaAs-электрода предел обнаружения снизился на порядок с 10–5 до 10–6 М. Для сенсора с модифицированной поверхностью время установления потенциала сократилось почти втрое с 60 с. до 15–20 с. После последовательной электрохимической обработки поверхности GaAs-электрода 0.1 М растворами Na2S и Cu(NO3)2 градуировочная кривая смещается в область положительных значений потенциалов, характерных для медьселективного электрода (Cu-СЭ). Это свидетельствует о протекании на поверхности GaAs-электрода твердофазных реакций с образованием пленки из труднорастворимого сульфида меди, вследствие чего GaAs-электрод функционирует как Cu-СЭ.
Аналогичные результаты получены при изучении зависимости потенциал электрода−концентрация для GaAs-электрода в растворах ионов свинца до и после модифицирования его поверхности. Установили, что электрохимическое модифицирование поверхности мембраны приводит к улучшению аналитических характеристик электрода. Электрод из GaAs, поочередно обработанный 0.1 М растворами Na2S и Рb(NO3)2 в течение 5 мин, обладает Рb2+-функцией в интервале 10–6−0.1 М с крутизной электродной функции 25 ± 2 мВ, тогда как для немодифицированного электрода она равна 22 ± 2 мВ. Время отклика сократилось до 15–20 с по сравнению с 60 с для немодифицированного электрода. В результате электрохимического модифицирования GaAs-электрода наблюдается смещение градуировочных кривых в область положительных значений потенциалов, что характерно для халькогенидных электродов.
Исследования зависимости потенциалов немодифицированных и модифицированных GaAs-электродов от концентрации ионов кадмия показали, что наилучшие результаты получены после обработки поверхности мембран. Электрохимическое активирование GaAs-электрода 0.1 М растворами Na2S и Сd(NO3)2 в течение 5 мин приводит к улучшению характеристик электрода: крутизна электродной функции становится равной 22 ± 2 мВ, в то время как до модифицирования она составляла 18 ± 2 мВ. Концентрационный диапазон расширяется до 10–5 М. Время отклика для GaAs-электрода с обработанной поверхностью уменьшается в 3 раза. Следует отметить, что для модицифированного GaAs-электрода наблюдается смещение градуировочной кривой в область значений потенциалов, характерных для кадмийселективного электрода. В результате электрохимической обработки на поверхности мембраны происходит образование модифицированного слоя и в дальнейшем электрод функционирует как электрод I рода.
Результаты эксперимента приведены в табл. 2. Видно, что для модифицированных GaAs-электродов улучшаются электроаналитические характеристики по сравнению с немодифицированными электродами: увеличивается крутизна электродной функции, расширяется диапазон линейности функции Е–рс и сокращается время установления потенциала.
Таблица 2.
Электроаналитические характеристики немодифицированных и модифицированных GaAs-электродов в растворах нитратов серебра, меди, свинца и кадмия
| Ион | Электрод | Интервал линейности функции Е = f(сi), М | Крутизна электродной функции, мВ/рс | Время отклика, с |
|---|---|---|---|---|
| Ag+ | GaAs (немод.) | 10–5–0.1 | 56 ± 2 | 60−90 |
| GaAs (мод.) | 10–5–0.1 | 66 ± 1 | 15−20 | |
| Ag-CЭ | 10–6–0.1 | 59 ± 2 | 20−30 | |
| Cu2+ | GaAs (немод.) | 10–5–0.1 | 20 ± 5 | 60−90 |
| GaAs (мод.) | 10–6–0.1 | 28 ± 1 | 15−20 | |
| Cu-CЭ | 10-6–0.1 | 29 ± 2 | 20−30 | |
| Рb2+ | GaAs (немод.) | 10–5–0.1 | 22 ± 5 | 60−90 |
| GaAs (мод.) | 10–6–0.1 | 25 ± 1 | 15−20 | |
| Рb-CЭ | 10–5–0.1 | 29 ± 2 | 20−30 | |
| Cd2+ | GaAs (немод.) | 10–4–0.1 | 18 ± 5 | 60−90 |
| GaAs (мод.) | 10–5–0.1 | 22 ± 1 | 15−20 | |
| Cd-CЭ | 10–5–0.1 | 29 ± 2 | 20−30 |
Таким образом, установлено, что электрохимический способ модифицирования является эффективным при обработке поверхности мембран. Так, после электрохимической обработки поверхности функции электродов из GaAs улучшились, за счет реакций, протекающих на поверхности мембраны и приводящих к возникновению сульфидного слоя.
На границе полупроводник–раствор электролита протекают электрохимические реакции, которые являются причиной возникновения электродного потенциала полупроводников. Различают анодную реакцию, связанную с окислением (коррозией, растворением) полупроводника, и катодную, протекающую с восстановлением растворенного окислителя.
При погружении электродов в растворы солей металлов на катодных участках поверхности происходит восстановление ионов металлов до металлического состояния:
Полученные нами данные показали, что значение электродного потенциала CaAs-электрода зависит от концентрации ионов серебра, меди, свинца и кадмия. Найдена корреляция между чувствительностью CaAs-электродов к ионам этих металлов и значениями стандартных электродных потенциалов. Чем более положителен стандартный окислительно-восстановительный потенциал адсорбируемого металла, тем в более положительную область сдвигается потенциал полупроводникового электрода. Это сказывается и на величине тангенса угла наклона электродной функции в растворах солей металлов. Наибольшую чувствительность CaAs-электрод проявляет к ионам серебра ($Е_{{{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}} {{\text{A}}{{{\text{g}}}^{{\text{0}}}}}}} \right. \kern-0em} {{\text{A}}{{{\text{g}}}^{{\text{0}}}}}}}}^{0}$ = 0.799 B), а наименьшую к ионам кадмия ($Е_{{{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}} {{\text{C}}{{{\text{d}}}^{{\text{0}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{d}}}^{{\text{0}}}}}}}}^{0}$ = –0.403 B).
Таким образом, чувствительность полупроводникового GaAs-электрода в растворах солей металлов можно объяснить протеканием на поверхности электрода окислительно-восстановительных реакций, приводящих к образованию поверхностного слоя, и специфической сорбцией ионов окислителей, т.е. восстановлением сорбированных ионов до металлического состояния на поверхности электрода [6].
Наличие отклика исследуемых электродов к ионам Ag, Cu, Pb и Cd подтверждают кривые их потенциометрического титрования 0.01 М раствором Na2S. На рис. 1–4 приведены кривые потенциометрического титрования растворов нитратов Ag, Cu, Pb и Cd 0.01 М раствором Na2S с немодифицированными и модифицированными GaAs-электродами.
Рис. 1.
Кривые потенциометрического титрования ионов серебра 0.01 М растворами Na2S с Ag-СЭ (1), GaAs электродами (2, 3) до модифицирования (2) и после модифицирования (3).
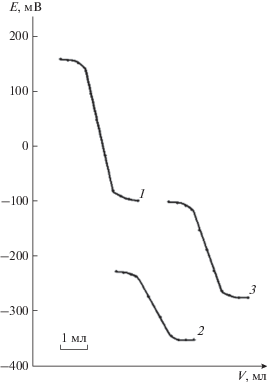
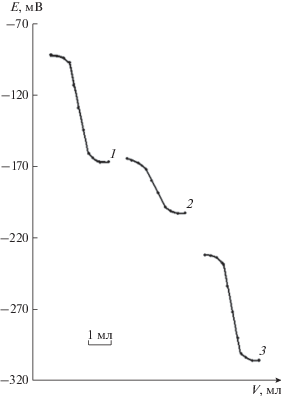
Рис. 2.
Кривые потенциометрического титрования ионов меди 0.01 М раствором Na2S с Cu-СЭ (1) и GaAs-электродами (2, 3) до модифицирования (2) и после модифицирования (3).
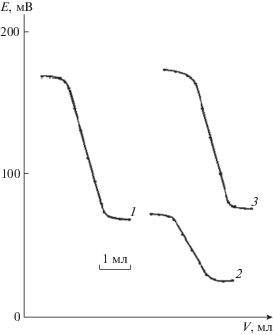
Рис. 3.
Кривые потенциометрического титрования ионов свинца 0.01 М раствором Na2S с Pb-СЭ (1) и GaAs-электродами (2, 3) до модифицирования (2) и после модифицирования (3).
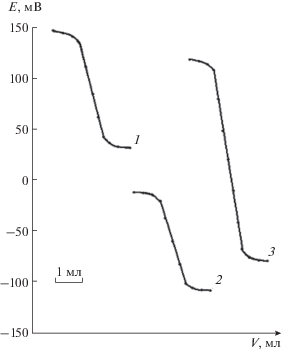
Рис. 4.
Кривые потенциометрического титрования ионов кадмия 0.01 М растворами Na2S с Cd-СЭ (1) и GaAs-электродами (2, 3) до модифицирования (2) и после модифицирования (3).
На рис. 1 представлены кривые потенциометрического титрования 0.01 М раствора AgNO3 растворами сульфида натрия. Видно, что с модифицированными GaAs-электродами получены более четкие скачки потенциалов большей величины (рис. 1, кривая 3) по сравнению с немодифицированными электродами (рис. 1, кривая 2). Если изменение потенциала в конечной точке титрования (КТТ) с немодифицированным GaAs-электродом составило 105 мВ, то после модифицирования поверхности – 145 мВ. Кривая потенциометрического титрования после обработки поверхности GaAs-электрода смещена в область функционирования Ag-СЭ (рис. 1, кривая 1). Время установления стационарного потенциала в КТТ не превышает 10 с.
Аналогичные результаты получены при потенциометрическом титровании ионов меди 0.01 М раствором Na2S. Из рис. 2 видно, что с модифицированными GaAs-электродами получены кривые титрования со скачками потенциалов большей величины, смещенные в более положительную область значений потенциалов. Скачок потенциала с модифицированным GaAs-электродом составляет 135 мВ (рис. 2, кривая 3), с немодифицированным − 100 мВ (рис. 2, кривая 2). Результаты эксперимента хорошо коррелируют с данными прямой потенциометрии. С модифицированными GaAs-электродами вдвое сократилось время установления стационарного потенциала.
При потенциометрическом титровании ионов свинца 0.01 М раствором Na2S с GaAs-электродами наилучшие результаты получены с модифицированным электродом. Скачок потенциала для немодифицированного GaAs-электрода равен 90 мВ (рис. 3, кривая 2), а для последовательно модифицированного 0.1 М растворами Na2S и Рb(NO3)2 величина скачка потенциала составила 110 мВ (рис. 3, кривая 3). Значение потенциала на немодифицированном электроде стабилизируется в течение 60 с, а после модифицирования поверхности электрода – мгновенно.
Сравнение характеристик немодифицированных и модифицированных GaAs-электродов в растворах ионов кадмия показало, что электроды с обработанной поверхностью мембран дают более резкие, четкие и воспроизводимые кривые титрования (рис. 4, кривая 3). Величина скачка потенциала для немодифицированного GaAs-электрода составила 30 мВ (рис. 4, кривая 2), а для модифицированного электрода она увеличилась в 2 раза и составила 60 мВ (рис. 4, кривая 3). Установление стационарного потенциала происходит в течение 10 с после добавления очередной порции титранта. В КТТ равновесный потенциал устанавливается мгновенно.
Таким образом, предложенное модифицирование поверхности полупроводниковых электродов из GaAs электрохимическим способом приводит к увеличению величины скачка потенциала и уменьшению времени отклика, что позволяет более точно и надежно фиксировать конечную точку титрования.
В табл. 3 представлены результаты определения ионов меди потенциометрическим титрованием раствором Na2S с модифицированным GaAs-электродом. Правильность определения оценивали методом введено–найдено.
Таблица 3.
Результаты (мг) потенциометрического титрования ионов меди 0.01 М раствором Na2S с модифицированным GaAs-электродом (n = 4, P = 0.95)
| Введено | Найдено, с ± δ | sr | δ, % |
|---|---|---|---|
| 2.13 | 2.11 ± 0.03 | 0.05 | 2 |
| 3.20 | 3.26 ± 0.06 | 0.03 | 6 |
| 6.40 | 6.5 ± 0.1 | 0.04 | 14 |
Видно, что потенциометрическое титрование Сu2+ в модельных растворах с применением GaAs-электродов характеризуется достаточной точностью и хорошей воспроизводимостью.
Исследована возможность использования электрохимически модифицированных GaAs-электродов в качестве индикаторных для определения сульфид-ионов в газовом конденсате Карачаганакского нефтегазоконденсатного месторождения Западно-Казахстанской области. Определение сульфидов очень важно при решении экологических проблем Западного Казахстана, богатого углеводородным сырьем с высоким содержанием сернистых соединений.
Сульфид-ионы определяли по методу осаждения с использованием в качестве титранта 0.1 М раствора AgNO3. В табл. 4 приведены результаты титрования газового конденсата Карачаганакского нефтегазоконденсатного месторождения с сульфидселективным и GaAs-электродами. Как видно, результаты, полученные с помощью классического сульфидселективного электрода и модифицированных GaAs-электродов, характеризуются хорошей сходимостью. Можно заключить, что электрохимически модифицированные полупроводниковые электроды из GaAs позволяют определять меркаптаны с высокой точностью и хорошей воспроизводимостью. Эти электроды обладают длительным сроком службы (более 10 лет), механической прочностью, стойкостью в агрессивных серосодержащих средах. GaAs-электрод использовали также в аналитических, экологических и нефтехимических лабораториях при исследовании различных объектов и он показал высокую надежность при выполнении серийных анализов.
* * *
Таким образом, показана возможность использования сенсоров на основе полупроводниковых соединений AIIIBV (арсенида галлия) для потенциометрического титрования. Чувствительность предлагаемого электрода к катионам делает его перспективным для экологического мониторинга природных объектов и для экспрессного контроля качества различной продукции.
Список литературы
Будников Г.К. Аналитическая химия в Казанском университете. Фрагменты истории. Казань: Казанский ун-т, 2003. С. 360.
Кулапина Е.Г., Чернова Р.К., Кулапин А.И. Потенциометрические сенсоры для определения синтетических поверхностно-активных веществ. Саратов: Научная книга, 2008. 179 с.
Киянский В.В. Функции халькогенидных электродов в растворах комплексообразующих реагентов и мешающих ионов // Журн. аналит. химии. 1990. Т. 45. № 1. С. 104. (Kiyansky V.V. Functions of chalcogenide electrodes in solutions of complexing reagents and interfering ions // J. Analyt. Chem. 1990. V. 45. № 1. P. 104.)
Бурахта В.А. Новые электроды с мембранами на основе полупроводниковых соединений АIII ВV // Журн. аналит. химии. 2003. Т. 58. № 4. С. 430. (Burakhtа V.А. New electrodes with membranes based on semiconductor compounds AIIIBV // J. Analyt. Chem. 2003. V. 58. №. 4. P. 430.)
Бурахта В.А., Сатаева С.С. Электрохимически модифицированные полупроводниковые электроды на основе арсенида галлия для аргентометрического титрования хлоридов в природных объектах нитратом серебра // Журн. аналит. химии. 2014. Т. 69. № 11. С. 1179. (Burakhta V.A., Sataeva S.S. Electrochemically modified semiconductor gallium arsenide electrodes for the argentometric titration of chlorides with silver nitrate in natural samples // J. Analyt. Chem. 2014. V. 69. № 11. P. 1079.)
Бурахта В.А. Развитие потенциометрических методов анализа объектов окружающей среды // Новости науки. Алматы. 2004. № 4. С. 37.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


