Журнал аналитической химии, 2020, T. 75, № 8, стр. 750-759
Потенциометрические сенсоры на основе мембран Nafion, модифицированных PEDOT, для определения прокаина, лидокаина и бупивакаина в водных растворах и фармацевтических препаратах
Т. С. Титова a, П. А. Юрова a, b, Т. С. Колганова c, И. А. Стенина a, А. В. Паршина c, *, О. В. Бобрешова c, А. Б. Ярославцев a, b
a Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
b Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, ул. Мясницкая, 20, Россия
c Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
* E-mail: parshina_ann@mail.ru
Поступила в редакцию 31.10.2019
После доработки 28.11.2019
Принята к публикации 16.02.2020
Аннотация
Методом окислительной полимеризации in situ синтезированы гибридные материалы на основе перфторированных сульфокатионообменных мембран Nafion и поли-3,4-этилендиокситиофена (PEDOT) с градиентным распределением последнего по длине пленки. При этом варьировали исходные концентрации мономера (0.01 и 0.002 М) и отношение концентраций мономера и окислителя (1/1.25 и 1/2.5). Исследовано влияние равновесных и транспортных свойств полученных материалов на характеристики перекрестно чувствительных ПД-сенсоров (аналитический сигнал–потенциал Доннана) в водных растворах гидрохлоридов прокаина, лидокаина, бупивакаина, в том числе содержащих хлорид натрия, в диапазоне концентраций от 1.0 × 10–4 до 1.0 × 10–2 М и рН от 2 до 6. Относительная погрешность определения действующего вещества в препарате “Новокаин” с помощью ПД-сенсора на основе мембраны Nafion/PEDOT (0.002 М, 1/2.5) составила 0.4%. Массив ПД-сенсоров на основе мембран Nafion и Nafion/PEDOT (0.002 М, 1/1.25) использован для определения гидрохлорида бупивакаина и хлорида натрия в препарате “Маркаин®Спинал” с погрешностью 11 и 6% соответственно.
Прокаин, лидокаин и бупивакаин в форме гидрохлоридов являются наиболее часто используемыми местными анестетиками. Для их определения в фармакопейном анализе рекомендованы титриметрические методы и ВЭЖХ с УФ-детектированием. В современных исследованиях для анализа препаратов местных анестетиков преимущественно используют хроматографию [1–3], спектрофотометрию [4–6] и электрохимические сенсоры [7–17]. Реже применяют капиллярный электрофорез [18, 19], хемилюминесцентный анализ [20, 21], флуориметрию [22] и колориметрию [23].
В работе [7] предложено использовать графитовый пастовый электрод для вольтамперометрического определения прокаина совместно с его метаболитом (п-аминобензойной кислотой) при контроле качества фармацевтических препаратов и фармакокинетических исследованиях. Для определения бупивакаина в присутствии лактозы, глюкозы и сахарозы разработан вольтамперометрический сенсор на основе платинового электрода и селективных полиимидных мембран [8]. Углеродный электрод, полученный по методу трафаретной печати, использован для амперометрического определения прокаина в препаратах методом проточно-инжекционного анализа [9]. В ряде работ в качестве материалов потенциометрических и пьезоэлектрических сенсоров для определения местных анестетиков применяют пластифицированные ПВХ-мембраны с ионными ассоциатами аналитов с тетрафенилборатом [10, 11] или сульфатиазолом [12].
В настоящее время растет интерес к использованию в электрохимических сенсорах гибридных материалов для контроля содержания лекарственных веществ. Для определения прокаина в растворах для инъекций разработаны вольтамперометрические сенсоры на основе стеклоуглеродных электродов, покрытых пленкой перфторсульфополимера Nafion [13], многостенными углеродными нанотрубками (МУНТ) [14], композитной пленкой из полиамидосульфоновой кислоты и МУНТ [15]. Известны вольтамперометрические сенсоры на основе углеродных пастовых электродов, модифицированных наночастицами CuO [16], а также алмазных электродов, допированных бором, для определения лидокаина и прокаина в растворах для инъекций и гелях [17].
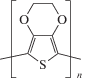
Ранее нами показана возможность использования в мультисенсорных системах гибридных мембран с внедренными неорганическими наночастицами для определения ряда аминокислот и лекарственных веществ [24–26]. В то же время среди потенциальных допантов особое внимание привлекают проводящие полимеры, обладающие собственной электронной проводимостью за счет сопряженной π-системы, в частности, поли-3,4-этилендиокситиофен (PEDOT) (схема 1).
Схема 1. Строение PEDOT.
Значительная часть публикаций посвящена композиту PEDOT с полистиролсульфонатом (PSS) [27, 28], в котором группы –SO3H выступают в качестве донора протонов, значительно повышая проводимость PEDOT. Благодаря высокой проводимости и малой ширине запрещенной зоны, хорошим электрооптическим характеристикам, химической стабильности и электрокаталитической активности PEDOT и PEDOT:PSS широко применяют в области альтернативной энергетики при производстве солнечных батарей, а также в электрохромных устройствах и электрохимических сенсорах [29, 30]. PEDOT используют в амперометрических и вольтамперометрических сенсорах в составе композитных материалов с наночастицами различной природы (Pd/PEDOT [31], МУНТ/PEDOT [32], МУНТ/CeO2-PEDOT [33–35], нанолисты оксида графена/PEDOT [36]), которые наносят на поверхность стеклоуглеродных электродов или изготовленных методом трафаретной печати углеродных электродов. Указанные сенсоры используют для определения пероксида водорода [31], пестицидов [32], дофамина [33–35] и рутина [36]. В качестве высокомолекулярного агента, способного допировать подобные проводящие материалы, могут также выступать перфторированные полисульфокислоты, такие как Nafion и МФ-4СК [37–39]. По данным [40, 41] внедрение PEDOT приводит к снижению ионной проводимости материала, что, на наш взгляд, может быть обусловлено достаточно большим его содержанием в исследованных образцах, приводящим к забиванию системы пор и каналов мембраны и блокированию ионного транспорта. В то же время сенсоры на основе пленок Nafion + PEDOT, электрополимеризованных на Pt-проволоке или углеродных волокнистых микроэлектродах, демонстрировали высокую чувствительность и селективность in vivo определения L-глутамата [42] и дофамина [41], а также стабильность при хранении.
Введение PEDOT, связывающего часть протонов и повышающего тем самым гидрофобность мембран Nafion, может сильно влиять на транспорт ионов внутри системы пор и каналов мембраны. Это может значительно расширить возможные области применения таких материалов. Так, в работе [24] при потенциометрическом определении катионов прокаина и лидокаина проблемой являлось мешающее влияние ионов H3O+. Для его снижения было предложено использовать ПД-сенсоры (аналитический сигнал – потенциал Доннана) на основе мембран Nafion и МФ-4СК, содержащих наночастицы ZrO2, проявляющего при рН < 7 протоноакцепторные свойства, или наночастицы SiO2, поверхностно модифицированные 3-аминопропил- или 3-(2-имидазолин-1-ил)пропил-группами [24]. Эффект достигался за счет вытеснения части электронейтрального раствора из мембраны вследствие присутствия частиц допанта в центре поры и электростатического притяжения противоположно заряженных двойных электрических слоев у поверхности допанта и стенок пор. Сравнение характеристик ПД-сенсоров на основе исходных и гибридных мембран Nafion и МФ-4СК, полученных методами экструзии и отливки, показало, что степень гидрофобности и размер ионов прокаина и лидокаина существенно влияют на возможность их перехода в мембрану. Присутствие PEDOT в порах (и на поверхности) мембран Nafion также должно влиять на возможность сорбции объемных катионов анестетиков, имеющих в своей структуре бензольное кольцо и протоноакцепторные группы, их концентрацию в порах и доступность для взаимодействия с ними сульфогрупп мембран.
Цель данной работы – разработка потенциометрических перекрестно чувствительных ПД-сенсоров на основе гибридных материалов Nafion/PEDOT для определения катионов прокаина, лидокаина и бупивакаина в водных растворах и фармацевтических препаратах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Используемые материалы и реагенты. Использовали промышленную мембрану Nafion-117 (Sigma-Aldrich), 3,4-этилендиокситиофен (Sigma-Aldrich, 98%), персульфат аммония (Riedel-de Haën, 98%), соляную кислоту (ООО “Химмед”, ос. ч.), калия хлорид (ООО “Химмед”, х. ч.), прокаина гидрохлорид (2-(диэтиламино)этил-4-аминобензоат гидрохлорид, ООО “Сигма-Алдрич Рус”, х. ч.), лидокаина гидрохлорид (2-(диэтиламино)-N-(2',6'-диметилфенил)ацетамид гидрохлорид, ООО “Сигма-Алдрич Рус”, х. ч.), бупивакаина гидрохлорид ((RS)-1-бутил-N-(2,6-диметилфенил)пиперидин-2-карбоксамида гидрохлорид, ООО “Сигма-Алдрич Рус”, х. ч.), фармацевтические препараты “Новокаин” (ОАО “Дальхимфарм”, раствор для инъекций), “Маркаин®Спинал” (AstraZeneca AB, раствор для инъекций), воду бидистиллированную или деионизованную (сопротивление 18.2 МОм).
Получение и регенерация гибридных мембран. Методом in situ окислительной полимеризации 3,4-этилендиокситиофена (далее – мономер) получали мембраны Nafion, допированные PEDOT (Nafion/PEDOT). Для этого мембраны выдерживали сначала в водном растворе персульфата аммония (далее – окислитель) в течение 2 ч, а затем еще 2 ч в водном растворе мономера, содержащем 0.1 М соляную кислоту. При этом варьировали как концентрацию мономера в растворе (0.01, 0.002 М), так и соотношение концентраций мономер/окислитель (1/1.25, 1/2.5), которые ниже приведены в обозначении образца, например Nafion/PEDOT (0.002 М, 1/2.5).
Для ПД-сенсоров получали мембраны с градиентным распределением допанта по длине образца. PEDOT содержался в части пленки, конец которой в процессе эксперимента контактирует с исследуемым раствором. Отсутствие допанта в части, контактирующей с раствором сравнения, необходимо для обеспечения близости составов раствора внутри мембраны и раствора сравнения и нивелирования потенциала Доннана на границе раствор сравнения/мембрана.
Поскольку в объектах анализа могут присутствовать несколько типов аналитов, как органических, так и неорганических, мембраны в ионную форму определяемых ионов не переводили. Кроме того, это не всегда представляется возможным, в частности, полное замещение протонов в перфтормембранах на катионы местных анестетиков не достигается [24]. В ПД-сенсорах использовали мембраны в K+-форме. Ее выбор обусловлен снижением влияния на величину и стабильность отклика ПД-сенсора ионов H3O+ и легким процессом “регенерации” мембран после контакта с полиионными растворами лекарственных веществ. Кроме того, в этом случае раствором сравнения в ПД-сенсорах является 1 М раствор KCl, что обеспечивает наименьшие значения диффузионного потенциала жидкостного соединения на границе с внутренним раствором хлоридсеребряного электрода сравнения.
После длительного использования (до 3 месяцев) мембраны “регенерировали”, выдерживая в 2 М растворе KCl в течение 72 ч, а затем промывали бидистиллированной водой. Между сериями повторных измерений (~100 измерений) мембраны выдерживали в 0.1 М растворе KCl в течение 30 мин при постоянном перемешивании и хранили в бидистиллированной воде. Между измерениями мембраны помещали в бидистиллированную воду.
Методы исследования. Влагосодержание определяли термогравиметрически на термовесах Netzsch TG 209 F1 в алюминиевых тиглях в диапазоне температур 20–200°C. Ионообменную емкость (ИОЕ) образцов определяли методом прямого титрования [43]; ее величины приведены из расчета на 1 г набухшего образца.
Проводимость полученных материалов исследовали с помощью измерителя импеданса Elins Z500 PRO в диапазоне частот 10–2 × 106 Гц в потенциостатическом режиме с амплитудой синусоидального сигнала 100 мВ. Для измерения проводимости мембрану закрепляли между графитовыми электродами в ячейке из оргстекла. Измерения проводили в интервале температур 25–100°С в деионизованной воде. Величину ионной проводимости при каждой температуре находили экстраполяцией годографов импеданса на ось активных сопротивлений.
Взаимную диффузию и диффузионную проницаемость исследовали в двухкамерной ячейке, разделенной мембраной, для следующих растворов: 0.1 М KCl/0.1 М HCl, 0.1 М KCl/H2O или 0.1 М HCl/H2O. Величину pH растворов измеряли с помощью pH-метра “Эконикс-Эксперт 001”, а концентрацию раствора КCl – с помощью кондуктометра “Эконикс-Эксперт 002”. Время окончания эксперимента определяли по выходу электропроводности или рН раствора на стационарное значение.
Ячейка для оценки откликов системы ПД-сенсоров включала два корпуса из непроводящего материала, набор мембран разного состава, хлоридсеребряные электроды и многоканальный потенциометр [26]. Во внутренний корпус наливали 5–10 мл исследуемого раствора. В центральную секцию девятисекционного внешнего корпуса помещали внутренний корпус с исследуемым раствором. В остальные восемь секций внешнего корпуса (или в часть из них, если число образцов мембран меньше восьми) наливали 5–10 мл 1 M раствора KCl (раствор сравнения). Мембраны концом модифицированной части погружали в исследуемый раствор, а другим концом – в одну из секций с раствором сравнения. Хлоридсеребряный электрод (ЭСр-10103, ООО “Эконикс-эксперт”), подключенный к входу многоканального потенциометра для электрода сравнения, погружали в исследуемый раствор, а хлоридсеребряные электроды (ЭСр-10103, ООО “Сенсорные Системы”), подключенные к измерительным входам, – в секции с раствором сравнения. Напряжение нескольких цепей (Ag|AgCl, 1 M KCl| Nafion/Nafion + + PEDOT|исследуемый раствор|нас. KCl, AgCl|Ag) измеряли по очереди с помощью многоканального аналого-цифрового преобразователя. Одновременно измеряли рН исследуемого раствора стеклянным электродом (ЭС-10301/4, ООО “Эконикс-эксперт”).
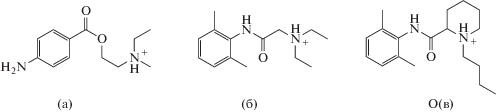
Характеристики ПД-сенсоров определяли в растворах, содержащих гидрохлориды прокаина (Pro), лидокаина (Lid), бупивакаина (Bup) и HCl (или NaCl), концентрации которых варьировали от 1.0 × 10–4 до 1.0 × 10–2 М. Значения рН растворов ProHCl + HCl, LidHCl + HCl и BupHCl + NaCl составляли 2.36–5.75, 2.05–5.56 и 5.13–5.74 соответственно. В данных условиях анестетики находятся в форме однозарядных катионов (схема 2).
Схема 2. Строение ионов ProH+ (а), LidН+ (б), BupН+ (в).
Составы модельных растворов выбирали с учетом состава фармацевтических препаратов местных анестетиков. Препарат “Новокаин” содержит 20 мг/мл ProHCl (действующее вещество), 0.1 М HCl до pH 3.8–4.5 и воду для инъекций (вспомогательные вещества). Препарат “Маркаин®Спинал” содержит BupHCl 5.0 мг/мл (действующее вещество), NaCl 8.0 мг/мл, NaОН и/или HCl для коррекции pH и воду для инъекций (вспомогательные вещества). Растворы препаратов “Новокаин” и “Маркаин®Спинал” для анализа готовили разбавлением бидистиллированной водой в 500 и 50 раз соответственно.
Для оценки воспроизводимости отклика ПД-сенсора в исследуемом растворе определяли дисперсию отклика (s2, мВ2). Стабильность откликов ПД-сенсоров оценивали на основе результатов хронопотенциометрических измерений в течение 1 ч. Для определения времени отклика сенсора (tresp, мин) сравнивали разброс значений отклика в течение времени измерения с разбросом значений при дублировании эксперимента.
Коэффициенты градуировочных уравнений рассчитывали методом многомерного регрессионного анализа с учетом влияния на отклик ПД-сенсоров концентрации всех катионов, присутствующих в растворах. В зависимости от состава градуировочных растворов уравнения имели вид (1) или (2):
(2)
$\Delta {{\varphi }_{{\text{D}}}} = {{b}_{0}} + {{b}_{1}}{\text{pА}} + {{b}_{2}}{\text{pH}} + {{b}_{3}}{\text{pNa}},$Корреляцию между откликами пар ПД-сенсоров для оценки возможности объединения их в массив оценивали по r-критерию.
В зависимости от состава раствора или фармацевтического препарата для расчета концентраций аналитов решали уравнение вида (1) или систему двух градуировочных уравнений вида (2) для выбранных ПД-сенсоров. Экспериментальными данными для расчета концентраций были значения откликов ПД-сенсоров и рН для объекта анализа. Для оценки правильности и воспроизводимости определения аналитов рассчитывали относительную погрешность, δ = (сэксп – стеор)/стеор, %, и относительное стандартное отклонение, sr = = s/сэксп, %.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Свойства гибридных мембран. Модификация мембран Nafion-117 поли-3,4-этилендиокситиофеном не приводит к значимому изменению влагосодержания полученных гибридных материалов как в протонной, так и в K+-форме (табл. 1). Это, наиболее вероятно, связано с небольшим содержанием PEDOT в мембранах, обусловленным используемой в данной работе методикой его получения. Катионообменная мембрана в существенно большей степени сорбирует катионы, чем недиссоциированные молекулы и анионы, вследствие чего концентрация анионов ${{{\text{S}}}_{2}}{\text{O}}_{8}^{{2 - }}$ в мембране, обработанной персульфатом аммония, невысока, как и количество 3,4-этилендиокситиофена, который они способны окислить. В то же время ИОЕ мембран несколько уменьшается с увеличением концентрация мономера и окислителя, а, следовательно, и содержания PEDOT в мембране (табл. 1). Это может быть обусловлено формированием достаточно прочных водородных связей между атомами серы поли-3,4-этилендиокситиофена и протонами сульфогрупп мембраны Nafion-117 и исключением последних из реакции ионного обмена.
Таблица 1.
Влагосодержание (${{\omega }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$), проводимость (σ) при 30°С протонной и калиевой форм мембран, ионообменная емкость мембран, коэффициенты взаимной диффузии (D) и диффузионная проницаемость (P) исследуемых мембран
| смономер, смономер/сокислитель |
${{\omega }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ (± 1), мас. %, H+-форма/K+-форма | ИОЕ (± 0.01), ммоль/г | σ, См/см, H+-форма/K+-форма |
D (KCl/HCl) × × 105, см2/с | P (KCl/вода) × × 107, см2/с | P (HCl/вода) × × 107, см2/с |
|---|---|---|---|---|---|---|
| Nafion-117 | ||||||
| – | 20/9 | 0.65 | 0.028/0.010 | 3.2 | 1.1 | 4.2 |
| Nafion/PEDOT | ||||||
| 0.002 М, 1/1.25 | 20/8 | 0.63 | 0.036/0.012 | 3.2 | 1.2 | 4.5 |
| 0.002 М, 1/2.5 | 19/9 | 0.63 | 0.038/0.011 | 3.3 | 1.2 | 4.5 |
| 0.01 М, 1/1.25 | 20/8 | 0.61 | 0.048/0.009 | 3.3 | 1.1 | 4.3 |
| 0.01 М, 1/2.5 | 19/8 | 0.59 | 0.051/0.008 | 3.3 | 1.1 | 4.3 |
Согласно полученным данным, модификация слабо влияет на коэффициент взаимной диффузии катионов и диффузионную проницаемость, которая определяется переносом анионов. Таким образом, можно заключить, что она не оказывает существенного влияния на перенос анионов через мембраны. Это, видимо, определяется наложением двух противоположных тенденций – расширением пор и каналов за счет внедрения PEDOT и их сужением за счет слабого связывания серы поли-3,4-этилендиокситиофена с сульфогруппами. Можно лишь отметить, что для образцов, полученных с использованием 0.002 М раствора 3,4-этилендиокситиофена, диффузионная проницаемость выше, чем для образцов, полученных с использованием 0.01 М раствора мономера, независимо от их ионной формы (табл. 1).
Проводимость модифицированных образцов в K+-форме сопоставима с таковой для исходной мембраны Nafion-117 (табл. 1) и несколько уменьшается с ростом содержания PEDOT (с увеличением концентрации мономера и избытка окислителя, используемых при получении). В то же время проводимость гибридных мембран в H+-форме значительно выше проводимости образца сравнения, что может быть обусловлено участием PEDOT в протонном транспорте за счет системы водородных связей, подобно тому, как это происходит в мембранах МФ-4СК, содержащих полианилин [37, 38].
Характеристики ПД-сенсоров на основе гибридных мембран. ПД-сенсоры на основе исходной мембраны Nafion-117 и гибридных материалов Nafion/PEDOT характеризуются достаточно низкими значениями времени установления (<1 мин) и дисперсии (11–71 мВ2) отклика в растворах местных анестетиков в диапазоне концентраций 1.0 × 10–4–1.0 × 10–2 М. Градуировочные характеристики ПД-сенсоров не изменялись в течение длительного времени вследствие того, что при переводе мембран в K+-форму их регенерация происходит полностью.
Исследуемые местные анестетики отличаются размером (LidH+ < ProH+ < BupH+), степенью гидрофобности (ProH+ < LidH+ < BupH+) и доступностью аминогрупп (у ионов ProH+ и LidH+ имеются легкодоступные третичные аминогруппы, а у ионов BupH+ аминогруппа в пиперидиновом цикле экранирована).
Гидрофильные свойства ионов ProH+ и наличие свободной положительно заряженной третичной аминогруппы, способной взаимодействовать с сульфогруппами мембраны, обусловливают высокую чувствительность к ним ПД-сенсоров при использовании как исходной (61 ± 3 мВ/рс), так и модифицированных (от 50.6 ± 1.6 до 57 ± 2 мВ/рс) мембран (рис. 1а). При этом чувствительность ПД-сенсоров как к ионам ProH+, так и к мешающим ионам H3O+ несколько снижается в результате модификации. Наибольшее соотношение чувствительности ПД-сенсора к аналиту и мешающим ионам достигается для образца Nafion/PEDOT (0.002 М, 1/2.5) (рис. 1а).
Рис. 1.
Зависимость коэффициентов чувствительности ПД-сенсоров к катионам в растворах ProHCl + + HCl (а) и LidHCl + HCl (б) от концентрации P-EDOT (смономер, М, смономер/сокислитель) в мембранах Nafion-117.
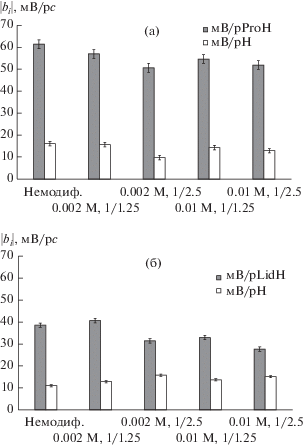
Чувствительность ПД-сенсоров к ионам LidH+ для всех исследуемых образцов ниже (от 27.7 ± 0.8 до 40.6 ± 1.1 мВ/рс), чем к ионам ProH+ (рис. 1). Наибольшая чувствительность ПД-сенсоров к ионам LidH+ (40.6 ± 1.1 мВ/рс) и при этом относительно низкая чувствительность к ионам H3O+ (12.8 ± 0.5 мВ/рс) достигается для образца с наименьшей концентрацией допанта Nafion/PEDOT (0.002 М, 1/1.25) (рис. 1б), характеризующегося несколько более высокой скоростью переноса как противо-, так и коионов (табл. 1). Это согласуется с ранее опубликованными данными [40], согласно которым сорбция гидрофобных ионов LidH+ зависит от стерического фактора.
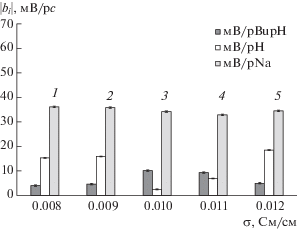
На чувствительность ПД-сенсоров к ионам BupH+, имеющим наибольший размер, степень гидрофобности и труднодоступную для взаимодействия аминогруппу в пиперидиновом цикле, существенно влияют как модификация мембран, так и присутствие в исследуемых растворах ионов Na+ (рис. 2). Чувствительность ПД-сенсоров к ионам Na+ в растворах BupHCl + NaCl превышает таковую к ионам BupH+ и H3O+ и мало зависит от модификации. Зависимость чувствительности ПД-сенсоров к ионам BupH+ от проводимости мембран имеет максимумом, а к ионам H3O+ – минимумом. Чувствительность ПД-сенсоров к ионам BupH+ выше, чем к ионам H3O+ для исходного образца и мембраны Nafion/PEDOT(0.002 М, 1/2.5), а для остальных наблюдается обратное соотношение (рис. 2). Различное соотношение чувствительности ПД-сенсоров к ионам BupH+ и H3O+ обусловливает снижение корреляции между их откликами, что позволяет использовать их в составе мультисенсорных систем.
Рис. 2.
Зависимость коэффициентов чувствительности ПД-сенсоров к катионам в растворe BupHCl + + NaCl от проводимости мембран Nafion/PEDOT в K+-форме: 1 – 0.01 М, 1/2.5; 2 – 0.01 М, 1/1.25; 3 – немодифицированный образец; 4 – 0.002 М, 1/2.5; 5 – 0.002 М, 1/1.25.
Для определения ионов LidH+ и ProH+ в водных растворах выбрали мембраны Nafion/PEDOT (0.002 М, 1/2.5) и Nafion/PEDOT (0.002 М, 1/1.25) соответственно, а для совместного определения ионов BupH+ и Na+ – пару мембран Nafion-117 и Nafion/PEDOT (0.002 М, 1/1.25). Основные характеристики выбранных ПД-сенсоров и мультисенсорной системы, определенные в диапазоне концентраций аналитов от 1.0 × 10–4 до 1.0 × 10–2 М, обобщены в табл. 2. В солянокислых растворах относительная погрешность и относительное стандартное отклонение результатов определения ионов ProH+ составили 1.4–8 и 4–20%, LidH+ – 0.3–13 и 4–11%, BupH+ – 0.10–5 и 1.1–6% соответственно. В растворах BupHCl + NaCl относительная погрешность и относительное стандартное отклонение результатов определения ионов BupH+ составили 3–18 и 8–25%, а ионов Na+ – 5–24 и 5–13% соответственно.
Таблица 2.
Характеристики ПД-сенсоров на основе мембран Nafion/PEDOT для определения катионов LidH+, ProH+, BupH+, Na+ в водных растворах в диапазоне концентраций 1.0 × 10–4–1.0 × 10–2 М
| Характе-ристика | Составы раствора и ПД-сенсора | |||
|---|---|---|---|---|
| ProHCl + HCl (рН 2.36–5.75); Nafion/PEDOT 0.002 М, 1/2.5 |
LidHCl + HCl (рН 2.05–5.56); Nafion/PEDOT 0.002 М, 1/1.25 |
BupHCl + NaCl (рН 5.13–5.74) | ||
| Nafion-117 | Nafion/PEDOT 0.002 М, 1/1.25 | |||
| tresp, мин | <1 | |||
| s2, мВ2 | 71 | 50 | 11 | 12 |
| b1, мВ/рA | –50.6 ± 1.6 | –40.6 ± 1.1 | –10.2 ± 0.3 | –5.0 ± 0.3 |
| b2, мВ/рН | –9.7 ± 0.7 | –12.9 ± 0.5 | –2.45 ± 0.08 | –18.52 ± 0.09 |
| b3, мВ/рNa | – | – | –34.2 ± 0.3 | –34.5 ± 0.3 |
| δ(A+), % | 1.4–8 | 0.3–13 | 3–18 | |
| δ(Na+), % | – | – | 5–24 | |
| sr(A+), % | 4–20 | 4–11 | 8–25 | |
| sr(Na+), % | – | – | 5–13 | |
С помощью ПД-сенсора на основе мембраны Nafion/PEDOT (0.002 М, 1/2.5) определили действующее вещество в препарате “Новокаин”. В соответствии с заявленным составом препарата при его разбавлении в 500 раз концентрация ионов ProH+ в растворе составляет 1.466 × 10–4 М. В табл. 3 представлены значения отклика ПД-сенсора, величина рН, найденное значение концентрации ионов ProH+ в растворе препарата, а также результаты расчета концентрации ProHCl (мг/мл) в препарате и характеристики точности его определения. Относительная погрешность и относительное стандартное отклонение результатов определения ProHCl в препарате “Новокаин” составили 0.4 и 6% соответственно.
Таблица 3.
Результаты определения действующего вещества в препарате “Новокаин”* с помощью ПД-сенсора на основе мембраны Nafion + PEDOT 0.002 М, 1/2.5 (n = 5, P = 0.95)
| Контролируемая величина | Значение |
|---|---|
| Раствор препарата | |
| pH | 6.0 ± 0.5 |
| –∆φD, мВ | 205 ± 4 |
| cэксп (ProH+), M | (1.46 ± 0.08) × 10–4 |
| Препарат | |
| cэксп (ProHCl), мг/мл | 19.9 ± 1.0 |
| δ (ProHCl), % | 0.4 |
| sr(ProHCl), % | 6 |
Мультисенсорную систему на основе мембран Nafion-117 и Nafion/PEDOT (0.002 М, 1/1.25) использовали для определения действующего и вспомогательного веществ в препарате “Маркаин®Спинал”. При разбавлении препарата в 50 раз концентрация ионов BupH+ и Na+ в растворе составляет 3.078 × 10–4 и 2.738 × 10–3 М соответственно. В табл. 4 представлены значения отклика ПД-сенсоров, величины рН, найденные значения концентраций ионов BupH+ и Na+ в растворах препарата, а также результаты расчета концентрации BupHCl и NaCl (мг/мл) в препарате и характеристики точности их определения. Относительная погрешность и относительное стандартное отклонение результатов определения BupHCl составили 11 и 13%, а NaCl – 6 и 3% соответственно.
Таблица 4.
Результаты определения действующего и вспомогательного веществ в препарате “Маркаин®Спинал”* с помощью мультисенсорной системы на основе мембран Nafion-117 (ПД-сенсор 1) и Nafion/PEDOT 0.002 М, 1/1.25 (ПД-сенсор 2) (n = 5, P = 0.95)
| Контролируемая величина | Значение |
|---|---|
| Раствор препарата | |
| pH | 5.52 ± 0.14 |
| –∆φD, мВ (ПД-сенсор 1) | 140 ± 4 |
| –∆φD, мВ (ПД-сенсор 2) | 134 ± 6 |
| cэксп(BupH+), M | (3.4 ± 0.5) × 10-4 |
| cэксп(Na+), M | (2.91 ± 0.09) × 10-3 |
| Препарат | |
| cэксп (BupHCl), мг/мл | 5.5 ± 1.7 |
| δ (BupHCl), % | 11 |
| sr(BupHCl), % | 13 |
| cэксп (NaCl), мг/мл | 8.5 ± 0.5 |
| δ (NaCl), % | 6 |
| sr(NaCl), % | 3 |
* * *
Таким образом, применение в перекрестно чувствительных ПД-сенсорах гибридных материалов на основе перфторированной сульфокатионообменной мембраны Nafion-117 и PEDOT, полученных с использованием 0.002 М раствора 3,4-этилендиокситиофена, обеспечивает достаточно высокую правильность и воспроизводимость определения местных анестетиков в водных растворах и фармацевтических препаратах. Преимуществами предложенных сенсорных систем для анализа фармацевтических сред является стабильность характеристик в течение длительного времени, выполнение анализа без использования реагентов и при относительно невысоком разбавлении препарата, а также простота анализа.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-38-60045.
Список литературы
Storms M.L., Stewart J.T. Stability-indicating HPLC assays for the determination of prilocaine and procaine drug combinations // J. Pharm. Biomed. Anal. 2002. V. 30. № 1. P. 49.
Shuang S., Choi M.M.F. Retention behaviour and fluorimetric detection of procaine hydrochloride using carboxymethyl-β-cyclodextrin as an additive in reversed-phase liquid chromatography // J. Chromatogr. A. 2001. V. 919. № 2. P. 321.
Fijałek Z., Baczyński E., Piwońska A., Warowna-Grześkiewicz M. Determination of local anaesthetics and their impurities in pharmaceutical preparations using HPLC method with amperometric detection // J. Pharm. Biomed. Anal. 2005. V. 37. № 5. P. 913.
Xu L.X., Shen Y.X., Wang H.Y., Jiang J.G., Xiao Y. Spectrophotometric determination of procaine hydrochloride in pharmaceutical products using 1, 2-naphthoquinone-4-sulfonic acid as the chromogenic reagent // Spectrochim. Acta A. 2003. V. 59. № 13. P. 3103.
Liu L.D., Liu Y., Wang H.Y., Sun Y., Ma L., Tang B. Use of p-dimethylaminobenzalhyde as a colored reagent for determination of procaine hydrochloride by spectrophotometry // Talanta. 2000. V. 52. № 6. P. 991.
Chen Y.H., Tian F.S., Song M.P. Spectrophotometric determination of procaine hydrochloride with hemoglobin as catalyst // J. Analyt. Chem. 2009. V. 64. № 4. P. 366.
Liu A.L., Wang J.D., Chen W., Xia X.H., Chen Y.Z., Lin X.H. Simultaneous and sensitive determination of procaine and its metabolite for pharmaceutical quality control and pharmacokinetic research by using a graphite paste electrode // J. Solid State Electrochem. 2012. V. 16. № 4. P. 1343.
Güngör Ö., Özcan İ., Ali Erdoğan M., Ateş B., Köytepe S. Differential pulse voltammetric (DPV) determination of the local anesthetic bupivacaine using polyimide membrane-based electrodes // Anal. Lett. 2019. P. 1.
Bergamini M.F., Santos A.L., Stradiotto N.R., Zanoni M.V.B. Flow injection amperometric determination of procaine in pharmaceutical formulation using a screen-printed carbon electrode // J. Pharm. Biomed. Anal. 2007. V. 43. № 1. P. 315.
Кулапина Е.Г., Баринова О.В. Ионоселективные электроды для определения азотсодержащих лекарственных средств // Журн. аналит. химии. 2001. Т. 56. № 5. С. 518. (Kulapina E.G., Barinova O.V. Ion-selective electrodes for the determination of nitrogen-containing medicinal substances // J. Analyt. Chem. 2001. V. 56. № 5. P. 457.)
Lei L., Su X., Xie Q., He J., Yao S. A novel ion-selective sensor for procaine hydrochloride based on a piezoelectric quartz crystal coated with a procaine tetraphenylborate PVC membrane // Microchim. Acta. 2000. V. 134. № 1–2. P. 63.
Giahi M., Pournaghdy M., Rakhshaee R. A new lidocaine-selective membrane electrode based on its sulfathiazole ion-pair // J. Analyt. Chem. 2009. V. 64. № 2. P. 195.
Li N., Duan J., Chen G. Determination of trace procaine hydrochloride by differential pulse adsorptive stripping voltammetry with a nafion modified glassy carbon electrode // Anal. Sci. 2003. V. 19. № 12. P. 1587.
Wu K., Wang H., Chen F., Hu S. Electrochemistry and voltammetry of procaine using a carbon nanotube film coated electrode // Bioelectrochemistry. 2006. V. 68. № 2. P. 144.
Zhang X., Zhao D., Feng L., Jia L., Wang S. Electrochemical sensor for procaine based on a glassy carbon electrode modified with poly-amidosulfonic acid and multi-walled carbon nanotubes // Microchim. Acta. 2010. V. 169. № 1–2. P. 153.
Rahbar N., Ramezani Z., Ghanavati J. CuO-nanoparticles modified carbon paste electrode for square wave voltammetric determination of lidocaine: Comparing classical and Box–Behnken optimization methodologies // Chin. Chem. Lett. 2016. V. 27. № 6. P. 837.
Oliveira R.T.S., Salazar-Banda G.R., Ferreira V.S., Oliveira S.C., Avaca, L.A. Electroanalytical determination of lidocaine in pharmaceutical preparations using Boron-Doped diamond electrodes // Electroanalysis. 2007. V. 19. № 11. P. 1189.
Michalska K., Pajchel G., Tyski S. Capillary electrophoresis method for simultaneous determination of penicillin G, procaine and dihydrostreptomycin in veterinary drugs // J. Chromatogr. B. 2004. V. 800. № 1–2. P. 203.
Başmakçi Akyil G., Şatana Kara H.E., Yarimkaya Baş S., Ertaş N., Günden Göğer N. Simultaneous determination of dexpanthenol, lidocaine hydrochloride and mepyramine maleate in combined pharmaceutical gel by capillary electrophoresis // Turk. J. Chem. 2014. № 38. P. 756.
Li N., Chi Y., Wang J., Duan J., Chen G. Determination of procaine hydrochloride using flow injection inhibitory chemiluminescence // J. Biolumin. Chemilumin. 2003. V. 18. № 3. P. 125.
Paseková H., Polášek M. Determination of procaine, benzocaine and tetracaine by sequential injection analysis with permanganate-induced chemiluminescence detection // Talanta. 2000. V. 52. № 1. P. 67.
Chen X.W., Song X., Wang J.H. A sequential injection fluorometric procedure for the determination of procaine in human blood and pharmaceuticals // Anal. Bioanal. Chem. 2006. V. 385. № 4. P. 737.
Amin A.S., El-Didamony A.M. Colorimetric determination of benzocaine, lignocaine and procaine hydrochlorides in pure form and in pharmaceutical formulations using p-benzoquinone // Anal. Sci. 2003. V. 19. № 10. P. 1457.
Паршина А.В., Денисова Т.С., Сафронова Е.Ю., Бобрешова О.В., Ярославцев А.Б. Влияние протоноакцепторной способности допантов на характеристики ПД-сенсоров на основе гибридных перфторированных мембран в смешанных водных растворах лидокаина и новокаина // Российские нанотехнологии. 2015. Т. 10. № 9–10. С. 62. (Parshina A.V., Denisova T.S., Bobreshova O.V., Safronova E.Y., Yaroslavtsev A.B. Effect of proton acceptor ability of dopants on the characteristics of PD-sensors based on hybrid perfluorinated membranes in a mixed aqueous solution of lidocaine and novocaine // Nanotechnol. Russia. 2015. V. 10. № 9–10. P. 748.)
Паршина А.В., Денисова Т.С., Сафронова Е.Ю., Караванова Ю.А., Сафронов Д.В., Бобрешова О.В., Ярославцев А.Б. Определение серосодержащих анионов в щелочных растворах с помощью массивов ПД-сенсоров на основе гибридных перфторированных мембран с допантами с протонодонорными свойствами // Журн. аналит. химии. 2017. Т. 72. № 12. С. 1104. (Parshina A.V., Denisova T.S., Safronova E.Yu., Karavanova Yu.A., Safronov D.V., Bobreshova O.V., Yaroslavtsev A.B. Determination of sulfur-containing anions in alkaline solutions using arrays of DP-sensors based on hybrid perfluorinated membranes with proton-donor dopants // J. Analyt. Chem. 2017. V. 72. № 12. P. 1243.)
Safronova E., Parshina A., Kolganova T., Bobreshova O., Pourcelly G., Yaroslavtsev A. Potentiometric sensors arrays based on perfluorinated membranes and silica nanoparticles with surface modified by proton-acceptor groups, for the determination of aspartic and glutamic amino acids anions and potassium cations // J. Electroanal. Chem. 2018. V. 816. P. 21.
Shi H., Liu C., Jiang Q., Xu J. Effective approaches to improve the electrical conductivity of PEDOT: PSS: A review // Adv. Electron. Mater. 2015. V. 1. № 4. P. 1500017.
Sun K., Zhang S., Li P., Xia Y., Zhang X., Du D., Isikgor F.H., Ouyang J. Review on application of PEDOTs and PEDOT: PSS in energy conversion and storage devices // J. Mater. Sci. - Mater. Electron. 2015. V. 26. № 7. P. 4438.
Hui Y., Bian C., Xia S., Tong J., Wang J. Synthesis and electrochemical sensing application of poly (3, 4-ethylenedioxythiophene)-based materials: A review // Anal. Chim. Acta. 2018. V. 1022. P. 1.
Groenendaal L., Jonas F., Freitag D., Pielartzik H., Reynolds J.R. Poly (3, 4-ethylenedioxythiophene) and its derivatives: past, present, and future // Adv. Mater. 2000. V. 12. № 7. P. 481.
Jiang F., Yue R., Du Y., Xu J., Yang P. A one-pot ‘green’synthesis of Pd-decorated PEDOT nanospheres for nonenzymatic hydrogen peroxide sensing // Bio-sens. Bioelectron. 2013. V. 44. P. 127.
Abirama Sundari P.L., Manisankar P. Development of ultrasensitive surfactants doped poly (3,4-ethylenedioxythiophene)/multiwalled carbon nanotube sensor for the detection of pyrethroids and an organochlorine pesticide // J. Appl. Electrochem. 2011. V. 41. № 1. P. 29.
Üğe A., Zeybek D.K., Zeybek B. An electrochemical sensor for sensitive detection of dopamine based on MWCNTs/CeO2-PEDOT composite // J. Electroanal. Chem. 2018. V. 813. P. 134.
Lin J.M., Su Y.L., Chang W.T., Su W.Y., Cheng S.H. Strong adsorption characteristics of a novel overoxidized poly (3, 4-ethylenedioxythiophene) film and application for dopamine sensing // Electrochim. Acta. 2014. V. 149. P. 65.
Xu G., Jarjes Z.A., Desprez V., Kilmartin P.A., Travas-Sejdic J. Sensitive, selective, disposable electrochemical dopamine sensor based on PEDOT-modified laser scribed grapheme // Biosens. Bioelectron. 2018. V. 107. P. 184.
Zhang K., Xu J., Zhu X., Lu L., Duan X., Hu D., Dong L., Sun H., Gao Y., Wu Y. Poly (3,4-ethylenedioxythiophene) nanorods grown on graphene oxide sheets as electrochemical sensing platform for rutin // J. Electroanal. Chem. 2015. V. 739. P. 66.
Стенина И.А., Ильина А.А., Пинус И.Ю., Сергеев В.Г., Ярославцев А.Б. Катионная подвижность в системах на основе высокомолекулярных сульфокислот и полианилина // Изв. Акад. наук. Сер. хим. 2008. № 11. С. 2219. (Stenina I.A., Il’ina A.A., Pinus I.Yu., Sergeev V.G., Yaroslavtsev A.B. Cation mobility in systems based on high-molecular-weight sulfonic acids and polyaniline // Russ. Chem. Bull. 2008. V. 57. № 11. P. 2261.)
Yaroslavtsev A.B., Stenina I.A., Voropaeva E.Yu., Ilyina A.A. Ion transfer in composite membranes based on MF-4SC incorporating nanoparticles of silica, zirconia, and polyaniline // Polymer Adv. Technol. 2009. V. 20. P. 566.
Wang P., Olbricht W.L. PEDOT/Nafion composite thin films supported on Pt electrodes: Facile fabrication and electrochemical activities // Chem. Eng. J. 2010. V. 160. № 1. P. 383.
De Leeuw D.M., Kraakman P.A., Bongaerts P.F.G., Mutsaers C.M.J., Klaassen D.B.M. Electroplating of conductive polymers for the metallization of insulators // Synth. Met. 1994. V. 66. № 3. P. 263.
Vreeland R.F., Atcherley C.W., Russell W.S., Xie J.Y., Lu D., Laude N.D., Porreca F., Heien M.L. Biocompatible PEDOT: Nafion composite electrode coatings for selective detection of neurotransmitters in vivo // Anal.Chem. 2015. V. 87. P. 2600.
Ganesana M., Trikantzopoulos E., Venton B.J. PEDOT: Nafion coated microelectrode biosensor for in vivo monitoring of glutamate release in brain // Procedia Technology. 2017. V. 27. P. 229.
Воропаева Е.Ю., Сангинов Е.А., Волков В.И., Павлов А.А., Шалимов А.С., Стенина И.А., Ярославцев А.Б. Ионный транспорт в композиционных мембранах МФ-4СК, модифицированных неорганическими допантами // Журн. неорг. химии. 2008. Т. 53. № 10. С. 1643. (Voropaeva E.Yu., Shalimov A.S., Stenina I.A., Yaroslavtsev A.B., Sanginov E.A., Volkov V.I., Pavlov A.A. Transport properties of MF-4SK membranes modified with inorganic dopants // Russ. J. Inorg. Chem. 2008. V. 53. № 10. P. 1536.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии