Журнал аналитической химии, 2020, T. 75, № 8, стр. 736-742
Использование двойного планарного электрода с наночастицами палладия для проточно-инжекционного амперометрического определения дофамина и адреналина
Л. Г. Шайдарова a, *, И. А. Челнокова a, Ю. А. Лексина a, А. В. Гедмина a, Г. К. Будников a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: larisashaidarova@mail.ru
Поступила в редакцию 13.11.2019
После доработки 10.01.2020
Принята к публикации 26.02.2020
Аннотация
Предложен способ селективного и высокочувствительного амперометрического определения дофамина и адреналина в присутствии аскорбиновой и мочевой кислот в проточно-инжекционной системе. В качестве детектора использовали планарные электроды, модифицированные наночастицами палладия, проявляющие каталитическую активность при электроокислении катехоламинов. Разность потенциалов пиков окисления этих соединений составляет 200 мВ. Линейная билогарифмическая зависимость аналитического сигнала от концентрации дофамина и адреналина наблюдается в интервалах от 5 × 10–12 до 5 × 10–8 М и от 1 × 10–9 до 1 × 10–5 М соответственно. Для одновременного двухкомпонентного анализа использовали планарные электроды с двумя рабочими электродами – двойные планарные электроды, модифицированные наночастицами палладия, позволяющие определять одновременно два вещества при двух различных потенциалах. Предложенный способ совместного проточно-инжекционного амперометрического определения дофамина и адреналина на модифицированном двойном планарном электроде апробирован при анализе урины.
Адреналин (АД) и дофамин (ДA) являются нейротрансмиттерами [1], оценка содержания которых в плазме крови необходима при диагностике неврологических, психиатрических и сердечно-сосудистых заболеваний [2]. Например, АД играет главную роль во время физического или умственного стресса, а также стимулирует серию действий симпатической нервной системы. Аномальные уровни концентрации ДА могут приводить к ряду заболеваний, таких как болезнь Паркинсона и шизофрения. Лекарственные препараты, содержащие АД и ДА, используют при лечении гипертонии, бронхиальной астмы, инфаркта миокарда и в кардиохирургии [3], поэтому разработка способов, позволяющих одновременно определять АД и ДA, привлекает внимание электроаналитиков.
Одним из методов количественного определения ДА и АД является вольтамперометрия [4]. Однако эти катехоламины окисляются практически при одних и тех же потенциалах, поэтому их определение при совместном присутствии затрудняется из-за перекрывания пиков [5]. Другое осложнение при определении ДА и АД обусловлено их низким содержанием в биообразцах (~10–11 и ~10–7 М) на фоне большого избытка аскорбиновой (АК) и мочевой (МК) кислот (~10–6 и ~10–3 М), которые также играют важную роль в организме [6].
Для повышения селективности и чувствительности вольтамперометрического определения АД, ДА, АК, МК используют различные химически модифицированные электроды (ХМЭ) [7–12]. В некоторых публикациях основное внимание уделяли одновременному определению ДA и АД [13–15], в то время как в других описаны положительные результаты совместного определения АК, МК, АД и/или ДА [16–21]. Для автоматизации и улучшения аналитических характеристик метода часто применяют схему проточно-инжекционного анализа (ПИА) [22, 23].
В настоящей работе изучена каталитическая активность наночастиц палладия, электроосажденных на планарных электродах с одним (Pd-ПЭ) или двумя рабочими электродами (Pd-ДПЭ), при электроокислении АД и ДА в присутствии АК и МК и оценена возможность использования каталитических свойств ХМЭ на основе электродов Pd-ПЭ и Pd-ДПЭ для амперометрического определения рассматриваемых органических соединений в проточно-инжекционной системе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклические вольтамперограммы (ЦВА) регистрировали с помощью бипотенциостата DropSens μSTAT400 (Испания) с электрохимической ячейкой емк. 10 мл, включающей планарный электрод (ПЭ) фирмы “DropSens” (Испания), на поверхности которого рабочий электрод с площадью поверхности 0.10 см2 и вспомогательный электрод изготовлены из углеродной пасты, электрод сравнения – из серебряной пасты. Вольтамперограммы регистрировали при скорости наложения потенциала (v) 20 мВ/с.
Поверхность рабочих электродов модифицировали электроосажденными частицами палладия. Рабочие условия электроосаждения наночастиц палладия на поверхности рабочего электрода приведены в работе [24].
Проточно-инжекционный анализ проводили по схеме [25], включающей перистальтический насос PERIMAX 12 (Германия), инжектор, проточную электрохимическую ячейку и регистрирующее устройство – бипотенциостат DropSens μSTAT400, совмещенный с персональным компьютером.
Аналиты детектировали в проточной электрохимической ячейке с ПЭ, содержащим один рабочий электрод, или с двойным планарным электродом (ДПЭ), содержащим два рабочих электрода с площадью поверхности 0.06 см2. Объем ячейки составлял 8 мкл.
Диапазон номинальных значений расхода жидкости при использовании проточной электрохимической ячейки с ПЭ и ДПЭ составлял 0.65–4.74 мл/мин. Подачу носителей, транспортирование смеси жидкости осуществляли по трубкам из поливинилхлорида постоянного внутреннего диаметра 1.4 мм.
Растворы ДА, АД, АК и МК готовили по точным навескам реактивов х. ч. (Sigma-Aldrich, Гер-мания). Растворы меньших концентраций получали разбавлением исходного раствора непосредственно перед измерениями. В качестве фонового электролита в стационарном режиме и потока-носителя в проточной системе использовали 0.1 М H2SO4.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
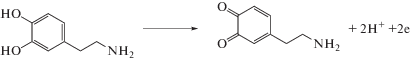
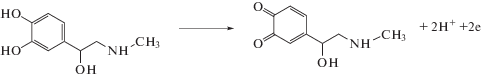
Электроокисление дофамина и адреналина на немодифицированном планарном углеродном электроде. Электроокисление ДА и АД на немодифицированном ПЭ в кислой среде протекает с перенапряжением, т.е. при высоких потенциалах. Например, ДА на фоне 0.1 М H2SO4 окисляется при потенциале пика (Еп) 0.70 В, а АД – при Еп 0.80 В. Электродная реакция, протекающая на углеродном электроде в растворе ДА, представляет собой 2-электронный процесс, который сопровождается переносом 2 протонов с образованием о-хиноидного фрагмента в структуре продукта окисления этого биогенного амина. Электрохимический процесс соответствует уравнениям, приведенным на схемах 1, 2 [26]:
Схема 1 . Окисление дофамина.
Схема 2 . Окисление адреналина.
Зависимость анодного тока от концентрации рассматриваемых аналитов линейна в интервале от 1 × 10–5 до 1 × 10–3 М. Для повышения чувствительности и селективности определения использовали электроды, модифицированные частицами палладия.
Электрокаталитическое окисление дофамина и адреналина на планарных электродах, модифицированных частицами палладия. При электроосаждении частиц палладия на поверхность ПЭ на анодной ветви ЦВА на фоне 0.1 М H2SO4 регистрируется пик с максимумом при Е > 0.40 В (рис. 1а), связанный со специфической адсорбцией гидрокисид-ионов и их разрядом с образованием поверхностного оксида палладия [27].
Рис. 1.
Циклические вольтамперограммы, полученные на Pd-ПЭ в отсутствие (1) и в присутствии (2) адреналина (с = 5 × 10–3 М) на фоне 0.1 М H2SO4, скорость изменения потенциала 20 мВ/с (а); графики зависимости тока пика при Еп 0.70 В от концентрации (б) и величины I/$\sqrt v $ от $\sqrt v $ (в).
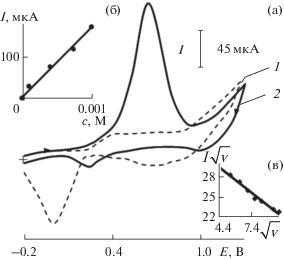
При окислении ДА и АД на рассматриваемых ХМЭ на анодной ветви ЦВА наблюдается один пик. ДА окисляется при Еп 0.50 В, АД − при Еп 0.70 В. В качестве примера на рис. 1а представлена ЦВА окисления АД на электроде Pd-ПЭ. Достигнутая высота пика в несколько раз превышает высоту пика окисления модификатора и растет с увеличением концентрации аналита (рис. 1б). Отрицательный наклон зависимости тока пика окисления АД от скорости изменения потенциала в координатах I/$\sqrt v $−$\sqrt v $ (рис. 1в) свидетельствует об электродном процессе, осложненном химической реакцией [28]. Такие же зависимости получены и при окислении ДА на этом ХМЭ. Вероятно, электроокисление ДА и АД на этом ХМЭ является каталитическим процессом, который проявляется в уменьшении перенапряжения и увеличении тока окисления субстрата.
Разность потенциалов пиков окисления ДА и АД на ПЭ, немодифицированном (ЕS) и модифицированном наночастицами Pd (Екат), составляет 100 и 200 мВ, величина тока окисления органического соединения многократно превышает ток окисления модификатора на этом ХМЭ.
С целью использования предложенного ХМЭ для анализа биологических жидкостей оценена каталитическая активность иммобилизованных частиц палладия по отношению к АК и МК. Установлено, что МК не окисляется на данном ХМЭ в рассматриваемых условиях. Формы ЦВА, полученных на Pd-ПЭ в присутствии и в отсутствие МК идентичны. При окислении АК на Pd-ПЭ на анодной ветви циклической вольтамперограммы регистрируется один пик при Eп 0.30 В, т.е. АК окисляется при менее положительных потенциалах, чем ДА и АД. Очевидно, что присутствие в исследуемом растворе АК и МК не мешает определению ДА и АД.
Вольтамперометрическое определение дофамина и адреналина в присутствии аскорбиновой и мочевой кислот на планарных электродах, модифицированных наночастицами палладия. Установлена возможность селективного определения АК, ДА и АД при совместном присутствии с помощью Pd-ПЭ в кислой среде по одной вольтамперограмме (рис. 2). Разность потенциалов пиков окисления этих соединений составляет 200 мВ. Содержание АК, ДА и АД определяли по току пиков при Еп 0.30, 0.50 и 0.70 В соответственно. Концентрацию определяемых органических соединений находили по градуировочным графикам. Интервалы линейных зависимостей каталитического тока от концентрации аналитов и уравнения регрессии для этих зависимостей приведены в табл. 1. Как видно, билогарифмические зависимости регистрируемого на ХМЭ тока от концентрации аналитов линейны в широких диапазонах. Использование ХМЭ с электрокаталическими свойствами приводит к снижению предела обнаружения (сmin) на два порядка: сmin = 4.3 × 10–8 и 9.7 × 10–8 М для ДА и АД на ХМЭ (табл. 1), а на немодифицированном электроде сmin = 9.7 × 10–6 и 9.8 × 10–6 М.
Рис. 2.
Циклические вольтамперограммы, полученные на Pd-ПЭ в отсутствие (1) и в присутствии (2) аскорбиновой кислоты, дофамина, адреналина и мочевой кислоты на фоне 0.1 М H2SO4, скорость изменения потенциала 20 мВ/с.
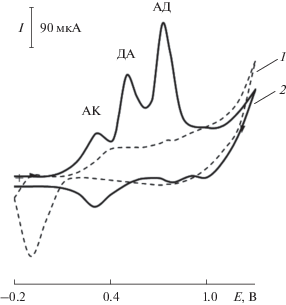
Таблица 1.
Аналитические характеристики определения дофамина и адреналина на модифицированных планарных электродах на фоне 0.1 М Н2SO4 методом циклической вольтамперометрии
| Аналит | Диапазон концентраций, М |
Уравнение регрессии lg I (мкА) = a + b lg с (М) |
R | cmin, М | |
|---|---|---|---|---|---|
| a ± Δa | b ± Δb | ||||
| Дофамин | 5.0 × 10–8−5.0 × 10–4 | 1.9 ± 0.1 | 0.17 ± 0.01 | 0.9985 | 4.3 × 10–8 |
| Адреналин | 1.0 × 10–7−5.0 × 10–3 | 1.7 ± 0.2 | 0.23 ± 0.01 | 0.9980 | 9.7 × 10–8 |
Для электрода Pd-ПЭ характерна высокая воспроизводимость аналитического сигнала. Рассчитанные значения sr для тока окисления АК, ДА и АД не превышают 5.0% (n = 20, c = 5 × 10–3 М).
Амперометрическое определение дофамина и адреналина в присутствии аскорбиновой и мочевой кислот на планарном электроде, модифицированном наночастицами палладия, в проточно-инжекционной системе. Измерения в системе ПИА проводили в потенциостатическом режиме на электроде Pd-ПЭ. На электрод подавали фиксированный потенциал и на хроноамперограмме регистрировали один аналитический сигнал в форме пика, отражающий содержание одного из веществ. Изучено влияние на чувствительность аналитического сигнала величины налагаемого потенциала (Е) и скорости потока носителя (u). На основании полученных результатов (рис. 3) выбраны условия определения рассматриваемых органических соединений при совместном присутствии в проточно-инжекционной системе: Е = 0.00, 0.20 и 0.40 В для АК, ДА и АД соответственно при u = 3.88 мл/мин. В выбранных условиях регистрировали зависимость аналитического сигнала от концентрации определяемых соединений. Полученные уравнения регрессии представлены в табл. 2. В условиях ПИА получены более низкие значения сmin, чем в стационарном режиме, за счет обновления поверхности электрода потоком носителя и уменьшения уровня так называемых “химических шумов”, вызванных потенциальной адсорбцией продуктов электролиза: до 4.5 × 10–12 М для ДА и 9.6 × 10–10 М для АД.
Рис. 3.
Зависимость тока окисления аскорбиновой кислоты, дофамина и адреналина (с = 5 × 10–3 М) при совместном присутствии на Pd-ПЭ от прилагаемого потенциала (а) и зависимости тока окисления аскорбиновой кислоты (1), дофамина (2) и адреналина (3) (с = 5 × 10–3 М) на Pd-ПЭ от скорости потока в проточно-инжекционной системе на фоне 0.1 М H2SO4 (б).
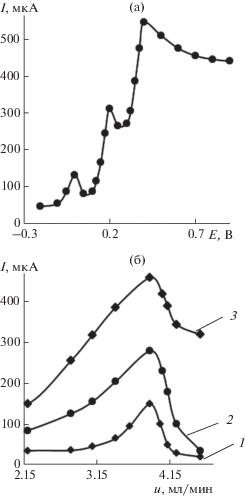
Таблица 2.
Аналитические характеристики проточно-инжекционного амперометрического определения дофамина и адреналина на модифицированных планарных электродах на фоне 0.1 М Н2SO4
| Аналит | Диапазон концентраций, М |
Уравнение регрессии lg I (мкА) = a + b lg с (М) |
R | cmin, М | |
|---|---|---|---|---|---|
| a ± Δa | b ± Δb | ||||
| Дофамин | 5.0 × 10–12−5.0 × 10–8 | 0.66 ± 0.01 | 0.14 ± 0.01 | 0.9980 | 4.5 × 10–12 |
| Адреналин | 1.0 × 10–9−1.0 × 10–5 | 3.60 ± 0.02 | 0.65 ± 0.01 | 0.9998 | 9.6 × 10–10 |
Правильность определения рассматриваемых соединений оценивали методом введено−найдено. Полученные значения показателя правильности (ПП) лежат в диапазоне 96–105% (табл. 3). Относительное стандартное отклонение (sr) не превышает 2.0% во всем диапазоне концентраций.
Таблица 3.
Метрологические характеристики проточно-инжекционного амперометрического определения дофамина и адреналина на Pd-ПЭ на фоне 0.1 М Н2SO4 (n = 6, P = 0.95, tтабл = 2.57)
| Аналит | Матричный компонент | Концентрация, нМ | Введено, нМ | Найдено, нМ | ПП, % | sr, % |
|---|---|---|---|---|---|---|
| Дофамин | – | – | 50 | 49 ± 1 | – | 2 |
| Адреналин | 25 | 50 | 51 ± 1 | 102 | 2 | |
| 50 | 50 | 48 ± 1 | 96 | 1 | ||
| 100 | 50 | 52 ± 1 | 104 | 2 | ||
| Адреналин | – | – | 80 | 81 ± 1 | 101 | 1 |
| Дофамин | 30 | 80 | 83 ± 2 | 104 | 2 | |
| 50 | 80 | 84 ± 2 | 105 | 2 | ||
| 70 | 80 | 83 ± 1 | 104 | 1 |
Использование электрокаталитического отклика ХМЭ в проточно-инжекционной системе приводит к повышению чувствительности, воспроизводимости и селективности определения, уменьшению объема пробы. В предлагаемой одноканальной проточно-инжекционной системе с амперометрическим детектором достигается производительность до 180 проб/ч (при времени отклика ХМЭ 20 с).
Проточно-инжекционное амперометрическое определение дофамина и адреналина на двойном планарном электроде, модифицированном частицами палладия, в урине. Предложен способ одновременного определения ДА и АД методом проточно-инжекционной амперометрии на модифицированном наночастицами палладия ДПЭ. Измерения осуществляли также в потенциостатических условиях. На каждый из двух рабочих электродов подавали фиксированные потенциалы и на хроноамперограмме регистрировали два аналитических сигнала. Определение ДА и АД проводили при Е 0.20 и 0.40 В соответственно.
Возможность одновременной регистрации двух сигналов на ДПЭ упрощает процедуру анализа, уменьшает объем проб и реактивов и сокращает продолжительность анализа. Производительность анализа увеличивается до 360 определений/ч (при времени отклика ХМЭ 20 с).
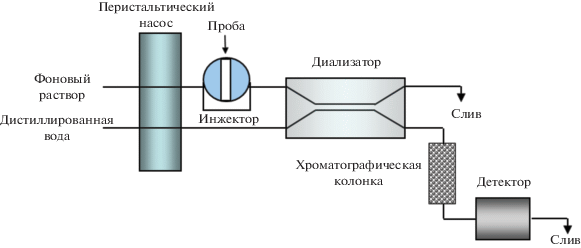
Обычно в качестве объекта анализа для скрининга ДА и АД выбирают урину, так как в ней содержание катехоламинов на 2–3 порядка выше, чем в крови [29]. Для анализа урины в схему проточно-инжекционной системы включили дополнительные блоки разделения: диализную колонку с мембраной из полипропилена и полиэфирсульфона, устраняющую мешающее влияние белков и мочевины, и хроматографическую мини-колонку, заполненную силикагелем с привитой фазой С18 (рис. 4), для on-line разделения определяемых веществ и других присутствующих электрохимически активных соединений.
Урину собирали в течение 24 ч в контейнер с добавлением консерванта (10 мл 6 М HCl) и хранили в холодильнике. Пробу урины вводили в петлю инжектора, затем согласно схеме (рис. 4) она проходила через диализатор, откуда поступала в хроматографическую колонку. Далее проводили амперометрическое детектирование ДА и АД на Pd-ДПЭ. Результаты определения содержания ДА и АД в пробах урины приведены в табл. 4.
Таблица 4.
Результаты проточно-инжекционного амперометрического определения дофамина и адреналина в урине на Pd-ПЭ на фоне 0.1 М Н2SO4 (n = 6, P = 0.95, tтабл = 2.57)
| Образец урины | Аналит | Содержание в урине, мкМ [29] | Найдено, мкМ |
sr, % |
|---|---|---|---|---|
| 1 | Дофамин | 0.34−2.6 | 1.20 ± 0.05 | 4 |
| Адреналин | 0.08−0.21 | 0.180 ± 0.009 | 5 | |
| 2 | Дофамин | 0.34−2.6 | 1.30 ± 0.04 | 3 |
| Адреналин | 0.08−0.21 | 0.150 ± 0.008 | 5 | |
| 3 | Дофамин | 0.34−2.6 | 0.90 ± 0.04 | 4 |
| Адреналин | 0.08−0.21 | 0.170 ± 0.007 | 4 |
* * *
Таким образом, при использовании ХМЭ с электрокаталитическими свойствами на основе ПЭ с электроосажденными частицами палладия повышается чувствительность и понижается предел обнаружения ДА и АД, а также повышается селективность их определения за счет уменьшения перенапряжения окисления аналитов в различной степени. Использование такого ХМЭ для амперометрического определения ДА и АД в проточно-инжекционной системе обеспечивает производительность до 180 проб/ч. Использование модифицированного ДПЭ с двумя рабочими электродами позволяет проводить высокочувствительный, селективный и экспрессный двухкомпонентный анализ с высокой производительностью (до 360 определений/ч), а введение в схему дополнительных блоков позволяет анализировать сложные по составу биологические объекты. Предложенный способ отличают высокая чувствительность, производительность, экспрессность, простота выполнения определений при низкой стоимости расходных материалов и автоматизация некоторых стадий анализа. Способ можно использовать в клинической лабораторной практике для совместного определения ДА и АД в урине.
Работа выполнена за счет средств субсидии, выделенной в рамках государственной поддержки Казанского (Приволжского) федерального университета в целях повышения его конкурентоспособности среди ведущих мировых научно-образовательных центров.
Список литературы
Michael D.J., Wightman R.M. Electrochemical monitoring of biogenic amine neurotransmission in real time // J. Pharm Biomed Anal. 1999. V. 19. № 1–2. P. 33.
Webster R., Jordan C. Neurotransmitters, Drugs and Disease. Oxford: Blackwell Scientific Publications, 1989. 474 p.
Sorouraddin M.H., Manzoori J.L., Kargarzadeh E., Haji Shabani A.M. Spectrophotometric determination of some catecholamine drugs using sodium bismuthate // J. Pharm. Biomed. Anal. 1998. V. 18. № 4–5. P. 877.
Шайдарова Л.Г., Будников Г.К. Химически модифицированные электроды на основе благородных металлов, полимерных пленок или их композитов в органической вольтамперометрии. Обзор // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1014.
Шайдарова Л.Г., Челнокова И.А., Ильина (Дегтева) М.А., Гедмина А.В., Будников Г.К. Амперометрическое детектирование биогенных аминов на электроде, модифицированном наночастицами золота, в условиях проточно-инжекционного анализа и высокоэффективной жидкостной хроматографии // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2015. Т. 157. № 3. С. 132.
Savk A., Ozdil B., Demirkan B., Nas M.S., Calimli M.H., Alma M.H., Inamuddin Asiri A. M., Sen F. Multiwalled carbon nanotube-based nanosensor for ultrasensitive detection of uric acid, dopamine, and ascorbic acid // Mater. Sci. Eng. C. 2019. V. 99. P. 248.
Alonso-Lomillo M.A., Domínguez-Renedo O., Saldaña-Botín A., Arcos-Martínez M.J. Determination of ascorbic acid in serum samples by screen-printed carbon electrodes modified with gold nanoparticles // Talanta. 2017. V. 174. P. 733.
Mohamadi M., Mostafavi A., Torkzadeh-Mahani M. Voltammetric behavior of uric acid on carbon paste electrode modified with salmon sperm dsDNA and its application as label-free electrochemical sensor // Biosens. Bioelectron. 2014. V. 54. P. 211.
Zheng Y.-Y., Li C.-X., Ding X.-T., Yang Q., Qu L.-T. Detection of dopamine at graphene-ZIF-8 nanocomposite modified electrode // Chin. Chem. Lett. 2017. V. 28. № 7. P. 1473.
Kim D., Lee S., Piao Y. Electrochemical determination of dopamine and acetaminophen using activated graphene-Nafion modified glassy carbon electrode // J. Electroanal. Chem. 2017. V. 794. P. 221.
Sochr J., Švorc L., Rievaj M., Bustin D. Electrochemical determination of adrenaline in human urine using a boron-doped diamond film electrode // Diam. Relat. Mater. 2014. V. 43. P. 5.
Reddy K.K., Satyanarayana M., Goud K.Y., Gobi K.V., Kim H. Carbon nanotube ensembled hybrid nanocomposite electrode for direct electrochemical detection of epinephrine in pharmaceutical tablets and urine // Mater. Sci. Eng. C. 2017. V. 79. P. 93.
Zhou Y.Z., Zhang L.J., Chen S.L., Dong S.Y., Zheng X.H. Electroanalysis and simultaneous determination of dopamine and epinephrine at poly(isonicotinic acid)-modified carbon paste electrode in the presence of ascorbic acid // Chin. Chem. Lett. 2009. V. 20. № 2. P. 217.
Canevari T.C., Nakamura M., Cincotto F.H., Melo F.M., Toma H.E. High performance electrochemical sensors for dopamine and epinephrine using nanocrystalline carbon quantum dots obtained under controlled chronoamperometric conditions // Electrochim. Acta. 2016. V. 209. P. 464.
Wang Y., Chen Z.-Z. A novel poly(taurine) modified glassy carbon electrode for the simultaneous determination of epinephrine and dopamine // Colloids Surf. B. 2009. V. 74. № 1. P. 322.
Ghanbari Kh., Hajian A. Electrochemical characterization of Au/ZnO/PPy/RGO nanocomposite and its application for simultaneous determination of ascorbic acid, epinephrine, and uric acid // J. Electroanal. Chem. 2017. V. 801. P. 466.
Taei M., Hasanpour F., Tavakkoli N., Bahrameian M. Electrochemical characterization of poly(fuchsine acid) modified glassy carbon electrode and its application for simultaneous determination of ascorbic acid, epinephrine and uric acid // J. Mol. Liq. 2015. V. 211. P. 353.
Lavanyaa N., Fazio E., Neri F., Bonavitac A., Leonardi S.G., Neri G., Sekar C. Simultaneous electrochemical determination of epinephrine and uric acid in the presence of ascorbic acid using SnO2/graphene nanocomposite modified glassy carbon electrode // Sens. Actuators B. 2015. V. 221. P. 1412.
Dinesh B., Saraswathi R., Kumar A.S. Water based homogenous carbon ink modified electrode as an efficient sensor system for simultaneous detection of ascorbic acid, dopamine and uric acid // Electrochim. Acta. 2017. V. 233. P. 92.
Rahman Md.M., Lopa N.S., Ju M.J., Lee J.-J. Highly sensitive and simultaneous detection of dopamine and uric acid at graphene nanoplatelet-modified fluorine-doped tin oxide electrode in the presence of ascorbic acid // J. Electroanal. Chem. 2017. V. 792. P. 54.
Zhang Y., Ren W., Zhang S. Simultaneous determination of epinephrine, dopamine, ascorbic acid and uric acid by polydopamine-nanogold composites modified electrode // Int. J. Electrochem. Sci. 2013. V. 8. № 5. P. 6839.
Шайдарова Л.Г., Будников Г.К. Амперометрическое детектирование лекарственных веществ в проточно-инжекционном анализе / Фармацевтический анализ. Серия “Проблемы аналитической химии”. М.: АНРАМАК-МЕДИА, 2013. С. 580.
Булатов А.В. Москвин А.Л., Москвин Л.Н., Вах К.С., Фалькова М.Т., Шишов А.Ю. Автоматизация и миниатюризация химического анализа на принципах проточных методов (обзор) // Научное приборостроение. 2015. Т. 25. № 2. С. 3.
Шайдарова Л.Г., Челнокова И.А., Гедмина А.В., Будников Г.К., Зиганшина С.А., Можанова А.А., Бухараев А.А. Электроокисление щавелевой кислоты на угольно-пастовом электроде с осажденными наночастицами палладия // Журн. аналит. xимии. 2006. Т. 61. № 4. С. 409.
Шайдарова Л.Г., Челнокова И.А., Лексина Ю.А., Ильина М.А., Гедмина А.В., Будников Г.К. Проточно-инжекционное амперометрическое определение дофы и тирозина на двойном электроде, модифицированном бинарной системой золото-кобальт // Журн. аналит. химии. 2018. Т. 73. № 2. С. 129.
Venton B.J., Wightman R.M. Psychoanalytical electrochemistry: dopamine and behavior // Anal. Chem. 2003. V. 75. № 19. P. 414A.
Casella I.G. Electrocatalytic oxidation of oxalic acid on palladium-based modified glassy carbon electrode in acidic medium // Electrochim. Acta. 1999. V. 44. № 19. P. 3353.
Гороховская В.И., Гороховский В.М. Практикум по электрохимическим методам анализа. М.: Высшая школа, 1983. 191 с.
Веселова И.А., Сергеева Е.А., Македонская М.И., Еремина О.Е., Калмыков С.Н., Шеховцова Т.Н. Методы определения маркеров нейромедиаторного обмена в целях клинической диагностики // Журн. аналит. xимии. 2016. Т. 71. № 12. С. 1235.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии