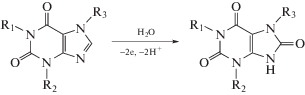Журнал аналитической химии, 2020, T. 75, № 8, стр. 743-749
Порционно-инжекционное амперометрическое определение кофеина и теофиллина на электроде, модифицированном углеродными нанотрубками и оксидами рутения
Л. Г. Шайдарова a, И. А. Челнокова a, М. А. Ильина a, *, Г. Ф. Махмутова a, Ф. Ф. Ахматханова a, Г. К. Будников a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: marina_ilina16@mail.ru
Поступила в редакцию 18.10.2019
После доработки 10.01.2020
Принята к публикации 17.02.2020
Аннотация
Разработан способ порционно-инжекционного амперометрического определения кофеина и теофиллина на планарном электроде, модифицированном композитом на основе оксидов рутения и функционализированных одностенных углеродных нанотрубок. Изучено влияние параметров порционно-инжекционной системы на величину регистрируемых сигналов, выбраны оптимальные условия детектирования. Зависимость аналитического сигнала от концентрации рассматриваемых соединений в логарифмических координатах линейна в интервале от 5 × 10–9 до 5 × 10–3 М. Показана возможность одновременного порционно-инжекционного амперометрического определения кофеина и теофиллина на модифицированном двойном планарном электроде. Предложенный способ определения кофеина и теофиллина апробирован при анализе лекарственных средств.
Среди гетероциклических азотсодержащих веществ, проявляющих значительную биологическую активность, широко известны пуриновые алкалоиды, представляющие собой небольшую группу метилзамещенных ксантина. К пуриновым алкалоидам относят кофеин (КФ), теофиллин (ТФ) и теобромин. Природные соединения этого класса встречаются главным образом в продуктах растительного происхождения и входят в состав лекарственных средств. Диапазоны терапевтической и токсической концентраций пуриновых алкалоидов близки, поэтому необходим тщательный контроль содержания этих веществ в различных объектах, в том числе и в лекарственных препаратах [1, 2]. Наличие на фармацевтическом рынке фальсифицированной продукции также увеличивает потребность в быстрых и надежных средствах идентификации и оценки содержания действующих веществ в лекарственных средствах.
Известные методы количественного определения КФ и ТФ – спектрометрические [3–6], хроматографические [7–10] и капиллярный электрофорез [11–14] – имеют некоторые ограничения, обусловленные длительностью пробоподготовки и анализа, сложностью выполнения, высокой стоимостью. Другой вариант – применение для определения биологически активных веществ вольтамперометрии с химически модифицированными электродами (ХМЭ), характеризующейся высокой чувствительностью, воспроизводимостью, простотой, экспрессностью и невысокой стоимостью оборудования.
Ранее установлено, что смешановалентные оксиды рутения обладают каталитической активностью по отношению к ксантину и его метилированному производному – КФ [15, 16]. Представляло интерес изучить электрохимическое поведение на этом модифицированном электроде другого производного ксантина – ТФ. Для повышения каталитической активности металлов часто применяют их иммобилизацию на поверхность углеродных нанотрубок [17]. Известно, что высокая чувствительность ХМЭ на основе углеродных нанотрубок объясняется большой эффективной площадью их поверхности и способностью ускорять электрохимические реакции с низкой скоростью переноса электронов [18, 19].
Измерения в проточном режиме позволяют автоматизировать процесс и повысить производительность, что нашло применение в анализе объектов окружающей среды и биомедицины [20–22]. Одним из вариантов анализа в потоке является система порционно-инжекционного анализа (ПрИА).
В настоящей работе сопоставлена электрокаталитическая активность оксидов рутения (RuOx), электроосажденных на планарном электроде (ПЭ), немодифицированном и модифицированном функционализированными карбоксильными и карбонильными группами одностенными углеродными нанотрубками (ФОНТ), при окислении КФ и ТФ. Каталитический отклик разработанного ХМЭ использован для амперометрического детектирования этих соединений в условиях ПрИА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
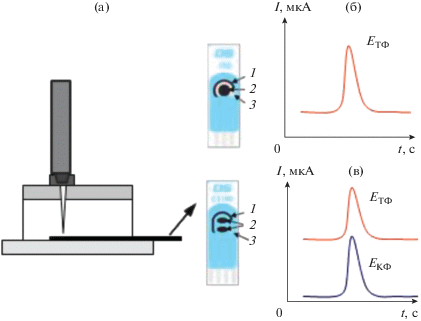
Циклические вольтамперограммы регистрировали с помощью бипотенциостата DropSens μSTAT400 (Испания) на ПЭ фирмы “DropSens” (Испания), содержащем один или два рабочих электрода (рис. 1). Рабочие и вспомогательный электроды были изготовлены из углеродной пасты, электрод сравнения – из серебряной пасты. Циклические вольтамперограммы регистрировали при скорости развертки потенциала 20 мВ/с.
Рис. 1.
Схема ячейки типа отражающей стенки для порционно-инжекционного амперометрического анализа с планарным электродом: 1 – электрод сравнения, 2 – рабочий электрод, 3 – вспомогательный электрод (а); регистрируемые сигналы на планарном электроде с одним рабочим (б) и двумя рабочими электродами (в).
Поверхность ПЭ модифицировали оксидами рутения методом потенциодинамического электролиза из раствора RuCl3 х. ч. фирмы “Aldrich” в диапазоне потенциалов от –0.3 до 1.0 В в течение 20 циклов. ФОНТ на электрод наносили из суспензии функционализированных карбоксильными и карбонильными группами одностенных углеродных нанотрубок фирмы “Aldrich” в хитозане с последующим испарением растворителя на воздухе. Электрод модифицировали композитом на основе RuOx и ФОНТ (RuOx–ФОНТ) в два этапа: сначала капельным путем наносили суспензию с ФОНТ и затем проводили электроосаждение RuOx.
Для проведения ПрИА использовали ячейку типа отражающей стенки с ПЭ, схема которой представлена на рис. 1. Инжекцию пробы осуществляли непосредственно на поверхность планарного электрода, погруженного в раствор фонового электролита, с помощью электронной микропипетки Rainin E4 XLS (METTLER TOLEDO, США).
Растворы КФ и ТФ готовили растворением их точных навесок х. ч. фирмы “Aldrich” в растворе фонового электролита. Серии растворов меньших концентраций готовили разбавлением исходных растворов непосредственно перед измерениями. Растворы лекарственных средств готовили также растворением их точных навесок в растворе фонового электролита. В качестве фонового электролита использовали 0.1 М H2SO4.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В кислой среде окисление рассматриваемых соединений на углеродных электродах происходит необратимо и при высоких анодных потенциалах. Зависимость величины тока регистрируемых сигналов от концентрации соединений линейна в узком интервале: 5 × 10–5–1 × 10–3 М для КФ и 5 × 10–4–1 × 10–3 М для ТФ соответственно.
Электроокисление КФ и ТФ можно представить следующей схемой [23, 24]:
Схема 1 . Окисление кофеина (R1, R2, R3 = CH3); теофиллина (R1, R2 = CH3; R3 = H).
Для разработки способа определения рассматриваемых соединений в широком интервале концентраций исследовали каталитические свойства иммобилизованных оксидов рутения, ФОНТ и композита на их основе по отношению к КФ и ТФ.
Электрохимическое поведение RuOx на углеродных электродах изучено ранее в работах [15, 16]. Установлено, что оксиды RuOx, электроосажденные на поверхности ПЭ и ФОНТ, проявляют каталитическую активность при окислении КФ и ТФ, что проявляется в уменьшении потенциала окисления субстрата и увеличении тока окисления модификатора в присутствии субстрата [25, 26]. В качестве примера на рис. 2а приведена вольтамперограмма окисления ТФ на композитном электроде на основе RuOx и ФОНТ. На анодной ветви при потенциалах окисления модификатора наблюдается один пик (рис. 2а), высота которого зависит от концентрации ТФ (рис. 2б). По сравнению с ПЭ на ХМЭ наблюдается увеличение тока окисления субстрата в 4 раза и уменьшение потенциала пика его окисления на 80 мВ.
Рис. 2.
Циклические вольтамперограммы на электроде RuOx–ФОНТ–ПЭ в отсутствие (1) и в присутствии (2) 5 × 10–3 М теофиллина на фоне 0.1 М H2SO4, скорость изменения потенциала 20 мВ/с (а). Зависимость тока при Е 1.27 В от концентрации теофиллина (б).
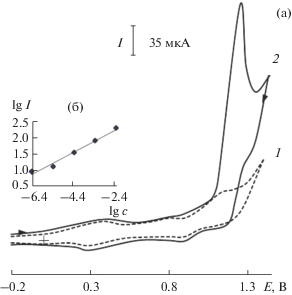
Для выяснения характера электрохимического процесса окисления рассматриваемых соединений рассчитали значения коэффициента Семерано [27]. Полученные данные позволяют отнести процесс электроокисления ТФ к диффузионному (Δ lg I/Δ lg v = 0.51), а КФ к кинетическому (Δ lg I/Δ lg v = 0.27).
Сопоставлена каталитическая активность RuOx, ФОНТ, а также композита RuOx–ФОНТ, иммобилизованных на ПЭ (RuOx–ФОНТ–ПЭ), по отношению к рассматриваемым органическим соединениям. Установлено, что при окислении КФ и ТФ наибольшую каталитическую активность (Iкат/Iмод, где Iкат – ток окисления субстрата на модифициронном электроде, а Iмод – ток окисления модификатора) проявляет композит RuOx–ФОНТ (табл. 1), что, вероятно, связано с формированием изолированных частиц оксидов рутения на поверхности электрода, модифицированного ФОНТ.
Таблица 1.
Вольт-амперные характеристики окисления органических соединений (c = 5 × 10–3 М) на фоне 0.1 М H2SO4
| Субстрат | Электрод | Екат, В | Iкат, мкА | Iкат/Iмод |
|---|---|---|---|---|
| Кофеин | ПЭ | 1.43 | 140.3 | – |
| ФОНТ–ПЭ | 1.40 | 193.3 | 4.6 | |
| RuOx–ПЭ | 1.40 | 204.0 | 4.6 | |
| RuOx–ФОНТ–ПЭ | 1.42 | 205.0 | 9.7 | |
| Теофиллин | ПЭ | 1.35 | 52.5 | – |
| ФОНТ–ПЭ | 1.23 | 224.0 | 5.0 | |
| RuOx–ПЭ | 1.27 | 239.5 | 6.0 | |
| RuOx–ФОНТ–ПЭ | 1.27 | 204.7 | 9.7 |
Разработанный модифицированный электрод RuOx–ФОНТ–ПЭ использовали в качестве амперометрического детектора при определении КФ и ТФ в порционно-инжекционной системе.
Система ПрИА выгодно отличается от наиболее распространенных систем проточного анализа, таких как проточно-инжекционный и последовательно-инжекционный анализ, отсутствием насоса, инжекционной петли и соединительных коммуникаций, поскольку роль всех этих составляющих выполняет электронная микропипетка. К тому же данную систему, включающую ячейку с ПЭ, микропипетку и потенциостат, можно применять в качестве портативной электрохимической системы. В связи с этим ПрИА с использованием ПЭ обладает большим потенциалом в проведении анализа “на месте” или в лаборатории с минимальным оборудованием.
Аналитический сигнал при окислении рассматриваемых соединений в проточной системе регистрировали в потенциостатическом режиме. Для каждого из рассматриваемых соединений в порционно-инжекционной системе устанавливали оптимальные условия регистрации сигнала на ХМЭ – объем вводимой пробы (V), скорость ввода пробы (u) и накладываемый потенциал (Е). На рис. 3 приведены зависимости тока окисления КФ и ТФ от накладываемого потенциала, объема инжектируемой пробы и скорости ввода пробы. Значения Е, V и u, при которых регистрировали наибольший по величине сигнал при окислении аналитов, были выбраны в качестве рабочих условий амперометрического детектирования в системе ПрИА (табл. 2).
Рис. 3.
Зависимость тока окисления кофеина (1) и теофиллина (2) (с = 5 × 10–3 М) на электроде RuOx–ФОНТ–ПЭ от накладываемого потенциала (а), (б), объема пробы (в) и скорости ввода пробы (г) в условиях порционно-инжекционного анализа на фоне 0.1 М H2SO4.
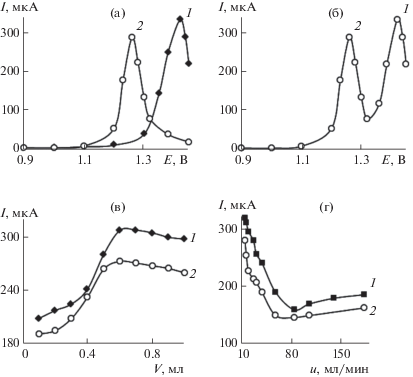
Таблица 2.
Условия порционно-инжекционного амперометрического определения кофеина и теофиллина на электроде RuOx–ФОНТ–ПЭ на фоне 0.1 М H2SO4
| Аналит | Электрохимические условия | Гидродинамические условия | |
|---|---|---|---|
| Е, В | V, мл | u, мл/мин | |
| Кофеин | 1.42 | 0.6 | 15.0 |
| Теофиллин | 1.27 | 0.6 | 15.0 |
Зависимость сигнала в порционно-инжекционной системе от концентрации аналитов в логарифмических координатах линейна в широком интервале 5 × 10–9–5 × 10–3 М. При непрерывном использовании ХМЭ в условиях ПИА электрокаталитический отклик хорошо воспроизводим. Рассчитанные значения sr для отклика ХМЭ не превышают 4.0% (n = 10, P = 0.95). Использование каталитического отклика модифицированного электрода в условиях ПрИА позволяет обеспечить теоретическую производительность до 180 проб/ч (при времени отклика ХМЭ 20 с).
Разработанные способы амперометрического определения КФ и ТФ на ХМЭ с каталитическими свойствами использовали при анализе некоторых лекарственных средств. Для этого анализируемые таблетки предварительно измельчали и растирали. Навеску порошка растертых таблеток растворяли в 0.1 М H2SO4 и переносили в мерную колбу емк. 50 мл, встряхивали и доводили до метки этим же фоновым электролитом. Раствор тщательно перемешивали и фильтровали. Приготовленные растворы инжектировали в порционно-инжекционную систему, затем регистрировали амперограмму, на которой измеряли величину тока при выбранном потенциале, а именно при Е = 1.27 В для ТФ и при Е = 1.42 В для КФ.
Результаты определения КФ и ТФ по амперометрическому отклику электрода RuOx–ФОНТ–ПЭ в условиях ПрИА в некоторых лекарственных средствах приведены в табл. 3. Матричные компоненты анализируемых лекарственных средств (стеарат кальция, полиэтиленгликоль, полиметакриловая кислота) электрохимически неактивны в условиях определения КФ и ТФ и не мешают их определению.
Таблица 3.
Результаты порционно-инжекционного амперометрического определения кофеина и теофиллина в лекарственных препаратах на электроде RuOx–ФОНТ–ПЭ (n = 6, P = 0.95, tтабл = 2.57)
| Лекарственный препарат | Аналит | Содержание в препарате, г | Найдено, г | sr |
|---|---|---|---|---|
| Теопэк “БИННОФАРМ АО” | Теофиллин | 0.30 | 0.270 ± 0.008 | 0.03 |
| Теотард “ВЕКТОР-ФАРМ ООО” | 0.20 | 0.200 ± 0.006 | 0.03 | |
| Кофетамин “Татхимфармпрепараты ОАО” | Кофеин | 0.10 | 0.110 ± 0.004 | 0.04 |
| Теофедрин “Мосхимфармпрепараты им Н.А. Семашко ОАО” | Кофеин | 0.05 | 0.051 ± 0.002 | 0.04 |
| Теофиллин | 0.10 | 0.102 ± 0.004 | 0.04 |
Установлено, что при совместном присутствии КФ и ТФ на графике зависимости величины тока от потенциала регистрируются два сигнала при Еп 1.27 и 1.42 В (рис. 3б), соответствующие окислению ТФ и КФ на ХМЭ. Для одновременного определения рассматриваемых соединений в лекарственных средствах использовали модифицированный двойной планарный электрод (ДПЭ) с двумя рабочими электродами, поверхности которых модифицировали композитом RuOx–ФОНТ. Измерения осуществляли также в потенциостатических условиях, сигнал ТФ регистрировали на одном рабочем электроде при Е1 1.27 В, а сигнал КФ – одновременно на другом рабочем электроде при Е2 1.42 В. Разработанную методику апробировали при анализе лекарственного препарата, содержащего КФ и ТФ (табл. 3). ПрИА обеспечивает теоретическую производительность на ДПЭ до 360 определений/ч (при времени отклика ХМЭ 20 с).
Как видно из табл. 4, разработанный электрод RuOx–ФОНТ–ПЭ отличается простотой изготовления, характеризуется достаточно высокой чувствительностью и позволяет проводить измерения в широком диапазоне концентраций. Использование композитного электрода по сравнению с немодифицированным ПЭ позволяет снизить нижнюю границу определяемых содержаний на 4–5 порядков, а применение ДПЭ – проводить двухкомпонентный анализ за одно измерение, сокращая при этом продолжительность анализа.
Таблица 4.
Сопоставление аналитических характеристик вольтамперометрического (ВА) и амперометрического (АМП) определения кофеина и теофиллина на различных электродах
| Аналит | Электрод | Метод | Диапазон линейности, мкМ | Предел обнаружения, мкМ | Литература |
|---|---|---|---|---|---|
| Кофеин | Полицистеин– УНТ–СУ | ВА | 0.40–140.0 | 0.20 | [28] |
| Au–УП | ВА | 25–150 и 200–1000 | 0.96 и 4.90 | [29] | |
| RuOx–ФОНТ–ПЭ | АМП | 0.005–500 | 0.001 | Данная работа | |
| Теофиллин | Полицистеин–УНТ–СУ | ВА | 0.10–70.0 | 0.033 | [28] |
| Золь-гель–УНТ–СУ | ВА | 0.05–30 | 0.0014 | [30] | |
| RuOx–ФОНТ–ПЭ | АМП | 0.005–500 | 0.001 | Данная работа |
К преимуществам ПрИА в сочетании с амперометрией на модифицированных электродах можно отнести высокую чувствительность, воспроизводимость, экспрессность, простоту выполнения анализа, низкое энергопотребление, минимальный расход проб и реагентов. Таким образом, разработанный электрод RuOx–ФОНТ–ПЭ в порционно-инжекционной системе можно использовать в качестве портативной электрохимической системы для амперометрического определения КФ и ТФ в фармацевтической продукции.
Работа выполнена при финансовой поддержке Казанского (Приволжского) федерального университета.
Список литературы
Самылинов И.А., Северцева В.А. Лекарственные растения Государственной фармакопеи. М.: АН-МИ, 2003. 534 с.
Глущенко Н.Н., Плетнева Т.В., Попков В.А. Фармацевтическая химия. М.: ИЦ “Академия”, 2004. 320 с.
Khajehsharifi H., Pourbasheer E. Simultaneous spectrophotometric determination of xanthine, hypoxanthine and uric acid in real matrix by orthogonal signal correction-partial least squares // J. Iranian Chem. Soc. 2011. V. 8. № 4. P. 1113.
Ashour A., Hegazy M.A., Abdel-Kawy M., ElZeiny M.B. Simultaneous spectrophotometric determination of overlapping spectra of paracetamol and caffeine in laboratory prepared mixtures and pharmaceutical preparations using continuous wavelet and derivative transform // J. Saudi Chem. Society. 2015. V. 19. № 2. P. 186.
Xia Z., Ni Y., Kokot S. Simultaneous determination of caffeine, theophylline and theobromine in food samples by a kinetic spectrophotometric method // Food Chem. 2013. V. 141. № 4. P. 4087.
Khanchi A.R., Mahani M.K., Hajihossein M., Maragheh M.G., Chaloosi M., Bani F. Simultaneous spectrophotometric determination of caffeine and theobromine in Iranian tea by artificial neural networks and its comparison with PLS // Food Chem. 2017. V. 103. № 3. P. 1062.
Лаврентьева А.В., Мелентьев А.Б. Определение теофиллина в плазме и крови методом высокоэффективной жидкостной хроматографии // Проблемы экспертизы в медицине. 2008. Т. 8. № 3–4. С. 16.
Rahim A.A., Saad B., Osman H., Hashim N., Yahya S., Talib K.M. Simultaneous determination of diethylene glycol, diethylene glycol monoethyl ether, coumarin and caffeine in food items by gas chromatography // Food Chem. 2011. V. 126. № 3. P. 1412.
Turak F., Güzel R., Dinç E. Simultaneous determination of ascorbic acid and caffeine in commercial soft drinks using reversed-phase ultraperformance liquid chromatography // J. Food Drug Anal. 2017. V. 25. № 2. P. 285.
Emre D., Ozaltin N. Simultaneous determination of paracetamol, caffeine and propyphenazone in ternary mixtures by micellar electrokinetic capillary chromatography // J. Chromatogr. B. 2007. V. 847. № 2. P. 126.
Wang J. Microchip capillary electrophoresis with a boron-doped diamond electrode for rapid separation and detection of purines // J. Chromatogr. A. 2004. V. 1022. № 1–2. P. 207.
Peri-Okonny U.L., Wang S.X., Stubbs R.J., Guzman N.A. Determination of caffeine and its metabolites in urine by capillary electrophoresis – mass spectrometry // Electrophoresis. 2005. V. 26. № 13. P. 2652.
Regan F. Rapid simultaneous determination of alkylxanthines by CZE and its application in analysis of pharmaceuticals and food samples // Anal. Chim. Acta. 2005. V. 540. № 1. P. 103.
Хасанов В.В., Слижов Ю.Г. Анализ энергетических напитков методом капиллярного электрофореза // Журн. аналит. химии. 2013. Т. 68. № 4. С. 385.
Shaidarova L.G., Chelnokova I.A., Il’ina M.A., Gedmina A.V., Budnikov H. Amperometric detection of caffeine and paracetamol on dual electrode modified by mixed-valence ruthenium and cobalt oxides composite in flow-injection analysis // Res. J. Pharm., Biol. Chem. Sci. 2016. V. 7. № 6. P. 2884.
Шайдарова Л.Г., Челнокова И.А., Ильина М.А., Гедмина А.В., Будников Г.К. Амперометрическое детектирование гидроксипуринов на электроде, модифицированном композитом на основе смешановалентных оксидов рутения и кобальта в условиях проточно-инжекционного анализа // Журн. аналит. химии. 2017. Т. 72. № 1. С. 91.
Quinn B.M., Dekker C., Lemay S.G. Electrodeposition of noble metal nanoparticles on carbon nanotubes // J. Am. Chem. Soc. 2005. V. 127. № 17. P. 6146.
Gooding J.J. Nanostruturing electrodes with carbon nanotubes: A review on eletrochemistry and applications for sensing // Eletrochim. Acta. 2005. V. 50. № 15. P. 3049.
Paradise M., Goswami T. Carbon nanotubes – Production and industrial applications // Mater. Design. 2007. V. 28. № 5. P. 1477.
Шайдарова Л.Г., Будников Г.К. Амперометрическое детектирование лекарственных веществ в проточно-инжекционном анализе / Фармацевтический анализ. Серия “Проблемы аналитической химии”. М: АНРАМАК-МЕДИА, 2013. С. 580.
Шайдарова Л.Г., Челнокова И.А., Дегтева М.А., Махмутова Г.Ф. Модифицированный электрод для определения кофеина и способ его определения. Патент РФ № 2 583 878. Заявка 2014137613/28 от 16.09.2014, опубл. 10.05.2016.
Шпигун Л.К., Андрюхина Е.Ю., Шушеначев Я.В. Спектрофотометрическое определение пуриновых алкалоидов методами проточно-инжекционного и последовательного инжекционного анализа // Журн. аналит. химии. 2015. Т. 70. № 8. С. 811.
Goyal R.N., Tyagi A. Controlled potential electrolysis of inosine: Dependence of the selected potential on the nature of the electrooxidised products // J. Electroanal. Chem. 2006. V. 592. № 1. P. 14.
Habibi B., Abazari M., Pournaghi-Azar M.H. A carbon nanotube modified electrode for determination of caffeine by differential pulse voltammetry // Chin. J. Catalysis. 2012. V. 33. № 11. P. 1783.
Шайдарова Л.Г., Будников Г.К. Амперометрические сенсоры с каталитическими свойствами в органической вольтамперометрии. М.: Наука, 2011. С. 203.
Шайдарова Л.Г., Будников Г.К. Химически модифицированные электроды на основе благородных металлов, полимерных пленок или их композитов в органической вольтамперометрии // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1014.
Будников Г.К., Майстренко В.Н., Евтюгин Г.А., Основы современного электрохимического анализа. М.: БИНОМ. Лаборатория знаний, 2003. С. 592.
Wang Y., Ding Y., Li L., Hu P. Nitrogen-doped carbon nanotubes decorated poly (L-Cysteine) as a novel, ultrasensitive electrochemical sensor for simultaneous determination of theophylline and caffeine // Talanta. 2018. V. 178. P. 449.
Ören T., Anık Ü. Voltammetric determination of caffeine by using gold nanoparticle-glassy carbon paste composite electrode // Measurement. 2017. V. 106. P. 26.
Güney S., Cebeci F. C. Selective electrochemical sensor for theophylline based on an electrode modified with imprinted sol–gel film immobilized on carbon nanoparticle layer // Sens. Actuators B. 2015. V. 208. P. 307.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии