Журнал аналитической химии, 2020, T. 75, № 9, стр. 781-787
УФ-спектроскопическое определение алоина в образцах алоэ вера (A. Vera) на основе хемометрической обработки данных
Н. А. Бурмистрова a, *, О. О. Кривец a, Ю. Б. Монахова a, b
a Саратовский государственный университет им. Н.Г. Чернышевского, Институт химии
410012 Саратов, ул. Астраханская, 83б, Россия
b Spectral Service AG
50996 Cologne, Emil-Hoffmann-Straße, 33, Germany
* E-mail: naburmistrova@mail.ru
Поступила в редакцию 22.05.2019
После доработки 29.06.2019
Принята к публикации 30.01.2020
Аннотация
Разработан простой экспресс-метод определения алоина в образцах A. vera методом УФ-видимой спектроскопии с исследованием результатов измерений методом главных компонент (ГК), который показал разделение образцов в пространстве ГК в зависимости от их производителя. Декомпозицию спектров модельных бинарных (алоин–яблочная кислота) и тройных (алоин–яблочная кислота–лимонная кислота) систем и спектров образцов A. vera выполняли с использованием алгоритма MILCA (Mutual Information Least Dependent Component Analysis), основанного на минимизации численных значений взаимной информации. Установлено, что для модельных смесей наблюдается хорошая корреляция между прогнозируемыми и фактическими концентрациями (n = 3, r = 0.986) алоина в исследуемых образцах. Спектры модельных систем, образцов A. vera с известной концентрацией алоина, а также спектры искусственно загрязненных образцов A. vera относительно исходных образцов использовали как калибровочные системы при разложении спектров образцов A. vera методом анализа независимых компонент. Показано, что УФ-спектроскопия в сочетании с соответствующей хемометрической обработкой данных позволяет количественно определять алоин в растительных образцах A. vera.
Aloe vera (L.) Burm. F. – хорошо известный во всем мире вид рода алоэ, нашедший широкое применение в качестве исходного растительного сырья в производстве медицинских (для стимуляции иммунной системы и заживления ран) и косметических препаратов, БАД [1–6]. Экстракт A. vera, особенно в форме геля, является главным ингредиентом в препаратах для лечения кожи и в косметике. Гель A. vera представляет собой сложную многокомпонентную биологическую матрицу, содержащую широкий круг низкомолекулярных органических соединений (антрахиноны, хромоны и их гликозиды, яблочную кислоту, аминокислоты и др.), моно- и полисахариды, углеводы, белки и неорганические компоненты (фосфор, калий, кальций, магний и др.) [1, 4, 7, 8]. В связи с этим сертификация качества геля A. vera является сложной задачей, которая существенно осложняется и особенностями процесса его получения.
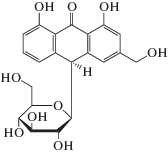
Одним из показателей качества A. vera как растительного сырья является концентрация алоина (или барбалоина) (схема 1) – основного действующего компонента геля A. vera, который отвечает за его терапевтические свойства, например за противовоспалительное действие [9]. В то же время, согласно рекомендациям International Aloe Science Council, концентрация алоина в продуктах, предназначенных для потребления внутрь, не должна превышать 10 ppm [10].
Схема 1. Структурная формула алоина.
В настоящее время для обнаружения и количественного определения активных компонентов, в том числе алоина, в растительных экстрактах A. vera и в коммерческих продуктах на его основе применяют ряд методов. Для полуколичественного анализа образцов A. vera в работе [11] предложено применение тонкослойной хроматографии. Методы контроля качества препаратов на основе A. vera А. включают ВЭЖХ с различными детекторами, такими как диодная матрица (ДМД) [12], флуоресцентный [13, 14] и масс-спектроскопический [15–17]. Хорошей альтернативой ВЭЖХ является метод ядерного магнитного резонанса (1Н ЯМР), который позволяет количественно определять широкий круг органических соединений [18, 19]. Несмотря на то, что ВЭЖХ и ЯМР являются высокоинформативными методами и позволяют определять основные компоненты A. vera с хорошими чувствительностью и точностью, высокая стоимость и, в ряде случаев, необходимость длительной и трудоемкой пробоподготовки ограничивает их использование. Наиболее широко применяют методы ВЭ-ЖХ-ДМД [20–22] и ВЭЖХ–МС/МС [23]. Од-нако актуальной задачей остается разработка более простых методов количественного определения алоина в сырье и препаратах на основе A. vera. Для ее решения в данной работе предложено использовать УФ-спектроскопию с последующей хемометрической обработкой данных, позволяющей преодолеть основной недостаток УФ-спектроскопии – существенное перекрывание в регистрируемых спектрах полос поглощения отдельных компонентов.
Цель работы состояла в разработке способа количественного определения алоина на основе данных УФ-спектрофотометрии с использованием двух хемометрических подходов – метода главных компонент (МГК) и метода независимых компонент (Independent Component Analysis, ICA).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы. В качестве стандартов в работе использовали алоин, яблочную и лимонные кислоты (Merck KGaA, Дармштадт, Германия). Все остальные реагенты, использованные в работе, были квалификации х. ч.
Для предотвращения химических превращений стандарт алоина хранили в инертной атмосфере в темноте. Исходные растворы алоина (0.4 мг/мл), яблочной (0.4 мг/мл) и лимонной (8 мг/мл) кислот готовили растворением их навесок в бидистиллированной воде непосредственно перед применением.
Образцы A. vera были предоставлены фирмой “Spectral Service” (Cologne, Германия). В ходе исследования проанализировано 16 образцов A. vera, включая 15 в твердом и 1 в жидком состоянии. Информация об образцах, а также содержание в них алоина, подтвержденное методом ВЭЖХ, представлены в таблице 1. Для приготовления растворов образцы A. vera (50 мг) растворяли в 1 мл бидистиллированной воды.
Таблица 1.
Идентификация образцов A. vera
| Образец | Идентификатор | Описание | Сухой остаток % | Концентрация алоина согласно ВЭЖХ, ppb |
|---|---|---|---|---|
| S1 | Aloe Vera Juice | Желтоватая жидкость | 1.1 | 52 |
| S2 | Aloe Vera Juice | Коричневая жидкость | 0.60 | 48.4 |
| S3 | Aloe Vera Juice | Коричневая жидкость | 0.75 | 69.6 |
| S4 | Aloe Vera Juice | Коричневая жидкость | 1.2 | 103 |
| S5 | Aloe Vera Juice | Коричневая жидкость | 0.81 | 87.1 |
| S6 | Aloe Vera Juice | Коричневая жидкость | 0.93 | 81.2 |
| S7 | Aloe Vera Gel | Белая жидкость | 0.98 | 9.8 |
| S8 | Aloe Vera Spray Dried Powder 200X | Бежевый порошок | – | 1.72 |
| S9 | Organic AV Juice | Бежевая жидкость | 0.90 | – |
| S10 | Aloe Vera Juice | Желтоватая жидкость | 1.3 | – |
| S11 | Aloe Vera Juice | Желтоватая жидкость | 0.78 | – |
| S12 | Aloe Vera Juice | Желтоватая жидкость | 0.80 | Неизвестно |
| S13 | Aloe Vera Juice | Светло-красная жидкость | 0.85 | Неизвестно |
| S14 | Aloe Vera Juice | Бежевая жидкость | 0.75 | 1.14 |
| S15 | Aloe Vera Juice | Бежевая жидкость | 0.70 | 1.09 |
| S16 | Aloe Vera Juice | Бесцветная жидкость | 0.80 | 1.13 |
Значения рH фосфатно-солевого буферного раствора (10 мМ) измеряли с помощью pH-метра pH-150МИ (Измерительная техника, Москва, Россия) с применением комбинированного электрода ЭСК-10603/7.
УФ-спектры регистрировали на спектрофотометре Shimadzu UV-1800 (Shimadzu, Kyōto, Япония) в спектральном диапазоне 190–400 нм с разрешением 1 нм.
Анализ данных. Исходные спектральные данные анализировали с помощью МГК с предварительным центрированием данных с использованием программного обеспечения MS Excel 2007 согласно [24]. Для определения оптимального количества главных компонент (ГК) использовали метод полной кросс-валидации.
Разложение спектров модельных растворов и образцов A. vera проводили методом ICA с использованием алгоритма MILCA (Mutual Information Least Dependent Component Analysis). Программа для реализации алгоритма MILCA свободно доступна в виде независимых исполняемых модулей [25] в программном обеспечении MATLAB 2013b (The Math Works, Natick, MA, США). Алоин количественно определяли в образцах A. vera методом добавок. При этом в качестве раствора сравнения использовали раствор, содержащий исследуемый образец A. vera с добавкой стандартного раствора алоина (конечные концентрации алоина в анализируемом растворе составляли 4 и 6 мкг/мл).
Спектры алоина, полученные для образца A. vera с добавкой относительно исходного образца, использовали в качестве калибровочных систем (n = 5) при разделении спектров методом ICA.
Для количественного определения алоина в образцах A. vera с неизвестной концентрацией в качестве относительной концентрации использовали сумму двух компонент MILCA.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
УФ-спектр алоина. Спектр стандартных растворов алоина (10–60 мкг/мл) характеризуется рядом полос, обусловленных наличием антронового цикла (рис. 1) и включает широкую интенсивную полосу в диапазоне 190–230 нм (lg ɛ = 4.35), характерную для ненасыщенных соединений, и две полосы с низкой интенсивностью при 268 нм (lg ɛ = 3.57) и 296 нм (lgɛ = 3.63), вызванных π → π* переходами в антраценовом кольце. Полоса при 353 нм (lg ɛ = 3.68) связана с n → π* переходом и присутствует в спектрах других гидроксильных производных антрацена. Следует отметить, что спектр алоина не чувствителен к изменениям рН в диапазоне 4.8–8.0.
Рис. 1.
УФ-спектры стандартных растворов алоина. Концентрация, мкг/мл: 1 – 1.0, 2 – 2.0, 3 – 3.0, 4 – 4.0, 5 – 5.0, 6 – 6.0.

В ряде работ УФ-спектроскопию использовали для оценки качества A. vera и продуктов на ее основе (лист, гель, корень, коммерческий гель, коммерческое мыло) [8, 26, 27]. Однако матричный эффект не позволяет отделить спектральный сигнал алоина от других органических соединений, которые поглощают в том же спектральном диапазоне (например, фенольных соединений). Относительно низкая чувствительность спектра поглощения образцов A. vera к изменению концентрации алоина также является существенным недостатком при разработке методики его определения.
Кроме того, спектр алоина чувствителен к присутствию кислорода воздуха и действию света вследствие гидроксилирования различных атомов углерода и этерификации остатка сахара. Возможно также и стереохимическое ферментативное превращение алоина А в алоин В.
УФ-спектры образцов A. vera. Анализ спектральных данных методом главных компонент. Спектры образцов A. vera (рис. 2) и показывают сильное перекрывание полос поглощения алоина и других соединений, присутствующих в матрице. Следовательно, стандартный метод добавок не может быть использован для определения концентрации алоина. В связи с этим использование приемов хемометрики становится необходимым для интерпретации сигналов и обнаружения информации, скрытой в УФ-спектрах образцов, например концентрации алоина.
Рис. 2.
УФ-спектры растворов образцов A. vera. Концентрация 5 мг/мл. 1 – S1, 2 – S2, 3 – S3, 4 – S4, 5 – S5, 6 – S6, 7 – S8, 8 – S9, 10 – S11, 11 – S12, 12 – S13, 13 – S14, 14 – S15, 15 – S16.

Спектрометрические данные изучали с помощью МГК, что позволило визуализировать распределение образцов A. vera в пространстве ГК. Как видно из рис. 2, два образца (S7 и S9) в пространстве ГК1–ГК2 идентифицированы как выбросы и не учитывались в дальнейшем при построении модели МГК. Причиной отличия этих образцов, вероятно, является присутствие высоких концентраций бензоата натрия (используемого как консервант), который характеризуется сильным поглощением в УФ-области спектра. Установлено, что первые три ГК описывают 99% общей дисперсии данных (ГК1 – 90, ГК2 – 6 и ГК3 – 3%). Анализ графика счетов в координатах ГК2–ГК1 (рис. 3) показал разделение образцов в зависимости от их производителя. Образцы первого производителя (S1–S6, точки) локализованы в области положительных значений ГК1, второго (S10–S13, прямоугольники) – в областях отрицательных значений PC1. Образцы других производителей (треугольники) распределены в пространстве ГК. В случае первого производителя распределение образцов по ГК2 показало также зависимость их положения от концентрации алоина. График нагрузок показал, что вклад характерных пиков алоина в модель незначителен (рис. 3б).
Рис. 3.
Графики счетов (а) и нагрузок (б) МГК-моделирования спектральных данных образцов A. vera. (а): производитель I – (⚫), производитель II – (◼), другие производители – (▲); (б): 1 – ГК1, 2 – ГК2, 3 – ГК3.

Алгоритм MILCA как альтернативный хемометрический инструмент. Метод ICA использовали в качестве альтернативного хемометрического инструмента для анализа УФ-спектрометрических данных. Ранее нами в работах [28–30] показан потенциал алгоритма MILCA для качественного и количественного анализа на основе УФ-спектрометрических данных. В отличие от МГК, который основан на определении максимальной дисперсии в многомерном пространстве переменных, целью ICA является извлечение сигналов индивидуальных (чистых) компонент из наблюдаемого сигнала смеси [31]. MILCA моделирует наименее зависимые компоненты путем минимизации числовых значений взаимной информации.
В общем виде линейная задача ICA может быть сформулирована как
где X – матрица M × N из M спектров измеренных смесей, S – матрица K × N из K неизвестных спектров чистых компонент (N обозначает число шагов по длине волны), A – матрица смесей M × K (неизвестные концентрации). Задача состоит в том, чтобы восстановить (предсказать) матрицы S и A с учетом наблюдаемой матрицы X, исходя из предположения, что исходные чистые компоненты взаимно независимы, насколько это возможно (гипотеза ограничивает многообразие решений).Базовый метод MILCA использует точные числовые оценки взаимной информации на основе алгоритма k-ближайших соседей и параметризован числом ближайших соседей Knn при отсутствии каких-либо предположений об индивидуальном распределении исходных (чистых) сигналов [31–33]. Y и W инвариантны относительно масштабирования и перестановки столбцов, поэтому физический смысл при анализе результатов ICA имеют только относительные концентрации и спектральные кривые в относительных единицах.
Первоначально алгоритм MILCA был апробирован при определении алоина в модельных бинарных (алоин–яблочная кислота) и тройных (алоин–яблочная кислота–лимонная кислота) смесях. Выбор компонентов модельных смесей обусловлен следующими причинами. A. vera характеризуется сложным составом [19], который существенно зависит от пробоподготовки растительного материала. Яблочная кислота является природным компонентом A. vera, а лимонную кислоту используют как подкислитель при производстве препаратов на основе A. vera. Кроме того, спектры этих веществ перекрываются со спектром алоина в исследуемой УФ-области. Установлено, что анализ спектрометрических данных методом MILCA позволяет выделить профиль компонент, вид которого идентичен индивидуальному сигналу алоина (рис. 4a). Использование индивидуальных спектров яблочной и лимонной кислот в качестве калибровочных систем позволило улучшить качество разложения. Успешность разложения подтвердило высокое значение индекса Амари (Perr < 0.09), который используется для оценки качества разложения [34].
Рис. 4.
Спектральные профили, выделенные ICA при моделировании УФ-спектров модельных растворов (1 – НК1, 2 – НК2), и экспериментальный спектр алоина (3) (НК – независимая компонента) (а). Корреляция между предсказанными MILCA и фактическими концентрациями алоина в модельных системах, r = 0.986 (б).
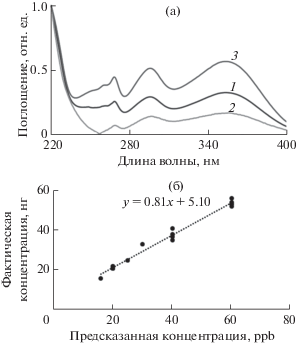
Концентрация алоина в 15 модельных системах с различными молярными соотношениями алоин–яблочная кислота–лимонная кислота рассчитывали по формуле:
где cx и ccal – концентрации алоина в неизвестных и калибровочных системах (ppb), $a_{x}^{e}$ и $a_{{{\text{cal}}}}^{e}$ – относительные концентрации MILCA для неизвестных и калибровочных систем соответственно [32]. Результаты расчетов показали хорошую корреляцию между прогнозируемой и фактической концентрациями алоина в модельных системах (r = 0.986), что иллюстрирует рис. 4б.Сложная матрица A. vera не позволила разделить спектры реальных образцов при использовании в качестве калибровочной системы алоина или смеси алоин–яблочная кислота–лимонная кислота. В связи с этим в качестве калибровочной системы использовали спектры образцов A. vera с известной концентрацией алоина (рис. 5). Следует отметить, что спектральные характеристики образцов, приготовленных из различных растительных материалов, отличаются, что необходимо учитывать при выборе калибровочной системы. Выделенный спектр алоина аналогичен спектру индивидуального вещества, что подтверждает рис. 5.
Рис. 5.
Уф-спектры образцов A. vera после декомпозиции методом MILCA и сравнение спектральных компонент (1 – НК1, 2 – НК2, 3 – НК3) и спектра алоина (4) (а). Взаимосвязь между предсказанной ICA категорией и фактической концентрацией алоина (б).
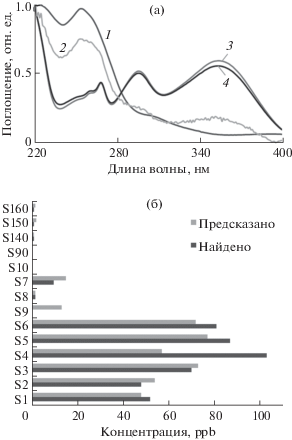
На следующем этапе ICA применили для полуколичественного определения алоина в образцах A. vera. Использование в качестве калибровочной системы образца S6 позволило разделить изучаемые образцы A. vera на пять групп с разными уровнями концентрации, что показано на рис. 5б. Высокое значение рангового коэффициента корреляции Rs = 0.947 указывает на сильную взаимосвязь между прогнозируемой и фактической концентрациями алоина.
Для учета возможной трансформации алоина в растворе использовали метод добавок, что позволило улучшить качество разделения спектров образцов A. vera. Первая компонента IC, полученная при разложении MILCA, хорошо описывает спектр индивидуального алоина. Предложенный подход позволил определить концентрацию алоина с высокой точностью, характеризующейся хорошей корреляцией между предсказанной MILCA и фактической концентрацией алоина в образцах A. vera (r = 0.930).
* * *
Таким образом, УФ-спектроскопия и методы МГК и ICA могут быть применены для оценки содержания алоина в образцах A. vera различных производителей. Хемометрическая обработка спектральных данных позволила разработать экспрессный и простой метод определения алоина в материалах на основе A. vera при минимальной пробоподготовке. Разработанный метод не требует применения токсичных растворителей и характеризуется небольшой продолжительностью анализа, что позволяет рекомендовать его для широкого круга лабораторий. Метод ICA, в отличие от МГК, позволяет предсказывать концентрацию алоина с высокой точностью в случае правильного выбора калибровочной системы. Поскольку ICA не требует обучающего набора данных, его можно применять для скрининга материалов на основе A. vera.
Работа выполнена при поддержке Российского научного фонда (грант 18-73-10009).
Список литературы
Baruah A., Bordoloi M., Deka Baruah H.P. Aloe vera: A multipurpose industrial crop // Ind. Crops. Prod. 2016. V. 94. P. 951. https://doi.org/10.1016/J.INDCROP.2016.08.034
Gao Y., Kuok K.I., Jin Y., Wang R. Biomedical applications of Aloe vera // Crit. Rev. Food. Sci. Nutr. 2019. V. 59. № 1. P. S244. https://doi.org/10.1080/10408398.2018.1496320
Guo X., Mei N. Aloe vera : A review of toxicity and adverse clinical effects // J. Environ. Sci. Heal. C. 2016. V. 34. P. 77. https://doi.org/10.1080/10590501.2016.1166826
Pandey A., Singh S. Aloe vera: A systematic review of its industrial and ethno-medicinal efficacy // Int. J. Pharm. Res. Allied. Sci. 2016. V. 5. № 1. P. 21.
Rodríguez E.R., Martín J.D., Romero C.D. Aloe vera as a functional ingredient in foods // Crit. Rev. Food. Sci. Nutr. 2010. V. 50. P. 305. https://doi.org/10.1080/10408390802544454
Sahu P.K., Giri D., Singh R., Pandey P., Gupta S., Shrivastava A., Kumar A., Pandey K. Therapeutic and medicinal uses of Aloe vera: A review // Pharmacol. Pharm. 2013. V. 4. P. 599. https://doi.org/10.4236/pp.2013.48086
Aloes: The genus aloe / Ed. Reynolds T. CRC Press, 2004. 408 p.
Ray A., Gupta S.D., Ghosh S. Evaluation of anti-oxidative activity and UV absorption potential of the extracts of Aloe vera L. gel from different growth periods of plants // Ind. Crops. Prod. 2013. V. 49. P. 712. https://doi.org/10.1016/J.INDCROP.2013.06.008
Harlev E., Nevo E., Lansky E., Ofir R., Bishayee A. Anticancer potential of aloes: Antioxidant, antiproliferative, and immunostimulatory attributes // Planta Med. 2012. V. 78. P. 843. https://doi.org/10.1055/s-0031-1298453
International Aloe Science Council. https://www.iasc.org/ (29.01.2020)
Ramírez-Durón R., Ceniceros-Almaguer L., Cavazos-Rocha N.C., Silva-Flores P.G., De Torres N.W. Comparison of high-performance liquid chromatographic and thin-layer chromatographic methods for determination of aloin in herbal products containing Aloe vera // J. AOAC Int. 2008. V. 91. № 6. P. 1265.
Brown P.N., Yu R., Kuan C.H., Kuan C.H., Finley J., Mudge E.M., Dentali S. Determination of aloin A and aloin B in Aloe vera raw materials and finished products by high-performance liquid chromatography: single-laboratory validation // J. AOAC Int. 2014. V. 97. P. 1323. https://doi.org/10.5740/jaoacint.13-028
Mandrioli R., Mercolini L., Ferranti A., Fanali S., Raggi M.A. Determination of aloe emodin in Aloe vera extracts and commercial formulations by HPLC with tandem UV absorption and fluorescence detection // Food. Chem. 2011. V. 126. P. 387. https://doi.org/10.1016/J.FOODCHEM.2010.10.112
Zhou Y., Chiu C.-W., Liang H. Interfacial structures and properties of organic materials for biosensors // Sensors. 2012. V. 12. P. 15036. https://doi.org/10.3390/s121115036
Elsohly M.A., Gul W., Avula B., Khan I.A. Determination of the anthraquinones aloe-emodin and aloin-a by liquid chromatography with mass spectrometric and diode array detection // J. AOAC Int. 2007. V. 90. № 1. P. 28.
Fanali S., Aturki Z., D’Orazio G., Rocco A., Ferranti. A., Mercolini L., Raggi M.A. Analysis of aloe-based phytotherapeutic products by using nano-LC-MS // J. Sep. Sci. 2010. V. 33. P. 2663. https://doi.org/10.1002/jssc.201000408
Zhao Y., Sun Y.N., Lee M.J., Kim Y.H., Lee W., Kim K.H., Kang J.S. Identification and discrimination of three common aloe species by high performance liquid chromatography–tandem mass spectrometry coupled with multivariate analysis // J. Chromatogr. B. 2016. V. 1031. P. 163. https://doi.org/10.1016/J.JCHROMB.2016.07.036
Jiao P., Jia Q., Randel G., Diehl B., Weaver S., Milligan G.J. Quantitative 1H-NMR spectrometry method for quality control of aloe vera products // J. AOAC Int. 2010. V. 93. №. 3. P. 842.
Monakhova Y.B., Randel G., Diehl B.W.K. Automated control of the organic and inorganic composition of aloe vera extracts using 1 H NMR spectroscopy // J. AOAC Int. 2016. V. 99. P. 1213. https://doi.org/10.5740/jaoacint.16-0020
Logaranjan K., Devasena T., Pandian K. Quantitative detection of aloin and related compounds present in herbal products and aloe vera plant extract using HPLC method // Am. J. Anal. Chem. 2013. V. 4. P. 600. https://doi.org/10.4236/ajac.2013.410071
Sánchez-Machado D.I., López-Cervantes J., Sendón R., Sanches-Silva A. Aloe vera: Ancient knowledge with new frontiers // Trends Food. Sci. Technol. 2017. V. 61. P. 94. https://doi.org/10.1016/J.TIFS.2016.12.005
Sánchez-Machado D.I., López-Cervantes J., Mariscal-Domínguez M.F., Cruz-Flores P., Campas-Baypoli O.N., Cantú-Soto E.U., Sanches-Silva A. An HPLC procedure for the quantification of aloin in latex and gel from aloe barbadensis leaves // J. Chromatogr. Sci. 2017. V. 55. P. 251. https://doi.org/10.1093/chromsci/bmw179
Wang P.G., Zhou W., Wamer W.G., Krynitsky A.J., Rader J.I. Simultaneous determination of aloin A and aloe emodin in products containing Aloe vera by ultra-performance liquid chromatography with tandem mass spectrometry // Anal. Methods. 2012. V. 4. № 11. P. 3612. https://doi.org/10.1039/c2ay25599e
Pomerant︠s︡ev A.L. Chemometrics in Excel. John Wiley & Sons, 2014. 336 p.
MILCA. https://www.ucl.ac.uk/ion/milca-0 (29.01.2020).
Ravi S., Kabilar P., Velmurugan S., Kumar R.A., Gayathiri M. Spectroscopy studies on the status of aloin in Aloe vera and commercial samples // J. Exp.Sci. 2011. V. 2. № 8. P. 10.
Ray A., Gupta S.D., Ghosh S. Evaluation of anti-oxidative activity and UV absorption potential of the extracts of Aloe vera L. gel from different growth periods of plants // Ind. Crops Prod. 2013. V. 49. P. 712.
Monakhova Y.B., Mushtakova S.P. Multicomponent quantitative spectroscopic analysis without reference substances based on ICA modelling // Anal. Bioanal. Chem. 2017. V. 409. P. 3319. https://doi.org/10.1007/s00216-017-0275-0
Монахова Ю.Б., Муштакова С.П. Применение пакета MATLAB для автоматизации хемометрической обработки спектрометрических сигналов в анализе смесей сложного состава // Журн. аналит. химии. 2016. Т. 71. № 8. С. 791. (Monakhova Y.B., Mushtakova S.P. Application of MATLAB package for the automation of the chemometric processing of spectrometric signals in the analysis of complex mixtures // J. Analyt. Chem. 2016. V. 71. № 8. P. 759.) https://doi.org/10.1134/S1061934816060125
Монахова Ю.Б., Муштакова С.П. Методология хемометрического моделирования спектрометрических сигналов в анализе объектов сложного состава // Журн. аналит. химии. 2017. Т. 72. № 2. С. 119. (Monakhova Y.B., Mushtakova S.P. Methodology of chemometric modeling of spectrometric signals in the analysis of complex samples // J. Analyt. Chem. 2017. V. 72. № 2. P. 147.) https://doi.org/10.1134/S1061934816120066
Stögbauer H., Kraskov A., Astakhov S.A., Grassberger P. Least-dependent-component analysis based on mutual information // Phys. Rev. E. 2004. V. 70. P. 066123. https://doi.org/10.1103/PhysRevE.70.066123
Monakhova Y.B., Astakhov S.A., Kraskov A., Mushtakova S.P. Independent components in spectroscopic analysis of complex mixtures // Chemom. Intell. Lab. Syst. 2010. V. 103. P. 108. https://doi.org/10.1016/J.CHEMOLAB.2010.05.023
Kraskov A., Stögbauer H., Grassberger P. Estimating mutual information // Phys. Rev. E. 2004. V. 69. P. 066 138. https://doi.org/10.1103/PhysRevE.69.066138
Malinowski E.R. Obtaining the key set of typical vectors by factor analysis and subsequent isolation of component spectra // Anal. Chim. Acta. 1982. V. 134. P. 129. https://doi.org/10.1016/S0003-2670(01)84184-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии