Журнал аналитической химии, 2020, T. 75, № 9, стр. 777-780
Концентрирование тория(IV) хелатообразующими сорбентами на основе сополимера малеинового ангидрида со стиролом
Ф. Н. Бахманова *
Бакинский государственный университет, химический факультет
Az 1148 Баку, ул. З. Халилова, 23, Азербайджан
* E-mail: fidan_chem@rambler.ru
Поступила в редакцию 09.04.2019
После доработки 18.02.2020
Принята к публикации 17.03.2020
Аннотация
Изучены сорбционные и комплексообразующие свойства модифицированных сорбентов на основе сополимера малеинового ангидрида со стиролом по отношению к ионам тория(IV). Использованы сорбенты, содержащие фрагменты 2-амино-4-хлор-6-сульфофенола и 2,4-диамино-6-фенилтриазина-1,3,5. Определены основные количественные характеристики сорбции тория, установлены оптимальные условия сорбции. Коэффициент концентрирования из 20 мл раствора 30 мг сорбента не ниже 200. Степень извлечения радиоактивного тория превышает 95%. Разработанная методика применена для определения тория (IV) в почве, загрязненной нефтью.
Химические и физико-химические методы [1–4] анализа природных и промышленных объектов не всегда позволяют определять микроколичества радиоактивных элементов. Все применяемые сорбенты обладают определенными недостатками: низкой сорбционной емкостью [1]; сорбцией радиоактивных элементов при нагревании до 45–60°С и ее отсутствием при комнатной температуре [2–4]; уменьшением степени сорбции тория в присутствии K+, Na+, Li+ [5]; необходимостью длительного контакта фаз (20–78 ч) в ряде случаев [6]. Недостатком некоторых методов является относительное низкое значение коэффициента концентрирования [7–9].
Известно [10], что для концентрирования радиоактивных элементов эффективны хелатообразующие лиганды, содержащие донорные атомы кислорода и азота или два соседних атома кислорода. Публикации последних лет свидетельствуют о том, что сополимер малеинового ангидрида со стиролом является перспективной матрицей для получения таких хелатообразующих сорбентов [11–16].
В настоящей работе предложены методики сорбционно-спектрофотометрического определения микроколичеств тория(IV), основанные на предварительном концентрировании тория(IV) из природных и промышленных объектов с применением полимерных хелатных сорбентов, содержащих фрагменты 2,4-диамино-6-фенилтриазина-1,3,5 (С1) и 2-амино-4-хлор-6-сульфофенола (С2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы и реагенты. Использовали реактивы квалификации х.ч. Раствор нитрата тория (0.01 М) готовили растворением его точной навески в дистиллированной воде [17]. Рабочие растворы получали разбавлением исходного. Необходимые значения рН создавали добавлением растворов НСl, NaOH и аммиачно-ацетатных буферных растворов. Для поддержания постоянной ионной силы использовали раствор KCl.
В качестве фотометрического реагента использовали 2,2',3,4-тетрагидрокси-3'-сульфо-5'-хлоразобензол (R), который синтезировали азосочетанием диазотированного амина с пирогаллолом в слабокислой среде по методике [18].
Использовали сорбенты, содержащие фрагменты 2,4-диамино-6-фенилтриазина-1,3,5 и 2-амино-4-хлор-6-сульфофенола. Их синтез осуществляли по методике [19]. Гранулы сорбента растирали в агатовой ступке и просеивали через сито (0.4 мм).
Аппаратура. Для контроля кислотности растворов использовали иономер PHS-25 со стеклянным электродом. Оптическую плотность измеряли на фотоколориметре КФК 2 (l = 1 cм).
Методика эксперимента. Сорбцию изучали в статических условиях. В градуированную пробирку с притертой пробкой вводили раствор металла, добавляли аммиачно-ацетатный буферный раствор до объема 20 мл для создания необходимой кислотности. Вносили 0.05 г сорбента, пробирку закрывали пробкой и оставляли на 3 ч, затем раствор декантировали. В элюате концентрацию тория определяли фотометрическим методом с использованием 2,2',3,4-тетрагидрокси-3'-сульфо-5'-хлоразобензола. Концентрацию рассчитывали с использованием градуировочного графика, полученные результаты обрабатывали статистически [20].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучали влияние на сорбцию тория(IV) рН среды, времени, ионной силы, концентрации металла в растворе, а также кинетические свойства сорбентов.
Влияние кислотности изучали в диапазоне рН 1–8. Максимальная степень извлечения тория сорбентами достигается из растворов с рН 4.
Сорбционную способность сорбента исследовали в статических условиях. К 50 мг сорбента добавляли 2 мл 0.01 М раствора тория(IV) и оставляли в буферной среде при разных рН. Смесь отфильтровывали и измеряли оптическую плотность при 490 нм. Количество оставшегося тория(IV) в растворе находили по градуировочному графику и рассчитывали количество сорбированного металла. Ниже показано влияние pH водной среды на сорбционную емкость (мг/г) сорбентов С1 и С2:
Коэффициент концентрирования при объеме раствора 20 мл и массе сорбента 30 мг не ниже 200. Во всех экспериментах объем раствора варьировали от 10 до 100 мл. Объем водной фазы 20 мл оказался оптимальным.
Влияние ионной силы. Ионная сила раствора существенно влияет на твердофазную матрицу и состояние функциональных групп в сорбенте. Исследовали зависимость сорбции от ионной силы фотометрическим методом. Торий(IV) сорбировали из 0.1–1.4 М растворов KCl. Результаты исследования (рис. 1) показали, что сорбция металла из растворов с ионной силой более 0.8 М (при сорбции с С1) и 0.6 (при сорбции с С2) заметно уменьшается.
Рис. 1.
Влияние ионной силы раствора на величину сорбции тория (IV): mсорб = 50 мг, V = 20 мл, рН 4, 1 – С1, 2 – С2.
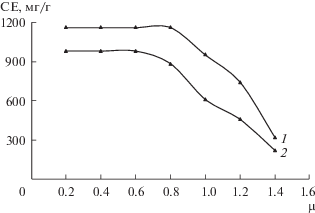
Влияние времени. Приведенные ниже данные иллюстрируют зависимость сорбции тория(IV) на сорбентах С1 и С2 (СЕ, мг/г) от времени:
| t, мин | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 |
|---|---|---|---|---|---|---|---|---|
| С1 | 115 | 258 | 412 | 635 | 852 | 1163 | 1163 | 1162 |
| С2 | 96 | 214 | 357 | 562 | 741 | 982 | 983 | 982 |
Видно, что сорбционное равновесие достигается после контакта сорбента с металлом в течение 3 ч. Во всех дальнейших экспериментах время установления сорбционного равновесия составляло 3 ч.
Влияние концентрации тория(IV) на сорбцию. Показано, что величина сорбционной емкости (СЕ) меняется с изменением концентрации металла (табл. 3 ). На изотермах сорбции тория(IV) имеются начальные линейные участки с большими углами наклона, а далее выпуклые нелинейные участки, что указывает на высокую СЕ (рис. 2). исследовали зависимость величины сорбции (СЕ, мг/г) от концентрации тория(IV):
| с0 × 104, М | 2 | 4 | 8 | 10 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| С1 | 79 | 152 | 279 | 354 | 584 | 842 | 1020 | 1163 | 1164 |
| С2 | 41 | 94 | 170 | 215 | 412 | 684 | 842 | 982 | 982 |
Рис. 2.
Изотермы сорбции тория(IV) на синтезированных сорбентах: mсорб = 50 мг, V = 20 мл, pH 4, 1 – С1, 2 – С2.
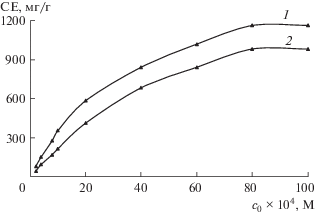
Видно, что с увеличением концентрации тория(IV) в растворе увеличивается его сорбция, и при концентрации 8 × 10–3 М она становится максимальной (pH 4, Vоб = 20 мл, mсорб = 0.05 г, CE = 1163 мг/г для C1 и 982 мг/г для C2).
Десорбция тория(IV) из полимерных сорбентов. Исследовали возможность и определили условия десорбции металла разными минеральными кислотами (HClО4, H2SО4, HNО3, HCl) после концентрирования. Показано, что торий(IV) количественно десорбируется 2 М HNО3 (С1) и 2 М HClО4 (С2). Возможно многократное использование регенерированного сорбента для концентрирования.
Влияние скорости потока растворов пробы и элюента изучали пропусканием раствора тория(IV) через миниколонку, содержащую 100 мг хелатообразующего сорбента, со скоростью 1–5 мл/мин. Установлено, что оптимальная скорость потока составляет 1.0 мл/мин, а при ее увеличении степень извлечения снижается. Сорбированные ионы количественно извлекаются из сорбента при скорости потока элюента 1–5 мл/мин. В дальнейшем в качестве элюента использовали 5 мл 2 М HNО3 (С1) и 5 мл 2 М HClО4 (С2) со скоростью потока 1 мл/мин.
Матричные влияния. Поскольку, морская вода помимо ионов тория(IV) содержит также ионы Na+, K+, Mg2+, Ca2+, Fe3+, Al3+, Cu2+, Mn2+, исследовали их влияние на сорбцию тория(IV). Результаты представлены в табл. 1. Видно, что основные макро- и микрокомпоненты заметно не влияют на извлечение тория(IV) разработанным методом.
Методика сорбционно-фотометрического определения тория(IV) в почве, загрязненной нефтью. Пробоподготовку почвы, загрязненной нефтью, проводят по следующей методике: 0.2 г почвы испаряют в графитовой чаше при 105°С, а затем прокаливают в муфельной печи при 550–650°С. Полученный пепел растворяют в смеси 8 мл конц. HF + 3 мл конц. HCl + 1 мл конц. HNO3. Для полного удаления HF полученную массу обрабатывают 3–4 раза конц. HNO3 при 50–60°С. Полученный осадок растворяют в дистиллированной воде и переносят в колбу емк. 1000 мл, добавляют HNO3 до определенного рН и разбавляют дистиллированной водой до метки. Концентрацию Th(IV) определяют фотометрическим методом.
Правильность методики проверяли сопоставлением с результатами анализа методом α-спектроскопии: в почве, загрязненной нефтью, после предварительного концентрирования сорбентом найдено по предложенной методике 516 ± 2 мкг/г тория(IV), методом α-спектроскопии (Alpha Analyst, Canberra) –520 ± 1 мкг/г (n = 5, P = 0.95).
* * *
Таким образом, показана возможность использования сополимера малеинового ангидрида со стиролом, модифицированного 2,4-диамино-6-фенилтриазином-1,3,5 и 2-амино-4-хлор-6-сульфофенолом, для сорбционно-фотометрического определения тория(IV). Указанные сорбенты характеризуются улучшенными сорбционными свойствами (сорбционная емкость, продолжительность анализа, температура концентрирования, влияние посторонних ионов на сорбцию) по сравнению с известными [1–6]. Возможно их повторное использование после регенерации.
Список литературы
Krishna D.G., Devi Ch.K. Determination of thorium(IV) in presence of micellar medium using 4-hydroxy 3,5-dimethoxy benzaldehyde-4-hydroxy benzoylhydrazone by spectrophotometry // Int. J. Chem. Sci. Technol. 2012. V. 2. P. 29.
Shiri S., Delpisheh A., Haeri A., Poornajaf A., Khezeli T., Badkiu N. Floatation-spectrophotometric determination of thorium, using complex formation with Eriochrome Cyanine R. // Anal. Chem. Insights. 2011. V. 6. P. 1.
Zhou K., Liu Y., Yang Z., Liu H., Xie T. High-capacity sorption of U(VI) from aqueous solution using a bio-based oxidized polymeric material // J. Taiwan Inst. Chem. Eng. 2016. V. 63. P. 453.
Hallaji H., Keshtkar A.R., Moosavian M.A. A novel electrospun PVA/ZnO nanofiber adsorbent for U(VI), Cu(II) and Ni(II) removal from aqueous solution // J. Taiwan Institute of Chemical Engineers. 2015. V. 46. P. 109.
Fawwaz I.K., Najla’a H.S., Shaybe M.M. Sorption of uranium(VI) and thorium(IV) by jordanian bentonite // J. Chem. V. 2013. (Article ID 586136).
Guerra D.L., Viana R.R., Airoldi C. Adsorption of thorium(IV) on chemically modified amazon clays // J. Braz. Chem. Soc. 2009.V. 20. № 6. P. 1164.
Пирогов А.В., Левкина В.В., Овинова Е.А., Савицкая В.Ю., Дьячков И.А., Смоленков А.Д., Ананьева И.А., Попик М.В., Шпигун О.А. Применение микроэмульсий для определения тетрафенилолова методом высокоэффективной жидкостной хроматографии со спектрофотометрическим детектированием // Журн. аналит. химии. 2019. Т. 74. № 6. С. 403. (Pirogov A.V., Levkina V.V., Ovinova E.A., Savitskaya V.Yu., Dyachkov I.A., Smolenkov A.D., Ananyeva I.A., Popik M.V., Shpigun O.A. The use of microemulsions for the determination of tetraphenyltin by high performance liquid chromatography with spectrophotometric detection // J. Analyt. Chem. 2019. V. 74. № 6. P. 403.)
Каменцев М.Я., Каменцев Я.С., Москвин Л.Н., Якимова Н.М. Совершенствование методов on-line концентрирования при капиллярно-электрофоретическом определении ионов металлов // Журн. аналит. химии. 2010. Т. 65. № 7. С. 707. (Kamentsev M.Ya., Kamentsev Ya.S., Moskvin L.N., Yakimova N.M. Improvement of on-line concentration methods for capillary-electrophoretic determination of metal ions // J. Analyt. Chem. 2010. V. 65. № 7. P. 707.)
Харлямов Д.А., Насыров И.А., Зиннатов Р.Р., Сиппель И.Я., Шайхиев И.Г. Сорбционное концентрирование ионов меди и свинца магнитным сорбентом // Вестн. технол. ун-та. 2015. Т. 18. № 13. С. 239. (Kharlyamov D.A., Nasyrov I.A., Zinnatov R.R., Sippel I.Ya., Shaikhiev I.G. Sorption concentration of copper and lead ions by magnetic sorbent // Herald Univ. Technol. 2015. V. 18. № 13. P. 239.)
Упор Э., Мохаи М., Новак Д. Фотометрические методы определения следов неорганических соединений. М .: Мир, 1985. 359 с.
Магеррамов А.М., Гаджиева С.Р., Бахманова Ф.Н., Гамидов С.З., Чырагов Ф.М. Концентрирование урана(VI) хелатообразующим сорбентом и фотометрическое определение с 2,3,4-тригидрокси-3'-нитро-4'-сульфоазобензолом // Журн. аналит. химии. 2011. 66. № 5. С. 480. (Magerramov A.M., Gadzhieva S.R., Bakhmanova F.N., Gamidov S.Z., Chyragov F.M. Preconcentration of uranium(VI) on a chelating adsorbent followed by photometric determination with 2,3,4-trihydroxy-3'-nitro-4'-sulfoazobenzene // J. Analyt. Chem. 2011. V. 66. № 5. P. 465.)
Басаргин Н.Н., Магеррамов А.М., Гаджиева С.Р., Бахманова Ф.Н., Гамидов С.З., Алиева Т.И., Чырагов Ф.М. Определение урана(VI) в природных водах после предварительного концентрирования сорбентом содержащим фрагменты м-амино фенола // Журн. аналит. химии. 2013. Т. 68. № 2. С. 136. (Basargin N.N., Magerramov A.M., Gadzhieva S.R., Bahmanova F.N., Gamidov S.Z., Alieva T.I., Chyragov F.M. Determination of uranium(VI) in natural waters after preconcentration on adsorbent containing m-aminophenol fragments // J. Analyt. Chem. 2013. V. 68. № 2. P. 123.)
Алиева Р.А., Мирзаи Дж.И., Абдуллаева К.С., Бахманова Ф.Н., Гамидов С.З., Чырагов Ф.М. Сорбционно-фотометрическое определение молибдена(VI) с 2,3,4-триокси-4'-фторазобензолом и 1,10-фенантролином в природных водах // Заводск. лаборатория. Диагностика материалов. 2014. Т. 80. № 1. С. 15. (Alieva R.A., Mirzai J.I., Abdullaeva K.S., Bahmanova F.N., Hamidov S.Z., Chyragov F.M. Sorption-photometric determination of molybdenum (VI) with 2,3,4-trioxy-4'-fluoroazobenzene and 1,10-phenanthroline in natural waters // Industrial Laboratory. Diagnostics of Materials. 2014. V.80. № 1. P. 15.)
Hajiyeva S.R., Bahmanova F.N., Alirzaeva E.N., Shamilov N.T., Chyragov F.M. Preconcentration of uranium(VI) by chelateforming sorbent and its photometric determination with 2,2',3,4-tetrahydroxy-3'-sulpho-5'-chlorazobenzol // Sohag J. Sci. 2016. 1. № 1. P. 1.
Гаджиева С.Р., Бахманова Ф.Н., Алирзаева Э.Н., Шамилов Н.Т., Чырагов Ф.М. Концентрирование урана хелатообразующим сорбентом на основе сополимера малеинового ангидрида со стиролом // Радиохимия. 2018. Т. 60. № 2. С. 175. (Hajiyeva S.R., Bahmanova F.N., Alirzaeva E.N., Shamilov N.T., Chyragov F.M. Uranium preconcentration with a chelating sorbent based on maleic anhydride-styrene copolymer // Radiochemistry. 2018. V. 60. № 2. P. 175.)
Магеррамов А.М., Алиева Р.А., Алиева З.М., Бахманова Ф.Н., Чырагов Ф.М. Концентрирование тория(IV) хелатообразующим сорбентом // Заводск. лаборатория. Диагностика материалов. 2018. Т. 84. № 3. С. 21. (Maharramov A.M., Alieva R.A., Aliyeva Z.M., Bahmanova F.N., Chyragov F.M. Concentration of thorium(IV) with a chelating sorbent // Industrial Laboratory. Diagnostics of Materials. 2018. V. 84. № 3. P. 21.)
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Наука, 1964. 261 с.
Гамбаров Д.Г. Новый класс фотометрических реагентов – азосоединения на основе пирогаллола. Дис. … докт. хим. наук. М., 1984. 295 с.
Алиева Р.А., Велиев В.Н., Гамидов С.З., Чырагов Ф.М. // Химические проблемы. 2006. № 3. С. 496.
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим и спектрофотометрическим методом анализа. Л.: Химия, 1972. 407 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


