Журнал аналитической химии, 2020, T. 75, № 9, стр. 771-776
Экстракционное вымораживание кофеина из водных растворов в условиях действия поля центробежных сил
В. Н. Бехтерев *
Сочинский государственный университет, Инженерно-экологический факультет
354000 Сочи, ул. Пластунская, 94, Россия
* E-mail: vic-bekhterev@yandex.ru
Поступила в редакцию 22.11.2019
После доработки 12.03.2020
Принята к публикации 24.03.2020
Аннотация
Изучено влияние рН среды, соотношения объемов экстрагента и воды на эффективность извлечения кофеина ацетонитрилом из водных растворов методом экстракционного вымораживания в условиях действия поля центробежных сил. Результаты могут быть объяснены с позиций ранее предложенной теоретической модели процесса. Наибольшая степень извлечения кофеина достигнута при рН 6−7. Минимальная определяемая концентрация кофеина в воде составила 0.015 мкг/мл.
Использование методов жидкостной экстракции в химическом анализе обычно связано с задачами устранения мешающего влияния матрицы объекта и концентрирования аналитов [1–3]. Существует потребность в расширении арсенала методов выделения растворимых, в том числе полярных и ионогенных, органических веществ из водных сред, обусловленная необходимостью повышения эффективности их экстракции, снижения химического и термического воздействия на исследуемый образец (исключение высаливания, перегонки, упаривания), сокращения стадий (фильтрование, обезвоживание экстрактов), улучшения экономических показателей.
Предложенный в 2005 г. способ извлечения растворимых органических соединений из водосодержащих сред [4], сочетающий экстракцию с вымораживанием и получивший название “экстракционное вымораживание” (ЭВ) [5, 6], успешно решает большинство из указанных выше задач. К настоящему времени ЭВ уже используют в ряде методик химического анализа [7–12]. Для выделения биологически активных веществ (БАВ) предложен лабораторный регламент выделения сапонинов из корней иглицы понтийской [13].
Установленные закономерности извлечения карбоновых кислот и фенолов с помощью ЭВ объяснены в рамках предложенной теоретической модели [5, 6]. Она базируется на механизме перераспределения аналита между предварительно добавленным незамерзающим растворителем (экстрагентом) и образующейся во время снижения температуры поверхностью кристаллической фазы льда. В результате, получено выражение (1), связывающее концентрацию целевого компонента в экстракте сorg с его исходной массой в пробе mo и объeмом экстрагента Vextr:
(1)
${{c}_{{{\text{org}}}}} = ({{K}_{{{\text{eq}}}}}\beta {\text{/}}\alpha )({{m}_{{\text{o}}}}{\text{/}}{{V}_{{{\text{extr}}}}}) = *{{K}_{{{\text{eq}}}}}({{m}_{{\text{o}}}}{\text{/}}{{V}_{{{\text{extr}}}}}),$В итоге появилась возможность количественной оценки эффективности извлечения того или иного вещества экстракционным вымораживанием из водных растворов с помощью введенного параметра *Keq. По сути, он является коэффициентом распределения аналита между объемом жидкого экстрагента и поверхностью льда, поскольку пропорционален константе адсорбционно-десорбционного равновесия Keq. Например, установлено, что в гомологическом ряду одноосновных карбоновых кислот С2–С8 рост гидрофобности с удлинением молекулы кислоты сопровождается увеличением коэффициента распределения *Keq [5, 9]. Как показало дальнейшее развитие метода, существенному возрастанию коэффициента распределения *Keq аналита между жидкой фазой экстракта и формирующейся поверхностью льда, а следовательно, и повышению эффективности его экстракции, также способствует осуществление процесса в условиях действия поля центробежных сил [14–16].
Исследование корреляций и установление закономерностей экстракции является неотъемлемым этапом раскрытия возможностей метода и оптимизации процедуры пробоподготовки. Это важно также для прогнозирования поведения экстракционных систем. В настоящей работе изучали влияние рН и ряда других параметров на эффективность извлечения кофеина из водных растворов экстракционным вымораживанием в условиях действия центробежных сил (ЭВЦ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Реагенты. Использовали кофеин х. ч. (ООО “Люмэкс”, С.-Петербург, Россия); ацетонитрил “сорт 0” (ООО “НПК Криохром”, С.-Петербург, Россия).
Аппаратура. Для приготовления модельных и стандартных растворов кофеина в диапазоне концентраций от 0.2 до 4520 мкг/мл, определения массы получаемого экстракта применяли аналитические весы ЛВ-210-А (ЗАО “Сартгосм”, С.-Петербург, Россия) с погрешностью взвешивания, не превышающей 0.5 мг.
Получаемые экстракты и стандартные смеси исследовали методом газовой хроматографии на хроматографе Кристаллюкс-4000М с термоионным детектором (ГХ-ТИД) (ООО НПФ “Мета-Хром”, Йошкар-Ола, Россия) и капиллярной колонкой ZB-5 длиной 30 м, внутренним диаметром 0.32 мм (Phenomenex, США).
Методика эксперимента. Процедура экстракционного вымораживания в условиях действия поля центробежных сил (ЭВЦ) детально описана нами ранее [16, 17]. Исследуемый образец модельного водного раствора кофеина готовили добавлением к определенному объему воды в стеклянной виале емк. 12 мл при заданном значении рН необходимого количества стандартного раствора аналита в ацетонитриле. Затем добавляли определенное количество ацетонитрила, используемого в качестве экстрагента. Объем растворителя, вносимый со стандартным раствором кофеина, учитывали в расчетах при обработке результатов экстракции. Регулировали значение рН добавлением серной кислоты и раствора гидроксида натрия. Флакон герметично закрывали завинчивающейся пробкой, перемешивали и помещали в ротор криоэкстрактора [17] для вымораживания водной части образца. Условия проведения ЭВЦ: температура –(29 ± 2)°С, скорость вращения ротора 4000 об./мин (центробежное ускорение 1650 g), продолжительность процедуры 25 мин. После описанного этапа верхний жидкий ацетонитрильный слой отделяли декантацией, взвешивали и подвергали ГХ-ТИД-анализу. Известно [18], что кофеин можно определять методами ВЭЖХ и ГХ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кофеин (1,3,7-триметилпурин-2,6-дион) – пуриновый алкалоид, довольно широко представленный в растительном мире. Благодаря биологической активности, он часто применяется в современной медицине [19]. Наличие в молекулярной структуре кофеина трех атомов азота аминного характера позволило отнести его к группе слабых органических оснований [18]. В таком случае, исходя из известных принципов экстракции, лучше он должен извлекаться из щелочной среды [20, 21], когда находится в растворе в молекулярной форме. Вместе с тем по данным [18] кофеин из водных растворов экстрагируют хлороформом и при рН 2.
Ранее при извлечении ацетонитрилом одноосновных карбоновых кислот С2–С8 методом ЭВ установлено [22], что рН среды существенным образом влияет на эффективность их экстракции. При переходе из кислой в щелочную среду степень извлечения каприловой кислоты снижается более чем в 10 раз, а в случае уксусной – в 150 раз. Это связано с подавлением электролитической диссоциации органических кислот в кислой среде, что способствует их локализации в органической жидкой фазе экстракта.
В данной работе исследовано влияние рН на эффективность извлечения кофеина с помощью ЭВЦ. Как видно из графиков 1 и 2 на рис. 1, переход от нейтральной среды к кислой при прочих равных условиях сопровождается значительным снижением величины наклона линейной зависимости сorg от mo/Vextr (тангенс угла наклона с 0.87 до 0.30). В используемой модели это эквивалентно уменьшению коэффициента распределения *Keq аналита между объемом жидкого экстракта и поверхностью образующейся кристаллической фазы льда, т.е. снижению эффективности экстракции. Рост сорбции кофеина на поверхности льда при переходе от нейтральной к кислой среде с учетом его основных свойств согласуется с известными закономерностями для сорбционных процессов на полярных фазах [23].
Рис. 1.
Зависимость концентрации кофеина в экстракте сorg от его исходной массы mo в воде и объема ацетонитрила Vextr в результате ЭВЦ: мольная доля ацетонитрила в воде 0.027, температура –(29 ± 2)°С, скорость вращения ротора 4000 об./мин, продолжительность процедуры ЭВЦ 25 мин. 1 – рН 6–7; 2 – рН 2; 3 – рН 10.
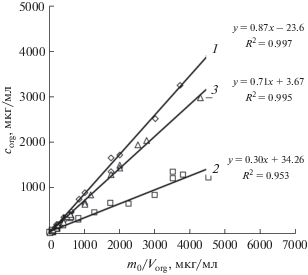
Наличие основных свойств у кофеина позволяет также объяснить полученные результаты его ЭВЦ из водных растворов при переходе от кислой среды к щелочной. Из сравнения графиков 2 и 3 рис. 1 следует, что наклон линейной зависимости сorg от mo/Vextr, полученной в условиях ЭВЦ из кислой среды, существенно ниже, чем при рН 10, при котором тангенс угла наклона составил 0.71.
Сравнение линейных зависимостей 1 и 3 рис. 1 свидетельствует о том, что в нейтральной среде коэффициент *Keq при извлечении кофеина методом ЭВЦ из воды в ацетонитрил больше, чем в щелочной (рН 10). Следовательно, в щелочной среде, как и в кислой, кофеин сильнее сорбируется на поверхности льда по сравнению с нейтральной. Подобный эффект не зафиксирован при изучении влияния рН на степень концентрирования одноосновных органических кислот С2–С8 методом ЭВ [22]. Кроме того, известно [24], что в широком диапазоне рН 3−10 сорбция кофеина из водных растворов на различных по природе сорбентах не меняется.
Полученные результаты свидетельствуют о том, что зависимость сорбции кофеина на поверхности льда во время ЭВЦ от рН не имеет монотонного характера, как на обычных сорбентах, а проходит через минимум при рН 6−7. Поскольку структура льда, а следовательно, и его сорбционные свойства, формируются в процессе ЭВЦ, можно предположить, что этот эффект, по-видимому, связан с изменением структуры льда в зависимости от рН. Это в свою очередь приводит к изменению сорбционных свойств кристаллической поверхности льда, зависящих от целого ряда параметров, в том числе от формы кристаллов, структуры твердой фазы. Например, методом оптической микроскопии на примере различных классов органических веществ показано [25], что их добавление в воду существенно меняет форму и размеры микрочастиц льда, способствует или препятствует образованию микротрещин в его структуре.
Детальное изучение установленного факта не являлось предметом настоящего исследования. Вместе с тем данное обстоятельство следует принимать во внимание при разработке методики определения кофеина с помощью ЭВЦ в различных объектах, в том числе биологических. Ранее установлено [11–13], что применение ЭВЦ на стадии извлечения целевых компонентов из биологических, в том числе растительных, проб существенно снижает фон соэкстрактивных веществ. Использование в настоящей работе ГХ-ТИД способствует как повышению селективности, так и снижению пределов определения кофеина. Минимальная определяемая концентрация кофеина в стандартном растворе составила 0.2 мкг/мл. Степень его концентрирования при извлечении из водных растворов в ацетонитрил в результате одной процедуры ЭВЦ достигала 17.4 при соотношении объемов водного раствора и экстрагента 10 : 0.5 (мольная доля ацетонитрила в воде 0.017). Дополнительно установлено, что применение метода ЭВЦ в сочетании с ГХ-ТИД позволяет снизить предел определения кофеина в воде до уровня 0.015 мкг/мл. Очевидно, что с учетом перечисленных выше достигнутых параметров концентрирования из водных растворов, а также относительно высокого природного содержания кофеина, например в чае, есть все предпосылки создания экспресс-метода его определения.
Из фазовой диаграммы системы ацетонитрил–вода [26] следует, что во время процедуры ЭВЦ при температуре –(28−30)°С выделяющийся в отдельную жидкую фазу незамерзающий ацетонитрил содержит не более 4% воды. Если пренебречь ее присутствием в экстракте, то можно для концентрации аналита в экстракте записать следующее выражение:
где morg – масса аналита в ЭВЦ-экстракте, мкг.В таком случае, принимая во внимание выражение (1), можно записать:
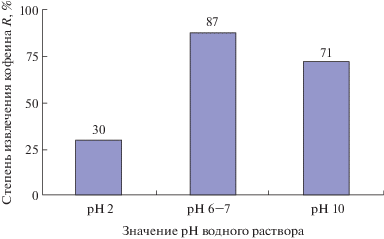
где R – степень извлечения.Иными словами, коэффициент распределения аналита *Keq между объемом образующегося экстракта и поверхностью кристаллической фазы льда во время ЭВЦ в этих условиях фактически равен доле целевого вещества (R), перешедшего из воды в ацетонитрильный экстракт, т.е. степени извлечения аналита. Таким образом, в рамках сделанных допущений степень извлечения кофеина из воды ацетонитрилом в изученных диапазонах концентраций и соотношений отдающей и принимающей фаз при рН 2 составляет примерно 30%, при рН 10 не превышает 71%, а в случае нейтральных условий ЭВЦ – 87% соответственно (рис. 2).
Рис. 2.
Зависимость степени извлечения кофеина в ацетонитрил в результате процедуры ЭВЦ от рН водного раствора: мольная доля ацетонитрила в воде 0.027.
Ранее полученные величины *Keq > 1 для карбоновых кислот С4–С8 [27] позволили сделать вывод, что при ЭВЦ ацетонитрилом из воды также играет роль их поверхностная активность в отношении границы раздела ацетонитрильного экстракта с газовой фазой (воздух). Данный эффект проявляется в превышении найденных экспериментально степеней концентрирования указанных кислот по сравнению с теоретическими. Учитывая это, можно полагать, что поверхностная активность кофеина меньше по сравнению с карбоновыми кислотами, поскольку *Keq < 1. Следовательно, установленные в настоящем исследовании закономерности связаны с факторами, лежащими в основе механизма ЭВЦ.
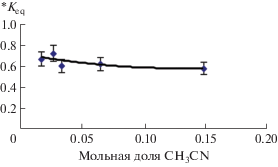
Соотношение объемов воды и ацетонитрила в исходной смеси в процессе ЭВЦ кофеина слабо влияет на величину *Keq. Как видно из рис. 3, уменьшение мольной доли экстрагента ацетонитрила в образце с 0.15 (объемное отношение воды и ацетонитрила 2 : 1) до 0.017 (объемное отношение воды и ацетонитрила 10 : 0.5) сопровождается несущественным возрастанием коэффициента распределения *Keq с 0.58 до 0.67. Вместе с тем необходимость снижения доли экстрагента в экстракционной системе на практике обусловлена как стремлением увеличить степень концентрирования, так и его экономией. Это актуально и с точки зрения повышения экологичности метода анализа, поскольку снижает количество токсичных отходов (растворителей).
Рис. 3.
Зависимость коэффициента распределения *Keq кофеина от мольной доли экстрагента (ацетонитрила) в исходной смеси при ЭВЦ: температура –(29 ± 2)°С, 4000 об/мин, продолжительность процедуры ЭВЦ 25 мин, рН 10.
Ранее установлено [16, 27], что осуществление ЭВ в условиях действия центробежных сил существенно сокращает количество трещин и дефектов в структуре льда. Образуется более прозрачная, монокристаллическая твердая фаза льда. В результате растет доля жидкого ацетонитрильного экстракта, которую можно отделить от застывшей части образца. Удалость достичь объемного соотношения вода–ацетонитрил (10 : 0.4), а следовательно, и высокой степени концентрирования аналита в экстракте. Например, даже для пропионовой кислоты получено 24-кратное концентрирование за один цикл ЭВЦ. Вместе с тем в представленном исследовании на большом массиве экспериментальных данных (более 200 опытов) показано, что, как и в случае ЭВ без центрифугирования образца, доля экстракта, которая остается в объеме льда, довольно значительна. Как видно из табл. 1, она частично снижается с увеличением относительного содержания ацетонитрила в экстракционной системе, но в указанных условиях ЭВЦ больше половины объема экстракта, тем не менее, остается в твердой фазе. Некоторая его часть, очевидно, втягивается за счет капиллярных сил в область между образцом и стенками виалы, чего нельзя избежать. Следовательно, перспективы развития метода связаны, прежде всего, с поиском условий ЭВЦ, сокращающих потери экстракта в объеме льда. Предварительные исследования показали [15], что одним из эффективных для этого параметров может стать величина поля центробежных сил.
Таблица 1.
Доля экстракта, остающегося в объеме льда после однократной процедуры экстракционного вымораживаниям в условиях действия центробежных сил*, в зависимости от соотношения ацетонитрила и воды в исходном образце
| Соотношение объемов CH3СN и H2O, мл | Мольная доля CH3СN в образце | Масса получаемого экстракта, г | Объем** получаемого экстракта, мл | Потери экстракта в объеме льда*** | |
|---|---|---|---|---|---|
| мл | % | ||||
| 1 : 2 | 0.148 | 0.290 ± 0.009 | 0.285 | 0.715 | 71.5 |
| 3.5 : 7 | 0.148 | 1.190 ± 0.008 | 1.491 | 2.009 | 57.4 |
| 1.75 : 8.75 | 0.065 | 0.470 ± 0.007 | 0.592 | 1.158 | 66.2 |
| 1 : 10 | 0.033 | 0.280 ± 0.008 | 0.352 | 0.648 | 64.8 |
| 0.778 : 9.72 | 0.027 | 0.130 ± 0.009 | 0.168 | 0.611 | 78.5 |
| 0.5 : 10 | 0.017 | 0.09 ± 0.01 | 0.111 | 0.389 | 77.8 |
* Температура экстракции –(30 ± 2)°С, скорость вращения ротора 4000 об/мин, продолжительность процедуры ЭВЦ 25 мин, рН 10. ** Вычисляли с учетом плотности раствора воды в ацетонитриле, используя данные [28]. *** Без учета содержания воды в экстракте (4%).
* * *
Таким образом, установлено, что рН влияет на эффективность извлечения кофеина из водных растворов методом ЭВЦ, причем эффективность экстракции максимальна из нейтральной среды. Степень извлечения при рН 6−7 достигает 87%. Развитие метода связано с дальнейшей оптимизацией параметров технологии ЭВЦ и, в частности, изучением влияния величины поля центробежных сил на степень концентрирования.
Список литературы
Raynie D.E. Modern extraction techniques // Anal. Chem. 2006. V. 78. № 12. P. 3997.
Цизин Г.И. Развитие методов концентрирования микрокомпонентов в России (1991–2010 гг.) // Журн. аналит. химии. 2011. Т. 66. № 11. С. 1135. (Tsysin G.I. Method of the preconcentration of trace components: development in Russia (1991–2010) // J. Analyt. Chem. 2011. V. 66. № 11. P. 1020.)
Золотов Ю.А. Успехи в подготовке проб // Журн. аналит. химии. 2013. Т. 68. № 9. С. 835.
Бехтерев В.Н. Способ извлечения органических веществ из водных сред экстракцией в сочетании с вымораживанием. Патент на изобретение № 2 303 476 РФ // Б. и. 2007. № 21. Приоритет 27.04.2005.
Bekhterev V.N. Extractive freezing-out in the analysis of organic compounds in the aqueous mediums // Mendeleev Comm. 2007. V. 17. P. 241.
Бехтерев В.Н. Выделение фенолов из воды экстракционным вымораживанием // Журн. аналит. химии. 2008. Т. 63. № 10. С. 1045. (Bekhterev V.N. Recovery of phenols from water by extraction freezing // J. Analyt. Chem. 2008. V. 63. № 10. P. 950.)
Бехтерев В.Н., Гаврилова С.Н., Маслаков И.В. Использование экстракционного вымораживания для анализа 1,4-бензодиазепинов в моче // Судебно-медицинская экспертиза. 2007. № 2. С. 32.
Бехтерев В.Н., Гаврилова С.Н., Козина Е.П., Маслаков И.В. Экспресс-определение кофеина в крови методом экстракционного вымораживания // Судебно-медицинская экспертиза. 2010. № 5. С. 22.
Бехтерев В.Н. Определение одноосновных карбоновых кислот С2−С6 в воде методом парофазной экстракции в сочетании с экстракционным вымораживанием // Заводск. лаборатория. Диагностика материалов. 2010. № 3. С. 17.
Бехтерев В.Н., Кабина Е. А., Мищенко И. В. Определение консервантов в пищевых жировых композициях методом высокоэффективной жидкостной хроматографии с экстракционным вымораживанием // Прикладная аналитическая химия. 2014. № 1. С. 10.
Bekhterev V.N., Malyarovskaya V.I. Rapid HPLC method for scopoletine determination in Weigela leaves based on one-step sample preparation by extractive freezing-out // Mendeleev Commun. 2019. V. 29. P. 592.
Бехтерев В.Н., Гаврилова С.Н., Шипанов И.Н. Применение экстракционного вымораживания на этапе предварительной подготовки биопроб в ГХ-МС химико-токсикологическом анализе // Судебно-медицинская экспертиза. 2019. № 6. С. 53.
Бехтерев В.Н., Маляровская В.И. Экстракционное вымораживание в качестве нового технологического подхода к получению растительных биологически активных веществ // Изв. вузов. Прикл. химия и биотехнол. 2018. Т. 8. № 4. С. 73.
Бехтерев В.Н. Способ извлечения органических веществ из водных сред экстракционным вымораживанием в поле центробежных сил. Патент на изобретение № 2564999 РФ // Б. и. 2015. № 28. Приоритет 14.04.2014.
Bekhterev V.N. A method of recovery of organic substances from aqueous media by freeze-out extraction under the action of a centrifugal force. Patent EP3357873 06.11.2019. // European Patent Bulletin. 2019. № 45. P. 940. Priority date 28.09.2015.
Бехтерев В.Н. Экстракционное вымораживание одноосновных карбоновых кислот из воды в ацетонитрил в условиях действия центробежных сил // Журн. физ. химии. 2016. Т. 90. № 10. С. 1558. (Bekhterev V.N. Freeze-out extraction of monocarboxylic acids from water into acetonitrile under the action of centrifugal forces // Russ. J. Phys. Chem. A. 2016. V. 90. № 10. P. 2055.)
Бехтерев В.Н. Устройство для экстракционного вымораживания органических веществ из жидких сред в условиях действия центробежных сил. Патент на полезную модель № 185933 РФ // Б. и. 2018. № 36. Приоритет 29.06.2017.
Вергейчик Т.Х. Токсикологическая химия: учебник / Под ред. Вергейчика Е.Н. М.: МЕДпресс-информ, 2009. 400 с.
Химическая энциклопедия. В 5-ти тт. М.: Советская энциклопедия, 1998. Т. 2. С. 487.
Dyke T.M., Sams R.A. Detection and determination of theobromine and caffeine in urine after administration of chocolate-coated peanuts to horses // J. Anal. Toxicol. 1998. V. 22. P. 112.
ГОСТ Р 51182-98. Кофепродукты. Методика выполнения измерений массовой доли кофеина. М.: ГОССТАНДАРТ России, 2003. 8 с.
Бехтерев В.Н. Закономерности поведения растворенных органических веществ в условиях экстракционного вымораживания // Журн. аналит. химии. 2011. Т. 66. № 6. С. 608. (Bekhterev V.N. Trend in the behavior of dissolved organic substances under conditions of freeze extraction // J. Analyt. Chem. 2011. V. 66. № 6. С. 591.)
Киселев А.В., Пошкус Д.П., Яшин Я.И. Молекулярные основы адсорбционной хроматографии. М.: Химия, 1986. 272 с.
Дмитриенко С.Г., Андреева Е.Ю., Толмачева В.В., Терентьева Е.А. Особенности сорбции метилксантинов сорбентами различной природы // Журн. физ. химии. 2013. Т. 87. № 5. С. 874. (Dmitrienko S.G., Andreeva E.Yu., Tolmacheva V.V., Terent’eva E.A. Sorption of methylxanthines by different sorbents // Russ. J. Phys. Chem. A. 2013. Т. 87. № 5. P. 856.)
Андреев А.А., Садикова Д.Г., Ивличева Н.А., Борода А.В. Формирование микрочастиц льда в криозащитных растворах // Биофизика. 2017. Т. 62. № 2. С. 213. (Andreev A.A., Sadikova D.G., Ivlicheva N.A., Boroda A.V. Formation of ice microparticles in cryoprotective solutions // Biophysics. 2017. Т. 62. № 2. С. 151.)
Schneider G.M. Aqueous solutions at pressures up to 2 GPa: gas–gas equilibria, closed loops, high-pressure immiscibility, salt effects and related phenomena // Phys. Chem. Chem. Phys. 2002. V. 4. P. 845.
Бехтерев В.Н. Экстракционное вымораживание карбоновых кислот из водного раствора в ацетонитрил в условиях действия поля центробежных сил // Сорбционные и хроматографические процессы. 2015. Т. 15. № 5. С. 683.
Gagliardi L.G., Castells C.B., Rafols C., Roses M., Bosch E. Static dielectric constants of acetonitrile/water mixtures at different temperatures and Debye-Huckel A and a0B parameters for activity coefficients // J. Chem. Eng. Data. 2007. V. 52. P. 1103.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


