Журнал аналитической химии, 2020, T. 75, № 9, стр. 834-843
Последовательное инжекционное амперометрическое определение глюкозы, инсулина, холестерина и мочевой кислоты на электродах, модифицированных частицами никеля и кобальта
Л. Г. Шайдарова a, *, И. А. Челнокова a, И. А. Гафиатова a, А. В. Гедмина a, Г. К. Будников a
a Казанский федеральный университет, Химический институт им. А.М. Бутлерова
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: larisashaidarova@mail.ru
Поступила в редакцию 17.01.2020
После доработки 04.03.2020
Принята к публикации 11.03.2020
Аннотация
Установлено, что электроосажденные на поверхности планарных углеродных электродов (ПЭ) частицы никеля (Ni-ПЭ) обладают каталитической активностью при электрокислении глюкозы, инсулина и холестерина (ХС) в щелочной среде, а частицы кобальта (Co-ПЭ) – при окислении ХС, инсулина и мочевой кислоты (МК) в нейтральной среде. При регистрации аналитического сигнала в последовательной инжекционной системе с амперометрическим детектированием билогарифмическая зависимость тока от концентрации аналита, полученная на электроде Ni-ПЭ, линейна в диапазоне от 5 × 10–6 до 5 × 10–2 М для глюкозы, от 1 × 10–6 до 1 × 10–4 М для инсулина, от 5 × 10–6 до 5 × 10–3 М для ХС, а на электроде Co-ПЭ – от 5 × 10–7 до 5 × 10–3 М для ХС, от 5 × 10–8 до 5 × 10–4 М для инсулина, от 5 × 10–8 до 5 × 10–3 М для МК. Показано, что использование двухдетекторной системы и модифицированных двойных планарных электродов позволяет селективно определять рассматриваемые биологически активные соединения в сыворотке крови.
В последние годы последовательный инжекционный анализ (ПослИА) все чаще используют для определения маркеров заболеваний в биологических жидкостях человека благодаря низкому пределу обнаружения и высокой селективности. Контроль уровней глюкозы и инсулина необходим для диагностики и лечения сахарного диабета [1]. Известно, что данное заболевание сопровождается повышенным уровнем холестерина (ХС) и заболеваниями мочевыводящих путей, почек и печени вследствие нарушенного обмена МК [2, 3]. Кроме того, в организме больного сахарным диабетом из-за нарушенного обмена веществ понижен уровень аскорбиновой кислоты. Разработка экспрессных и селективных способов определения рассматриваемых биологически активных соединений (БАС) представляет большой интерес для медицинской диагностики.
Среди методов определения глюкозы, инсулина, ХС и мочевой кислоты (МК) в клинической диагностике можно выделить химические [4, 5], спектральные [6–8], хроматографические [6, 9–11] и электрохимические [12–16]. Химические и спектральные методы отличаются недостаточными чувствительностью и селективностью, а хроматографические – длительностью анализа и дорогим оборудованием. По сравнению с ними ПослИА в сочетании с амперометрическими детекторами на основе химически модифицированных электродов (ХМЭ) с электрокаталитическими свойствами позволяет проводить высокочувствительный, селективный и экспрессный многокомпонентный анализ.
В настоящей работе изучена возможность селективного одновременного определения глюкозы, инсулина, ХС и МК в последовательной инжекционной (ПослИ) системе с амперометрическими детекторами на основе планарного углеродного электрода (ПЭ) или двойного планарного электрода (ДПЭ), модифицированных частицами кобальта и никеля.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Циклические вольтамперограммы и хронамперограммы регистрировали с помощью бипотенциостата μSTAT400 (DropSens, Испания). Использовали углеродные ПЭ и ДПЭ фирмы “DropSens” (Испания). Поверхность рабочих углеродных электродов модифицировали электроосажденными частицами никеля или кобальта. Электролитический осадок кобальта на поверхности рабочих ПЭ и ДПЭ получали методом потенциостатического электролиза из раствора, содержащего хлорид кобальта СoCl2 · 5H2O х.ч. (Aldrich, Германия) на фоне 0.1 М KNO3. Электроосаждение частиц никеля проводили из раствора, содержащего хлорид никеля NiCl2 · 6H2O х. ч. (Экофарм, Россия) на фоне 0.01 М H2SO4. Полимерную пленку из поли-2-винилпиридина (ПВП) получали методом капельного нанесения и последующего испарения растворителя.
Оксо-, гидроксоформы металла на поверхности осадков никеля и кобальта генерировали электрохимически путем многократного сканирования потенциала в щелочной среде для никеля и нейтральной для кобальта. Композитные полимерные электроды получали в две стадии: сначала на поверхность ПЭ осаждали частицы никеля, потом их покрывали пленкой из ПВП (ПВП-Ni-ПЭ).
Последовательная инжекционная система включала шприцевой насос, многоходовой кран, одну (рис. 1а) или две (рис. 1б) проточные электрохимические ячейки типа “wall-jet” с ПЭ или ДПЭ и бипотенциостат DropSens μSTAT400.
Рис. 1.
Схема последовательно-инжекционной системы с одним (а) или с двумя (б) детекторами: 1 – шприцевой насос, 2 – многоходовый кран, 3 – детектор.

Использовали растворы, содержащие глюкозу, инсулин, ХС, и МК х. ч. (Aldrich, Германия). Фоновым электролитом в статических условиях и потоком-носителем в проточной системе служили фосфатный буферный раствор (ФБ) и 0.1 М раствор NaOH.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
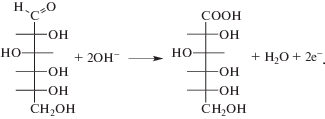
Рассматриваемые БАС по-разному проявляют электрохимическую активность на немодифицированном ПЭ. Так, окисление глюкозы на немодифицированном ПЭ в щелочной среде происходит необратимо в далекой области потенциалов Е > 1.20 В. При этом ациклическая структура молекулы глюкозы определяет ее редокс-свойства. Конечным продуктом окисления глюкозы является глюконовая кислота (уравнение (1)) [17]:
Инсулин на немодифицированном ПЭ в нейтральной и щелочной средах окисляется при Е > > 0.80 В с плохой воспроизводимостью вольт-амперных характеристик. При этом в молекуле инсулина окисляются фенольные группы в тирозиновом фрагменте (уравнение (2)) [18]:
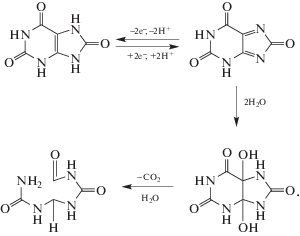
Мочевая кислота на немодифицированных углеродных электродах на фоне ФБ окисляется необратимо при потенциале 0.65 В с потерей 2 протонов и 2 электронов с образованием аллантоина (уравнение (3)) [19]:
Линейная зависимость тока окисления рассматриваемых БАС от их концентраций наблюдается в узком интервале концентраций: от 1 × 10–3 до 1 × 10–2 М для глюкозы, от 1 × 10–5 до 1 × 10–4 М для инсулина, от 5 × 10–4 до 5 × 10–3 М для МК.
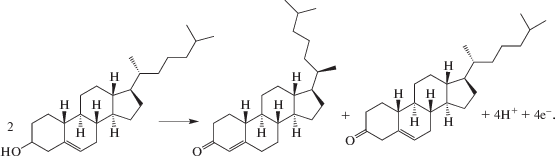
Холестерин на немодифицированных электродахв рассматриваемых условиях не окисляется.Обычно электроокисление ХС представляют следующей схемой (уравнение (4)) [20]:
Селективное определение рассматриваемых БАС при совместном присутствии затруднено, так как окисление этих соединений происходит при близких потенциалах, при этом регистрируемые пики перекрывают друг друга.
Для повышения селективности определения глюкозы, инсулина, ХС и МК использовали модификацию поверхности ПЭ. Ранее показано [12], что электрохимически генерированные оксо- и гидроксоформы никеля, осажденные на поверхности стеклоуглеродного электрода, обладают каталитической активностью при электроокислении глюкозы в щелочной среде. Представляло интерес оценить каталитическую активность этого модификатора по отношению к рассматриваемым БАС.
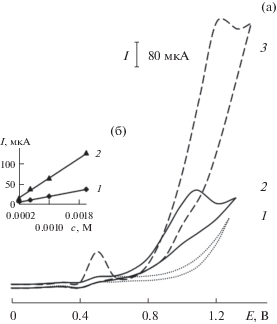
На циклической вольтамперограмме, полученной на электроде Ni-ПЭ после его электрохимической активации в щелочной среде, регистрируется пара анодно-катодных пиков, связанных с электроокислением гидроксоформ никеля(II) (рис. 2а). При окислении инсулина, глюкозы и ХС на этом ХМЭ наблюдаются максимумы тока при потенциалах 0.70, 1.20 и 1.35 В соответственно. Каталитический эффект, рассчитанный как отношение каталитического тока окислении инсулина, глюкозы и ХС на ХМЭ к току окисления модификатора, составил 6.7, 36.7 и 29.2 соответственно. Величина тока пика линейно зависит от концентрации органического соединения. В качестве примера на рис. 2а приведена вольтамперограмма окисления глюкозы, полученная на электроде Ni-ПЭ, и зависимость величины тока от концентрации глюкозы (рис. 2б).
Рис. 2.
(а) Вольтамперограммы, полученные на планарных электродах, модифицированных частицами никеля, на фоне 0.1 М NaOH в отсутствие (1) и в присутствии (2) глюкозы (c = 0.05 М); на планарном электроде, модифицированном композитом на основе частиц никеля и поли-2-винилпиридина, на фоне 0.1 М NaOH в растворе, содержащем инсулин (c = 1 × 10–4 М) и глюкозу (c = 0.05 М) (3). (б) Зависимости тока при Еп 1.2 В от концентрации глюкозы на планарных электродах, модифицированных частицами никеля (1) и композитом на основе частиц никеля и поли-2-винилпиридина (2).
Таким образом, каталитическая активность электрохимически генерированных оксо-, гидроксоформ никеля проявляется в многократном увеличении тока при потенциалах окисления модификатора и уменьшении потенциала окисления органического соединения на ХМЭ по сравнению с немодифицированным электродом.
Установлено, что в рассматриваемых условиях МК не окисляется на Ni-ПЭ, форма вольт-амперной кривой повторяет фоновую кривую. При совместном присутствии инсулина, глюкозы и ХС на анодной вольт-амперной кривой регистрируются два пика: при потенциале пика (Eп) 0.70 В происходит окисление инсулина, при Еп 1.25 В регистрируется суммарный пик окисления глюкозы и ХС. Для достижения селективности определения этих БАС использовали композитный пленочный электрод.
Известно, что в щелочной среде молекулы инсулина и глюкозы заряжены отрицательно, а молекула ХС нейтральна, поэтому, вероятно, нанесение анионобменной пленки из ПВП на поверхность Ni-ПЭ позволит селективно определить инсулин и глюкозу в присутствии ХС. Действительно, глюкоза и инсулин окисляются на ПВП-Ni-ПЭ, а ХС – нет. На циклической вольтамперограмме регистрируются максимумы тока при Еп 0.70 и 1.20 В, характерные для окисления инсулина и глюкозы соответственно (рис. 2а). Разность потенциалов пиков окисления инсулина и глюкозы при совместном присутствии составляет 500 мВ, что позволяет проводить совместное определение этих соединений. Высота пика окисления глюкозы на ПВП-Ni-ПЭ по сравнению с Ni-ПЭ увеличивается в 3 раза (рис. 2а).
Таким образом, для селективного определения глюкозы целесоообразно использовать ПВП-Ni-ПЭ. Для определения инсулина можно использовать Ni-ПЭ или ПВП-Ni-ПЭ, поскольку присутствие ХС не мешают его определению на обоих электродах.
При анодной поляризации Co-ПЭ в ФБ происходит окисление частиц кобальта с формированием оксо-, гидроксоформ Co(II) и Co(III), при этом на анодной ветви вольтамперограммы наблюдаются два максимума тока в области потенциалов от 0.60 до 1.30 В [21] (рис. 3а).
Рис. 3.
Вольтамперограммы, полученные в отсутствие (1) и в присутствии холестерина (c = 5 × 10–3 М) (2) на планарном электроде, модифицированном частицами кобальта, на фоне фосфатного буферного раствора с pH 6.9 (а); зависимости тока при Еп 1.35 В от скорости наложения потенциала (б) и концентрации холестерина (в).
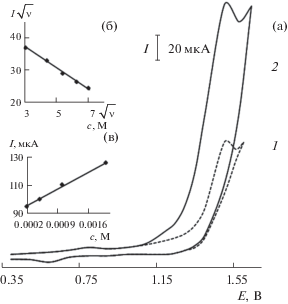
При окислении МК на Co-ПЭ на фоне ФБ на анодной ветви вольтамперограммы наблюдается пик тока при Eп 0.55 В, при окислении инсулина – при Еп 0.90 В, а ХС – при Еп 1.45 В. Каталитический эффект для МК, инсулина и ХС равен 8.0, 14.0 и 3.0 соответственно. Величина тока пика линейно зависит от концентрации органического соединения. Глюкоза в рассматриваемых условиях не окисляется. В качестве примера на рис. 3а приведена вольтамперограмма окисления XC на Co-ПЭ, на рис. 3б, в – зависимости величины тока от скорости сканирования потенциала и концентрации ХС соответственно.
При совместном присутствии инсулина, МК и ХС на анодной вольт-амперной кривой регистрируются три пика: при Eп 0.40 В происходит окисление инсулина, при Еп 0.70 В – МК и при Еп 1.35 В – ХС. Достигнутая разность потенциалов пиков окисления рассматриваемых БАС при совместном присутствии составляет 300–650 мВ, что позволяет селективно определять эти соединения в рассматриваемых условиях.
Таким образом, в щелочной среде возможно селективное определение глюкозы и инсулина в присутствии ХС на ПВП-Ni-ПЭ. Кроме того, эти соединения можно определить на разных электродах: глюкозу на ПВП-Ni-ПЭ, а инсулин на Ni-ПЭ. В нейтральной среде возможно селективное определение МК, инсулина, ХС на Co-ПЭ.
Найденные рабочие условия регистрации аналитического сигнала в режиме циклической вольтамперометрии могут быть использованы для проведения однокомпонентного проточного анализа различных объектов, например в ПослИ-системе с амперометрическим детектором (рис. 1а).
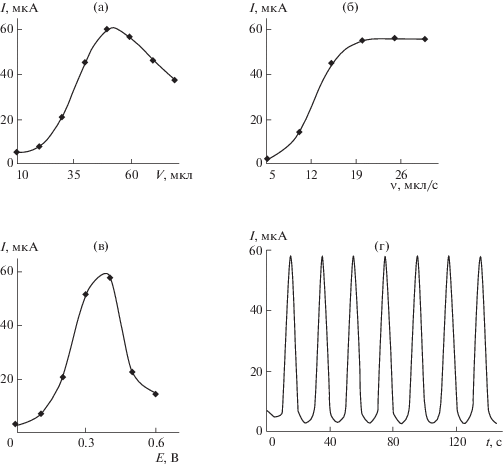
Для каждого соединения оценили влияние налагаемого потенциала (E), скорости потока (u) и объема инжектируемой пробы (V) на величину аналитического сигнала. В качестве примера на рис. 4а–в приведены соответствующие зависимости при последовательном инжекционном определении МК. На основании полученных результатов выбраны рабочие условия определения рассматриваемых БАС в условиях ПослИА: u = 25 мкл/с, V = 25 мкл и E = 0.50, 1.20 и 1.2 В для инсулина, глюкозы и ХС соответственно на Ni-ПЭ при использовании в качестве потока-носителя 0.1 М раствора NaOH; u = 20 мкл/с, V = 50 мкл и E = = 0.40, 0.70 и 1.35 В для МК, инсулина и ХС соответственно на Co-ПЭ при использовании в качестве потока-носителя ФБ.
Рис. 4.
Зависимость тока окисления мочевой кислоты (c = 5 × 10–3 М) на планарном электроде с электроосажденными частицами кобальта на фоне фосфатного буферного раствора от объема инжектируемой пробы (а), скорости потока (б), накладываемого потенциала (в) в последовательной инжекционной системе, от числа воспроизведений (г).
В выбранных условиях построили зависимости аналитического сигнала от концентраций рассматриваемых БАС. Интервалы линейности билогарифмических зависимостей каталитического тока от концентрации аналитов и уравнения регрессии для этих зависимостей приведены в табл. 1. Использование Ni-ПЭ и Co-ПЭ повышает чувствительность метода и снижает нижнюю границу определяемых содержаний БАС по сравнению с немодифицированным ПЭ на два–четыре порядка, что можно рассматривать как достижение для вольтамперометрии.
Таблица 1.
Аналитические характеристики амперометрического определения глюкозы, инсулина, холестерина и мочевой кислоты на планарных углеродных электродах, модифицированных частицами никеля и кобальта, в последовательной инжекционной системе
| Электрод | Носитель | Аналит | Диапазон концентраций, М |
Уравнение регрессии lg I (мкА) = a + b lg с (M) |
R | |
|---|---|---|---|---|---|---|
| a ± ∆а | (b ± ∆b) × 10 | |||||
| ПЭ | NaOH | Глюкоза | 1 × 10–3–1 × 10–2 | 0.60 ± 0.03 | 20.2 ± 0.3 | 0.996 |
| Инсулин | 1 × 10–4–1 × 10–3 | 2.40 ± 0.09 | 3.50 ± 0.15 | 0.998 | ||
| ФБ | Инсулин | 1 × 10–5–1 × 10–4 | 3.3 ± 0.1 | 4.8 ± 0.2 | 0.995 | |
| Мочевая кислота | 5 × 10–4–5 × 10–3 | 2.5 ± 0.1 | 4.3 ± 0.2 | 0.998 | ||
| Ni-ПЭ | NaOH | Глюкоза | 5 × 10–6–5 × 10–2 | 3.2 ± 0.1 | 6.9 ± 0.3 | 0.998 |
| Инсулин | 1 × 10–6–1 × 10–4 | 4.20 ± 0.15 | 6.50 ± 0.25 | 0.999 | ||
| Холестерин | 5 × 10–6–5 × 10–3 | 3.8 ± 0.1 | 6.6 ± 0.3 | 0.998 | ||
| ПВП-Ni-ПЭ | NaOH | Глюкоза | 5 × 10–7–5 × 10–2 | 3.7 ± 0.1 | 6.30 ± 0.25 | 0.998 |
| Co-ДПЭ | ФБ | Холестерин | 5 × 10–7–5 × 10–3 | 2.20 ± 0.08 | 2.4 ± 0.1 | 0.999 |
| Инсулин | 5 × 10–8–5 × 10–4 | 3.0 ± 0.1 | 3.4 ± 0.1 | 0.996 | ||
| Мочевая кислота | 5 × 10–8–5 × 10–3 | 2.6 ± 0.1 | 2.2 ± 0.1 | 0.998 | ||
Правильность методик оценивали методом введено-найдено. В табл. 2 приведены метрологические характеристики амперометрического определения глюкозы и инсулина на Ni-ПЭ в ПослИ-системе с использованием в качестве носителя раствора NaOH, а также ХС, инсулина и МК на Co-ПЭ с использованием в качестве носителя ФБ с pH 6.9. Относительное стандартное отклонение (sr) не превышает 4.0% во всем диапазоне исследуемых концентраций при n = 10 (табл. 2, рис. 4г).
Таблица 2.
Метрологические характеристики амперометрического определения глюкозы, холестерина, инсулина и мочевой кислоты на планарных углеродных электродах, модифицированных частицами никеля и кобальта, в последовательной инжекционной системе (n = 6, P = 0.95)
| Электрод | Носитель | Аналит | Введено, мкМ | Найдено, мкМ | sr, % |
|---|---|---|---|---|---|
| Ni-ПЭ | NaOH | Глюкоза | 1.0 | 1.15 ± 0.05 | 4 |
| 5.0 | 5.1 ± 0.2 | 3 | |||
| Инсулин | 1.0 | 0.95 ± 0.04 | 4 | ||
| 5.0 | 4.9 ± 0.2 | 3 | |||
| Co-ПЭ | ФБ | Холестерин | 1.0 | 1.20 ± 0.05 | 4 |
| 5.0 | 5.2 ± 0.2 | 3 | |||
| Инсулин | 1.0 | 1.10 ± 0.04 | 4 | ||
| 5.0 | 4.9 ± 0.2 | 3 | |||
| Мочевая кислота | 1.0 | 1.10 ± 0.04 | 4 | ||
| 5.0 | 4.9 ± 0.2 | 3 |
При непрерывной эксплуатации разработанных ХМЭ в проточной системе электрокаталитический отклик дает хорошую воспроизводимость: время использования электрода, в течение которого ток падает на 5.0% – 2 ч. Расчетная производительность составляет 180 проб/ч.
Согласно хроноамперограмме, полученной при инжекции раствора, содержащего инсулин и глюкозу, в проточную систему с потоком-носителем 0.1 М раствором NaOH и амперометрическим детектором на ПВП-Ni-ПЭ регистрируются два раздельных пика (рис. 5а). Разность потенциалов пиков составляет 500 мВ, что позволяет проводить селективное последовательное инжекционное амперометрическое определение инсулина и глюкозы на этом электроде.
Рис. 5.
Зависимость тока окисления глюкозы (c = 0.05 М) и инсулина (c = 1 × 10–4 М) при совместном присутствии на планарном электроде, модифицированном композитом на основе частиц никеля и поли-2-винилпиридина, на фоне 0.1 М NaOH от потенциала в последовательной инжекционной системе (а); зависимость тока в растворе, содержащем мочевую кислоту (c = 5 × 10–3 М), инсулин (с = 1 × 10–4 М) и холестерин (с = 5 × 10–3 М), на планарном электроде, модифицированном частицами кобальта, в отсутствие (1) и в присутствии (2) аскорбиновой кислоты (c = 5 × 10–3 М) на фоне фосфатного буферного раствора от потенциала в последовательной инжекционной системе (б).
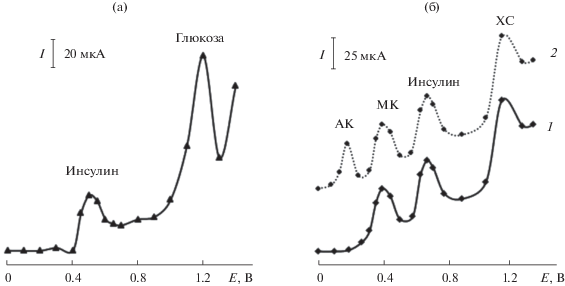
При инжекции раствора, содержащего ХС, инсулин и МК, в проточную систему с носителем ФБ и амперометрическим детектором Co-ПЭ регистрируются три раздельных пика (рис. 5б). Разность потенциалов пиков составляет 200–450 мВ, что достаточно для раздельного определения этих БАС.
Оценена возможность определения рассматриваемых БАС в присутствии органических соединений, которые могут потенциально мешать при анализе крови. Установлено, что аскорбиновая кислота окисляется при меньших потенциалах и не мешает определению рассматриваемых БАС (рис. 5б). Присутствие других матричных компонентов, таких как креатинин, фолиевая кислота, биогенные амины, витамин В12, также не мешает определению рассматриваемых БАС. Креатинин не окисляется в выбранных условиях, а фолиевая кислота, биогенные амины и витамин В12 в крови содержатся в нано- и пикомолярных количествах. В присутствии этих соединений достигнута хорошая сходимость результатов определения глюкозы, ХС, инсулина и МК (sr < 5%).
В связи с необходимостью диагностирования сахарного диабета и сопутствующих ему патологий рассмотрена возможность многокомпонентного анализа биологических жидкостей. При выполнении раздельного определения двух компонентов в смеси использовали ПослИА-систему с амперометрическим детектором на основе ДПЭ: Ni-ДПЭ для определения глюкозы и инсулина и Co-ДПЭ для определения ХС и МК. Для повышения селективности определения глюкозы и инсулина в присутствии ХС один из рабочих электродов Ni-ДПЭ покрывали пленкой из ПВП.
Одновременное определение всех четырех рассматриваемых БАС проводили с помощью двухканальной и двухдетекторной ПослИ-системы. Один детектор включал электрохимическую ячейку с ДПЭ, содержащим один рабочий электрод, модифицированный частицами никеля, для определения инсулина и второй рабочий электрод, модифицированный композитом ПВП-Ni, для определения глюкозы. Другой детектор, содержащий Co-ДПЭ, использовали для определения ХС и МК. Сначала по коммуникациям ПослИ-системы подавали 0.1 М раствор NaOH для создания условий электроокисления инсулина и глюкозы. Затем меняли положение крана-переключателя и подавали ФБ с pH 6.9 для детектирования ХС и МК. Хроноамперограмммы регистрировали в потенциостатическом режиме при указанных выше условиях. На хроноамперограммах наблюдали по два пика, величины которых зависят от концентраций глюкозы и инсулина, ХС и МК соответственно. Использование двухдетекторной проточной системы с модифицированными ДПЭ в составе электрохимических ячеек позволяет сократить продолжительность и увеличить производительность анализа до 360 определений/ч.
Разработанный способ использовали в анализе сыворотки крови. Пробоподготовка заключалась в предварительном центрифугировании пробы в течение 10 мин (скорость вращения 2000 об/мин). Приготовленный раствор вводили в проточную систему. Содержание аналитов находили по градуировочным графикам. Результаты определения органических соединений в сыворотке крови представлены в табл. 3.
Таблица 3.
Результаты одновременного амперометрического определения глюкозы, инсулина, холестерина, мочевой кислоты на двойном планарном электроде в сыворотке крови в двухдетекторной последовательной инжекционной системе (n = 6, P = 0.95)
| Образец | Модификатор | Носитель | Аналит | Норма, мМ (мкМ) |
Введенo, мМ (мкМ) |
Расчет, мМ (мкМ) |
Найдено, мМ (мкМ) |
ПП, % |
|---|---|---|---|---|---|---|---|---|
| № 1 | ПВП-Ni | NaOH | Глюкоза | 3.3–5.5 | – | – | 4.8 ± 0.3 | – |
| 0.5 | 5.3 | 5.1 ± 0.3 | 96 | |||||
| Ni | Инсулин | (0.1–1.0) | – | – | (0.90 ± 0.05) | – | ||
| (0.1) | (1.00) | (1.00 ± 0.04) | 100 | |||||
| Co | ФБ | Холестерин | 3.08–7.85 | – | – | 3.2 ± 0.2 | – | |
| 2 | 5.2 | 5.0 ± 0.3 | 96 | |||||
| Мочевая кислота | 0.15–0.42 | – | – | 0.22 ± 0.01 | – | |||
| 0.05 | 0.27 | 0.26 ± 0.01 | 96 | |||||
| № 2 | ПВП-Ni | NaOH | Глюкоза | 3.3–5.5 | – | – | 3.5 ± 0.3 | – |
| 1.0 | 4.5 | 4.4 ± 0.3 | 98 | |||||
| Ni | Инсулин | (0.1–1.0) | – | – | (0.50 ± 0.03) | – | ||
| (0.2) | (0.7) | (0.68 ± 0.03) | 97 | |||||
| Co | ФБ | Холестерин | 3.08–7.85 | – | – | 4.5 ± 0.1 | – | |
| 5 | 9.5 | 9.4 ± 0.4 | 99 | |||||
| Мочевая кислота | 0.15–0.42 | – | – | 0.22 ± 0.01 | – | |||
| 0.1 | 0.32 | 0.31 ± 0.02 | 97 |
Для оценки показателя правильности (ПП) в исследуемой раствор сыворотки крови добавляли фиксированную аликвоту стандартных растворов инсулина, глюкозы, ХС и МК. Приготовленный раствор также инжектировали в проточную систему. Результаты определения содержания рассматриваемых БАС в сыворотке крови в присутствии стандартных аликвот представлены в табл. 3.
* * *
Разработан оригинальный способ одновременного амперометрического определения инсулина, глюкозы, ХС и МК с использованием двухдетекторной проточной системы и модифицированных ДПЭ в составе электрохимических ячеек. Его можно применять в качестве высокочувствительного, экспрессного и производительного способа анализа сыворотки крови в биохимических лабораториях. Предложенная схема последовательной инжекционной системы обладает рядом преимуществ: в ходе анализа используются небольшие объемы проб и реагентов; возможна автоматизация анализа, поскольку параметры системы (объемы проб и реагентов, скорость потока, продолжительность анализа) задаются управляющей компьютерной программой; включение в схему последовательной инжекционной системы нескольких амперометрических детекторов с ДПЭ и возможность подачи разных носителей позволяет реализовать многокомпонентный проточный анализ.
Работа выполнена за счет средств субсидии, выделенной в рамках государственной поддержки Казанского (Приволжского) федерального университета в целях повышения его конкурентоспособности среди ведущих мировых научно-образовательных центров.
Список литературы
Барсуков И.А., Демина А.А. Новые технологии в управлении сахарным диабетом: от теории − к практике // Consilium Medicum. 2018. Т. 4. № 4. С. 24.
Теодорович О.В., Аметов А.С., Бова Ф.С. Нарушение обмена мочевой кислоты у больных сахарным диабетом 2 типа // Русский медицинский журн. 2008. Т. 16. № 15. С. 985.
Уразгильдеева С.А., Малыгина О.Ф. Особенности лечения дислипидемии у больных сахарным диабетом 2-го типа // Медицинский совет. 2016. № 3. С. 48.
Mitra K., Ghosh A.B., Sarkar A., Saha N., Dutta A.K. Colorimetric estimation of human glucose level using c-Fe2O3 nanoparticles: An easily recoverable effective mimic peroxidase // Biochem. Biophys. Res. Commun. 2014. V. 451. № 1. P. 30.
Mirlohi M., Madany G., Hasanzadeh A., Yahay M.J. On the colorimetric method for cholesterol determination in the laboratory media // Int. J. Biol. Chem. 2012. V.6. № 1. P. 37.
Li L.-H., Dutkiewicz E.P., Huang Y.-C., Zhou H.-B., Hsu C.-C. Analytical methods for cholesterol quantification // J. Food Drug Anal. 2019. V. 27. № 2. P. 375.
Yamaguchi T., Hasegawa K., Kamino S., Miyachi K., Tominaga H., Fujita Y. Spectrophotometric determination of uric acid based on fading of o-hydroxyhydroquinonephthalein-palladium(II)-hexadecyltrimethyl-ammonium complex // Anal. Chem. 2007. V. 23. № 2. P. 223.
Yilmaz B., Kadioglu Y. Determination of human insulin in pharmaceutical preparation by zero, first and second order derivative spectrophotometric methods // Int. J. Pharm. 2012. V. 2. № 2. P. 21.
Suksom W., Wannachai W., Boonchiangma S., Chanthai S., Srijaranai S. Ion Chromatographic analysis of monosaccharides and disaccharides in raw sugar // Chromatographia. 2015. V. 78. № 13-14. P. 873.
Yilmaz B., Kadioglu Y., Capoglu I. Determination of insulin in humans with insulin-dependent diabetes mellitus patients by HPLC with diode array detection // J. Chromatogr. Sci. V. 50. № 7. P. 586.
Wijemanne N., Soysa P., Wijesundara S., Perera H. Development and validation of a simple high performance liquid chromatography/uv method for simultaneous determination of urinary uric acid, hypoxanthine, and creatinine in human urine // Int. J. Anal. Chem. 2018. V. 2018. P. 1.
Шайдарова Л.Г., Челнокова И.А., Махмутова Г.Ф., Гедмина А.В., Будников Г.К. Вольтамперометрическое и проточно-инжекционное определение углеводов на композитных электродах на основе углеродных нанотрубок и гексацианоферрата никеля(II) // Журн. аналит. химии. 2014. Т. 69. № 7. С. 725.
Lu H.-T., Cao X.-H., Yang Z.-J., Chen S., Fan Y. Electrochemical determination of glucose in human serum utilizing a novel nanocomposite composed of copper nanoparticles in a hollow carbon shell // Anal. Lett. 2015. V. 48. № 1. P. 137.
Shaidarova L.G., Abzalova I.A., Chelnokova I.A., Gedmina A.V., Budnikov G.K. Voltammetric and flow injection amperometric determination of insulin, uric acid, and ascorbic acid at the electrode modified by iridium oxides // Drug Invention Today. 2018. V. 10. № 2. P. 2949.
Шайдарова Л.Г. Челнокова И.А., Гафиатова И.А., Гедмина А.В., Будников Г.К. Амперометрическое определение мочевой кислоты, креатинина и холестерина на планарных электродах, модифицированных частицами золота, в проточно-инжекционной системе // Аналитика и контроль. 2019. Т. 23. № 3. С. 354.
Rahman M.M., Asiri A.M. One-step electrochemical detection of cholesterol in the presence of suitable K3Fe(CN)6/phosphate buffer mediator by an electrochemical approach // Talanta. 2015. V. 140. P. 96.
Park S., Boo H., Chung T.D. Electrochemical non-enzymatic glucose sensors // Anal. Chim. Acta. 2006. V. 556. № 1. P. 46.
Zhang M., Mullens C., Gorski W. Insulin oxidation and determination at carbon electrodes // Anal. Chem. 2005. V. 77. № 19. P. 6396.
Dutt J.S.N., Cardosi M.F., Davis J. Electrochemical tagging of urate: Developing new redox probes // Analyst. 2003. V. 128. № 7. P. 813.
Rengaraj A., Haldorai Y., Kwak C.H., Ahn S., Jeon K.-J., Park S.H., Han Y.-K., Huh Y.S. Electrodeposition of flower-like nickel oxide on CVD-grown graphene to develop an electrochemical non-enzymatic biosensor // J. Mater. Chem. B. 2015. V. 3. P. 6309.
Будников Г.К., Евтюгин Г.А., Майстренко В.Н. Модифицированные электроды для вольтамперометрии в химии, биологии и медицине. М.: БИНОМ. Лаборатория знаний, 2010. 416 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии