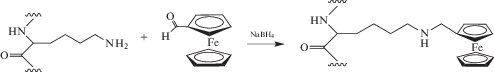Журнал аналитической химии, 2020, T. 75, № 9, стр. 820-833
Гибридный редокс-активный полимер на основе бычьего сывороточного альбумина, ферроцена, карбоксилированных углеродных нанотрубок и глюкозооксидазы
В. А. Арляпов a, А. С. Харькова a, Т. Н. Абрамова a, Л. С. Кузнецова a, А. С. Илюхина a, М. Г. Зайцев a, А. В. Мачулин b, А. Н. Решетилов a, b, *
a Тульский государственный университет
300012 Тула, просп. Ленина, 92, Россия
b Федеральный исследовательский центр Пущинский научный центр биологических исследований
Российской академии наук, Институт биохимии и физиологии микроорганизмов
142290 Московская обл., Пущино, просп. Науки, 5, Россия
* E-mail: anatol@ibpm.pushchino.ru
Поступила в редакцию 27.08.2019
После доработки 13.02.2020
Принята к публикации 03.03.2020
Аннотация
Проводящие редокс-активные полимеры на основе хитозана и бычьего сывороточного альбумина (БСА), ковалентно связанных с медиаторами ферроценом или метиленовым синим, или тионином и модифицированных углеродными нанотрубками, использовали в качестве основы амперометрического биосенсора для определения глюкозы. Структуру полученных полимеров исследовали методами ИК-спектроскопии и сканирующей электронной микроскопии. Электрохимические характеристики изучали методом циклической вольтамперометрии. Наиболее перспективными характеристиками обладает редокс-активный полимер на основе БСА, ковалентно связанного с ферроценом и модифицированного карбоксилированными углеродными нанотрубками. Сформированный на основе выбранного гибридного полимера биосенсор характеризуется высокой чувствительностью, нижней границей определяемых концентраций 0.05 мМ и высокой корреляцией (R = 0.9919) с результатами определения содержания глюкозы в крови человека альтернативным методом.
Создание безреагентных биосенсоров – одно из перспективных направлений в современной аналитической химии. Чувствительность биосенсорных определений можно повысить за счет совершенствования физико-химических преобразователей аналитического сигнала [1, 2] или за счет модификации рецепторного системы. На данный момент наиболее инновационными являются два подхода к разработке рецепторных систем: а) иммобилизация биоматериалов в редокс-активные полимеры; б) применение наноматериалов для обеспечения прямого переноса электронов от биоматериала на электрод [3, 4]. Редокс-активные полимеры имеют сложную структуру. Они состоят из молекул электроактивных соединений, ковалентно связанных с полимерной основой, которая может обладать или не обладать электропроводностью. Наиболее часто используют неэлектропроводящие основы, полученные методом золь–гель синтеза, или биосовместимые органические полимеры [3, 5].
Следует отметить, что неорганические золь–гель полимеры имеют ряд недостатков: длительный синтез, сложность в подборе оптимального соотношения исходных реагентов, хрупкость [6]. В связи с этим в качестве основы удобнее использовать органические вещества с высокой молекулярной массой, например бычий сывороточный альбумин (БСА) и хитозан, так как процесс их сшивки с медиатором прост и протекает быстрее. Важно отметить, что БСА и хитозан обладают высокой биосовместимостью, биоразлагаемы и нетоксичны [7]. Данные свойства имеют большое значение при их использовании в качестве основы редокс-активных полимеров для иммобилизации ферментов при создании биосенсоров.
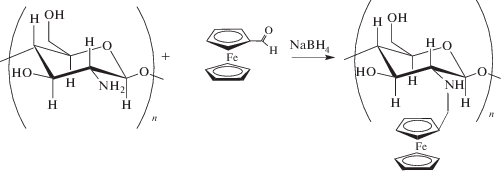
Синтез ферроцен-модифицированного хитозана описан в работе [8]. Он заключается в восстановительном N-алкилировании хитозана ферроценкарбоксальдегидом: при сшивке хитозана с медиатором с помощью глутарового альдегида образуются основания Шиффа, полученная двойная связь восстанавливается боргидридом натрия. Данную матрицу использовали в качестве основы для иммобилизации глюкозооксидазы и целых клеток Gluconobacter oxydans при создании биосенсора для определения концентрации глюкозы. Диапазоны определяемых концентраций ферментного и микробного биосенсоров составили 2.0–16.0 мМ и 1.5–25.0 мМ соответственно [8]. Аналогичный метод синтеза использовали в нашей научной группе [9] для иммобилизации бактериальных клеток Gluconobacter oxydans на графитовый печатный электрод. В качестве редокс-активного полимера применяли бычий сывороточный альбумин, ковалентно связанный с ферроценкарбоксальдегидом. Полученный сенсор использовали для определения БПК5. В работе [10] при создании иммуносенсорного электрода иминную связь, образованную в ходе сшивки медиатора тионина с хитозаном с помощью глутарового альдегида, не восстанавливали. Если в работах [8, 9] восстановление иминной связи было необходимо для предотвращения гидролиза и вымывания медиатора из структуры матрицы, то при использовании бифункционального сшивающего реагента образование имина необратимо [10], поэтому разработанный сенсор характеризовался высокой воспроизводимостью результатов анализа. Помимо образований оснований Шиффа при создании такого рода полимеров, можно использовать карбодиимидный способ синтеза. В работе [11] конъюгат БСА и ферроценкарбоновой кислоты с добавлением многостенных углеродных нанотрубок использовали в качестве гибридного редокс-активного полимера при формировании сенсора на основе фермента глюкозооксидазы. Однако подобный метод создания полимеров имеет существенный недостаток – высокую стоимость активирующих агентов 1-этил-3-(3-диметиламинопропил) карбодиимида и N-гидроксисукцинимида.
При создании биосенсоров с прямым переносом электронов используют различные наноматериалы. Наиболее широко применяют материалы на основе углерода из-за их ценных свойств, таких как высокая электрическая проводимость, возможность химической модификации поверхности, высокая биосовместимость, низкие цены по сравнению с большинством других сырьевых материалов. Среди наиболее часто используемых углеродных наноматериалов можно отметить следующие: одностенные [12, 13] и многостенные [14, 15] углеродные нанотрубки, сажу [16, 17], графен [4], мезопористые углеродные пены [18]. Введение наноматериалов в структуру редокс-активного полимера, как правило, приводит к улучшению характеристик формируемых биосенсоров. В работе [19] для определения БПК5 в состав биосенсора на основе активного ила, иммобилизованного в криогель БСА и хитозана, вводили графен для увеличения общей проводимости системы и скорости взаимодействия медиатора метиленового синего с электродом; биосенсор характеризовался низкой нижней границей определяемых концентраций 1 мгО2/дм3. Другим направлением использования наноматериалов является обеспечение прямого переноса электронов за счет модификации поверхности рабочего ферментного электрода. Прямой перенос электронов от активного центра фермента на поверхность инертного электрода зачастую затруднен либо из-за того, что активный центр фермента слишком глубоко погружен в белок, как в случае фермента глюкозооксидазы [20], либо поскольку при этом необходимо реализовать правильную ориентацию фермента: каждый активный центр должен находиться достаточно близко к поверхности электрода [21].
Электрохимические свойства систем на основе электропроводящих матриц и систем с прямым переносом электронов пока мало изучены, несмотря на большое число работ в этой области. Кроме того, отсутствуют данные по сравнению эффективности применения таких систем для одного биоматериала. В данной работе в качестве биоматериала использовали фермент глюкозооксидазу, так как он является наиболее изученным, а полученные результаты можно использовать при создании глюкометров для многоразового анализа или для постоянного мониторинга концентрации определяемого соединения. Перспективность иммобилизации фермента глюкозооксидазы в гибридные полимеры на основе золь–геля и углеродных наноматериалов иллюстрируeт наше предыдущее исследование [22], в котором установлено влияние наноматериалов на электрохимические свойства матрицы, а также состава исходных компонентов силановых предшественников на структурные особенности золь–гель матрицы.
Цель настоящей работы – создание и исследование характеристик безреагентного биосенсора для определения содержания глюкозы с использованием различных редокс-активных полимеров на основе бычьего сывороточного альбумина и хитозана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и оборудование. Биосенсорные измерения проводили с использованием фермента глюкозооксидазы (ГО) (Sigma-Aldrich, США) (удельная активность 15 Е/мл). В качестве медиаторов электронного транспорта использовали ферроценкарбоксальдегид (Sigma-Aldrich, Германия), нейтральный красный (НК) (Диаэм, Россия), тионин (Диаэм, Россия). В качестве основы редокс-полимера использовали непроводящие матрицы на основе низкомолекулярного хитозана со средней молекулярной массой 50–190 кДа (Sigma-Aldrich, Германия) и БСА (Sigma-Aldrich, Германия). Для создания рабочего угольно-пастового электрода применяли графитовую пудру с размером частиц 75 микрон с высокой чистотой 99.997% (Fluka, Германия), парафиновое масло (Fluka, Германия) и диализную мембрану с пределом пропускания 14 кДа (Roth, Германия). Для формирования редокс-активных полимеров и для проведения биосенсорных измерений использовали натрий-калий фосфатный буферный раствор с рН 6.8 (33 мМ KH2PO4 + 33 мМ Na2HPO4, ООО “Диаэм”, Россия).
Величину рН контролировали с помощью pH-метра-иономера Эксперт-001-3(0.1) (ООО “Эконикс-Эксперт”, Россия). Для регистрации циклических вольтамперограмм использовали вольтамперометрический анализатор Экотест-ВА (ООО “Эконикс-Эксперт”, Россия). Биосенсорные измерения выполняли с помощью гальванопотенциостата IPC-micro (НПО “Вольта”, Россия). Для получения ИК-спектров использовали инфракрасный Фурье-спектрометр ФМС 1201 (ООО “Мониторинг”, Россия). Электронно-микроскопический анализ образцов выполняли с помощью сканирующего электронного микроскопа JSM-6510 LV (JEOL, Япония).
Синтез редокс-активных полимеров с использованием медиатора ферроценкарбоксальдегида. Модификация хитозана ферроценкарбоксальдегидом. Раствор 100 мг хитозана в 10 мл 3%-ной уксусной кислоты перемешивали с 7 мл 0.1%-ного раствора ферроценкарбоксальдегида в ацетоне в течение 2 ч. Затем в раствор добавляли 2 мл 0.7 М раствора NaBH4 и перемешивали в течение 4 ч. Модифицированный полимер титрованием 50 мМ раствором NaOH доводили до значения рН 10, центрифугировали, промывали C2H5OH и высушивали. Реакции протекают по схеме 1 .
Схема 1 . Взаимодействие хитозана с ферроценкарбоксальдегидом в присутствии NaBH4.
Для создания редокс-активного полимера модифицированный хитозан растворяли в 100 мкл уксусной кислоты и добавляли 10 мкл глутарового альдегида.
Модификация бычьего сывороточного альбумина ферроценкарбоксальдегидом. К 5 мл 9%-ного раствора БСА в калий-натрий фосфатном буферном растворе с рН 6.8 добавляли 5 мл 1%-ного раствора ферроценкарбоксальдегида в ацетоне. Полученный раствор доводили до рН 9.3 добавлением 5%-ого раствора K2CO3. Реакция протекала в течение 60 мин при 30°С. Затем в реакционную смесь добавляли 0.01 г NaBH4 и перемешивали в течение 10 мин. Полученную смесь выдерживали при комнатной температуре в течение 6 ч. После проведения данной процедуры рН полученной смеси доводили до 6.5 для того, чтобы разложить непрореагировавший боргидрид. Затем титрованием смеси 0.1 М раствором NaOH рН доводили 8.5. Далее реакционную массу центрифугировали, полученный супернатант подвергали диализу фосфатным буферным раствором с рН 6.8 в течение нескольких суток. Общая схема превращений приведена на схеме 2 .
Схема 2 . Взаимодействие фрагмента бычьего сывороточного альбумина (аминокислота лизин) с ферроценкарбоксальдегидом в присутствии NaBH4.
Для дальнейшего использование редокс-активного полимера в составе биосенсора 20 мкл полученного модифицированного БСА смешивали с 10 мкл глутарового альдегида.
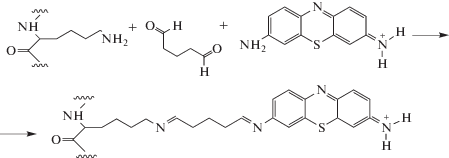
Синтез редокс-активного полимера с использованием медиаторов нейтрального красного и тионина. Модификация хитозана медиаторами электронного транспорта. К 500 мкл 1%-ного раствора хитозана в 1%-ной уксусной кислоте добавляли 5 мкл 0.6 М раствора нейтрального красного (или 6 мкл 0.5 М раствора тионина) и 50 мкл фосфатного буферного раствора с рН 6.8. Полученную смесь встряхивали в течение 5 мин. Затем к раствору добавляли 7.5 мкл глутарового альдегида и встряхивали в течение 30 с. Схема синтеза показана на схеме 3.
Схема 3. Взаимодействие хитозана с нейтральным красным.
К 3.5 мкг БСА добавляли 5 мкл 0.6 М раствора нейтрального красного (или 5 мкл 0.5 М раствора тионина) и 50 мкл фосфатного буфера с рН 6.8. Далее формирование матрицы проходило аналогично формированию матрицы на основе хитозана. Реакция модификации БСА медиатором тионином представлена на схеме 4.
Схема 4. Взаимодействие фрагмента бычьего сывороточного альбумина (аминокислота лизин) с тионином.
Формирование редокс-активных полимеров на основе углеродных нанотрубок. Для создания гибридных полимеров использовали 0.5%-ную суспензию одностенных углеродных нанотрубок (ОСУНТ) (ООО “Углерод Чг”, Россия). Длина углеродных нанотрубок составляла 1–10 мкм, средний диаметр 1.5 нм, внешняя удельная поверхность была равна 450 м2/г. Для создания электрода использовали матрицу, содержащую 10 мкл 0.5%-ной суспензии углеродных нанотрубок, 10 мкл раствора глюкозооксидазы и 5 мкл непроводящего геля БСА или хитозана. Для создания геля БСА 3.5 мкг белка растворяли в 50 мкл буферного раствора с pH 6.8, и добавляли 7.5 мкл 25%-ного глутарового альдегида. Для создания геля хитозана к 500 мкл 1%-ного раствора хитозана в 1%-ной уксусной кислоте добавляли 7.5 мкл 25%-ного глутарового альдегида.
Модификация углеродных нанотрубок карбоксильными группами. 0.1 г углеродных нанотрубок суспендировали в 10 мл смеси конц. HNO3 и H2SO4 (1 : 3. по объему). Смесь кислот с ОСУНТ обрабатывали ультразвуком (частота 22 кГц, мощность 50 Вт) в течение 3 ч при комнатной температуре, затем разбавляли водой и нейтрализовали 1 М раствором NaOH до рН 7. Окисленные ОСУНТ осаждали центрифугированием в течение 10 мин в деионизированной воде на центрифуге VORTEX ELMI (×10 000 g). Затем карбоксилированные ОСУНТ высушивали на воздухе и использовали для формирования рабочего электрода и для получения аминированных нанотрубок.
Модификация углеродных нанотрубок аминогруппами. 0.02 г карбоксилированных ОСУНТ смешивали с 2 мл водного раствора аммиака при 25°С. Суспензию высушивали в сушильном шкафу при 100°С, затем сухой остаток прокаливали при 200°С в течение 15 мин. В результате получили амидированные нанотрубки. Аминирование проводили следующим образом: к суспензии амидированных ОСУНТ добавляли гипобромит натрия в избытке гидроксида натрия при перемешивании при 25°С. Модифицированные ОСУНТ осаждали центрифугированием в течение 10 мин в деионизированной воде на центрифуге VORTEX ELMI (×10000 g). Высушивали на воздухе и использовали для формирования рабочего электрода.
Формирование электродов для электрохимических измерений. Рабочий электрод формировали по методике, описанной в работе [23], наполняя приготовленной пастой “графитовая пудра–минеральное масло” пластиковую трубку площадью 6.3 мм2. Графитовую пасту готовили смешиванием 100 мг графитовой пудры с 40 мкл парафинового масла. Пластиковая трубка содержала платиновую проволоку для электрического контакта с частицами графита. Затем на поверхность электрода наносили 10 мкл редокс-активного полимера и оставляли до полного высыхания. Все полученные электроды хранили при 4°С.
Регистрация вольт-амперных зависимостей. Циклические вольтамперограммы регистрировали при помощи вольтамперометрического анализатора Экотест-ВА (ООО “Эконикс-Эксперт”, Россия) по трехэлектродной схеме. Рабочим электродом служил угольно-пастовый электрод, вспомогательным – платиновый электрод. В качестве электрода сравнения использовали насыщенный хлоридсеребряный электрод (Ag/AgCl), относительно которого представлены все значения потенциалов. Циклические вольтамперограммы регистрировали при скорости развертки потенциала 20–200 мВ/с в калий-натрий фосфатном буферном растворе с рН 6.8 при 22°С. Объем ячейки составлял 15 мл.
Биосенсорные измерения выполняли с помощью гальванопотенциостата IPC-micro (НПО “Вольта”, Россия). Для регистрации отклика биосенсора применяли двухэлектродную схему. Рабочим электродом служил угольно-пастовый электрод с иммобилизованным в проводящий гель ферментом ГО, электродом сравнения – насыщенный хлоридсеребряный. Использовали кювету, заполненную раствором натрий-калиевого фосфатного буферного раствора с рН 6.8. Перемешивание осуществляли магнитной мешалкой (ЗАО “Экрос”, Россия) со скоростью 200 об./мин. Измеряемым параметром (откликом биосенсора) являлась амплитуда выходного сигнала биосенсора при добавлении субстрата. После каждого измерения электрод трехкратно промывали буферным раствором.
ИК-спектроскопия. Для получения ИК-спектров использовали инфракрасный Фурье-спектрометр ФМС 1201 (ООО “Мониторинг”, Россия). Спектры снимали в таблетке KBr (ООО “Диаэм”, Россия) в области 4000–500 см–1 при отношении массы образца белковой матрицы к массе бромида калия 2 : 300 (мг).
Сканирующая электронная микроскопия (СЭМ). На образцы измерительных электродов (на различных этапах формирования, для немодифицированного и модифицированного состояний) напыляли тонкий слой платиново-углеродной смеси в вакуумно-напылительной установке JEE-4X (JEOL, Япония). Электронно-микроскопический анализ образцов проводили с помощью сканирующего электронного микроскопа JSM-6510 LV (JEOL, Япония) в режиме высокого вакуума при регистрации вторичных электронов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Создание биоэлектродов на основе редокс-активных полимеров. Наличие функциональных групп (аминогрупп) позволяет провести сшивку тионина и нейтрального красного с матрицами БСА и хитозана с помощью глутарового альдегида (схемы 3, 4). Матрицу на основе БСА, ковалентно сшитого с НК, ранее успешно использовали для создания глюкозного биосенсора [24] и биосенсора для определения биохимического потребления кислорода [25], однако закономерности переноса электронов в ней не изучали, электрохимические характеристики не сравнивали с другими матрицами.
Кроме проводящих матриц на основе медиаторов феназинового ряда, синтезировали матрицы на основе производных ферроцена. Мы предположили, что модификация БСА и хитозана ферроценкарбоксальдегидом путем нуклеофильного присоединения свободных аминогрупп остатков БСА к альдегидной группе Fe-CHO с последующим восстановлением боргидридом натрия (схемы 1, 2) также позволит получить редокс-активный полимер. На завершающем этапе полученные модифицированные БСА и хитозан сшивали глутаровым альдегидом для получения механически прочной матрицы, пригодной для иммобилизации ГО. Матрицу на основе БСА, ковалентно сшитого с ферроценкарбоксальдегидом, ранее успешно использовали для создания микробного БПК-биосенсора [9], а матрицу на основе хитозана, ковалентно сшитого с ферроценкарбоксальдегидом, использовали при создании микробного биосенсора для определения глюкозы [8].
В предыдущих работах нами показана возможность создания печатного электрода, содержащего ГО и одностенные углеродные нанотрубки, с прямым переносом электронов при окислении глюкозы [13, 26]. В качестве матрицы для иммобилизации ОСУНТ и ГО использовали модифицированный глутаровым альдегидом бычий сывороточный альбумин. В настоящей работе изучали влияние матрицы для иммобилизации и химической модификации УНТ карбоксильными и аминогруппами на электрохимические характеристики электродов.
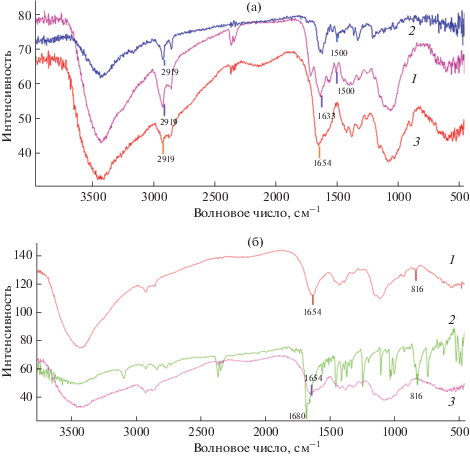
Наличие сшивки между медиатором и неэлектропроводящей основой (хитозан или БСА) подтверждали методом ИК-спектроскопии (рис. 1). Для электропроводящих матриц с использованием ферроценкарбоксальдегида характерно наличие полосы поглощения, равной 816 см–1, которая соответствует деформационным колебаниям связей C–H циклопентадиеновых колец ферроцена [27]. Данная полоса указывает на наличие ферроценилов в полученных матрицах. Отсутствие полосы 1680 см–1, характерной для валентных колебаний С=О ферроценкарбоксальдегида, подтверждает полноту взаимодействия ферроценкарбоксальдегида с аминогруппами основы. Для всех редокс-активных полимеров на основе хитозана и БСА, сшитых с медиаторами феназинового ряда (нейтральный красный и тионин), характерна полоса поглощения при 1633 см–1, которая соответствует валентным колебаниям С=N иминной связи основания Шиффа.
Рис. 1.
ИК-спектр полученных редокс-активных полимеров: (а) – ковалентно связанного нейтрального красного с хитозаном (1) и чистых нейтрального красного (2) и хитозана (3); (б) – ковалентно связанного ферроцена с хитозаном (1) и чистых ферроценкарбоксальдегида (2) и хитозана (3).
На рис. 2 представлены микрофотографии поверхности разработанных электродов на различных этапах модификации, полученные методом СЭМ. Видно, что угольно-пастовый электрод имеет высокоразвитую поверхность (рис. 2а), что обеспечивает большую площадь контакта фермента и проводящего геля и позволяет добиться высокой чувствительности биосенсоров на основе разработанных электродов. Сформированная матрица равномерно покрывает поверхность рабочего электрода (рис. 2б). Получаемая после сшивания молекул БСА и хитозана глутаровым альдегидом структура монолитна, содержит малые поры и способна прочно удерживать молекулы ферментов, не препятствуя диффузии субстратов и метаболитов. Введение в состав матрицы используемых медиаторов мало влияет на образующуюся структуру, так как решающий вклад в формирование каркаса матриц вносит модификация биополимеров глутаровым альдегидом. Используемая для иммобилизации матрица обеспечивает высокую прочность удерживания биоматериала и его сопряжение с наноматериалом за счет связывания молекул ГО с БСА глутаровым альдегидом. После модификации белковой мембраны ОСУНТ (рис. 2в, 2г) наблюдается равномерное распределение нанотрубок, пронизывающих мембрану по всему объему. Это может способствовать значительному облегчению переноса электронов от фермента на электрод.
Рис. 2.
СЭМ-изображение рабочего электрода на разных этапах модификации. (а) — поверхность немодифицированного угольно-пастового электрода; (б) — поверхность угольно-пастового электрода, модифицированного гелем на основе БСА-нейтральный красный; (в) — фотография используемых для создания проводящей матрицы углеродных нанотрубок; (г) – фотография поверхности угольно-пастового электрода, модифицированного гибридным материалом на основе БСА с углеродными нанотрубками.

Электрохимические свойства биоэлектродов на основе редокс-активных полимеров. В системе медиатор–электрод перенос электронов протекает в несколько стадий: диффузия медиатора к поверхности электрода, адсобция медиатора на электроде, перенос электрона на электрод, десорбция продукта реакции и его диффузия [28]. Скорость процесса определяет самая медленная стадия. Следует отметить, что в случае редокс-активных гелей вместо диффузии имеет место прыжковый механизм (ПМ) переноса электрона между окисленными и восстановленными группами медиатора в пределах поверхностного слоя [29], а в случае гелей на основе УНТ – прямой перенос электронов нанотрубками (ППЭ) (рис. 3). Поскольку в электропроводящих матрицах электроны передаются через так называемый “прыжок”, т.е. серию переходов между одним или несколькими стабильными сайтами (мостиковыми молекулами), скорость переноса электрона будет определяться количеством молекул медиатора либо углеродных нанотрубок, необходимых для завершения переноса электронов на электрод [30].
Рис. 3.
Схема переноса электронов в редокс-активных полимерах: (а) – матрица на основе хитозана и нейтрального красного; (б) – матрица на основе хитозана и ОСУНТ; (в) – матрица на основе хитозана, нейтрального красного и УНТ.
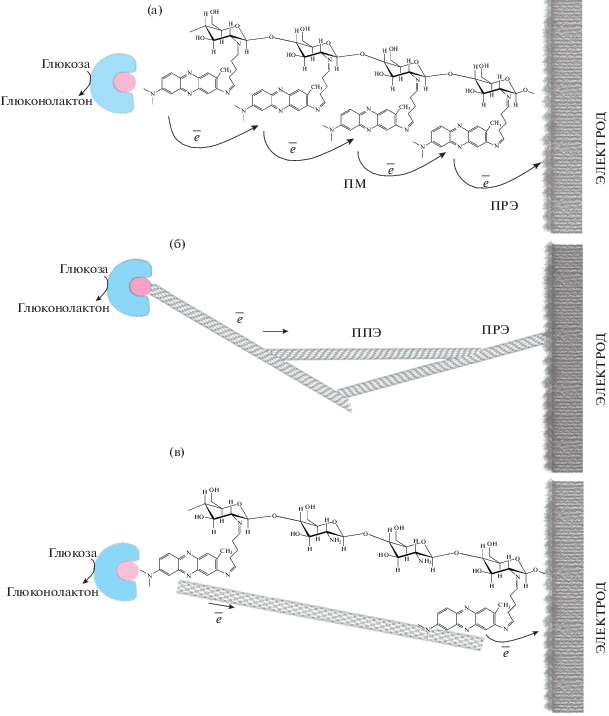
Метод циклической вольтамперометрии удобен для нахождения лимитирующих стадий, так как в случае прыжкового механизма (перенос электрона по проводящему гелю) предельный ток прямо пропорционален квадратному корню из скорости развертки (уравнение (1)). В случае если прыжковый механизм осуществляется достаточно быстро и процесс лимитируется поверхностной реакцией на электроде (перенос электронов от проводящего геля на электрод, ПРЭ), то ток пропорционален скорости развертки (уравнение 2).
где Ip – ток анодного пика, А; n – число электронов; F – число Фарадея, Кл/моль; S – площадь поверхности электрода, см2; с0 – концентрация вещества в растворе, моль/мл; D – коэффициент диффузии электроактивного вещества, см2/с; v – скорость развертки потенциала, В/с; R – универсальная газовая постоянная, Дж/(моль К); Т – температура, К; S – площадь электрода, см2; Г0 – поверхностная концентрация электроактивного вещества на электроде, моль/см2.Для изучения электрохимических характеристик систем методом циклической вольтамперометрии получили и проанализировали циклические вольтамперограммы, общий вид которых представлен на рис. 4.
Рис. 4.
Циклическая вольт-амперная зависимость для электропроводящей системы БСА–нейтральный красный при скоростях развертки потенциала 20 (1), 30 (2), 40 (3), 60 (4), 80 (5), 100 (6) мВ/с.

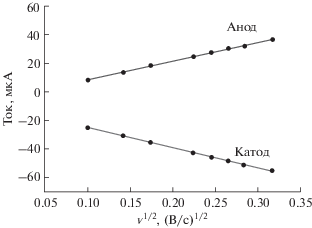
При выявлении лимитирующей стадии путем анализа зависимости предельного тока от скорости развертки (рис. 5) применили модели Николсона [31] (уравнение (3)) и Лавирона [32] (уравнение (4)) для нахождения гетерогенной константы переноса электрона. Обе модели применимы как для обратимых, так и необратимых систем [33, 34].
(4)
$\begin{gathered} \log ({{k}_{S}}) = {\alpha }\log (1 - {\alpha }) + (1 - {\alpha })\log {\alpha } - \\ - \,\,\log \left( {\frac{{RT}}{{nF{v}}}} \right) - \frac{{{\alpha }(1 - {\alpha })nF\Delta E}}{{2.3RT}}, \\ \end{gathered} $Рис. 5.
Зависимость тока от квадратного корня из скорости развертки потенциала при использовании редокс-активного полимера БСА–нейтральный красный.
Определенные лимитирующие стадии процесса и рассчитанные константы гетерогенного переноса электронов представлены в табл. 1. Кроме того, рассчитан формальный потенциал для каждой матрицы как среднее арифметическое катодного и анодного пиков при скорости развертки потенциала 50 мВ/с.
Таблица 1.
Гетерогенные константы скорости при скорости развертки 0.1 В/с и характер лимитирующей стадии электрохимической системы электропроводящий гель–угольно-пастовый электрод
| Состав редокс-активного полимера | Формальный потенциал, мВ | Характер лимитирующей стадии | Гетерогенная константа скорости, см/с |
|---|---|---|---|
| БСА–нейтральный красный | –540 | ПМ | 0.0119 ± 0.0006 |
| БСА–тионин | –37 | ПРЭ | 0.113 ± 0.006 |
| Хитозан–нейтральный красный | –560 | ПРЭ | 0.063 ± 0.003 |
| Хитозан–тионин | –40 | ПРЭ | 0.38 ± 0.02 |
| БСА–ферроцен | +255 | ПРЭ | 0.78 ± 0.04 |
| Хитозан–ферроцен | +240 | ПМ | 0.0125 ± 0.0006 |
| БСА–ОСУНТ–ГО(ФАД)* | –400 | ПРЭ | 0.42 ± 0.04 |
| БСА–ОСУНТ–NH2–ГО(ФАД) | –400 | ПРЭ | 0.28 ± 0.04 |
| БСА–ОСУНТ–COOH–ГО(ФАД) | –400 | ПРЭ | 0.52 ± 0.01 |
| Хитозан–ОСУНТ–ГО(ФАД) | –400 | ПРЭ | 0.42 ± 0.03 |
| Хитозан–ОСУНТ–NH –ГО(ФАД) | –400 | ПРЭ | 0.26 ± 0.03 |
| Хитозан–ОСУНТ–COOH–ГО(ФАД) | –400 | ПРЭ | 0.49 ± 0.03 |
| БСА–ферроцен–ОСУНТ–COOH–ГО(ФАД) | +255 | ПРЭ | 0.87 ± 0.04 |
* В гели, в которых предполагается прямой перенос электронов, вводили фермент глюкозооксидазу; Обозначения: БСА – бычий сывороточный альбумин, ОСУНТ – одностенные углеродные нанотрубки, ГО(ФАД) – фермент глюкозооксидаза и ее кофермент флавинадениндинуклеотид, ПМ – прыжковый механизм, ПРЭ – поверхностная реакция.
Передачу электрона по прыжковому механизму как лимитирующую стадию переноса электронов в матрицах БСА–нейтральный красный и хитозан–ферроцен можно объяснить низким числом молекул медиатора, связанных с матрицей, что проводит к снижению контакта между ними. Для остальных созданных проводящих гидрогелей лимитирующей стадией является передача электрона на поверхность электрода. Редокс-полимеры на основе тионина обладают более высокими константами переноса электронов по сравнению с аналогичной матрицей на основе НК, что, вероятно, связано со свойствами самого медиатора. Константы переноса электрона имеют наибольшее значение в случае, когда скорость процесса определяется поверхностной реакций. В целом можно отметить, что самая высокая скорость переноса заряда среди матриц, модифицированных медиаторами, достигается в гидрогеле БСА–ферроцен, что обусловливает перспективность его использования при создании сенсоров.
Формальный потенциал матриц на основе прямого переноса с участием кофермента ФАД (в табл. 1 данные системы обозначены как ГО(ФАД), за исключением гибридной матрицы БСА–ферроцен – ОСУНТ–COOH – ГО(ФАД), в которой имеется два редокс-активных центра: ферроцен, ковалентно связанный с основой, и кофермент глюкозооксидазы – ФАД) хорошо согласуется с электрохимическим поведением глюкозооксидазы в нейтральных средах [35] и позволяет предположить, что в этих условиях ФАД способен обратимо восстанавливаться до ФАД · H2 и вновь окисляться. Полученные результаты свидетельствуют о прямом переносе электронов с ГО на электрод в системах. Выявлен характер влияния функциональных заместителей ОСУНТ на перенос электронов в безмедиаторных системах: наличие акцепторных –COOH групп увеличивает эффективность передачи электрона (kS ~ 0.5 см/с), а донорных NH2-групп – уменьшает (kS ~ 0.27 см/с) по сравнению с использованием немодифицированных ОСУНТ (kS ~ 0.42 см/с). Кроме того, показано, что гетерогенная константа скорости переноса электронов практически не зависит от типа матрицы, используемой при иммобилизации, и определяется свойствами используемых для переноса электронов ОСУНТ. Вместе с тем матрица может существенно влиять на аналитические характеристики созданных сенсоров.
Таким образом, наиболее перспективными редокс-активными полимерами являются системы БСА–ферроцен и БСА–(ОСУНТ–COOH)–ФАД, так как они обладают наибольшим значением гетерогенной константы скорости переноса электронов. На основе полученных данных сформирован гибридный полимер, содержащий редокс-активный полимер БСА–ферроцен и карбоксилированные ОСУНТ. Предполагается, что введение УНТ в структуру проводящего геля, с одной стороны, обеспечит повышение проводимости и площади контакта электрода с матрицей, а с другой, – позволит обеспечить прыжковый перенос электронов в тех местах матрицы, где не образовались сшивки БСА–ферроцен (рис. 3в). Полученная для данной матрицы гетерогенная константа скорости (табл. 1) выше, чем константы для других сформированных матриц, что подтверждает выдвинутые предположения.
Практическое использование биосенсоров на основе модифицированных электродов. Определили аналитические и метрологические характеристики биосенсоров для определения глюкозы на основе созданных редокс-активных полимеров. Для нахождения диапазона определяемых концентраций глюкозы построили градуировочные зависимости отклика биосенсора от концентрации стандартного раствора глюкозы (рис. 6) в амперометрическом режиме при постоянном потенциале. Зависимость отклика биосенсора от концентрации субстрата описывается уравнением Михаэлиса–Ментен (уравнение (5)).
где V – отклик биосенсора, мкА; Vmax – максимальный отклик биосенсора, при котором все молекулы фермента участвуют в образовании фермент-субстратного комплекса, мкА; КM – эффективная константа Михаэлиса, численно равная концентрации субстрата – глюкозы, при которой величина отклика биосенсора составляет половину от максимального значения, М; [S] – концентрация субстрата, М.Рис. 6.
Градуировочные зависимости биосенсоров на основе используемых проводящих матриц: 1 – БСА–ферроцен–ОСУНТ–COOH, 2 – БСА – ОСУНТ–COOH, 3 – БСА–ферроцен. Вставка: типичный вид отклика биосенсора при добавлении 2 мМ раствора глюкозы для биосенсора на основе гибрида БСА–ОСУНТ–СООН.

Из уравнения (5) следует, что при низких концентрациях субстрата аналитический сигнал пропорционален концентрации глюкозы, что позволяет выделить линейный участок градуировочной кривой, ограниченный сверху значением KM. Типичный вид градуировочных графиков представлен на рис. 6. Характеристики биосенсоров на основе разработанных гидрогелей представлены в табл. 2.
Таблица 2.
Характеристики разработанных биосенсоров
| Характеристика | БСА–ферроцен | БСА–ОСУНТ–СООН– ГО(ФАД) | БСА–ферроцен–ОСУНТ–СООН–ГО(ФАД) |
|---|---|---|---|
| Диапазон определяемых концентраций глюкозы, мМ | 0.1–10.1 | 0.2–1.0 | 0.05– 2.3 |
| sr (15 последовательных измерений), % | 5.1 | 6.4 | 6.8 |
| Время единичного измерения, мин | 4 | 4 | 4 |
| Долговременная стабильность, сут | 8 | 10 | 10 |
Следует отметить, что разработанные биосенсоры характеризуются высокой чувствительностью к глюкозе. Таким образом, они могут найти широкое применение при мониторинге низкого содержания глюкозы в различных объектах. Так как разработанный биосенсор относится к кюветному типу, с точки зрения непрерывного мониторинга глюкозы в крови более чувствительная система позволит анализировать меньшие объемы пробы. Важно отметить, что значение нижней границы определяемых концентраций (табл. 2) коррелирует с результатами определения гетерогенных констант скорости (табл. 1): чем выше константа скорости переноса электронов на электрод, тем выше чувствительность разработанного биосенсора. Нижняя граница определяемых концентраций глюкозы биосенсором на основе гибридного гидрогеля минимальна по сравнению с известными аналогами, например, на основе ковалентно-связанного ферроцена (нижняя граница 2 мМ) [8], биосенсора на основе модифицированного ферроценом композита на основе полисилоксана и хитозана (1.06.0 мМ) [6] и биосенсора на основе графитового печатного электрода на основе прямого переноса электронов с ОСУНТ (нижняя граница 0.1 мМ) [26].
Для биосенсора длительность единичного измерения складывается из времени отклика и времени регенерации активности рецепторного элемента (промывки сенсора). Время отклика биосенсора занимает менее 1 мин. Регенерацию биосенсора после контакта с глюкозой проводили промыванием измерительной ячейки новой порцией буферного раствора. В среднем данная операция занимает 3 мин. Таким образом, время единичного анализа составляет 4 мин. Средняя продолжительность работы одного ферментного электрода определяли путём ежедневной фиксации величины отклика биосенсора на одну и ту же концентрацию раствора глюкозы. Между измерениями электрод хранили в буферном растворе при +4°С. За долговременную стабильность биоэлектрода принимали время, в течение которого величина сигнала составляла не менее 50% от начальной. Как видно из полученных результатов, созданные биоэлектроды характеризуются близким значением долговременной стабильности.
Высокочувствительный биосенсор на основе созданного гибридного полимера апробирован на образцах крови человека. В качестве референтного метода применяли аттестованные тест-полоски One Touch Select (LifeSkan Inc., Johnson and Johnson, США). Полученные результаты приведены в табл. 3. Статистическая обработка (модифицированный тест Стьюдента) полученных результатов показала, что данные двух методов различаются незначимо. Коэффициент корреляции (R) между результатами двух методов составил 0.9919. Разработанный биосенсор можно использовать в качестве альтернативы стандартному анализу.
Таблица 3.
Результаты (мМ) определения содержания глюкозы в крови человека (n = 3, P = 0.95)
| Образец | Найдено разработанным биосенсором | Найдено по тест-полоскам One Touch Select |
|---|---|---|
| 1 | 4.6 ± 0.4 | 4.4 ± 0.1 |
| 2 | 4.9 ± 0,4 | 5.5 ± 0.2 |
| 3 | 5.5 ± 0.5 | 5.1 ± 0.3 |
| 4 | 7.0 ± 0.4 | 6.6 ± 0.2 |
| 5 | 9.9 ± 0.5 | 9.4 ± 0.3 |
| 6 | 10.3 ± 0.2 | 9.7 ± 0.4 |
| 7 | 10.6 ± 0.3 | 10.0 ± 0.4 |
* * *
Таким образом, созданы гибридные полимеры как на основе углеродных нанотрубок, так и с использованием медиаторов электронного транспорта (нейтральный красный, тионин, ферроцен), сшитых с органическим основанием (БСА или хитозан); наличие сшивки доказано методом ИК-спектроскопии. На основании значения константы скорости гетерогенного переноса электронов установлено, что наиболее перспективной системой для создания биосенсора является полимер на основе бычьего сывороточного альбумина, ковалентно связанного с ферроценом, содержащий карбоксилированные одностенные ОСУНТ. Биосенсор, созданный с использованием разработанной матрицы, характеризуется высокими чувствительностью (нижняя граница определяемых концентраций глюкозы 0.05 мМ) и операционной стабильностью, а также небольшой продолжительностью анализа. Разработанный сенсор апробирован в анализе реальных образцов крови человека. Статистический анализ не выявил значимых отклонений полученных результатов по сравнению с референтным методом. Разработанный биосенсор может быть использован в качестве альтернативы стандартному тесту.
Работа выполнена при поддержке Государственного задания Минобрнауки РФ (№ FEWG-2020-0008).
Список литературы
Мельников П.В., Наумова А.О., Александровская А.Ю., Зайцев Н.К. Оптимизация условий изготовления композитного оптического композитного сенсора с применением мезопористого SiO2 // Российские нанотехнологии. 2018. Т. 13. № 11–12. С. 47. (Melnikov P.V., Naumova A.O., Alexandrovskaya A.Yu., Zaitsev N.K. Optimizing production conditions for a composite optical oxygen sensor using mesoporous SiO2 // Nanotechnol. Russ. 2018. V. 13. № 11–12. P. 602.)
Melnikov P.V., Kozhukhova A.E., Naumova A.O., Yashtulov N.A., Zaitsev N.K. Optical analyzer for continuous monitoring of dissolved oxygen in aviation fuel and other non-aqueous media // Int. J. Eng., Trans. B. 2019. V. 32. № 5. P. 641.
Qiu J. D., Deng M.Q., Liang R.P., Xiong M. Ferrocene-modified multiwalled carbon tubes as building block for construction of reagentless enzyme-based biosensors // Sens. Actuators B. 2008. V. 135. № 1. P. 181.
Afsahi S., Lerner M.B., Goldstein J.M., Lee J., Tang X., Jr. Bagarozzi A., Pan D., Locascio L., Walker A., Barron F., Goldsmith B.R. Novel graphene-based biosensor for early detection of Zika virus infection // Biosens. Bioelectron. 2018. V. 100. P. 85.
Garcia A., Peniche-Covas C., Chico B., Simpson B.K., Villalonga R. ferrocene branched chitosan for the construction of a reagentless amperometric hydrogen peroxide biosensor // Macromol. Biosci. 2007. V. 7. № 4. P. 435.
Chen X., Jia J., Dong S. Organically modified sol-gel/chitosan composite based glucose biosensor // Electroanalysis. 2003. V. 15. № 7. P. 608.
Brena B.M., Batista-Viera F. Immobilization of enzymes / Methods in Biotechnology: Immobilization of Enzymes and Cells. Totowa, N.J.: Humana Press, 2006. P. 15.
Yılmaz Ö., Demirkol D.O., Gülcemal S., Kılınç A., Timur S., Çetinkaya B. Chitosan-ferrocene film as a platform for flow injection analysis applications of glucose oxidase and Gluconobacter oxidans biosensors // Colloids Surf. B. 2012. № 100. P. 62.
Каманин С.С., Арляпов В.А., Понаморева О.Н., Блохин И.В., Алферов В.А., Решетилов А.Н. Графитовые печатные электроды, модифицированные проводящим белковым гидрогелем бактериальными клетками, как основа амперометрического биосенсора // Сенсорные системы. 2017. Т. 31. №. 2. P. 161.
Lu D., Pang G., Xie J. A new phosphothreonine lyase electrochemical immunosensor for detecting Salmonella based on horseradish peroxidase/GNPs-thionine/chitosan // Biomed. Microdevices. 2017. V. 19. № 1. P. 12.
Kandimalla V.B., Tripathi V. S., Ju H. A conductive ormosil encapsulated with ferrocene conjugate and multiwall carbon nanotubes for biosensing application // Biomaterials. 2006. V. 27. № 7. P. 1167.
Chen J., Munje R., Godman N.P., Prasad S., Glatzhofer D.T., Schmidtke D.W. Improved performance of glucose bioanodes using composites of (7, 6) single-walled carbon nanotubes and a ferrocene-LPEI redox polymer // Langmuir. 2017. V. 33. № 31. P. 7591.
Арляпов В.А, Каманин С.С., Каманина О.А., Решетилов А.Н. Глюкозный биосенсор на основе печатного электрода, модифицированного одностенными углеродными нанотрубками и терморасширенным графитом // Российские нанотехнологии. 2017. Т. 12. № 11–12. С. 76. (Arlyapov V.A., Kamanin S.S., Kamanina O.A., Reshetilov A.N. Biosensor based on screen-printed electrode and glucose-oxidase modified with the addition of single-walled carbon nanotubes and thermoexpanded graphite // Nanotechnol. Russ. 2017. V. 11. № 11–12. P. 658.)
Benjamin S.R., Vilela R.S., de Camargo H.S., Guedes M.I.F., Fernandes K.F., Colmati F. Enzymatic electrochemical biosensor based on multiwall carbon nanotubes and cerium dioxide nanoparticles for rutin detection // Int. J. Electrochem. Sci. 2018. V. 13. P. 563.
Singh C., Srivastava S., Ali A., Gupta T.K., Sumana G., Srivastava A., Mathur R.B., Malhotra B.D. Carboxylated multiwalled carbon nanotubes based biosensor for aflatoxin detection // Sens. Actuators B. 2013. V. 185. P. 258.
Silva T.A., Moraes F.C., Janegitz B.C., Fatibello-Filho O. Electrochemical biosensors based on nanostructured carbon black: a review // J. Nanomater. 2017. V. 2017. P. 4571614.
Lounasvuori M.M., Kelly D., Foord J.S. Carbon black as low-cost alternative for electrochemical sensing of phenolic compounds // Carbon. 2018. V. 129. P. 252.
Walcarius A. Recent trends on electrochemical sensors based on ordered mesoporous carbon // Sensors. 2017. V. 17. № 8. P. 1863.
Niyomdecha S., Limbut W., Numnuam A., Asawatreratanakul P., Kanatharana P., Thavarungkul P. A novel BOD biosensor based on entrapped activated sludge in a porous chitosan-albumin cryogel incorporated with graphene and methylene blue // Sens. Actuators B. 2017. V. 241. P. 473.
Liang B., Fang B., Yang G., Hu Y., Guo X., Ye X. Direct electron transfer glucose biosensor based on glucose oxidase self-assembled on electrochemically reduced carboxyl grapheme // Biosens. Bioelectron. 2013. V. 43. P. 131.
Ciaccafava A., Infossi P., Ilbert D.M., Guiral D. M., Lecomte D.S., Giudici-Ortivoni D.M.T., Lojiou D.E. Electrochemistry, AFM, and PM-IRRA spectroscopy of immobilized hydrogenase: role of a hydrophobic helix in enzyme orientation for efficient H2 oxidation // Angew. Chem. Int. Ed. 2012. V. 51. № 4. P. 953.
Kamanina O. A., Kamanin S.S., Kharkova A.S., Arlyapov V.A. Glucose biosensor based on screen-printed electrode modified with silicone sol-gel conducting matrix containing carbon nanotubes // 3 Biotech. 2019. V. 9. № 7. P. 290.
Харькова А.С., Арляпов В.А., Туровская А.Д., Автух А.Н., Стародумова И.П., Решетилов А.Н. Мeдиаторный БПК-биосенсор на основе клеток микроорганизмов, выделенных из активного ила // Прикл. биохим. микробиол. 2019. Т. 55. № 2. С. 199. (Kharkova A.S., Arlyapov V.A., Turovskaya A.D., Avtukh A.N., Starodumova I.P., Reshetilov A.N. Mediator BOD biosensor based on cells of microorganisms isolated from activated sludge // Appl. Biochem. Microbiol. 2019. V. 55. № 2. P. 189.)
Каманин С.С., Скворцова Л.С., Коина Е.А., Арляпов В.А. Амперометрический биосенсор для определения глюкозы на основе глюкозооксидазы, иммобилизованной в электропроводящий гель // Изв. Тул. ГУ. Естественные науки. 2016. № 1. С. 46.
Курбаналиева С.К., Харькова А.С., Арляпов В.А. Разработка биосенсора на основе бактерий Paracoccus yeei, иммобилизованных в электропроводящий гель БСА с нейтральным красным // Изв Тул. ГУ. Естественные науки. 2019. № 1. С. 11.
Арляпов В.А., Каманина О.А., Каманин С.С., Решетилов А.Н., Швец В.И. Контроль биотехнологических процессов ферментными электродами, модифицированными нанотрубками // Прикл. биохим. микробиол. 2019. Т. 55. № 3. С. 303. (Arlyapov V.A., Kamanina O.A., Kamanin S.S., Reshetilov A.N., Shvets V.I. Biotechnological processes monitoring with carbon nanotubes-modified enzyme electrodes // Appl. Biochem. Microbiol. 2019. V. 55. № 3. P. 303.)
Yang W., Zhou H., Sun C. Synthesis of ferrocene-branched chitosan derivatives: redox polysaccharides and their application to reagentless enzyme-based biosensors // Macromol. Rapid Commun. 2007. V. 28. № 3. P. 265.
Bard A.J., Faulkner L.R. Electrochemical Methods. Fundamentals and Applications. V. 2. N.Y.: Wiley, 2001. P. 482.
Campbell A.S., Islam M.F., Russell A.J. Intramolecular electron transfer through poly-ferrocenyl glucose oxidase conjugates to carbon electrodes: 2. Mechanistic understanding of long-term stability // Electrochim. Acta. 2017. V. 246. P. 294.
Creasey R.C.G., Mostert A.B., Nguyen T.A.H., Virdis B., Freguia S., Laycock B. Microbial nanowires – Electron transport and the role of synthetic analogues // Acta Biomater. 2018. V. 69. P. 3.
Nicholson R.S. Theory and application of cyclic voltammetry for measurement of electrode reaction kinetics // Anal. Chem. 1965. V. 37. № 11. P. 1351.
Laviron E. General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems // J. Electroanal. Chem. Interfacial Electrochem. 1979. V. 101. № 1. P. 19.
Giarola J., Mano V., Pereira A.C. Development and application of a voltammetric biosensor based on polypyrrole/uricase/graphene for uric acid determination // Electroanalysis. 2018. V. 30. № 1. P. 119.
Ribau I., Fortunato E. A simple procedure to fabricate paper biosensor and its applicability– NADH/NAD + redox system // J. Pharm. Pharmacol. 2018. V. 6. P. 175.
Liang B., Guo X., Fang L., Hu Y., Yang G., Zhu Q., Wei J., Ye X. Study of direct electron transfer and enzyme activity of glucose oxidase on graphene surface // Electrochem. Commun. 2015. V. 50. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии