Журнал аналитической химии, 2021, T. 76, № 1, стр. 67-73
Влияние серебряных наночастиц на флуоресцентные свойства левофлоксацина в присутствии ионов иттрия(III) в водных и мицеллярных средах поверхностно-активных веществ
Т. Д. Смирнова a, *, Т. Г. Данилина a, Т. Ю. Русанова a, Н. А. Симбирева a
a Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского,
Институт химии
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: smirnovatd@mail.ru
Поступила в редакцию 10.06.2020
После доработки 09.07.2020
Принята к публикации 21.07.2020
Аннотация
Изучено влияние синтезированных борогидридным методом наночастиц серебра со средним диаметром 4.3 ± 1.5 нм на интенсивность флуоресценции производного фторхинолона – левофлоксацина. Установлено, что при добавлении ионов Y3+ в систему левофлоксацин–наночастицы серебра интенсивность собственной флуоресценции антибиотика возрастает в 2.5 раза. Увеличение эмиссии возможно в результате формирования жесткой структуры флуоресцирующего центра, а также одновременного воздействия на флуорофор поверхностного плазмонного резонанса наночастиц и внешнего источника излучения. Проведение реакции комплексообразования в среде мицелл додецилсульфата натрия при одновременном присутствии наночастиц серебра позволяет увеличить сигнал эмиссии в четыре раза вследствие самоорганизации супрамолекулярных структур в растворе. Предложены флуориметрические методики определения левофлоксацина в природной воде и лекарственном препарате. Диапазон линейности градуировочного графика составляет 1 × 10–9–1 × 10–6 М. Предел обнаружения 3.0 × 10–10 М (3σ).
Наночастицы серебра обладают уникальными оптическими свойствами [1–3], благодаря которым находят применение в фотоэлектрических и фотонных устройствах, химических и биологических датчиках. Наночастицы металлов в зависимости от природы способны поглощать электромагнитное излучение в ультрафиолетовой, видимой и ближней инфракрасной областях спектра. При поглощении фотона поверхностью наночастицы возникают коллективные колебания электронов проводимости, вызывающие явление поверхностного плазмонного резонанса (ППР), способное увеличить интенсивность рассеяния или поглощения находящегося рядом хромофора. Воздействие локализованного плазмонного резонанса на флуоресцирующую молекулу зависит от размера и формы нанообъекта, природы стабилизатора наночастиц. Нанокластеры серебра со средним диаметром 5–10 нм характеризуются светопоглощением в диапазоне спектра 395–420 нм, для наночастиц размером от 10 до 100 нм плазмонно-резонансные полосы в спектрах могут смещаться батохромно до 500 нм. Зависимость интенсивности и положения максимума полосы ППР наночастиц от их формы и размера может быть использована для управления аналитическим процессом с целью улучшения метрологических характеристик флуориметрических определений [4–9]. Преимущества серебряных нанокластеров перед другими благородными металлами заключаются в максимальном значении молярного коэффициента светопоглощения, высокой стабильности и простоте получения [10], а также существенном влиянии на оптические характеристики, флуоресцентные свойства многих биологически активных органических хромофоров, используемых в схемах зондирования при длинах волн ≥400 нм.
Фторхинолоны являются синтетическими бактерицидными агентами. Они не имеют природного аналога, содержат в своей структуре атом фтора и пиперазиновый цикл и применяются в лечебной терапии, а также в ветеринарии не только в качестве лекарственных препаратов, но и стимуляторов роста. В связи с широким применением фторхинолонов и их значительным влиянием на окружающую среду растет интерес к разработке новых подходов к их количественному определению.
Левофлоксацин (схема 1 ), один из представителей фторхинолонов четвертого поколения, используют для лечения инфекций, вызванных патогенами различных локализаций в процессе выращивания крупного рогатого скота, свиней в неблагополучных по заболеванию хозяйствах. Очевидно, что необходим постоянный контроль остаточных содержаний левофлоксацина в готовых продуктах питания, полуфабрикатах мясной и молочной промышленности, а также объектах окружающей среды.
Схема 1 . Структурная формула левофлоксацина.
В настоящее время для решения подобных задач наиболее часто используют простой и доступный флуориметрический метод, который отличается высокой чувствительностью, широким диапазоном определяемых концентраций и избирательностью. Улучшить метрологические характеристики известных методик, а также предложить новые способы определения фторхинолонов возможно, используя современные подходы к повышению интенсивности сигнала флуоресценции, основанные на резонансном переносе энергии возбуждения в процессах с участием наночастиц серебра и определяемого антибиотика, измерении сигнала сенсибилизированной флуоресценции аналитической системы.
Цель настоящей работы – изучение влияния наночастиц серебра в водных и мицеллярных растворах поверхностно-активных веществ на флуоресцентные свойства левофлоксацина и его комплекса с ионами иттрия(III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Левофлоксацин (Sigma-Aldrich, США, не менее 99% основного вещества), 1.0 × 10–3 М раствор, готовили растворением точной навески в 0.1 М HCl; хлорид цетилпиридиния (не менее 96%), 0.1 М раствор; Тритон Х-100 (Sigma-Aldrich, США, не менее 99%), 0.1 М раствор; Бридж 35 (Acros, США, не менее 99%), 0.1 М раствор; Твин-80 (Sigma, США, не менее 99%), 0.1 М раствор; додецилсульфат натрия (AppliChem, Германия, не менее 99%), 1.0 × 10–1 М раствор; хлорид иттрия(III) гексагидрат (AcrosOrganics, США, 99.9%), нитрат серебра х. ч. (PeaХим, Россия, 99.9%); тетрагидридоборат натрия х. ч. (PeaХим, Россия, 99.9%); тринатрий цитрат дигидрат х. ч. (PeaХим, Россия, 99.9%).
Аппаратура. Спектры флуоресценции регистрировали с использованием спектрометра флуоресцентного многофункционального CaryEclipse (AgilentTechnologies, Австралия) с источником возбуждения – импульсной ксеноновой лампой. Ширина дифракционной щели возбуждения 5 нм, флуоресценции 10 нм. Скорость регистрации спектров 300 нм/мин. Измерения проводили в кварцевой кювете с толщиной слоя 1 см. Сигнал регистрировали под углом 90° к возбуждающему свету.
Оптическую плотность растворов и электронные спектры поглощения в видимой и УФ-областях спектра измеряли на спектрофотометре UV-1800 (Shimadzu, Япония) в кварцевых кюветах толщиной 1 см.
Значения рН контролировали рН-метром рН-673М со стеклянным индикаторным электродом и хлоридсеребряным электродом сравнения. Кислотность растворов создавали ацетатно-аммиачными буферными растворами.
Измерение среднего диаметра и ζ-потенциала наночастиц серебра проводили методом динамического рассеяния света с использованием прибора Zetasizer Nano ZS (Великобритания).
Методика получения наночастиц серебра (НЧAg). Наноразмерные частицы серебра получали по методике [10] химическим восстановлением нитрата серебра при смешивании 1 мл 10 мМ раствора AgNO3, 1 мл 500 мМ раствора цитрат-иона и 47 мл бидистилированной воды в течение 10 мин при комнатной температуре и добавлении к смеси 600 мкл 10 мМ раствора NaBH4. Реакция восстановления продолжалась 30 мин, раствор охлаждали в холодильнике в течение 8–9 ч для завершения роста наночастиц.
Концентрацию наночастиц серебра в растворах рассчитывали по формуле:
N = 3m/4πr3ρ, c = N/NAV,
где N – число частиц в растворе; NA = 6.02 × × 1023 моль–1 – постоянная Авогадро; V – объем раствора, мл; m – масса серебра в растворе (m = = 0.0535 г); r – радиус наночастиц; ρ = 10.5 г/см3 – плотность серебра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Флуоресцентные свойства левофлоксацина и его комплекса с ионами Y3+. Левофлоксацин обладает флуоресцентными свойствами, обусловленными плоскостной структурой, большой протяженностью цепи сопряжения и наличием хромофорных групп в молекуле. Одним из известных подходов к дополнительному увеличению сигнала флуоресценции лиганда является использование комплексообразования бидентатных фторхинолонов с трехвалентными металлами, такими как Al3+, Y3+, La3+ по карбонильной и гидроксильной группам при рН 6–8 [11, 12].
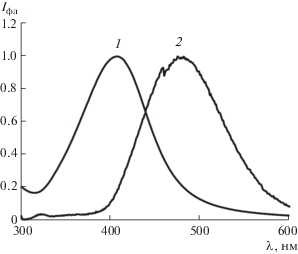
Образование комплексов сопровождается формированием жесткой структуры флуоресцирующего центра, приводящим к уменьшению доли диссипации энергии возбуждения [13]. Нами установлено, что максимальное увеличение сигнала эмиссии хелата наблюдается в случае взаимодействия левофлоксацина с ионами Y3+, у которого отсутствуют электроны на 4f-оболочке, обычно вызывающие тушение люминесценции органического лиганда в результате безызлучательных переходов энергии возбуждения [14]. Согласно теории Льюиса, ионы Y3+ относятся к группе “жестких” акцепторов и образуют устойчивые комплексы с “жесткими” донорными атомами, например, кислородом. Нами показано, что образование комплекса левофлоксацина (ЛФ) с ионами Y3+ сопровождается смещением полосы флуоресценции в коротковолновую область на 20 нм и возрастанием интенсивности эмиссии в 1.8 раз (рис. 1, кривая 2).
Рис. 1.
Спектр флуоресценции левофлоксацина (1) и комплекса левофлоксацин–Y3+ (2). сЛФ = 1.0 × 10–6 М, ${{c}_{{{{{\text{Y}}}^{{3 + }}}}}}$ = 1.0 × 10–4 М, рН 6.0, λвозб = 290 нм.

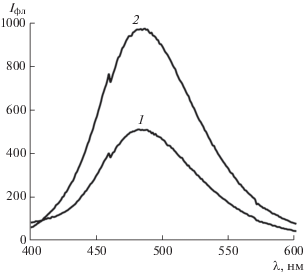
Влияние наночастиц серебра. Средний диаметр и ζ-потенциал НЧAg зависят от условий получения и природы стабилизатора. Метод трансмиссионной электронной микроскопии позволил установить средний диаметр 4.3 ± 1.5 нм и отрицательное значение ζ-потенциала –30 мВ синтезированных наночастиц. Спектр ППР нанокластеров с максимумом λмакс = 405 нм перекрывается со спектром флуоресценции левофлоксацина (λфл = 475 нм) (рис. 2, кривые 1, 2), что свидетельствует о возможности диполь-дипольного переноса энергии возбуждения между левофлоксацином и НЧAg в области ферстеровского радиуса. Установлено, однако, что в растворе левофлоксацина при добавлении НЧAg при рН 3–9 интенсивность флуоресценции фторхинолона не изменяется. Химическая модификация поверхности НЧAg ионами Y3+ за счет образования смешанолигандного хелата ионов Y3+ с левофлоксацином и стабилизатором коллоидной системы цитрат-ионом позволяет сократить расстояние между наночастицей и фторхинолоном. В результате интенсивность флуоресценции левофлоксацина возрастает в 2.5 раза (рис. 3, кривая 2). Поверхность НЧAg модифицировали по следующей методике: в полипропиленовые пробирки емк. 2 мл вносили 1 мл 3.3 × 10–7 М раствора НЧAg и 0.75 мл 0.01 М раствора Y3+. Содержимое пробирок перемешивали и центрифугировали (12 000 об./мин) в течение 30 мин. Установлено, что средний диаметр и ζ-потенциал модифицированных ионами Y3+ наночастиц серебра возросли соответственно до 5.1 ± 1.7 нм и –12 мВ.
Рис. 3.
Спектры флуоресценции левофлоксацина в присутствии наночастиц серебра (1) и комплекса левофлоксацин–Y3+ в присутствии наночастиц серебра (2). сЛФ = 1.0 × 10–6 М, сНЧС = 3.3 × 10–9 M, ${{с}_{{{{{\text{Y}}}^{{{\text{3}} + }}}}}}$ = 1.0 × 10–4 М, рН 6.0, λвозб = 290 нм.

Роль стабилизатора наночастиц в формировании сигнала флуоресценции исследуемой системы заключается в образовании смешанолигандного хелата Y3+ с левофлоксацином и цитрат-ионом вблизи поверхности НЧAg, что позволяет сократить расстояние между донором и акцептором электронов для эффективного диполь-дипольного переноса энергии возбуждения. Способность координационно ненасыщенного иона металла Y3+ к образованию смешанолигандного комплекса с цитрат-ионом (стабилизатором наночастиц) и левофлоксацином максимально реализуется при рН 6.0 и сопровождается незначительным ростом флуоресценции (рис. 4). Можно предположить, что основным фактором роста интенсивности флуоресценции (увеличение в 2.5 раза, рис. 3, кривая 2) хелата Y3+ с левофлоксацином в присутствии НЧAg является воздействие поверхностного плазмонного резонанса на ионы антибиотика.
Рис. 4.
Спектры флуоресценции левофлоксацина (1), комплекса Y3+-левофлоксацин (2), комплекса Y3+- левофлоксацин-цитрат-ион (3). сЛФ = 1.0 × 10–6 М, ${{с}_{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = 2.0 × 10–4 M, ${{с}_{{{{{\text{Y}}}^{{{\text{3}} + }}}}}}$ = 1.0 × 10–4 М, рН 6.0, λвозб = 290 нм.

Флуоресценция системы зависит от кислотности среды и максимальна при рН 6–8. При рН ≥ 8 эмиссия исследуемых систем уменьшается в результате гидролиза антибиотика, агрегации золей наночастиц серебра и смещения ППР в длинноволновую область. Интенсивность флуоресценции комплекса зависит также от концентрации наночастиц в системе и максимальна при сНЧAg = = 3.3 × 10–9 M. При бóльших содержаниях нанокластеров наблюдается концентрационное тушение флуоресценции левофлоксацина.
Влияние мицелл поверхностно-активных веществ (ПАВ). Известно, что при проведении реакции в мицеллярных средах, где жесткость структуры флуоресцирующего центра возрастает, наблюдается рост интенсивности эмиссии. В присутствии микрогетерогенных сред установлено значительное увеличение интенсивности флуоресценции самого левофлоксацина и его комплекса с ионами Y3+ [15].
Изучено влияние природы мицелл ПАВ на эффективность флуоресценции левофлоксацина вблизи поверхности наночастиц. Установлено, что в присутствии неионогенных и катионных ПАВ интенсивность флуоресценции системы левофлоксацин−Y3+−НЧAg практически не изменяется. В то же время мицеллы анионных ПАВ увеличивают эмиссию в два раза (рис. 5), а флуоресценцию самого левофлоксацина, − более чем в четыре раза. Максимальное увеличение флуоресценции наблюдается в присутствии мицелл додецилсульфата натрия при его концентрации в растворе 0.01 М.
Рис. 5.
Спектры флуоресценции комплекса левофлоксацин–Y3+ в присутствии наночастиц серебра (1) и системы левофлоксацин–Y3+–додецилсульфат в присутствии наночастиц серебра (2). сЛФ = 1.0 × 10–6 М, сНЧС = 3.3 × 10–9 M, ${{с}_{{{{{\text{Y}}}^{{{\text{3}} + }}}}}}$ = 1.0 × ×10–4 М, сДДС = 1.0 × 10–2 М, рН 6.0, λвозб = 290 нм.
Значительное возрастание интенсивности флуоресценции (до четырех раз) связано с высокой поверхностной активностью наночастиц серебра и эффективным концентрированием на ней ионов додецилсульфата, левофлоксацина и его комплексов. Определяющим в формировании сигнала флуоресценции процессом является самоорганизация наночастиц, молекул и ионов без возникновения новых химических связей и образование в растворе супрамолекулярных структур [16–18], которые характеризуются одновременно свойствами организованных сред − мицелл ПАВ и твердых нанообъектов. Образующиеся супрамолекулярные структуры способствуют сближению и концентрированию компонентов в паре донор–акцептор на поверхности металлических наночастиц, повышая эффективность переноса энергии возбуждения, в том числе за счет уменьшения диэлектрической проницаемости микроокружения, удаления молекул воды из ближайшего окружения флуоресцирующего центра, являющихся основной причиной тушения флуоресценции. Гемимицеллы додецилсульфата на поверхности наночастиц содействуют созданию более жесткой структуры флуорофора, что также повышает интенсивность эмиссии. Поверхностный плазмонный резонанс супрамолекулярной системы и внешний источник излучения при совместном воздействии способствуют увеличению эффективности возбуждения левофлоксацина и интенсивности его флуоресценции.
Дополнительным подтверждением межмолекулярного переноса энергии от наночастиц серебра к фторхинолону является установленная нами экспериментальная зависимость увеличения интенсивности эмиссии левофлоксацина в присутствии возрастающей концентрации наночастиц серебра, что подтверждает диполь–дипольный перенос энергии электронного возбуждения от наночастиц серебра (донор) к левофлоксацину (акцептор энергии).
Таким образом, в настоящем исследовании впервые экспериментально доказано участие индуктивно-резонансного переноса энергии возбуждения между наночастицами серебра и левофлоксацином в формировании аналитического сигнала. Повышение эффективности межмолекулярного переноса энергии возбуждения и дополнительное увеличение сигнала эмиссии левофлоксацина в четыре раза достигается в результате комплексообразования Y3+ с левофлоксацином в присутствии самообразующихся супрамолекулярных структур наночастиц серебра и мицелл додецилсульфата натрия. Предложен новый подход к увеличению интенсивности флуоресценции аналита, который позволяет повысить чувствительность определения антибиотика и расширить диапазон определяемых содержаний аналита (табл. 1). Установленные зависимости позволяют предложить флуориметрические методики определения содержания левофлоксацина в объектах с низкими концентрациями антибиотика (природная вода), а также в лекарственных препаратах, где фторхинолон выступает как основное вещество.
Таблица 1.
Метрологические характеристики исследуемых систем
| Система | Линейный диапазон, М | Предел обнаружения (3σ), М | Литература |
|---|---|---|---|
| ЛФ | 5.0 × 10–7–3.0 × 10–5 | 3.0 × 10–8 | [15] |
| ЛФ + Y3+ | 1.0 × 10–7–3.0 × 10–5 | 5.0 × 10–8 | |
| ЛФ + Y3+ + ДДС | 1.0 × 10–8–2.0 × 10–5 | 6.0 × 10–9 | |
| ЛФ + Y3+ + ДДС + НЧAg | 1.0 × 10–9–1.0 × 10–6 | 3.0 × 10–10 | Данная работа |
Найдены оптимальные условия получения максимального сигнала флуоресценции в исследуемой системе. Диапазон концентраций левофлоксацина, в котором наблюдается линейная зависимость интенсивности флуоресценции, составляет 1.0 × 10–9–1.0 × 10–6 М. Предел обнаружения 3.0 × 10–10 М.
Определение левофлоксацина в речной воде (модельный раствор, р. Волга) по методу градуировочного графика. В пробирку вносят 1.0 мл ацетатно-аммиачного буферного раствора (pH 6.0), 1 мл исследуемого образца воды, 0.4 мл 1.0 × 10–3 М соли Y3+, 0.4 мл 0.1 М раствора ДДС, 0.4 мл 3.3 × 10–9 М раствора НЧAg, буферный раствор до общего объёма 4 мл. Измеряют интенсивность флуоресценции (λвозб = 290 нм, λфл = 475 нм, временная задержка 0.03 мс), с помощью градуировочного графика определяют содержание левофлоксацина в воде (табл. 2).
Таблица 2.
Результаты (мкг/л) определения левофлоксацина в природной воде (р. Волга) (n = 3, P = 0.95, tтабл = 4.30)
| Введено | Найдено | sr | tэксп |
|---|---|---|---|
| 30 | 29 ± 2 | 0.06 | 0.6 |
| 72 | 71 ± 7 | 0.08 | 0.5 |
Методика построения градуировочного графика: в шесть пробирок вносят по 1.0 мл ацетатно-аммиачного буферного раствора (pH 6.0), 0.4–1.2 мл 1.0 × 10–8–1.0 × 10–5 М стандартного раствора левофлоксацина, 0.4 мл 1.0 × 10–3 М соли Y3+, 0.4 мл 0.1 М раствора ДДС, 0.4 мл 3.3 × 10–9 М раствора НЧAg, буферный раствор до общего объeма 4.0 мл. Измеряют интенсивность флуоресценции (λвозб = 290 нм, λфл = 475 нм) с временной задержкой 0.03 мс, полученные данные используют для построения градуировочного графика.
Определение левофлоксацина в лекарственном препарате (Глево, фирма “Гленмарк Фармасьютикалз Лтд.”, Индия). 5–7 таблеток лекарственного препарата растирают в ступке, навеску порошка, соответствующую массе одной таблетки, переносят в колбу емк. 25 мл с 2.5 мл 1.0 × 10–8 М HCl, растворяют в УЗ-ванне в течение 20 мин и отделяют раствор от осадка (фильтр синяя лента); 0.1–0.5 мл полученного раствора, разбавленного в 100 раз, вносят в пробирку с 1 мл буферного раствора с pH 6.0, добавляют 0.4 мл 1.0 × 10–3 М раствора соли Y3+, 0.4 мл 0.1 М раствора ДДС, 0.4 мл 3.3 × 10–9 М раствора НЧAg, буферный раствор до общего объeма 4.0 мл, измеряют интенсивность флуоресценции (λвозб = 290 нм, λфл = 475 нм, время задержки 0.03 мс).
Заявленное содержание левофлоксацина в лекарственном препарате 0.5 г, найдено 0.49 ± 0.03 г, относительная погрешность определения не превышает 2%.
Правильность люминесцентного определения устанавливали методом введено–найдено. Кроме левофлоксацина, в состав таблетки входят целлюлоза, крахмал, гомополимер 1-винил-2-пирролидинон, магния стеарат. Установлено, что указанные вещества при данных соотношениях не оказывают мешающего влияния на определение левофлоксацина.
* * *
Таким образом, показано, что химическая модификация поверхности наночастиц ионами Y3+ сопровождается незначительным увеличением среднего диаметра и ζ-потенциала наночастиц и позволяет увеличить интенсивность флуоресценции левофлоксацина в 2.5 раза. В присутствии мицелл додецилсульфата натрия в системе наночастиц серебра и комплекса Y3+ с левофлоксацином происходит самоорганизация супрамолекулярных структур, образование которых сопровождается возрастанием флуоресценции левофлоксацина более чем в четыре раза. Предложены флуориметрические методики определения левофлоксацина в природной воде и лекарственном препарате, основанные на измерении флуоресценции антибиотика с использованием мицеллярных растворов додецилсульфата натрия и наночастиц серебра. Правильность определения контролировали методом введено–найдено, относительная погрешность определения не превышает 2%, sr не более 0.14.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-03-01029).
Список литературы
Farooq S., Nunes F.D., Evangelista de Araujo R. Optical properties of silver nanoplates and perspectives for biomedical applications // Photonics Nanostruct. 2018. V. 31. P. 160.
Cesca T., Michieli N., Kalinic B., Balasa I.G., Rangel-Rojo R., Reyes-Esquedac J.A., Matteia G. Bidimensional ordered plasmonic nanoarrays for nonlinear optics, nanophotonics and biosensing applications // Mater. Sci. Semicond. Process. 2019. V. 92. P. 2.
Fu J.-X., Collins A., Zhao Y.-P. Optical properties and biosensor application of ultrathin silver films prepared by oblique angle deposition // J. Phys. Chem. C. 2008. V. 112. P. 16784.
Barnes W.L., Dereux A., Ebbesen T.W. Surface plasmon subwavelength optics // Nature. 2003. V. 424. P. 824.
Smirnova T.D., Shtykov S.N., Zhelobitskaya E.A. Energy transfer in liquid and solid nanoobjects: Application in luminescent analysis / Nanoanalytics: Nanoobjects and Nanotechnologies in Analytical Chemistry. Pt. II: Application in spectrometric methods. Ch. 5 / Ed. Shtykov S. Berlin, Germany: De Gruyter., 2018. P. 131.
Смирнова Т.Д., Желобицкая Е.А., Данилина Т.Г. Люминесцентные свойства доксициклина в присутствии наночастиц серебра // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Экология. Биология. 2017. Т. 17. Вып. 4. С. 371.
Смирнова Т.Д., Желобицкая Е.А., Данилина Т.Г. Влияние поверхностного плазмонного резонанса на флуориметрические свойства молекул и комплексов // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Экология. Биология. 2017. Т. 17. Вып. 2. С. 132.
Yao T., Wang H., Si X., Yin S., Wu T., Wang P. Determination of trace fluoroquinolones in water solutions and in medicinal preparations by conventional and synchronous fluorescence spectrometry // Open Chem. 2018. V. 16. P. 1122.
Yina S.-N., Yaoa T., Wub T.-H., Zhangc Y., Wang P. Novel metal nanoparticle-enhanced fluorescence for determination of trace amounts of fluoroquinolone in aqueous solutions // Talanta. 2017. V. 174. P. 14.
Крутяков Ю.А., Кудринский А.А., Оленин А.Ю., Лисичкин Г.В. Синтез и свойства наночастиц серебра: достижения и перспективы // Успехи химии. 2008. Т. 77. № 3. С. 242.
Maciuca A.-M., Munteanu A.C., Uivarosi V. Quinolone complexes with lanthanide ions: An insight into their analytical applications and biological activity // Molecules. 2020. V. 25. P. 1347.
Jakovljevic I., Petrovic D., Joksovic L., Lazarevic I., Jelikic-Stankov M., Djurdjevic P. Complex formation equilibria between aluminum(III), gadolinium(III) and yttrium(III) ions and some fluoroquinolone ligands. Potentiometric and spectroscopic study // J. Coord. Chem. 2015. V. 68. № 24. P. 4272.
Kaur K., Singh B., Malik A.K. Chemiluminescence and spectrofluorimetric methods for determination of fluoroquinolones: A review // Anal. Lett. 2011. V. 44. № 9. P. 1602.
Полуэктов Н.С., Кононенко Л.И., Ефрюшина Н.П., Бельтюкова С.В. Спектрофотометрические и люминесцентные методы определения лантаноидов. Киев: Наукова Думка, 1989. 256 с.
Данилина Т.Г., Смирнова Т.Д., Брышкина А.Д., Левина Н.А., Неврюева Н.В. Влияние мицелл поверхностно-активных веществ на флуоресцентные свойства комплекса иттрия с левофлоксацином // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2019. Т. 19. Вып. 4. С. 372.
Штыков С.Н. Химический анализ в нанореакторах: основные понятия и применение // Журн. аналит. химии. 2002. № 10. С. 1018.
Романовская Г.И., Королева М.В. Супрамолекулярные структуры наночастиц серебра в растворах ионных поверхностно-активных веществ // Журн. физ. химии. 2013. Т. 87. № 1. С. 66. (Romanovskaya G.I., Koroleva M.V. Supramolecular structures of silver nanoparticles in solutions of surfactants // J. Phys. Chem. 2013. V. 87. № 1. P. 58.)
Климов В.В. Наноплазмоника. М.: Наука. Физматлит, 2010. 480 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии