Журнал аналитической химии, 2021, T. 76, № 1, стр. 59-66
Твердофазно-спектрофотометрическое определение катионных поверхностно-активных веществ на основе системы кремний-титановый ксерогель–пирокатехиновый фиолетовый
М. А. Моросанова a, Е. И. Моросанова a, *
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: emorosanova@gmail.com
Поступила в редакцию 26.03.2020
После доработки 02.06.2020
Принята к публикации 25.07.2020
Аннотация
Изучено влияние хлорида цетилпиридиния (ЦПХ) на взаимодействие трифенилметановых соединений (пирокатехинового фиолетового, эриохромцианина R и хромазурола S) с кремний-титановыми ксерогелями. С использованием твердофазной спектрофотометрии для всех изученных трифенилметановых соединений (ТФМ) установлено образование окрашенных комплексных соединений ЦПХ–ТФМ–титан(IV) (последний входит в состав кремний-титановых ксерогелей), при этом наибольшее увеличение оптической плотности наблюдается при использовании пирокатехинового фиолетового (ПКФ). С использованием системы кремний-титановый ксерогель–ПКФ выбраны условия и разработана методика определения 0.01–0.56 мM ЦПХ (предел обнаружения 3.6 мкМ). Правильность методики проверена методом введено–найдено. Продемонстрирована возможность определения ЦПХ в очищенных сточных водах и катионных поверхностно-активных веществ (в эквивалентах ЦПХ) в технологических растворах на основе препаратов Аламинол и Катамин АБ.
Катионные поверхностно-активные вещества (КПАВ) разнообразны и широко используются в качестве основы различных дезинфицирующих средств. Необходимо определять КПАВ в рабочих растворах для дезинфекции, которые сохраняют свои свойства в течение ограниченного времени, а также в смывах этих растворов. Другая важная задача – определение КПАВ в сточных водах различных предприятий, в первую очередь, пищевой промышленности. С учетом массовости таких определений, большинство из которых необходимо проводить во внелабораторных условиях, актуальной остается разработка быстрых и простых способов определения КПАВ. Один из путей решения этой задачи – создание чувствительных к КПАВ материалов. Примеры новых материалов для создания потенциометрических сенсоров описаны в литературе [1–4].
Обычно в реальных объектах КПАВ присутствуют в виде суммы однотипных веществ. Это, с одной стороны, затрудняет возможность их раздельного определения даже при использовании эффективных методов предварительного разделения. С другой стороны, в большинстве случаев раздельное определение КПАВ нецелесообразно из-за схожести их дезинфицирующей активности или токсичности независимо от строения. Общепринятым приемом в таких случаях является определение суммарного содержания в эквивалентах стандартного вещества [5].
Для определения КПАВ используют потенциометрические [1–4], хроматографические и электрофоретические [6–8], а также спектрофотометрические [9–13] методы анализа. В основе спектрофотометрического определения КПАВ лежат два подхода – образование ионных ассоциатов КПАВ с органическими аналитическими реагентами и образование соединений КПАВ с комплексными соединениями ион металла – органический аналитический реагент. Спектрофотометрические характеристики при реализации первого подхода изменяются незначительно, поэтому перед определением необходимы дополнительные операции жидкость-жидкостной экстракции [14] или сорбции ионного ассоциата [15]. На наш взгляд, для разработки чувствительных материалов более перспективен второй подход, сопровождающийся существенным изменением спектрофотометрических характеристик. Описаны способы определения КПАВ с использованием комплексов меди(II) и бериллия с хромазуролом [10, 12], стронция и молибдена(VI) с бромпирогаллоловым красным [9, 11], а также роданидных комплексов железа(III) [13], в том числе в вариантах определения в потоке [11, 13]. Примеры разработки чувствительных к КПАВ материалов на основе таких комплексов в литературе не описаны.
Взаимодействие КПАВ с комплексами титана(IV) с различными лигандами, в том числе с трифенилметановыми соединениями (ТФМ), в растворах, сопровождается значительным изменением спектрофотометрических характеристик. Это явление использовано для повышения чувствительности определения титана(IV) в различных объектах [16–19]. Комплексы титана(IV) для определения КПАВ ранее не применяли.
Наши предыдущие исследования [20–27] показали, что титан(IV), включенный в матрицу кремний-титановых ксерогелей, сохраняет способность к комплексообразованию. Гетерогенные хромогенные реакции комплексообразования позволяют легко регистрировать аналитический сигнал, в том числе во внелабораторных условиях. Кремний-титановые ксерогели стабильны в течение нескольких лет и удобны в работе. С использованием кремний-титановых ксерогелей в качестве чувствительных материалов разработаны способы определения различных веществ в пищевых продуктах, фармацевтических препаратах и биологических жидкостях [20–27].
Цель настоящей работы состояла в изучении влияния хлорида цетилпиридиния (ЦПХ) – модельного КПАВ – на взаимодействия в системах кремний-титановый ксерогель–ТФМ и выборе условий твердофазно-спектрофотометрического определения КПАВ в очищенных сточных водах и технологических растворах (растворы для дезинфекции и их смывы).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали следующие реагенты: ТФМ – пирокатехиновый фиолетовый х. ч. (ПКФ), эриохромцианин R х. ч. (ЭХЦ) и хромазурол S х. ч. (ХАЗ), тетраэтоксититан техн., дигидрофосфат калия х. ч., гидрофосфат натрия х. ч., серную кислоту ос. ч., хлорид цетилпиридиния (96.0–101.0%), (Acros Organics, США); тетраэтоксисилан ос. ч. (Компонент-Реактив, Россия).
Растворы ТФМ с концентрацией 0.01 М готовили растворением точных навесок в дистиллированной воде. Растворы меньших концентраций готовили разбавлением исходных растворов. Исходный 5.6 × 10–4 М раствор ЦПХ готовили растворением точной навески. Буферные растворы готовили согласно рекомендациям [28].
Кремний-титановый (Si-Ti) ксерогель синтезировали согласно разработанной ранее методике [22]. Для высушивания Si-Ti ксерогеля использовали микроволновую печь (мощность 800 Вт). Оптическую плотность Si-Ti-ксерогелей измеряли на спектрофотометре Lambda 35 с интегрирующей сферой (PerkinElmer, Waltman, США), толщина поглощающего слоя 0.1 см. Значения рН измеряли рН-метром Эксперт-001 (Эконикс-Эксперт, Россия). Для перемешивания суспензий использовали вибропривод ВП-Т/220 (Вибротехник, Россия).
Для изучения условий комплексообразования (pH, ТФМ и его концентрация, время взаимодействия) к 0.10 г Si-Ti-ксерогеля добавляли 5.0 мл растворов с нужным значением pH, содержащих ТФМ (2.0 × 10–4 М) и ЦПХ (0–5.6 × 10–4 М), перемешивали в течение 1–20 мин и регистрировали спектры поглощения окрашенных Si-Ti-ксерогелей.
Для получения градуировочной зависимости к 5.0 мл раствора ЦПХ добавляли 0.2 мл 5.0 × 10–3 М раствора ПКФ (pH 4.3) и 0.10 г Si-Ti-ксерогеля, перемешивали в течение 10 мин и измеряли оптическую плотность ксерогеля при 670 нм. Предел обнаружения рассчитывали как отношение утроенного значения стандартного отклонения контрольного опыта (n = 3) к тангенсу угла наклона градуировочного графика. Предел определения рассчитывали как утроенное значение предела обнаружения.
Образец модельной очищенной сточной воды готовили на основе реального образца очищенной сточной воды пищевого производства. Для этого в мерную колбу емк. 100 мл вносили 2.0 мл 0.56 мМ раствора ЦПХ и доводили до метки очищенной сточной водой. К 5.0 мл этого раствора добавляли 0.2 мл 5.0 × 10–3 М раствора ПКФ (pH 4.3) и 0.10 г Si-Ti-ксерогеля, перемешивали в течение 10 мин, измеряли оптическую плотность ксерогеля при 670 нм. Суммарное содержание КПАВ (в эквивалентах ЦПХ) определяли по заранее построенному градуировочному графику.
Для приготовления растворов дезинфицирующих средств на основе Аламинола в мерную колбу емк. 100 мл вносили 1.0 мл препарата и доводили до метки дистиллированной водой; на основе Катамина АБ – в мерную колбу емк. 200 мл вносили 0.2 мл препарата и доводили до метки дистиллированной водой. Концентрация обоих растворов по КПАВ составляла 0.05 мас. %. Суммарное содержание КПАВ (в эквивалентах ЦПХ) определяли методом добавок: к 5.0 мл раствора, содержащего 1.0 мл 0.05 мас. % раствора средства и разные количества ЦПХ, добавляли 0.2 мл 5.0 × × 10–3 М раствора ПКФ (pH 4.3) и 0.10 г Si-Ti-ксерогеля, перемешивали в течение 10 мин и измеряли оптическую плотность ксерогеля при 670 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение взаимодействий в системах кремний-титановый ксерогель–трифенилметановое соединение–хлорид цетилпиридиния. Для изучения возможности твердофазно-спектрофотометрического определения КПАВ с использованием кремний-титановых ксерогелей в качестве чувствительных материалов анализировали влияние КПАВ на комплексообразование трифенилметановых соединений с титаном(IV), включенным в матрицу ксерогелей. Ранее на примере взаимодействия Si-Ti-ксерогелей с пероксидом водорода, аскорбиновой кислотой, полифенолами (галловой, феруловой, кофейной кислотами, рутином, кверцетином, дигидрокверцетином, пирокатехином, дофамином, пропилгаллатом), салициловой кислотой и ее производными (салициламидом, метиласалицилатом) и ТФМ (пирокатехиновым фиолетовым, эриохромцианином, хромазуролом) установлено, что титан(IV) сохраняет способность к комплексообразованию [20–27]. Для определения КПАВ интерес представляют системы кремний-титановый ксерогель–ТФМ.
Влияние КПАВ на кислотно-основные свойства ТФМ и их комплексообразование в системах КПАВ–ТФМ–ион металла в растворах изучено достаточно подробно [15–18, 29, 30]. На образование хелатных ассоциатов с ионами металлов существенно влияет взаимодействие КПАВ с ТФМ, которое происходит в результате электростатических взаимодействий не только с донорно-акцепторной группировкой, но и с депротонированными аналитико-активными группами (–ОН, –SО3Н, ‒СООН), так называемое “многоцентровое связывание” [29, 30]. Образование ионных ассоциатов можно описать следующим уравнением:
Число участвующих во взаимодействии молекул КПАВ варьируется от 2 до 5 [28]. Взаимодействия такого типа существенно влияют на π-электронную систему ТФМ: молекулы переходят из преимущественно гидрофильно-гидратированного в гидрофобно-гидратированное состояние. В присутствии КПАВ при взаимодействии ТФМ с ионами металлов повышается контрастность реакции в результате батохромного сдвига максимума поглощения и увеличения оптической плотности (гиперхромный эффект). Взаимодействиe ТФМ с иммобилизованными ионами металлов в присутствии КПАВ ранее не изучалось.С целью выбора условий твердофазно-спектрофотометрического определения КПАВ исследовали взаимодействие кремний-титановых ксерогелей с ПКФ, ЭХЦ и ХАЗ в присутствии ЦПХ в качестве модельного КПАВ. Выбранные ТФМ содержат однотипные хиноидные циклические системы и различаются числом и природой аналитико-активных групп. ПКФ содержит 3 гидроксильных и одну сульфо-группу, ХАЗ и ЭХЦ наряду с одной гидроксильной и одной сульфо-группой содержат еще две карбонильные группы.
Взаимодействие Si-Ti-ксерогелей с ТФМ в отсутствие ЦПХ изучено нами ранее. С использованием модифицированного метода сдвига равновесия [19, 20] показано, что образуются комплексы состава 1 : 1 согласно уравнению:
Константа равновесия этой гетерогенной реакции комплексообразования максимальна (1.4 × × 104 М–1) при взаимодействии с ПКФ. При взаимодействии с ХАЗ и ЭХЦ соответствующие константы близки между собой и практически на порядок меньше, чем в случае ПКФ. Комплексообразование сопровождается контрастным изменением окраски ксерогелей с белой на сине-зеленую, фиолетовую и розовую соответственно для ПКФ, ЭХЦ и ХАЗ [26].
При изучении взаимодействия в системе кремний-титановый ксерогель–ТФМ–ЦПХ были рассмотрены две возможности образования комплекса: 1) взаимодействие ЦПХ с ксерогелем, модифицированным ТФМ (уравнение (3)), 2) взаимодействие кремний-титанового ксерогеля с раствором, содержащим ТФМ и ЦПХ (уравнение (4)):
(3)
${\text{Si - TiТФМ}} + n{\text{ЦПХ}} = {\text{Si - TiТФМ}}{{\left( {{\text{ЦПХ}}} \right)}_{n}},$(4)
${\text{Si - Ti}} + {\text{ТФМ}} + n{\text{ЦПХ}} = {\text{Si - TiТФМ}}{{\left( {{\text{ЦПХ}}} \right)}_{n}}.$В первом случае (уравнение (3)) изменений в спектрах поглощения ксерогелей не наблюдали. При добавлении ЦПХ в систему Si-Ti-ксерогель–ТФМ для всех изученных ТФМ наблюдали значительное увеличение оптической плотности (гиперхромный эффект). Это, по-видимому, свидетельствует об образовании в матрице кремний-титанового ксерогеля соединений согласно уравнению (4). Спектры поглощения ксерогелей после взаимодействия с ТФМ в присутствии/в отсутствие ЦПХ при различных рН среды приведены на рис. 1–3. Для всех ТФМ наибольшее влияние добавления ЦПХ имеется в области рН 4.3–4.8. В спектрах поглощения в случае ЭХЦ наблюдается максимум при 510 нм (рис. 1), ХАЗ – при 505 нм (рис. 2), ПКФ – при 670 нм (рис. 3).
Рис. 1.
Спектры поглощения Si-Ti-ксерогелей в присутствии эриохромцианина R (ЭХЦ) в отсутствие хлорида цетилпиридиния (ЦПХ) (1–3)/в присутствии 5.6 × 10–4 М ЦПХ (4–6) при различных значениях pH: с(ЭХЦ) = 1.0 × 10–3 М, t = 10 мин, m(Si-Ti) = = 0.10 г, Vобщ = 5.0 мл. 1, 4 – рН 2.0; 2, 5 – рН 4.4; 3, 6 – рН 7.0.
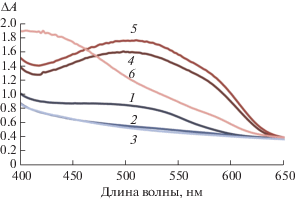
Рис. 2.
Спектры поглощения Si-Ti-ксерогелей в присутствии хромазурола S (ХАЗ) в отсутствие хлорида цетилпиридиния (ЦПХ) (1–3)/в присутствии 5.6 × ×10–4 М ЦПХ (4–6) при различных значениях pH: с(ХАЗ) = 1.0 × 10–3 М, t = 10 мин, m(Si-Ti) = 0.10 г, Vобщ = 5.0 мл. 1, 4 – рН 2.0; 2, 5 – рН 4.8; 3, 6 – рН 7.0.

Рис. 3.
Спектры поглощения Si-Ti-ксерогелей в присутствии пирокатехинового фиолетового (ПКФ) и в отсутствие хлорида цетилпиридиния (ЦПХ) (1–3)/в присутствии 5.6 × 10–4 М ЦПХ (4–6) при различных значениях pH: с(ПКФ) = 1.0 × 10–3 М, t = 10 мин, m(Si-Ti) = 0.10 г, Vобщ = 5.0 мл. 1, 4 – рН 2.2; 2, 5 – рН 4.3; 3, 6 – рН 7.0.

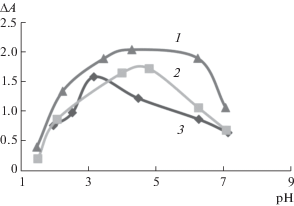
Изучено влияние pH в интервале от 1.5 до 7.0 на ΔА (разность оптических плотностей ксерогелей в присутствии 5.6 × 10–4 М ЦПХ и в его отсутствие) для различных ТФМ (рис. 4). Максимальное значение ΔА в наиболее протяженном диапазоне рН наблюдается для ПКФ. По-видимому, это связано с особенностями аналитико-активных групп ПКФ [29]. Дальнейшие исследования проводили с использованием ПКФ при pH 4.3.
Рис. 4.
Зависимость разности оптических плотностей Si-Ti-ксерогелей в присутствии и в отсутствие хлорида цетилпиридиния (ЦПХ) (ΔА) от pH: с(ТФМ) = = 1.0 × 10–3 М, с(ЦПХ) = 5.6 × 10–4 М , t = 10 мин, m(Si-Ti) = 0.10 г, Vобщ = 5.0 мл. 1 – пирокатехиновый фиолетовый (670 нм), 2 – хромазурол S (505 нм), 3 – эриохромцианин R (510 нм).
Зависимость ∆А от концентрации ПКФ в диапазоне от 1.0 × 10–5 до 0.01 М представляет собой кривую с максимумом (рис. 5). Значение ∆А максимально при c(ПКФ) = 5.0 × 10–3 М. В изученной системе в присутствии ЦПХ одновременно или последовательно протекают две реакции: образование соединения Ti(IV) с ПКФ и соединения ЦПХ–ПКФ–Ti(IV) . По-видимому, скорости этих процессов различаются, и в диапазоне концентраций ПКФ 1.0 × 10–5–5.0 × 10–3 М доминирует образование комплексного соединения с ЦПХ, а свыше 5.0 × 10–3 М – образование комплекса Ti(IV) с ПКФ. Для дальнейших экспериментов была выбрана концентрация ПКФ 5.0 × × 10–3 М.
Рис. 5.
Влияние концентрации пирокатехинового фиолетового (ПКФ) на комплексообразование: зависимость разности оптических плотностей Si-Ti-ксерогелей в присутствии и в отсутствие хлорида цетилпиридиния (ЦПХ) (∆А) от концентрации ПКФ. с(ЦПХ) = 5.6 × 10–4 М, t = 10 мин, m(Si-Ti) = 0.10 г, Vобщ = 5.0 мл, pH 4.3, λmax = 670 нм.

Изучение кинетики комплексообразования в системе Si-Ti-ксерогель–ПКФ–ЦПХ позволило определить необходимое время взаимодействия (рис. 6): с увеличением времени взаимодействия до 10 мин оптическая плотность растет, а далее практически не изменяется. Константу скорости внешней диффузии (K) и время полуреакции (t1/2) рассчитывали, как описано ранее [31]; они составили K = 0.52 мин–1, t1/2 = 3.6 мин. В дальнейших экспериментах перемешивание проводили в течение 10 мин.
Рис. 6.
Зависимость оптической плотности Si-Ti-ксерогеля от времени взаимодействия. с(пирокатехиновый фиолетовый) = 5.0 × 10–3 М, с(хлорид цетилпиридиния) = 5.6 × 10–4 М, m(Si-Ti) = 0.10 г, Vобщ = = 5.0 мл, pH 4.3, λmax = 670 нм.

Выбранные условия (рН 4.3, с(ПКФ) = 5.0 × × 10–3 М, время контакта 10 мин) использовали для разработки методики твердофазно-спектрофотометрического определения ЦПХ.
Аналитическое использование системы кремний-титановый ксерогель–пирокатехиновый фиолетовый для определения катионных поверхностно-активных веществ. КПАВ разнообразны и практически всегда встречаются в реальных образцах как смеси близких по свойствам и строению веществ. Дезинфицирующие средства содержат хлорид алкилдиметилбензиламмония, где алкильный радикал может содержать от 8 до 18 атомов углерода, косметические средства содержат хлорид алкилтриметиламмония, в котором алкильный радикал может содержать от 12 до 18 атомов углерода. Сточные воды могут содержать несколько КПАВ из различных источников. Покомпонентный состав смеси КПАВ в анализируемых образцах установить сложно, с использованием экспресс-методов – невозможно, в то же время быстрое и внелабораторное определение КПАВ – очень важная задача. Для спектрофотометрических определений в таких случаях суммарное содержание КПАВ определяют в эквивалентах стандартного вещества, чаще всего ЦПХ [5, 11, 13].
Взаимодействие неиммобилизованных комплексов металл–ТФМ с КПАВ изучено ранее достаточно подробно. На примере комплексов бериллия и меди(II) с ХАЗ установлено отсутствие влияния природы КПАВ на спектрофотометрические характеристики соединений, полученных в присутствии различных КПАВ: бромидов цетилпиридиния, цетилтриметиламмония, додецилтриметиламмония в случае бериллия [10] и бромидов цетилпиридиния и цетилтриметиламмония в случае меди(II) [12]. Это можно объяснить природой взаимодействий, приводящих к возникновению аналитического сигнала. При определении КПАВ с помощью кремний-титанового ксерогеля в присутствии ПКФ усиление окраски, так же, как и в растворе, по-видимому, происходит за счет подобных электростатических взаимодействий аналитико-активных групп ПКФ и КПАВ. Таким образом, использование кремний-титановых ксерогелей в присутствии ПКФ представляет интерес для твердофазно-спектрофотометрического определения суммарного содержания КПАВ.
В выбранных условиях зависимость оптической плотности кремний-титанового ксерогеля от концентрации ЦПХ линейна в диапазоне 0.01–0.56 мM ЦПХ (А = 3.59с (мМ) + 0.477, R2 = 0.997), предел обнаружения составляет 3.6 мкМ (n = 3). Правильность методики твердофазно-спектрофотометрического определения ЦПХ проверяли методом введено–найдено с использованием в качестве матрицы реального образца очищенной сточной воды пищевого производства (n = 3, P = 0.95):
Полученные результаты свидетельствуют об отсутствии значимых влияний компонентов матрицы очищенной сточной воды на определение. Характеристики разработанной методики твердофазно-спектрофотометрического определения КПАВ в сравнении с описанными в литературе методиками, основанными на взаимодействии КПАВ с комплексами металлов, приведены в табл. 1. Разработанная методика твердофазно-спектрофотометрического определения ЦПХ характеризуется простотой и широким диапазоном определяемых концентраций.
Таблица 1.
Сравнение характеристик различных спектрофотометрических методик определения катионных поверхностно-активных веществ
| Аналит | Комплекс | Способ определения | Диапазон, мг/л |
Время анализа, мин | Литература |
|---|---|---|---|---|---|
| Цетилпиридиния хлорид | Sr(II)–бромпиро-галлоловый красный | Спектрофотометрия | 10–70 | 30 | [9] |
| Цетилтриметиламмония, додецилтриметиламмония, цетилпиридиния бромиды, Triton X-100 | Be(II)–хромазурол | Спектрофотометрия с математической обработкой спектров | 0.06–121.8 | – | [10] |
| Цетилпиридиния хлорид | Mo(VI)–бромпиро-галлоловый красный | Последовательно- инжекционный анализ (спектрофотометрическое детектирование) | 2.5–152.5 | – | [11] |
| Цетилтриметиламмония бромид | Cu(II)–хромазурол S | Спектрофотометрия | 0.06–15 | 5 | [12] |
| Додецилтриметиламмония, тетрадецилтриметиламмония, цетилтриметиламмония бромиды, цетилпиридиния хлорид | Fe(III)–SCN | Проточно-инжекционный анализ (спектрофотомет-рическое детектирование) | 0.5–30 | – | [13] |
| Цетилпиридиния хлорид | Ксерогель на основе оксидов кремния и титана–пирокатехи-новый фиолетовый | Твердофазная спектрофотометрия | 3.6–190 | 10 | Данная работа |
С целью демонстрации возможностей разработанной методики определили суммарное содержание КПАВ (в эквивалентах ЦПХ) в разбавленных растворах дезинфицирующих средств Аламинол и Катамин АБ. Оперативный контроль качества рабочих растворов и полноты смывания средств необходимо осуществлять в местах их использования во внелабораторных условиях.
Дезинфицирующие средства Аламинол и Катамин АБ на основе хлорида алкилдиметилбензиламмония рекомендованы для дезинфекции помещений и оборудования на предприятиях пищевой промышленности, а также для дезинфекции изделий медицинского назначения. Средство Аламинол содержит 5% хлорида алкилдиметилбензиламмония и 8% глиоксаля. Для дезинфекции готовят рабочие растворы Аламинола с концентрацией 0.75–10.0% по препарату, что соответствует 0.04–0.50% по КПАВ. Средство Катамин АБ содержит 49–51% алкилдиметилбензиламмония хлорида и третичные амины (не более 1.7%). Для дезинфекции готовят рабочие растворы 0.3–1.0% по препарату, что соответствует 0.15–0.50% по КПАВ. Для определения КПАВ (в эквивалентах ЦПХ) с использованием системы кремний-титановый ксерогель–ПКФ готовили разбавленные растворы двух средств с содержанием КПАВ 0.05%. Результаты определения суммарного содержания КПАВ в эквивалентах ЦПХ приведены ниже (n = 3, P = 0.95):
| Образец | Найдено, % | sr |
|---|---|---|
| Аламинол, разб. раствор | 0.048 ± 0.005 | 0.04 |
| Катамин АБ, разб. раствор | 0.050 ± 0.009 | 0.07 |
Таким образом, продемонстрирована возможность определения ЦПХ в очищенных сточных водах и КПАВ (в эквивалентах ЦПХ) в технологических растворах дезинфицирующих средств.
* * *
Изучено комплексообразование титана(IV), включенного в матрицу кремний-титановых ксерогелей, с трифенилметановыми соединениями (пирокатехиновым фиолетовым, эриохромцианином R и хромазуролом S) в присутствии катионных поверхностно-активных веществ на примере хлорида цетилпиридиния. Присутствие КПАВ приводит к значительному увеличению оптической плотности ксерогелей за счет образования окрашенных соединений. Для разработки методики определения КПАВ выбрали пирокатехиновый фиолетовый, так как комплексы с ним характеризуются наибольшим увеличением оптической плотности в максимально протяженном диапазоне рН 4–6. Изучена кинетика комплексообразования в системе Si-Ti-ксерогель–ПКФ–ЦПХ и выбрано время контакта ксерогеля с раствором – 10 мин. Разработана методика твердофазно-спектрофотометрического определения ЦПХ: диапазон определяемых содержаний 0.01–0.56 мM, предел обнаружения 3.6 мкМ. Продемонстрирована возможность определения КПАВ (в эквивалентах ЦПХ) в очищенных сточных водах и технологических растворах на основе препаратов Аламинол и Катамин АБ.
Авторы выражают благодарность студентам химического факультета МГУ З.В. Самоделову и С.Э. Дронову за участие в эксперименте.
Работа выполнена при финансовой поддержке ООО “МедЭкоТест” (хоз. договор № 407/14).
Список литературы
Madunic-Cacic D., Sak-Bosnar M., Galovic O., Sakac N., Matesic-Puac R. Determination of cationic surfactants in pharmaceutical disinfectants using a new sensitive potentiometric sensor // Talanta. 2008. V. 76. P. 259.
Samardzic M., Sak-Bosnar M., Madunic-Cacic D. Simultaneous potentiometric determination of cationic and ethoxylated nonionic surfactants in liquid cleaners and disinfectants // Talanta. 2011. V. 83. P. 789.
Mostafa G.A.E. s-Benzylthiuronium PVC matrix membrane sensor for potentiometric determination of cationic surfactants in some pharmaceutical formulation // J. Pharm. Biomed. Anal. 2006. V. 41. P. 1110.
Hajdukovic M., Samardzic M., Calovic O., Szechenyi A., Sak-Bonsar M. A functionalized nanomaterial based, new, solid state cationic-surfactant-selective sensor with fast response and low noise // Sens. Actuators B. 2017. V. 251. P. 795.
Вершинин В.И. Определение суммарного содержания однотипных органических веществ (теория интегральных показателей). Омск: ОмГУ, 2016. 288 с.
Peng X.T., Shi Z.G., Feng Y.Q. Rapid and high-throughput determination of cationic surfactants in environmental water samples by automated on line polymer monolith microextraction coupled to high performance liquid chromatography–mass spectrometry // J. Chromatogr. A. 2011. V. 1218. P. 3588.
Heinig K., Vogt C., Werner G. Determination of cationic surfactants by capillary electrophoresis with indirect photometric detection // J. Chromatogr. A. 1997. V. 781. P. 17.
Herrero-Martiınez J.M., Simo-Alfonso E.F., Mongay-Fernandez C., Ramis-Ramos G. Determination of cationic surfactants by capillary zone electrophoresis and micellar electrokinetic chromatography with deoxycholate micelles in the presence of large organic solvent concentrations // J. Chromatogr. A. 2000. V. 895. P. 227.
Benamor M., Aguersif N., Draa M.T. Spectrophotometric determination of cetylpyridinium chloride in pharmaceutical products // J. Pharm. Biomed. Anal. 2001. V. 26. P. 151.
Afkhami A., Nematollahi D., Madrakian N., Abbasi-Tarighat M., Hajihadi M. Simultaneous spectrophotometric determination of binary mixtures of surfactants using continuous wavelet transformation // J. Hazard. Mater. 2009. V. 166. P. 770.
Passos M.L., Saraiva M.L., Lima J.L. Application of sequential injection analysis to the determination of cationic surfactants based on the sensitized molybdenum-bromopyrogallol red reaction // Anal. Sci. 2005. V. 21. P. 1509.
Nemcova I., Tomankova V., Rychlovsky P. Non-extraction batchwise and FIA determination of cationic and nonionic surfactants using Cu(II)-chromazurol S‑surfactant complexes // Talanta. 2000. V. 52. P. 111.
Patel R., Patel K.S. Simple and specific method for flow injection analysis determination of cationic surfactants in environmental and commodity samples // Talanta. 1999. V. 48. P. 923.
Sakai T., Ohno N., Kamoto T., Hideto S. Formation of ternary ion associates using diprotic acid dyes and its application to determination of cationic surfactants // Mikrochim. Acta. 1992. V. 106. P. 45.
Дмитриенко С.Г., Пяткова Л.Н., Вахаева Л.П., Рунов В.К., Золотов Ю.А. Оптические сорбционно-молекулярно-спектроскопические методы анализа. Применение пенополиуретанов и сульфофталеиновых красителей для определения катионных поверхностно-активных веществ // Журн. аналит. химии. 1996. Т. 51. № 5. С 493. (Dmitrienko S.G., Pyatkova L.N., Bakhaeva L.P., Runov V.K., Zolotov Y.A. Optical sorption-molecular-spectroscopy methods of analysis: Application of polyurethane foams and sulfophthalein dyes to the determination of cationic surfactants // J. Analyt. Chem. 1996. V. 51. P. 453.)
Саввин С.Б., Чернова Р.К., Белоусова В.В., Сухова Л.К., Штыков С.Н. О механизме действия катионных поверхностно-активных веществ (ПАВ) в системах органический краситель–ион металла–ПАВ // Журн. аналит. химии. 1978. Т. 33. С. 1473.
Тихонов В.Н., Александрова Н.П. Спектрофотометрическое исследование трехкомпонентных комплексов некоторых металлов с хромазуролом S и цетилтриметиламмонием // Журн. аналит. химии. 1981. Т. 36. № 2. С. 242.
Marczenko Z., Kalowska H. Spectrophotometric determination of titanium with chrome azurol S (or eriochrome cyanine R) in the presence of some cationic surfactants // Microchem. J. 1982. V. 27. P. 174.
Sicilia D., Rubio S., Perez-Bendito D. Micellar effects on reaction kinetics. Part II. Stady of the action of dodecyltrimethylammonium bromide on the reactions between pyrogallol red and chromium(VI), vanadium(V), and titanium(IV) // Anal. Chim. Acta. 1994. V. 297. P.453.
Моросанова Е.И., Беляков М.В., Золотов Ю.А. Кремний-титановые ксерогели: получение и использование для определения аскорбиновой кислоты и полифенолов // Журн. аналит. химии. 2012. Т. 67. № 1. С. 17. (Morosanova E.I., Belyakov M.V., Zolotov Y.A. Silicon–titanium xerogels: Synthesis and application to the determination of ascorbic acid and polyphenoles // J. Analyt. Chem. 2012. V. 67. P. 14.)
Моросанова Е.И., Беляков М.В., Золотов Ю.А. Кремний-титановые ксерогели: твердофазно-спектрофотометрическое и тест-определение пероксида водорода в дезинфицирующих средствах // Журн. аналит. химии. 2012. Т. 67. № 2. С. 186. (Morosanova E.I., Belyakov M.V., Zolotov Y.A. Silica–titania xerogels: Solid phase spectrophotometric and field test determination of hydrogen peroxide in disinfectants // J. Analyt. Chem. 2012. V. 67. P. 151.)
Morosanova M.A., Morosanova E.I., Anisimov D.I., Zolotov Y.A. Using silica–titania xerogels for solid phase spectrophotometric determination of fluoride in oral hygiene products // Curr. Anal. Chem. 2015. V. 11. P. 291.
Моросанова М.А., Самоделов З.В., Моросанова Е.И. Использование кремний-титановых ксерогелей для твердофазно-спектрофотометрического определения фторид-ионов в искусственной слюне // Аналитика и контроль. 2015. Т. 19. № 4. С. 357.
Morosanova M.A., Morosanova E.I. Silica–titania xerogel for solid phase spectrophotometric determination of salicylate and its derivatives in biological liquids and pharmaceuticals // Chem. Cent. J. 2015. V. 9. P. 64.
Morosanova M.A., Morosanova E.I. Silica–titania sensor material prepared by cetylpyridinium chloride assisted sol–gel synthesis for solid phase spectrophotometric and visual test determination of propyl gallate in food samples // Anal. Methods. 2016. V. 8. P. 8092.
Morosanova M.A., Samodelov Z.V., Morosanova E.I. Determination of food oxalates using silica–titania xerogel modified with eriochrome cyanine R // Sensors. 2018. V. 18. P. 864.
Моросанова Е.И. Кремний-титановые золь-гель материалы: синтез и использование в анализе // Журн. аналит. химии. 2018. Т. 73. № 11. С. 818. (Morosanova E.I. Silica-titania sol-gel materials: Synthesis and analytical applications // J. Analyt. Chem. 2018. V. 73. Р. 1043.)
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. 448 с.
Иванов В.М., Кочелаева Г.А. Пирокатехиновый фиолетовый в спектрофотометрических и новых оптических методах // Успехи химии. 2006. Т. 75. № 3. С. 283. (Ivanov V. M., Kochelayeva G. A. Pyrocatechol violet in spectrophotometric and new optical methods // Russ. Chem. Rev. 2006. V. 75. №. 3. P. 283.)
Неудачина Л.К., Петрова Ю.С. Применение поверхностно-активных веществ в анализе. Екатеринбург: Из-во Урал. ун-та, 2017. 76 с.
Моросанова Е.И., Великородный А.А., Золотов Ю.А., Скорняков В.И. Использование микроволнового излучения для получения модифицированных ксерогелей кремниевой кислоты и ускорения гетерогенных реакций с их участием // Журн. аналит. химии. 2000. Т. 55. № 12. С. 1265. (Morosanova E.I., Velikorodnyi A.A., Zolotov Y.A., Skornyakov V.I. Modifying silicic acid xerogels and accelerating heterogeneous reactions with their participation with the use of microwave radiation // J. Analyt. Chem. 2000. V. 55. P. 1136.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


