Журнал аналитической химии, 2021, T. 76, № 10, стр. 867-875
Ионные жидкости в процессах электрофоретического разделения и концентрирования
Е. А. Бессонова a, *, Л. А. Карцова a, Д. О. Москвичев a
a Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Университетский просп., 26, Петродворец, Россия
* E-mail: lena_pol@inbox.ru
Поступила в редакцию 07.04.2021
После доработки 22.04.2021
Принята к публикации 22.04.2021
Аннотация
Ионные жидкости (ИЖ) находят широкое применение в методах разделения, таких как хроматография и капиллярный электрофорез, благодаря своим уникальным свойствам. В обзоре обсуждаются перспективы применения ИЖ на основе имидазола в качестве модификаторов электрофоретической системы в капиллярном зонном электрофорезе, мицеллярной и микроэмульсионной электрокинетической хроматографии при определении биологически активных веществ (аминокислоты, катехоламины, стероидные гормоны, полифенольные антиоксиданты). Рассмотрены новые подходы к селективному электрофоретическому определению и эффективному онлайн-концентрированию аналитов с участием имидазолиевых ИЖ; примеры применения разработанных подходов для анализа природных объектов (моча, плазма, экстракты растений).
Ионные жидкости (ИЖ) представляют собой обширный класс органических солей со слабо координированными ионами, имеющие температуру плавления ниже 100°С. Есть соли, которые существуют в жидком состоянии при комнатной температуре или ниже; их называют “room temperature – ionic liquids” (RTILs). Ионные жидкости состоят из объемного органического катиона и органического или неорганического аниона (рис. 1) [1].
Рис. 1.
Структуры типичных катионов и анионов, используемых в протонных, апротонных, дикатионных, полимерных и магнитных ионных жидкостях. Катионы (верхний ряд, слева направо): замещенный аммоний, пирролидиний, 1-метил-3-алкилимидазолий, 1,3-бис[3-метилимидазолий-1-ил]-алкан; (второй ряд) фосфоний, пиридиний, поли(диаллилдиметиламмоний), металлический (M+) тетраглим. Анионы (третий ряд): галогениды, формиат, нитрат, гидросульфат, гептафторбутират, бис(пентафторметилсульфанил)имид, тетрафторборат; (нижний ряд) тиоцианат, гексафторфосфат, трис(пентафторэтил)трифторфосфат, дицианамид, поли(фосфоновая кислота), тетрахлорферрат [1].

Изменение катионно-анионного состава влияет на гидрофобность, вязкость, протонные–апротонные свойства ИЖ. Ионные жидкости находят широкое применение в капиллярном электрофорезе [2–6] благодаря своим уникальным физико-химическими свойствам [1, 7]. Возможные взаимодействия (гидрофобные, ион-дипольные, π–π-взаимодействия, образование водородных связей) ИЖ с аналитами влияют на их эффективность и селективность разделения. Кроме того, ИЖ относят к “зеленым” растворителям: они нетоксичны, характеризуются низким давлением насыщенных паров, минимально загрязняют окружающую среду [1].
Первоначально ИЖ использовали в качестве модификаторов в составе фонового электролита [8, 9]. Позднее было показано, что они могут выполнять самые разные функции в условиях капиллярного электрофореза (КЭ): блокировать силанольные гидроксильные группы на стенках кварцевого капилляра, предотвращая сорбцию основных аналитов; динамически или ковалентно модифицировать стенки кварцевого капилляра [10–13]; выступать в качестве ион-парного агента; создавать хромофорный фон, позволяя обнаруживать непоглощающие в УФ-области спектра соединения в условиях косвенного детектирования; участвовать в формировании псевдостационарной фазы (мицеллярной или микроэмульсионной), обеспечивая разделение нейтральных аналитов, а также в процессах онлайн-концентрирования определяемых веществ [6, 14–16]; выполнять роль хирального селектора при разделении энантиомеров [17–19]. Наибольшее применение в методах разделения получили ИЖ на основе имидазолия [6].
Динамическая модификация капилляра. Особый интерес представляют ИЖ, содержащие большой алкильный радикал. Введение ИЖ на основе имидазола в состав фонового электролита в условиях КЭ приводит к динамической модификации стенок кварцевого капилляра, а при определенных концентрациях (выше критической концентрации мицеллообразования, ККМ) ионные жидкости, подобно поверхностно-активным веществам (ПАВ), способны образовывать мицеллы [10, 11, 16]. Все это открывает новые возможности для регулирования эффективности и селективности разделения аналитов различной природы [6].
Исследовано влияние ионных жидкостей С12MImCl и C16MImCl на электрофоретические параметры миграции гидрофильных аналитов (биогенные амины адреналин, норадреналин, норметанефрин и дофамин, аминокислоты), а также гидрофобных аналитов (стероидные гормоны кортизол, кортизон, кортикостерон, 11-дезоксикортизол, 11-дезоксикортикостерон) при разных значениях рН (2.0, 9.3) фонового электролита [20–22]. Указанные соединения представляют собой биологически активные вещества, играющие важную роль при диагностике заболеваний нервной, сердечно-сосудистой и эндокринной систем.
В случае катехоламинов и аминокислот (ионогенные аналиты) реализован режим зонного капиллярного электрофореза (КЗЭ). Аминокислоты и катехоламины при рН фонового электролита ниже 7 заряжены положительно и в условиях КЗЭ мигрируют в направлении катода за счет собственных электрофоретических подвижностей. При введении ионной жидкости в состав фонового электролита в концентрации, меньшей чем ККМ (<12.15 мМ) происходит динамическая модификация стенок кварцевого капилляра, электроосмотический поток (ЭОП) обращается и увеличивается эффективность как в случае электрофоретического определения аминокислот, так и катехоламинов в 2–3 раза за счет предотвращения сорбции основных аналитов (табл. 1).
Таблица 1.
Условия электрофоретического разделения и пределы обнаружения катехоламинов, аминокислот и стероидов без добавки и с добавкой ионной жидкости в фоновый электролит
| Условия КЭ | Катехоламины | Стероидные гормоны | |
|---|---|---|---|
| Без введения ионной жидкости | Фоновый электролит | 50 мМ ацетатно-аммонийный буферный раствор (pH 4.0) | 25 мМ фосфатный буферный раствор (рН 2.5), 25 мМ ДДСН*, 5 М мочевины |
| Эффективность тыс. т.т. | 75–80 | 200–230 | |
| ПО** | 3–4 мкг/мл | 5 мкг/мл | |
| С введением ионной жидкости | Фоновый электролит | 50 мМ ацетатно-аммонийный буферный раствор (pH 4.0), 0.5 мМ С16MImCl |
25 мМ ацетатно-аммиачный буферный раствор (рН 4.0), 15 мМ С16MImCl, 12 мМ ГП-β-ЦД*** |
| Эффективность тыс. т.т. | 210–410 | 250–750 | |
| ПО | 1–2 мкг/мл | 2 мкг/мл | |
Ионные жидкости – модификаторы мицелл и микроэмульсий. Стероидные гормоны являются нейтральными и гидрофобными соединениями и могут быть определены лишь в режиме мицеллярной (МЭКХ) или микроэмульсионной электрокинетической хроматографии (МЭЭКХ). В этом случае ионная жидкость должна выполнять роль либо агента, образующего мицеллы или микроэмульсию (концентрация превышает ККМ), либо модификатора псевдостационарной фазы (ПСФ), образованной другим детергентом. Нами в условиях МЭКХ и МЭЭКХ исследованы оба варианта при разделении кортикостероидов [23, 24].
Ионные жидкости в мицеллярной электрокинетической хроматографии. При концентрации ИЖ, превышающей значение ККМ, реализуется режим мицеллярной электрокинетической хроматографии. В этом случае селективность разделения аминокислот и катехоламинов увеличивается. Рост факторов селективности связан с реализуемыми взаимодействиями аналитов с псевдостационарной фазой – гидрофобной внутренней полостью сформированной мицеллы и π–π-взаимодействиями с имидазольным кольцом. Селективное разделение стероидных гормонов с применением ИЖ в качестве мицелл удалось осуществить путем добавления 2-гидроксипропил-β-циклодекстрина в фоновый электролит [23]. Он может образовывать комплексы включения с аналитами, что определяется главным образом стерическими факторами, гидрофобными взаимодействиями, возможным образованием водородных связей и эффектами сольватации. Полученные результаты сопоставлены с влиянием традиционно используемого катионного детергента – цетилтриметиламмоний бромида и показано, что применение ИЖ обеспечивает более высокие значения эффективностей.
Таким образом, введение ИЖ в состав фонового электролита позволило снизить пределы обнаружения (ПО) при разделении стероидов, катехоламинов и аминокислот, однако чувствительность метода КЭ оказалось недостаточной для определения этих аналитов в реальных объектах, поскольку содержания катехоламинов и свободных кортикостероидов в биологических жидкостях находятся на уровне нг/мл. Именно поэтому требовалось выявить возможности различных вариантов онлайн-концентрирования с участием ИЖ (стэкинг с усилением поля, стэкинг с усилением поля с водной пробкой, динамический рН-скачок, свипинг и др.) и/или, в случае необходимости, предложить новые способы.
Ионные жидкости в процессах онлайн-концентрирования в мицеллярной электрокинетической хроматографии. Сочетание процессов онлайн-концентрирования с применением в составе фонового электролита веществ, способных блокировать силанольные группы кварцевого капилляра и тем самым устранять или снижать сорбцию определяемых соединений, может сопровождаться ростом эффективности и селективности разделения, а также снижением пределов обнаружения до значений, достаточных для определения следовых количеств диагностически важных аналитов в биологических жидкостях.
Проведен поиск условий электрофоретического онлайн-концентрирования катехоламинов и стероидных гормонов в МЭКХ с участием ИЖ C12MImCl и C16MImCl (стэкинг с усилением поля, стэкинг с введением водной пробки, свипинг); установлены факторы, влияющие на процесс онлайн-концентрирования аналитов: время ввода и состав раствора пробы (вода, органический растворитель, добавки циклодекстринов, ИЖ, додецилсульфата натрия (ДДСН)), концентрация и природа фонового электролита [23, 25].
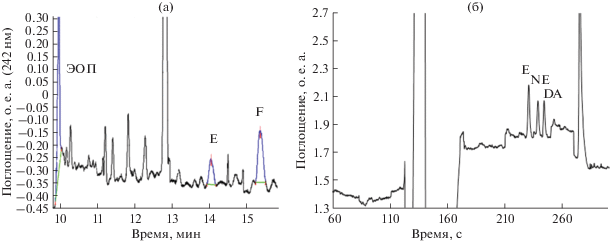
Выявлены возможности интересного варианта свипинга с высокопроводящей матрицей пробы с участием ионной жидкости C16MimCl (рис. 2а) [23, 25]. Установлено, что использование высокопроводящей матрицы пробы и введение ИЖ С16MImCl в состав фонового электролита приводит к значительному росту эффективности до ~1 × 106 т.т., что обеспечило снижение ПО катехоламинов до 50 нг/мл, стероидов – до 25–100 нг/мл и возможность их определения в реальных объектах. Факторы концентрирования составили 40–48 для стероидов и 83–112 для катехоламинов. Метод основан на предварительном концентрировании псевдостационарной фазы (мицелл ИЖ и ДДСН) на границе с высокопроводящей зоной пробы, что обеспечивает увеличение эффективности процесса свипинга с участием ИЖ (рис. 2б). Показано, что эффективность свипинга в значительной степени зависит от концентрации буфера в растворе образца. В случае катехоламинов ИЖ С16MImCl выполняла роль мицеллообразующего агента, при разделении стероидов ИЖ использовались как модификаторы мицелл, образованных ДДСН. Выбранный электрофоретический режим реализован при анализе мочи и сыворотки крови.
Рис. 2.
(а) Электрофореграмма стероидных гормонов (0.5 мкг/мл) (МЭКХ; С16MImCl в составе фонового электролита). Условия: прибор “Капель-105”; ввод пробы: 100 с × 30 мбар; фоновый электролит: 25 мМ ацетатный буферный раствор (рН 4.0), 25 мМ ДДСН, 0.5 мМ С16MImCl, 15% CH3OH. Раствор пробы: 60 мМ ацетатный буферный раствор (рН 4.0). Капиллярный электрофорез: –20 кВ, 242 нм. (б) Схема механизма концентрирования стероидных гормонов в условиях свипинга c высокопроводящей матрицей пробы [23]. Стероидные гормоны: кортизол (F), кортизон (E), 11‑дезоксикортизол (S), 11-дезоксикортикостерон (DOC), 11-дегидрокортикостерон (B).

Биогенные амины и стероидные гормоны в моче и крови находятся в двух формах: свободной и связанной. Биологической активностью обладает только свободная фракция, поэтому гидролиз конъюгатов не проводили.
Предложена [23] схема электрофоретического определения (МЭКХ) стероидных гормонов в реальных объектах (моча) с введением ионной жидкости C16MImCl в фоновый электролит (25 мМ ацетатно-аммиачный буферный раствор, 25 мМ ДДСН и 15 об. % метанола) и внутрикапиллярным онлайн-концентрированием. Пробоподготовка включала жидкостную экстракцию аналитов с использованием хлороформа в случае мочи и дихлорметана в случае сыворотки крови. Степень извлечения стероидов составила 89–95.1%, ПО – 3–5 нг/мл, что достаточно для определения эндо- и экзогенных стероидных гормонов в биологических жидкостях (рис. 3).
Рис. 3.
Электрофореграмма (а) стероидных гормонов в образце мочи (МЭКХ с онлайн-концентрированием) (а); катехоламинов в образце мочи (МЭКХ, свипинг с высокопроводящей матрицей пробы). Условия МЭКХ: (а) фоновый электролит 25 мМ ацетатный буферный раствор (pH 4.0), 25 мМ ДДСН, 0.5 мМ C16MImCl, 15% CH3OH. Раствор пробы: 60 мМ ацетатный буферный раствор (pH 4.0). Ввод пробы: 100 × 30 мбар. (б) Фоновый электролит 10 мМ ацетат аммония, 150 мМ муравьиная кислота (рН 4.0), 0.5 мМ С16MImCl. Раствор пробы: 60 мМ ацетат аммония, 150 мМ муравьиная кислота (рН 4.0). Ввод пробы: 30 с × 50 мбар [23, 25]. Катехоламины: адреналин (E), норадреналин (NE), дофамин (DA).
Разработана схема электрофоретического определения катехоламинов в образцах мочи с участием ИЖ C16MImCl в составе фонового электролита и применением предложенного варианта онлайн-концентрирования [25]. Подготовку образцов мочи для определения катехоламинов проводили методом твердофазной экстракции на активированном оксиде алюминия по схеме, описанной в работе [26]. Степени извлечения составили 85–90%. На рис. 3б представлена электрофореграмма образца экстракта мочи в найденных условиях. Воспроизводимость результатов (sr) 2.7–4.2%.
Таким образом, введение ИЖ в фоновый электролит обеспечило значительное увеличению эффективности и снижение ПО стероидов и катехоламинов. Применение разработанной схемы онлайн-концентрирования с участием ИЖ С16MImCl и предварительной пробоподготовки образцов мочи и сыворотки крови позволяет определять катехоламины и стероидные гормоны в реальных объектах методом МЭКХ с высокими чувствительностью и воспроизводимостью.
Ионные жидкости в микроэмульсионной электрокинетической хроматографии. В последние годы при разделении сложных смесей гидрофобных аналитов особое внимание уделяется методу МЭЭКХ, где фоновым электролитом является микроэмульсия [27–37]. К достоинствам метода МЭЭКХ следует отнести возможность одновременного разделения заряженных и нейтральных, гидрофобных и гидрофильных аналитов и высокие коэффициенты распределения исследуемых веществ. В методе МЭЭКХ нейтральные аналиты способны распределяться между каплями “масла” и водной фазой в соответствии с их гидрофобностью [34, 37]. Различные по природе соединения могут быть разделены за счет возможности варьирования широкого набора параметров: концентрации и природы ПАВ [28], “масла” [29], вспомогательного ПАВ (со-ПАВ) [30], различных добавок в фоновый электролит [31, 32], pH и природы буферного раствора [33].
Значительные перспективы открываются и при использовании ИЖ в составе микроэмульсии в МЭЭКХ [38–40]. Ионная жидкость, в зависимости от длины алкильного радикала и природы аниона, может выступать в роли любого из трех компонентов микроэмульсии.
Выявлены перспективы применения гидрофильных ионных жидкостей на основе имидазола (C12MImCl, C16MImCl) в качестве модификаторов и ПАВ, а также гидрофобных ИЖ (C6MImBF4) в качестве “масла” в составе микроэмульсии при разделении стероидных гормонов методом МЭЭКХ [24].
Определен ряд факторов (концентрация ИЖ, природа и значение рН фонового электролита, соотношение различных компонентов микроэмульсии), влияющих на эффективность и селективность разделения аналитов. Найдены подходящие условия для полного разделения модельной смеси стероидных гормонов: кортизола (F), кортизона (E), 11-дезоксикортизола (S), 11-дезоксикортикостерона (DOC), 11-дегидрокортикостерона (B). Сопоставлены аналитические характеристики методов МЭКХ и МЭЭКХ при определении стероидов.
Введение в состав микроэмульсии 2-гидроксипропил-β-циклодекстрина (ГП-β-ЦД) (15 мМ) существенно влияет на селективность разделения (рис. 4). Этот макроцикл способен формировать с молекулами стероидов комплексы по типу “гость−хозяин” [41]. Образование комплекса включения ГП-β-ЦД с кортикостероидами обеспечило полное разделение аналитов, при этом эффективность возросла до 900 тыс. т и снизилась продолжительность анализа до 7 мин. Следует отметить, что происходит изменение порядка миграции стероидных гормонов. В присутствии ГП-β-ЦД лучшие результаты получены при более низком содержании ИЖ.
Рис. 4.
Влияние 2-гидроксипропил-β-циклодекстрина на разделение стероидных гормонов с использованием ионной жидкости C16MImCl. Условия: фоновый электролит: 0.8% C16MImCl, 0.5% этилацетата, 1.2% бутанола-1, 97.7% 5 мМ фосфатного буферного раствора, pH 7 (а); 0.8% C16MImCl, 0.5% этилацетата, 1.2% бутанола-1, 97.7% 15 мМ ГП-β-ЦД, 5 мМ фосфатный буферный раствор, pH 7. Напряжение: −20 кВ. Ввод пробы: 2 с, 3 кПа [24].

Применение методов онлайн-концентрирования (электростэкинг и свипинг) позволило снизить пределы обнаружения аналитов до 50 нг/мл, что достаточно для их обнаружения в образцах мочи. На основании полученных результатов предложен экспрессный способ определения стероидных гормонов в образцах мочи и сыворотки крови методом МЭЭКХ с введением имидазолиевой ионной жидкости в состав фонового электролита.
Использование ионной жидкости C6MImBF4 в качестве масла позволило разделить смесь стероидов при варьировании содержания C6MImBF4 в диапазоне 0.3–1 мас. %. Оптимальное содержание ИЖ составило 0.7%.
Сопоставлены аналитические характеристики методов МЭКХ и МЭЭКХ с участием ИЖ и традиционно используемого ПАВ цетилтриметиламмоний бромида при разделении стероидных гормонов (табл. 2) [24]. Все варианты обеспечивают достаточно селективное разделение аналитов, однако введение ИЖ приводит к значительному росту эффективности.
Таблица 2.
Сравнение аналитических характеристик методов мицеллярной и микроэмульсионной электрокинетической хроматографии при разделении стероидных гормонов
| Параметр | МЭКХ с С16MImCl |
МЭЭКХ с С16MImCl |
МЭКХ с ЦТАБ | MЭЭКХ с ЦТАБ |
|---|---|---|---|---|
| Эффективность, т. т. | 400 000–610 000 | 630 000–820 000 | 350 000–500 000 | 300 000–400 000 |
| Предел обнаружения, нг/мл | 25–100 | 25–100 | 50–120 | 50–120 |
| Продолжительность анализа, мин | 15 | 7 | 15 | 7 |
| cмин, % | 1.3 – 1.5 | 0.8 | 0.5 | 0.8 |
Исследованы возможности применения гидрофильной ИЖ на основе имидазола (C16MImCl) в качестве ПАВ и гидрофобных ИЖ (C6MImBF4, C6MImN(SO2CF3)2) в качестве “масла” в составе микроэмульсии при разделении полярных аналитов, таких как полифенольные антиоксиданты, методом МЭЭКХ [42]. Показано, что введение ИЖ в состав микроэмульсии в качестве как ПАВ, так и масла приводит к значительному росту эффективности (200–650 тыс. т. т.). Установлено, что применение гидрофобных ИЖ (C6MImBF4, C6MImN(SO2CF3)2) обеспечивает бóльшие чувствительность и селективность разделения полифенолов по сравнению с гидрофильной ИЖ (С16MImCl) в МЭЭКХ. Состав микроэмульсии (мас. %) для селективного разделения катехинов с применением ИЖ в качестве “масла”: 0.6 ДДСН, 0.7 C6MImBF4, 1.6 бутанола-1, фосфатный буферный раствор с pH 7 (рис. 5). Достигнуты пределы обнаружения на уровне нг/мл. Выбранные условия МЭЭКХ использованы для определения полифенолов в образцах зеленого чая (рис. 5).
Рис. 5.
Электрофореграммы разделения катехинов и кофеина в модельных смесях (а), и в экстракте зеленого чая (метод МЭЭКХ; C6MImBF4 в составе микроэмульсии в качестве масла) (б). Условия: 0.6% (w/v) ДДСН, 0.7% (w/v) C6MImBF4, 1.6% (w/v) бутанола-1, фосфатный буферный раствор, pH 7, (а) – 280 нм; (б), (в) – 200 нм. Напряжение: 20 кВ. Ввод пробы: 15 с, 30 мбар [42]. Аналиты: эпикатехин (EC), галлокатехин (GC), эпигаллокатехин (EGC), эпигаллокатехин галлат (EGCG), эпикатехин галлат (ECG), кофеин (Caf).

Таким образом, применение ИЖ C16MImCl и C6MImBF4 в методе МЭЭКХ приводит к увеличению эффективности и сокращению продолжительности анализа по сравнению с ДДСН и гептаном при разделении катехинов. Состав микроэмульсии (мас. %) 0.8 ДДСН, 0.7 C6MImBF4, 1.6 бутанола-1, фосфатный буферный раствор с pH 7 подходит для селективного разделения как гидрофобных, так и гидрофильных соединений.
* * *
Ионные жидкости на основе имидазола в составе фонового электролита могут выполнять различные функции: обеспечивать дополнительные взаимодействия с аналитами, динамически модифицировать стенки кварцевого капилляра, выполнять роль мицелло- или микроэмульсиообразующего агента. Применение ИЖ в процессах онлайн-концентрирования в КЗЭ и МЭКХ (стэкинг, свипинг с высокопроводящей матрицей пробы) обеспечило значительное увеличение чувствительности определения биологически активных веществ, что продемонстрировано на примере гидрофильных (катехоламинов, аминокислот) и гидрофобных (стероидные гормоны и полифенолы) аналитов. Предложены схемы электрофоретического определения (МЭКХ) стероидных гормонов и катехоламинов в реальных объектах (моча) с введением ионной жидкости C16MImCl в фоновый электролит, а также определение (МЭЭКХ) полифенолов и стероидных гормонов с применением ИЖ в составе микроэмульсии в качестве масла и ПАВ соответственно. Сопоставление с традиционно используемыми катионными ПАВ показало, что ИЖ позволяют существенно повысить чувствительность определения аналитов различной природы. Достигнуты пределы обнаружения (на уровне нг/мл), достаточные для их определения в природных объектах.
Работа выполнена при финансовой поддержке проекта РНФ № 19-13-00370. Выражаем благодарность Ресурсному центру СПбГУ “Методы анализа состава вещества” за предоставленное оборудование.
Список литературы
Hayes R., Warr G.G., Atkin R. Structure and nanostructure in ionic liquids // Chem. Rev. 2015. V. 115. P. 6357.
Sun P., Armstrong D.W. Ionic liquids in analytical chemistry // Anal. Chim. Acta. 2010. V. 661. P. 1.
Soukup-Hein R.J., Warnke M.M., Armstrong D.W. Ionic liquids in analytical chemistry // Annu. Rev. Anal. Chem. 2009. V. 2. P. 145.
Tanga S., Liu S., Guo Y., Liu X., Jiang S. Recent advances of ionic liquids and polymeric ionic liquids in capillary electrophoresis and capillary electrochromatography // J. Chromatog A. 2014. V. 1357. P. 147.
Yu R.B., Quirino J.P. Ionic liquids in electrokinetic chromatography // J. Chromatogr A. 2021. V. 1637. Article 461801.
Карцова Л.А., Бессонова Е.А., Колобова Е.А. Ионные жидкости – модификаторы хроматографических и электрофоретических систем // Журн. аналит. химии. 2016. Т. 71. С. 141. (Kartsova L.А., Bessonova Е.А., Kolobova E.A. Ionic liquids as modifiers of chromatographic and electrophoretic systems // J. Anal. Chem. 2016. V. 71. P. 147.)
Ionic Liquids in Chemical Analysis (Analytical Chemistry) / Ed. Koel M. US: CRC Press, 2009.
Vaher M., Koel M., Kaljurand M. Non-aqueous capillary electrophoresis in acetonitrile using ionic-liquid buffer electrolytes // Chromatographia. 2001. V. 53. P. S302.
Yanes E.G., Gratz S.R., Baldwin M.J., Robison S.E., Stalcup A.M. Capillary electrophoretic application of 1‑alkyl-3-methylimidazolium-based ionic liquids // Anal. Chem. 2001. V. 73. P. 3838.
Guo X.F., Chen H.Y., Zhou X.H., Wang H., Zhang H.S. N-methyl-2-pyrrolidonium methyl sulfonate acidic ionic liquid as a new dynamic coating for separation of basic proteins by capillary electrophoresis // Electrophoresis. 2013. V. 34. P. 3287.
Li J., Han H., Wang Q., Liu X., Jiang S. Polymeric ionic liquid as a dynamic coating additive for separation of basic proteins by capillary electrophoresis // Anal. Chim. Acta. 2010. V. 674. P. 243.
Tursen J., Wang A., Qin W. Electrophoretic separation of acidic and basic proteins in the presence of micromolar concentrations of an ionic liquid // Microchim. Acta. 2011. V. 174. P. 63.
Li J., Yu T., Xu G., Du Y., Liu Z., Feng Z., Yang X., Xi Y., Liu J. Synthesis and application of ionic liquid functionalized β-cyclodextrin, mono-6-deoxy-6-(4-amino-1,2,4-triazolium)-β-cyclodextrin chloride, as chiral selector in capillary electrophoresis // J. Chromatogr. A. 2018. V. 1559. P. 178.
El-Hady D.A., Albishri H.M., Wätzig H. Ionic liquids in enhancing the sensitivity of capillary electrophoresis: Off-line and on-line sample preconcentration techniques // Electrophoresis. 2016. V. 37. P. 1609.
Ferreira T.A., Flores-Aguilar J.F., Santos E.M., Rodriguez J.A., Ibarra I.S. New poly(ionic liquid) based fiber for determination of oxytetracycline in milk samples by application of SPME-CE technique // Molecules. 2019. V. 24. P. 430.
Quirino J.P., Anres P., Sirieix-Plénet J., Delaunay N., Gareil P. Potential of long chain ionic liquids for on-line sample concentration techniques: Application to micelle to solvent stacking // J. Chromatogr. A. 2011. V. 1218. P. 5718.
Li J., Yu T., Xu G., Du Y., Liu Z., Feng Z., Yang X., Xi Y., Liu J. Synthesis and application of ionic liquid functionalized β-cyclodextrin, mono-6-deoxy-6-(4-amino-1,2,4-triazolium)-β-cyclodextrin chloride, as chiral selector in capillary electrophoresis // J. Chromatogr. A. 2018. V. 1559. P. 178.
Yu J., Zuo L., Liu H., Zhang L., Guo X. Synthesis and application of a chiral ionic liquid functionalized β-cyclodextrin as a chiral selector in capillary electrophoresis // Biomed. Chromatogr. 2013. V. 27. P. 1027.
Kolobova E.A., Kartsova L.A., Bessonova E.A., Alopina E.V., Safonova E. The possibilities of amino acid ionic liquids as a chiral selectors at separation of enantiomers of amino acids and β-blockers // J. Chromatogr. Sep. Tech. 2016. V. 7. P. 97.
Колобова Е.А., Карцова Л.А., Бессонова Е.А. Ионные жидкости на основе имидазола в качестве модификаторов электрофоретических систем при определении биогенных аминов и стероидных гормонов // Вестник СПбГУ. Сер. 4. 2015. Т. 2(60). Вып. 3. С. 175.
Колобова Е.А., Карцова Л.А., Бессонова Е.А. Применение ионных жидкостей на основе имидазола при электрофоретическом определении аминокислот в моче // Журн. аналит. химии. 2015. Т. 70. № 11. С. 1179. (Kolobova E.A., Kartsova L.А., Bessonova Е.А. Application of ionic liquids based on imidazole to the electrophoretic determination of amino acids in urine // J. Anal. Chem. 2015. V. 70. P. 1342.)
Kolobova E.A., Kartsova L.A., Kravchenko A.V., Bessonova E.A. Imidazolium ionic liquids as dynamic and covalent modifiers of electrophoretic systems for determination of catecholamines // Talanta. 2018. V. 188. P. 183.
Бессонова Е.А., Карцова Л.А., Галлямова В.Ф. Влияние ионной жидкости хлорид 3-метил-1-цетилимидазолия на процессы электрофоретического концентрирования стероидных гормонов // Журн. аналит. химии. 2016. Т. 71. № 7. С. 724. (Bessonova E.A., Kartsova L.A., Gallyamova V.F. Effect of 3-methyl-1-cetylimidazolium chloride ionic liquid on the electrophoretic preconcentration of steroid hormones // J. Anal. Chem. 2016. V. 71. P. 696.)
Карцова Л.А., Бессонова Е.А., Москвичев Д.О. Разделение стероидных гормонов методом микроэмульсионной электрокинетической хроматографии с участием ионных жидкостей // Аналитика и контроль. 2019. Т. 23. № 2. С. 193. (Kartsova L.A., Bessonova E.A., Moskvichev D.O. Separation of steroid hormones by microemulsion electrokinetic chromatography involving ionic liquids // Anal. Control. 2019. V. 23. P. 193.)
Bessonova E.A., Kartsova L.A., Gallyamova V.F. Ionic liquids based on imidazole for on-line concentration of catecholamines in capillary electrophoresis // J. Sep. Sci. 2017. V. 40. P. 2304.
Kartsova L.A., Sidorova A.A., Ganga O.V. Chromatographic and electrophoretic determination of catecholamines, metanephrines and 3,4-dihydrohyphenylalanine in urine and human plasma // Sorption Chromatogr. Process. 2008. V. 8. P. 75.
Watarai H. Microemulsion capillary electrophoresis // Chem. Lett. 2006. V. 20. P. 391.
Pomponio R., Gotti R., Fiori J., Cavrini V. Microemulsion electrokinetic chromatography of corticosteroids // J. Chromatogr. A. 2005. V. 1081. P. 24.
Boso R.L., Bellini M.S., Miksik I., Deyl Z. Microemulsion electrokinetic chromatography with different organic modifiers: separation of water- and lipid-soluble vitamins // J. Chromatogr. A. 1995. V. 709. P. 11.
Pomponio R., Gotti R., Luppi B., Cavrini V. Microemulsion electrokinetic chromatography for the analysis of green tea catechins: Effect of the cosurfactant on the separation selectivity // Electrophoresis. 2003. V. 24. P. 1658.
Yin C., Cao Y., Ding S., Wang Y. Rapid determination of water- and fat-soluble vitamins with microemulsion electrokinetic chromatography // J. Chromatogr. A. 2008. V. 1193. P. 172.
Nieto N.K., Rodriguez J.A., Ibarra I.S., Cruz-Borbolla J., Vasquez-Perez J.M. Determination of antibiotics in feedstuff samples by microemulsion electrokinetic chromatography using fullerene as additive // Electrophoresis. 2018. V. 39. P. 2228.
Subirats X., Yuan H.P., Chaves V., Marzal N., Rosés M. Microemulsion electrokinetic chromatography as a suitable tool for lipophilicity determination of acidic, neutral, and basic compounds // Electrophoresis. 2016. V. 37. P. 2010.
Buchberger W. Microemulsion electrokinetic chromatography // Methods Mol. Biol. 2016. V. 1483. P. 91.
Giringer K., Holtkamp H.U., Movassaghi S., Tremlett W.D.J., Lam N.Y.S., Kubanik M., Hartinger C.G. Analysis of ruthenium anticancer agents by MEEKC-UV and MEEKC–ICP-MS: Impact of structural motifs on lipophilicity and biological activity // Electrophoresis. 2018. V. 39. P. 1201.
Chu B.L., Guo B.Y., Wang Z.H., Lin J.M. Enantioseparation of esbiothrin by cyclodextrin-modified microemulsion and micellar electrokinetic chromatography // J. Sep. Sci. 2008. V. 31. P. 3911.
Проблемы аналитической химии Т. 18: Капиллярный электрофорез / Под ред. Карцовой Л.А. Научный совет по аналитической химии ОХНМ. М.: Наука, 2014. 442 с. [Издано при поддержке РФФИ].
Cao J., Qu H., Cheng Y. The use of novel ionic liquid-in-water microemulsion without the addition of organic solvents in a capillary electrophoretic system // Electrophoresis. 2010. V. 31. P. 3492.
Li F., Yang F.Q., Xia Z.N. Simultaneous determination of ten nucleosides and related compounds by MEEKC with [BMIM]PF6 as oil phase // Chromatographia. 2013. V. 76. P. 1003.
Ni X., Yu M., Cao Y. Microstructure of microemulsion modified with ionic liquids in microemulsion electrokinetic chromatography and analysis of seven corticosteroids // Electrophoresis. 2013. V. 34. P. 2568.
Flood K.G., Reynolds E.R., Snow N.H. Characterization of inclusion complexes of betamethasone-related steroids with cyclodextrins using high-performance liquid chromatography // J. Chromatogr. A. 2000. V. 903. P. 49.
Kartsova L., Moskvichev D., Bessonova E., Peshkova M. Imidazolium ionic liquids in microemulsion electrokinetic chromatography for separation of polyphenol antioxidants // Chromatographia. 2020. V. 83. P. 1001.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


