Журнал аналитической химии, 2021, T. 76, № 10, стр. 876-889
Пассивные сорберы на основе углеродных материалов и их сравнение для оценки нефтегазоносности пород
А. В. Пирогов a, Е. С. Маркова a, *, В. Ю. Ананьев b
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
b Федеральный центр гигиены и эпидемиологии Федеральной службы по надзору
в сфере защиты прав потребителей и благополучия человека
117105 Москва, Варшавское шоссе, 19A, Россия
* E-mail: kate.s.markova@yandex.ru
Поступила в редакцию 07.04.2021
После доработки 12.04.2021
Принята к публикации 12.04.2021
Аннотация
Рассмотрены сорбенты, применяемые для анализа воздуха на содержание в нем различных органических соединений с последующим их определением методом термодесорбционной газовой хромато-масс-спектрометрии (ГХ-МС). Tenax-TA является самым распространенным материалом для решения подобных задач, но он не лишен недостатков. Приведены характеристики сорбентов семейств Tenax, Carbosieve, Carboxen, Carbotrap, Capbopack, Porapak, Chromosorb, полимерных смол XAD, а также активированных углей и некоторых монолитных углеродных материалов. Обсуждены их достоинства и недостатки для сорбции/термодесорбции углеводородов. Обоснованы преимущества монолитных углеродных материалов и необходимость разработки нового отечественного материала для аналитической ГХ-МС с термодесобцией при решении нефтепоисковых задач.
Загрязнение летучими органическими соединениями (ЛОС) воздуха внутри и вне помещений представляет опасность для здоровья людей. В связи с этим существует потребность в разработке простого, недорогого и надежного способа определения концентраций летучих органических соединений.
Пассивный пробоотбор – перспективный метод отбора проб для определения средневзвешенного по времени среднего значения концентрации летучих органических соединений в воздухе [1, 2]. Во-первых, такой способ отбора проб очень прост – требуется только установить патрон с сорбентом (далее – сорбера) на некоторое время в районе, где требуется определить концентрацию ЛОС (помещение, природный участок и т.п.). Во-вторых, он не требует применения насоса, в отличие от метода активного отбора проб. В-третьих, устройства для отбора проб легкие и недорогие, они удобнее для транспортировки и хранения по сравнению с громоздкими канистрами отбора воздуха для доставки его в лабораторию.
Наиболее сложным шагом в пассивном пробоотборе является выбор сорбента и определение времени экспозиции сорбера. Последний параметр определяется чувствительностью метода последующего анализа и зависит от так называемой “диффузионной скорости загрузки” (UR) [3]. Во многих исследованиях UR определяли из теории диффузии [4], в лабораторных камерах [5–8] и путем сравнения активной и пассивной выборки “в поле” [9, 10]. На величину UR влияют многие факторы, в том числе выбор сорбента, конфигурация трубки, длительность воздействия и условия окружающей среды.
Для конкретного ЛОС идеальная скорость поглощения (UR(опт), мл/мин) составляет [11]:
где D – коэффициент диффузии соединения, см2/с; A – площадь поперечного сечения сорбера, см2; L – воздушный зазор между корпусом сорбера и поверхностью сорбента, см; 60 – коэффициент для преобразования мл/с в мл/мин. Из рис. 1 видно, что для наиболее успешной и быстрой сорбции параметр А должен иметь высокое значение, а параметр L – по возможности минимальное.Рис. 1.
Структура и геометрия пассивного пробоотборника трубчатого типа для улавливания летучих органических соединений.

Коэффициент диффузии D является физическим свойством химического вещества и может быть экспериментально определен или рассчитан. В идеале UR(опт) может быть теоретически рассчитана для любого соединения. Однако, UR(реал) значительно отличается от UR(опт) из-за конвекции, специфических свойств сорбента, обратной диффузии (летучести сорбированных аналитов) и насыщения сорбента в течение длительного времени.
К сожалению, только небольшая часть летучих органических соединений охарактеризована значениями UR(опт), определенными и подтвержденными в лаборатории и/или в натурном эксперименте. Для определения этой величины требуются сложные приборы, хорошо контролируемые лабораторные условия и занимающие много времени полевые тесты, что делает непрактичным для обычных пользователей экспериментальное определение UR. Обычно эту величину определяют экспериментально или берут из публикаций, посвященных использованию того или иного сорбера. Для градуировки используют метод внутреннего стандарта или цветовую полуколичественную шкалу (если сорбент меняет цвет в зависимости от количества поглощенного вещества/веществ).
Среди методов обнаружения новых залежей углеводородов (УВ) особый интерес представляет площадная геохимическая съемка. Этот высокотехнологичный метод основан на использовании пассивных сорберов с различными сорбентами, которые извлекают из почвенного воздуха углеводороды, характерные для нефтей. Их наличие и концентрация отражают географическое расположение нефтенасыщенной зоны. Технология пассивной адсорбции углеводородов почвенно-грунтовых газов (от этана С2 до фитана С20) основана на известной теории Пирсона о так называемом “углеводородном дыхании” недр – явлении диффузионного проникновения углеводородов в надзалежное пространство путем микрофильтрации, что подтверждается на многочисленных месторождениях нефти и газа. На рис. 2 схематически представлен такой способ пробоотбора. Типичное время сорбции 10–14 дней.
Данный способ поиска новых месторождений не требует больших денежных затрат [12], присутствия оператора при пробоотборе (достаточно поместить сорбент в исследуемую среду на определенное время [13]), а также позволяет эффективно оценить нефтегазоносность территории за счет поглощения широкого спектра соединений, являющихся нефтяными маркерами (н-алканы, изоалканы, циклоалканы, моно- и полиароматические соединения (ПАУ) и т.д.) [12].
На сегодняшний день разработано более 200 материалов, различающихся по механизму сорбции, значениям нефте- и водопоглощения, структуре материала и т.д. [14].
Цель данного сообщения – сравнение свойств некоторых порошковых сорбентов и оценка пригодности этих материалов для площадной геохимической съемки. Микрофотографии сорбентов представлены на рис. 3.
Для прогноза нефтегазоносности территории наиболее информативными являются летучие органические соединения С8–С20 [24–26]. Более тяжелые УВ обладают низким давлением насыщенных паров при нормальных условиях, из-за чего их сорбция в почвенном воздухе является проблематичной. В табл. 1 перечислены материалы, используемые для определения органических веществ методом термодесорбционной газовой хромато-масс-спектрометрии (ТД-ГХ-МС). Наиболее распространенным среди них является Tenax-TA.
Таблица 1.
Сорбенты для улавливания паров углеводородов
| Название материала | Состав | Область применения (определяемые соединения) | Площадь поверхности, м2/г | Рекомендуемая температура десорбции, °С | |
|---|---|---|---|---|---|
| Tenax-TA | Поли(2,6-дифенил-п-фениленоксид) | Полиароматические соединения (ПАУ: флуорен, аценафтен, аценафтилен, фенантрен, антрацен, т.д.) [27], н-алканы, изоалканы и моноароматические углеводороды в диапазоне С7–С15 [24], хлорбензальмалондинитрил [28] | 35 | 280 | |
| Tenax-GR | Частично графитированный Tenax-TA (примерно 20–30% ГС) | Низкомолекулярные ЛОС (этан, бутан, хлорметан, др.), углеводороды С5–С8 (ксиленолы, толуол, др.) [29], С7–С30 (ПАУ, моноароматические соединения, полихлорированные дифенилы) | 25 | 320 | |
| Carbosieve и Carboxen | Углеродные молекулярные сита | УВ С3–С9 (Carboxen-1016), С2–С5 (Carbosieve-G, Carbosieve S-III, Carboxen-1032) | 400–1500 | 330 | |
| Carbopack, Carbograph и Carbotrap | Графитированный углерод (размер частиц от 100 до 800 мкм) | УВ С5–С12 (Carbopack-B), C5–C20 (Caprotrap-202), C2–C14 (Carpotrap-200), хлорбензальмалондинитрил (Carbotrap-300) [28], алкилбензолы и алифатические соединения от C8 до C20 (Carbopack-C), УВ С3–С8 (Carbograph-5TD) [30] | 5–240 | 330 | |
| XAD-2, XAD-4, XAD-7 | Сополимер стирола и дивинилбензола (ДВБ) | Тиофосфаты, органические кислоты (фталевая, янтарная), примеси нитросоединений (XAD-2) [31] | 290–750 | 150–200 | |
| АУ | Пористый углеродный материал | Алканы, галогеналканы, кетоны, спирты, эфиры, ацетон [31], ПАУ [32] | 800–1000 | 400 | |
| PoraPak | P | Сополимер стирола и ДВБ | Алканы С5–С8 [33], спирты, гликоли, альдегиды, кетоны [31] | 100–200 | 250 |
| Q | Сополимер этилстирола и ДВБ | Кислородсодержащие ЛОС [2], низкокипящие хлоруглеводороды (например, хлористый метилен) [31] | 500–600 | 250 | |
| N | Сополимер стирола, ДВБ и винилпирролидона | Ацетилен, алифатические УВ, оксиды олефинов, хлоруглеводороды С1–С12, сложные эфиры, нитросоединения, меркаптаны [31] | 225–350 | 200 | |
| R | Нитрилы | 500–550 | |||
| S | Сополимер стирола, ДВБ и винилпиридина | Спирты, хлорсодержащие УВ | 300–450 | 200 | |
| S | Сополимер стирола и этиленгликольдиметакритала | Формальдегид [31], амины | 250–350 | 200 | |
| Chromosorb серии 100 (или “Century”) | 101 | Cополимер стирола и ДВБ | Алканы, спирты, гликоли, альдегиды, кетоны, эфиры, карбоновые кислоты [31] | 350 | 300 |
| 102 | Спирты, кетоны, алифатические УВ [2], низкокипящие ЛОС, хлорсодержащие пестициды [31] | 300–400 | 250 | ||
| 103 | Полистирол | Арсины, фосфины, амины, аммиак, гидразины [31] | 350 | 275 | |
| 106 | Алканы С5–С12, кислородсодержащие ЛОС [2] | 700–800 | 250 | ||
| 104 | Сополимер акрилонитрила и ДВБ | Нитрилы, нитропарафины, аммиак, оксиды азота [31] | 100–200 | 250 | |
| 105 | Полиароматический сорбент | Ацетилен, формальдегид [31] | 600–700 | 250 | |
| 107 | Полиакриловый эфир | Ацетилен [31] | 400–500 | 250 | |
| 108 | Спирты, альдегиды, кетоны, гликоли [31] | 100–200 | 200 | ||
Сорбенты Tenax. Tenax-TA (ранее GC [15]) – пористый полимерный материал с размером частиц около 200 мкм, обладает развитой поверхностью, легко десорбирует углеводороды при термодесорбции [34] (рис. 3a). Однако этот сорбент не является универсальным и имеет ряд недостатков: он неприменим в условиях высокой влажности [35] и при температурах десорбции выше 300°C [36]. Tenax-TA производится за рубежом и имеет высокую стоимость [37], реагирует с такими окислителями, как хлор, озон, оксиды азота и серы с образованием ацетофенона, бензальдегида и фенола [38]. Отмечается также невозможность хранения образцов дольше 14 дней [15] и низкие “объемы до проскока” для очень летучих соединений.
Некоторые недостатки этого материала устраняют путем добавления графитированной сажи (ГС) (рис. 3з) [39] при полимеризации или частичном обугливании Tenax-TA. Полученный сорбент (Tenax-GR) лучше и быстрее сорбирует некоторые УВ в диапазоне С5–С8 (изопрен, толуол, ксилолы), имеет более широкий интервал рабочих температур и хуже сорбирует пары воды [29]. Несмотря на меньшую площадь поверхности Тenax-GR по сравнению с Tenax-TA, “объемы до проскока” для большинства ЛОС на Тenax-GR в два раза больше, чем на Tenax-TA, но во всем остальном эти сорбенты не имеют значимых отличий. В результате частичной карбонизации сорбент Тenax-GR способен работать при чуть более высоких температурах десорбции.
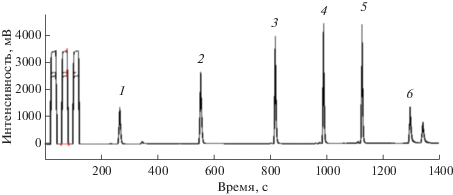
Сорбенты Carbopack, Carbograph и Carbotrap. Графитированная сажа – неспецифический углеродный сорбент, который широко используют для определения следовых количеств органических соединений. Материалы Carbograph, Carbopack и Carbotrap представляют собой частицы графитированных саж разного размера (от 100 до 800 мкм) с сильно различающейся площадью поверхности (табл. 1). В этой линейке есть и очень “слабые” (Carbopack-F), и “сильные” сорбенты (Carbopack-X), что позволяет подобрать материал для улавливания как мало-, так и высоколетучих соединений. Такие сорбенты гидрофобны (можно использовать для определения УВ и в водных средах), имеют высокую степень чистоты (низкий фоновый сигнал и уровень шума) [40], не подвержены разложению при 300–350°C, как Tenax, допускают повторное использование после процедур очистки (но не более 200 раз) [41]. В идентичных условиях хроматограммы десорбатов, полученные с Carbotrap, содержат больше пиков полярных веществ, чем при использовании Tenax (рис. 4) [42]. Тем не менее графитированные сажи тоже имеют минусы – десорбция соединений с высокими температурами кипения (250–300°C) происходит не полностью [43], мельчайшие примеси в адсорбенте могут действовать как специфические активные центры и искажать результаты анализа [41].
Рис. 4.
Сравнение площадей пиков на хроматограмме после термодесорбции органических веществ жидкости для розжига: 1 – этанол, 2 – ацетон, 3 – бутанол, 4 – гексан, 5 – метилгексан, 6 – гептан, 7 – метилгептан, 8 – октан, 9 – толуол, 10 – о-ксилен, 11 – этилбензол, 12 – триметилбензол, 13 – этилдиметилбензол, 14 – додекан, 15 – тридекан, 16 – тетрадекан, 17 – пентадекан, 18 – гексадекан.

Cорбенты Carbosieve и Carboxen. Углеродные молекулярные сита (УМС) представляют собой пористый углеродный скелетный каркас, который получают пиролизом органических полимеров или из углей при температуре около 400°С [44, 45]. Площадь поверхности таких материалов в несколько раз выше по сравнению с графитированной сажей, их адсорбционная способность определяется размером и формой пор. Как правило, адсорбенты УМС обладают более высокой относительной адсорбционной способностью по сравнению с ГС благодаря наличию только микропор. Carbosieve и Carboxen – углеродные сорбенты с молекулярно-ситовыми свойствами, различающиеся по площади поверхности (от S = 400 м2/г для Carboxen-564, до S = 1500 м2/г для Carboxen-1012, исключение – Carboxen-1016 с S = 75 м2/г). В отличие от сорбентов на основе сажи (которые, как правило, имеют нерегулярную форму), молекулярные сита сферичны (исключение – гранулированный Carbosieve-G). Такие адсорбенты хорошо улавливают ЛОС от С2 до С5, алканы от С1 до С4 (рис. 5 [46]), а также метанол (в отличие от Tenax и ГС). Как и Carbotrap, УМС практически не содержат примесей, но, как и в случае с Tenax-TA, УМС не способны работать в условиях высокой влажности [30], поскольку значительно уменьшаются объемы “проскока” ЛОС.
Рис. 5.
Хроматограмма разделения смеси н-алканов (1 – метан, 2 – этан, 3 – пропан, 4 – бутан, 5 – пентан, 6 – гексан), полученная на газовом хромато-масс-спектрометре, оснащенном лайнером с сорбентом Carbosieve для концентрирования соединений. Колонка PoraPLOT Q (25 м × 0.32 мм × 10 мкм, Agilent Technologies), градиентный режим (33°С в течение 6 мин, затем нагрев до 200°С со скоростью 15°С/мин и поддержание температуры в течение 6 мин), концентрация каждого соединения в смеси 100 мкг/мл.
Сорбенты PoraPak. PoraPak – полимерные адсорбенты со сферической формой частиц. В настоящее время выпускается шесть типов таких сорбентов – Р, Q (неполярные) и R, S, T и N (средней полярности) [47]. Все типы сорбента стабильны до 200–250°С, т.е. рабочий интервал температур меньше, чем у Tenax-TA. Среди недостатков материалов PoraPak отметим более высокий фоновый сигнал, чем у других адсорбентов, трудоемкую очистку [48], слабую адсорбцию газов и паров низкомолекулярных полярных соединений (метанол, этанол, формальдегид, ацетон) [45]. Сроки хранения образцов со сконцентрированными на них ЛОС у PoraPak и Tenax-TA не отличаются [49]. Следует отметить, что такие полимеры пригодны для сорбции не только неполярных веществ, но и для концентрирования полифункциональных органических соединений кислотного и основного характера [50]. Однако более низкая по сравнению с другими сорбентами сорбция неполярных углеводородов затрудняет их использование в нефтепоисковой практике [31].
Сорбенты Chromosorb серии 100 (или “Century”, 101–108). Сорбенты этой серии получают полимеризацией монофункциональных мономеров с дифункциональными. Размер частиц сорбентов от 100 до 250 мкм. Подобно сорбентам PoraPak имеют широкий диапазон полярности, наименее полярным является Chromosorb-101, наиболее полярным – Chromorb-104. Такие полимеры эффективны для улавливания из воздуха газов и ЛОС с температурой кипения до 250°С (рис. 6). Чаще других при пробоотборе используют Chromosorb-106, поскольку он имеет наиболее развитую удельную поверхность, и Chromosorb-102 [48, 31 ]. Однако Chromosorb-102 при анализе дает более высокий фоновый сигнал и уровень шума, а также взаимодействует с кислородом при нагревании [51]. В качестве достоинств сорбентов этого типа следует упомянуть продолжительный срок эксплуатации (очищают в токе азота при 150–170°С), более высокую адсорбционную способность по сравнению с Tenax-TA, способность удерживать очень низкие концентрации ЛОС. Сорбенты этого типа лучше сорбируют соединения при пониженной температуре, чем Tenax-TA [52]. Недостатки: наличие пиков примесей на хроматограмме холостого образца (рис. 7), низкие объемы “до проскока” для среднелетучих органических соединений по сравнению с Tenax-TA. К недостаткам следует отнести и низкую максимальную температуру десорбции (из-за чего комбинирование с другими сорбентами, например с Carbotrap, затруднено) [53].
Рис. 6.
Контроль содержания вредных веществ в воздухе рабочей зоны: (а) – определение растворителей (1 – SO2, 2 – ацетон, 3 – CS2, 4 – 1-хлорбутадиен-1,3, 5 – хлороформ, 6 – бензол), (б) – определение азотсодержащих соединений (7 – п-нитрохлорбензол, 8 – форманилид, 9 – п-фенилендиамин). Отбор проб воздуха с помощью сорбционных трубок, заполненных Chromosorb-106, с последующим определением веществ методом ТД-ГХ-МС. Условия термодесорбции: t = 5 мин, T = 200°C, сорбент в криоловушке Tenax-TA.

Полимерные смолы XAD. Смолы XAD (2, 4, 7) – неионогенные, гидрофобные, сферические синтетические адсорбенты [31]. Они отличаются от других сорбентов своей пористой макросетчатой структурой. Материал полидисперсный, т.е. кривая распределения пор по размерам имеет широкий пик с отсутствием четко выраженного максимума. Смолы XAD-2 и -4 используют для отбора неполярных соединений, а XAD-7 – полярных. Метанол плохо удерживается сорбентами (в отличие от диэтилового эфира). Сорбционная емкость сорбентов уменьшается в ряду: XAD-4 > > XAD-7 > PoraPak-Q > XAD-2 $ \gg $ PoraPak-P > Tenax-TA [54]. Достоинства смол: высокая механическая прочность [55], более высокие объемы “до проскока” по сравнению с Tenax-TA. Существует возможность комбинирования с другими сорбентами для сорбции большего количества соединений (например, с полианилином для улавливания ПАУ [56]). Полимерные смолы этого типа характеризуются высокой скоростью десорбции соединений [31], поскольку последние не проникают на большую глубину в микросферы полимера, а сорбируются на его поверхности. Такие материалы можно регенерировать при помощи обработки растворами гидроксида натрия, сульфита натрия, хлороформом или ацетоном [55]. Недостатки материалов: высокая стоимость [57], искажение результатов анализа при высокой влажности в условиях сорбции. Имеются данные, что число использований смолы XAD-2 должно не быть более шести, после чего необходимо убедиться, что свойства сорбента не изменились и значительного ухудшились [58]. К недостаткам следуют отнести и достаточную реакционную способность материалов – сорбенты реагируют экзотермически с окислителями даже при комнатной температуре.
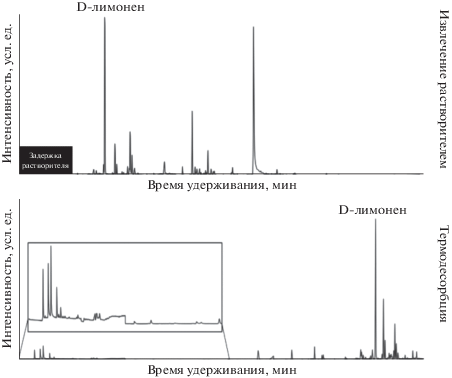
Активированный (активный) уголь (АУ) – пористый сорбент, получаемый из различных углеродсодержащих материалов (скорлупа кокосовых орехов, нефтяной кокс, каменноугольный кокс, древесный уголь, кости крупного рогатого скота, др.). Материал содержит огромное количество пор (макро, мезо и микро), имеет большую площадь поверхности (табл. 1), что делает его очень эффективным сорбентом для поглощения соединений из воздуха. Его максимальная рабочая температура гораздо выше, чем у Tenax-TA. Выделяют три типа активированного угля – порошковый, гранулированный, формованный, которые отличаются друг от друга формой и размером частиц. Сущность процесса активации состоит во вскрытии пор, находящихся в закрытом состоянии, путeм обработки углеродного материала углекислым газом при 800°С. Активированный уголь в основном используют для улавливания неполярных веществ, поскольку полярные соединения очень трудно извлекаются из сорбента [31]. Сорбционные характеристики материала позволяют применять его для извлечения из воздуха многих органических соединений, однако у АУ есть существенные недостатки. Во-первых, он хорошо сорбирует влагу, из-за чего снижается сорбционная емкость концентраторов. Во-вторых, извлечение с применением АУ многих ЛОС затруднено, особенно при термодесорбции. Возникает необходимость нагрева криоловушки до 450°C, что приводит к появлению примесных пиков на хроматограмме за счет термодеструкции определяемых компонентов. Решить эту проблему можно двумя способами – либо заменить АУ на другой углеродсодержащий сорбент, свободный от этих недостатков (ГС или УМС), либо использовать другой метод десорбции соединений. Самый распространенный вариант – извлечение веществ растворителем (толуолом, сероуглеродом, нитрометан, др.) и дальнейший анализ экстракта методом ГХ. Однако в этом случае теряется часть соединений, как легких (их пики не детектируются из-за установки времени “задержки на растворитель”), так и тяжелых (хуже растворяются, рис. 8 [59]).
Рис. 8.
Сравнение хроматограмм экстракта, полученного после обработки активированного угля сероуглеродом, и адсорбата на полимерном материале Tenax-TA.
Таким образом, можно заключить, что идеального сорбента для целей поисковой геохимии нет. Tenax-TA на сегодняшний день является лидером среди сорбентов по числу методик на его основе для идентификации различных летучих органических соединений с последующим их определением методом ТД-ГХ-МС. Однако из-за определенных недостатков этого материала для увеличения эффективности поиска новых нефтяных месторождений создание более универсального сорбента является актуальной задачей. Такой материал должен поглощать УВ в диапазоне С8–С20 как алканового ряда, так и ароматические соединения для полноценного последующего анализа и обоснованной интерпретации полученных экспериментальных данных. Сорбент должен иметь широкий интервал рабочих температур, обладать высокой пористостью, желательно допускать многократное повторное использование после процедур кондиционирования и регенерации.
На наш взгляд, более перспективными для целей использования в пассивных сорберах при геологоразведке месторождений углеводородов являются монолитные углеродные материалы нового поколения. В отличие от порошковых материалов, они не содержат мелких легких частиц, следовательно, отсутствуют неконтролируемые потери при наполнении сорбера или высыпании из него. Отрезанием куска определенной длины можно обеспечить постоянные равные и воспроизводимые массы сорбента от партии к партии. Повышается возможность многократного использования одного и итого же сорбера. Углеродные материалы устойчивы при нагреве до 400–500°С, что дает возможность более полно десорбировать труднолетучие соединения и лучше подготавливать сорбер к последующему анализу. Более того, такие материалы электропроводны, что открывает возможность их очистки после анализа путем нагрева при пропускании электрического тока. Углеродная поверхность монолитов достаточно развитая и допускает возможность целенаправленной модификации, например, образования тех или иных функциональных групп или допирования металлами. Наконец, монолитные углеродные материалы дешевле синтетических импортных полимеров.
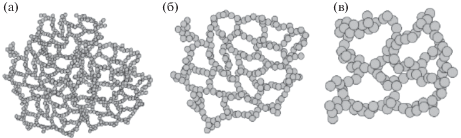
Монолитные сорбенты. Монолитные углеродные материалы с развитой поверхностью могут быть получены различными способами: свободно-радикальной трехмерной полимеризацией в порогенных растворителях [60], сворачиванием графитовой фольги в жгуты (нити) подходящего размера [61] либо просто при печати полимерным органическим материалом на 3D-принтере, а потом обугливанием при высокой температуре [62]. Пористая структура таких материалов (рис. 9 [63]) отличается от структуры, формируемой макропористым гранулированным сорбентом. Она сочетает в себе доменные частицы малых размеров и макропоры, за счет чего осуществляется быстрый конвекционный, а не медленный диффузионный механизм массопереноса. Кроме того, монолитные сорбенты позволяют относительно легко регулировать структуру пор в зависимости от решаемой задачи.
Рис. 9.
Схема влияния порообразователя на макропористость и размер глобул монолитного сорбента. Количество “плохого” растворителя увеличивается от (а) к (в).
В работе [64] показано, что высота, эквивалентная теоретической тарелке для монолитных сорбентов практически не зависит от типа сорбента. Монолитные сорбенты могут быть синтезированы на матрице как органических, так и неорганических веществ (например, силикагеля, рис. 10 [65, 66]).
В дальнейшем монолитные углеродные сорбенты можно модифицировать, например, увеличить гидрофобность поверхности за счет введения углеродных нанотрубок, графена, УМС или АУ [63, 67]. Запатентован монолитный материал [67] на неорганической основе (октадецилсилане) с площадью поверхности 600–700 м2/г и размером пор от 5 до 10 мкм. Монолит содержит 1.5% АУ (по массе), что улучшает его сорбционные свойства по отношению к галогеналканам (рис. 11). Другой пример модификации приведен в работе [68], где авторы используют композитный материал на основе поли(бензил)метакрилата, допированный углеродными нанотрубками, для сорбции полиароматических углеводородов. Площадь поверхности такого материала составила 55.84 м2/г при доле включений 0.3% (по массе), при этом площадь поверхности исходного монолита составила 25.63 м2/г. В результате удалось увеличить температуру разложения сорбента и повысить эффективность экстракции ПАУ.
Рис. 11.
Интенсивность хроматографических пиков при определении летучих органических соединений с помощью чистого монолита (пунктирная линия) и монолитной структуры, содержащей активированный уголь (сплошная линия).

Помимо универсальных монолитных материалов, существуют и селективные адсорбенты для определения летучих аналитов (например, никотина) [69]. Используют молекулярно-импринтированную полимерную систему (МИП) на основе кремнезема. Такие адсорбционные материалы несложно получить, при этом они являются высокостабильными и специфичными. Однако для целей нефтепоисковой геохимии их не применяли.
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 20-33-90073.
Список литературы
Gorecki T., Namiesnik J. Passive sampling // Trends Anal. Chem. 2002. V. 21. № 4. P. 276.
Krol S., Zabiegala B., Namiesnik J. Monitoring VOCs in atmospheric air II. Sample collection and preparation // Trends Anal. Chem. 2010. V. 29. № 9. P. 1101.
U.S. Environmental Protection Agency. Passive samplers for investigations of air quality: Method description, implementation, and comparison to alternative sampling methods (EPA/600/R-14/434) // USEPA. 2014. P. 1.
Batterman S., Metts T., Kalliokoski P. Diffusive uptake in passive and active adsorbent sampling using thermal desorption tubes // J. Environ. Monit. 2002. V. 4. № 6. P. 870.
Martin N.A., Marlow D.J., Henderson M.H., Goody B.A., Quincey P.G. Studies using the sorbent Carbopack X for measuring environmental benzene with Perkin-Elmer-type pumped and diffusive samplers // Atmos. Environ. 2003. V. 37. № 7. P. 871.
Simpson A.T., Wright M.D. Diffusive sampling of C7‒C16 hydrocarbons in workplace air: Uptake rates, wall effects and use in oil mist measurements // Ann. Occup. Hyg. 2008. V. 52. № 4. P. 249.
Brown V.M., Crump D.R., Gardiner D., Yu C.W.F. Long-term diffusive sampling of volatile organic-compounds in indoor air // Environ. Technol. 1993. V. 14. № 8. P. 771.
McClenny W.A., Oliver K.D., Jacumin H.H., Daughtrey E.H., Whitaker D.A. 24 h diffusive sampling of toxic VOCs in air onto Carbopack X solid adsorbent followed by thermal desorption/GC/MS analysis–Laboratory studies // J. Environ. Monit. 2005. V. 7. № 3. P. 248.
Hellen H., Hakola H., Laurila T., Hiltunen V., Koskentalo T. Aromatic hydrocarbon and methyl tert-butyl, ether measurements in ambient air of Helsinki (Finland) using diffusive samplers // Sci. Total Environ. 2002. V. 298. № 1–3. P. 55.
Walgraeve C., Demeestere K., Dewulf J., Van Huffel K., Van Langenhove H. Diffusive sampling of 25 volatile organic compounds in indoor air: Uptake rate determination and application in Flemish homes for the elderly // Atmos. Environ. 2011. V. 45. № 32. P. 5828.
Jia C., Fu X. Diffusive uptake rates of volatile organic compounds on standard ATD tubes for environmental and workplace applications // Environments. 2017. V. 4. № 4. P. 87.
Алексеева А.А. Применение листового опада в качестве основы сорбционного материала при ликвидации аварийных разливов нефти с поверхности воды. Дис. … канд. техн. наук. Казань: Казанский национальный исследовательский технологический университет, 2017. 159 с.
Юшкетова Н.А., Поддубный В.А. Метод пассивного отбора проб для мониторинга химического загрязнения атмосферного воздуха. Ч. 2. Практические аспекты (обзор) // Экологические системы и приборы. 2007. № 3. С. 15.
Цомбуева Б.В. Влияние деятельности нефтедобывающего комплекса на загрязнение земель юго-востока республики Калмыкия. Дис. … канд. хим. наук. Элиста: Калмыцкий государственный университет им. Б.Б. Городовикова, 2016. 156 с.
Alfeeli B., Jain V., Johnson R.K., Beyer F.L., Heflin J.R., Agah M. Characterization of poly(2,6-diphenyl-p-phenylene oxide) films as adsorbent for microfabricated preconcentrators // Microchem. J. 2011. V. 98. № 2. P. 240.
Filipiak W., Filipiak A., Ager C., Wiesenhofer H., Amann A. Optimization of sampling parameters for collection and preconcentration of alveolar air by needle traps // J. Breath Res. 2012. V. 6. № 2. Article 027107.
Poormohammadi A., Bahrami A., Ghiasvand A. Preparation of Carbotrap/silica composite for needle trap field sampling of halogenated volatile organic compounds followed by gas chromatography/mass spectrometry determination // J. Environ. Health Sci. Eng. 2019. V. 17. P. 1045.
Kenessov B., Derbissalin M., Koziel J.A., Kosyakov D.S. Modeling solid-phase microextraction of volatile organic compounds by porous coatings using finite element analysis // Anal. Chim. Acta. 2019. V. 1076. P. 73.
Farshchi N., Abbasian A. Larijani K. Is inverse gas chromatography (IGC) a convenient method to determine compatibility of rubber materials? // Chromatographia. 2019. V. 82. P. 1709.
İnan S., Tel H., Sert Ş., Çetinkaya B., Sengül S., Özkan B., Altaş Y. Extraction and separation studies of rare earth elements using Cyanex 272 impregnated Amberlite XAD-7 resin // Hydrometallurgy. 2018. V. 181. P. 156.
Asalieva E., Sineva L., Sinichkina S., Solomonik I., Gryaznov K., Pushina E., Kulchakovskaya E., Gorshkov A., Kulnitskiy B., Ovsyannikov D., Zholudev S., Mordkovich V. Exfoliated graphite as a heat-conductive frame for a new pelletized Fischer–Tropsch synthesis catalyst // Appl. Catal. A: General. 2020. V. 601. Article 117639.
Ahamad S., Ahmad M., Mehta B.R., Gupta A. Effect of nano-fillers on capacity retention and rate capability of mesocarbon microbeads anode // J. Electrochem. Soc. 2017. V. 164. № 13. P. 2967.
Bauria R., Surappa M.K. Processing and properties of Al–Li–SiCp composites // Science and technology of advanced materials. 2007. V. 8. № 6. P. 494.
Бадикова А.Д., Рулло А.В., Аблеев Р.И., Бейгул Н.А., Парамонов Е.А., Алехина И.Е. Сорбция углеводородных сорбатов, типичных для нефтяных месторождений, на поверхности полимерного адсорбента Tenax // Вестник Башкирского университета. 2018. Т. 23. № 4. С. 1074.
Бадикова А.Д., Рулло А.В., Аблеев Р.И., Масагутов Р.Х., Алехина И.Е. Анализ почвенно-грунтового воздуха лесной и промышленной зоны методом пассивной адсорбции углеводородов на комбинированном адсорбенте с использованием модуль-сорберов // Вестник Башкирского университета. 2019. Т. 24. № 4. С. 852.
Бадикова А.Д., Рулло А.В., Аблеев Р.И., Масагутов Р.Х., Бейгул Н.А., Журкин О.П., Бежан Д.И. Углеродный адсорбент в составе модуль-сорбера для исследования пассивной адсорбции углеводородов из модели нефти Баклановского месторождения // Башкирский химический журн. 2019. Т. 26. № 4. С. 32.
Wallace M.A.G., Pleil J.D., Whitaker D.A., Oliver K.D. Recovery and reactivity of polycyclic aromatic hydrocarbons collected on selected sorbent tubes and analyzed by thermal desorption-gas chromatography/mass spectrometry // J. Chromatogr. A. 2019. V. 1602. P. 19.
Borusiewicz R. Chromatographic analysis of the traces of 2-chlorobenzalmalononitrile with passive adsorption from the headspace on Tenax TA and Carbotrap 300 // Forensic Sci. Int. 2019. V. 303. Article 109933.
Cao X., Hewitt N. Evaluation of Tenax-GR adsorbent for the passive sampling of volatile organic compounds at low concentrations // Atmospheric Environ. 1993. V. 27. № 12. P. 1865.
Richter M., Juritsch E., Jann O. Determination of recovery rates of adsorbents for sampling very volatile organic compounds (C1–C6) in dry and humid air in the sub-ppb range by use of thermal desorption gas chromatography-mass spectrometry // J. Chromatogr. A. 2020. V. 1626. Article 461389.
Другов Ю.С., Родин А.А. Пробоподготовка в экологическом анализе. СПб: Анатолия, 2002. 755 с.
Valderrama C., Cortina J.L., Farran A., Gamisans X., Lao C. Kinetics of sorption of polyaromatic hydrocarbons onto granular activated carbon and Macronet hyper-cross-linked polymers (MN200) // J. Colloid Interface Sci. 2007. V. 310. № 1. P. 35.
Dalas E., Karaiskakis G., Katsanos N.A., Gounaris A. Reversed-flow gas chromatographic technique applied to measurement of mass transfer coefficients of n-hydrocarbons on Porapak P // J. Chromatogr. A. 1985. V. 348. P. 339.
Павлюк М.А., Ануфриев О.Н., Понаморева Т.С. Сорбционные трубки Tenax-TA как эффективный инструмент при выполнении анализа воздушной среды методом газовой хроматографии // Изв. ТулГУ. Естественные науки. 2016. Вып. 4. С. 75.
Ho S.S.H., Chow J.C., Watson J.G., Wang L., Qu L., Dai W., Huang Y., Cao J. Influences of relative humidities and temperatures on the collection of C2−C5 aliphatic hydrocarbons with multi-bed (Tenax TA, Carbograph 1TD, Carboxen 1003) sorbent tube method // Atmospheric Environ. 2017. V. 151. P. 45.
ГОСТ Р ИСО 16017-2-2007. Воздух атмосферный, рабочей зоны и замкнутых помещений. Отбор проб летучих органических соединений при помощи сорбционной трубки с последующей термодесорбцией и газохроматографическим анализом на капиллярных колонках. Часть 2. Диффузионный метод отбора проб. М: Стандартинформ, 2008. 40 с.
Ott W.R., Steinemann A.C., Wallace L.A. Exposure Analysis. 1st Ed. Boca Raton: CRC Press, 2006. P. 534.
McDermott H.J. Air monitoring for toxic exposures. 2nd Ed. N.Y.: John Wiley & Sons, 1991. P. 687.
Стайлз Э.Б. Носители и нанесенные катализаторы: Теория и практика. М.: Химия, 1991. 232 с.
Poormohammadi A., Bahrami A., Farhadian M., Ghorbani Shahna F., Ghiasvand A. Development of Carbotrap B-packed needle trap device for determination of volatile organic compounds in air // J. Chromatogr. A. 2017. V. 1527. P. 33.
Rothweiler H., Wager P.A., Schlatter C. Comparison of Tenax-TA and Carbotrap for sampling and analysis of volatile organic compounds in air // Atmospheric Environ. Part B. Urban Atmosphere. 1991. V. 25. № 2. P. 231.
Borusiewicz R., Zięba-Palus J. Comparison of the effectiveness of Tenax TA and Carbotrap 300 in concentration of flammable liquids compounds // J. Forensic Sci. 2007. V. 52. № 1. P. 70.
Nunez A.J., Gongalez L.F., Janak J. Preconcentration of headspace volatiles for trace organic analysis by gas chromatography // J. Chromatogr. 1984. V. 300. P. 127.
Sazali N. A comprehensive review of carbon molecular sieve membranes for hydrogen production and purification // Int. J. Adv. Manuf. Technol. 2020. V. 107. P. 2465.
Журавлёва Г.А. Поверхностно-слойные сорбенты на основе непористых солей для газоадсорбционного концентрирования и разделения полярных органических соединений. Дис. … канд. хим. наук. Санкт-Петербург: Санкт-Петербургский государственный университет, 2014. 102 с.
Blessing M., Proust E., Fléhoc C. Customized injection techniques for compound-specific isotope analysis of natural gas samples // Procedia Earth and Planetary Science. 2015. V. 13. P. 227.
Мак-Нейр Г. Введение в газовую хроматографию. М.: Мир, 1970. 277 с.
Майстренко В.Н., Хамитов Р.З., Будников Г.К. Эколого-аналитический мониторинг супертоксикантов. М.: Химия, 1996. 319 с.
Павлова Л.В., Платонов И.А., Колесниченко И.Н., Новикова Е.А. Cорбционные микротрубки как образцы состава летучих органических соединений на примере ромашки аптечной (Chamomilla recutita R.) // Сорбционные и хроматографические процессы. 2018. Т. 18. № 5. С. 734.
Shibamoto T., Aino K., Hengel M. Application of Porapak Q Column for a Sample Preparation of Volatile Chemicals from Brewed Coffee // EC Nutrition. 2019. V. 14. № 10. P. 880.
Murray K.E. Concentration of headspace, airborne and aqueous volatiles on chromosorb 105 for examination by gas chromatography and gas chromatography-mass spectrometry // J. Chromatogr. A. 1977. V. 135. № 1. P. 49.
Volden J., Thomassen Y., Greibrokk T., Thorud S., Molander P. Stability of workroom air volatile organic compounds on solid adsorbents for thermal desorption gas chromatography // Anal. Chim. Acta. 2005. V. 530. № 2. P. 263.
Lamaa L., Ferronato C., Fine L., Jaber F., Chovelon J. Evaluation of adsorbents for volatile methyl siloxanes sampling based on the determination of their breakthrough volume // Talanta. 2013. V. 115. P. 881.
Другов Ю.С., Беликов А.Б., Дьякова Г.А., Тульчинский В.М. Методы анализа загрязнений воздуха. М.: Химия, 1984. 384 с.
Каменщиков Ф.А., Богомольный Е.И. Нефтяные сорбенты. Москва−Ижевск: Регулярная и хаотическая динамика, 2005. 268 с.
Ghalichi Z.Z., Bahrami A., Ghorbani S.F., Farhadian M. Application of a needle trap device packed with XAD-2 polyaniline composite for sampling naphthalene and phenanthrene in air // J. Chromatogr. A. 2019. V. 1602. P. 74.
Жебентяев А.И. Токсикологическая химия. Часть 2. Витебск: ВГМУ, 2015. 415 с.
ГОСТ Р ИСО 12884-2007. Воздух атмосферный. Определение общего содержания полициклических ароматических углеводородов (в газообразном состоянии и в виде твердых взвешенных частиц). Отбор проб на фильтр и сорбент с последующим анализом методом хромато-масс-спектрометрии. М.: Стандартинформ, 2008. 38 с.
Demets R., Roosen M., Vandermeersch L., Ragaert K., Walgraeve C., De Meester S. Development and application of an analytical method to quantify odour removal in plastic waste recycling processes // Resources, Conservation and Recycling. 2020. V. 161. Article 104907.
Nischang I. Porous polymer monoliths: morphology, porous properties, polymer nanoscale gel structure and their impact on chromatographic performance // J. Chromatogr. A. 2013. V. 1287. P. 39.
Авдеев В.В., Савченко Д.В., Афанасов И.М., Свиридов А.А., Сорокина Н.Е., Матвеев А.Т., Селезнев А.Н., Годунов И.А., Ионов С.Г. Способ получения электронагревательного элемента и электронагревательный элемент. Патент РФ № 2387106. Заявка 2009106484/09 от 26.02.2009, опубл. 20.04.2010.
Regufe M.J., Ferreira A.F.P., Loureiro J.M., Rodrigues A., Ribeiro A.M. Electrical conductive 3D-printed monolith adsorbent for CO2 capture // Micropor. Mesopor. Mater. 2019. V. 278. P. 403.
Сотникова Ю.С. Приготовление и исследование хроматографических свойств монолитных колонок для ВЭЖХ с новыми неподвижными фазами на основе гетероциклических азотсодержащих соединений. Дис. … канд. хим. наук. Новосибирск: Институт катализа СО РАН, 2020. 156 с.
Родинков О.В., Москвин Л.Н. Поверхностно-слойные композиционные сорбенты для экспрессного концентрирования летучих органических веществ из водных и газовых сред // Журн. аналит. химии. 2012. Т. 67. № 10. С. 908. (Rodinkov O.V., Moskvin L.N. Surface-layer composite sorbents for the rapid preconcentration of volatile organic substances from aqueous solutions ans gas atmospheres // J. Anal. Chem. 2012. V. 67. № 10. P. 814.)
Cabrera K. Applications of silica-based monolithic HPLC columns // J. Sep. Sci. 2004. V. 27. P. 843.
Svec F. Porous polymer monoliths: Amazingly wide variety of techniques enabling their preparation // J. Chromatogr. A. 2010. V. 1217. P. 902.
Sato A., Terashima H., Takei Y. Monolith adsorbent and method and apparatus for adsorbing samples with the same. Patent № US-8795410-B2. Appl. № 12/665612 of 18.07.2007, pub. date 03.02.2011.
Al-Rifai A., Aqel A., Wahibi L.A., ALOthman Z.A., Badjah-Hadj-Ahmed A. Carbon nanotube-based benzyl polymethacrylate composite monolith as a solid phase extraction adsorbent and a stationary phase material for simultaneous extraction and analysis of polycyclic aromatic hydrocarbon in water // J. Chromatogr. A. 2018. V. 1535. P. 17.
Huang X.H., Song J.J., Li H., Gong M.T., Zhang Y. Selective removal of nicotine from the main stream smoke by using a surface-imprinted polymer monolith as adsorbent // J. Hazard. Mater. 2018. V. 365. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии






