Журнал аналитической химии, 2021, T. 76, № 10, стр. 890-905
Определение органических соединений в водно-органических и дисперсных средах с помощью электрохимических методов анализа
Г. А. Евтюгин a, *, **, А. В. Порфирьева a
a Химический институт им. А.М. Бутлерова Казанского (Приволжского) федерального университета
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Gennady.Evtugyn@kpfu.ru
** E-mail: gevtugyn@gmail.com
Поступила в редакцию 21.04.2021
После доработки 16.05.2021
Принята к публикации 17.05.2021
Аннотация
Рассмотрены возможности электрохимического анализа при определении органических соединений в водно-органических и дисперсных средах. Определены основные факторы, влияющие на электрохимические характеристики аналитов, и вклад природы растворителя в операционные и аналитические характеристики соответствующих сенсоров. Приведены примеры реализации преимуществ электрохимического анализа на примере использования гомогенных водно-органических растворов, эмульсий органических растворителей и отдельных капель на границе электрод–раствор. Также рассмотрены примеры биосенсоров, функционирующих в присутствии органических растворителей.
Современный этап развития электроаналитической химии характеризуется повышенным вниманием к биологическим объектам анализа – метаболитам, биомаркерам заболеваний, лекарственным препаратам, компонентам биологических добавок, витаминам и антиоксидантам [1–4]. Это в значительной степени обусловлено большими возможностями практического применения электроанализа, связанными с развитой теорией, существующими эффективными подходами к повышению чувствительности определения указанных аналитов за счет модификации электродов, а также с наличием компактного удобного измерительного оборудования, в том числе работающего автономно и в сочетании с проточными и полуавтоматизированными средствами измерения [5, 6]. Однако по сравнению с определением металлов определение органических соединений по их реакциям окисления–восстановления на электродах имеет ряд сложностей, связанных с образованием нерастворимых продуктов, блокирующих поверхность электрода [7], неоднозначностью путей превращения промежуточных соединений, склонностью аналитов к агрегации и образованию гетерогенных систем, снижающих качество сигнала и его чувствительность. Пассивация электродов может быть снижена путем использования медиаторов электронного переноса. В то же время ограничения растворимости и формирования микрогетерогенных систем в анализируемом растворе связаны с фундаментальными свойствами органических соединений – их липофильностью, низкой растворимостью в воде, склонностью к мицеллообразованию и автоагрегации.
Использование органических растворителей – очевидный путь повышения растворимости органических соединений-аналитов. Однако он чреват усложнением протокола измерения, требует подготовки больших объемов чистых органических растворителей и органических солей, используемых в качестве индифферентных электролитов. Кроме того, электрохимические реакции в органических растворителях могут протекать по механизмам, далеким от реакций тех же соединений в воде и в биохимических циклах in vivo. Это снижает привлекательность электрохимических методов анализа, поскольку электродные реакции органических соединений часто рассматриваются как модели их поведения в реальных биологических системах.
Использование водно-органических систем – компромисс между требованиями к достижению растворимости и гомогенности раствора аналита, с одной стороны, и необходимости сохранения преимущественно водной (гидрофильной) среды, с другой. С точки зрения методологии эксперимента, такие системы незначительно отличаются от чисто водных растворов электролитов. Стадии диспергирования/насыщения воды органическими растворителями, ограниченно смешивающимися с водой, и тем более приготовления водных смесей с растворителями, смешивающимися с водой в любых отношениях, большой проблемы не представляют. С другой стороны, низкие расходы органического растворителя не влияют на утилизацию отработанных растворов и выполнение иных требований, связанных с концепцией “зеленой химии’ и возможностями проведения измерений вне лабораторной базы. В данном обзоре рассмотрены основные примеры успешного использования водно-органической и дисперсной сред при электрохимическом определении органических соединений с особым вниманием к электрохимическим аспектам включения органических растворителей. В обзоре не рассматриваются примеры использования органических растворителей на стадии получения модифицирующих покрытий, если последующее измерение электрохимического сигнала происходит в традиционном (водном) электролите. Также вне рамок обзора остались системы с использованием в качестве сигнала ионного тока переноса аналита на границе жидкость/жидкость. Несмотря на то, что в таких системах в качестве аналитов применяются органические лиганды для комплексообразования ионов металлов или органические ионы, специфика сигналообразующих процессов заслуживает в этом случае самостоятельного обзора.
Гомогенные водно-органические системы. Использование органических растворителей для повышения растворимости органических соединений является, по-видимому, одним из старейших приемов расширения возможностей определения органических соединений электрохимическими методами. Поскольку многие органические соединения ограниченно растворимы в воде, естественно использовать водно-органические растворы, содержащие полярные органические растворители, увеличивающие растворимость аналита. В этом случае речь идет об истинных растворах с содержанием органического растворителя 5–80 об. %. Во многих случаях органические растворители достаточно летучи (ацетон, метанол, этанол), что создает методические проблемы обеспечения постоянства состав раствора в процессе измерения, особенно при деаэрировании раствора током инертного газа. Состав водно-органических растворов может также соответствовать условиям, ранее описанным для определения тех же соединений методами ВЭЖХ или капиллярного электрофореза. Совместимость таких растворов с условиями электрохимического эксперимента принимается априорно. Однако есть исключения. Так, ацетонитрил способен к частичному гидролизу и поликонденсации с образованием олигомерных продуктов, пассивирующих электрод. Сообщалось о способности нитрильных растворителей влиять на электрохимические процессы, протекающие при восстановлении гидрохинона [8]. Диметилформамид (ДМФА) неустойчив в анодной области потенциалов, но подходит при регистрации токов восстановления.
Влияние органических растворителей на характеристики электрохимического определения органических соединений, помимо повышения их растворимости, связано с изменением гидрофильно-гидрофобного баланса на границе электрод–раствор, с общим снижением диэлектрической проницаемости раствора, а также с изменением скорости процессов протонирования–депротонирования промежуточных продуктов переноса электрона. Устойчивость материала электрода также зависит от природы органического растворителя. Например, угольно-пастовый электрод на основе силиконового масла показал лучшие характеристики при определении электрохимических характеристик ряда фенотиазиновых препаратов, включая феназепам, чем его аналог, включающий в качестве компонента пасты нуйол [9]. Авторы связывают это со способностью нуйола сорбировать метанол из водно-органической фазы. Исследования в 50%-ном метаноле показали обратимые пики окисления–восстановления исходных фенотиазинов и продуктов их химического нитрования. При этом авторы отмечают, что аналогичные измерения в водной среде имеют более высокую чувствительность к исследованным органическим соединениям.
В отсутствие ограничений переноса иона водорода низкие концентрации органических растворителей незначительно влияют на положение и высоту пиков окисления–восстановления аналита, несколько увеличивая необратимость стадии переноса электрона и перенапряжение переноса электрона. Исходные растворы аналита обычно готовят в полярном органическом растворителе, смешивающимся с водой (метанол, ацетонитрил), далее для построения градуировочной зависимости их кратно разбавляют водным раствором электролита, содержащим до 10 об. % того же или иного растворителя, препятствующего выделению твердой фазы аналита из получаемого разбавленного раствора. Электрохимическое поведение аналитов априорно принимается таким же, как и в водной среде, но проверить это зачастую не удается или считается излишним. В качестве исключения можно привести исследование анодного окисления диэтилдитиокарбамината в щелочной среде в воде и в водном этаноле. Если в 0.1 М растворе NaOH окисление протекает с переносом одного электрона на молекулу аналита с последующей димеризацией и выделением из нее сульфид-иона, то в присутствии органического растворителя электродная реакция протекает с переносом уже двух электронов [10]. Другой пример прямого сравнения электрохимического поведения аналита в органическом и водно-органическом растворителе – определение линдана в ДМФА, ацетонитриле, метаноле и их 50%-ных смесях с водой [11]. В качестве фонового электролита во всех случаях использовали тетрафторборат тетрабутиламмония. Восстановление линдана на серебряном электроде протекало при (–0.90)–1.40 В. По данным препаративного электролиза электродный процесс предполагает перенос шести электронов и образование бензола с выходами в диапазоне 60–100%. В чистом ацетонитриле и этаноле зафиксировано также образование значительных количеств хлорбензола. В присутствии воды выход бензола увеличивался.
Полиароматические соединения определяли по току их окисления на стеклоуглеродном и угольно-пастовом электродах [12]. Измерения проводили в серной кислоте, содержащей 20 об. % метанола (нафталин) или 25 об. % ацетонитрила (флуорен и антрацен). Пределы обнаружения (clim) составили 12, 6.4 и 1.2 мкМ для нафталина, флуоренона и антрацена соответственно. Электростатическое накопление флуорена на анодно поляризованном электроде снижало указанное значение до 0.2 мкМ. Близость потенциалов пиков на дифференциально-импульсных вольтамперограммах не позволила одновременно определять все три аналита: более летучий нафталин может быть удален из смеси при выпаривании экстракта.
Витамины Д2 (эргокальциферол) и Д3 (холекальциферол) определяли на стеклоуглеродном электроде в 40%-ном водном этаноле [13]. Помимо этанола, исследования проводили в присутствии ацетонитрила и дихлорметана, однако данные растворители показали более высокие потенциалы пика окисления аналитов. Значение clim составило 0.113 и 0.118 мМ соответственно. Интервалы линейности градуировочных графиков оказались достаточно узкими: 1.0–10 мкМ для витамина Д2 и 6.0–50 мкМ для витамина Д3. Не установлено мешающего влияния на сигнал витаминов А, Е и К.
Ретинол (витамин А1), ретинол ацетат и пальмитат определяли на угольно-пастовом электроде, содержащем додецилсульфат натрия, после его сорбционного накопления из органических и водно-органических растворов [14]. Наилучшие результаты были достигнуты при использовании 50–80% ацетонитрила в ацетатном буферном растворе. В режиме дифференциально-импульсной вольтамперометрии метод позволяет определять 1.5 мкА–0.18 мА ретинола (clim 0.46 мкМ). Отмечены сходство вольтамперограмм, полученных на угольно-пастовом и стеклоуглеродном электродах, и возможность определения только суммарного содержания всех форм ретинола без их разделения на индивидуальные соединения.
Канабидиол окисляли в смеси ацетонитрила и универсального буферного раствора (1 : 1) на стеклоуглеродном электроде [15]. Процесс носил необратимый характер. Регистрируемые с помощью дифференциально-импульсной вольтамперометрии токи пика увеличивались при переходе от кислой к щелочной области рН. Модификация электрода углеродной чернью стабилизировала и увеличивала аналитический сигнал. Разработан метод проточно-инжекционного определения канабидиола из конопляного масла и листьев конопли в потоке 30%-ного метанола в интервале концентраций 0.2–2 мг/л. Референсным методом служила хромато-масс-спектрометрия.
Краситель дисперсный красный 13 определяли на стеклоуглеродном электроде в 50%-ной смеси универсального буферного раствора и ДМФА [16]. Для определения красителя использовали необратимый пик катодного восстановления, отнесенный к протонированной нитрогруппе. Модификация электрода полиглутаминовой кислотой повышала чувствительность определения. В оптимальных условиях электрод позволял проводить определение красителя в интервале концентраций от 0.25 до 3.0 мкМ (clim 15 нМ).
Введение значительных количеств органических растворителей неизбежно увеличивает омическое падение напряжения в растворе и снижает диэлектрическую проницаемость раствора, что неблагоприятно влияет на морфологию вольт-амперных кривых, повышает фоновые токи и уширяет пики окисления/восстановления. Вывод о природе факторов, определяющих влияние органического растворителя, неочевиден. Например, при исследовании цитохрома С в системах вода–органический растворитель (ДМФА, ацетонитрил, метанол, пропанол) вывод о преимущественном влиянии диэлектрических свойств среды был сделан по термодинамическим характеристикам переноса электрона, установленным по величине равновесного потенциала и его температурной зависимости [17]. Тот же аналит демонстрировал денатурацию в присутствии диметилсульфоксида (ДМСО), выявляемую по снижению тока пика на вольтамперограммах, зарегистрированных на золотом электроде [18].
Другой электрохимически активный белок – миоглобин, будучи адсорбирован на поверхности стеклоуглеродного электрода, показал устойчивость электрохимических характеристик в присутствии 30%-ного этанола [19]. Стабилизатором водно-органического раствора белка являлся полисахарид глюкоманнан. Электрод с адсорбированным миоглобином использовали для чувствительного определения органических пероксидов, пероксида водорода, оксида азота(II) и полихло-рированных алканов по токам их медиаторного восстановления. Влияние органического растворителя на электрохимическую активность миоглобина подробно рассмотрено в работе [20]. Показано, что введение в раствор спиртов вызывает частичную денатурацию молекул миоглобина, адсорбированных на стеклоуглеродном углероде. Структурные изменения были подтверждены данными фотоэлектронной рентгеновской спектроскопии и эллипсометрии. Толщина белковой пленки на электроде увеличивалась в присутствии спиртов. В совокупности с сокращением расстояния переноса электрона это вызывало увеличение электроактивности миоглобина на 60% (под данным дифференциально-импульсной вольтамперометрии). В наибольшей степени изменения были заметны в присутствии смеси этанола и н-пропанола.
В случае нитрофурильного производного 1,4-дигидропиридина целью применения органического растворителя, смешивающегося с водой, был контроль протогенной активности среды [21]. Молекулы аналита содержали два потенциальных редокс-центра, – нитрофурильную и дигидропиридиновую группы. При pH < 9 катодное восстановление протекало с переносом четырех электронов. Однако в более щелочной среде число пиков на вольтамперограммах, как и соотношение токов пика, зависело от выбранной области сканирования потенциала и природы добавляемого растворителя (ацетонитрил, ДМСО, до 60% этанола в объеме). Низкая протогенная активность смешанного раствора способствовала проявлению сигнала анион-радикала на нитрогруппе, а восстановление нитрофуранового фрагмента зависело от характера окислительных процессов на обратной ветви циклической вольтамперограммы.
Коэнзимы Q10 и Q0 восстанавливали на стеклоуглеродном электроде в уксусной кислоте, содержащей ацетонитрил [22]. Механизм включает две последовательные стадии переноса иона водорода и электрона с промежуточным образованием неустойчивого радикала семихинона. Механизм согласуется с установленным ранее в водных щелочных средах при рН 12.0. Длина углеродного радикала коэнзима слабо влияла на его электрохимическую активность. Обратимость процесса переноса первого электрона создавала условия регистрации коэнзимов в биохимических реакциях, а установленные термодинамические значения потенциалов отдельных стадий позволяют использовать электрохимические данные для обсуждения поведения коэнзимов в живой клетке. Полученные результаты были впоследствии использовали для определения коэнзима Q10 на серебряном электроде в водном этаноле [23]. Аналит давал пару обратимых пиков на вольтамперограммах в отсутствие растворенного кислорода и необратимый пик в его присутствии. Этанол наряду с молекулярным кислородом участвовал в цепи переноса электрона, реагируя с радикалом, образующимся при отрыве иона водорода от продукта первичного переноса электрона. В режиме дифференциально-импульсной вольтамперометрии ток пика линейно зависел от концентрации коэнзима Q10 в интервале концентраций 0.1 мкМ–1.0 мМ (clim 33.3 нМ). Сенсор опробовали при анализе экстрактов из рыбных, мясных и растительных проб, и он показал высокую сходимость результатов с данными газо-жидкостной хроматографии.
Электрохимические свойства и влияние на них органических растворителей также изучали для гомогентизиновой кислоты в водном ацетонитриле [24], коричной кислоты в водном ДМФА [25, 26], алкилгетеросульфонов в 20–80%-ном ДМСО [27], парабенов в смеси уксусная кислота–ацетонитрил [28], нитрофенилгликозидов в водном метаноле [29], холестерина в водном этаноле [30].
Экзотичным примером использования водно-органических сред можно считать определение нерастворимых в воде антиоксидантов (каротин, токоферол, 4,4,4-трифтор-3-метил-2-бутеновая кислота и мелатонин) по их влиянию на химический осциллятор Белоусова−Жаботинского [31]. Колебательную реакцию контролировали потенциометрически и с помощью циклической вольтамперометрии, для солюбилизации антиоксидантов использовали смеси акрилонитрила и ДМФА в серной кислоте.
Микроэмульсии. Линдман и соавт. [32] определили микроэмульсии как дисперсные системы, включающие воду, масло и поверхностно-активное вещество (ПАВ), которые спонтанно образуют изотропный, прозрачный и термодинамический стабильный раствор. Многие микроэмульсии, нашедшие применение в электроанализе, были разработаны для доставки гидрофобных молекул лекарств и улучшения растворимости фармацевтических препаратов и красителей.
Эмульгирование органического экстракта может рассматриваться как простейший способ совершенствования методики определения, предусматривающей экстракцию аналита в органический растворитель. Однако число таких методик невелико. В качестве примера можно привести полярографическое определение двух гербицидов sртриазинового ряда – азипротрина (2-азидо-4-изопропиламино-6-метилтио-1,3,5-триазина) и десметрина (4-изопропиламино-6-метиламино-2-метилтио-1,3,5-триазина) [33]. Эмульсию этилацетата готовили в присутствии 0.1%-ного пентансульфоната натрия. Сигналом служил ток катодного восстановления триазинов. Способ позволяет определять от 0.1 мкМ до 0.1 мМ гербицидов (clim 45 и 66 нМ азипротрина и 66 нМ десметрина).
Описано [34] определение таншинона IIA, биологически активного вещества растительного происхождения, применяемого в качестве иммуномодулятора и антиоксиданта, в микроэмульсии, образованной триглициридом каприловой и каприновой кислот в присутствии эмульгаторов полисорбата 80 и Kolliphor® HS 15. Установлены влияние детергентов на скорость переноса электрона и возможность прямого определения препарата без разрушения микроэмульсий в интервале концентраций от 0.2 до 1.2 мкг/л (clim 50.25 нг/мл).
Витамины С и Е вводили в микроэмульсии типа “масло в воде” в присутствии 1–77% пентанола (эмульгатор додецилсульфат натрия) и 10–80% бутанола (эмульгатор цетилтриметиламмоний бромид) [35]. Включение аскорбиновой кислоты в эмульсии ускоряло ее окисление растворенным кислородом в степени, увеличивающейся с ростом доли органического растворителя в системе. Кроме того, витамин С ускорял аналогичное разложение присутствующего в его растворе витамина Е. В отсутствие органического растворителя повышение концентрации ПАВ стабилизировало растворы указанных витаминов. В дальнейшем исследовали электрохимическое окисление аскорбиновой кислоты и установили лимитирующее влияние рН на скорость ее окисления [36]. Введение этанола (1 : 1) и ацетонитрила (2 : 3) в буферный раствор увеличивало потенциалы пика окисления и снижало ток пика. Электрохимические параметры окисления в слабокислой среде малочувствительны к присутствию в растворе ПАВ.
Интересный способ оценки антиоксидантных свойств оливкового масла и установления его торговой марки предложен в работе [37]. Для этого разработали массив вольтамперометрических сенсоров типа “электронный язык”, состоящий из печатных графитовых электродов, покрытых различным образом допированным полипирролом. Полимерное покрытие получали путем электролиза. Эмульсии готовили, диспергируя масло в растворе додецилсульфата натрия. На циклических вольтамперограммах регистрировали широкий обратимый пик окисления–восстановления полипиррола, параметры которого зависели от сорта масла и добавок в него модельных антиоксидантов. Образцы масла классифицировали по стандартным образцам с помощью проекций главных компонент. Критерием дискриминации служило значение полного полифенольного индекса. Способ показал возможность надежного предсказания данного параметра, референсным методом служил стандартный способ определения антиоксидантов Фолина–Чокальтеу. Влияние эмульгирования масла на стадии подготовки к измерению вольтамперограмм на результаты тестирования не обсуждалось.
Анализ в капле. Электрохимические методы анализа широко применяются для анализа окислительно-восстановительных процессов, протекающих в капле на поверхности электрода, погруженного в раствор электролита [38]. Такие исследования имитируют многие природные и биохимические процессы, протекающие в микродисперсных системах [39]. Примером могут служить реакции в клетке с участием микровезикул или концентрирование в капле воды электрохимически активных растворимых газов в атмосферном воздухе. Параметры окислительно-восстановительных процессов измеряют в единичной капле, множестве разделенных капель или тонком слое органической жидкости, находящейся на индикаторном электроде. Объем капли обычно составляет от нескольких десятых до десятков микролитров, площадь электрода – менее 1 мм2. Органическая фаза состоит из нитробензола и аналогичных полярных органических растворителей, способных удерживать достаточные количества электрохимически активных соединений. Противоэлектрод и электрод сравнения могут размещаться во второй жидкой фазе или вводиться в ту же каплю на индикаторном электроде, изготовленном из достаточно гидрофобного материала, например полированного высокоориентированного графита. Пленка органического вещества содержит растворенный редокс-индикатор, такой как ферроцен [40] или производные порфирина [41]. Водная фаза может содержать металлоцианаты, сигнал которых используется для интерпретации регистрируемых токов, или традиционные индифферентные фоновые электролиты. Для предотвращения вымывания медиатора из капли использовали электрополимеризацию или ковалентную пришивку медиатора к полимеру. Аналогичным образом организованы системы типа “вода в масле”, когда водный раствор электрохимически активного вещества (гидрохинон [42]) диспергирован в органическом растворителе. Окислительно-восстановительная реакция генерирует ток переноса иона через границу вода/органическая фаза, который фиксируется на индикаторном электроде [43]. Для компенсации изменения заряда фаз в них вводят соли фоновых электролитов, которые сами не могут переноситься через границу раздела фаз. Подобные системы не нашли широкого применения при электрохимическом определении небольших органических молекул, однако оказались перспективными при определении белков [44] и ДНК [45], участвующих в трансграничном переносе заряда индикаторных ионов. Вместе с тем продолжают активно исследоваться системы, включающие множества микрокапель органической фазы в порах инертных носителей, контактирующих с водной средой. Такие системы показали перспективность применения в электрооптических методах анализа, например, при определении заряженных молекул некоторых пестицидов (1,3-ди(карбамоилтио)-2-диметиламинопропан, аминоэтилфосфоновая кислота, 4-нитро-1H-пиразол-3-карбоновая кислота, 3,5-дихлорфенол) [46] или при определении комплексов металлов с переменной валентностью [47]. Инертная пористая матрица облегчает манипулирование сенсором, поскольку механически защищает капли от их слияния или удаления с поверхности электрода.
Хотя пока перспективность использования микрокапель в формате электрохимического анализа неочевидна, этот способ хорошо укладывается в стратегию формирования и эксплуатации микрофлюидных устройств. Примером подобного подхода может служить устройство, изготавливаемое с помощью 3D печати, в котором электроды выполняют функции генератора и “счетчика” микрокапель масла или воды из компактной фазы, содержащей низкие концентрации детергента [48]. Измеряемым параметром является изменение электропроводности в микроканалах. Устройство может найти применение в обеспечении и контроле доставки лекарственных препаратов и исследовании их фармакокинетики.
Глубокие эвтектические растворители и ионные жидкости. Глубокие эвтектические растворители рассматриваются как альтернатива неводным органическим растворителям и в определенной степени ионным жидкостям в различных областях, таких как электрохимический синтез полимеров [49], модификация электродов соединениями металлов [50], металлизация различных поверхностей [51], включая электрополировку гальванических покрытий [52], экстракция аналитов и др. [53]. В отличие от ионных жидкостей, синтез глубоких эвтектических растворителей в большей степени удовлетворяет принципам “зеленой химии”. Он не требует токсичных реагентов, а сам продукт не содержит побочных токсичных примесей, нивелирующих преимущества использования. Как правило, для получения глубоких эвтектических растворителей берут смесь как минимум двух веществ в стехиометрическом соотношении, близком к требуемому для получения их эвтектики [54]. Глубокие эвтектические растворители обычно состоят из акцептора и донора водородной связи, например холин хлорида и мочевины (глицерина, этиленгликоля). Другие варианты, реже применяемые в электрохимии – это сочетание кислот Льюиса (хлориды цинка, алюминия, магния, хрома(III), олова(II)) и кислот Бренстеда (трифлат-анион, карбоновые дикислоты, лимонная кислота). Помимо этого выделяют так называемые природные глубокие эвтектические растворители и терапевтические глубокие эвтектические растворители. Это смеси метаболитов, которые накапливаются в больших количествах в клетках и играют роль криопротекторов, протекторов обезвоживания и т.д. Растворимость многих промежуточных соединений биохимических циклов в таких системах выше, чем в воде. В перспективе – применение таких систем в парфюмерной и пищевой промышленности. Глубокие органические растворители готовят, смешивая компоненты при незначительном нагреве и перемешивании. Они имеют температуру плавления от 10–20 до –70°С и плотность в 1.1–1.6 раз больше плотности воды. Структурные формулы соединений – компонентов глубоких эвтектических растворителей приведены на схеме 1 .
Схема 1 . Компоненты глубоких эвтектических растворителей, используемых в электрохимии и электрохимическом анализе.
Природный глубокий эвтектический растворитель, включающий 10%-ную молочную кислоту, глюкозу и воду, использовали для повышения чувствительности определения олейропеина в сложных растительных матрицах. Измерения проводили на графитовом электроде, покрытом дисперсией оксида графена и многостенных углеродных нанотрубок, с помощью дифференциально-импульсной вольтамперометрии. Использование добавки увеличило ток окисления аналита в 5.3 раза относительно аналогичного измерения в буферном растворе на немодифицированном электроде. Градуировочная зависимость линейна в интервале концентраций от 0.1 до 37 мкМ (предел обнаружения 30 нМ). Сенсор опробован при анализе экстрактов из листьев оливкового дерева, полученные результаты сравнивали с данными капиллярного зонного электрофореза [55].
Сходный по составу растворитель из молочной кислоты, глюкозы, лимонной кислоты и воды использовали для определения кверцетина на печатном графитовом электроде [56]. В зависимости от соотношения компонентов глубокого эвтектического растворителя увеличение сигнала – тока пика окисления кверцетина – составило до 100% относительно аналогичного сигнала в буферном водном растворе. Сенсор позволяет проводить определение 0.026–7 мкМ кверцетина (предел обнаружения 7.97 нМ). Метод прошел апробацию при определении антиоксиданта в различных сортах лука.
Кверцетин также определяли на графитовом электроде, модифицированном многостенными углеродными нанотрубками, в 5%-ном глубоком эвтектическом растворителе на основе холин хлорида и мочевины (мольное соотношение 2 : 1) [57]. Сигналом служил ток пика окисления кверцетина при 0.42 В в дифференциально-импульсном режиме измерения, пропорциональный концентрации аналита в интервале от 9.95 × 10–7 М до 4.76 × 10–5 М (предел обнаружения 36 нМ).
Предложена методика определения антиоксидантов в оливковом масле холодного отжима на планарных одноразовых стеклоуглеродных электродах, модифицированных частицами диоксида титана и углеродных нанотрубок в пленке нафиона [58]. Сигнал измеряли методом квадратно-волновой вольтамперометрии в экстракте, полученном с помощью глубокого эвтектического растворителя состава молочная кислота, глюкоза и вода в молярном отношении 6 : 1 : 6 без использования других органических растворителей. В качестве эталонных антиоксидантов были выбраны кофейная и ванилиновая кислоты. Метод апробирован также при определении токоферола в масле подсолнечника, кукурузы и сои.
Гибридный электрохимический и оптический сенсор на 2,4,6-тринитротолуол предложен в работе [59]. В нем используется электрохимическое восстановление комплекса Мейзенхеймера, протекающее в глубоком эвтектическом растворителе на основе н-бутиламина. Интервал определяемых концентраций составил 0.63–1.81 мкМ, а коффициент селективности относительно пикриновой кислоты и динитротолуолов – до 104. Растворитель эталин готовили, смешивая холин хлорид и этиленгликоль в мольном отношении 1 : 2 с последующим добавлением 20 об. % н-бутиламина. Рабочий электрод представлял собой стекло с прозрачным слоем оксида олова, допированного фтором (FTO). Сигналом служило поглощение продуктов восстановления, которое регистрировали при 512 нм.
Ионные жидкости – органические солеобразные соединения с температурами плавления в интервале 0–100°С. Как правило, они состоят из одного объемного гидрофобного иона (обычно катиона) и небольшого гидрофильного противоиона. Примеры ионных жидкостей, нашедших применение в электрохимическом анализе, приведены на схеме 2 .
Схема 2 . Компоненты ионных жидкостей, применяемых в составе электрохимических сенсоров и средообразующих компонентов.
Благодаря ионной проводимости и низкой температуре плавления ионные жидкости нашли применение в составе ионселективных электродов, пластификаторов пастовых вольтамперометрических сенсоров [60, 61], гелеобразователей [62], компонентов модифицирующих слоев углеродных наноматериалов [63] и соединений металлов с переменной валентностью [64]. В зависимости от природы составляющих ионов и способа применения ионные жидкости могут также способствовать электрополимеризации различных органических соединений [65], облегчать диспергирование графита на стадии получения оксида графена и его последующего восстановления [66]. Кроме того, ионные жидкости могут включать электрохимически активные ионы, участвующие в реакции переноса электрона [67, 68].
Помимо изготовления электрохимических сенсоров и участия в генерации их сигнала ионные жидкости могут служить компонентами растворов аналитов для улучшения их растворимости и предотвращения агрегации на индикаторном электроде. Описано применение солюбилизированных ионных жидкостей на основе холина и ПАВ для высокочувствительного определения этилпарабена [69]. Указывается, что растворение аналита в указанных системах позволяет избежать агрегации этилпарабена на поверхности электрода, увеличивает пик окисления аналита на стеклоуглеродном электроде, покрытом полианилином и наночастицами золота, и улучшает метрологические характеристики его определения. Сенсор позволяет определять с помощью дифференциально-импульсной вольтамперометрии от 0.1 до 5.10 нМ этилпарабена (предел обнаружения 0.1 нМ). Наилучшие результаты достигнуты в присутствии холин хлорида. Сенсор апробирован на примере определения этилпарабена в косметическом средстве.
Разработан тонкопленочный сенсор на основе оптически прозрачного электрода ITO (оксиды индия и олова) с пленочными электродами, соединенными тонким слоем ионной жидкости (1-бутил-3-метилимидазолиний гексафторфосфат) [70]. Определяемыми веществами являлись пары нитроароматических соединений – взрывчатых веществ (2,4,6-тринитротолуол, пикриновая кислота и 2,4-динитротолуол), сорбируемых из газовой фазы в слое ионной жидкости и далее восстанавливаемых на электроде. Продукты электровосстановления дополнительно регистрировали по их цвету с использованием УФ-спектроскопии. Разложение цветов по спектру RGB повысило чувствительность определения. Оценка чувствительности определения исходила из разрешения и уровня шума светодиода LED как регистрирующего устройства и составила до нескольких мкг/м3.
Особенности применения ионных жидкостей в составе электродов или модифицирующих слоев электродов в вольтамперометрическом определении органических соединений рассмотрены в обзоре [71]. Отмечается повышение чувствительности и селективности определения, особенно в присутствии нескольких окисляющихся соединений, однако механизм указанного влияния во многих работах не раскрывается. Предположение об экстракционном концентрирования в целом нуждается в дополнительных исследованиях, а улучшение условий электронного обмена на поверхности сенсора очевидно, но прямо с аналитическими характеристиками определения связано не всегда. Описано определение дофамина и аскорбиновой кислоты [72–75], теофиллина и кофеина [76], аденозиндифосфата [77], рутина [78]. Более ранние работы по применению ионных жидкостей в составе электрохимических сенсоров обобщены в обзоре [79].
Биохимические сенсоры. Причины применения органических растворителей при измерениях с помощью биосенсоров те же, что и в традиционном электрохимическом анализе – повышение чувствительности измерения за счет гомогенизации объекта анализа и повышения концентрации аналита. Важным стимулом можно считать еще и упрощение пробоподготовки за счет исключения стадии удаления растворителя из экстракта. Однако большинство биохимических рецепторов при контакте с полярными органическими растворителями теряет часть молекул воды, стабилизирующих их трехмерную структуру [80]. Это зачастую приводит к необратимым последствиям – снижению сигнала в холостом опыте, уменьшению избирательности связывания молекул аналита и радикальному сокращению времени жизни биосенсора. Указанные проблемы в основном связаны с функционированием белков – антител и ферментов. Тем не менее существуют две области применения органических растворителей, заслуживающих упоминания применительно к ферментным сенсорам. Это – иммобилизация ферментов в присутствии высоких концентраций апротонных растворителей, не смешивающихся с водой, и проблемы определения необратимых ингибиторов ацетилхолинэстеразы (АХЭ).
Возможность сохранения ферментативной активности после контакта фермента с растворителями, не смешивающимися с водой, установлена в работах проф. А.М. Клибанова и сотр. (МГУ, Москва) [81]. Показано, что зависимость ферментативной активности от концентрации органического растворителя имеет максимум в области высоких ее значений, так что фермент не только сохраняет свои каталитические свойства, но и приобретает возможность катализировать процессы, в водной среде невозможные. Указанное свойство нашло применение, в первую очередь, в органическом синтезе, включая промышленно важные процессы, протекающие под действием липаз [82]. Помимо этого органические растворители в концентрации около 90% успешно использовали также на стадии изготовления ферментных сенсоров с улучшенными аналитическими характеристиками. Так, описан сенсор [83] для контроля уровня лактата в потовых выделениях, в котором фермент иммобилизовали из 90%-ного изопропанола. Для защиты активного центра фермента в раствор дополнительно вводили полиэлектролиты. Биосенсор показал стабильный воспроизводимый сигнал в режиме проточно-инжекционного анализа в интервале концентраций лактата 1 мкМ–1 мМ. Предложены аналогичные способы иммобилизации глюкозооксидазы в пленки перфторированных полимеров, полученных из органических растворителей [84]. Биосенсоры демонстрировали 10-кратное увеличение чувствительности сигнала на пероксид водорода, продукт ферментативной реакции, и высокую устойчивость в потоке.
Ацетилхолинэстераза – фермент, катализирующий гидролиз эфиров холина. Она несовместима с полярными органическими растворителями, смешивающимися с водой, поскольку они вызывают необратимую потерю активности фермента. В присутствии пестицидов – ингибиторов фермента их действие аддитивно с влиянием растворителя. В этих условия выбор растворителя и его концентрации можно рассматривать как компромисс между необходимостью работы с раствором пестицида и побочным эффектом растворителя, повышающим определяемые концентрации аналита в силу собственного влияния на фермент. Сигналом биосенсоров на основе АХЭ обычно служит ток окисления тиохолина – продукта ферментативного гидролиза синтетического субстрата ацетилтиохолина (уравнение (1)):
Его же определяют в фотометрической реакции с реактивом Эллмана [85]. Результаты сравнения влияния метанола, этанола пропанола, бутанола, пентанола, пропан-2-ола, ДМСО, ДМФА, тетрагидрофурана и ацетонитрила в концентрациях 5–20 об. % на взаимодействие АХЭ с хлорпирифосом, диизопропилфторфосфатом, дихлофосом, диметоатом, фенитоном, параоксоном, фозалоном, пиримифосом приведены в работе [86]. Наименьшее влияние на определение пестицидов оказал изопропанол. Несколько позднее закономерности, установленные для раствора фермента в водных органических растворителях, применили для АХЭ, иммобилизованной на печатном графитовом электроде с хроноамперометрической регистрацией сигнала [87]. В оптимальных условиях биосенсор позволил определять боевые отравляющие вещества зарин, зоман, табун и VX газы с clim 7.41, 6.31, 61.7 и 21.9 пМ соответственно. Продолжительность анализа составила не более 10 мин. Измерению не мешали 10–20% этанола, метанола, изопропанола и ацетонитрила.
Применительно к иммобилизованной АХЭ наибольшее применение нашел ацетонитрил, присутствие которого в некоторых случаях даже повышало чувствительность фермента в отношении необратимых ингибиторов [88]. Так, описано определение O,O-диметил-O-2,2-дихлорвинилфосфата (ДДВФ) и метомила с помощью АХЭ, растворенной в смеси трис-буферного раствора и ацетонитрила. Сигналом служило медиаторное окисление тиохолина на золотом электроде в присутствии медиаторов электронного переноса – феррицианида и тионина [89]. Ацетилхолинэстеразау различного происхождения, включая мутантные белки, полученную с помощью генной инженерии, использовали в составе биосенсоров на основе печатных графитовых электродов для определения дихлорфоса в кожуре яблок после его экстракции ацетонитрилом [90]. Для минимизации влияния растворителя фермент дополнительно защищали пленкой фотосшитого полимера PVA-SbQ, а экстракт разбавляли до содержания растворителя 5%, не влияющего на активность АХЭ. В модельных растворах максимум чувствительности показал мутантный фермент, выделенный из дрозофилы, с clim дихлорфоса 70 пМ. Аналогичная защита иммобилизованного фермента от действия органического растворителя может быть обеспечена введением в поверхностный слой биосенсора хитозана [91]. Определение параоксона в этом случае возможно при концентрации ацетонитрила до 15% и метанола до 25%. Ранее предложено использовать стабилизацию АХЭ в каппа-каррагинане и проводить измерение в органических растворителях, не смешивающихся с водой, но предварительно насыщенных водным буферным раствором [92, 93].
Среди других ферментных сенсоров, функционирующих в присутствии органических растворителей, можно выделить оксидоредуктазы, реагирующие с полярными субстратами, ограниченно растворимыми в воде. Так, описано [94] определение 2-аминофенола с помощью пероксидазы из хрена, включенной в состав угольно-пастового электрода. Измерения проводили в ацетатном буферном растворе, содержащем изопропанол, по току биокаталитического восстановления продукта димеризации аналита, образующегося в присутствии фермента; clim составил 9.2 мкМ, диапазон определяемых концентраций – 10 мкМ–1.0 мМ. Возможно селективное определение 2-аминофенолда в присутствии избытка парацетамола.
Описано определение глюкозы с помощью глюкозооксидазы, иммобилизованной в слое полипиррола [95]. Для повышения чувствительности определения в слой полимера вводили сульфонатное производное каликс [6]арена, а электрополимеризацию проводили в ацетонитриле. По сравнению с полимером, полученным в водной среде, введение макроцикла и ацетонитрила повысило чувствительность определения более чем в два раза (с 31.6 до 79.3 мкА М–1 см–2). Тот же фермент, иммобилизованный в пленке нафиона, прошел апробацию при проточно-инжекционном определении глюкозы в присутствии изопропанола [96].
Тирозиназу (полифенолоксидазу) иммобилизовали в нанокапсулах полиакрилата, полученных in situ в присутствии 4-диметиламиноантипирина как стабилизатора [97]. Нанокапсулы закрепляли на поверхности стеклоуглерода в пленке хитозана и использовали при вольтамперометрическом определении бисфенола А (clim 12 нМ, диапазон определяемых концентраций 50 нМ–2.0 мкМ). Биосенсор сохранял отклик в 50%-ных водных растворителях (ДМСО, ДМФА, этанол и метанол). Биосенсор апробирован при определении бисфенола А в бутилированной воде и пластиковой посуде. Стабилизирующий эффект аналогичного полимерного слоя установлен также для лакказы [98].
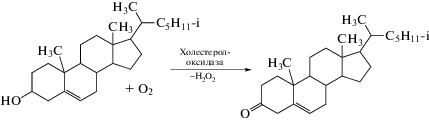
Холестеролоксидазу иммобилизовали на гребенчатом электроде путем диазотирования 4-карбоксиметилфенилдиазониевой соли с последующим карбодиимидным связыванием по карбоксилатной группе [99]. Фермент катализирует окисление холестерола с образование пероксида водорода (уравнение (2)):
Для ускорения переноса электрона на электрод дополнительно электрохимически осаждали наночастицы золота. Холестерол определяли в присутствии 5%-ного изопропанола для повышения его растворимости в водной среде. В хроноамперометрическом режиме сенсор позволяет определять 0.005–1 мМ холестерина (clim 1.2 мкМ). Ферментный сенсор тестировали на образцах сыворотки крови человека, предварительно разбавленной в 20 раз фосфатным буферным раствором. Определению не мешали стандартные компоненты крови, способные к окислению в условиях эксперимента, – ацетаминофен, сорбиновая, аскорбиновая, мочевая и салициловая кислоты, глутатион, глюкоза и креатинин.
Мутантные белки – цинк-, медьсодержащие супероксиддисмутазы – иммобилизовали на золотом электроде посредством Au–S-связывания [100]. Электронный перенос изучали в смесях вода–ДМСО с содержанием растворителя до 60%. Выявлено отсутствие зависимости формального редокс-потенциала, хотя токи пика белка уменьшались при увеличении доли ДМСО в растворе. Биосенсор использовали для чувствительного определения супероксидного аниона. Его генерировали в реакции ксантина и ксантиноксидазы, добавляемых в раствор. Наклон соответствующей зависимости тока пика фермента уменьшался линейно при увеличении концентрации органического растворителя, но оставался достаточно большим по сравнению с параметрами аналогичного сенсора на основе цитохрома С. Оптимальное содержание ДМСО составило 40 об. %.
Среди других классов ферментов можно упомянуть лишь глутатион-S-трансферазу, применяемую для определения пестицидов [101, 102]. Фермент иммобилизовали совместно с оксидом графена в слое желатина на стеклоуглеродном электроде. Субстратом служили глутатион и 1-хлор-2,4-динитробензол. Биосенсор тестировали на широком круге пестицидов – бензимидазолов, хлорорганических соединений, карбаматов, тиофосфатов, полифенолов и пиретроидов. Измерения проводили в среде 25%-ного метанола.
Применение водно-органических и дисперсных сред для других типов электрохимических биосенсоров фактически не описано. Среди редких исключений – аптасенсор на глютен, функционирующий в глубоком эвтектическом растворителе эталине [103]. Измерения проводили на печатном графитовом электроде в сэндвичевом формате, используя в качестве метки пероксидазу из хрена. Активность фермента устанавливали хроноамперометрически по току восстановления продукта окисления тетраметилбензидина, субстрата пероксидазы. Биосенсор позволяет определять до 100 мкг/л глютена с нижней границей определяемых содержаний 1 мкг/л. Это существенно лучше, чем характеристики того же аптасенсора при измерениях в фосфатном буферном растворе (10 мкг/л). Интересно, что структуру аптамера на глютен также устанавливали, проводя селекцию последовательностей олигонуклеотидов в том же растворителе [104]. Аптасенсор использовали для контроля глютена в соевой и рисовой муке, а также в десертах (панакотта и ванильный крем). В последнем случае в качестве референсного метода использовали иммуноферментный тест.
* * *
Водно-органические и дисперсные среды, содержащие органические растворители, позволяют решать различные задачи, связанные с конструированием и применением электрохимических сенсоров на органические соединения. Традиционные подходы, когда растворитель изначально используется как экстрагент для извлечения аналита из органической матрицы, постепенно теряют свое значение, уступая более экологичным методам солюбилизации растворов в присутствии ПАВ. Однако гомогенные и эмульгированные среды сохраняют важное значение для определения веществ с низкой растворимостью в воде – витаминов, антиоксидантов, некоторых фармацевтических препаратов. В таких случаях объемная доля органического растворителя достаточно низка для сохранения низкой себестоимости измерения, а влияние на электродную реакцию связано в основном с некоторым снижением обратимости электронного переноса по сравнению с аналогичными измерениями в водных растворах фоновых электролитов. Использование глубоких эвтектических растворителей и ионных жидкостей расширяет возможности электрохимического анализа за счет смягчения требований к условиям модификации индикаторных электродов и рабочему окну потенциалов, а также более широкого круга определяемых аналитов. Хотя число глубоких эвтектических растворителей пока ограничено в основном системами на основе холин хлорида, с введением в практику других аналогичных компонентов возможности электроанализа возрастут. Среди других перспективных направлений использования органических компонентов растворов – анализ в микрокаплях и микроэмульсиях как частях микрофлюидных устройств. Пока эти исследования ограничены генерацией микрокапель в электрическом поле и их подсчетом в микроканалах пористых матриц, однако следует ожидать в ближайшем будущем расширения данной тематики в связи с активными усилиями по разработке и внедрению нового поколения устройств на принципах микрофлюидики для решения задач медицинской диагностики и фармакокинетики вне лечебного учреждения.
Исследования проводили при поддержке Российского научного фонда (грант № 17-73-20024).
Список литературы
Bessegato G.G., Brugnera M.F., Valnice M., Zanoni B. Electroanalytical sensing of dyes and colorants // Curr. Opin. Electrochem. 2019. V. 16. P. 134. https://doi.org/10.1016/j.coelec.2019.05.008
Jeerapan I., Sonsaard T., Nacapricha D. Applying nanomaterials to modern biomedical electrochemical detection of metabolites, electrolytes, and pathogens // Chemosensors. 2020. V. 8. Article 71. https://doi.org/10.3390/chemosensors8030071
Simoska O., Stevenson K.J. Electrochemical sensors for rapid diagnosis of pathogens in real time // Analyst. 2019. V. 144. P. 6461. https://doi.org/10.1039/c9an01747j
Labib M., Sragent E.H., Kelly O.S. Electrochemical methods for the analysis of clinically relevant biomolecules // Chem. Rev. 2016. V. 116. P. 9001. https://doi.org/10.1021/acs.chemrev.6b00220
Zima J., Švancara I., Barek J., Vytřas K. Recent advances in electroanalysis of organic compounds at carbon paste electrodes // Crit. Rev. Anal. Chem. 2009. V. 39. P. 204. https://doi.org/10.1080/10408340903011853
Choi J.R., Yong K.W., Choi J.Y., Cowie A.C. Emerging point-of-care technologies for food safety analysis // Sensors. 2019. V. 19. P. 817. https://doi.org/10.3390/s19040817
Barek J. How to improve the performance of electrochemical sensors via minimization of electrode passivation // Chemosensors. 2021. V. 9. Article 12. https://doi.org/10.3390/chemosensors9010012
Tessensohn M.E., Ng S.J., Chan K.K., Gan S.L., Sims N.F., Koh Y.R., Webster R.D. Impurities in nitrile solvents commonly used for electrochemistry, and their effects on voltammetric data // ChemElectroChem. 2016. V. 3. № 11. P. 1753. https://doi.org/10.1002/celc.201600266
Švancara I., Vytras K., Renger F., Smyth M.R. Application of carbon paste electrodes in highly methanolic solutions // Electrochim. Acta. 1992. V. 37. P. 1355. https://doi.org/10.1016/0013-4686(92)87007-M
Басова Е.М., Иванов В.М., Апендеева О.К., Прохорова Г.В. Изучение окисления диэтилдитиокарбамината натрия на стеклоуглеродном электроде в водных и водно-органических растворах // Вестн. Моск. ун-та. Химия. 2013. Т. 54. № 2. С. 85. (Basova E.M., Ivanova V.M., Apendeeva O.K., Pro-khorova G.V. A study of sodium diethyldithiocarbamate oxidation at glassy carbon electrode in water and water-organic mixtures // Moscow Univ. Chem. Bull. 2013. V. 68. № 2. P. 87. ).https://doi.org/10.3103/S0027131413020028
Peverly A.A., Karty J.A., Peters D.G. Electrochemical reduction of (1R,2r,3S,4R,5r, 6S)-hexachlorocyclohexane (lindane) at silver cathodes in organic and aqueous-organic media // J. Electroanal. Chem. 2013. V. 692. P. 66. https://doi.org/10.1016/j.jelechem.2013.01.009
German N., Armalis S. Voltammetric determination of naphthalene, fluorene and anthracene using mixed water-organic solvent media // Chemija. 2012. V. 23. P. 86.
Cincotto F.H., Canevari T.C., Machado S.A.S. Highly sensitive electrochemical sensor for determination of vitamin D in mixtures of water-ethanol // Electroanalysis. 2014. V. 26. P. 2783. https://doi.org/10.1002/elan.201400451
Žabčíková S., Mikysek T., Červenka L., Sýs M. Electrochemical study and determination of all-trans-retinol at carbon paste electrode modified by a surfactant // Food Technol. Biotechnol. 2018. V. 56. P. 337. https://doi.org/10.17113/ftb.56.03.18.5618
Cirrincione M., Zanfrognini B., Pigani L., Protti M., Mercolini L., Zanardi C. Development of an electrochemical sensor based on carbon black for the detection of cannabidiol in vegetable extracts // Analyst. 2021. V. 146. P. 612. https://doi.org/10.1039/D0AN01932A
Santos D.P., Trindade M.A.G., Oliveira R.A.G., Osugi M.E., Bianchi A.R., Zanoni M.V.B. Electrochemical method for quantitative determination of trace amounts of disperse dye in wastewater // Color. Technol. 2013. V. 130. P. 43. https://doi.org/10.1111/cote.12059
Borsari M., Bellei M., Tavagnacco C., Peressini S., Millo D., Costa G. Redox thermodynamics of cytochrome c in mixed water /organic solvent solutions // Inorg. Chim. Acta. 2003. V. 349. P. 182. https://doi.org/10.1016/S0020-1693(03)00043-4
Krylov A.V., Pfeil W., Lisdat F. Denaturation and renaturation of cytochrome c immobilized on gold electrodes in DMSO-containing buffers // J. Electroanal. Chem. 2004. V. 569. P. 225. https://doi.org/10.1016/j.jelechem.2004.03.005
Liu H.-H., Wan Y.-Q., Zou G.-L. Redox reactions and enzyme-like activities of immobilized myoglobin in aqueous/organic mixtures // J. Electroanal. Chem. 2006. V. 594. P. 111. https://doi.org/10.1016/j.jelechem.2006.05.027
Tom J., Jakubec P.J., Andreas H.A. Mechanisms of enhanced hemoglobin electroactivity on carbon electrodes upon exposure to a water-miscible primary alcohol // Anal. Chem. 2018. V. 90. P. 5764. https://doi.org/10.1021/acs.analchem.8b00117
Da Silva J.A., Vergara L.J.N., Bollo S., Squella J.A. Voltammetric redox behavior of nitrofuryl 1,4-dihydropyridine derivatives: Interdependence between two redox centers // J. Electroanal. Chem. 2006. V. 591. P. 99. https://doi.org/10.1016/j.jelechem.2006.03.034
Michalkiewicz S. Cathodic reduction of coenzyme Q10 on glassy carbon electrode in acetic acid–acetonitrile solutions // Bioelectrochem. 2007. V. 70. P. 495. https://doi.org/10.1016/j.bioelechem.2006.08.003
Li D., Deng W., Xu H., Sun Y., Wang Y., Chen S., Ding X. Electrochemical investigation of coenzyme Q10 on silver electrode in ethanol aqueous solution and its determination using differential pulse voltammetry // J. Lab. Autom. 2016. V. 21. P. 579. https://doi.org/10.1177/2211068216644442
Eslami M., Namazian M., Zare H.R. Electrooxidation of homogentisic acid in aqueous and mixed solvent solutions: Experimental and theoretical studies // J. Phys. Chem. B. 2013. V. 117. P. 2757. https://doi.org/10.1021/jp3121325
Коротаева Л.М., Рубинская Т.Я., Михальченко Л.В., Рыбакова И.А., Гультяй В.П. Особенности механизма электровосстановления коричной кислоты в ДМФ и смеси ДМФ–Н2O // Электрохимия. 2011. Т. 47. № 10. С. 1220. (Korotaeva L.M., Rubinskaya T.Ya., Mikhal’chenko L.V., Rybakova I.A., Gul’tyai V.P. Peculiarities of the mechanism of electroreduction of cinnamic acid in DMF and DMF–H2O mixture // Russ. J. Electrochem. 2011. V. 47. № 10. P. 1139. )https://doi.org/10.1134/S1023193511100065
Коротаева Л.М., Рубинская Т.Я., Рыбакова И.А., Гультяй В.П. Электровосстановление коричной кислоты в ДМФ в присутствии уксусной кислоты на ртутном катоде // Электрохимия. 2013. Т. 49. № 10. С. 1048. (Korotaeva L.M., Kurmaz V.B., Rubinskaya T.Ya., Gul’tyai V.P. Electrochemical behavior of cinnamic acid associates on carbositall electrode in dimethylformamide in the presence of external proton donors // Russ. J. Electrochem. 2015. V. 51. № 12. P. 1135. )https://doi.org/10.1134/S1023193513100108
Кривенко А.Г., Курмаз В.А., Коткин А.С., Манжос Р.А., Коротаева Л.М., Гультяй В.П. О природе элементарных стадий электровосстановления алкил(гетеро)арилсульфонов в водно-органических средах // Электрохимия. 2011. Т. 47. № 10. С. 1209. (Krivenko A.G., Kurmaz V.A., Kotkin A.S., Manzhos R.A., Korotaeva L.M., Gul’tyai V.P. The elementary stages of electroreduction of alkyl(hetero)arylsulfones in water-organic media // Russ. J. Electrochem. 2011. V. 47. № 10. P. 1129. )https://doi.org/10.1134/S1023193511100090
Michalkiewicz S. Anodic oxidation of parabens in acetic acid-acetonitrile solutions // J. Appl. Electrochem. 2013. V. 43. P. 85. https://doi.org/10.1007/s10800-012-0502-5
Gubica T., Stroka J., Temeriusz A., Kańska M. Cyclic voltammetry of nitrophenyl N-glycosides on mercury electrode // Phys. Org. Chem. 2011. V. 24. P. 1229. https://doi.org/10.1002/poc.1854
Alagappan M., Immanuel S., Sivasubramanian R., Kandaswamy A. Development of cholesterol biosensor using Au nanoparticles decorated f-MWCNT covered with polypyrrole network // Arab. J. Chem. 2020. V. 13. № 1. P. 2001. https://doi.org/10.1016/j.arabjc.2018.02.018
Ganaie N.B., Peerzada G.M. Dynamical regime of resorcinol based Belousov – Zhabotinsky chemical oscillator in the presence or absence of some hydrophobic antioxidants in aqueous–organic mixed media // RSC Adv. 2017. V. 7. P. 13019. https://doi.org/10.1039/C6RA25351B
Danielsson I., Lindman B. The definition of microemulsion // Colloids Surf. 1981. V. 3. P. 391. https://doi.org/10.1016/0166-6622(81)80064-9
Gálvez R., Pedrero M., Buyo F., de Villena J.M., Pingarrón J.M. Oil-in-water emulsions as suitable working media for the direct polarographic determination of aziprotryne and desmetryne from its organic extracts in water samples // Fresenius J. Anal. Chem. 2000. V. 367. P. 454. https://doi.org/10.1007/s002160000352
Wu J., Wang W., Wang M., Liu H., Pan H. Electrochemical behavior and direct quantitative determination of tanshinone IIA in micro-emulsion // Int. J. Electrochem. Sci. 2016. V. 11. P. 5165. https://doi.org/10.20964/2016.06.55
Drach M., Narkiewicz-Michałek J., Sienkiewicz A., Szymula M., Bravo-Díaz C. Antioxidative properties of vitamins C and E in micellar systems and in microemulsions // Colloids Surf. A. 2011. V. 379. P. 79. https://doi.org/10.1016/j.colsurfa.2010.11.073
Sienkiewicz A., Szymula M., Narkiewicz-Michałek J. Studies of ascorbic acid electroactivity in the H2O/ACN(EtOH) solutions containing SDS // Colloids Surf. A. 2012. V. 413. P. 44. https://doi.org/10.1016/j.colsurfa.2012.02.034
Apetrei I.M., Apetrei C. Voltammetric e-tongue for the quantification of total polyphenol content in olive oils // Food Res. Int. 2013. V. 54. P. 2075. https://doi.org/10.1016/j.foodres.2013.04.032
Banks C.E., Davies T.J., Evans R.G., Hignett G., Wain A.J., Lawrence N.S., Wadhawan J.D., Marken F., Compton R.G. Electrochemistry of immobilised redox droplets: Concepts and applications // Phys. Chem. Chem. Phys. 2003. V. 5. P. 4053. https://doi.org/10.1039/B307326M
Yeste J., Illa X., Alvarez M., Villa R. Engineering and monitoring cellular barrier models // J. Biol. Eng. 2018. V. 12. P. 1. https://doi.org/10.1186/s13036-018-0108-5
Cuartero M., Chai L., Zhang B., De Marco R., Crespo G.A. Ferrocene self-assembled monolayer as a redox mediator for triggering ion transfer across nanometer-sized membranes // Electrochim. Acta. 2019. V. 315. P. 84. https://doi.org/10.1016/j.electacta.2019.05.091
Shi C., Anson F.C. Electron transfer between reactants located on opposite sides of liquid/liquid interfaces // J. Phys. Chem. B. 1999. V. 103. P. 6283. https://doi.org/10.1021/jp991132l
Yang H., Kwon H., Kim B.-K., Park J.H. Electrochemical detection of single attoliter aqueous droplets in electrolyte-free organic solvent via collision events // Electrochim. Acta. 2019. V. 320. Article 134620. https://doi.org/10.1016/j.electacta.2019.134620
Laborda E., González J., Molina A. Analytical theory for ion transfer-electron transfer coupled reactions at redox layer-modified/thick film-modified electrodes // Curr. Opin. Electrochem. 2020. V. 19. P. 78. https://doi.org/10.1016/j.coelec.2019.10.007
Vagin M.Yu., Trashin S.A., Karpachova G.P., Klya-chko N.L., Karyakin A.A. Protein extracting electrodes: Insights in the mechanism // J. Electroanal. Chem. 2008. V. 623. P. 68. https://doi.org/10.1016/j.jelechem.2008.06.019
Vagin M.Yu., Trashin S.A., Karyakin A.A., Mascini M. Label-free detection of DNA hybridization at a liquid | liquid interface // Anal. Chem. 2008. V. 80. № 4. P. 336. https://doi.org/10.1021/ac701923c
Zhang Q., Li D., Cao X., Gu H., Deng W. Self-assembled microgels arrays for electrostatic concentration and surface-enhanced Raman spectroscopy detection of charged pesticides in seawater // Anal. Chem. 2019. V. 91. № 17. P. 11192. https://doi.org/10.1021/acs.analchem.9b02106
Ganesan V., Madrid E., Malpass-Evans R., Carta M., McKeown N.B., Marken F. Biphasic voltammetry and spectroelectrochemistry in polymer of intrinsic microporosity – 4-(3-phenylpropyl)-pyridine organogel/aqueous electrolyte systems: Reactivity of MnPc versus MnTPP // Electrocatalysis. 2019. V. 10. P. 295. https://doi.org/10.1007/s12678-018-0497-8
Duarte L.C., Chagas C.L.S., Ribeiro L.E.B., Coltro W.K.T. 3D printing of microfluidic devices with embedded sensing electrodes for generating and measuring the size of microdroplets based on contactless conductivity detection // Sens. Actuators B. 2017. V. 251. P. 427. https://doi.org/10.1016/j.snb.2017.05.011
Hosu O., Barsan M.M., Săndulescu R., Cristea C., Brett C.M.A. Hybrid nanocomposite platform, based on carbon nanotubes and poly(methylene blue) redox polymer synthesized in ethaline deep eutectic solvent for electrochemical determination of 5-aminosalicylic acid // Sensors. 2021. V. 21. Article 1161. https://doi.org/10.3390/s21041161
Aldana-Gonzalez J., Romero-Romo R., Robles-Peralta J., Morales-Gil P., Palacios-Gonzalez E., Ramírez-Silva M.T., Mostany J., Palomar-Pardav M. On the electrochemical formation of nickel nanoparticles onto glassy carbon from a deep eutectic solvent // Electrochim. Acta. 2018. V. 276. P. 417. https://doi.org/10.1016/j.electacta.2018.04.192
Zhong J., Li L., Waqas M., Wang X., Fan Y., Qi J., Yang D., Rong C., Chen W., Sun S. Deep eutectic solvent-assisted synthesis of highly efficient PtCu alloy nanoclusters on carbon nanotubes for methanol oxidation reaction // Electrochim. Acta. 2019. V. 322. Article 134677. https://doi.org/10.1016/j.electacta.2019.134677
Smith E.L., Abbott A.P., Ryder K.S. Deep eutectic solvents (DESs) and their applications // Chem. Rev. 2014. V. 114. P. 11060. https://doi.org/10.1021/cr300162p
Shishov A., Pochivalov A., Nugbienyo L., Andruch V., Bulatov A. Deep eutectic solvents are not only effective extractants // Trends Anal. Chem. 2020. V. 129. Article 115956. https://doi.org/10.1016/j.trac.2020.115956
Brett C.M.A. Deep eutectic solvents and applications in electrochemical sensing // Curr. Opin. Electrochem. 2018. V. 10. P. 143. https://doi.org/10.1016/j.coelec.2018.05.016
Gomez F.J.V., Spisso A., Silva M.F. Pencil graphite electrodes for improved electrochemical detection of oleuropein by the combination of natural deep eutectic solvents and graphene oxide // Electrophoresis. 2017. V. 38. P. 2704. https://doi.org/10.1002/elps.201700173
Gomez F.J.V., Espino M., Fernandez M.A., Raba J., Silva M.F. Enhanced electrochemical detection of quercetin by natural deep eutectic solvents // Anal. Chim. Acta. 2016. V. 936. P. 91. https://doi.org/10.1016/j.aca.2016.07.022
Zheng H., Ye L., Yan L., Gao Y. The electrochemical behavior and determination of quercetin in choline chloride/urea deep eutectic solvent electrolyte based on abrasively immobilized multi-wall carbon nanotubes modified electrode // Int. J. Electrochem. Sci. 2014. V. 9. P. 238.
Shabani E., Zappi D., Berisha L., Dini D., Antonelli M.L., Sadun C. Deep eutectic solvents (DES) as green extraction media for antioxidants electrochemical quantification in extra-virgin olive oils // Talanta. 2020. V. 215. Article 120880. https://doi.org/10.1016/j.talanta.2020.120880
Alizadeh N., Ghoorchian A. Hybrid optoelectrochemical sensor for superselective detection of 2,4,6-trinitrotoluene based on electrochemical reduced Meisenheimer complex // Anal. Chem. 2018. V. 90. P. 10360. https://doi.org/10.1021/acs.analchem.8b02183
Li Y., Li Y., Wang Y., Ma G., Liu X., Li Y., Soar J. Application of zeolitic imidazolate frameworks (ZIF-8)/ionic liquid composites modified nano-carbon paste electrode as sensor for electroanalytical sensing of 1-hydroxypyrene // Microchem. J. 2020. V. 159. Article 105433. https://doi.org/10.1016/j.microc.2020.105433
Mangaiyarkarasi, R., Premlatha, S., Khan R., Pratibha R., Umadevi S. Electrochemical performance of a new imidazolium ionic liquid crystal and carbon paste composite electrode for the sensitive detection of paracetamol // J. Mol. Liquids. 2020. V. 319. Article 114255. https://doi.org/10.1016/j.molliq.2020.114255
Zhang X., Li X., Pei X., Shu S., Min Q., Wang S. Determination of tyrosine in artificial urine using a screen-printed electrode modified with tetrathiafulvalene-tetracyanoquinodimethane/ionic liquid conductive gel // Int. J. Electrochem. Sci. 2020. V. 15. P. 9179. https://doi.org/10.20964/2020.09.38
El-Desoky H.S., Khattab A.E. A simple approach for trace voltammetrical determination of itraconazole an inhibitor of the cytochrome P-450 14 α-demethylase enzyme in formulation and human plasma utilizing graphene-carbon paste electrode in situ modified with an anionic surfactant // J. Electrochem. Soc. 2020. V. 167. P. 147502. https://doi.org/10.1149/1945-7111/abbdd5
Tajik S., Aflatoonian M.R., Beitollahi H., Shoaie I.S., Dourandish Z., Garkani F., Fariba, Nejad G., Aflatoonian B., Bamorovat M. Electrocatalytic oxidation and selective voltammetric detection of methyldopa in the presence of hydrochlorothiazide in real samples // Microchem. J. 2020. V. 158. Article 105182. https://doi.org/10.1016/j.microc.2020.105182
Zou F., Kong Y., Cui B. Fluoride-free electropolymerization of 3-aminophenylboronic acid in room temperature ionic liquids without exogenous protons // J. Mol. Liquids. 2020. V. 317. Article 114141. https://doi.org/10.1016/j.molliq.2020.114141
Aldroubi S., Brun N., Malham I.B., Mehdi A. When graphene meets ionic liquids: A good match for the design of functional materials // Nanoscale. 2021. V. 13. P. 2750. https://doi.org/10.1039/D0NR06871C
Dohertya, A.P., Graham L., Wagner K., Officer D.L., Chen J., Wallace G.G. Functional electro-materials based on ferricyanide redox-active ionic liquids // Electrochim. Acta. 2017. V. 245. P. 934. https://doi.org/10.1016/j.electacta.2017.05.201
Tajik S., Beitollahi H., Hosseinzadeh R., Afshar A.A., Varma R.S., Jang H.W., Shokouhimehr M. Electrochemical detection of hydrazine by carbon paste electrode modified with ferrocene derivatives, ionic liquid, and CoS2 – carbon nanotube nanocomposite // ACS Omega. 2021. V. 6. P. 4641. https://doi.org/10.1021/acsomega.0c05306
Rather J.A. Al Abria A., Kannan P. Electrochemical sensing of parabens in solubilized ionic liquid system at polyaniline decorated gold nanoparticles constructed interface // Microchem. J. 2020. V. 159. Article 105379. https://doi.org/10.1016/j.microc.2020.105379
Forzani E.S., Lu D., Leright M.J., Aguilar A.D., Tsow F., Iglesias R.A., Zhang Q., Lu J., Li J., Tao N. A hybrid electrochemical-colorimetric sensing platform for detection of explosives // J. Am. Chem. Soc. 2009. V. 131. P. 1390. https://doi.org/10.1021/ja809104h
Плетнев И.В., Смирнова С.В., Шведене Н.В. Новые направления применения ионных жидкостей в аналитической химии. 2. Электрохимические методы // Журн. аналит. химии. 2019. Т. 74. № 7 Приложение. С. S3. (Pletnev I.V., Smirnova S.V., Shvedene N.V. New directions in using ionic liquids in analytical chemistry. 2: Electrochemical methods // J. Anal. Chem. 2019. V. 74. P. S1 (Suppl. 1).) doi ).https://doi.org/10.1134/S1061934819070177
Wang C.-H., Wu C.-H., Wu J.-W., Lee M.-T., Chang J.-K., Ger M.-D., Sun C.-L. The effects of ionic liquid on the electrochemical sensing performance of graphene- and carbon nanotube-based electrodes // Analyst. 2012. V. 138. № 2. P. 576. https://doi.org/10.1039/C2AN36263E
Sun W., Wang Y., Zhang Y., Ju X., Li G., Sun Z. Poly(methylene blue) functionalized graphene modified carbon ionic liquid electrode for the electrochemical detection of dopamine // Anal. Chim. Acta. 2012. V. 751. P. 59. https://doi.org/10.1016/j.aca.2012.09.006
Wang C., Xu P., Zhuo K. Ionic liquid functionalized graphene-based electrochemical biosensor for simultaneous determination of dopamine and uric acid in the presence of ascorbic acid // Electroanalysis. 2014. V. 26. № 1. P. 191. https://doi.org/10.1002/elan.201300345
Zhuang X., Wang H., He T., Chen L. Enhanced voltammetric determination of dopamine using a glassy carbon electrode modified with ionic liquid-functionalized graphene and carbon dots // Microchim. Acta. 2016. V. 183. № 12. P. 3177. https://doi.org/10.1007/s00604-016-1971-8
Yang G., Zhao F., Zeng B. Facile fabrication of a novel anisotropic gold nanoparticle–chitosan–ionic liquid/graphene modified electrode for the determination of theophylline and caffeine // Talanta. 2014. V. 127. P. 116. https://doi.org/10.1016/j.talanta.2014.03.029
Руан Ч., Сун Ж., Лу Ш., Ли Л., Лоу Ж., Сун В. Электрохимическое поведение и определение аденозин-5-дифосфата на углеродном электроде, модифицированном ионной жидкостью // Электрохимия. 2014 .Т. 5. С. 144. (Ruan C., Sun Z., Lu S., Li L., Lou J., Sun W. Electrochemistry of adenosine 5' diphosphate on ionic liquid modified carbon electrode and its detection // Russ. J. Electrochem. 2014. V. 50. № 2. P. 129. ).https://doi.org/10.1134/S1023193513020158
Sun W., Dong L., Lu Y., Deng Y., Yu J., Sun X., Zhu Q. Electrochemical detection of rutin on nitrogen-doped graphene modified carbon ionic liquid electrode // Sens. Actuators B. 2014. V. 199. P. 36. https://doi.org/10.1016/j.snb.2014.03.080
Шведене Н.В., Чернышёв Д.В., Плетнев И.В. Ионные жидкости в электрохимических сенсорах // Рос. хим. журн. 2008. Т. 52. № 2. С. 80. (Shvedene N.V., Chernyshov D.V., Pletnev I.V. Ionic liquids in electrochemical sensors // Russ. J. Gen. Chem. 2008. V. 78. № 12. P. 2507. ).https://doi.org/10.1134/S1070363208120311
Klibanov A.M. Why are enzymes less active in organic solvents than in water? // Trends Biotechnol. 1997. V. 15. № 3. P. 97. https://doi.org/10.1016/S0167-7799(97)01013-5
Klibanov A.M. Improving enzymes by using them in organic solvents // Nature. 2001. V. 409. P. 241. https://doi.org/10.1038/35051719
Zaks A., Klibanov A.M. Enzyme-catalyzed processes in organic solvents // PNAS. 1985. V. 82. № 10. P. 3192. https://doi.org/10.1073/pnas.82.10.3192
Pribil M.M., Laptev G.U., Karyakina E.E., Karyakin A.A. Noninvasive hypoxia monitor based on gene-free engineering of lactate oxidase for analysis of undiluted sweat // Anal. Chem. 2014. V. 86. № 11. P. 5215. https://doi.org/10.1021/ac501547u
Karyakin A.A., Kotel’nikova E.A., Lukachova L.V., Karyakina E.E., Wang J. Optimal environment for glucose oxidase in perfluorosulfonated ionomer membranes: Improvement of first-generation biosensors // Anal. Chem. 2002. V. 74. № 7. P. 1597. https://doi.org/10.1021/ac0155409
Ellman G.L., Courtney K.D., Andres V. A new and rapid colorimetric determination of acetylcholinesterase activity // Biochem. Pharmacol. 1961. V. 7. P. 88. https://doi.org/10.1016/0006-2952(61)90145-9
Pohanka M., Drtinova L., Kuca K. Acetylcholinesterase based assay of eleven organophosphorus pesticides: Finding of assay limitations // Int. J. Environ. Anal. Chem. 2012. V. 92. № 1. P. 125. https://doi.org/0.1080/03067310903199526
Pohanka M., Adam V., Kizek R. An acetylcholinesterase-based chronoamperometric biosensor for fast and reliable assay of nerve agents // Sensors. 2013. V. 13. P. 11498. https://doi.org/10.3390/s130911498
Gogol E.V., Evtugyn G.A., Marty J.-L., Budnikov H.C., Winter V.G. Amperometric biosensors based on nafion coated screen-printed electrodes for the determination of cholinesterase inhibitors // Talanta. 2000. V. 53. № 2. P. 379. https://doi.org/10.1016/s0039-9140(00)00507-5
Shimada H., Kiyozumi Y., Koga Y., Ogata Y., Katsuda Y., Kitamura Y., Nishiyama M.K., Baba H., Ihara T. A novel cholinesterase assay for the evaluation of neurotoxin poisoning based on the electron-transfer promotion effect of thiocholine on an Au electrode // Sens. Actuators B. 2019. V. 298. Article 126893. https://doi.org/10.1016/j.snb.2019.126893
Valdés-Ramírez G., Fournier D., Ramírez-Silva M.T., Marty J.-L. Sensitive amperometric biosensor for dichlorovos quantification: application to detection of residues on apple skin // Talanta. 2008. V. 74. № 4. P. 741. https://doi.org/10.1016/j.talanta.2007.07.004
Warner J., Andreescu S. An acetylcholinesterase (AChE) biosensor with enhanced solvent resistance based on chitosan for the detection of pesticides // Talanta. 2016. V. 146. P. 279. https://doi.org/10.1016/j.talanta.2015.08.030
Campanella L., Favero G., Sammartino M.P., Tomassetti M. Enzymatic immobilisation in kappa-carrageenan gel suitable for organic phase enzyme electrode (OPEE) assembly // J. Mol. Catal. B. 1999. V. 7. № 1–4. P. 101. https://doi.org/10.1016/S1381-1177(99)00035-1
Campanella L., De Luca, S., Sammartino M.P., Tomassetti M. A new organic phase enzyme electrode for the analysis of organophosphorus pesticides and carbamates // Anal. Chim. Acta. 1999. V. 385. № 1–3. P. 59. https://doi.org/10.1016/S0003-2670(98)00806-X
Reddaiah K., Madhusudana Reddy T. Electrochemical biosensor based on silica sol–gel entrapment of horseradish peroxidase onto the carbon paste electrode toward the determination of 2-aminophenol in non-aqueous solvents: A voltammetric study // J. Mol. Liquids 2014. V. 196. P. 77. https://doi.org/10.1016/j.molliq.2014.03.023
Safarnavadeh V., Zare K., Fakhari A.R. Capability of parasulfonato calix[6]arene, as an anion dopant, and organic solvents in enhancing the sensitivity and loading of glucose oxidase (GOx) on polypyrrole film in a biosensor: A comparative study // Biosens. Bioelectron. 2013. V. 49. P. 159. https://doi.org/10.1016/j.bios.2013.04.043
Adányia N., Tóth-Markus M., Szabóa E.E., Váradi M., Sammartino M.P., Tomassetti M., Campanella L. Investigation of organic phase biosensor for measuring glucose in flow injection analysis system // Anal. Chim. Acta. 2004. V. 501. № 2. P. 219. https://doi.org/10.1016/j.aca.2003.09.034
Wu L., Lu X., Niu K., Dhanjai, Chen T. Tyrosinase nanocapsule based nano-biosensor for ultrasensitive and rapid detection of bisphenol A with excellent stability in different application scenarios // Biosens. Bioelectron. 2020. V. 165. Article 112407. https://doi.org/0.1016/j.bios.2020.112407
Kovaliov K., Zhang B., Konkolewicz D., Szcześniak K., Jurga S., Averick S. Polymer grafting from a metallo-centeredenzyme improves activity in non-nativeenvironments // Polymer Int. 2020. https://doi.org/10.1002/pi.6127
Sharma D., Lee J., Seo J., Shin H. Development of a sensitive electrochemical enzymatic reaction-based cholesterol biosensor using nano-sized carbon interdigitated electrodes decorated with gold nanoparticles // Sensors. 2017. V. 17. № 9. Article 2128. https://doi.org/10.3390/s17092128
Kapp A., Beissenhirtz M.K., Geyer F., Scheller F., Viezzoli M.S., Lisdat F. Electrochemical and sensorial behavior of SOD mutants immobilized on gold electrodes in aqueous/organic solvent mixtures // Electroanalysis 2006. V. 18. P. 1909. https://doi.org/10.1002/elan.200603620
Borah H., Dutta R.R., Gogoi S., Puzari P. Influence of methanol, ethanol and cypermethrin on the glutathione-S-tranferase catalyzed reaction of glutathione with 1-chloro-2,4-dinitrobenzene: A method for detection and quantification of cypermethrin // Electrochim. Acta. 2016. V. 205. P. 198. https://doi.org/10.1016/j.electacta.2016.03.199
Borah H., Gogoi S., Kalita S., Puzari P. A broad spectrum amperometric pesticide biosensor based on glutathione-S-transferase immobilized on graphene oxide-gelatin matrix // J. Electroanal. Chem. 2018. V. 828. P. 11. https://doi.org/10.1016/j.jelechem.2018.09.047
Svigelj R., Dossi N., Pizzolato S., Toniolo R., Miranda-Castro R., de-los-Santos-Álvarez N., Lobo-Castañón M.E. Truncated aptamers as selective receptors in a gluten sensor supporting direct measurement in a deep eutectic solvent // Biosens. Bioelectron. 2020. V. 165. P. 112339. https://doi.org/10.1016/j.bios.2020.112339
Svigelj R., Dossi N., Toniolo R., Miranda-Castro R., de-los-Santos-Álvarez N., Lobo-Castañón M.E. Selection of anti-gluten DNA aptamers in a deep eutectic solvent // Angew. Chem. 2018. V. 130. № 39. P. 13032. https://doi.org/10.1002/anie.201804860
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии