Журнал аналитической химии, 2021, T. 76, № 11, стр. 1022-1027
Хиральная неподвижная фаза на основе конгломератов гуанина, полученных в условиях созревания виедмы
Н. И. Сайранова a, Ю. Ю. Гайнуллина a, *
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: umashkova@mail.ru
Поступила в редакцию 24.03.2021
После доработки 06.04.2021
Принята к публикации 12.04.2021
Аннотация
Предложена новая хиральная неподвижная фаза на основе гуанина. В качестве основного объекта исследования выбрали инертный носитель Inerton NAW–HDMS, модифицированный 10% гуанина в условиях созревания Виедмы. Модифицированный адсорбент, полученный путем нанесения гуанина в режиме созревания Виедмы, способен к хиральному распознаванию. Анализ термодинамических функций адсорбции показал, что различия в мольных изменениях внутренней энергии и энтропии адсорбции энантиомеров галогеналканов обусловлены преимущественной адсорбцией одного из энантиомеров внутри полости супрамолекулярной структуры гуанина, а другого – на ее поверхности. Установлено, что предлагаемая неподвижная фаза способна проявлять энантиоселективность по отношению к галогеналканам. Методом газовой хроматографии разделены рацематы 2-бромгептана, 1,2-дихлорпропана, 1,2-дибромпропана и 2-хлорбутана. Наилучшее разделение достигнуто в случае рацемата 2-хлорпентана: фактор разделения α составил 2.43.
Многие лекарственные препараты, полученные синтетически, являются рацематами. Еще недавно считалось, что если один изомер физиологически активен, то второй энантиомер – неактивный и соответственно не будет оказывать влияния на организм. Однако зафиксированы случаи, когда один из энантиомеров может оказывать вредное воздействие [1].
При химическом синтезе возникает рацемическая смесь 50% левовращающего и 50% правовращающего изомеров. В живые системы включены оптические изомеры только одного типа. Хиральность – одна из уникальных особенностей всех живых существ. Существует несколько гипотез объяснения хиральности в природе, одной из которых является нарушение симметрии – созревание Виедмы [2, 3]. Созревание Виедмы – это процесс образования энантиоморфных кристаллов из растворов ахирального вещества. Ранее Кондепуди [4–7] при изучении хлората натрия обнаружил, что без перемешивания количество образовавшихся лево- и правовращающих энантиомеров равно, однако при перемешивании раствора образуется только один тип энантиоморфных кристаллов. Избыток одной энантиоморфной формы возникает за счет вторичной нуклеации. Кристалл, который получается первоначально, разбивается стеклянными шариками на более мелкие. В результате количество кристалликов одной из энантиоморфныx форм становится больше, чем другой. Ранее установлено [8–16], что хиральные кристаллы, полученные из определенных видов оптически неактивных органических молекул, при облучении ультрафиолетовым излучением дают оптически активные соединения. Кроме образования энантиоморфных кристаллов из растворов ахирального вещества, в настоящее время для получения хиральных кристаллов применяют автокатализ и воздействие ультразвука [17–21].
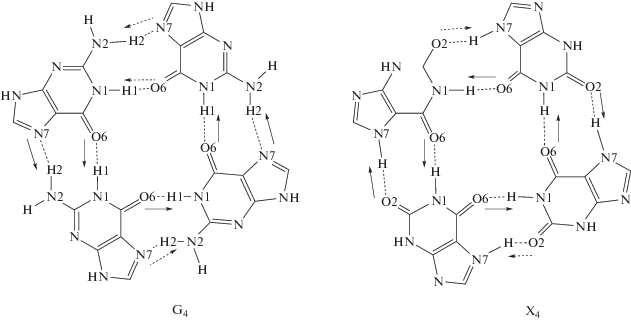
Созревание Виедмы применимо и к органическим молекулам [22]. Ранее установлено [23], что хиральные органические трехмерные кристаллы образуются из ахиральных молекул посредством самосборки. При этом 2D супрамолекулярные структуры характеризуются аналогичным механизмом самосборки. К таким молекулам относится гуанин (схема 1 ) [24–26].
Схема 1 . Супрамолекулярная структура гуанина.
Созревание Виедмы можно применять для получения хиральных 2D поверхностей, которые в дальнейшем можно использовать в качестве новых хиральных неподвижных фаз (адсорбентов) для газовой и жидкостной хроматографии. Модифицированные циклодекстрины [27–30] уже известны как хиральные адсорбенты, однако они отвечают не всем требованиям энантиоселективности. В последнее время успешно развивается направление по применению неподвижных фаз на основе наноматериалов [31, 32], которые, однако, в отличие от циклодекстринов, показали невысокую энантиоселективность. Достаточно хорошо изучены хиральные 2D поверхности цитозина [33–35], полученные по автокаталитическому механизму. Однако информации по получению хиральных 2D поверхностей в условиях созревания Виедмы недостаточно.
Данная работа посвящена получению хиральных кристаллов гуанина в условиях созревания Виедмы. Показана способность полученной неподвижной фазы к хиральному распознаванию галогеналканов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве модификатора неподвижной фазы выбрали гуанин (51030, Sigma–Aldrich, USA, EC number: 200-799-8), очищенный дополнительной перекристаллизацией. Для разделения энантиомеров и исследования термодинамических характеристик адсорбции алканов на поверхности гуанина в качестве адсорбента–носителя применяли инертный носитель Inerton NAW–HDMS (Chemapol, Чехия).
Кристаллы гуанина готовили по методике [36]. Использовали деионизированную воду, полученную с помощью деионизатора ДВ-10UV (ЦветХром, Россия). Модифицирование сорбента гуанином осуществляли по скорректированной методике созревания Виедмы [2].
1. Первичная нуклеация. Гуанин, подготовленный по методике [36].
2. Вторичная нуклеация. В размешиваемый со скоростью 500 об/мин насыщенный при комнатной температуре водно-спиртовой раствор 0.4 г гуанина вносили отобранный микрошприцом микрокристалл гуанина рядом с мешалкой. Раствор оставляли при постоянном размешивании при комнатной температуре на двое суток.
3. Адсорбция хиральных конгломератов. В полученную суспензию добавляли Inerton NAW–HDMS в количестве 4 г. Далее суспензию выдерживали при перемешивании со скоростью 200 об/мин в течение 3 ч.
4. Рост хиральных доменов на поверхности. В суспензию со скоростью 0.3 мл/мин добавляли 0.4 г гуанина в водно-спиртовой смеси с постепенным охлаждением раствора до +7°С. По окончании внесения всей порции гуанина суспензию выдерживали в течение часа. Затем сорбент отделяли от жидкой фазы путем фильтрования.
Для разделения энантиомеров и получения данных о термодинамических характеристиках адсорбции рацематов галогеналканов на изучаемом образце применяли метод обращенной газовой хроматографии в режиме бесконечного разбавления. Использовали хроматограф Цвет 500М (Цвет, Дзержинск, Россия) с пламенно-ионизационным детектором. Длина колонки 1 м, внутренний диаметр 3 мм, расход газа-носителя азота 10 мл/мин. Температура испарителя и детектора 150°С. В качестве аналитов использовали рацематы 2-бромгептана, 1,2-дихлорпропана, 1,2-дибромпропана, 2-хлорбутана, 2-бутанола и 2-пентанола (CAS № 1974-04-5, 78-87-5, 78-75-1, 78-86-4, 78-92-2 и 6032-29-7 соответственно, Sigma–Aldrich, США, чистота >98%).
Фактор разделения энантиомеров рассчитывали по формуле:
где tR(2) – время удерживания второго пика, tR(1) – время удерживания первого пика.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
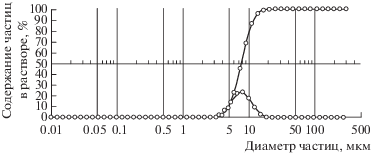
Перед газохроматографическим анализом определяли размер частиц гуанина, наносимых на поверхность инертного носителя. Для этого использовали лазерный анализатор Shimadzu SALT 7101. Полученные данные приведены на рис. 1. Обнаружено, что частицы гуанина имеют размеры от 1 до 40 мкм. Средний размер частиц составил 8 мкм.
Рис. 1.
Распределение частиц гаунина по размерам перед их нанесением на поверхность инертного носителя. Ось ординат – содержание частиц в растворе, %. Ось абсцисс – диаметр частиц, мкм.
На рис. 2–6 приведены хроматограммы разделения рацематов 2-бромгептана, 2-хлорпентана, 2-хлорбутана, 1,2-дихлорпропана, 1,2-дибромпропана соответственно. Как видно, наилучшее разделение наблюдается для рацемата 2-хлорпентана, фактор разделения α равен 2.43 при 60°С. Рацемат 2-хлорбутана характеризуется самым низким фактором разделения α = 1.81 при 70°С. Анализ параметров разделения показал, что с увеличением температуры времена удерживания закономерно уменьшаются. Заметно, что фактор разделения α для рацемата 2-хлорбутана имеет достаточно низкие значения по сравнению с другими аналитами (табл. 1). Как видно из табл. 1, факторы разделения 2-хлорбутана с увеличением температуры меняются незначительно по сравнению с другими рацематами. Обнаружено, что факторы разделения α практически для всех аналитов с увеличением температуры снижаются равномерно. Однако в случае 2-бромгептана происходит более резкое снижение фактора разделения. При 100°С факторы разделения α имеют самые низкие значения для всех изучаемых аналитов.
Рис. 2.
Газохроматографическое разделение рацемата 2-бромгептана на инертном носителе, модифицированном гуанином: Т = 60°С, α = 2.33, ω = 10 мл/мин.

Рис. 3.
Газохроматографическое разделение рацемата 1,2-дихлопропана на инертном носителе, модифицированном гуанином: Т = 70°С, α = 2.0, ω = 10 мл/мин.

Рис. 4.
Газохроматографическое разделение рацемата 1,2-дибромпропана на инертном носителе, модифицированном гуанином: Т = 70°С, α = 2.24, ω = 10 мл/мин.

Рис. 5.
Газохроматографическое разделение рацемата 2-хлорпентана на инертном носителе, модифицированном гуанином: Т = 60°С, α = 2.43, ω = 10 мл/мин.

Рис. 6.
Газохроматографическое разделение рацемата 2-хлорбутана на инертном носителе, модифицированном гуанином: Т = 70°С, α = 1.81, ω = 10 мл/мин.

Таблица 1.
Параметры газохроматографического разделения рацематов на изучаемой неподвижной фазе
| T, °С | tR(первый пик), с | tR(второй пик), с | α |
|---|---|---|---|
| 2-Хлорбутан | |||
| 70 | 227 | 412 | 1.81 |
| 80 | 215 | 374 | 1.73 |
| 90 | 207 | 321 | 1.55 |
| 1,2-Дихлорпропан | |||
| 70 | 221 | 422 | 1.90 |
| 80 | 216 | 409 | 1.89 |
| 90 | 209 | 345 | 1.65 |
| 1,2-Дибромпропан | |||
| 70 | 214 | 481 | 2.24 |
| 80 | 208 | 396 | 1.90 |
| 90 | 201 | 332 | 1.65 |
| 2-Бромгептан | |||
| 60 | 223 | 520 | 2.33 |
| 70 | 236 | 407 | 1.72 |
| 80 | 231 | 346 | 1.49 |
| 90 | 227 | 312 | 1.37 |
| 100 | 216 | 268 | 1.24 |
| 2-Хлорпентан | |||
| 60 | 228 | 556 | 2.43 |
| 70 | 223 | 480 | 2.15 |
| 80 | 204 | 374 | 1.83 |
При высоких температурах неподвижная фаза теряет способность разделять энантиомеры. Следует отметить, что такое явление наблюдалось и ранее [37, 38]. Для хиральных неподвижных фаз на основе меламина, урацила и циануровой кислоты максимальная рабочая температура, при которой колонка оставалась стабильной во времени, не превышала 80–90°С. В случае гуанина обнаружено, что в диапазоне 60–90°С факторы разделения α имеют достаточно высокие значения и только при 100°С – значительно более низкие, а при более высоких температурах ни один из галогеналканов не удалось разделить на энантиомеры. Таким образом, хиральная неподвижная фаза на основе гуанина достаточно термостабильна для того, чтобы оценить ее энантиоселективность по отношению к галогеналканам (температура кипения 100°С и выше).
Попытка разделения рацематов спиртов на данном адсорбенте оказалась неудачной: ни один из рацематов не делится на энантиомеры. Ранее установлено [37], что предложенные неподвижные фазы имеют высокую энантиоселективность по отношению к соединениям, содержащим гидроксильную группу при асимметрическом атоме углерода. В случае гуанина и аденина показано [39], что такие фазы проявляют энантиоселективность только по отношению к молекулам галогеналканов. Вероятно, это связано с тем, что данные вещества имеют одинаковый механизм образования супрамолекулярных структур, а именно ДНК-квадруплексов. Такие структуры проявляют другие свойства по сравнению с веществами, способными к образованию 2D упорядоченных структур. Возможно, отсутствие проявления энантиоселективности по отношению к спиртам связано со свойствами полости, образующейся в результате самосборки гуанина. В связи с тем, что молекула гуанина имеет полярные центры (одна кетогруппа и пять атомов азота), образующаяся полость обладает более низкой способностью к дисперсионным взаимодействиям, и образование большого числа водородных связей между спиртами и супраструктурой гуанина не обеспечивает полной адсорбции спиртов внутри полости. Поэтому адсорбция спиртов происходит на поверхности супраструктуры, в результате чего разделения не происходит. В случае галогеналканов разделение можно объяснить тем, что один из энантиомеров адсорбируется в полости, а другой – на ее поверхности. Для подтверждения данного факта рассчитали мольные изменения внутренней энергии и энтропии адсорбции энантиомеров для двух пиков. Как видно из табл. 2, значения –ΔF, кДж/моль и –ΔS, Дж/(моль К) галогеналканов на неподвижной фазе на основе гуанина для всех аналитов для двух пиков отличаются почти в 2–3 раза. Такие различия в мольных изменениях внутренней энергии и энтропии адсорбции энантиомеров галогеналканов обусловлены преимущественной адсорбцией одного из энантиомеров внутри полости супрамолекулярной структуры гуанина, а другого – на ее поверхности. Полученные хроматограммы представлены на рис. 2–6.
Таблица 2.
Значения –ΔF и –ΔS галогеналканов на неподвижной фазе на основе гуанина
| Аналит | –ΔF, кДж/моль | –ΔS, Дж/ (моль К) | ||
|---|---|---|---|---|
| 1 пик | 2 пик | 1 пик | 2 пик | |
| 1,2-Дихлорпропан | 4.01 | 15.14 | 16.33 | 31.26 |
| 1,2-Дибромпропан | 4.28 | 17.71 | 11.37 | 43.07 |
| 2-Бромгептан | 6.29 | 22.71 | 13.77 | 45.50 |
| 2-Хлорпентан | 5.29 | 17.13 | 12.49 | 42.49 |
| 2-Хлорбутан | 4.67 | 15.56 | 10.12 | 33.70 |
| R | 0.9789 | 0.9876 | 0.9845 | 0.9756 |
* * *
Таким образом, новая хиральная неподвижная фаза на основе гуанина показала высокую способность к разделению энантиомеров галогеналканов. Даже на метровой насадочной колонке достигнуто достаточно хорошее разделение. Высокие факторы разделения дают надежду на применение предложенной фазы для препаративного разделения энантиомеров, а высокая стабильность фазы (гуанин плавится при температуре 360°С) и легкость нанесения позволят решить многие задачи разделения энантиомеров.
Работа выполнена за счет гранта Российского научного фонда (проект № 19-73-10079).
Список литературы
Blaschke G., Kraft H.P., Markgraf H. Optical resolution of thalidomide and other glutarimide derivatives // Chem. Ber. 1980. V. 113. № 6. P. 2318.
Viedma C. Chiral symmetry breaking during crystallization: Complete chiral purity induced by nonlinear autocatalysis and recycling // Phys. Rev. Lett. 2005. V. 94. № 6. P. 065504.
Viedma C., McBride J.M., Kahr B., Cintas P. Enantiomer-specific oriented attachment: formation of macroscopic homochiral crystal aggregates from a racemic system // Angew. Chem. Int. Ed. 2013. V. 52. № 40. P. 10545.
Kondepudi D.K., Digits J., Bullock K. Studies in chiral symmetry breaking crystallization I: The effects of stirring and evaporation rates // Chirality. 1995. V. 7. № 2. P. 62.
Kondepudi D.K., Asakura K. Chiral autocatalysis, spontaneous symmetry breaking, and stochastic behavior // Acc. Chem. Res. 2001. V. 34. № 12. P. 946.
Kondepudi D.K. Spontaneous generation and propagation of chiral asymmetry // Int. J. Quantum Chem. 2004. V. 98. № 2. P. 222.
Kondepudi D.K., Nelson G.W. Chiral symmetry breaking in nonequilibrium chemical systems: Time scales for chiral selection // Phys. Lett. A. 1984. V. 106. № 4. P. 203.
Ramamurthy V. Organic Photochemistry in Organized Media // Tetrahedron. 1986. V. 42. № 21. P. 5753.
Scheffer J.R., Garcia-Garibay M.A., Nalamasu O. The influence of the molecular crystalline environment on organic photorearrangements // Org. Photochem., 1987. V. 8. P. 249.
Ramamurthy V., Venkatesan K. Photochemical reactions of organic crystals // Chem. Rev. 1987. V. 87. № 2. P. 433.
Sakamoto M. Absolute asymmetric synthesis from achiral molecules in the chiral crystalline environment // Chem. Eur. 1997. V. 3. № 5. P. 684.
Feringa B.L., Van Delden R.A. Absolute asymmetric synthesis: The origin, control, and amplification of chirality // Angew. Chem. Int. Ed. Engl. 1999. V. 38. № 23. P. 3418.
Toda F. Organic Solid-State Reactions. Dordrecht: Kluwer Academic Publishers, 2002. P. 189.
Inoue Y., Ramamurthy V. Chiral Photochemistry. N.Y.: Marcel Dekker, 2004. P. 485.
Hazen R.M., Filley T.R., Goodfriend G.A. Selective adsorption of L- and D-amino acids on calcite: Implications for biochemical homochirality // Proc. Natl. Acad. Sci. 2001. V. 98. № 10. P. 5487.
Hazen R.M., Sholl D.S. Chiral selection on inorganic crystalline surfaces // Nat. Mater. 2003. V. 2. № 6. P. 367.
Hem S.L. The effect of ultrasonic vibrations on crystallization processes // Ultrasonics. 1967. V. 5. № 4. P. 202.
Dennehy R.D. Particle engineering using power ultrasound // Org. Process Res. Dev. 2003. V. 7. № 6. P. 1002.
Ruecroft G., Hipkiss D., Cains P.W., Ly T., Maxted N. Sonocrystallization: The use of ultrasound for improved industrial crystallization // Org. Process Res. Dev. 2005. V. 9. № 6. P. 923.
Castro L. de M.D., Priego-Capote F. Ultrasound-assisted crystallization (sonocrystallization) // Ultrason. Sonochem. 2007. V. 14. № 6. P. 717.
Avalos M., Babiano R., Cintas P., Jimenez J.L., Palacios L.C., Barron L.D. Absolute asymmetric synthesis under physical fields: facts and fictions // Chem. Rev. 1998. V. 98. № 7. P. 2391.
Kawasaki T., Suzuki K., Hakoda Y., Soai K. Generation of absolute controlled crystal chirality by the removal of crystal water from achiral crystal of nucleobase cytosine // Angew. Chem. Int. Ed. 2008. 47. № 6. P. 496.
Koshima H. Generation of chirality in two-component molecular crystals from achiral molecules // J. Mol. Struct. 2000. V. 552. № 1. P. 111.
Steiner T. The hydrogen bond in the solid state // Angew. Chem. Int. Ed. 2002. V. 41. № 1. P. 48.
Ciesielski A., Lena S., Masiero S., Spada G.P., Samor P. Dynamers at the solid-liquid interface: Controlling the reversible assembly/reassembly process between two highly ordered supramolecular guanine motifs // Angew. Chem. Int. Ed. 2010. V. 49. № 11. P. 1963.
Sun H., Xiang J., Zhou Q., Yang Q., Xu G., Tang Y. Temperature-sensitive supramolecules self-assembled by G-quadruplex DNA // Int. J. Biol. Macromol. 2010. V. 46. № 1. P. 123.
Xiao Y., Ng S.-C., Tan T.T.Y., Wang Y. Recent development of cyclodextrin chiral stationary phases and their applications in chromatography // J. Chromatogr. A. 2012. V. 1269. P. 52.
Zhang X., Zhang C., Sun G., Xu X., Tan Y., Wu H., Cao R., Liu J., Wu J. Cyclodextrins and their derivatives in the resolution of chiral natural products: A review // Instrum. Sci. Technol. 2012. V. 40. P. 194.
Zhou J., Tang J., Tang W. Engineering cyclodextrin clicked chiral stationary phase for high-efficiency enantiomer separation // Trends Anal. Chem. 2015. V. 65. P. 22.
Tang W., Ng S.-C., Sun D. Modified Cyclodextrins for Chiral Separation. Berlin: Springer-Verlag, 2013.
Peluso P., Mamane V., Cossu S. Homochiral metal–organic frameworks and their application in chromatography enantioseparations // J. Chromatogr. A. 2014. V. 1363. P. 11.
Li G., Yu W., Ni J., Liu T., Liu Y., Sheng E., Cui Y. Self-assembly of a homochiral nanoscale metallacycle from a metallosalen complex for enantioselective separation // Angew. Chem. Int. Ed. Engl. 2008. V. 47. № 7. P. 1245.
Soai K., Kawasaki T. Discovery of asymmetric autocatalysis with amplification of chirality and its implication in chiral homogeneity of biomolecules // Chirality. 2006. V. 18. № 7. P. 469.
Bolm C., Bienewald F., Seger A. Asymmetrische autocatalyse mit chiralitäts verstärkung // Angew. Chem. 1996. V. 108. № 15. P. 1767.
Xiouras C., Fytopoulos A., Jordens J., Boudouvis A., Van Gerven T., Stefanidis G.D. Applications of ultrasound to chiral crystallization, resolution and deracemization // Ultrason. Sonochem. 2018. V. 43. P. 184.
Gur D., Pierantoni M., Dov N.E., Feldman Y., Weiner S., Addadi L. Guanine crystallization in aqueous solutions enables control over crystal size and polymorphism // Cryst. Growth Des. 2016. V. 16. № 9. P. 4975.
Гуськов В.Ю., Гайнуллина Ю.Ю., Утеева Ж.Д., Мусабиров Д.Э. Применение хиральной неподвижной фазы на основе 3,4,9,10-перилентетракарбоновой кислоты для разделения энантиомеров в условиях газовой и жидкостной хроматографии // Журн. аналит. химии. 2020. Т. 75. № 6. С. 537. (Gus’kov V.Yu., Gainullina Yu.Yu., Uteeva J.D., Musabirov D.E. The use of a chiral stationary phase based on 3,4,9,10-perylene tetracarboxylic acid dianhydride for the separation of enantiomers in gas and liquid chromatography // J. Anal. Chem. 2020. V. 75. № 6. P. 537.)
Нафикова А.Р., Аллаярова Д.А., Гуськов В.Ю. Разделение энантиомеров 2-бромбутана, 2-хлорбутана, 2-хлорпентана, а также бутанола-2 на неподвижной фазе на основе супрамолекулярной структуры урацила // Журн. аналит. химии. 2019. Т. 74. № 6. С. 415. (Nafikova A.R., Allayarova D.A., Gus’kov V.Yu. Separation of 2-bromobutane, 2-chlorobutane, 2-chloropentane and 2-butanol enantiomers using a stationary phase based on a supramolecular uracil structure // J. Anal. Chem. 2019. V. 74. № 6. P. 565.)
Гуськов В.Ю., Гуськова М.В., Зарипова А.И., Рамазанова Г.А. Адсорбционные и хроматографические характеристики графитированной термической сажи, модифицированной аденином, по отношению к ряду органических соединений // Журн. физ. химии. 2020. Т. 94. № 6. С. 903. (Gus’kov V.Yu., Gus’kova M.V., Zaripova A.I., Ramazanova G.A. Adsorption and chromatographic characteristics of graphitized thermal soot modified with adenine under the conditions of maturation of Viedma // J. Phys. Chem. 2020. V. 94. P. 1208.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии