Журнал аналитической химии, 2021, T. 76, № 11, стр. 1038-1048
Сенсор для распознавания и определения энантиомеров триптофана на основе модифицированного энантиоморфными кристаллами бромтрифенилметана угольно-пастового электрода
Ю. А. Яркаева a, *, Е. Н. Исламуратова a, Л. Р. Загитова a, В. Ю. Гуськов a, Р. А. Зильберг a, В. Н. Майстренко a
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
* E-mail: julijajarkaeva05@gmail.com
Поступила в редакцию 30.03.2021
После доработки 14.04.2021
Принята к публикации 14.04.2021
Аннотация
Разработан энантиоселективный вольтамперометрический сенсор на основе угольно-пастового электрода, модифицированного энантиоморфными кристаллами бромтрифенилметана, для распознавания и определения энантиомеров триптофана. Энантиоморфные кристаллы бромтрифенилметана получены по механизму созревания Виедмы. Изучены электрохимические и аналитические характеристики сенсора. Предложенный сенсор использован для распознавания и определения L- и D-энантиомеров триптофана в модельных растворах фармацевтических препаратов, моче и плазме крови человека. Предложенный сенсор прост в изготовлении, проявляет высокую воспроизводимость и стабильность. Показано, что с использованием хемометрической обработки данных наличие даже небольших различий между вольтамперограммами энантиомеров на предложенном угольно-пастовом электроде достаточно для их достоверного распознавания.
Известно, что энантиомеры обладают одинаковыми физическими и химическими свойствами (температурой кипения, температурой плавления, растворимостью, электропроводностью и т.д.), но в зависимости от ориентации заместителей вокруг асимметричного атома углерода по-разному реагируют с хиральными соединениями, чем объясняется их различное физиологическое действие. Например, ферменты часто проявляют реакционную способность только по отношению к одному из энантиомеров [1]. Это характерно и для оптически активных лекарственных соединений, которые существуют в виде двух или нескольких пространственных изомеров. Их фармакологическая активность обычно связана с действием лишь одного стереоизомера [2], что свидетельствует о важности хирального анализа и привело к созданию большого количества методов распознавания и определения энантиомеров лекарственных соединений и биологически активных веществ. Однако, такие методы как круговой дихроизм [3], капиллярный электрофорез, высокоэффективная жидкостная хроматография [4] и др. порой малочувствительны, требуют дорогостоящего оборудования [5], храктеризуются невысокой производительностью для рутинного анализа. Альтернативой данным методам являются электрохимические сенсоры, которые получают все более широкое распространение для распознавания хиральных молекул из-за высокой селективности и чувствительности, низкой себестоимости и возможности экспрессного обнаружения [6]. Широкое применение среди них получили энантиоселективные вольтамперометрические сенсоры (ЭВС) [7]. Энантиоселективность ЭВС достигается за счет хирального селектора, иммобилизованного на поверхности или в объеме электрода, на котором происходит регистрация определяемого энантиомера [8]. В течение последнего десятилетия предложены различные подходы и хиральные материалы на основе соединений природного или синтетического происхождения, обладающие молекулярной хиральностью в виде, как правило, соединений с асимметрическим атомом углерода (так называемые “хиральные 1D материалы”) [9], к которым относятся полисахариды и их производные, аминокислоты и др. Кроме них повышенный интерес вызывают новые материалы: хиральные 2D материалы, имеющие планарную структуру [10, 11], к которым относятся парациклофаны, пиллар[n]арены и металлоцены, 2D графен, 2D материалы на основе хиральных супрамолекулярных сборок [12–14] и др., и хиральные 3D материалы с объемной пористой структурой [10] – хиральные металлоорганические каркасные структуры, хиральные цеолиты, нанокластеры с пористой структурой [15–17] и др. К таким материалам можно также отнести различные кристаллические соединения, обладающие энантиоморфностью. Например, аморфный диоксид кремния является оптически неактивным веществом, однако, когда он кристаллизуется в кварц, то образует оптически активные энантиоморфные (хиральные) кристаллы, а именно: право- и левовращающие кристаллы кварца. Этот процесс называется хиральной кристаллизацией. Хиральная кристаллизация характерна не только для диоксида кремния, но и для других кристаллических соединений, включая неорганические (NaClO3, MgSO4·7H2O, KLiSO4) [9], органические (замещенные производные бензола, полициклические ароматические соединения, гетероциклические соединения, хиноны и др.) и металлоорганические [10, 11]. Лучший способ установления хиральности кристаллов – выяснение с помощью рентгеноструктурного анализа пространственного расположения в них функциональных групп. Из 230 теоретически возможных расположений пространственных групп в кристаллах 65 являются хиральными, такие как P21, P212121, P3 и т.д. [18]. Как правило, в обычных условиях осаждения кристаллов из ахиральных соединений сложно получить смесь, в которой преобладают энантиоморфные кристаллы (+ или –). Для этого чаще всего используют внешнее воздействие, например, механическое перемешивание, изменение температуры, добавление хиральной затравки и т.д. Хиральность может быть индуцирована с помощью эффекта Кондепуди, заключающегося в получении хиральных кристаллов из ахиральных соединений при интенсивном перемешивании упариваемого раствора [19–22]. Группа испанских химиков под руководством Виедма [23] показала, что при нагревании раствора аспарагиновой кислоты с добавлением салицилового альдегида и уксусной кислоты при 100–130°С образуются кристаллы одного оптического изомера. Получение энантиоморфных кристаллов, образованных по механизму созревания Виедмы, многократно подтверждено различными научными группами [24, 25]. Несмотря на всплеск интереса к энантиоморфным кристаллам в практике хирального вольтамперометрического анализа сенсоры на их основе не использовались. Подтверждением возможности использования энантиоморфных кристаллов, образованных по механизму созревания Виедмы, для энантиоселективного определения являются работы в области хроматографии [26, 27]. Ранее авторами представленной статьи были разработаны сенсоры и сенсорные системы на основе хиральных супрамолекулярных структур урацила [13], меламина и циануровой кислоты [12, 14], а также нанокластеров 3,4,9,10-перилентетракарбоновой кислоты [15, 16], образующихся по аналогичному механизму, для определения и распознавания энантиомеров антиаритмических препаратов и жизненно важных аминокислот.
В настоящей работе в качестве хирального селектора при создании ЭВС был выбран бромтрифенилметан (БТФМ), энантиоморфные кристаллы которого получены по механизму созревания Виедмы. На рис. 1 представлена кристаллическая структура БТФМ, изображение которой опубликовано на сайте Кембриджской структурной базы данных [28, 29], позволяющей получить доступ к трехмерным структурам молекул, определенным экспериментально с использованием дифракционных методов. Молекулы БТФМ в кристалле связаны парами, при этом реализуется взаимодействие “голова к голове” Ph3C–Br⋅⋅⋅Br–CPh3, характеризующееся длинными связями C–Br и короткими контактами Br⋅⋅⋅Br [30]. Энантиоморфные кристаллы БТФМ имеют пространственную группу симметрии P3, которая является хиральной [18]. Строение подобных структур изучено также на примере энантиоморфных кристаллов иод- и хлортрифенилметана [31, 32].
В качестве аналита для апробации разработанного сенсора использовали ранее хорошо изученную аминокислоту триптофан (Трп), являющуюся незаменимой аминокислотой, энантиомеры которой выполняют различные физиологические и метаболические функции в организме человека. При этом L-Трп является биологически активным соединением, дефицит которого может вызвать различные хронические заболевания, а D-энантиомер участвует в синтезе пептидных антибиотиков и иммуносупрессантов [33, 34]. Основные подходы к созданию ЭВС для определения энантиомеров триптофана, в том числе с применением циклодекстринов и неометилиндена, рассмотрены в работах [35, 36].
С использованием методов электрохимической импедансной спектроскопии (ЭИС), циклической и квадратно-волновой вольтамперометрии изучены электрохимические и аналитические характеристики угольно-пастового электрода (УПЭ), модифицированного энантиоморфными кристаллами БТФМ, проведено определение энантиомеров Трп в модельных растворах, в моче и плазме крови человека, в фармацевтических препаратах. Показано, что с использованием хемометрического подхода, в частности методов главных компонент (МГК) и проекции на латентные структуры с дискриминантным анализом (ПЛС-ДА), можно с высокой вероятностью распознавать энантиомеры Трп независимо от их концентрации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. Для электрохимических измерений применяли потенциостат-гальваностат Autolab PGSTAT 204 (MetrohmAutolab Ins., Нидерладны) с модулем импеданса FRA 32M (Metrohm Autolab Ins., Нидерладны) c программным обеспечением NOVA. Измерения проводили в стандартной трехэлектродной ячейке объемом 20 мл, состоящей из модифицированного угольно-пастового электрода диаметром 2 мм, вспомогательного электрода, выполненного в виде платиновой пластинки, и хлоридсеребряного электрода сравнения. Значения pH растворов измеряли с помощью pH-метра Seven Compact pH/Ion S220 (Mettler-Toledo AG, Швейцария). Для перемешивания графитовой пасты при модифицировании кристаллами бромтрифенилметана использовали магнитную мешалку MR Hei-Tec (Heidolph, Германия). При пробоподготовке образцов мочи и плазмы крови человека использовали центрифугу CM-6MT (ELMI, Латвия).
Исследуемые вещества D- и L-триптофан (ч. д. а.) приобретали у Sigma-Aldrich (США). Фоновым электролитом служил 0.1 M фосфатный буферный раствор, содержащий Na2HPO4 и KH2PO4 (pH 6.9). Стандартные растворы D- и L-Трп получали растворением точных навесок реагентов в 25 мл 0.1 M фосфатного буферного раствора. Растворы более низких концентраций получали разбавлением исходных растворов Трп. Раствор [Fe(CN)6]3–/4– (5 мМ) готовили на фоне 0.1 М KCl и использовали в качестве стандартного при электрохимических измерениях.
Образцы мочи получали с письменного согласия донора, плазму крови приобретали на Уфимской Республиканской станции переливания крови. Образцы мочи и плазмы крови объемом 2.5 мл центрифугировали в течение 10 мин и разбавляли в 10 раз фосфатным буферным раствором с рН 6.9. В полученные растворы добавляли известные количества D- и L-Трп для получения растворов с концентрациями 0.08 и 0.04 мМ. Растворы фармацевтических препаратов, содержащие L-триптофан, готовили растворением точной навески образца в мерных колбах емк. 100 мл в фосфатном буферном растворе (pH 6.9) и разбавляли далее до необходимой концентрации. Для приготовления растворов использовали деионизованную воду с удельной проводимостью 0.1 мкСм/см.
Модифицирование графита и изготовление угольно-пастового электрода. Для модифицирования графита 1 г бромтрифенилметана растворяли в 85.5 мл толуола при комнатной температуре и вносили порошок графита массой 10 г, затем отгоняли толуол при температуре 120°С и постоянном перемешивании с помощью магнитной мешалки. Модифицированный бромтрифенилметаном порошок графита высушивали в сушильном шкафу и смешивали со скваланом: к 0.1 г модифицированного БТФМ графита добавляли 1 каплю сквалана (0.022 г). Полученной графитовой пастой заполняли стеклянный цилиндр корпуса УПЭ диаметром 2 мм. В качестве токосъемника использовали медную проволоку диаметром 2 мм, поверхность которой перед каждым измерением очищали. После заполнения УПЭ пастой рабочую поверхность электрода выравнивали на гладкой кальке.
Методика эксперимента. Квадратно-волновые вольтамперограммы регистрировали в диапазоне потенциалов от 0 до 1.2 В со скоростью развертки 20 мВ/с. Спектры электрохимического импеданса регистрировали в диапазоне частот от 500 кГц до 0.1 Гц с амплитудой 10 мВ. Циклические вольтамперограммы регистрировали в диапазоне потенциалов от 0 до 1.3 В со скоростью развертки потенциала 0.1 В/с. Массив данных для каждого образца состоял из 10 параллельных измерений. Для хемометрической обработки данных использовали программное обеспечение The Unscrambler (САМО, Норвегия). Все измерения проводили при температуре (25 ± 0.1)°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе разработки ЭВС на основе УПЭ, модифицированного энантиоморфными кристаллами БТФМ, выбрали оптимальное массовое соотношение графит/квалан, влияющее на высоту пика окисления энантиомеров Трп и относительное стандартное отклонение аналитического сигнала. Для этого приготовили графитовые пасты трех составов, содержащие 1, 2 и 3 капли сквалана с массовыми соотношениями графит/сквалан 1 : 0.22, 1 : 0.44 и 1 : 0.66 соответственно. Полученные результаты свидетельствуют, что при увеличении содержания сквалана ток пика окисления Трп на немодифицированном УПЭ уменьшается от 12.7 ± 0.1 до 5.4 ± 0.3 мкА, а относительное стандартное отклонение увеличивается от 2.4 до 8.0%. В дальнейшей работе использовали графитовую пасту с массовым соотношением графит/сквалан 1 : 0.22, которая к тому же имеет высокую вязкость и удобна для работы.
Электрохимические характеристики и значения активной площади поверхности немодифицированного УПЭ и УПЭ, модифицированного энантиоморфными кристаллами БТФМ (УПЭ/БТФМ), получали с использованием ЭИС и циклической вольтамперометрии для стандартного 5 мМ раствора [Fe(CN)6]3–/4–. Из рис. 2а видно, что циклические вольтамперограммы в таком растворе соответствуют классическому одноэлектронному процессу, характерному для ферроцианид-ионов. При этом модифицирование графита энантиоморфными кристаллами БТФМ приводит к незначительному увеличению тока пика, что обусловлено увеличением активной площади поверхности модифицированного УПЭ, рассчитанной по уравнению Рэндлса−Шевчика [37]. Это отражается также и на диаграммах Найквиста (рис. 2б), на которых сопротивление переноса электрона Ret для модифицированного УПЭ уменьшается. Параметры спектров электрохимического импеданса и активная площадь поверхности электродов представлены в табл. 1.
Рис. 2.
Циклические вольтамперограммы (а) и диаграммы Найквиста (б) для УПЭ и УПЭ/БТФМ в 5.0 мМ растворе редокс-пары [Fe(CN)6]3–/4– (1 : 1); 0.1 М раствор KCl, скорость развертки потенциала 0.1 В/с.

Таблица 1.
Параметры спектров электрохимического импеданса и активная площадь поверхности УПЭ и УПЭ/БТФМ (n = 5, P = 0.95)
| Электрод | Rs, Ом | Ret, кОм | N* | A, мм2 |
|---|---|---|---|---|
| УПЭ | 139.7 ± 4.1 | 21.0 ± 1.8 | 0.92 ± 0.01 | 0.015 ± 0.001 |
| УПЭ/БТФМ | 138.7 ± 2.3 | 15.5 ± 0.6 | 0.89 ± 0.01 | 0.017 ± 0.002 |
Известно, что на УПЭ Трп необратимо окисляется с переносом двух электронов [38, 39] в диапазоне потенциалов от 0.65 до 0.95 В с образованием на вольтамперограммах хорошо выраженного пика (рис. 3). При модифицировании графитовой пасты энантиоморфными кристаллами БТФМ вольтамперограммы энантиомеров Трп отличаются друг от друга как максимальными токами пиков (IpL/IpD = 1.14), так и потенциалами (ΔEp = 20 мВ). Наблюдаемые различия свидетельствуют о том, что свободные энергии взаимодействия L- и D-Трп с энантиоморфными кристаллами БТФМ отличаются друг от друга, что отражается на максимальных токах и потенциалах пиков их окисления. Стоит отметить, что использование предложенного угольно-пастового электрода позволило получить результаты с высокой воспроизводимостью, относительное стандартное отклонение (sr) не превышало 3%.
Рис. 3.
Квадратно-волновые вольтамперограммы 0.4 мМ растворов энантиомеров триптофана в фосфатном буферном растворе с pH 6.9 на УПЭ (а) и УПЭ, модифицированном энантиоморфными кристаллами бромтрифенилметана (б); скорость развертки потенциала 20 мВ/с.

Для установления природы наблюдаемых токов изучили зависимость lgip = lgV + const в диапазоне от 10 до 200 мВ/с, где V – скорость развертки потенциала электрода, и рассчитали критерий Семерано (lgip/lgV). Из рис. 4 видно, что для L-Трп критерий Семерано близок к 0.5, т.е. лимитирующей стадией электродного процесса является диффузия электроактивного вещества к поверхности электрода, тогда как для D-энантиомера электродный процесс в большей степени осложнен его адсорбцией на электроде. Это также свидетельствует о различиях в энергиях взаимодействия энантиомеров Трп с поверхностью модифицированного УПЭ.
Рис. 4.
Зависимости логарифма тока пика окисления D- (а) и L-триптофана (б) от логарифма скорости развертки потенциала на УПЭ, модифицированном энантиоморфными кристаллами бромтрифенилметана.

Кроме того, что Трп является важной для человека аминокислотой, выбор его в качестве аналита обусловлен более высокими и сильнее различающимися аналитическими сигналами энантиомеров по сравнению с другими электроактивными аминокислотами, например, тирозином (Тир), метионином (Мет) и цистеином, из которых для цистеина пики окисления не наблюдаются (рис. 5а). Можно предположить, что этот факт обусловлен бóльшим размером молекулы триптофана за счет присутствия в ней индольного кольца по сравнению с остальными аминокислотами, что приводит к бóльшим стерическим различиям при взаимодействии L- и D-Трп с энантиоморфными кристаллами БТФМ. Кроме высокой воспроизводимости результатов, предложенный сенсор характеризуется достаточной стабильностью, которую изучали в течение шести дней (рис. 5б).
Рис. 5.
(а) Электроаналитические характеристики определения энантиомеров аминокислот с использованием УПЭ/БТФМ; (б) значения коэффициента селективности УПЭ/БТФМ в течение 6 дней.

Рис. 6.
Квадратно-волновые вольтамперограммы растворов D- (а) и L-триптофана (б) разных концентраций (1 → 7: 0.01, 0.02, 0.06, 0.1, 0.2, 0.3, 0.4 мМ) на УПЭ, модифицированном энантиоморфными кристаллами бромтрифенилметана; pH 6.9, v = 20 мВ/с, n = 5, P = 0.95.

Токи пиков энантиомеров Трп линейно возрастают с увеличением их концентрации в диапазоне от 10 до 400 мкМ; чувствительность для D-Трп больше, чем для L-Трп, а соотношение токов IpD/IpL равно 1.14 и сохраняется во всем диапазоне изученных концентраций (рис. 6). Разность потенциалов ΔЕр равна 20 мВ. Пределы обнаружения и пределы количественного определения оценивали по 3σ- и 10σ-критерию соответственно. Для D‑Трп они имеют значения 1.16 и 3.85 мкМ, для L‑Трп – 2.09 и 6.98 мкМ соответственно.
Правильность определения энантиомеров Трп с использованием предложенного сенсора оценивали методом введено–найдено (табл. 2). Для этого использовали модельные растворы мочи, плазмы крови, а также растворы фармацевтических препаратов, содержащих L-Трп. Предложенный сенсор обладает высокой воспроизводимостью, относительное стандартное отклонение результатов определения энантиомеров Трп в чистых растворах не превышает 3%, в модельных растворах мочи оно не превышают 5%, а в модельных растворах плазмы крови человека – 7%. Более высокое значение sr в случае плазмы крови можно объяснить ее более сложным составом, присутствием в ней значительного количества других органических соединений. Для тестирования сенсора на модельных растворах фармацевтических препаратов использовали три препарата L-Трп различных производителей (препараты 1, 2 и 3), содержащие также вспомогательные компоненты (в основном пантотеновую кислоту и пиридоксин). В этом случае значение sr не превышало 6.2%. Правильность определения во всех случаях была не ниже 96%.
Таблица 2.
Результаты вольтамперометрического определения энантиомеров триптофана на УПЭ, модифицированном бромтрифенилметаном, в чистых растворах, в моче и плазме крови человека и в препаратах триптофана (pH 6.9, скорость развертки потенциала 20 мВ/с, n = 5, P = 0.95)
| Аналит | Введено, мкМ | Найдено, мкМ | sr, % | Правильность, % |
|---|---|---|---|---|
| Чистые растворы | ||||
| D-Трп | 80.0 | 80.1 ± 1.2 | 2.0 | 99.8 |
| 40.0 | 40.5 ± 0.6 | 2.0 | 98.8 | |
| L-Трп | 80.0 | 79.6 ± 1.7 | 2.9 | 99.6 |
| 40.0 | 40.2± 0.3 | 1.1 | 98.1 | |
| Моча | ||||
| D-Трп | 80.0 | 81.0 ± 2.8 | 4.7 | 98.7 |
| 40.0 | 39.1 ± 0.9 | 3.1 | 97.7 | |
| L-Трп | 80.0 | 80.5 ± 2.3 | 4.0 | 99.4 |
| 40.0 | 41.0 ± 0.9 | 2.9 | 97.6 | |
| Плазма крови | ||||
| D-Трп | 80.0 | 82.0 ± 3.6 | 6.0 | 97.6 |
| 40.0 | 41.6 ± 0.8 | 2.8 | 96.0 | |
| L-Трп | 80.0 | 80.7 ± 4.0 | 6.8 | 99.1 |
| 40.0 | 41.0 ± 1.1 | 3.6 | 97.6 | |
| Препарат 1 | ||||
| L-Трп | 40.0 | 40.3 ± 1.8 | 6.2 | 99.3 |
| 80.0 | 79.8 ± 2.4 | 4.1 | 99.7 | |
| Препарат 2 | ||||
| L-Трп | 40.0 | 39.7 ± 1.5 | 5.3 | 99.3 |
| 80.0 | 81.5 ± 2.6 | 4.4 | 98.1 | |
| Препарат 3 | ||||
| L-Трп | 40.0 | 40.5 ± 1.7 | 5.7 | 98.9 |
| 80.0 | 78.6 ± 3.1 | 5.4 | 98.3 | |
Хотя вольтамперограммы энантиомеров Трп на модифицированном УПЭ отличаются друг от друга и их воспроизводимость высокая, различия между максимальными токами пиков и потенциалами достаточно малы (рис. 3). В связи с этим целесообразно было применить хемометрическую обработку полученных данных, в частности методы МГК и ПЛС-ДА [40, 41]. Следует заметить, что с практической точки зрения задача распознавания энантиомеров Трп независимо от их концентрации является исключительно важной. Ее можно решить хемометрически, если на вольтамперограммах энантиомеров наблюдаются хотя бы небольшие различия потенциалов окисления и максимальных токов пиков при достаточно высокой воспроизводимости результатов измерений. В случае УПЭ/БТФМ оба эти условия выполняются. Для построения МГК-моделей составили матрицу данных, содержащую вольтамперограммы растворов D- и L-Трп различных концентраций: 0.4, 0.3, 0.2 и 0.1 мМ. Заметим, что МГК позволяет визуализировать экспериментальные данные путем преобразования каждой вольтамперограммы в точку и перенесения ее в новую систему координат, так называемых главных компонент (ГК). Расположение точек на плоскостях ГК свидетельствует о схожести и различии анализируемых образцов. Как правило, наиболее значимую информацию несут 3–5 первых ГК. Графики счетов МГК-моделирования, представленные на рис. 7, свидетельствуют о том, что на плоскости ГК1–ГК2 (рис. 7а) наблюдается распределение образцов по концентрации энантиомеров Трп, но не по хиральности аналитов. Это значит, что ГК2 и частично ГК1 характеризуют концентрацию энантиомеров Трп в образцах и соответственно высоту пиков их окисления.
Рис. 7.
Графики счетов МГК-моделирования квадратно-волновых вольтамперограмм энантиомеров триптофана различных концентраций, полученных на УПЭ/БТФМ и представленных в трех плоскостях ГК: ГК1–ГК2 (а), ГК1–ГК3 (б) и ГК2–ГК3 (в).
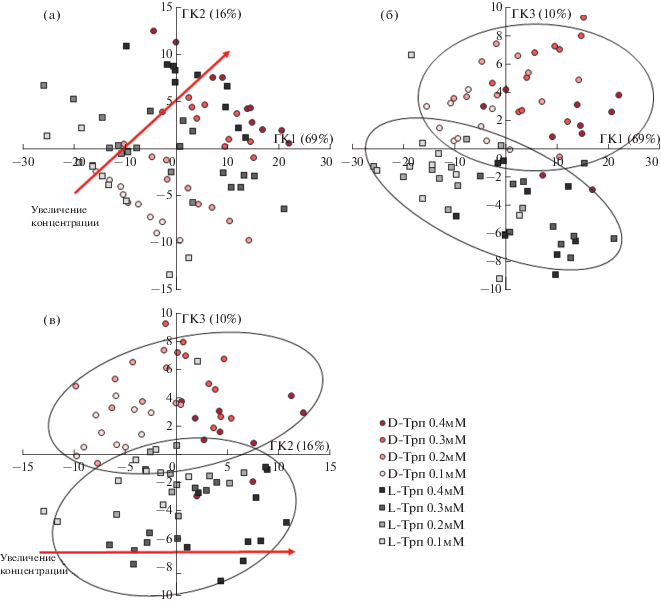
На плоскости ГК1–ГК3 (рис. 7б) наблюдается распределение образцов по хиральности аналитов. Образцы D- и L-Трп независимо от концентрации растворов образуют отдельные кластеры (облака), причем эти кластеры располагаются в верхней и нижней частях и разделены первой ГК. Это значит, что ГК3 определяет хиральность аналитов, что, скорее всего, происходит благодаря наличию различий между потенциалами пиков окисления энантиомеров Трп. И, наконец, на плоскости ГК2–ГК3 (рис. 7в) наблюдается распределение образцов как по хиральности (кластеры энантиомеров Трп разделены второй ГК), так и по концентрации растворов вдоль ГК2.
Следующим этапом хемометрической обработки данных было построение регрессионной модели и прогнозирование (распознавание) энантиомеров Трп. Так как в нашем случае имелись два определяемых вещества – L- и D-Трп, т.е. два класса анализируемых образцов, то целесообразно было использовать метод ПЛС-ДА. ПЛС-модель строили с использованием вольтамперограмм, соответствующих 0.4 мМ растворам D- и L-Трп путем присвоения каждому классу коэффициентов 0 и 1. Таким образом, 0.4 мМ растворы служили образцами сравнения (ОС), а остальные – 0.3, 0.2 и 0.1 мМ растворы – тестовыми образцами (ТО). Полученные результаты представлены в виде доли правильно распознанных образцов и приведены в табл. 3. Кроме растворов Трп с различной концентрацией, в качестве тестовых образцов приготовили также 0.4 мМ растворы фармацевтических препаратов, содержащих L-Трп и вспомогательные компоненты. Из табл. 3 видно, что при распознавании 0.4 и 0.3 мМ растворов энантиомеров Трп наблюдаются минимальные ошибки первого рода – от 6 до 10%. Далее при уменьшении концентрации ошибка распознавания увеличивается вплоть до 44% для 0.1 мМ растворов. При распознавании фармацевтических препаратов L-Трп все образцы распознаны как L-Трп с ошибкой менее 15%. С использованием УПЭ, модифицированного энантиоморфными кристаллами БТФМ, и хемометрического метода ПЛС-ДА, можно с высокой вероятностью распознать энантиомеры Трп как в модельных растворах, так и в реальных растворах с различной концентрацией энантиомеров Трп.
Таблица 3.
Результаты распознавания энантиомеров триптофана на угольно-пастовом электроде, модифицированном энантиоморфными кристаллами бромтрифенилметана, с использованием метода ПЛС-ДА
| Модельные растворы | ТО | ОС (0.4 мМ растворы) | |
|---|---|---|---|
| D-Трп | L-Трп | ||
| 0.4 мМ растворы | D-Трп | 0.92* | 0.08 |
| L-Трп | 0.08 | 0.92 | |
| 0.3 мМ растворы | D-Трп | 0.94 | 0.06 |
| L-Трп | 0.10 | 0.90 | |
| 0.2 мМ растворы | D-Трп | 0.93 | 0.07 |
| L-Трп | 0.28 | 0.72 | |
| 0.1 мМ растворы | D-Трп | 0.79 | 0.21 |
| L-Трп | 0.44 | 0.56 | |
| Препарат 1 | L-Трп | 0.13 | 0.87 |
| Препарат 2 | L-Трп | 0.11 | 0.89 |
| Препарат 3 | L-Трп | 0.15 | 0.85 |
* * *
Таким образом, для селективного распознавания и определения энантиомеров триптофана в модельных растворах фармацевтических препаратов, плазмы крови и мочи человека предложен хиральный вольтамперометрический сенсор на основе угольно-пастового электрода, модифицированного энантиоморфными кристаллами бромтрифенилметана, полученными по механизму созревания Виедмы. Предложенный сенсор прост в изготовлении, проявляет высокую воспроизводимость и стабилен во времени. Применение хемометрической обработки данных методами МГК и ПЛС-ДА при использовании предложенного сенсора позволяет достоверно определять энантиомеры триптофана независимо от их концентрации.
Работа выполнена при поддержке РНФ: грант № 19-73-10079.
Список литературы
Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.: Дрофа, 2004. 544 с.
Kaya S.I., Karabulut T.C., Kurbanoglu S., Ozkan S.A. Chemically modified electrodes in electrochemical drug analysis // Curr. Pharm. Anal. 2020. V. 16. № 6. P. 641.
Liu Z., Xu Y., Ji C.Y., Chen S., Li X., Zhang X., Li J. Fano-Enhanced circular dichroism in deformable stereo metasurfaces // Adv. Mater. 2020. V. 32. Article 1907077.
He Y., He M., Nan K., Cao R., Chen B., Hu B. Magnetic solid-phase extraction using sulfur-containing functional magnetic polymer for high-performance liquid chromatography-inductively coupled plasma-mass spectrometric speciation of mercury in environmental samples // J. Chromatogr. A. 2019. V. 1595. P. 19.
Yang W., Cadwallader K.R., Liu Y., Huang M., Sun B. Characterization of typical potent odorants in raw and cooked Toona sinensis (A. Juss.) M. Roem. by instrumental-sensory analysis techniques // Food Chem. 2019. V. 282. P. 153.
Zhu G., Kingsford O.J., Yi Yi., Wong K-yin. Review – Recent advances in electrochemical chiral recognition // J. Electrochem. Soc. 2019. V. 166. № 6. P. H205.
Майстренко В.Н., Евтюгин Г.А., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры. Уфа: Издательство БашГУ, 2018. 240 с.
Майстренко В.Н., Сидельников А.В., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры: новые решения // Журн. аналит. химии. 2018. Т. 73. № 1. С. 3. (Maistrenko V.N., Sidel’nikov A.V., Zil’berg R.A. Enantioselective voltammetric sensors: New solutions // J. Anal. Chem. 2018. V. 73. № 1. P. 1.)
Jaques A., Collet A., Wilen S.H. Enantiomers, Racemates and Resolutions. N.Y.: Wiley, 1981. 447 p.
Shen B.W., Kim Y., Lee M. Supramolecular chiral 2D materials and emerging functions // Adv. Mater. 2020. V. 32. Article 1905669.
Pigot C., Dumur F. Recent advances of hierarchical and sequential growth of macromolecular organic structures on surface // Materials. 2019. V. 12. Article 662.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., YarkaevaYu.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. № 34. P. 619.
Сидельников А.В., Майстренко В.Н., Зильберг Р.А., Яркаева Ю.А., Хамитов Э.М. Энантиоселективный вольтамперометрический сенсор для распознавания стереоизомеров пропранолола // Журн. аналит. химии. 2017. Т. 72. № 5. С. 486. (Sidel’nikov A.V., Maistrenko V.N., Zil’berg R.A., YarkaevaYu.A., Khamitov E.M. An enantioselective voltammetric sensor for the recognition of propranolol stereoisomers // J. Anal. Chem. 2017. V. 72. № 5. P. 575.)
Зильберг Р.А., Майстренко В.Н., Кабирова Л.Р., Гуськов В.Ю., Хамитов Э.М., Дубровский Д.И. Хиральный вольтамперометрический сенсор на основе модифицированного циануровой кислотой пастового электрода для распознавания и определения энантиомеров тирозина // Журн. аналит. химии. 2020. Т. 75. С. 80. (Zil’berg R.A., Maistrenko V.N., Kabirova L.R., Gus’kovV.Yu., Khamitov E.M., Dubrovskii D.I. A chiral voltammetric sensor based on a paste electrode modified by cyanuric acid for the recognition and determination of tyrosine enantiomers // J. Anal. Chem. 2020. V. 75. P. 101.)
Zilberg R.A., Maistrenko V.N., Zagitova L.R., Guskov V.Y., Dubrovsky D.I. Chiral voltammetric sensor for warfarin enantiomers based on carbon black paste electrode modified by 3,4,9,10-perylenetetracarboxylic acid // J. Electroanal. Chem. 2020. V. 861. Article 113986.
Яркаева Ю.А., Дубровский Д.И., Зильберг Р.А., Майстренко В.Н., Корнилов В.М. Вольтамперометрический сенсор на основе композита 3,4,9,10-перилентетракарбоновой кислоты для распознавания и определения энантиомеров тирозина // Журн. аналит. химии. 2020. Т. 75. № 12. С. 1108. (Yarkaeva Yu.A., Dubrovskii D.I., Zil’berg R.A., Maistrenko V.N., Kornilov V.M. A Voltammetric sensor based on a 3,4,9,10-perylenetetracarboxylic acid composite for the recognition and determination of tyrosine enantiomers // J. Anal. Chem. 2020. V. 75. № 12. P. 1537.)
Майстренко В.Н., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры на основе хиральных материалов // Журн. аналит. химии. 2020. Т. 75. № 12. С. 1080. (Maistrenko V.N., Zil’berg R.A. Enantioselectivevoltammetric sensors on the basis of chiral materials // J. Anal. Chem. 2020. V. 75. № 12. P. 1514.)
Matsuura T., Koshima H. Introduction to chiral crystallization of achiral organic compounds. Spontaneous generation of chirality // J. Photochem. Photobiol. C: Photochem. Rev. 2005. V. 6. P. 67.
Kondepudi D.K., Kaufman R.J., Singh N. Chiral symmetry breaking in sodium chlorate crystallization // Science. 1990. V. 250. № 4983. P. 975.
Kondepudi D.K., Digits J., Bullock K. Studies in chiral symmetry breaking crystallization I: The effects of stirring and evaporation rates // Chirality. 1995. V. 7. P. 62.
Kondepudi D.K., Asakura K. Chiral autocatalysis, spontaneous symmetry breaking, and stochastic behavior // Acc. Chem. Res. 2001. V. 34. P. 346.
Kondepudi D.K. Spontaneous generation and propagation of chiral asymmetry // Int. J. Quantum Chem. 2004. V. 98. P. 222.
Viedma C. Chiral symmetry during crystallization: complete chiral purity induced by nonlinear autocatalysis and recycling // Phys. Rev. Lett. 2005. V. 94. P. 065504.
Sogutoglu L.-C., Steendam R.R.E., Meekes H., Vlieg E., Rutjes F.P.J.J.T. Viedma ripening: A reliable crystallization method to reach single chirality // Chem. Soc. Rev. 2015. V. 44. P. 6723.
Kawasaki T., Suzuki K., Hakoda Y., Soai K. Achiral nucleobase cytosine acts as an origin of homochirality of biomolecules in conjunction with asymmetric autocatalysis // Chem. Int. Ed. 2008. V. 47. № 3. P. 496.
Gus'kov V.Y., Sukhareva D.A., Gainullina Y.Y., Hamitov E.M., Galkin Y.G., Maistrenko V.N. Chiral recognition capabilities of melamine and cyanuric acid supramolecular structures // Supramol. Chem. 2018. V. 30. № 11. P. 940.
Gus'kov V.Y., Gainullina Y.Y., Musina R.I., Zaripo-va A.I., Pavlova I.N. The emergence of chirality in cyanuric acid conglomerates by Viedma ripening: Surface characterization, chirality assessment and applications in chromatography // Sep. Sci. Technol. 2020. https://doi.org/10.1080/01496395.2020.1723030
https://www.ccdc.cam.ac.uk/structures/Search?Ccdcid=910020 (22.03.2021).
Wang R., Dols T., Lehmann C., Englert U. Charge density of intra- and intermolecular halogen contacts // Z. Anorg. Allg. Chem. 2013. V. 639. P. 1933.
Dunand A., Gerdil R. X-ray structure and crystal packing analysis of triphenylbromomethane, C19H15Br // Acta Cryst. 1984. V. 40. P. 59.
Dunand A., Gerdil R. X-ray structure and crystal packing analysis of triphenylchloromethane // Acta Cryst. 1982. V. 38. P. 570.
Arkin R., Cowans B., Kahr B. Toward hexaphenylethane: structure and decomposition of crystalline triphenylmethyl iodide // Chem. Mater. 1996. V. 8. P. 1500.
Engin A.B. Evaluation of tryptophan metabolism in chronic immune activation / Molecular and Integrative Toxicology / Ed. Engin A.B. Berlin: Springer, 2015. P. 121.
Steinert R.E., Luscombe-Marsh N.D., Little T.J., Standfield S., Otto B., Horowitz M., Feinle-Bisset C. Effect of intraduodenal infusion of L-tryptophan on adlybitum eating, anthropyl or duodenal motility, glycemia, insulinemia, and gut peptide secretion in healthy men // J. Clin. Endocrinol. Metab. 2014. V. 99. P. 3275.
Зильберг Р.А., Майстренко В.Н., Яркаева Ю.А., Дубровский Д.И. Энантиоселективная вольтамперометрическая сенсорная система для распознавания D- и L-триптофана на основе стеклоуглеродных электродов, модифицированных компо-зитами полиариленфталида с α-, β- и γ-циклодекстринами // Журн. аналит. химии. 2019. Т. 74. № 12. С. 941 (Zil’berg R.A., Maistrenko V.N., Yarkaeva Yu.A., Dubrovskii D.I. An enantioselective voltammetric sensor system based on glassy carbon electrodes modified by polyarylenephthalide composites with α-, β-, and γ-cyclodextrins for recognizing D- and L-tryptophans // J. Anal. Chem. 2019. V. 74. № 12. P. 1237.)
Zagitova L.R., Maistrenko V.N., Yarkaeva Yu.A., Zagitov V.V., Zilberg R.A., Kovyazin P.V., Parfenova L.V. Novel chiral voltammetric sensor for tryptophan enantiomers based on 3-neomenthylindene as recognition element // J. Electroanal. Chem. 2021. V. 880. Article 114939.
Bard A.J., Faulkner L.R. Electrochemical methods. Fundamentals and applications. N.Y.: Wiley, 2004. 833 p.
Xu J., Wang Q., Xuan C., Xia Q., Lin X., Fu Y. Chiral recognition of tryptophan enantiomers based on β-cyclodextrin-platinum nanoparticles/graphene nanohybrids modified electrode // Electroanalysis. 2016. V. 28. P. 868.
Xiao Q., Lu S., Huang C., Su W., Zhou S., Sheng J., Huang S. An electrochemical chiral sensor based on amino-functionalized graphene quantum dots/β-cyclodextrin modified glassy carbon electrode for enantioselective detection of tryptophan isomers // J. Iran. Chem. Soc. 2017. V. 14. P. 1957.
Pomerantsev A.L. Chemometrics in Excel. N.Y.: Wiley, 2014.
Esbensen K.H. Multivariate Analysis – in Practice. Oslo: CAMO Process AS, 2001.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



