Журнал аналитической химии, 2021, T. 76, № 2, стр. 135-142
Опреление каротиноидов плодов томатов различной окраски
В. И. Дейнека a, *, Т. Г. Буржинская a, Л. А. Дейнека a, И. П. Блинова a
a Белгородский государственный национальный исследовательский университет,
Институт фармации, химии и биологии
308015 Белгород, ул. Победы, 85, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 19.05.2020
После доработки 01.06.2020
Принята к публикации 02.07.2020
Аннотация
Предложен способ определения состава каротиноидов плодов томатов различной окраски с использованием комбинации спектрофотометрического и хроматографического методов. Впервые предложено объяснение последовательности элюирования моно цис-изомеров ликопина в условиях обращенно-фазовой хроматографии на традиционных “мономерных” обращенных С18-фазах. Установлено, что для проликопина, (7Z, 9Z, 7'Z, 9'Z)-ликопина, обеспечивающего оранжевую окраску плодов, существует почти незаметный при обычном просмотре переход в электронно-колебательной структуре электронного спектра поглощения с наименьшей энергией, λmax(1) = 486.2 нм. Определены основные каротиноиды плодов томатов различной окраски: транс-ликопин и его цис-изомеры для плодов красной и розовой окрасок, протоликопин и другие каротины, предшествующие его биосинтезу, для плодов оранжевой окраски, а каротиноидный состав томатов желтой окраски отличается от томатов первых двух окрасок значительным накоплением лютеина. Для количественной оценки содержания каротиноидов с различающимися хромофорами предложена система расчета, позволяющая определить вклад каждого из компонентов сложных смесей.
В последнее время отмечен заметный интерес к природным каротиноидам, не обладающим провитаминной А активностью. Установлено, что ксантофиллы лютеин и зеаксантин отвечают за профилактику возрастной макулярной дистрофии [1, 2]. Астаксантин оказался эффективным агентом в дерматологии [3, 4]. Ликопин в ряде исследований проявил активность в борьбе с онкологическими заболеваниями и в профилактике сердечно-сосудистых заболеваний [5, 6].
Как и все каротиноиды, не синтезирующиеся в организме человека, ликопин входит в состав растительных продуктов, употребляемых в пищу. Важнейшими растительными источниками полностью транс-ликопина для типичной диеты являются плоды томатов привычного красного цвета и продукты их переработки (томатные пасты, томатный сок и пр.) [7]. Однако ликопин, как и ряд других каротиноидов, относится к соединениям с невысокой биологической доступностью. Более того, в некоторых исследованиях [8, 9] концентрация цис-изомеров в сыворотке крови оказалась более высокой, чем полностью транс-ликонина. Ликопин лучше усваивается после термической обработки, которая приводит к появлению цис-изомеров [8]. В этом отношении особый интерес представляет тетра-цис-изомер ликопина – (7Z, 9Z, 7'Z, 9'Z)-ликопин или проликопин – изомер с высокой биодоступностью. В связи с этим неудивительны рекомендации [9] по употреблению в пищу предпочтительно сортов томатов, обогащенных цис-изомерами ликопина.
Первоначально для проликопина была предложена структура, содержащая семь цис-двойных связей (5Z, 9Z, 13Z, 15Z, 13'Z, 9'Z, 5'Z) (схема 1 ) [10]. При ее построении исключили стерически неблагоприятную из-за большого перекрывания сфер с ван-дер-ваальсовыми радиусами атомов водорода метиновой и метильной групп конфигурацию (схема 1 , вариант (б)), т.е. фактически цис-концигурацию по связям 7, 11, 11' и 7'. Однако выполненные позднее ЯМР-спектроскопические исследования [11] позволили уточнить строение проликопина, в котором в двух частях молекулы все-таки имеются приведенные на схеме 1 (вариант (б)) напряжения.
Схема 1 . Строение проликопина по данным работ [10] (I) и [11] (II).
Ранее для разделения и определения проликопина и других изомеров ликопина широко использовали тонкослойную хроматографию [10, 12]. В настоящее время при разделении каротиноидов чаще применяют обращенно-фазовую ВЭЖХ [13], причем для более эффективного разделения цис- и транс-изомеров разработаны специальные “полимерные” обращенные фазы. На традиционной С18 стационарной фазе [14] проликопин элюируется сразу после полностью транс- и обычных цис-изомеров ликопина. При разделении каротиноидов на “полимерной” обращенной фазе С30 с элюированием в градиентном режиме от метанола до трет-бутилметилового эфира [15] для идентифицированных веществ удерживание возрастает в ряду (в скобках приведено время удерживания, мин): лютеин (14.3) < β-каротин (20.3) < проликопин (20.6) < δ-каротин (22.3) < γ-каротин (23.5) < цис-ликопин (25.1) < транс-ликопин (26.4).
При качественном и количественном определении проликопина (как и для многих каротиноидов) используют параметры электронного спектра поглощения. Так, в работе [9] отмечено, что максимум поглощения проликопина (438 нм) существенно гипсохромно смещен относительно максимума поглощения полностью транс-ликопина (470 нм); при этом различаются и молярные коэффициенты поглощения: 102 900 и 184 000 м2/моль соответственно. Однако в работе [16], на которую ссылаются авторы работы [9], для проликопина приведены несколько иные спектральные характеристики: 461 (плечо, 70 000), 437 (105 000) и 417 (плечо, 90 000), где в скобках указан молярный коэффициент поглощения с размерностью л/(моль см); плечо – это перегиб спектральной линии. Впрочем, молярный коэффициент поглощения 102 900 использован и в работе [17]. Наконец, в ряде работ при определении каротиноидного состава сложных смесей, содержащих ликопин и цис-изомеры, включая проликопин, используют площади пиков на хроматограмме без поправок на молярные коэффициенты поглощения [8, 18].
Цель настоящей работы – разработка методики определения проликопина в томатах оранжевой окраски с использование обращенно-фазовой ВЭЖХ на традиционных С18-фазах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и аппаратура. Использовали ацетон для УФ-ИК-ВЭЖХ-ГПХ, ацетонитрил для УФ-ИК-ВЭЖХ-ГПХ (Panreac, Германия) и н-гексан для ВЭЖХ (Компонент-Реактив, Россия).
Электронные спектры поглощения регистрировали на спектрофотометре Shimadzu UV 2550 в кварцевых кюветах (l = 1 см). Общее содержание каротиноидов в пересчете на главный компонент смеси определяли по уравнению:
(1)
$c\left( i \right) = \frac{{A\left( i \right)V\left( i \right)k\left( i \right)M\left( i \right) \times 100}}{{{{\varepsilon }_{\lambda }}\left( i \right)m\left( i \right)}},\,\,{\text{мг/г,}}$Таблица 1.
Индивидуальные каротиноиды плодов томата с различной окраской
| №* | Название | λ, нм [17] | ε, л/(моль см) [17] | tR, мин | Уровень накопления (мкг/г) для томатов различной окраски | |||
|---|---|---|---|---|---|---|---|---|
| красная | розовая | оранжевая | желтая | |||||
| 1 | Лютеин | 445 | 145 100 | 1.83 | 0.5 | 2.2 | 0.8 | 1.7 |
| 2 | транс-Ликопин (с цис-изомерами) | 472 | 185 200 | 5.19 | 50.2 | 43.3 | 4.0 | 0.6 |
| 3 | Проликопин | 434 | 102 900 | 6.02 | <0.1 | <0.1 | 38.3 | <0.1 |
| 4 | β-Каротин (с цис-изомерами) | 448 | 139 200 | 8.83 | 3.6 | 6.4 | 2.8 | 2.5 |
| 5 | Нейроспорин | 435 | 134 500 | 6.33 | <0.1 | <0.1 | 5.0 | <0.1 |
| 6 | Пронейроспорин | 430 | 83 900 | 6.80 | <0.1 | <0.1 | 15.1 | <0.1 |
| 7 | ξ-Каротин (с цис-изомерами) | 399 | 135 200 | 7.80 | <0.1 | <0.1 | 19.0 | <0.1 |
* Нумерация как на рис. 3.
Для контроля видового состава и определения площадей пиков каротиноидов использовали хроматографическую систему Agilent 1260 Infinity с диодно-матричным детектором. Хроматографическую колонку: 150 × 4.6 мм, Reprosil-Pur C18-AQ, 3.5 мкм с предколонкой 10 × 4.6 мм Kromasil 100-5C18 использовали при температуре термостата колонки 30°С. Подвижную фазу состава 30 об. % ацетонитрила в ацетоне подавали со скоростью 0.8 мл/мин в изократическом режиме. Хроматограммы записывали при длине волны детектора, настроенной на определение конкретных основных каротиноидов, см. табл. 1. Хроматограммы записывали, хранили и обрабатывали, используя программное обеспечение Agilent ChemStation.
Пробоподготовка. С приобретенных на рынке томатов различной окраски снимали тонкую кожицу и мезокарпий гомогенизировали, замораживали в морозильной камере (–20°С) с последующей лиофилизацией на лиофильной сушилке FreeZone 6L Labconco, продукт растирали в порошок в фарфоровой ступке. Порошок хранили в холодильнике.
Экстракт готовили растиранием навески (m) порошка, смоченного небольшим количеством воды, под слоем н-гексана. Порции экстракта отбирали из ступки и переносили на воронку с фильтровальной бумагой. К твердому остатку добавляли новую порцию экстрагента и экстракцию повторяли. Повторение экстракции продолжали до получения практически бесцветной порции экстракта. Все порции экстракта объединяли, и растворитель удаляли на вакуумном ротационном испарителе. Остаток растворяли в известном объеме (V) подвижной фазы для ВЭЖХ-определения каротиноидов. Полученный раствор фильтровали через насадочный фильтр в виалы, перенося их в ячейки автодозатора хроматографа.
Расчетные методы. Для обработки площадей пиков по методу внутренней нормировки использовали два способа.
Способ 1 применяли только для оценки вклада основного компонента в суммарное поглощение при выбранной длине волны детектирования:
где α*(i) – доля компонента i (ликопина или проликопина) в сумме каротиноидов, на который проводится пересчет общего содержания, найденного по данным спектрофотометрического анализа (формула (1)); S(i) – площадь пика основного компонента; ΣS(j) – сумма площадей все пиков на хроматограмме. При этом исправленное на индивидуальный компонент содержание компонента i (c*(i)) определяли по формуле:Способ 2 использовали для определения истинных долей компонентов в сумме каротиноидов анализируемой смеси. Для этого электронный спектр поглощения каждого вещества (записанный в кювете детектора) экспортировали в Excel. Затем по спектрам находили A(λmax(i)) – оптическую плотность пика в характеристическом для вещества i-том максимуме поглощения и A(λdet(i)) – оптическую плотность этого же кароиноида при длине волны записи хроматограммы и, используя приведенные в литературе значения молярных коэффициентов поглощения ε(λmax(i)) при характеристической для каждого компонента длине волны, рассчитывали:
(4)
$\alpha (i) = \frac{{{{S(i)} \mathord{\left/ {\vphantom {{S(i)} {\varepsilon ({{\lambda }_{{\max }}}(i))}}} \right. \kern-0em} {\varepsilon ({{\lambda }_{{\max }}}(i))}}{{A({{\lambda }_{{\max }}}(i))} \mathord{\left/ {\vphantom {{A({{\lambda }_{{\max }}}(i))} {A({{\lambda }_{{\det }}}(i))}}} \right. \kern-0em} {A({{\lambda }_{{\det }}}(i))}}}}{{\sum\limits_j {{{S(j)} \mathord{\left/ {\vphantom {{S(j)} {\varepsilon ({{\lambda }_{{\max }}}(j))}}} \right. \kern-0em} {\varepsilon ({{\lambda }_{{\max }}}(j))}}{{A({{\lambda }_{{\max }}}(j))} \mathord{\left/ {\vphantom {{A({{\lambda }_{{\max }}}(j))} {A({{\lambda }_{{\det }}}(j))}}} \right. \kern-0em} {A({{\lambda }_{{\det }}}(j))}}} }},$Оптимизацию геометрии β-каротина проводили по методу ММ2 в программе Chem3D пакета ChemOffice2016 (PerkinElmer, GB).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование электронных спектров поглощения. Напряжения типа (а) на схеме 1 достаточны для искажения линейной формы полиеновой цепи изопреновых фрагментов до S-образной формы, что можно продемонстрировать структурой, энергия которой минимизирована в программе MM2 (рис. 1). Планарная центральная часть молекулы (между иононовыми кольцами) искажается в плоскости S-образно из-за стерических напряжений типа (а). Такая изогнутая структура в этой части сохраняется для всех каротиноидов. Однако два стерических напряжения типа (б) выводят двойные связи колец из полного сопряжения с полиеновой системой средней части. Это приводит к тому, что у β-каротина по сравнению с ликопином при одинаковой длине цепи сопряжения (по 11 С=С-связей) максимумы полос абсорбции смещены гипсохромно на 27 нм: длины волн для первых (по энергии) переходов электрона равны 478 и 505 нм для β-каротина и для ликопина соответственно [19], т.е. они различаются на 27 нм. Для 7,7′-ди-цис-ликопина гипсохромный сдвиг оказывается относительно небольшим – лишь около 9 нм, в то время как для 9,9'-ди-цис-ликопина он несколько больше – 12 нм [16]. В таком случае уменьшение длины волны для такого же (первого) перехода для проликопина (7,9,7',9'-тетра-цис-ликопина) на 41 нм объяснить трудно.
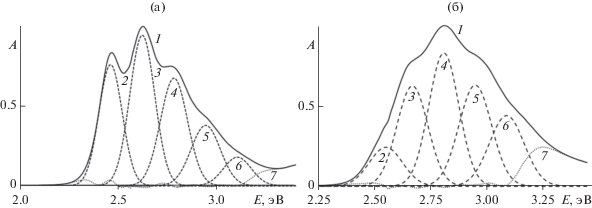
Можно предположить, что в спектре проликопина имеется еще один малозаметный перегиб. Для подтверждения предположения о существовании еще одного (именно первого) перехода электрона провели разложение суммарного спектра на индивидуальные полосы. Разложение выполняли гауссовыми функциями в спектрах с измененными координатами – вместо шкалы длин волн (нм) использовали энергетическую шкалу (эВ). При этом для полностью транс-ликопина найдены пять первых полос переходов с длинами волн 503.8, 472.9, 445.5, 421.1 и 399.2 нм. Между полосами обнаружен одинаковый энергетический интервал 0.161 эВ, характерный для переходов на различные колебательные состояния возбужденного электронного состояния (рис. 2а). В случае проликопина длины волн пяти первых полос переходов 485.2, 464.7, 441.5, 420.6 и 401.5 нм (при одинаковом энергетическом интервале 0.140 эВ, рис. 2) включают переход, который практически невозможно обнаружить на спектре. Разность между длинами волн первых переходов для полностью транс-ликопина и проликопина составляет 18.6 нм, что уже не вызывает вопросов.
Рис. 2.
Разложение электронно-колебательных спектров поглощения ликопина (а) и проликопина (б) на составляющие.
Разделение и количественное определение каротиноидов разноцветных томатов. Экстракты томатов красной, розовой, оранжевой и желтой окраски исследовали методом обращенно-фазовой ВЭЖХ на традиционной “мономерной” С18-фазе (рис. 3). Каротиноиды идентифицировали по их электронным спектрам поглощения с учетом изменения хроматографической подвижности. При этом установлено, что ликопин удерживается существенно сильнее по сравнению с лютеином, что соответствует снижению липофильности аналитов при добавлении гидроксильных групп. Проликопин удерживается сильнее ликопина. На этот факт следует обратить особое внимание. Так, по литературным данным для транс-β-каротина и транс-ликопина и их моно цис-изомеров времена удерживания для “мономерных” обращенных С18-фаз возрастают в ряду [20]: tR(транс-ликопин) < tR(9-цис-ликопин) < tR(13-цис-ликопин) < < tR(15-цис-ликопин). Для объяснения такого порядка следует учесть, что удерживание транс-ликопина по нашим данным уменьшается при замене С18-фазы на фазу с меньшей длиной привитых алкильных групп (С8 и С4), что указывает на внедрение молекул внутрь привитой фазы. По предложенному ранее варианту строения привитой фазы [21] между алкильными группами привитой фазы могут свободно разместиться алкильные группы аналита нормального строения. Но молекулы большей длины по сравнению с толщиной привитой фазы должны сорбироваться либо горизонтально, либо под углом к поверхности основания, а длина молекулы ликопина примерно вдвое больше толщины привитого С18-слоя. В таком случае очевидно следующее. Во-первых, чем длиннее внедряемая (горизонтально по отношению к привитой фазе) молекула, тем меньше вероятность того, что пустоты между привитыми радикалами выстраиваются в линейный ряд. Погружение молекулы внутрь такой фазы связано с изменением конформации привитых радикалов для создания таких пустот, в таком случае выигрыш энергии при сорбции уменьшается, и время удерживания также должно уменьшиться. Во-вторых, возникающие при этом стерические напряжения внутри привитого слоя тем сильнее, чем ближе внедряемая молекула к месту крепления радикала к силикагелевой основе. В случае 15-цис-ликопина изгиб молекулы будет способствовать сорбции из-за удаления концов молекулы от силикагелевой основы (рис. 4), что объясняет усиление сорбции аналита. При переходе от 15-цис-ликопина к другим изомерам длина одной из частей молекулы (с полностью транс-связями) увеличивается, что соответствует относительно меньшему удерживанию.
Рис. 3.
Разделение каротиноидов плодов томатов красной (a), розовой (б), оранжевой (в) и желтой (г) окраски. Каротиноиды: 1 – лютеин, 2 – полностью транс-ликопин, 3 – проликопин, 4 – β-каротин, 5 – нейроспорин, 6 – пронейроспорин, 7 – ξ-каротин.
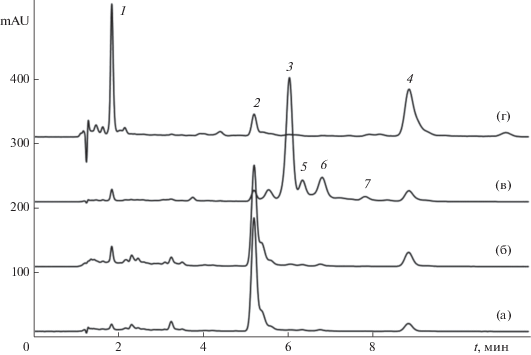
Рис. 4.
Упрощенная схема сорбции полностью транс-ликопина (а) и 15-цис-ликопина (б) на “мономерной” обращенной С18-фазе.

Рост времен удерживания в ряду ликопин – нейроспорин – ξ-каротин (табл. 1), как и дальнейший переход к фитофлуину, является следствием последовательного увеличения липофильности молекул при замене С=С-связи на две метиленовые группы.
Как следует из представленных хроматограмм, томаты красного цвета накапливают в качестве основных каротинов полностью транс-ликопин с цис-изомерами (около 90%) и β-каротин (немногим более 6%). В томате розового цвета найдены такие же каротины в несколько отличающемся соотношении. В томате желтого цвета на β-каротин приходится около половины от всех каротиноидов, и примерно треть от всех каротиноидов занимает ксантофилл – лютеин.
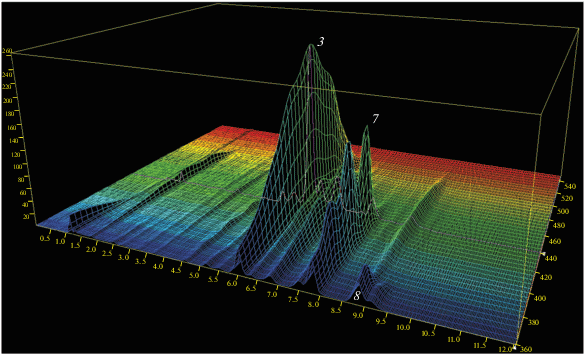
Наиболее сложным оказывается каротиноидный состав плодов томатов оранжевого цвета: при небольших долях лютеина, транс-ликопина, обычных простых цис-изомеров и β-каротина основной пик на хроматограмме представлен проликопином (45% от суммы каротиноидов), которому сопутствует группа каротинов, предшествующих проликопину с цепи биосинтеза [14]. То, что небольшому пику ξ-каротина на хроматограмме на рис. 3в соответствует значительная доля (22.4%) среди всех каротиноидов объясняется особенностью детектирования при 440 нм – в области с небольшим поглощением веществ с сильно гипсохромно смещенными полосами. На 3D хроматограмме (рис. 5) заметен и трудно отделяющийся от β-каротина пик фитофлуина (8), который невозможно обнаружить при обычных длинах волн, используемых при записи хроматограмм каротиноидов. Таким образом, использование площадей пиков без поправочных коэффициентов может привести к очень большим погрешностям в определении долей каротиноидов в сложной смеси, поэтому предложенный способ расчета по уравнению (3) для контроля состава каротиноидов следует считать обязательным.
Для определения уровня накопления каротиноидов в сложных смесях можно предложить подход, комбинирующий спектрофотометрический и хроматографический методы. По предлагаемому методу следует записать электронный спектр смеси каротиноидов и определить оптическую плотность при длине волны, рекомендуемой для определения основного компонента – обычно это второй (по энергии) максимум в спектрах индивидуальных каротиноидов, например 472 нм для ликопина. Затем записать хроматограмму с детектированием при той же длине волны и выполнить расчеты как указано в “Экспериментальной части”.
Список литературы
Корнеева А.В. Лютеин-зеаксантиновый комплекс: выбор офтальмологов // Российский медицинский журн. Клиническая офтальмология. 2019. Т. 19. С. 54.
Tan B.L., Norhaizan M.E. Carotenoids: How effective are they to prevent age-related diseases? // Molecules. 2019. V. 24. P. 1801.
Olaizola M. Ch. 13. The production and health benefits of astaxanthin / Marine Nutraceuticals and Functional Foods. 1st. Ed. / Eds. Barrow C., Shahidi F. Boca Raton, London, N.Y.: CRC Press, Taylor & Francis Group, 2007. P. 322.
Davinelli S., Nielsen M.E., Scapagnini G. Astaxanthin in skin health, repair, and disease: A comprehensive review // Nutrition. 2018. V. 10. P. 522.
Story E.N., Kopec R.E., Schwartz S.J., Harris G.K. An update on the health effects of tomato lycopene // Ann. Rev. Food Sci. Technol. 2010. V. 1. P. 189.
Clinton S.K. Lycopene: Chemistry, biology, and implications for human health and disease // Nutr. Rev. 1998. V. 56. № 2. P. 35.
Белокурова Е.С., Панкина И.А. Сравнительный анализ концентрированных томатопродуктов на содержание каротиноидов // Техника и технология пищевых производств. 2018. Т. 48. № 2. С. 162.
Burri B.J., Chapman M.H., Neidlinger T.R., Seo J.S., Ishida B.K. Tangerine tomatoes increase total and tetra-cis-lycopene isomer concentrations more than red tomatoes in healthy adult humans // Int. J. Food Sci. Nutr. 2009. V. 60(S1). P. 1.
Unlu N.Z., Bohn T., Francis D. Clinton S.K., Scwartz S.J. Carotenoid absorption in humans consuming tomato sauces obtained from tangerine or high-β-carotene varieties of tomatoes // J. Agric. Food Chem. 2007. V. 55. P. 1597.
Zechmeister L., Lerosen A.L., Went F.W., Pauling L. Prolycopene, a naturally occurring stereoisomer of lycopene // Proc. Natl. Acad. Sci. USA. 1941. V. 27. P. 468.
Clough J.M., Pattenden G. Stereochemical assignment of prolycopene and other poly-Z-Isomeric carotenoids in fruits of the tangerine tomato Lycopersicon esculentum var. “Tangella” // J. Chem. Soc. Perkin Trans. I. 1983. P. 3011.
Johjima T. Determination of cis and trans carotenes of tangerine and yellowish tangerine tomatoes by micro-thin-layer chromatography // J. Japan. Soc. Hort. Sci. 1993. V. 62. P. 567.
Daood H.G., Bencze G., Palotás G, Pék Z., Sidikov A., Helyes L. HPLC analysis of carotenoids from tomatoes using cross-linked C18 column and MS detection // J. Chromatogr. Sci. 2014. V. 52. P. 985.
Isaacson T., Ohad I., Beyer P., Hirschberg J. Analysis in vitro of the enzyme CRTISO establishes a poly-cis-carotenoid biosynthesis pathway in plants // Plant Physiol. 2004. V. 136. P. 4246.
Yoo H.J., Park W.J., Lee G.-M., Oh C.-S., Yeam I., Won D.-C., Kim C.K., Lee J.M. Inferring the genetic determinants of fruit colors in tomato by carotenoid profiling // Molecules. 2017. V. 22. P. 764.
Hengartner U., Bernhard K., Meyer K., Englert G., Glinz E. Synthesis, isolation, and NMR-spectroscopic characterization of fourteen (Z)-isomers of lycopene and of some acetylenic didehydro- and tetradehydrolycopenes // Helv. Chim. Acta. 1992. V. 75. P. 1848.
Hirota S., Watanabe K., Arinobu T., Tsuyuki H. Relationship of carotene and xanthophyll production in tomato strains and their progeins // Food Sci. Technol. Int. 1996. V. 2. P. 150.
Takehara M., Nishimura M., Kuwa T., Inoue Y., Kitamura C., Kumagai T., Honda M. Characterization and thermal isomerization of (all-E)-lycopene // J. Agric. Food Chem. 2014. V. 62. P. 264.
Amorim A.G.N., Souza J.M.T., Santos R.C., Gullón B., Oliveira A., Santos L.F.A., Virgino A.L.E., Mafud A.C., Petrilli H.M., Mascarenhas Y.P., Delerue-Matos C., Pintado M.E., Leite J.R.S.A. HPLC-DAD, ESI–MS/MS, and NMR of lycopene isolated from P. guajava L. and its biotechnological applications // Eur. J. Lipid Sci. Technol. 2018. V. 120. № 3. Article 1700330.
Stah W., Sundquist A.R., Hanusch M., Schwarz W., Sies H. Separation of 13-carotene and lycopene geometrical isomers in biological samples // Clin. Chem. 1993. V. 39. P. 810.
Дейнека В.И., Нгуен Ань Ван, Дейнека Л.А. Модель привитой обращенной фазы на основе силикагеля // Журн. физ. химии. 2019. Т. 93. № 12. С. 1860.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии