Журнал аналитической химии, 2021, T. 76, № 3, стр. 195-207
Люминесцентные полупроводниковые квантовые точки в химическом анализе
А. М. Абрамова a, О. А. Горячева a, Д. Д. Дрозд a, А. С. Новикова a, Т. С. Пономарева a, П. Д. Строкин a, И. Ю. Горячева a, *
a Саратовский государственный университет им. Н.Г. Чернышевского, Институт химии
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: goryachevaiy@mail.ru
Поступила в редакцию 29.07.2020
После доработки 15.09.2020
Принята к публикации 25.09.2020
Аннотация
Люминесцентные полупроводниковые квантовые точки (КТ) – это достаточно новый тип люминесцентных меток, используемых для визуального и инструментального определения аналитов с помощью разнообразных вариантов анализа. Высокий квантовый выход, фотостабильность, узкие спектры испускания, широкий спектр возбуждения данных частиц делают их идеальными метками для анализа, позволяя разрабатывать методики одновременного определения нескольких веществ и добиваться низких пределов обнаружения. Широкое внедрение КТ в аналитическую практику ограничено многостадийностью и трудоемкостью некоторых подходов к получению КТ и реагентов на их основе, склонностью к неспецифическим взаимодействиям, вероятностью перепоглощения света при неправильном подборе концентрации КТ. В обзоре рассмотрены основные подходы к получению, модификации и использованию люминесцентных КТ в анализе. Обсуждаются подходы к повышению чувствительности и мультиплексности анализа и инструменты регулирования селективности на основе как свойств самих КТ, так и дополнительно используемых рецепторов.
Квантовые точки (КТ) – это достаточно новый тип люминесцентных меток, используемых для визуального и инструментального определения различных аналитов с помощью разнообразных вариантов анализа [1–4]. Квантовые точки представляют собой нанокристаллы неорганического полупроводника, цвет люминесценции которых зависит как от природы полупроводника, так и от размера и наличия оболочек других материалов [5, 6]. Помимо этого (не всегда оправданно), к КТ относят наночастицы и наноструктуры других материалов. В частности, в литературе встречаются упоминания углеродных [7, 8], графеновых [9, 10] КТ, КТ оксида кремния [11] и др.
Высокий квантовый выход, фотостабильность, узкие спектры испускания, широкий спектр возбуждения данных частиц делают их идеальными метками для анализа, позволяя разрабатывать методики одновременного определения нескольких веществ [12, 13] и добиваться низких пределов обнаружения [14, 15]. К основным трудностям применения КТ относятся токсичность исходных материалов, высокая вероятность перепоглощения света при неправильном подборе концентрации КТ, многостадийность и трудоемкость некоторых подходов к получению КТ.
Несмотря на значительные сложности синтеза и гидрофилизации, метки на основе полупроводниковых КТ востребованы в люминесцентном анализе и визуализации благодаря высокой устойчивости к фотообесцвечиванию и возможности одновременного возбуждения нескольких КТ практически любым источником света. Таким образом, исследования в области анализа на основе КТ представляют особый интерес, требуется детальное рассмотрение факторов, влияющих на свойства КТ, а также отдельных стадий их синтеза и особенностей использования.
Описано применение люминесцентных КТ для определения соединений различных классов: пестицидов [16], ДНК-последовательностей [17, 18], белков [19, 20], антибиотиков [21, 22] микотоксинов [23, 24], полициклических ароматических углеводородов [15], маркеров различных заболеваний [25–28] и ряда других соединений.
В обзоре рассматриваются основные подходы к получению, модификации и использованию люминесцентных КТ в анализе. Описаны подходы к повышению чувствительности и мультиплексности анализа и инструменты регулирования селективности на основе как свойств самих КТ, так и дополнительно используемых рецепторов.
СТРУКТУРА И СВОЙСТВА КВАНТОВЫХ ТОЧЕК
Люминесцентные КТ представляют собой полупроводниковые нанокристаллы размером в несколько нанометров [29]. В строгом понимании к квантовым точкам относят нанокристаллы, размеры которых по трем измерениям меньше радиуса экситона Бора для данного материала [30, 31]. В таких нанокристаллах наблюдается размерный эффект: оптические свойства, в частности ширина запрещенной зоны и коэффициент экстинкции, зависят от размеров наночастиц и их формы [32–35]. Квантовые точки, в отличие от фрагментов полупроводников бóльшего размера, имеют дискретные уровни энергии и в валентной зоне, и в зоне проводимости [36].
Для описания оптических свойств КТ их рассматривают в рамках квантовой теории частицы в ящике. При этом учитывают кулоновское взаимодействие между разноименными зарядами (электроном и дыркой) и предполагают сферическую форму КТ. Уравнение, выведенное в 1986 г. [37], в настоящее время считается одним из основных для описания свойств нанокристаллов, проявляющих квантовые эффекты:
При получении КТ с высокими интенсивностями люминесценции и квантовым выходом (КВ) безызлучательные процессы должны быть сведены к минимуму. Уменьшить безызлучательную дезактивацию и повысить КВ позволяет пассивация поверхности КТ. Чаще всего для пассивации используется подход, основанный на создании внешней оболочки (оболочек) более широкозонных полупроводников. Этот способ позволяет получить высокоэффективные, стабильные к фотоокислению немерцающие КТ [39]. Бóльшая ширина запрещенной зоны материала оболочек “запирает” электроны и дырки в ядре. Оболочка физически отделяет поверхность ядра от воздействия окружающей его среды. Таким образом обычно осуществляют наращивание достаточно толстой оболочки. Однако зачастую параметры кристаллической решетки ядра и оболочки значительно различаются, что сильно ограничивает возможность наращивания толщины оболочки без ухудшения люминесцентных свойств [40]. Решением является синтез КТ, содержащих оболочки из нескольких полупроводников, например CdSe/CdS/ZnS. Путем подбора материалов полупроводников и толщины оболочек можно настроить длину волны испускания в большом спектральном диапазоне и значительно улучшить оптические свойства. При этом чувствительность оптических свойств КТ к изменениям среды, прежде всего присутствию молекул кислорода или воды, в значительной степени уменьшается.
ОСОБЕННОСТИ ЛЮМИНЕСЦЕНТНЫХ СВОЙСТВ КВАНТОВЫХ ТОЧЕК
Люминесцентные полупроводниковые КТ обладают уникальными оптическими характеристиками.
Высокая фотостабильность. Квантовые точки проявляют высокую фотостабильность, что позволяет многократно увеличивать мощность возбуждаемого излучения и длительно наблюдать за поведением люминесцентной метки в режиме реального времени [30, 34]. На сегодняшний день опубликовано большое количество работ, показывающих преимущества применения КТ в качестве меток в молекулярной биологии по сравнению с флуоресцентными органическими красителями [41].
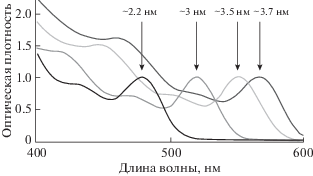
Широкий спектр поглощения. Квантовые точки обладают широким спектром поглощения с характерным максимумом в его длинноволновой части (экситонный пик). Как правило, экситонный пик сдвинут в коротковолновую область всего на 10–20 нм относительно максимума испускания. Широкие полосы поглощения позволяют использовать один источник возбуждения для наблюдения эмиссии от КТ разного цвета. Например, КТ на основе CdSe диаметром от 2.2 до 3.7 нм могут быть одновременно возбуждены источником света с длиной волны 400 нм (или другой), при этом длина волны эмиссии этих образцов изменяется в диапазоне 490–590 (цвет люминесценции от голубого до оранжево-красного) (рис. 1) [42].
Рис. 1.
Спектры поглощения квантовых точек CdSe разного диаметра (спектры нормализованы на максимум экситонного пика).
Симметричный и узкий пик люминесценции. Пик эмиссии КТ симметричен, ширина пика на половине высоты не превышает 30 нм. Как омечено выше, положение пика люминесценции определяется размером КТ и составом; таким образом, разные цвета эмиссии можно получать, используя КТ одного состава, но разного размера, что упрощает получение разноцветных меток при сохранении близости их остальных свойств.
Высокая яркость люминесценции. Стоит отметить, что, хотя полупроводниковые КТ уступают лучшим флуоресцентным меткам по КВ (получение КТ с КВ 80% и выше описано сравнительно недавно), нанокристаллы превосходят их на несколько порядков по величинам сечения поглощения возбуждающего света. В результате яркость свечения КТ оказывается настолько высокой, что они детектируются как единичные объекты с помощью флуоресцентного микроскопа [43]. По оценкам [44] каждая КТ CdSe/ZnS примерно в 20 раз ярче и имеет фотостабильность в 200 раз выше, чем молекула родамина 6Ж.
Высокое перепоглощение испускаемого света, возникающее за счет упомянутого выше небольшого сдвига между экситонным пиком в спектре поглощения и спектром испускания, приводит к тому, что часть испускаемых фотонов может перепоглощаться КТ с такими же спектральными свойствами. Это может привести к искажению аналитического сигнала и должно учитываться при разработке аналитических методик с использованием люминесцентных КТ.
ОСНОВНЫЕ ПОДХОДЫ К СИНТЕЗУ КВАНТОВЫХ ТОЧЕК
Существуют два основных подхода к синтезу квантовых точек: (1) высокотемпературный синтез в органических растворителях, который позволяет получать КТ с высокой интенсивностью люминесценции (КВ до 95% и выше), однако дальнейший перевод в водную фазу часто приводит к значительному снижению яркости свечения; (2) синтез в водных растворах, который позволяет получить гидрофильные КТ, однако по ряду характеристик, таких как квантовый выход люминесценции, распределение частиц по размерам и стабильность во времени, они могут уступать полупроводниковым КТ, полученным методом (1).
Высокотемпературный синтез в органических растворителях. Большинство высококачественных КТ до настоящего времени синтезируют в высококипящем координирующем органическом растворителе. В качестве стабилизирующих лигандов используют триоктилфосфиноксид, триоктилфосфин, олеиновую кислоту, олеиламин и др., что делает коллоидный раствор стабильным только в неполярных органических растворителях [45]. Использование КТ в биологических исследованиях диктует необходимость стабилизации коллоида в водных растворах при помощи гидрофильных соединений, которые зачастую содержат функциональные группы для связывания с биомолекулами [46]. В настоящее время “золотым стандартом” являются КТ на основе селенида кадмия. Несмотря на присутствие токсичных ионов кадмия и многостадийный синтез, эти КТ имеют лучший набор свойств – разнообразие цветов, узкие спектры, высокий квантовый выход и стабильность после гидрофилизации в водных растворах.
Впервые КТ CdSe в органическом растворителе были получены в 1993 г. научной группой Мюррей и др. [47]. Основной принцип синтеза – впрыскивание растворов прекурсоров металла Cd и халькогенида Se в нагретый до высоких температур растворитель – триоктилфосфин оксид (ТОФО). При высоких температурах прекурсоры распадаются до мономеров, образуется пересыщенный раствор, в результате чего осаждаются кристаллы. Температура реакционной смеси падает после впрыскивания прекурсоров, так как они имеют комнатную температуру. Из-за падения температуры реакционной среды новые ядра не зарождаются, а образовавшиеся ядра растут за счет оставшихся в растворе прекурсоров. С увеличением времени синтеза происходит рост размера нанокристаллов, сопровождающийся смещением спектров поглощения и испускания в длинноволновую область. Молекулы ТОФО на поверхности КТ создают стерический барьер между отдельными нанокристаллами, препятствующий коагуляции. В дальнейшем данную методику всесторонне модифицировали (исходные соединения селена и кадмия, органические лиганды и растворители), поддерживая основную идею метода – впрыскивание холодных прекурсоров в горячий растворитель, тем самым разделяя во времени стадии зародышеобразования и роста кристаллов [48–54]. Ядра CdSe имеют невысокую яркость люминесценции – их КВ, как правило, не превышает 5% [55].
Для повышения КВ и фотостабильности люминесцирующие ядра CdSe покрывают слоем более широкозонного полупроводника с близкими структурой и составом, который не поглощает фотоны, испущенные ядром. В результате КВ и фотостабильность КТ структуры ядро–оболочка значительно увеличиваются по сравнению с исходными ядрами CdSe [48, 53, 56]. Оптимальным веществом внешней оболочки является сульфид цинка. Однако сульфид цинка, как правило, наращивают только на небольших ядрах селенида кадмия (при d(CdSe) < 3 нм). Cогласно [57], наращивание оболочки ZnS на ядрах CdSe бóльшего диаметра затруднительно из-за большой разницы в параметрах кристаллических решеток CdSe и ZnS. Для того, чтобы избежать дефектов, возникающих при наращивании ZnS непосредственно на ядрах CdSe диаметром более ~3 нм, между ядром и сульфидом цинка помещают промежуточный слой ZnSe или CdS, которые имеют промежуточные между CdSe и ZnS параметры кристаллической решетки и величину запрещенной зоны [58]. При создании подобных структур ядро–оболочка–оболочка часто используют метод послойного наращивания (Successive Ion Layer Adsorption and Reaction, SILAR). Суть метода заключается в попеременном добавлении прекурсоров металла и халькогенида в раствор КТ CdSe при высоких температурах [59]. Такой подход позволяет избежать зарождения нанокристаллов материала оболочки и с высокой точностью контролировать количество нанесенных слоев. Помимо КТ на основе CdSe, высокотемпературный синтез в органическом растворителе применяют для получения КТ ядро/оболочка на основе других полупроводниковых нанокристаллов, в частности CuInS2/ZnS [60, 61].
Для применения в большинстве аналитических методик, а так же для проведения биохимических и биомедицинских исследований КТ переводят в водные растворы одним из следующих путей: (1) модификацией лигандного слоя, покрывающего КТ; (2) с помощью полной замены исходного лигандного слоя на гидрофильные молекулы.
Модификация лигандного слоя обычно состоит во включении КТ внутрь гидрофильного образования с сохранением исходных гидрофобных лигандов и соответственно без нарушения целостности поверхности полупроводниковой наночастицы. Показано, что использование полимерных амфифильных молекул приводит к образованию стабильных во времени растворов КТ, поскольку одна полимерная молекула образует сразу много связей с одной КТ [48, 62, 63]. Важно подчеркнуть, что исходные лиганды (амины, олеиновая кислота, триоктилфосфин оксид) остаются на поверхности КТ, следовательно, изменения состояния поверхностных атомов не происходит и в процессе гидрофилизации непосредственная поверхность полупроводниковой КТ остается нетронутой. Это приводит к тому, что яркость флуоресценции сильно не падает после перевода КТ в воду. Для повышения коллоидной стабильности в широком интервале рН используют амфифильные молекулы, содержащие полиэтиленгликолевые (ПЭГ) цепи [48]. Например, показано, что КТ, покрытые модифицированным ПЭГ полимером, устойчивы в интервале рН 3–13, поскольку гидрофильность всей КТ обеспечивается наличием незаряженных полиэтиленгликолевых групп [64]. Недостатком данного подхода считается значительное увеличение гидродинамического диаметра КТ, а также возможность изменения формы амфифильного полимера при внешнем воздействии.
При использовании метода замены лигандов гидрофобные молекулы, покрывающие КТ в органических средах, замещают на гидрофильные. Как правило, лиганды связываются с атомами металлов на поверхности КТ через тиольные группы, которые имеют наибольшее сродство к поверхности КТ [65]. В 1998 г. КТ были впервые переведены в воду методом замены лигандов с помощью меркаптоуксусной кислоты [44]. Очевидным недостатком данных точек является их устойчивость только в средах с невысокой ионной силой и рН > 7, а также низкая стабильность во времени из-за легкости окисления тиольных групп до дисульфидных, которые, в свою очередь, не связываются с поверхностными атомами КТ, и нанокристаллы выпадают в осадок [66]. Тем не менее данный подход широко применяется, особенно в случае модифицированных лигандов, поскольку КТ обладают небольшим размером и соответственно эффективны, если аналитический сигнал зависит от расстояния между компонентами, как, например, при переносе энергии.
Покрытие оксидом кремния также предусматривает замену исходных гидрофобных лигандов на прекурсоры оксида кремния, такие как тетраалкоксисиланы. Растворы КТ, покрытые оксидом кремния, отличаются высокой фотостабильностью и устойчивостью при хранении [27, 66–68].
Синтез в водных растворах. К достоинствам синтеза в водных средах можно отнести увеличение выхода продукта и хорошую воспроизводимость его свойств; использование нетоксичных растворителей и реагентов; низкую стоимость; биосовместимость; отсутствие необходимости использования инертной атмосферы. Реакция обычно происходит между поверхностными лигандами и соединениями – предшественниками металлов. Нитраты или галогениды металлов используют в качестве источников металла, тиомочевину (CS(NH2)2) и сульфид натрия (Na2S) – в качестве источников серы благодаря возможности непосредственного растворения в воде. Как правило, синтез КТ ядро/оболочка представляет собой двухэтапный процесс, сначала осуществляют синтез ядер, а затем наращивание оболочки.
Несмотря на то, что из-за более низкой температуры проведения реакций и, следовательно, низкой кристалличности структуры по сравнению с КТ, получаемыми высокотемпературными методами в органических растворителях, КВ ниже, данный подход проще в исполнении, экологичнее и экономичнее.
Водный синтез КТ протекает при сравнительно низких температурах, ограниченных температурой кипения воды. В таких условиях формирующиеся нанокристаллы имеют большое количество дефектов как на поверхности, так и в объеме. Эти дефекты порождают безызлучательные рекомбинации и тем самым подавляют эмиссию [69]. Для стабилизации водных коллоидов используют как высокомолекулярные соединения (полиолы, белки, полиэлектролиты, полифосфаты), так и бифункциональные низкомолекулярные лиганды, такие как анионы меркаптокарбоновых кислот (меркаптоуксусная, меркапропропионовая, дигодролипоевая и т.д.) [70], аминокарбоновых кислот [71] и фосфонокарбоновых кислот [72].
Разработаны методики водного синтеза КТ ядро/оболочка с квантовым выходом в районе 40% для КТ состава Ag–In–S/ZnS [71, 73–75], Cd-Te/CdS [76], CdTe [77] и др. При этом получены значения КВ, достаточные для обнаружения объектов на клеточном уровне, особенно для нетоксичных RN, излучающих в ближнем инфракрасном диапазоне [74].
АНАЛИТИЧЕСКОЕ ПРИМЕНЕНИЕ КВАНТОВЫХ ТОЧЕК
С точки зрения принципа возникновения аналитического сигнала, методы с использованием люминесцентных КТ можно разделить (иногда весьма условно) на три основные группы: (i) методы, основанные на измерении интенсивности люминесценции КТ; (ii) методы, основанные на модуляции сигнала КТ в результате тушения либо усиления; (iii) методы, основанные на различных вариантах хемилюминесцентных реакций.
Практически более удобным оказалось разделение на методы, связанные с использованием различных “распознающих элементов”. Спектр таких систем варьируется очень сильно. В самом простом случае “узнавание” аналита люминесцентной меткой регулируется зарядом молекулы. Более высокая селективность достигается использованием специально подобранных рецепторов – нуклеотидных последовательностей либо антител.
Методы без использования специфических взаимодействий. Методы, не связанные с использованием биореагентов, проще в разработке. Механизм возникновения аналитического сигнала и объяснение его селективности зачастую сложно четко обосновать, тем не менее тушение люминесценции КТ легло в основу целого ряда аналитических методик. Тушение люминесценции КТ в присутствии катионов металлов предложено использовать для определения Hg2+ [78], Zn2+ and Cd2+ [79] и ряда других катионов. В основе определения лежит либо собственно тушение испускания КТ в присутствии аналита [79], либо его усиление, если определяемое вещество “оттягивает” тушитель от поверхности КТ [80]. Так, антибиотик цефтриаксон при взаимодействии с полиэтиленимином в водном растворе предположительно формирует нековалентный молекулярный комплекс, который при нагревании гидролизуется с образованием продуктов, приводящих к тушению флуоресценции КТ CdSe/CdS/ZnS, вероятно, за счет образования свободных меркаптогрупп [80]. Показано, что определению цефтриаксона в водных растворах (сmin = 1 × 10–6 M) не мешают Na+, Ca2+, глюкоза, мочевина, мочевая кислота, эритромицин, ципрофлоксацин и доксициклин.
Для повышения селективности определения предложено использовать тушение люминесценции нескольких эмиттеров – вариант метода “отпечатков пальцев”. Методы “отпечатков пальцев” основаны на получении многомерного образа объекта, который обрабатывают методами хемометрики [81–83]. Данный подход позволяет использовать как усиление, так и снижение интенсивности испускания используемых флуорофоров, в том числе КТ. Описано применение метода “отпечатков пальцев” для определения лекарственных веществ в модельных растворах [83] и в плазме крови [81].
Методы на основе распознавания нуклеотидных последовательностей. Естественная способность одноцепочечных последовательностей нуклеотидов образовывать прочные комплексы с комплементарными им последовательностями широко используют при получении реагентов для селективного определения рибонуклеиновых кислот и других соединений, играющих важную роль в живых организмах. Связывание таких реагентов с люминесцентными КТ и тушителями позволяет проводить высокоселективное определение биологически значимых соединений. Возможности синтеза олигонуклеотидных последовательностей, их связывания с метками, технологии амплификации позволяют проводить высокочувствительное селективное определение, избирательно разделяя последовательности, отличающиеся всего одним нуклеотидом. Опубликованы обзоры [17, 18, 84], посвященные применению КТ для обнаружения РНК и ДНК с использованием различных форматов анализа, в частности тест-форматов, микрочипов, гомогенного и гетерогенного флуоресцентного резонансного переноса энергии (ФРПЭ, FRET) и различных методик усиления сигнала.
Узкие полосы испускания КТ позволяют использовать их при модификации нуклеотидными последовательностями различного дизайна для одновременного определения нескольких аналитов. Например, КТ использованы в качестве люминесцентных меток для профилирования РНК [85] с пределом обнаружения 0.4 фмоль и динамическим диапазоном от 156 до 20 000 пМ. Метод применен для обнаружения 11 микроРНК из листьев и корней риса.
Использование нуклеотидных последовательностей и их комплементарное взаимодействие позволяют особенно эффективно использовать детекторные системы, чувствительные к расстоянию между люминесцентной меткой и тушителем (либо усилителем) люминесценции.
Одной из популярных схем применения люминесцентных КТ является конструирование нуклеотидных зондов, которые содержат как КТ, так и тушитель люминесценции (рис. 2). Нуклеотидную структуру зонда подбирают таким образом, чтобы обеспечивать эффективное связывание целевой мишени и сделать термодинамически неблагоприятным связывание несовпадающей последовательности с зондом [86]. Испускание КТ в таких зондах потушено за счет близости с тушителем. При связывании с целевой нуклеотидной последовательностью тушитель удаляется от КТ и интенсивность испускания увеличивается. Восстановление интенсивности испускания КТ линейно зависит от концентрации аналита, например микроРНК miR124a [87].
Рис. 2.
Нуклеотидный зонд в виде петли, испускание люминесцентных квартовых точек потушено находящимся радом тушителем. Разворачивание нуклеотидного зонда при комплементарном связывании с целевым аналитом приводит к усилению интенсивности люминесценции квантовых точек за счет увеличения расстояния до тушителя люминесценции.

Разработана методика одновременного обнаружения miRNA-141 и miRNA-21 на основе КТ (CdSe/ZnS и CdTe) с испусканием в разных областях спектра с использованием стратегии амплификации [88]. В качестве тушителей применяли комплекс магнитных и золотых наночастиц. Чувствительные к pH КТ CdTe использовали в качестве индикатора реакции гибридизации [89].
Изящное сочетание люминесцентных КТ с нуклеотидными последовательностями реализовано в ряде работ при водном синтезе КТ непосредственно в присутствии олигонуклеотидных последовательностей, играющих роль темплатов. Данный подход впервые предложен Келли и сотр. в 2009 г. [90]. В 2018 г. применение этих КТ для детектирования ДНК рассмотрено в обзоре Ванг и соавт. [91]. ДНК–КТ получают одностадийным методом с использованием молекулы ДНК в качестве матрицы для прямого роста КТ. Размер и эмиссию КТ можно варьировать, изменяя условия синтеза [92, 93]. ДНК–КТ обладают высокой биосовместимостью и низкой цитотоксичностью, что обеспечивает их применимость для биосенсинга и биовизуализации [91, 94].
Иммунохимические методы анализа. Методы с использованием распознавания на основе антител – самая большая группа аналитических систем с применением люминесцентных КТ. Конъюгирование КТ с биомолекулами открыло широкие возможности для разработки различных форматов анализа [95]. Большинство методов химического анализа и биовизуализации основаны на измерении интенсивности люминесценции КТ. В данном подходе важно количество КТ в органе или органелле (в случае биовизуализации), либо в единице объема/площади, с которых происходит сбор аналитического сигнала при регистрации результатов анализа [96, 97]. Самый распространенный способ количественного определения вещества путем регистрации сигнала КТ – это формирование иммунокомплексов с использованием специфических иммунореагентов [47, 60, 97]. Данный подход применяют как в классическом микропланшетном варианте [13, 22, 98, 99], так и весьма широко в разнообразных тест-методах [14, 100]. Применение КТ в иммунохроматографическом анализе впервые описано в 2010 г. для определения белковых маркеров церулоплазмина [101] и антегена сифилиса [102]. С тех пор иммунохроматографические методы с использованием КТ получили широкое распространение в медицинских исследованиях [20, 24, 26, 103] и для контроля качества продуктов питания [18, 104, 105]. Применению иммунохроматографических тестов на основе КТ для экологического анализа посвящено меньше исследований, поскольку, во-первых, данная область вызывает меньший научный интерес и, во-вторых, из-за малых концентраций определяемых токсикантов в природных объектах соответствующиe тесты должны обеспечивать более низкие значения их пределов обнаружения [106, 107]. Важно отметить возможность одновременного иммунохроматографического определения нескольких аналитов, например микотоксинов [22, 23, 108], антибиотиков [12], онкомаркеров [24] и др.
Особенности спектральных характеристик КТ – узкий и симметричный спектр люминесценции и широкая полоса поглощения – позволяют использовать один источник возбуждения для получения люминесценции различных цветов от КТ разного размера или состава. Это создает возможность применения КТ для одновременного определения нескольких аналитов. Кроме того, возможности спектрального разрешения позволяют определять несколько аналитов в одной тест-зоне [109, 110]. Размер КТ, сопоставимый с размером антител, позволяет использовать различную архитектуру конъюгатов [111–113]. Объединение нескольких КТ в структуру бóльшего размера позволяет повысить интенсивность испускания каждой метки, что при правильном подборе условий дает возможность повысить чувствительность анализа [114–116].
В основе большого количества иммунохимических аналитических методов лежат процессы, связанные с переносом энергии электронного возбуждения, прежде всего ФРПЭ. Широкое распространение ФРПЭ именно в сочетании с образованием иммунокомплексов обусловлено как большим разнообразием компонентов ферстеровской пары – доноров и акцепторов, так и разработкой методик получения различных иммунореагентов.
Флуоресцентный резонансный перенос энергии – безызлучательный перенос энергии от донорного хромофора (D), изначально присутствующего в электронно-возбужденном состоянии, к акцепторному хромофору (A) в основном состоянии через безызлучательное диполь-дипольное взаимодействие без участия фотонов. ФРПЭ особенно удобно использовать для индикации взаимодействий с участием флуорофоров, конъюгированных с биомолекулами со специфическим распознаванием, такими как антитела [117]. Это позволяет применять ФРПЭ в качестве источника аналитических сигналов для качественного и количественного определения широкого круга аналитов. Основные условия для реализации ФРПЭ следующие: энергия электронно-возбужденного состояния D выше возможного уровня энергии A; спектральное перекрытие между излучением D и поглощением A; непосредственная близость A и D (расстояние 1–20 нм). Помимо энергетических характеристик донора и акцептора, эффективность ФРПЭ определяется их пространственным расположением, расстоянием между D и A, их относительной ориентацией, свойствами среды, в которой находятся D и A, относительной ориентацией дипольных моментов эмиссии и поглощения D и A [118]. Традиционные конфигурации ФРПЭ основаны на взаимодействии красителя с красителем.
Люминесцентные КТ можно считать отличными донорами ФРПЭ в сочетании с короткоживущими молекулярными флуорофорами. ФРПЭ с участием КТ был рассмотрен в обзорах [119–121]. Детальный анализ литературы показывает, что данная система является потенциально мощным инструментом обнаружения и подтверждения образования иммунокомплексов. КТ в качестве доноров энергии используют достаточно широко. Время затухания возбужденного состояния КТ больше, чем у большинства органических красителей, что повышает эффективность ФРПЭ, облегчает проектирование систем D–A, упрощает количественные измерения и позволяет реализовать мультиплексирование [122, 123].
С точки зрения стабильности и эффективности хорошо зарекомендовала себя пара КТ–наночастица золота (AuНЧ). AuНЧ являются отличными акцепторами благодаря их характерному плазмонному резонансу, который может спектрально перекрываться с излучением КТ, и хорошей коллоидной стабильностью [119]. Связывание КТ и наночастиц с иммунореагентами приводит к сближению пары КТ–наночастица в случае формирования иммунокомплекса, реализации ФРПЭ и тушению люминесценции КТ [124–126].
Напротив, использование КТ в качестве акцепторов ФРПЭ, например, в сочетании с органическими красителями и флуоресцентными белками, довольно ограничено [127] по следующим причинам: (i) из-за больших коэффициентов экстинкции и широких спектров поглощения КТ, приводящих к очень эффективному и неизбежному прямому возбуждению независимо от длины волны возбуждения [128]; (ii) в связи с трудностью реализации самого процесса ФРПЭ из-за очень высокой скорости излучательной дезактивации доноров энергии (для красителей время жизни люминесценции составляет от 1 до 5 нс) по сравнению со скоростью процессов переноса энергии и затухания КТ (10–20 нс); (iii) из-за трудности измерения эмиссии с временным разрешением, поскольку время жизни флуоресценции КТ больше, чем у красителей. Данные затруднения удалось легко преодолеть при использовании КТ в качестве акцепторов в сочетании с долгоживущими донорами энергии – комплексами лантаноидов, что позволило в полной мере использовать потенциал КТ, включая чрезвычайно высокое молярное поглощение (коэффициенты экстинкции более чем 1 × 106 М–1 см–1, в 10–100 раз выше, чем у традиционных красителей) [129] в широком диапазоне длин волн; перекрывание поглощения КТ с несколькими эмиссионными линиями лантаноидов, что приводит к очень большим спектральным интегралам перекрытия [129]; достаточно большое ферстеровское расстояние (R0 ≈ 7–11 нм), обусловленное упомянутыми выше высокими молярными коэффициентами поглощения и широкими спектрами поглощения КТ. Все вместе повышает эффективность ФРПЭ и улучшает чувствительность анализа [128, 130].
Способность лантаноида – донора ФРПЭ передавать энергию КТ разного цвета, а также узкие полосы испускания КТ позволяют реализовать мультиплексирование [128]. Использование пары лантаноид–КТ дает возможность выбрать лантаноид с оптимальными абсорбционными свойствами, временем жизни и энергией возбужденных состояний, КТ с оптимальными спектрами люминесценции, оптимальное отношение D к A и при этом использовать два независимых канала обнаружения (затухание люминесценции A и D) или их соотношение. В аналитических целях в качестве донора энергии чаще используют комплексы тербия благодаря высокому квантовому выходу люминесценции, чрезвычайно большому времени затухания (около миллисекунды) и нескольким спектрально разрешенным полосам излучения в спектральном диапазоне 480–630 нм. Использование в биологических системах ФРПЭ на базе лантаноидов основано, как правило, на комплексах европия, которые представляют собой очень яркие излучатели в видимой области спектра и применяются чаще, чем комплексы тербия из-за более эффективной передачи обратной энергии комплекса лантаноида [131].
Первая аналитическая система с использованием лантаноида и КТ для отслеживания образования иммунокомплексов описана в 2007 г. [132] для обнаружения низкомолекулярного гормона эстрадиола в гомогенном анализе. Обнаружение высокомолекулярных аналитов с использованием неконкурентных многослойных структур позволяет варьировать отношение D к A, помечая одно из антител несколькими D. Изменение количества D, присоединенного к одному антителу, дает возможность оптимизировать отношение D/A в сэндвич-структуре с двумя антителами. Данный подход использован для определения альфа-фетопротеина [133], карциноэмбрионального антигена [134], простатического специфического антигена [135], рецептора эпидермального фактора роста [136].
Таким образом, в последние десятилетия интенсивно развивалось применение люминесцентных КТ в качестве меток. Можно выделить следующие преимущества КТ:
• высокий квантовый выход люминесценции и высокая устойчивость к фотообесцвечиванию;
• возможность варьировать размеры ядра, а также толщину полупроводниковых оболочек и гидрофильного слоя;
• возможность настраивать цвет свечения за счет изменения размера, состава и структуры нанокристаллов;
• большие эффективные значения Стоксова сдвига (до сотен нанометров);
• спектрально узкие и симметричные спектры испускания (полная ширина на половине максимума 25–35 нм);
• широкие спектры поглощения с большими однофотонными (ε = 104–107 М–1 см–1) сечениями поглощения;
• возможность мультиплексирования;
• широкие возможности для функционализации.
Существует ряд тонкостей и технологических сложностей, которые затрудняют разработку аналитических методик на основе КТ и их широкое применение. Прежде всего, это касается неспецифических взаимодействий как с другими реагентами, так и с материалами подложки, характерных в большей степени для наночастиц, чем для низкомолекулярных веществ и макромолекул. Все биоконъюгаты должны сохранять как биологические, так и фотофизические свойства и демонстрировать близкую кинетику взаимодействия. Для одновременного определения в одной тест-зоне либо с разрешением во времени оборудование для детектирования люминесцентных сигналов должно допускать возможность спектрального либо временнóго разрешения.
По нашему мнению, логика разработки аналитических систем на основе КТ в настоящее время – это переход от оптимизации методик получения и исследования физико-химической основ функционирования КТ, основные закономерности которых ясны, как минимум, на качественном уровне, к аналитической валидации систем для широкого круга аналитов и матриц с дальнейшей разработкой коммерческих продуктов. Аналитическая валидация должна включать в себя характеризацию стабильности и воспроизводимости систем, накопление результатов для широкого спектра аналитов в различных условиях в реальных объектах при наличии мешающих соединений, а также применение различного лабораторного оборудования с разработкой дружественных для неспециалиста операционных систем.
Работа выполнена в рамках госзадания Минобрнауки РФ (FSRR-2020-0002).
Список литературы
Chandan H.R., Schiffman J.D., Balakrishna, R.G. Quantum dots as fluorescent probes: Synthesis, surface chemistry, energy transfer mechanisms, and applications // Sens. Actuators B. 2018. V. 258. P. 1191.
Chern M., Kays J.C., Bhuckory S., Allison D.M. Sensing with photoluminescent semiconductor quantum dots // Methods Appl. Fluoresc. 2019. V. 7. № 1. Article 012005.
Petryayeva E., Russ A.W., Medint I.L. Quantum dots in bioanalysis: A review of applications across various platforms for fluorescence spectroscopy and imaging // Ap-pl. Spectrosc. 2013. V. 76. № 3. P. 215.
Bilan R., Nabiev I., Sukhanova A. Quantum dot-based nanotools for bioimaging, diagnostics, and drug delivery // Chem. Bio. Chem. 2016. V. 17. № 22. P. 2103.
Zrazhevskiy P., Mark S., Xiaohu G. Designing multifunctional quantum dots for bioimaging, detection, and drug delivery // Chem. Soc. Rev. 2010. V. 39. P. 4326.
Brichkin S.B., Razumov V.F. Colloidal quantum dots: Synthesis, properties and applications // Russ. Chem. Rev. 2016. V. 85. № 12. P. 1297.
Lim S.Y., Shen W., Gao Z. Carbon quantum dots and their applications // Chem. Soc. Rev. 2015. V. 44. P. 362.
Кокорина А.А., Прихожденко Е.С., Сухоруков Г.Б., Сапелкин А.В., Горячева И.Ю. Люминесцентные углеродные наночастицы: способы получения, методы исследования, области применения // Успехи химии. 2017. Т. 86. № 11. С. 1157. (Kokorina A.A., Pri-khozhdenko E.S., Sukhorukov G.B., Sapelkin A.V., Goryacheva I.Yu. Luminescent carbon nanoparticles: synthesis, study, applications // Russ. Chem. Rev. 2017. V. 86. № 11. P. 1157.)
Zhu S., Song Y., Zhao X., Shao J., Zhang J., Yang B. The photoluminescence mechanism in carbon dots (graphene quantum dots, carbon nanodots, and polymer dots): Current state and future perspective // Nano Res. 2015. V. 8. P. 355.
Goryacheva I.Y., Sapelkin A.V., Sukhorukov G.B. Carbon nanodots: Mechanisms of photoluminescence and principles of application // Trends Anal. Chem. 2017. V. 80. P. 27.
Cheng X., Lowe S.B., Reece P.J., Gooding J.J. Colloidal silicon quantum dots: From preparation to the modification of self-assembled monolayers (SAMs) for bio-applications // Chem. Soc. Rev. 2014. V. 43. P. 2680.
Song E., Yu M., Wang Y., Hu W., Cheng D., Swihart M.T., Song Y. Multi-color quantum dot-based fluorescence immunoassay array for simultaneous visual detection of multiple antibiotic residues in milk // Biosens. Bioelectron. 2015. V. 72. P. 320.
Taranova N.A., Berlina A.N., Zherdev A.V., Dzantiev B.B. ‘Traffic light’ immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk // Biosens. Bioelectron. 2015. V. 63. P. 255.
Beloglazova N.V., Shmelin P.S., Goryacheva I.Yu., De Saeger S. Liposomes loaded with quantum dots for ultrasensitive on-site determination of aflatoxin M1 in milk products // Anal. Bioanal. Chem. 2013. V. 405. № 24. P. 7795.
Beloglazova N.V., Goryacheva I.Yu., Niessner R., Knopp D. A comparison of horseradish peroxidase, gold nanoparticles and quantum dots as labels in non-instrumental gel-based immunoassay // Microchim. Acta. 2011. V. 175. № 3–4. P. 361.
Nsibande S.A., Forbes P.B.C. Fluorescence detection of pesticides using quantum dot materials – A review // Anal. Chim. Acta. 2016. V. 945. P. 9.
Goryacheva O.A., Mishra P.K., Goryacheva I.Y. Luminescent quantum dots for miRNA detection // Talanta. 2018. V. 179. P. 456.
Goryacheva O.A., Novikova A.S., Drozd D.D., Pidenko P.S., Ponomaryeva T.S., Bakal A.A., Mishra P.K., Beloglazova N.V., Goryacheva I.Y. Water-dispersed luminescent quantum dots for miRNA detection // Trends Anal. Chem. 2019. V. 111. P. 197.
Berlina A.N., Taranova N.A., Zherdev A.V., Vengerov Y.Y., Dzantiev B.B. Quantum dot-based lateral flow immunoassay for detection of chloramphenicol in milk // Anal. Bioanal. Chem. 2013. V. 405. P. 4997.
García-Fernández J., Trapiella-Alfonso L., Costa-Fernández J.M., Pereiro R., Sanz-Medel A. Quantum dot-based immunoassay for screening of tetracyclines in bovine muscle // J. Agric. Food Chem. 2014. V. 62. № 7. P. 1733.
Berlina A.N., Taranova N.A., Zherdev A.V., Sankov M.N., Andreev I.V., Martynov A.I., Dzantiev B.B. Quantum-dot-based immunochromatographic assay for total IgE in human serum // PLoS One. 2013. V. 8. № 10. Article e77485.
Levy M., Cater S.F., Ellington A.D. Quantum-dot aptamer beacons for the detection of proteins // ChemBioChem. 2005. V. 6. P. 2163.
Beloglazova N.V., Speranskaya E.S., Wu A., Wang Z., Sanders M., Goftman V., Zhang D. Goryacheva I.Yu., De Saeger S. Novel multiplex fluorescent immunoassays based on quantum dot nanolabels for mycotoxins determination // Biosens. Bioelectron. 2014. V. 62. P. 59.
Beloglazova N.V., Sobolev A.M., Tessier M.D., Hens Z., Goryacheva I.Y., De Saeger S. Fluorescently labelled multiplex lateral flow immunoassay based on cadmium-free quantum dots // Methods. 2017. V. 116. P. 141.
Wang C., Hou F., Ma Y. Simultaneous quantitative detection of multiple tumor markers with a rapid and sensitive multicolor quantum dots based immunochromatographic test strip // Biosens. Bioelectron. 2015. V. 68. P. 156.
Zhang W.H., Ma W., Long Y.T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots // Anal. Chem. 2016. V. 88. № 10. P. 5131.
Sobolev A.M., Byzova N.A., Goryacheva I.Y., Zherdev A.V. Silanized quantum dots as labels in lateral flow test strips for C-reactive protein // Anal. Lett. 2019. V. 52. № 12. P. 1874.
Liu L., Wu S., Jing F., Zhou H., Jia C., Li G., Cong H., Jin Q., Zhao J. Bead-based microarray immunoassay for lung cancer biomarkers using quantum dots as labels // Biosens. Bioelectron. 2016. V. 80. P. 300.
Martynenko I.V., Baimuratov A.S., Osipova V.A., Kuznetsova V.A., Purcell-Milton F., Gun’Ko Y.K., Resch-Genger U., Baranov A.V. Excitation energy dependence of the photoluminescence quantum yield of core/shell CdSe/CdS quantum dots and correlation with circular dichroism // Chem. Mater. 2018. V. 30. № 2. P. 465.
Олейников В.А., Суханова А.В., Набиев И.Р. Флуоресцентные полупроводниковые кристаллы в биологии и медицине // Российские нанотехнологии. 2007. Т. 2. № 1–2. С. 160.
Drbohlavova J., Adam V., Kizek R., Hubalek J. Quantum dots – characterization, preparation and usage in biological systems // Int. J. Mol. Sci. 2009. V. 10. P. 656.
Quantum Dots: Research, Technology and Applications / Ed. Knoss R.W. N.Y.: Nova Science Publishers, Inc., 2008. 691 p.
Yu W.W. Semiconductor quantum dots: synthesis and water-solubilization for biomedical applications // Expert Opin. Biol. Ther. 2008. V. 8. P. 1571.
Gill R., Zayats M., Willner I. Semiconductor quantum dots for bioanalysis // Angew. Chem. Int. Ed. 2008. V. 47. P. 7602.
Semiconductor Nanocrystal Quantum Dots: Synthesis, Assembly, Spectroscopy and Applications / Ed. Rogach A.L. New York: Springer, 2008. 365 p.
Adair J.H., Li T., Kido T., Havey K., Moon J., Mecholsky J., Morrone A., Talham D.R., Ludwig M.H., Wang L. Recent developments in the preparation and properties of nanometer-size spherical and platelet-shaped particles and composite particles // Mater. Sci. Eng. R. 1998. V. 23. P. 139.
Brus L. Electronic wave functions in semiconductor clusters: Experiment and theory // J. Phys. Chem. 1986. V. 90. P. 2555.
Zhou H., Liu J., Zhang S. Quantum dot-based photoelectric conversion for biosensing applications // Trends Anal. Chem. 2015. V. 67. P. 56.
Kalyuzhny G., Murray R.W. Ligand effects on optical properties of CdSe nanocrystals // J. Phys. Chem. B. 2005. V. 109. № 15. P. 7012.
Reid K.R., McBride J.R., Freymeyer N.J., Thal L.B., Rosenthal S.J. Chemical structure, ensemble and single-particle spectroscopy of thick-shell InP–ZnSe quantum dots // Nano Lett. 2018. V. 18. № 2. P. 709.
Resch-Genger U., Grabolle M., Cavaliere-Jaricot S., Nitschke R., Nann T. Quantum dots versus organic dyes as fluorescent labels // Nature Methods. 2008. V. 5. P. 763.
Chan W.C., Maxwell D.J., Gao X., Bailey R.E., Han M., Nie S. Luminescent quantum dots for multiplexed biological detection and imaging // Curr. Opin. Biotechnol. 2002. V. 13. P. 40.
Liu S.L., Zhang Z.L., Sun E.Z., Peng J., Xie M., Tian Z.Q., Lin Y., Pang D.W. Visualizing the endocytic and exocytic processes of wheat germ agglutinin by quantum dot-based single-particle tracking // Biomaterials. 2011. V. 32. P. 7616.
Chan W.C.W., Nie S.M. Quantum dot bioconjugates for ultrasensitive nonisotopic detection // Science. 1998. V. 281. P. 2016.
Bilan R., Fleury F., Nabiev I., Sukhanova A. Quantum dot surface chemistry and functionalization for cell targeting and imaging // Bioconjug. Chem. 2015. V. 26. № 4. P. 609.
Vasudevan D., Gaddam R.R., Trinchi A., Cole I. Core–shell quantum dots: Properties and applications // J. Alloys Compd. 2015. V. 636. P. 395.
Murray C.B., Norris D.J., Bawendi M.G. Synthesis and characterization of nearly monodisperse CdE (E = S, Se, Te) semiconductor nanocrystallites // J. Am. Chem. Soc. 1993. V. 115. P. 8706.
Speranskaya E.S., Beloglazova N.V., Lenain P., De Saeger S., Wang Z., Zhang S., Hens Z., Knopp D., Potapkin D.V., Goryacheva I.Y. Polymer-coated fluorescent CdSe-based quantum dots for application in immunoassay // Biosens. Bioelectron. 2014. V. 53. P. 225.
Линьков П.А., Вохминцев К.В., Самохвалов П.С., Набиев И.Р. Квантовые точки сверхмалого размера для флуоресцентного биоимиджинга in vivo и in vitro // Оптика и спектроскопия. 2017. Т. 122. № 1. С. 12.
Rousserie G., Sukhanova A., Even-Desrumeaux K., Fleury F., Chames P., Baty D., Oleinikov V., Pluot M., Cohen J.H.M., Nabiev I. Semiconductor quantum dots for multiplexed bio-detection on solid-state microarrays // Crit. Rev. Oncol. Hematol. 2010. V. 74. № 1. P. 1.
Sukhanova A., Devy J., Venteo L., Kaplan H., Artemyev M., Oleinikov V., Klinov D., Pluot M., Cohen J.H.M., Nabiev I. Biocompatible fluorescent nanocrystals for immunolabeling of membrane proteins and cells // Anal. Biochem. 2004. V. 324. № 1. P. 60.
Jasieniak J., Bullen C., van Embden J., Mulvaney P. Phosphine-free synthesis of CdSe nanocrystals // J. Phys. Chem. B. 2005. V. 109. № 44. P. 20665.
Сперанская Е.С., Гофтман В.В., Дмитриенко А.О., Дмитриенко В.П., Акмаева Т.А., Горячева И.Ю. Синтез гидрофобных и гидрофильных квантовых точек ядро–оболочка // Изв. Саратовского ун-та. Сер. Химия. Биология. Экология. 2012. Т. 12. № 4. С. 3.
Aleksandrova O.A., Mazing D.S., Matyushkin L.B., Moshnikov V.A., Pshchelko N.S. Features of colloidal quantum dots synthesis in nonpolar and aqueous media // Smart Nanocomposites. 2014. T. 5. № 2. P. 61.
Yu Z., Guo L., Du H., Krauss T., Silcox J. Shell distribution on colloidal CdSe/ZnS quantum dots // Nano Lett. 2005. V. 5. P. 565.
Hines M.A., Guyot-Sionnest P. Synthesis and characterization of strongly luminescing ZnS−Capped CdSe nanocrystals // J. Phys. Chem. 1996. V. 100. P. 468.
Yu Z., Guo L., Du H., Krauss T., Silcox J. Shell distribution on colloidal CdSe/ZnS quantum dots // Nano Lett. 2005. V. 5. P. 565.
Reiss P., Protière M., Li L. Core/shell semiconductor nanocrystals // Small. 2009. V. 5. P. 154.
Blackman B., Battaglia D., Peng X. Bright and water-soluble near IR-emitting CdSe/CdTe/ZnSe type-II/type-I nanocrystals, tuning the efficiency and stability by growth // Chem. Mater. 2008. V. 20. P. 4847.
Speranskaya E.S., Beloglazova N.V., Abé S., Aubert T., Smet P., Poelman D., Goryacheva I.Yu., De Saeger S., Hens Z. Environment-friendly CuInS2/ZnS quantum dots: Hydrophilization with a PEG-containing polymer and application as fluorescent label in immunoassay // Langmuir. 2014. V. 30. № 25. P. 7567.
Speranskaya E.S., Sevrin C., De Saeger S., Hens Z., Goryacheva I.Yu., Grandfils C. Synthesis of hydrophilic CuInS2/ZnS quantum dots with different polymeric shells and study of their cytotoxicity and hemocompatibility // ACS Appl. Mater. Interfaces. 2016. V. 8. № 12. P. 7613.
Yu W.W., Chang E., Drezek R., Colvin V.L. Water-soluble quantum dots for biomedical applications // Biochem. Biophys. Res. Commun. 2006. V. 348. P. 781.
Lin C.J., Sperling R.A., Li J.K., Yang T.-Y., Li P.-Y., Zanella M., Chang W.H., Parak W.J. Design of an amphiphilic polymer for nanoparticle coating and functionalization // Small. 2008. V. 4. P. 334.
Sperling R.A., Pellegrino T., Li J.K., Chang W.H., Parak W.J. Electrophoretic separation of nanoparticles with a discrete number of functional groups // Adv. Funct. Mater. 2006. V. 16. P. 943.
Zhang W., Chen G., Wang J., Ye B.C., X. Zhong. Design and synthesis of highly luminescent near-infrared-emitting water-soluble CdTe/CdSe/ZnS core/shell/sell quntum dots // Inorg. Chem. 2009. V. 48. P. 9723.
Lees E.E., Nguyen T.L., Clayton A.H.A., Mulvaney P. The preparation of colloidally stable, water-soluble, biocompatible semiconductor nanocrystals with a small hydrodynamic diameter // ACS Nano. 2009. V. 3. P. 1121.
Goftman V.V., Aubert T., Van Deun R., Beloglazova N.V., Hens Z., De Saeger S., Goryacheva I.Y. Synthesis, modification, bioconjugation of silica coated fluorescent quantum dots and their application for mycotoxin detection // Biosens. Bioelectron. 2016. V. 79. P. 476.
Drozd D., Zhang H., Goryacheva I.Y., De Saeger S., Beloglazova N.V. Silanization of quantum dots: Challenges and perspectives // Talanta. 2019. V. 205. Article 120164.
Omata T., Nose K., Otsuka-Yao-Matsuo S. Size dependent optical band gap of ternary I-III-VI2 semiconductor nanocrystals // J. Appl. Phys. 2009. V. 105. Article 073106.
Raevskaya A.E., Stroyuk O.L., Solonenko D.I., Dzhagan V.M., Lehmann D., Kuchmiy S.Y., Plyusnin V.F., Zahn D.R.T. Synthesis and luminescent properties of ultrasmall colloidal CdS nanoparticles stabilized by Cd(II) complexes with ammonia and mercaptoacetate // J. Nanopart. Res. 2014. V. 16. P. 2650.
Rivera-Gonzalez N., Chauhan S., Watson D.F. Aminoalkanoic acids as alternatives to mercaptoalkanoic acids for the linker-assisted attachment of quantum dots to TiO2 // Langmuir. 2016. V. 32. P. 9206.
Calzada R., Thompson C.M., Westmoreland D.E., Edme K., Weiss E.A. Organic-to aqueous phase transfer of cadmium chalcogenide quantum dots using a sulfur-free ligand for enhanced photoluminescence and oxidative stability // Chem. Mater. 2016. V. 28. P. 6716.
Raevskaya A.E., Ivanchenko M.V., Stroyuk O.L., Kuchmiy S.Ya., Plyusnin V.F. Luminescent Ag-doped In2S3 nanoparticles stabilized by mercaptoacetate in water and glycerol // J. Nanopart. Res. 2015. V. 17. P. 135.
Raevskaya A., Rozovik O., Novikova A., Selyshchev O., Stroyuk O., Dzhagan V., Goryacheva I., Gaponik N., Zahn D.R.T., Eychmuller A. Luminescence and photoelectrochemical properties of size-selected aqueous copper-doped Ag–In–S quantum dots // RSC Advances. 2018. V. 8. P. 7550.
Raevskaya A., Lesnyak V., Haubold D., Dzhagan V., Stroyuk O., Gaponik N., Zahn D.R.T., Eychmüller A. A fine size selection of brightly luminescent water-soluble Ag–In–S and Ag–In–S/ZnS quantum dots // J. Phys. Chem. C 2017. V. 121. № 16. P. 9032.
Yue D., Qian X., Zhang Z., Kan M., Ren M., Zhao Y. CdTe/CdS core/shell quantum dots cocatalyzed by sulfur tolerant [Mo3S13]2– nanoclusters for efficient visible-light-driven hydrogen evolution // ACS Sustainable Chem. Eng. 2016. V. 4. № 12. P. 6653.
Schneider J., Dudka T., Xiong Y., Wang Z., Gaponik N., Rogach A.L. Aqueous-based cadmium telluride quantum dot/polyurethane/polyhedral oligomeric silsesquioxane composites for color enhancement in display backlights // J. Phys. Chem. C 2018. V. 122. № 25. P. 13 391.
Ke J., Li X., Zhao Q., Hou Y., Chen J. Ultrasensitive quantum dot fluorescence quenching assay for selective detection of mercury ions in drinking water // Sci. Rep. 2015. V. 4. Article E 5624.
Xu H., Miao R., Fang Z., Zhong X. Quantum dot-based “turn-on” fluorescent probe for detection of zinc and cadmium ions in aqueous media // Anal. Chim. Acta 2011. V. 687. № 1. P. 82.
Карпов В.М., Спектор Д.В., Беклемишев М.К. Определение цефтриаксона по тушению флуоресценции квантовых точек с использованием связывания с полиэтиленимином // Журн. аналит. химии. 2016. Т. 71. № 5. С. 544. (Karpov V.M., Spektor D.V., Beklemishev M.K. Determination of ceftriaxone by the fluorescence quenching of quantum dots using binding with polyethyleneimine // J. Anal. Chem. 2016. V. 71. № 5. P. 519.)
Дивянин Н.Н., Рукосуева Е.А., Гармаш А.В., Беклемишев М.К. Распознавание смесей модельных аналитов в присутствии плазмы крови с помощью смеси флуорофоров (“флуоресцентный язык”) // Журн. аналит. химии. 2018. Т. 73. № 12. С. 934. (Divyanin N.N., Rukosueva E.A., Garmash A.V., Beklemishev M.K. Recognition of model analyte mixtures in the presence of blood plasma using a mixture of fluorophores (“fluorescent tongue”)) // J. Anal. Chem. 2018. V. 73. P. 1195.)
Monakhova Yu.B., Goryacheva I.Yu. Chemometric analysis of luminescent quantum dots systems: Long way to go but first steps taken // Trends Anal. Chem. 2016. V. 82. P. 164.
Divyanin N.N., Razina A.V., Rukosueva E.A., Garmash A.V., Beklemishev M.K. Discrimination of 2−3-component mixtures of organic analytes by a “fluorescent tongue”: A pilot study // Microchem. J. 2017. V. 135. P. 48.
Russ Algar W., Massey M., Krull U.J. The application of quantum dots, gold nanoparticles and molecular switches to optical nucleic-acid diagnostics // Trends Anal. Chem. 2009. V. 28. P. 292.
Liang R.Q., Li W., Li Y., Tan C.Y., Li J.X., Jin Y.X., Ruan K.C. An oligonucleotide microarray for microRNA expression analysis based on labeling RNA with quantum dot and nanogold probe // Nucleic Acids Res. 2005. V. 33. Article E 17.
Wang D., Hu L., Zhou H., Abdel-Halim E.S., Zhu J.J. Molecular beacon structure mediated rolling circle amplification for ultrasensitive electrochemical detection of microRNA based on quantum dots tagging // Electrochem. Commun. 2013. V. 33. P. 80.
Lee J., Moon S.U., Lee Y.S., Ali B.A., Al-Khedhairy A.A., Ali D., Ahmed J., Al Salem A.M., Kim S. Quantum dot-based molecular beacon to monitor intracellular microRNAs // Sensors. 2015. V. 15. P. 12872.
Jie G., Zhao Y., Wang X., Ding C. Multiplexed fluorescence detection of microRNAs based on novel distinguishable quantum dot signal probes by cycle amplification strategy // Sens. Actuators B. 2017. V. 252. P. 1026.
Liang R.Q., Li W., Li Y., Tan C.Y., Li J.X., Jin Y.X., Ruan K.C. An oligonucleotide microarray for microRNA expression analysis based on labeling RNA with quantum dot and nanogold probe // Nucleic Acids Res. 2005. V. 33. № 2. Article E 17.
Ma N., Sargent E.H., Kelley S.O. One-step DNA-programmed growth of luminescent and biofunctionalized nanocrystals // Nat. Nanotechnol. 2009. V. 4. P. 121.
Wang G., Li Z., Ma N. Next-generation DNA-functionalized quantum dots as biological sensors // ACS Chem. Biol. 2018. V. 13. P. 1705.
Tikhomirov G., Hoogland S., Lee P.E., Fischer A., Sargent E.H., Kelley S.O. DNA-based programming of quantum dot valency, self-assembly and luminescence // Nat. Nanotechnol. 2011. V. 6. P. 485.
He X., Zeng T., Li Z., Wang G., Ma N. Catalytic molecular imaging of microRNA in livingcells by DNA-programmed nanoparticle disassembly // Angew. Chem. Int. Ed. 2016. V. 55. P. 3073.
Li Z., He X., Luo X., Wang L., Ma N. DNA-programmed quantum dot polymerization for ultrasensitive molecular imaging of cancer cells // Anal. Chem. 2016. V. 88. P. 9355.
edintz I., Uyeda H., Goldman E., Matoussi H. Quantum dot bioconjugates for imaging, labelling and sensing // Nature Mater. 2005. V. 4. P. 435
Martynenko I.V., Litvin A.P., Purcell-Milton F., Baranov A.V., Fedorov A.V., Gun’ko Y.K. Application of semiconductor quantum dots in bioimaging and biosensing // J. Mater. Chem. B. 2017. V. 5. P. 6701.
Zherdev A.V., Dzantiev B.B. Ways to reach lower detection limits of lateral flow immunoassays / Rapid Test – Advances in Design, Format and Diagnostic Applications / Ed. Anfossi L. London: IntechOpen, 2018.
Goryacheva I.Yu., Lenain P., De Saeger S. Nanosized labels for rapid immunotests: New trends and developments // Trends Anal. Chem. 2013. V. 46. P. 30.
Suzuki M., Udaka H., Fukuda T. Quantum dot-linked immunosorbent assay (QLISA) using orientation-directed antibodies // J. Pharm. Biomed. Anal. 2017. V. 143. № 5. P. 110.
Beloglazova N.V., Speranskaya E.S., De Saeger S., Hens Z., Abé S., Goryacheva I.Yu. Quantum dot based rapid tests for zearalenone detection // Anal. Bioanal. Chem. 2012. V. 403. № 10. P. 3013.
Li Z., Wang Y., Wang J., Tang Z., Pounds J.G., Lin Y. Rapid and sensitive detection of protein biomarker using a portable fluorescence biosensor based on quantum dots and a lateral flow test strip // Anal. Chem. 2010. V. 82. № 16. P. 7008.
Yang H., Li D., He R., Guo Q., Wang K., Zhang X., Huang P., Cui D. A Novel quantum dots–based point of care test for syphilis // Nanoscale Res. Lett. 2010. V. 5. P. 875.
Shandilya R., Sobolev A.M., Bunkar N., Bhargava A., Goryacheva I.Yu., Mishra P.K. Quantum dot nanoconjugates for immuno-detection of circulating cell-free miRNAs // Talanta. 2020. V. 208. Article E 120486.
Di Nardo F., Anfossi L., Giovannoli C., Passini C., Goftman V.V., Goryacheva I.Y., Baggiani C. A fluorescent immunochromatographic strip test using quantum dots for fumonisins detection // Talanta. 2016. V. 150. P. 463.
Sheng W., Li S., Liu Y. Wang J., Zhang Y., Wang S. Visual and rapid lateral flow immunochromatographic assay for enrofloxacin using dyed polymer microspheres and quantum dots // Microchim. Acta. 2017. V. 184. P. 4313.
Peng T., Pei X., Zheng Y., Wang J., Wang Q., Li J., Xia X., Jiang H. Performance of fluorescence microspheres-based immunochromatography in simultaneous monitoring of five quinoxalines // Food Agric. Immunol. 2017. V. 28. № 6. P. 1544.
Sun J., Li Y., Pi F., Ji J., Zhang Y., Sun X. Using fluorescence immunochromatographic test strips based on quantum dots for the rapid and sensitive determination of microcystin-LR // Anal. Bioanal. Chem. 2017. V. 409. P. 2213.
Goryacheva O.A., Guhrenz C., Schneider K., Beloglazova N.V., Goryacheva I.Yu., De Saeger S., Gaponik N. Silanized luminescent quantum dots for simultaneous multicolour lateral flow immunoassay of two mycotoxins // ACS Appl. Mater. Interfaces. 2020. V. 12. № 22. P. 24575.
Goldman E.R., Clapp A.R., Anderson G.P., Uyeda H.T., Mauro J.M., Medintz I.L., Mattoussi H. Multiplexed toxin analysis using four colors of quantum dot fluororeagents // Anal. Chem. 2004. V. 76. P. 684.
Chan W.C., Maxwell D.J., Gao X., Bailey R.E., Han M., Nie S. Luminescent quantum dots for multiplexed biological detection and imaging // Curr. Opin. Biotechnol. 2002. V. 13. P. 40.
Sukhanova A., Even-Desrumeaux K., Kisserli A., Tabary T., Reveil B., Millot J.M., Chames P., Baty D., Artemyev M., Oleinikov V., Pluot M., Cohen J.H.M., Nabiev I. Oriented conjugates of single-domain antibodies and quantum dots: toward a new generation of ultrasmall diagnostic nanoprobes // Nanomedicine. 2012. V. 8. № 4. P. 516.
Nabiev I., Rakovich A., Sukhanova A., Lukashev E., Zagidullin V., Pachenko V., Rakovich Y.P., Donegan J.F., Rubin A.B., Govorov A.O. Fluorescent quantum dots as artificial antennas for enhanced light harvesting and energy transfer to photosynthetic reaction centers // Angew. Chem. 2010. V. 49. № 40. P. 7217.
Balalaeva I.V., Zdobnova T.A., Krutova I.V., Brilkina A.A., Lebedenko E.N., Deyev S.M. Passive and active targeting of quantum dots for whole-body fluorescence imaging of breast cancer xenografts // Biophotonics. 2012. V. 5. № 11–12 (Special Issue: Topical Problems of Biophotonics). P. 860.
Goryacheva I.Yu., Speranskaya E.S., Goftman V.V., Tang D., De Saeger S. Synthesis and bioanalytical applications of nanostructures multiloaded with quantum dots // Trends Anal. Chem. 2015. V. 66. P. 53.
Beloglazova N.V., Shmelin P.S., Speranskaya E.S., Lucas B., Helmbrecht C., Knopp D., Niessner R., De Saeger S., Goryacheva I.Yu. Quantum dot loaded liposomes as new luminescent labels for immunoassay // Anal. Chem. 2013. V. 85. № 15. P. 7197.
Ren M., Xu H., Huang X., Kuang M., Xiong Y., Xu H., Xu Y., Chen H., Wang A. Immunochromatographic assay for ultrasensitive detection of aflatoxin B1 in maize by highly luminescent quantum dot beads // ACS Ap-pl. Mater. Interfaces. 2014. V. 6. № 16. P. 14215.
Lindén S., Singh M.K., Wegner K.D., Regairaz M., Dautry F., Treussart F., Hildebrandt N. Terbium-based time-gated Förster resonance energy transfer imaging for evaluating protein–protein interactions on cell membranes // Dalton Trans. 2015. V. 44. P. 4994.
Tagit O., Annio G., Hildebrandt N. Terbium to quantum rod Förster resonance energy transfer for homogeneous bioassays with picomolar detection limits // Microchim. Acta. 2015. V. 182. P. 1693.
Dos Santos M.C., Algar W.R., Medintz I.L., Hildebrandt N. Quantum dots for Förster resonance energy transfer (FRET) // Trends Anal. Chem. 2020. V. 125. Article E 115819.
Goryacheva O.A., Beloglazova N.V., Vostrikova A.M., Pozharov M.V., Sobolev A.M., Goryacheva I.Yu. Lanthanide-to-quantum dot Förster resonance energy transfer (FRET): Application for immunoassay // Talanta. 2017. V. 164. P. 377.
Geissler D., Hildebrandt N. Recent developments in Förster resonance energy transfer (FRET) diagnostics using quantum dots // Anal. Bioanal. Chem. 2016. V. 408. P. 4475.
Clapp A.R., Medintz I.L., Uyeda H.T., Fisher B.R., Goldman E.R., Bawendi M.G., Mattoussi H. Quantum dot-based multiplexed fluorescence resonance energy transfer // J. Am. Chem. Soc. 2005. V. 127. P. 18212.
Rogach A.L., Klar T.A., Lupton J.M., Meijerink A., Feldmann J. Energy transfer with semiconductor nanocrystals // J. Mater. Chem. 2009. V. 19. P. 1208.
Jiménez-López J., Rodrigues S.S.M., Ribeiro D.S.M., Ortega-Barrales P., Ruiz-Medina A., Santos J.L.M. Exploiting the fluorescence resonance energy transfer (FRET) between CdTe quantum dots and Au nanoparticles for the determination of bioactive thiols // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2019. V. 212. P. 246.
Anfossi L., Calza P., Sordello F., Giovannoli C., Di Nardo F., Passini C., Cerruti M., Goryacheva I.Yu., Speranskaya E.S., Baggiani C. Multi-analyte homogenous immunoassay based on quenching of quantum dots by functionalized grapheme // Anal. Bioanal. Chem. 2014. V. 406. № 20. P. 4841.
Anfossi L., Di Nardo F., Cavalera S., Giovannoli C., Spano G., Speranskaya E.S., Goryacheva I.Y., Baggiani C. A lateral flow immunoassay for straightforward determination of fumonisin mycotoxins based on the quenching of the fluorescence of CdSe/ZnS quantum dots by gold and silver nanoparticles // Microchim. Acta. 2018. V. 185. № 2. P. 94.
Ji X., Wang W., Mattoussi H. Controlling the spectroscopic properties of quantum dots via energy transfer and charge transfer interactions: Concepts and applications // Nanotoday. 2016. V. 11. P. 98.
Algar W.R., Massey M., Krull U.J. Semiconductor quantum dots and FRET / FRET – Förster Resonance Energy Transfer: From Theory to Applications / Eds. Medintz I., Hildebrandt N. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2013. P. 475.
Geissler D., Linden S., Liermann K., Wegner K.D., Charbonnière L.J., Hildebrandt N. Lanthanides and quantum dots as Förster resonance energy, transfer agents for diagnostics and cellular imaging // Inorg. Chem. 2014. V. 53. P. 1824.
Algar W.R., Kim H., Medintz I.L., Hildebrandt N. Emerging non-traditional Forster resonance energy, transfer configurations with semiconductor quantum dots: investigations and applications // Coord. Chem. Rev. 2014. V. 263–264. P. 65.
Hildebrandt N., David Wegner K., Algar W.R. Luminescent terbium complexes: Superior Förster resonance energy transfer donors for flexible and sensitive multiplexed biosensing // Coord. Chem. Rev. 2014. V. 273–274. P. 125.
Härmä H., Soukka T., Shavel A., Gaponik N., Weller H. Luminescent energy transfer between cadmium telluride nanoparticle and lanthanide(III) chelate in competitive bioaffinity assays of biotin and estradiol // Anal. Chim. Acta. 2007. V. 604. P. 177.
Chen M.J., Wu Y.S., Lin G.F., Hou J.Y., Li M., Liu T.C. Quantum-dot-based homogeneous time-resolved fluoroimmunoassay of alpha-fetoprotein // Anal. Chim. Acta. 2012. V. 741. P. 100.
Chen Z.H., Wu Y.S., Chen M.J., Hou J.Y., Ren Z.Q., Sun D., Liu T.C. A novel homogeneous time-resolved fluoroimmunoassay for carcinoembryonic antigen based on water-soluble quantum dots // J. Fluoresc. 2013. V. 23. P. 649.
Bhuckory S., Lefebvre O., Qiu X., Wegner K.D., Hildebrandt N. Evaluating quantum dot performance in homogeneous FRET immunoassays for prostate specific antigen // Sensors. 2016. V. 16. Article E 197.
Wegner K.D., Lindén S., Jin Z.W., Jennings T.L., el Khoulati R., van Bergen en Henegouwen P.M.P., Hildebrandt N. Nanobodies and nanocrystals: Highly sensitive quantum dot-based homogeneous FRET immunoassay for serum-based EGFR detection // Small. 2014. V. 10. № 4. P. 734.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


