Журнал аналитической химии, 2021, T. 76, № 3, стр. 208-217
Концентрирование углеродными сорбентами фенольных соединений и их хроматографическое определение в водных экстрактах лекарственных растений
З. А. Темердашев a, *, Е. А. Виницкая a, В. В. Милевская a, М. А. Статкус b
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: temza@kubsu.ru
Поступила в редакцию 21.09.2020
После доработки 02.10.2020
Принята к публикации 13.10.2020
Аннотация
Исследована возможность применения углеродных сорбентов для извлечения, концентрирования и хроматографического определения фенольных веществ растительного происхождения. Предложен способ концентрирования биологически активных веществ из экстрактов лекарственных растений углеродными сорбентами с последующей десорбцией аналитов органическими растворителями при повышенных температуре и давлении. Изучены некоторые сорбционные характеристики углеродных материалов Supelclean ENVI-Carb и HyperSep Hypercarb по отношению к фенолкарбоновым кислотам и флавоноидам, выделенным из водных экстрактов зверобоя продырявленного Hypericum perforatum L. Оптимизированы условия сорбции и десорбции аналитов различных классов. Показана возможность применения углеродных сорбентов для извлечения и концентрирования фенольных веществ из водных экстрактов различных лекарственных растений на примере ча-бреца ползучего Thymus serpyllum L. и шалфея лекарственного Salvia officinalis L.
Лекарственные растения привлекают исследователей и практиков благодаря многообразию фитотерапевтических свойств, обусловленных содержанием в них макро- и микроколичеств биологически активных веществ. Для определения минорных компонентов в лекарственном растительном сырье (ЛРС) приходится использовать методы концентрирования, поэтому поиск новых схем эффективного извлечения и концентрирования малых количеств веществ в таких объектах остается актуальной задачей. Первой стадией анализа ЛРС чаще всего является извлечение компонентов твердого сырья с помощью подходящего жидкого экстрагента. В ряде случаев возможен дальнейший прямой анализ жидкого экстракта, однако нередко для повышения чувствительности и селективности анализа требуется концентрирование компонентов экстракта. Твердофазная экстракция (ТФЭ) сочетает в себе возможности очистки экстрактов от мешающих компонентов, извлечения и концентрирования минорных соединений. Одним из преимуществ ТФЭ является универсальность, широкий выбор типов сорбентов, а также использование меньшего количества растворителей при десорбции соединений по сравнению с жидкостно-жидкостной экстракцией. Применение различных сорбционных материалов позволяет объединить очистку экстракта от сложной растительной матрицы и концентрирование целевых соединений.
Для извлечения фенольных соединений из экстрактов ЛРС в основном применяют такие сорбенты, как октадецилсиликагель (Диапак С18, C18 LiChrolut, Strata C18 и т.д.) [1–4] и полимерные материалы различной природы (Bond Elut Plexa, Oasis HLB, Strata X и др.) [5–8]. Меньшее распространение для этих целей получили углеродные материалы [9]. С другой стороны, учитывая структуру и свойства углеродных сорбентов [10, 11], несомненный интерес представляет оценка возможности концентрирования аналитов фенольного происхождения с использованием этих материалов. Перспективными сорбентами в данном случае мы считаем непористый графитированный углерод (Supelclean ENVI-Carb), графитированную сажу и углеродные нанотрубки, обеспечивающие высокую степень извлечения некоторых гидрофильных соединений [12, 13]. Авторы работ [12, 14] использовали эти материалы в качестве сорбентов для извлечения полициклических ароматических углеводородов и пестицидов из объектов окружающей среды. Стеклоуглеродные электроды, модифицированные многослойными углеродными нанотрубками, применяли для вольтамперометрического определения кверцетина в экстрактах ЛРС [15]. Отмечена сложность элюирования определенных групп соединений и возможность необратимой адсорбции компонентов при использовании материалов данного типа [16].
Важным аспектом работы с сорбентами для ТФЭ является установление их характеристик для концентрирования аналитов на стадиях сорбции (таких как “объем до проскока” и “динамическая емкость”) и десорбции (коэффициент концентрирования и степень извлечения). Эти показатели позволяют установить оптимальные объемы экстрактов ЛРС, а также объем растворителя для десорбции, обеспечивающий эффективное извлечение компонентов из фазы сорбента [17]. Одним из определяющих факторов эффективного элюирования аналитов с сорбента является подбор растворителя для десорбции. Для этой цели обычно используют полярные органические растворители: ацетонитрил, спирты, а также водно-спиртовые смеси различного состава.
Цель данной работы – исследование и оптимизация условий ТФЭ фенольных соединений из экстрактов ЛРС с использованием некоторых углеродных материалов на примере сорбентов Supelclean ENVI-Carb и HyperSep Hypercarb.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал. В качестве объектов исследования использовали зверобой продырявленный (Hypericum perforatum L.), шалфей лекарственный (Salvia officinalis L.), чабрец ползучий (Thуmus serpуllum L.) (компания “Травы Кавказа”, Краснодарский край, г. Горячий Ключ). При исследовании этих растительных материалов учитывали рекомендации Фармакопейных статей, и сырье предварительно измельчали до размера частиц 0.5–1.0 мкм [18].
Сорбционные углеродные материалы. Использовали углеродные материалы Supelclean ENVI-Carb (Supelco, США), масса сорбента в патроне составляла 500 мг, размер частиц 37–125 мкм и HyperSep Hypercarb (Thermo, США), масса сорбента в патроне составляла 500 мг, размер частиц 30 мкм.
Реактивы и стандартные образцы. Использовали деионизованную воду с удельным сопротивлением 18.2 МОм/см (25°С), полученную с помощью установки Milli-Q-UV (Millipore, Франция), ацетонитрил (HPLC-S, Biosolve BV, Нидерланды), муравьиную кислоту (85%, ЛенРеактив, Россия), изопропиловый, этиловый и метиловый спирты х. ч. (Вектон, Россия). Аналиты идентифицировали с применением стандартных образцов 3,4-дигидроксибензойной, неохлорогеновой, хлорогеновой, кофейной и розмариновой кислот, (–)-эпикатехина, рутина, гиперозида, изокверцитрина и кверцитрина (Sigma-Aldrich, Германия).
Оборудование и условия определения фенольных соединений методом ВЭЖХ. Для хроматографического определения фенольных соединений (ФС) использовали хроматограф LC 20 Prominence (Shimadzu, Япония), включающий дегазатор DGU-20A5, насос LC20AD, автоматический дозатор SIL-20A, термостат колонок CTO-20AC, спектрофотометрический детектор с диодной матрицей SPD-M20A и квадрупольный масс-детектор LCMS2010EV. Разделение компонентов осуществляли на колонке Luna C18 100Å, 250 × 2.0 мм, 5 мкм (Phenomenex, США) с предколонкой C18 4 × 2.0 мм, 5 мкм (Phenomenex, США), температура термостатирования колонки 40°С, диапазон сканирования диодной матрицы 190–800 нм, диапазон сканирования масс 120–650 m/z. В качестве подвижной фазы для разделения компонентов использовали ацетонитрил и воду с добавкой 0.1% муравьиной кислоты. Подробные методики определения ФС предложены нами ранее и подробно описаны в работе [19]. Данные обрабатывали в программной среде LCMS Solution (Shimadzu, Япония).
Сорбцию фенольных веществ на углеродных сорбентах изучали путем получения и обработки выходных динамических кривых сорбции (ВДКС) фенольных кислот и флавоноидов [17]. Для построения этих зависимостей водные экстракты ЛРС, полученные на микроволновой установке ETHOS (Milestone, Италия) по методике, подробно изложенной в работе [19], пропускали через патроны с сорбентом, отбирая фракции пропущенного раствора в виалы. Содержание аналитов в каждой фракции определяли методом ВЭЖХ. Устанавливали зависимость отношения текущей и входной концентраций каждого аналита (c/c0) от объема прошедшего раствора (V). Полученные с помощью сорбентов Supelclean ENVI-Carb и HyperSep Hypercarb ВДКС фенолкарбоновых кислот, флавоноидов и их гликозидов из водных экстрактов зверобоя продырявленного представлены на рис. 1. При обработке ВДКС фенольных соединений использовали формулы [17]:
где ДЕ – динамическая емкость сорбента, моль/г; с0 – концентрация аналита в исходном растворе (экстракте), М; VB – “объем до проскока” аналита, мл; m – масса сухого сорбента, г. где σV и σV∗ – стандартные отклонения производной кривой, определяемые графически, VR – объем удерживания, VB – объем “до проскока”, VE – равновесный объем.Рис. 1.
Выходные динамические кривые сорбции фенолкарбоновых кислот, флавоноидов и их гликозидов из водных экстрактов зверобоя продырявленного на сорбентах Supelclean ENVI-Carb (а), (б) и HyperSep Hypercarb (в), (г).
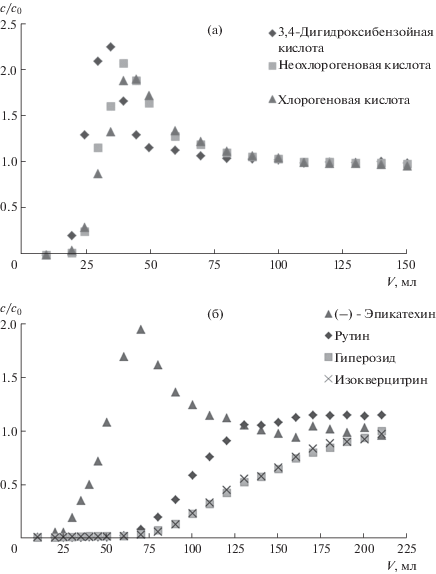
Рис. 1.
Окончание

Десорбция фенольных соединений с углеродных материалов в условиях повышенных температуры и давления. Для извлечения фенольных соединений с сорбента при повышенных температуре и давлении использовали экспериментальную установку, состоящую из термостата с трубчатым электронагревателем [19]. Контроль и регулировку температуры в системе осуществляли с помощью электронного блока ТРМ-101 и термоэлектрического преобразователя. Растворитель для десорбции подавали насосом жидкостного хроматографа LC20AD (Shimadzu, Япония), в качестве ячейки-экстрактора использовали стальной корпус хроматографической колонки размером 150 × 4.6 мм, которую подключали к установке с помощью двух стальных капилляров. В ячейку-экстрактор помещали исследуемый углеродный сорбент. Для предотвращения закипания растворителя и поддержания требуемого давления в системе использовали ограничитель противодавления P-455 (Upchurch Scientific, США). На выходе из системы фракции элюента собирали в хроматографические виалы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из рис. 1 видно, что выходные динамические кривые сорбции флавоноидов имеют S-образную форму, в то время как для фенолкарбоновых кислот и (–)-эпикатехина на кривых имеется “подъем” выше значения c/c0 = 1, по-видимому, связанный с вытеснением слабоудерживаемых аналитов более сильно удерживаемыми компонентами образца. Выходные динамические кривые сорбции фенольных соединений на обоих углеродных сорбентах схожи между собой, что позволяет предположить одинаковый механизм сорбции аналитов. Исходя из этого, условия десорбции фенольных соединений в данной работе оптимизировали на основе данных, полученных с использованием сорбента Supelclean ENVI-Carb.
S-образная форма ВДКС компонентов водного экстракта зверобоя позволила рассчитать некоторые характеристики сорбции (объeм удерживания, объем “до проскока”, равновесный объем) для углеродных сорбентов по отношению к фенольным соединениям, а также динамическую емкость сорбционных материалов. Результаты расчетов сорбционных характеристик представлены в табл. 1. “Проскок” фенольных кислот и флавоноидов на уровне 10% наблюдается после пропускания через сорбент 15–21 и 18–70 мл водного экстракта зверобоя соответственно (табл. 1). Динамические емкости обоих сорбентов по отношению к фенольным соединениям водного экстракта зверобоя, рассчитанные по формуле (1), коррелируют между собой. Расчетные данные для сорбента Supelclean ENVI-Carb составили, моль/г: (1.0 ± 0.2) × 10–6 для 3,4-дигидроксибензойной кислоты, (4.1 ± 0.4) × 10–6 для неохлорогеновой кислоты, (1.8 ± 0.3) × 10–6 для хлорогеновой кислоты, (1.6 ± 0.2) × 10–6 для (–)-эпикатехина, (35 ± 4) × 10–6; для рутина, (23 ± 2) × 10–6 для гиперозида и (9.0 ± 1.3) × 10–6 для изокверцитрина.
Таблица 1.
Основные сорбционные характеристики сорбентов по отношению к фенольным соединениям водного экстракта зверобоя (n = 3, Sr ≤ 0.3)
| Соединение | Supelclean ENVI-Carb | HyperSep Hypercarb | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| VR, мл | VB, мл | σV, мл | σV*, мл | VE, мл | ДЕ × 10–6 моль/г | VR, мл | VB, мл | σV, мл | σV*, мл | VE, мл | ДЕ × 10–6 моль/г | |
| 3,4-Дигидроксибензойная кислота | 25 | 15 | 5 | 5 | 26 | 1.0 | 22 | 14 | 4 | 2 | 26 | 0.9 |
| Неохлорогеновая кислота | 29 | 20 | 4 | 5 | 31 | 4.1 | 30 | 20 | 5 | 4 | 38 | 4.0 |
| Хлорогеновая кислота | 28 | 21 | 3 | 4 | 32 | 1.8 | 28 | 18 | 5 | 6 | 40 | 1.8 |
| (–)-Эпикатехин | 39 | 18 | 10 | 7 | 49 | 1.6 | 47 | 17 | 15 | 11 | 69 | 1.3 |
| Рутин | 95 | 60 | 18 | 19 | 121 | 35 | 98 | 62 | 18 | 30 | 158 | 39 |
| Гиперозид | 95 | 64 | 32 | 41 | 215 | 23 | 136 | 58 | 39 | 36 | 208 | 24 |
| Изокверцитрин | 124 | 70 | 27 | 49 | 218 | 9.0 | 138 | 58 | 40 | 32 | 202 | 7.7 |
Интерпретация данных по сорбции кверцетина углеродным материалом вызывает затруднения, поскольку его ВДКС из водного экстракта зверобоя не имеет характерной для других аналитов сигмоидальной формы и характеризуется малыми значениями отношения с/с0, что, вероятно, свидетельствует о низкой скорости массопереноса этого аналита в системе [20]. Полученную ВДКС математически сложно описать с помощью приведенных выше формул, а обсуждение сорбционных характеристик сорбента Supelclean ENVI-Carb по отношению к кверцетину требует отдельного исследования.
Десорбция фенольных компонентов с углеродных сорбентов. Основываясь на данных табл. 1, при изучении десорбции с непористого графитированного сорбента Supelclean ENVI-Carb фенольные соединения разбили на две группы: 1) фенолкарбоновые кислоты и (–)-эпикатехин; 2) флавоноиды. Такое разделение позволило минимизировать и/или исключить проскок аналитов каждой группы при пропускании водных экстрактов зверобоя через сорбент. С учетом разделения ФС на группы установили оптимальные пропускаемые объемы водных экстрактов зверобоя для исследования процесса десорбции, которые составили: для фенолкарбоновых кислот и (–)-эпикатехина – 15 мл, для флавоноидов – 60 мл.
Кривые десорбции ацетонитрилом аналитов (рис. 2) после установления сорбционного равновесия на стадии сорбции свидетельствуют о возможности десорбции подавляющей части соединений с сорбента, что, в свою очередь, подтверждает возможность разработки процедуры концентрирования аналитов с высоким коэффициентом концентрирования.
Рис. 2.
Кривые десорбции фенольных соединений зверобоя ацетонитрилом с углеродных сорбентов Supelclean ENVI-Carb (а) и HyperSep Hypercarb (б).
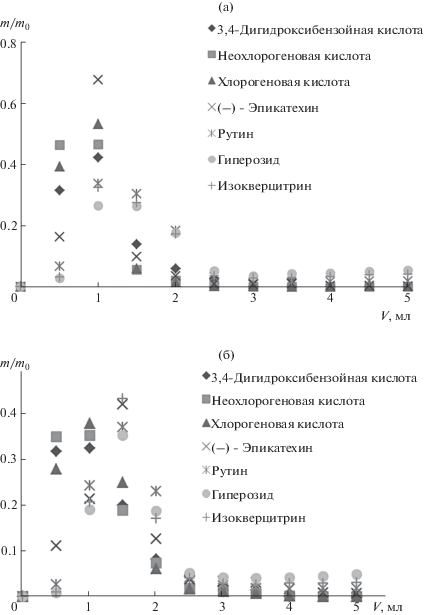
Для десорбции аналитов применяли метанол, ацетонитрил, а также их смесь с добавлением изопропилового спирта (90 : 5 : 5, по объему) (такой элюент далее обозначили как смесь МАИ). При десорбции ацетонитрилом и метанолом степень извлечения флавоноидов оказалась невысокой, а при использовании смеси МАИ данный показатель незначительно увеличивается. Для фенолкарбоновых кислот при десорбции компонентов с сорбента смесью МАИ извлекаются 7 и 22% неохлорогеновой и хлорогеновой кислот соответственно. В случае 3,4-дигидроксибензойной кислоты на хроматограмме наблюдается соэлюирование, возможно, с близким по природе, но не установленным соединением с m/z = 315 а. е. м., что может приводить к завышению степени десорбции этого аналита. Степени извлечения фенолкарбоновых кислот и флавоноидов различными растворителями с сорбента Supelclean ENVI-Carb приведены в табл. 2.
Таблица 2.
Степени извлечения (%) фенолкарбоновых кислот и флавоноидов различными растворителями с сорбента Supelclean ENVI-Carb
| Соединение | Ацетонитрил | Метанол | МАИ |
|---|---|---|---|
| 3,4-Дигидроксибензойная кислота | 22 ± 1 | 62 ± 3 | 86 ± 4 |
| Неохлорогеновая кислота | 0.56 ± 0.03 | 3.3 ± 0.2 | 7 ± 1 |
| Хлорогеновая кислота | 5.3 ± 0.3 | 15.7 ± 0.8 | 22 ± 1 |
| (–)-Эпикатехин | 6.4 ± 0.3 | 9.7 ± 0.5 | 10.8 ± 0.5 |
| Рутин | 0.67 ± 0.03 | 1.13 ± 0.06 | 2.42 ± 0.12 |
| Гиперозид | 0.39 ± 0.02 | 0.264 ± 0.013 | 2.41 ± 0.12 |
| Изокверцитрин | 0.239 ± 0.012 | 0.53 ± 0.03 | 2.60 ± 0.13 |
| Кверцитрин | 7.4 ± 0.4 | 7.7 ± 0.4 | 25 ± 6 |
По данным [21–23] выявлено, что при использовании углеродных материалов в качестве сорбентов в хроматографических колонках на эффективность процесса элюирования компонентов заметно влияет повышение температуры и давления в экстракционной системе. Для изучения и оптимизации условий десорбции компонентов использовали экспериментальную установку для субкритической экстракции ФС из ЛРС, описанную в работе [19].
Влияние давления на десорбцию фенольных веществ смесью МАИ с сорбента (на примере флавоноидов) изучали в стальной колонке. Установили, что увеличение в системе давления (9.4–9.5 МПа) не повышает эффективность десорбции компонентов с сорбентов. Степени извлечения рутина, гиперозида, изокверцитрина и кверцетина не превысили 6%, а кверцитрина – 17%.
С другой стороны, при повышенных температурах возможно ослабление ван-дер-ваальсовых, диполь-дипольных взаимодействий и водородных связей между аналитом и материалом сорбента [24], а также снижение вязкости элюента, которое улучшает массоперенос компонентов в системе сорбент–растворитель; все это может приводить к повышению степеней извлечения целевых соединений.
С учетом полученных ранее результатов [19], подтверждающих влияние температуры на процесс десорбции соединений фенольной природы с углеродного сорбента, изучили десорбцию аналитов при 120°С метанолом, ацетонитрилом и смесью МАИ. Полученные результаты представлены в виде диаграммы на рис. 3. Как видно, степени извлечения целевых соединений метанолом и смесью МАИ с материала сорбента близки, эти элюенты обеспечили десорбцию 35–72% аналитов. Можно предположить, что при десорбции смесью МАИ в условиях повышенных температур и давления степени извлечения фенольных компонентов из водных экстрактов ЛРС увеличиваются, а также расширяется список идентифицируемых компонентов.
Рис. 3.
Зависимость степени извлечения флавоноидов с сорбента Supelclean ENVI-Carb от состава растворителя при 120°С.

Температурный режим десорбции компонентов оптимизировали в диапазоне 90–180°C для флавоноидов и 90–150°C для фенолкарбоновых кислот с шагом в 30°C. По полученным данным строили зависимости степени извлечения фенольных соединений, содержащихся в экстракте зверобоя, от температуры десорбции для флавоноидов (рис. 4а), фенолкарбоновых кислот и (–)-эпикатехина (рис. 4б) при концентрировании данных групп соединений в шесть раз.
Рис. 4.
Зависимость степени извлечения флавоноидов (а), (–)-эпикатехина и фенолкарбоновых кислот (б) с сорбента Supelclean ENVI-Carb от температуры десорбции.

При повышении температуры десорбции с 90 до 120°С увеличиваются степени извлечения флавоноидов (рис. 4а). Дальнейшее увеличение температуры десорбции не вызывает повышения эффективности извлечения данной группы соединений. Напротив, для (–)-эпикатехина и представителей фенолкарбоновых кислот при температурах десорбции выше 120°С эффективность извлечения компонентов с материала сорбента снижается (рис. 4б).
На основании полученных результатов предположили, что оптимальными условиями извлечения фенолкарбоновых кислот и флавоноидов с углеродного сорбента Supelclean ENVI-Carb является десорбция смесью МАИ при повышенном давлении и температуре 120°С.
Возможность расширения круга идентифицируемых соединений. Структура и свойства углеродных сорбентов [10, 11] позволяют предположить, что круг идентифицируемых соединений можно расширить за счет их концентрирования с использованием сорбента Supelclean ENVI-Carb. При изучении хроматограмм элюатов, полученных при десорбции компонентов зверобоя смесью МАИ в условиях повышенных температуры и давления, обнаружили незарегистрированные ранее в экстрактах и элюатах с других сорбентов хроматографические пики (рис. 5). Предположительно, соединение А с tR = 11 мин и m/z = 337 а. е. м. можно отнести к 5-о,п-кумароилхинной или к 3‑о,п-кумароилхинной кислотам [25–28], а соединение Б с tR = 17.5 мин и m/z = 515 а. е. м. – изомеру дикофеилхинной кислоты [25, 29]. Данное отнесение соединений основано на сопоставлении с литературными данными, имеет предположительный характер и требует дальнейшего изучения и подтверждения.
Рис. 5.
TIC-хроматограммы исходного водного экстракта Hypericum perforatum L. (1) и элюата смесью метанол–ацетонитрил–изопропиловый спирт (90 : 5 : 5, по объему) с сорбента Supelclean ENVI-Carb (2).

Апробация схемы твердофазного извлечения фенольных соединений с помощью сорбента Supelclean ENVI-Carb на различных растительных объектах. С учетом полученных закономерностей отработанная схема апробирована при извлечении фенольных кислот из растительного сырья семейства Яснотковых, а именно чабреца ползучего (Thymus serpyllum L.) и шалфея лекарственного (Salvia officinalis L.). Получены водные экстракты этих ЛРС, которые затем использовали для сорбции аналитов на концентрирующий патрон. Десорбцию целевых соединений проводили в оптимизированных условиях. Содержание аналитов в экстракте и элюатах определяли хроматографически. Коэффициент концентрирования аналитов при этом составил 2. В табл. 3 приведены значения степеней извлечения целевых соединений из водных экстрактов чабреца ползучего и шалфея лекарственного. Степень извлечения этих компонентов достаточна высока и составила для кофейной кислоты 89–99%, для розмариновой кислоты 62–71% в зависимости от растения, а также 74 и 80% для содержащихся в чабреце хлорогеновой и неохлорогеновой кислот соответственно.
Таблица 3.
Степени извлечения (%) фенольных кислот из водных экстрактов лекарственных растений семейства Яснотковые (K = 2)
| Соединение | Чабрец ползучий (Thymus serpyllum L.) |
Шалфей лекарственный (Salvia officinalis L.) |
|---|---|---|
| Кофейная кислота | 99 ± 10 | 89 ± 4 |
| Розмариновая кислота | 62 ± 6 | 71 ± 3 |
| Хлорогеновая кислота | 74 ± 6 | н.о.* |
| Неохлорогеновая кислота | 80 ± 4 | н.о. |
Как видно из табл. 3, несмотря на различную растительную матрицу, степени извлечения фенольных соединений шалфея и чабреца достаточно близки.
Таким образом, можно сделать вывод, что углеродные сорбенты могут быть использованы для извлечения фенольных соединений из различных водных экстрактов ЛРС.
Исследования проводили при финансовой поддержке РФФИ (проект № 20-33-90045) с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Zgorka G., Hajnos A. The application of solid-phase extraction and reversed phase high-performance liquid chromatography for simultaneous isolation and determination of plant flavonoids and phenolic acids // Chromatographia. 2003. V. 57. P. 77.
Zeng H., Liu Z., Zhao S., Shu Y., Song Z., Wang C., Dong Y., Ning Z., He D., Wang M., Lu C., Liu Y., Lu A. Preparation and quantification of the total phenolic products in Citrus fruit using solid-phase extraction coupled with high-performance liquid chromatography with diode array and UV detection // J. Sep. Sci. 2016. V. 39. P. 3806.
Oniszczuka A., Podgorski R., Oniszczuk T., Zukiewicz-Sobczak W., Nowak R., Waksmundzka-Hajnos M. Extraction methods for the determination of phenolic compounds from Equisetum arvense L. herb // Ind. Crops Prod. 2014. V. 61. P. 377.
Skrzypczak-Pietraszek E., Pietraszek J. Chemical profile and seasonal variation of phenolic acid content in bastard balm (Melittis melissophyllum L., Lamiaceae) // J. Pharm. Biomed. Anal. 2012. V. 66. P. 154.
Koseoglu Yılmaz P., Kolak U. Determination of phenolic acids in Atriplex hortensis L. by novel solid-phase extraction and high-performance liquid chromatography // Anal. Lett. 2016. V. 49. P. 2157.
Stephen Inbaraj B., Lu H., Kao T., Chen B. Simultaneous determination of phenolic acids and flavonoids in Lycium barbarum Linnaeus by HPLC–DAD–ESI-MS // J. Pharm. Biomed. Anal. 2010. V. 51. P. 549.
Dvorackova E., Snoblova M., Hrdlicka P. Content of phenolic compounds in herbs used in the Czech Republic // Int. Food Res. J. 2014. V. 21. P. 1495.
Ziakova A., Brandsteterova E. Application of different preparation techiques for extraction of phenolic antioxidants from Lemon Balm (Melissa officinalis) before HPLC analysis // J. Liq. Chromatogr. Relat. Technol. 2002. V. 25. P. 3017.
одолина Е.А., Ханина М.А., Мухин В.М., Лежнина М.Г., Кузнецова Ю.А., Небольсин А.Е. Сорбция коричной и гидроксикоричных (кофейной и хлорогеновой) кислот, таксифолина и умбеллиферона на активном угле БАУ-А // Сорбционные и хроматографические процессы. 2020. Т. 20. № 2. С. 240
Pereira L. Porous graphitic carbon as a stationary phase in HPLC: Theory and applications // J. Liq. Chromatogr. Relat. Technol. 2008. V. 31. P. 1687.
Hennion M.-C. Graphitized carbons for solid-phase extraction // J. Chromatogr. A. 2000. V. 885. P. 73.
Fontanals N., Marce R., Borrull F. Materials for solid-phase extraction of organic compounds // Separations. 2019. V. 6. № 4. P. 1.
Cserhati T. Carbon-based sorbents in chromatography. New achievements // Biomed. Chromatogr. 2009. V. 23. № 2. P. 111.
Alothman Z.A., Wabaidur S.M. Application of carbon nanotubes in extraction and chromatographic analysis: A review // Arab. J. Chem. 2019. V. 12. № 5. P. 633.
Ziyatdinova G., Kozlova E., Budnikov H. Poly(gallic acid)/MWNT-modified electrode for the selective and sensitive voltammetric determination of quercetin in medicinal herbs // J. Electroanal. Chem. 2018. V. 821. P. 73.
Palma M., Pineiro Z., Barroso C.G. In-line pressurized-fluid extraction-solid-phase extraction for determining phenolic compounds in grapes // J. Chromatogr. A. 2002. V. 968. № 1–2. P. 1.
Bielicka-Daszkiewicz K., Voelkel A. Theoretical and experimental methods of determination of the breakthrough volume of SPE sorbents // Talanta. 2009. V. 80. P. 614.
Государственная Фармакопея Российской Федерации. М., 2018. Изд. 14. Т. 4. С. 6074.
Милевская В.В., Статкус М.А., Темердашев З.А., Киселева Н.В., Бутыльская Т.С., Шилько Е.А. Экстракция и определение биологически активных компонентов зверобоя и препаратов на его основе // Журн. аналит. химии. 2016. Т. 71. № 7. С. 768. (Milevskaya V.V., Statkus M.A., Temerdashev Z.A., Kiseleva N.V., Butyl’skaya T.S., Shil’ko E.A. Extraction and determination of biologically active components of st. John’s wort and its pharmaceutical preparations // J. Anal. Chem. 2016. V. 71. № 7. P. 741.)
Шилько Е.А., Милевская В.В., Темердашев З.А., Киселева Н.В. Твердофазное концентрирование фенольных веществ из водных экстрактов лекарственного растительного сырья на примере зверобоя (Hypericum perforatum L.) // Аналитика и контроль. 2018. Т. 22. № 3. С. 303.
Vial J., Hennion M.-C., Fernandez-Alba A., Aguera A. Use of porous graphitic carbon coupled with mass detection for the analysis of polar phenolic compounds by liquid chromatography // J. Chromatogr. A. 2001. V. 937. P. 21.
Hennion M.-C., Coquart V., Guenu S., Sella C. Retention behavior of polar compounds using porous graphitic carbon with water-rich mobile phases // J. Chromatogr. A. 1995. V. 712. P. 287.
Mockel H., Braedikow A., Melzer H., Aced G. A comparison of the retention of homologous series and other test solutes on an ODS column and a Hypercarb carbon column // J. Liq. Chromatogr. 1991. V. 14. № 13. P. 2477.
Richter B., Jones B., Ezzell J., Porter N. Accelerated solvent extraction: A technique for sample preparation // Anal. Chem. 1996. V. 68. P. 1033.
Gouveia S., Castilho P. Characterisation of phenolic acid derivatives and flavonoids from different morphological parts of Helichrysum obconicum by a RP-HPLC–DAD-(-)–ESI-MS method // Food Chem. 2011. V. 129. P. 333.
Brolis M., Gabetta B., Fuzzati N., Pace R., Panzeri F., Peterlongo F. Identification by high-performance liquid chromatography–diode array detection–mass spectrometry and quantification by high-performance liquid chromatography–UV absorbance detection of active constituents of Hypericum perforatum // J. Chromatogr. A. 1998. V. 825. № 1. P. 9.
Tatsis E., Boeren S., Exarchou V., Troganis A., Vervoort J., Gerothanassis I. Identification of the major constituents of Hypericum perforatum by LC/SPE/NMR and/or LC/MS // Phytochemistry. 2007. V. 68. № 3. P. 383.
Tusevski O., Petreska Stanoeva J., Stefova M., Pavokovic D., Gadzovska Simic S. Identification and quantification of phenolic compounds in Hypericum perforatum L. transgenic shoots // Acta Physiol. Plant. 2014. V. 36. № 10. P. 2555.
Chandrasekara A., Shahidi F. Determination of antioxidant activity in free and hydrolyzed fractions of millet grains and characterization of their phenolic profiles by HPLC-DAD-ESI-MSn // J. Funct. Foods. 2011. V. 3. № 3. P. 144.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


